i
PEMURNIAN PARSIAL DAN KARAKTERISASI
β
-GALAKTOSIDASE Lactobacillus plantarum B 123
BELLEN NASTITIE PAMELA FURY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pemurnian Parsial dan Karakterisasi β-Galaktosidase Lactobacillus plantarum B 123 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Tema dan dana penelitian ini merupakan bagian dari Proyek DIPA TEMATIK Pusat Penelitian Biologi LIPI. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
ABSTRAK
BELLEN NASTITIE PAMELA FURY. Pemurnian Parsial dan Karakterisasi β -Galaktosidase Lactobacillus plantarum B 123. Dibimbing oleh SYAMSUL FALAH dan TATIK KHUSNIATI.
Intoleransi laktosa merupakan masalah yang dihadapi oleh sebagian besar populasi di dunia. Masalah ini dapat diatasi dengan menghidrolisis laktosa menjadi glukosa dan galaktosa dengan β-galaktosidase. β-Galaktosidase ditemukan secara luas di alam dan diproduksi oleh sejumlah mikroorganisme. Namun, karakteristik setiap β-galaktosidase sangat berbeda dan bervariasi berdasarkan sumber mikroorganisme. Penelitian ini bertujuan untuk melakukan pemurnian dan karakterisasi β-galaktosidase L. plantarum B 123. β-Galaktosidase diekstraksi dan dimurnikan secara parsial dengan pengendapan amonium sulfat dan dialisis. Tahapan ini menghasilkan pemurnian 7.61 kali lipat, rendemen 10.67%, dan aktivitas spesifik 61.53 U/mg protein. Suhu dan pH optimum β -galaktosidase hasil dialisis tercapai pada suhu 50 °C dan pH 7.0. Ion-ion logam Mg2+, Mn2+, Co2+, Zn2+ 10 mM meningkatkan aktivitas β-galaktosidase kasar, sedangkan ion-ion logam Cu2+, Hg2+, Ca2+ 10 mM menghambat aktivitas β -galaktosidase kasar. Nilai KM dan Vmaks β-galaktosidase hasil dialisis masing-masing sebesar 1.13 mM dan 7.25 U/mL.
Kata kunci: β-galaktosidase, Lactobacillus plantarum B 123, dialisis, karakterisasi
ABSTRACT
BELLEN NASTITIE PAMELA FURY. Partial Purification and Characterization of β-Galactosidase Lactobacillus plantarum B 123. Supervised by SYAMSUL FALAH and TATIK KHUSNIATI.
Lactose intolerance was a problem faced by a large proportion of the world's population. These problem could be alleviated by hydrolyzing lactose to glucose and galactose by β-galactosidase. β-Galactosidase occurred widely in nature and it was produced by a number of microorganisms. However, their characteristics were very different and it varied with the source of microorganism. The aim of this study was purification and characterization of β-galactosidase L. plantarum B 123. β-Galactosidase was extracted and partially purified by ammonium sulfate precipitation and dialysis. These steps resulted a purification level of 7.61 fold, a yield of 10.67%, and a specific activity of 61.53 U/mg protein. Optimum temperature and pH for dialyzed β-galactosidase were optimized at 50 °C and 7.0, respectively. Metal ions of Mg2+, Mn2+, Co2+, and Zn2+ in 10 mM stimulated the activity of crude β-galactosidase, while metal ions of Cu2+, Hg2+, and Ca2+ in 10 mM inhibited the activity of crude β-galactosidase. KM and Vmax for this dialyzed β-galactosidase were 1.13 mM and 7.25 U/mL, respectively. Key words: β-galactosidase, Lactobacillus plantarum B 123, dialysis,
v
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PEMURNIAN PARSIAL DAN KARAKTERISASI
β
-GALAKTOSIDASE Lactobacillus plantarum B 123
BELLEN NASTITIE PAMELA FURY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillahirabbil alamin, puji syukur yang tak terhingga kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis mampu menyelesaikan penelitian dan karya ilmiah ini dengan sebaik-baiknya. Shalawat dan salam senantiasa terlimpah kepada Nabi Muhammad SAW, keluarga, serta para sahabatnya.
Ucapan terima kasih dan penghargaan setinggi-tingginya penulis sampaikan kepada Dr Syamsul Falah, SHut, MSi dan Prof Dr Ir Tatik Khusniati, MAppSc selaku pembimbing I dan II yang senantiasa meluangkan waktu dan kesempatan untuk memberikan bimbingan, saran, pengetahuan, dan inspirasi kepada penulis dalam menyelesaikan karya ilmiah ini.
Terima kasih penulis ucapkan juga kepada staf Laboratorium Biokimia Mikroba, Bidang Mikrobiologi, Pusat Penelitian Biologi, LIPI khususnya kepada Neneng Karimayati, AMdAL dan Lusiana Kresnawati Hartono, SSi, MSi atas segala bantuan dan dukungan selama penulis melakukan penelitian disana.
Terima kasih juga atas persahabatan dan persaudaraan yang telah terjalin selama ini, kepada rekan mahasiswa Biokimia 47 dan para penghuni Pondok Putri Rahmah.
Tak lupa, ucapan terima kasih juga penulis ucapkan kepada ibunda Rieta Purwati dan ayahanda Ir Widodo yang selalu mengajarkan akan pentingnya pendidikan, serta kepada kakak An Nasser Bayu Ajie, SE yang selalu memberikan dukungan serta semangat.
Atas inspirasi dan motivasi dari berbagai pihak, penulis akhirnya mampu menyelesaikan penelitian dan karya ilmiah ini. Kritik dan saran senantiasa penulis harapkan. Semoga karya ilmiah ini dapat bermanfaat, terutama untuk pengembangan ilmu pengetahuan, khususnya untuk pengembangan ilmu biokimia.
ix
DAFTAR ISI
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL 4
Pemurnian Parsial β-Galaktosidase Lactobacillusplantarum B 123 4 Karakteristik β-Galaktosidase Lactobacillusplantarum B 123 5
PEMBAHASAN 8
Kondisi Optimum Pertumbuhan Lactobacillus plantarum B 123 8 Produksi β-Galaktosidase Lactobacillusplantarum B 123 8 Pemurnian Parsial β-Galaktosidase Lactobacillusplantarum B 123 9 Karakteristik β-Galaktosidase Lactobacillusplantarum B 123 10
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR GAMBAR
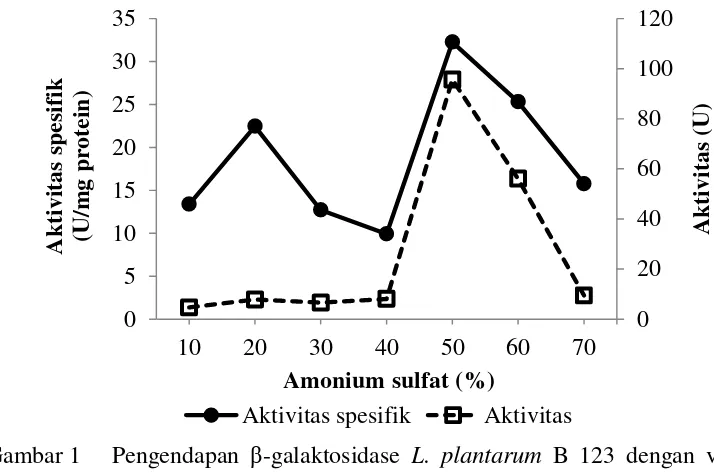
1 Pengendapan β-galaktosidase L. plantarum B 123 dengan variasi
konsentrasi amonium sulfat 5
2 Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis pada
berbagai pH 6
3 Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis pada
berbagai suhu 6
4 Aktivitas β-galaktosidase L. plantarum B 123 kasar setelah
penambahan ion logam 7
5 Kurva Lineweaver-Burk β-galaktosidase L. plantarum B 123 hasil
dialisis 7
DAFTAR LAMPIRAN
1 Diagram alir penelitian 18
2 Kurva standar oNP dalam analisis aktivitas β-galaktosidase dengan
metode Lu et al. modifikasi (2009) 19
3 Kurva standar protein dalam analisis protein dengan metode Bradford
(1976) 19
4 Perhitungan aktivitas β-galaktosidase yang diukur dengan metode Lu et al. modifikasi (2009) 20 5 Hasil pengendapan β-galaktosidase L. plantarum B 123 dengan
amonium sulfat 20
6 Hasil pemurnian parsial β-galaktosidase L.plantarum B 123 20 7 Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis pada
berbagai pH 21
8 Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis pada
berbagai suhu 21
9 Aktivitas β-galaktosidase L. plantarum B 123 kasar setelah
penambahan ion logam 21
1
PENDAHULUAN
Intoleransi laktosa merupakan masalah yang dihadapi oleh lebih dari 70% populasi di dunia akibat ketidakmampuan usus halus dalam mengabsorpsi laktosa. Ketidakmampuan ini disebabkan karena adanya penurunan aktivitas β -galaktosidase yang berperan dalam menghidrolisis laktosa menjadi glukosa dan galaktosa (Juajun et al 2011). Apabila ketersediaan β-galaktosidase di membran mukosa usus halus rendah, laktosa tidak dapat dicerna dan akan difermentasi oleh bakteri usus halus. Proses fermentasi ini akan menimbulkan gas yang menyebabkan kembung dan rasa sakit di perut. Laktosa yang tidak dicerna akan tetap berada di dalam saluran cerna, sehingga penyerapan air dari feses menjadi terganggu. Hal inilah yang menyebabkan penderita intoleransi laktosa mengalami diare (BPOM 2008). Menurut Kim dan Rajagopal (2000), produk hidrolisis laktosa memiliki rasa yang lebih manis, mudah dicerna, dan mudah larut, sehingga dapat dimanfaatkan untuk meringankan pencernaan laktosa.
Menurut Muchtadi et al. (1992), hidrolisis enzimatis memiliki beberapa keuntungan seperti mampu bekerja secara spesifik, tidak memerlukan pH dan temperatur ekstrim, serta pemisahan enzim di akhir proses tidak perlu dilakukan karena konsentrasi enzim yang rendah. Cheetham (1985) juga menyatakan, pemanfaatan enzim dalam industri pangan dapat mengurangi biaya produksi karena penggunaannya yang relatif sedikit.
Secara umum enzim dihasilkan dari tiga sumber yaitu hewan, tumbuhan, dan mikroorganisme. Namun, enzim yang digunakan secara luas dalam bidang industri adalah berasal dari mikroorganisme karena memiliki beberapa kelebihan seperti murah, stabil, jumlah enzim yang dihasilkan banyak, mudah dikembangkan, serta prosedur untuk menghasilkan enzim lebih mudah dan aman (Cheetham 1985). Lebih lanjut Sani et al. (1999) dan Chen et al. (2009) mengungkapkan, enzim dari bakteri lebih dipilih karena aktivitasnya yang tinggi dan optimum pada pH 6.0-7.0, sehingga sangat cocok untuk digunakan dalam pengolahan produk susu yang memiliki pH 6.8.
2
Kurva pertumbuhan L. plantarum B 123 sudah diketahui sebelumnya (Mariyani 2013), namun karakteristik β-galaktosidase L. plantarum B 123 belum sepenuhnya terungkap. Tujuan penelitian ini adalah melakukan pemurnian parsial dan karakterisasi β-galaktosidase L. plantarum B 123. Pemurnian β-galaktosidase L. plantarum B 123 kemungkinan menghasilkan aktivitas β-galaktosidase yang lebih tinggi dibandingkan dengan tanpa pemurnian (enzim kasar). Hasil penelitian ini diharapkan dapat bermanfaat dalam pengembangan produk susu rendah laktosa yang baik untuk dikonsumsi penderita intoleransi laktosa.
METODE
Bahan dan Alat
Media MRS (de Mann Rogosa Sharpe) yang digunakan sebagai media produksi L. plantarum B 123 indigenous terdiri atas 1% pepton (Difco, France), 0.8% beef extract (Himidia, India), 0.4% yeast extract (Difco, France), 1% laktosa (Difco, France), 0.1% Tween 80 (Merck, Germany), 0.5% natrium asetat (Merck, Germany), 0.2% triamonium sitrat (Sigma Aldrich Chemie GmbH, Germany), 0.02% magnesium sulfat monohidrat (Merck, Germany), 0.005% mangan sulfat tetrahidrat (Merck, Germany), dan 0.2% dinatrium hidrogen fosfat dihidrat (Merck, Germany).
Bahan kimia yang digunakan adalah buferasetat 0.1 M, bufer fosfat 0.1 M; 0.05 M; 0.01 M, bufer Tris-HCl 0.1 M, o-nitrofenil-β-D-galaktopiranosida atau oNPG (Fluka, Switzerland), o-nitrofenol atau oNP (Sigma Aldrich Chemie GmbH, Germany), Na2CO3 1 M (Merck, Germany), bovine serum albumin atau BSA (Merck, Germany), NaCl 0.15 M, pereaksi Bradford, logam CaCl2; CoCl2; CuCl2; HgCl2; MnCl2; MgSO4; ZnSO4 10 mM (Merck, Germany), dan amonium sulfat (Merck, Germany).
Alat yang digunakan adalah pH meter, inkubator (Isuzu, Japan), sentrifuga (Kubota dan Eppendorf, Japan), sonikator (Ultrasonic homogenizer UH 150 SMT, Japan), vorteks (Sibata, Japan), penangas air (Memmert, Germany dan Eyela, Japan), pengaduk magnetik, membran dialisis selofan MWCO 6-8 kDa (Calbiochem Novagen, Israel), dan spektrofotometer UV-Vis 1700 (Shimadzu, Japan).
Prosedur Penelitian
Ekstraksi β-Galaktosidase Lactobacillus plantarum B 123 (Wang dan Sakakibara modifikasi 1997)
3
3 sonikator 50 kHz dengan suhu 4 oC selama 15 menit. Setelah sel pecah, dilakukan pemisahan menggunakan sentrifugasi berkecepatan 9500 rpm dengan suhu 4 oC selama 15 menit. Supernatan dipisahkan dari peletnya kemudian disimpan di dalam ruang pendingin. Supernatan yang diperoleh merupakan β-galaktosidase L. plantarum B 123 kasar. β-Galaktosidase kasar ini kemudian diuji aktivitas dan kadar proteinnya sebelum dimurnikan secara parsial menggunakan pengendapan amonium sulfat dan dialisis.
Pembuatan Kurva Standar oNP dan Penentuan Aktivitas β-Galaktosidase (Lu et al. modifikasi 2009)
Pembuatan kurva standar oNP dilakukan dengan cara: oNP dilarutkan dengan buferfosfat 0.01 M pH 7.0 hingga didapatkan konsentrasi akhir 0.00-2.50 mM. Selanjutnya, ke dalam masing-masing larutan oNP berbagai konsentrasi dimasukkan sebanyak 1 mL bufer fosfat 0.1 M pH 7.0 dan 100 µL bufer fosfat 0.05 M pH 6.5. Campuran reaksi ini kemudian diinkubasi pada suhu 37 oC selama 5 menit. Reaksi lalu dihentikan dengan 1 mL Na2CO3 1 M. Analisis dilakukan menggunakan spektrofotometer UV Vis pada 420 nm. Hasil pembacaan aktivitas β-galaktosidase yang dihasilkan selanjutnya diplotkan pada kurva standar. Satu unit aktivitas β-galaktosidase dinyatakan sebagai sejumlah β-galaktosidase yang mengkatalisis konversi dari 1 moloNPG per unit dalam kondisi percobaan.
Penentuan aktivitas β-galaktosidase dilakukan dengan cara: sebanyak 100 L β-galaktosidase dimasukkan ke dalam 1 mL bufer fosfat 0.1 M pH 7.0.Setelah itu, sebanyak 200 L oNPG 2 mg/mL ditambahkan ke dalam campuran reaksi untuk kemudian diinkubasi pada suhu 37 oC selama 5 menit. Reaksi dihentikan dengan 1 mL Na2CO3 1 M. Selanjutnya, analisis dilakukan menggunakan spektrofotometer UV Vis pada 420 nm
Pembuatan Kurva Standar dan Penentuan Kadar Protein (Bradford 1976)
Pembuatan kurva standar dilakukan dengan cara: sebanyak 40 L protein standar BSA berbagai konsentrasi (0.00-1.00 mg/mL) dimasukkan ke dalam 2 mL pereaksi Bradford. Setelah 5 menit larutan dianalisis menggunakan spektrofotometer UV Vis pada 5λ5 nm.
Penentuan kadar protein dilakukan dengan cara: sebanyak 20 L β -galaktosidase dimasukkan ke dalam 1 mL pereaksi Bradford. Setelah 5 menit, larutan dianalisis menggunakan spektrofotometer UV Vis pada 5λ5 nm.
Pengendapan Protein dengan Amonium Sulfat (Scopes 1993)
4
Jumlah amonium sulfat (g/L) = 533(S2 - S1) 100 - (0.3 × S2) Keterangan: S1 merupakan konsentrasi awal amonium sulfat S2 merupakan konsentrasi akhir amonium sulfat
533 merupakan jumlah gram amonium sulfat yang dibutuhkan per liter larutan untuk membuat larutan jenuh 100%
Dialisis
β-Galaktosidase hasil pengendapan amonium sulfat didialisis menggunakan membran dialisis selofan MWCO 6-8 kDa. β-Galaktosidase yang telah dimasukkan ke dalam membran dialisis, direndam di dalam 2 L buferfosfat 0.01 M pH 6.5 dengan terus diaduk menggunakan pengaduk magnetik berkecepatan 100 rpm dengan suhu 4 oC. β-Galaktosidase hasil dialisis yang diperoleh kemudian diuji aktivitas dan kadar proteinnya.
Karakterisasi β-Galaktosidase
Uji Aktivitas β-Galaktosidase pada Berbagai pH. Uji aktivitas β -galaktosidase dilakukan dengan cara: sebanyak 100 L β-galaktosidase dimasukkan ke dalam 1 mL buferfosfat 0.1 M variasi pH 4.5-8.5 (selang pH 0.5). Selanjutnya, uji aktivitas β-galaktosidase dilakukan seperti metode Lu et al. modifikasi (2009).
Uji Aktivitas β-Galaktosidase pada Berbagai Suhu. Uji aktivitas β -galaktosidase dilakukan dengan caraμ sebanyak 100 L β-galaktosidase dimasukkan ke dalam 1 mL bufer 0.1 M pH 7.0 (pH optimum), kemudian diinkubasi selama 5 menit pada variasi suhu 25-50 oC (selang suhu 5 oC). Selanjutnya, uji aktivitas β-galaktosidase dilakukan seperti metode Lu et al. modifikasi (2009).
Uji Pengaruh Logam. Logam yang digunakan adalah CaCl2, CoCl2, CuCl2, HgCl2, MnCl2, MgSO4, dan ZnSO4.Pengujian pengaruh logam dilakukan dengan cara: sebanyak 100 L logam 0.01 M dimasukkan ke dalam 1 mL bufer fosfat 0.1 M pH 7.0 dan 100 L β-galaktosidase kasar. Selanjutnya, uji aktivitas β -galaktosidase dilakukan seperti metode Lu et al. modifikasi (2009).
Uji Pengaruh Konsentrasi Substrat. Sebanyak 100 L β-galaktosidase hasil dialisis dimasukkan ke dalam 1 mL bufer fosfat 0.1 M pH 7.0. Kemudian, ke dalam campuran reaksi ini dimasukkan sebanyak 200 L oNPG berbagai konsentrasi (0.01-5.00 mg/mL). Selanjutnya, uji aktivitas β-galaktosidase dilakukan seperti metode Lu et al. modifikasi (2009).
HASIL
Pemurnian Parsial β-Galaktosidase Lactobacillusplantarum B 123
5
5 Gambar 1 Pengendapan β-galaktosidase L. plantarum B 123 dengan variasi
konsentrasi amonium sulfat
β-Galaktosidase kasar memiliki aktivitas unit dan aktivitas spesifik sebesar 2470.51 U dan 8.08 U/mg protein. Setelah β-galaktosidase kasar diendapkan dengan amonium sulfat 50%, kemurnian β-galaktosidase meningkat 3.99 kali lipat, dengan rendemen 38.73%, dan aktivitas spesifik sebesar 32.27 U/mg. β -Galaktosidase kemudian dimurnikan lebih lanjut menggunakan membran dialisis selofan. Kemurnian β-galaktosidase meningkat 7.61 kali lipat, dengan rendemen 10.67%, dan aktivitas spesifik sebesar 61.53 U/mg (Tabel 1).
Tabel 1 Tahapan pemurnian parsial β-galaktosidase L. plantarum B 123 Tahapan Aktivitas
Karakteristik β-Galaktosidase Lactobacillusplantarum B 123
Pengaruh pH terhadap Aktivitas β-Galaktosidase L. plantarum B 123
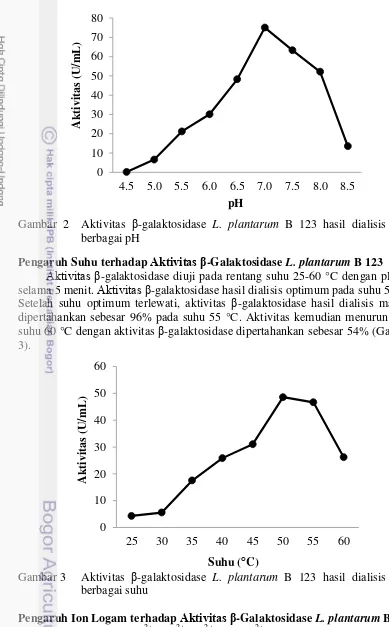
Aktivitas β-galaktosidase L. plantarum B 123 diuji pada rentang pH 4.5-8.5 dengan suhu 37 °C selama 5 menit. Aktivitas β-galaktosidase hasil dialisis optimum pada pH 7.0. Setelah pH optimum terlewati, aktivitas β-galaktosidase hasil dialisis dipertahankan sebesar 84% dan 70% pada pH 7.5 dan 8.0. Aktivitas kemudian menurun tajam hingga aktivitas β-galaktosidase hasil dialisis dipertahankan sebesar 18% pada pH 8.5 (Gambar 2).
6
Gambar 2 Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis pada berbagai pH
Pengaruh Suhu terhadap Aktivitas β-Galaktosidase L. plantarum B 123
Aktivitas β-galaktosidase diuji pada rentang suhu 25-60 °C dengan pH 7.0 selama 5 menit. Aktivitas β-galaktosidase hasil dialisis optimum pada suhu 50 °C. Setelah suhu optimum terlewati, aktivitas β-galaktosidase hasil dialisis mampu dipertahankan sebesar 96% pada suhu 55 °C. Aktivitas kemudian menurun pada suhu 60 °C dengan aktivitas β-galaktosidase dipertahankan sebesar 54% (Gambar 3).
Gambar 3 Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis pada berbagai suhu
Pengaruh Ion Logam terhadap Aktivitas β-Galaktosidase L. plantarum B 123
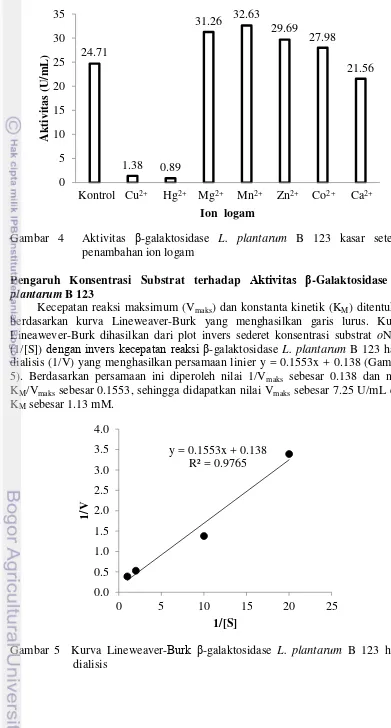
Ion-ion logam Mg2+, Mn2+, Zn2+, dan Co2+ 10 mM mampu meningkatkan aktivitas β-galaktosidase kasar masing-masing sebesar 25%, 31%, 19%, dan 12%, namun ion-ion logam Cu2+, Hg2+, dan Ca2+ 10 mM menghambat aktivitas β -galaktosidase kasar masing-masing sebesar 94%, 96% dan 15% (Gambar 4).
7
7 Gambar 4 Aktivitas β-galaktosidase L. plantarum B 123 kasar setelah
penambahan ion logam
Pengaruh Konsentrasi Substrat terhadap Aktivitas β-Galaktosidase L. plantarum B 123
8
PEMBAHASAN
Kondisi Optimum Pertumbuhan Lactobacillus plantarum B 123
Media yang digunakan untuk pertumbuhan L. plantarum B 123 adalah media MRS yang merupakan media selektif untuk pertumbuhan bakteri asam laktat. Menurut Mariyani (2013), kondisi optimum pertumbuhan L. plantarum B 123 untuk menghasilkan β-galaktosidase dengan aktivitas tertinggi adalah pada jumlah inokulum 2%, kandungan laktosa 1%, pH media 8, waktu inkubasi 24 jam, dan suhu inkubasi 37 °C.
Produksi enzim oleh mikroba dapat ditingkatkan dengan menambahkan suatu zat kimia yang dapat bertindak sebagai induser atau dengan mengubah komposisi substrat (Muchtadi et al. 1992). Zat kimia yang dapat bertindak sebagai induser adalah substrat atau senyawa yang sekerabat dengan substrat dari reaksi yang dikatalis oleh enzim yang bersangkutan (Pelczar dan Chan 1986). Laktosa merupakan sumber karbon dan induser untuk menghasilkan β-galaktosidase. Seperti dilaporkan Kim dan Rajagopal (2000) dan Isobe et al. (2013), Lactobacillus crispatus dan Teratosphaeria acidotherma memiliki aktivitas yang lebih tinggi pada saat ditumbuhkan di media yang mengandung sumber karbon laktosa dibandingkan pada saat ditumbuhkan di media yang mengandung sumber karbon lain seperti glukosa dan maltosa. Sumber karbon laktosa juga digunakan sebagai media pertumbuhan Lactobacillus brevis (Honda dan Yajima 2012), Bacillus sp. MTCC 3088 (Chakraborti et al. 2000), Aspergillus alliaceus (Sen et al. 2012), dan Arthrobacter sp. (Bialkowska et al. 2009). Penggunaan substrat kromogenik oNPG pada pengujian aktivitas β-galaktosidase L. plantarum B 123 juga didasarkan pada penelitian sebelumnya. Chakraborti et al. (2000) menyatakan, hidrolisis oNPG pada Bacillus sp. MTCC 3088 menghasilkan aktivitas β-galaktosidase yang lebih tinggi bila dibandingkan dengan hidrolisis substrat kromogenik lainnya.
Produksi β-Galaktosidase Lactobacillusplantarum B 123
Jumlah volume bufer yang digunakan untuk mengekstraksi β-galaktosidase adalah minimal dua kali bahan awal karena semakin banyak volume bufer yang ditambahkan, semakin banyak pula protein enzim yang terekstrak. Namun, dengan semakin banyaknya volume bufer yang digunakan, ekstrak enzim kasar yang diperoleh akan menjadi lebih encer (Scopes 1987). Oleh karena itu, perbandingan volume yang digunakan pada penelitian ini adalah 1:2.5, sehingga larutan ekstrak yang didapatkan tidak terlalu encer dan enzim yang terisolasi lebih stabil dan mudah diisolasi.
9
9 (2002), penggunaan tekanan osmotik rendah dapat membantu peristiwa lisisnya sel dan organel, sehingga jumlah enzim yang terekstrak mampu ditingkatkan. Selain itu, suhu 4 °C juga dipertahankan pada saat ektraksi guna mempertahankan struktur dan fungsi dari protein.
Pemurnian Parsial β-Galaktosidase Lactobacillusplantarum B 123
Pengendapan β-galaktosidase berfungsi untuk meningkatkan konsentrasi protein enzim, mereduksi volume larutan enzim, dan memisahkan protein target dari sebagian kontaminan yang tidak dikehendaki (Scopes 1987). Penggunaan garam amonium sulfat juga dipilih karena memiliki beberapa keuntungan seperti mudah larut, tidak toksik, dan stabil terhadap enzim (Darwis dan Sukara 1990). Penambahan amonium sulfat dilakukan secara perlahan agar enzim dapat mengendap dengan baik dan terus diaduk menggunakan pengaduk magnetik untuk menghindari penumpukan kadar elektrolit pada satu tempat dan untuk meningkatkan kontak pengendapan dengan enzim. Munculnya buih dihindari pada saat pengendapan amonium sulfat karena buih yang terbentuk mengindikasikan adanya kerusakan pada protein.
Tingkat kejenuhan amonium sulfat berbeda-beda, hal ini berhubungan dengan jumlah asam amino hidrofilik dan hidrofobik yang terdapat pada permukaan protein enzim. Protein enzim yang memiliki lebih banyak asam amino hidrofilik akan membutuhkan konsentrasi garam yang lebih banyak untuk mengendapkan protein enzim. Hal ini terjadi karena permukaan protein yang hidrofilik akan berinteraksi kuat dengan air, sehingga diperlukan ion-ion dari garam dalam jumlah banyak untuk mengganggu interaksi tersebut. Sebaliknya, jika protein enzim mengandung lebih banyak asam amino hidrofobik, jumlah amonium sulfat yang diperlukan untuk mengendapkan protein enzim pun akan lebih sedikit (Scopes 1987).
Fraksinasi bertingkat β-galaktosidase L. plantarum B 123 menunjukan, konsentrasi garam amonium sulfat 10-40% belum mampu mengendapkan β -galaktosidase secara keseluruhan (Gambar 1). Hal ini disebabkan karena protein masih mengalami salting in. Saat salting in, ion garam yang dihasilkan akan melindungi dan mencegah bersatunya molekul protein, sehingga protein masih banyak yang melarut dibandingkan dengan β-galaktosidase yang banyak terbuang pada saat pemisahan. Namun, setelah konsentrasi garam amonium sulfat mencapai 50%, sebagian besar β-galaktosidase L. plantarum B 123 dapat terendapkan. Hal ini terjadi karena protein mengalami salting out. Saat salting out, ion garam yang dihasilkan akan meningkatkan muatan listrik di sekitar protein, sehingga mantel air protein akan tertarik. Hal inilah yang menyebabkan interaksi hidrofobik dan kelarutan protein menurun (Suhartono et al. 1992). Lebih lanjut Scopes (1987) menyatakan, jika konsentrasi amonium sulfat yang ditambahkan ke dalam larutan melebihi nilai optimum yang dibutuhkan untuk mengendapkan molekul protein, kelebihan ion-ion garam ini akan menarik molekul-molekul protein, sehingga molekul-molekul protein menjadi terlarut kembali. Hal ini yang menyebabkan jumlah protein terendapkan menjadi lebih sedikit.
10
aktivitas optimum pada fraksi amonium sulfat 50% seperti β-galaktosidase Lactobacillus bulgaricus (Hartono 2013). Aktivitas β-galaktosidase yang optimum pada fraksi amonium sulfat 50% menunjukan bahwa, β-galaktosidase L. plantarum B 123 memiliki sifat hidrofobik karena hanya diperlukan amonium sulfat dalam jumlah relatif sedikit untuk mengendapkan β-galaktosidase. Pernyataan ini diperkuat dengan hasil penelitian Chen et al. (2008) yang menyatakan, β-galaktosidase Bacillus stearothermophilus mengandung lebih banyak asam amino leusin, isoleusin, valin, prolin, dan alanin yang merupakan asam amino yang bersifat non polar atau hidrofobik.
Setelah pengendapan β-galaktosidase dengan amonium sulfat, dilakukan pemurnian dengan dialisis terhadap fraksi amonium sulfat yang memiliki aktivitas optimum. Tujuan utama dialisis adalah menghilangkan molekul garam amonium sulfat dan ion-ion penganggu lainnya yang dapat berpengaruh terhadap kestabilan molekul enzim. Membran dialisis selofan yang digunakan memiliki ukuran 6-8 kDa, sehingga molekul yang berukuran kurang dari 6-8 kDa akan keluar dari membran semipermeabel. Saat dialisis, terjadi proses difusi dan osmosis yang ditandai dengan masuknya larutan bufer ke dalam kantong dialisis menggantikan molekul garam yang keluar (Scopes 1993). Tahapan dialisis ini menyebabkan aktivitas β-galaktosidase L. plantarum B 123 menurun (Tabel 1). Menurut Plumer (1979), penurunan aktivitas setelah pemurnian dengan dialisis mungkin disebabkan karena ion-ion penting yang berfungsi untuk menstabilkan dan mengaktivasi enzim hilang selama proses dialisis, karena selain membran dialisis bersifat semipermeabel terhadap ion-ion garam, membran dialisis juga bersifat semipermeabel terhadap ion-ion lainnya.
Kemurnian β-galaktosidase L. plantarum B 123 hasil dialisis meningkat 7.61 kali lipat dibandingkan dengan β-galaktosidase kasar (Tabel 1). Tingkat kemurnian ini lebih tinggi dibandingkan dengan β-galaktosidase Lactobacillus bulgaricus (3.13 kali lipat) dan Lactobacillus plantarum (7.28 kali lipat) (Hartono 2013; Mariyani 2013). Aktivitas spesifik β-galaktosidase L. plantarum B 123 hasil dialisis (61.53 U/mg protein) juga lebih tinggi dibandingkan dengan aktivitas spesifik β-galaktosidase Lactobacillusbulgaricus (45.828 U/mg protein) (Hartono 2013). Pemurnian β-galaktosidase lebih lanjut seperti pemurnian menggunakan metode kromatografi akan meningkatkan aktivitas β-galaktosidase seperti ditunjukkan oleh β-galaktosidase Bifidobacterium longum (168.6 unit/mg protein), Pseudoalteromonas sp. (251 unit/mg protein), Phaseolus vulgaris (281 unit/mg protein), Bifidobacterium infantis (568.7 unit/mg protein), dan Thermotoga naphtopila (1204.1 unit/mg protein), Bacillus stearothermophilus (125.2 unit/mg protein) (Hsu et al. 2006; Fernandes et al. 2002; Biswas et al. 2003; Hung dan Lee 2002; Honda dan Yajima 2012; Chen et al. 2008).
Karakteristik β-Galaktosidase Lactobacillusplantarum B 123
Pengaruh pH terhadap Aktivitas β-Galaktosidase L. plantarum B 123
11
11 mengakibatkan perubahan konformasi pada sisi aktif enzim. Bila sisi aktif enzim tidak sama dengan substrat, maka reaksi tidak akan terjadi. Sama halnya pada saat kadar pH terlalu tinggi, adanya ion OH- akan bereaksi dengan gugus karboksil pada sisi aktif enzim, sehingga mengakibatkan aktivitas enzim menurun (Palmer 1991). Aktivitas β-galaktosidase L. plantarum B 123 optimum pada pH 7.0 (Gambar 2). Seperti β-galaktosidase Bifidobacterium longum (Hsu et al. 2006) dan Bacillus stearothermophilus (Chen et al. 2008) yang juga optimum pada pH 7.0. Meningkatnya aktivitas enzim pada pH optimum dapat dikaitkan dengan perubahan ionisasi pada sisi aktif enzim, sehingga konformasi sisi aktif menjadi lebih efektif dalam mengikat dan mengubah substrat menjadi produk.
Pengaruh Suhu terhadap Aktivitas β-Galaktosidase L. plantarum B 123
Setiap enzim memiliki kisaran suhu tertentu untuk mencapai aktivitas optimum. Sebelum suhu optimum tercapai, aktivitas β-galaktosidase akan terus meningkat karena adanya peningkatan energi kinetik yang mempercepat gerak vibrasi, translasi, serta rotasi antara enzim dan substrat, sehingga peluang keduanya untuk saling bertumbukan menjadi lebih besar (Hames dan Hoper 2000). Namun setelah suhu optimum terlewati, aktivitas β-galaktosidase akan terus menurun. Hal ini disebabkan karena enzim mengalami denaturasi, sehingga konformasi molekul protein menjadi berubah dan enzim kehilangan sifat alamiahnya. Menurut Lehninger (1994), jika suatu protein terdenaturasi, struktur tiga dimensi yang bersifat khusus dari rantai polipeptida juga akan terganggu. Rantai polipeptida yang terganggu inilah yang menyebabkan struktur protein menjadi terbuka dan acak. Terbukanya struktur protein tidak menjadikan struktur kerangka kovalen rusak namun menyebabkan aktivitas biologis enzim menjadi tidak berfungsi.
Aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis optimum pada suhu 50 oC (Gambar 3). Seperti β-galaktosidase Lactobacillus kerfiranofaciens K-1, Lactobacillusbugaricus, Lactobacillus lactis, dan Bullera singularis (Hsu et al. 2006; Kim dan Rajagopal 2000) juga optimum pada suhu 50 oC. Aktivitas yang optimum pada suhu 50 oC ini menunjukan bahwa, β-galaktosidase L. plantarum B 123 bekerja aktif pada suhu tinggi atau bersifat termofilik. Menurut Sadeghi et al. (2006), protein yang bersifat termofilik memiliki karakteristik yang berbeda pada strukturnya dibandingkan dengan protein mesofilik. Protein termofilik memiliki lebih banyak struktur jembatan garam dan ikatan hidrogen yang berlimpah dibandingkan dengan protein mesofilik. Selain itu, protein termofilik memiliki lebih banyak residu asam amino yang bersifat hidrofobik, sehingga menyebabkan titik didih protein termofilik menjadi lebih tinggi.
Pengaruh Logam terhadap Aktivitas β-Galaktosidase L. plantarum B 123
12
Ion logam Mg2+, Mn2+,Co2+, dan Zn2+ berperan sebagai aktivator sedangkan ion logam Ca2+, Cu2+, dan Hg2+ berperan sebagai inhibitor bagi β-galaktosidase L. plantarum B 123 kasar (Gambar 4). Seperti β-galaktosidase L. plantarum B 123, β-galaktosidase L. bulgaricus (Hartono 2013), Bacillus liceniformis (Hsu et al. reaksi antara enzim dan substrat menjadi lebih mudah terjadi. Palmer (1991) juga menyatakan, ion logam berfungsi dalam peningkatan aktivitas enzim karena ion logam dapat berperan dalam pengikatan antara enzim dan substrat untuk menstabilkan konformasi sisi aktif enzim.
Penambahan ion logam berat seperti Hg2+ dan Cu2+ menurunkan sebagian besar aktivitas β-galaktosidase L. plantarum B 123 kasar. Ion logam Hg2+ merupakan inhibitor ireversibel yang akan bereaksi membentuk ikatan kovalen pada gugus fungsi, sehingga laju reaksi terhambat secara tetap. Lain halnya dengan ion logam Cu2+, yang merupakan inhibitor reversibel non-kompetitif. Ikatan yang terbentuk antara ion logam Cu2+ dan ezim tidak secara kovalen dan ikatan yang terbentuk bukan pada sisi aktifnya, sehingga enzim dapat mengikat substrat dan inhibitor secara bersamaan (Bintang 2010).
Penambahan 10 mM ion logam Ca2+ juga menurunkan aktivitas β -galaktosidase L. plantarum B 123 kasar. Namun, penambahan ion logam Ca2+ sampai pada batas tertentu mampu mengaktivasi aktivitas β-galaktosidase. Penambahan 1 mM ion logam Ca2+ mampu meningkatkan aktivitas β -galaktosidase Pseudoalteromonas sp.namun penambahan 10 mM ion logam Ca2+ akan menghambat aktivitas β-galaktosidase. Seperti halnya pada β-galaktosidase Bacillus liceniformis, penambahan 1; 2.5; dan 5 mM ion logam Ca2+ mampu meningkatkan aktivitas β-galaktosidase, namun penambahan 10; 20; dan 25 mM ion logam Ca2+ akan menghambat aktivitas β-galaktosidase (Chakraborti et al. 2000; Hung dan Lee 2002). Peristiwa ini didukung oleh pernyataan Palmer (1991) yang menyatakan, beberapa enzim memerlukan ion-ion logam tertentu untuk meningkatkan aktivitasnya. Namun, pada konsentrasi tertentu ion logam dapat bertindak sebagai inhibitor.
Pengaruh Konsentrasi Substrat terhadap Aktivitas β-Galaktosidase L. plantarum B 123
13
13 suatu konsentrasi substrat yang separuh lokasi aktifnya telah terisi atau bila kecepatan reaksi enzimatis telah mencapai setengah dari kecepatan maksimum (Wiseman 1989).
Penentuan nilai KM dan Vmaks secara lebih tepat dapat ditentukan berdasarkan persamaan Lineweaver-Burk (Gambar 5). Berdasarkan persamaan ini, diperoleh nilai Vmaks sebesar 7.25 U/mL dan KM sebesar 1.13 mM. Nilai Vmaks sebesar 7.25 U/mL didefinisikan sebagai suatu kondisi optimum β-galaktosidase L. plantarum B 123 untuk mengubah substrat oNPG menjadi oNP sebesar 7.25 U/mL setiap menit. Semakin tinggi Vmaks suatu enzim, semakin tinggi pula kecepatan yang bisa dicapai oleh enzim tersebut.
β-Galaktosidase L. plantarum B 123 hasil dialisis (1.13 mM) memiliki nilai KM yang lebih kecil dibandingkan dengan nilai KM β-galaktosidase Thermotoga naphtophila (1.31 mM), Aspergillus niger van Tiegh (1.74 mM), Bifidobacterium infantis (2.6 mM), Bacillus stearothermophilus (2.96 mM), L. plantarum B 134 (3.93 mM), Bacillus liceniformis (13.7 mM), dan Bacillus sp. MTCC 3088 (6.34 mM) (Fansi et al. 2014; Connell dan Walsh 2010; Hung dan Lee 2002; Chen et al. 2008; Hartono 2013; Juajun et al. 2011; Chakraborti et al. 2000). Winarno (1999) menyatakan, semakin rendah nilai KM, semakin kuat ikatan yang terbentuk antara enzim dan substrat. Selain itu, nilai KM yang rendah juga menyebabkan energi yang diperlukan untuk memulai terjadinya reaksi enzimatik lebih sedikit, sehingga reaksi menjadi lebih mudah terjadi.
SIMPULAN DAN SARAN
Simpulan
Pemurnian parsial β-galaktosidase L. plantarum B 123 dengan pengendapan amonium sulfat 50% dan dialisis mampu meningkatkan kemurnian β -galaktosidase sebesar 7.61 kali lipat, dengan rendemen 10.67%, dan aktivitas spesifik 61.53 U/mg protein.
Aktivitas β-galaktosidase hasil dialisis optimum pada pH 7.0 dan suhu 50 °C. Ion-ion logam Mg2+, Mn2+, Co2+, dan Zn2+ mampu meningkatkan aktivitas β-galaktosidase kasar sedangkan ion-ion logam Cu2+, Hg2+, dan Ca2+ menghambat aktivitas β-galaktosidase kasar pada konsentrasi 10 mM. Nilai KM dan Vmaks β -galaktosidase hasil dialisis sebesar 1.13 mM dan 7.25 U/mL.
Berdasarkan pemurnian parsial dan karakterisasi β-galaktosidase, L. plantarum B 123 merupakan bakteri asam laktat yang baik sebagai penghasil β -galaktosidase.
Saran
14
DAFTAR PUSTAKA
[BPOM] Badan Pengawasan Obat dan Makanan. 2008. Kenali Intoleransi Lebih Lanjut. InfoPOM. 9(1):1-3.
Bialkowska AM, Cieslinski H, Nowakowska KM, Kur J, Turkiewicz M. 2009. A new β-galactosidase with a low temperature optimum isolated from the Antarctic Arthrobacter sp. 20B: gene cloning, purification and characterization. Arch Microbiol. 191:825-835.doi:10.1007/s00203-009-0509-4.
Bintang M. 2010. Biokimia Teknik penelitian. Jakarta (ID): EGC.
Biswas S, Kayastha AM, Seckler R. 2003. Purification and characterization of a thermostable β-galactosidase from kidney beans (Phaseolus vulgaris L.) cv. PDR14. J Plant Physiol. 160:327-337.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72:248-254.
Chakraborti S, Sani RK, Banerjee UC, Sobti RC. 2000. Purification and characterization of a novel β-galactosidase from Bacillus sp. MTCC 3088. J Indust Microbiol Biotechnol. 24:58-63.
Cheetham PSJ. 1985. The applications of enzyme in industry. Di dalam: Wiseman A, editor. Handbook of Enzyme Biotechnology. Ed ke-2. New York (US): J Wiley. hlm 274-293.
Chen W, Chen H, Xia Y, Zhao J, Tian F, Zhang H. 2008. Production, purification, and characterization of a potential thermostable galactosidase for milk lactose hydrolysis from Bacillus stearothermophilus. J Dairy Sci. 91:1751-1758.doi:10.3168/jds.2007-617.
Chen W, Chen H, Xia Y, Yang J, Zhao J. 2009. Immobilization of recombinant thermostable [beta]-galactosidase from Bacillus stearothermophilus for lactose hydrolysis in milk. J Dairy Science. 92(2):491-498.
Connell S, Walsh G. 2010. A novel acid-stable, acid-active β-galactosidase potentially suited to the alleviation of lactose intolerance. Appl Microbiol Biotechnol. 86:517-524.doi:10.1007/s00253-009-2270-7.
Darwis AA, Sukara E. 1990. Isolasi, Pemurnian, dan Karakterisasi Enzim. Bogor (ID): IPB Pr.
Dennison C. 2002. A Guide to Protein Isolation. New York (US): Kluwer Academic.
Deutscher MP. 1990. Methods in Enzimology: Guide to Protein Purification. Volume ke-1. California (US): Academic Pr.
15
15 Fernandes S, Geueke B, Delgado O, Coleman J, Hatti-Kaul R. 2002. β
-Galactosidase from a cold-adapted bacterium: purification, characterization and application for lactose hydrolysis. Appl Microbiol Biotechnol. 58:313-321.doi:10.1007/s00253-001-0905-4.
Hames BD, Hoper NM. 2000. Biochemistry: The Instant Notes. Ed ke-2. Hongkong (HK): Springer-Verlag.
Hartono LK. 2013. Pemurnian parsial dan karakterisasi β-galaktosidase dari isolat bakteri asam laktat (BAL) strain B134 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Honda H, Yajima N. 2012. Characterization of lactose utilization and β -galactosidase in Lactobacillus brevis KB290, the hetero-fermentative lactic acid bacterium. Curr Microbiol. 65:679-685.doi:10.1007/s00284-012-0216-2.
Hsu CA, Yu RC, Chou CC. 2006. Purification and characterization of a sodium-stimulated β-galactosidase from Bifidobacterium longum CCRC 15708. J Microbiol Biotechnol. 22:355-361.doi:10.1007/s11274-005-9041-0.
Hung MN, Lee BH. 2002. Purification and characterization of a recombinant β -galactosidase with transgalactosylation activity from Bifidobacterium infantis HL96. Appl Microbiol Biotechnol. 58:439-445.doi:10.1007/s00253-001-0911-6.
Isobe K, Yamashita M, Chiba S, Takahashi N, Koyama T. 2013. Characterization of new β-galactosidase from acidophilic fungus Teratosphaeria acidotherma AIU BGA-1. J Biosci Bioengin. 116(3):293-297.
Juajun O, Nguyen TH, Maischberger T, Iqbal S, Haltrich D, Yamabhai M. 2011.
Cloning, purification, and characterization of β-galactosidase from Bacillus
licheniformis DSM 13. Appl Microbiol Biotechnol.
89:645-654.doi:10.1007/s00253-010-2862-2.
Kim JW, Rajagopal SN. 2000. Isolation and characterization of β-galactosidase from Lactobacillus crispatus. Folia Microbiol. 45(1):29-34.
Lehninger AL. 1994. Dasar-Dasar Biokimia. Thenawidjaja M, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: Principles of Biochemistry.
Lu LL, Xiao M, Li YM, Wang FS. 2009. A novel transglycosylating β- galactosidase from Enterobacter cloacae B5. Process Biochem. 44: 232-236. Mariyani N. 2013. Potensi enzim β-galaktosidase dari Lactobacillus plantarum
strain B123 indigenous untuk hidrolisis laktosa pada susu UHT [tesis]. Bogor (ID): Institut Pertanian Bogor.
Matthews BW. 2005. The structure of Escherichia coli β-galactosidase. CR Biologies. 328:529-556.
16
Murray RK, Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Hartono A, penerjemah; Bani AP dan Sikumbang TMN, editor. Jakarta (ID): EGC. Terjemahan dari: Harper’s Biochemistry. Ed ke-25.
Palmer T. 1991. Understanding Enzymes. Inggris (GB): Ellis Horwood.
Pelczar MJ, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Elements of Microbiology.
Plumer DT. 1979. An Introduction to Practical Biochemistry. Ed ke-2. New Delhi (IN): McGraw-Hill.
Sadeghi M, Manesh HN, Zarrabi M, Ranjbar B. 2006. Effective factors in thermostability of thermophilic proteins. Biophysic Chem. 119(3):256-270. doi:10.1016/j.bpc.2005.09.018.
Sani RK, Chakraborti S, Sobti RC, Patnaik PR, Banerjee UC. 1999. Characterization and some reaction-engineering aspects of thermostable extracellular β-galactosidase from a new Bacillus species. Folia Microbiol. 44(4):367-371.
Scopes RK. 1987. Protein Purification: Principles and Practice. Ed ke-2. New York (US): Springger-Verlag.
Scopes RK. 1993. Protein Purification. New York (US): RR Doneley and Sons. Sen S, Ray L, Chattopadhyay. 2012. Production, purification, immobilization, and
characterization of a thermostable β-galactosidase from Aspergillus alliaceus. Appl Biochem Biotechnol. 167:1938-1953.doi:10.1007/s12010-012-9732-6.
Suhartono MT, Suswanto A, Widjaja H. 1992. Struktur dan Biokimiawi Protein. Bogor (ID): PAU-IPB.
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor (ID): PAU-IPB.
Wang D, Sakakibara M. 1λλ7. Lactose hydrolysis and β-galactosidase activity in sonicated fermentation with Lactobacillus strain. Ultrasonics Sonochem. 4:255-261.
Winarno FG. 1999. Enzim Pangan. Jakarta (ID): Gramedia.
17
18
Lampiran 1 Diagram alir penelitian
Ekstraksi
Karakterisasi
Pengendapan amonium sulfat Peremajaan L. plantarum B 123
Dialisis
Karakterisasi
2% Inokulum, 1% Laktosa, pH media 8, Waktu Inkubasi 24 Jam, Suhu 37 °C
Aktivitas pH & Suhu, Parameter Kinetik Pengaruh
19
19 Lampiran 2 Kurva standar oNP dalam analisis aktivitas β-galaktosidase dengan
metode Lu et al. modifikasi (2009) 0.00 0.00000 0.0000000000 0.000000000 0.000 0.000 0.05 0.00005 1.599765E-05 0.000000115 0.115 0.020 0.10 0.00010 3.199530E-05 0.000000230 0.230 0.039 0.20 0.00020 6.399060E-05 0.000000460 0.460 0.080 0.30 0.00030 9.598590E-05 0.000000690 0.690 0.117 0.40 0.00040 0.0001279812 0.000000920 0.920 0.150 0.50 0.00050 0.0001599765 0.000001150 1.150 0.171 1.00 0.00100 0.0003199530 0.000002300 2.300 0.400 1.50 0.00150 0.0004799295 0.000003450 3.450 0.545 2.00 0.00200 0.0006399060 0.000004600 4.600 0.690 2.50 0.00250 0.0007998825 0.000005750 5.750 0.882
Contoh perhitungan:
[oNP] (g) = oNP (M) × oNP (mL) × 139.11 g oNP/mol × 1/1000 [oNP] (mol) = g oNP / 139.11 g oNP/moL
[oNP] ( mol) = [oNP] (mol) × 10-6
20
Lampiran 4 Perhitungan aktivitas β-galaktosidase yang diukur dengan metode Lu et al. modifikasi (2009) Tingkat kemurnian (kali) = Aktivitas spesifik pemurnian (U/mg) Aktivitas spesifik enzim kasar (U/mg) β-Galaktosidase kasar 12.353 24.705 2470.511 305.682 8.082 Pengendapan dengan
amonium sulfat 50% 95.675 191.350 956.750 29.650 32.268
Dialisis 37.549 75.098 262.844 4.272 61.527
22
Lampiran 10 Pengaruh konsentrasi substrat terhadap aktivitas β-galaktosidase L. plantarum B 123 hasil dialisis
[Substrat]
(mg/mL) Aktivitas (U/mL) 1/[S] 1/V
0.05 0.295 20.0 3.390
0.10 0.727 10.0 1.376
0.50 1.894 2.0 0.528
1.00 2.602 1.0 0.384
Kurva Michaelis-Menten β-galaktosidase L. plantarum B 123
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50
0.00 1.00 2.00 3.00 4.00 5.00 6.00
Aktivi
tas (
U/m
L
)
23
23
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 10 Nopember 1993 dari ayah Ir Widodo dan ibu Rieta Purwati. Penulis merupakan putri bungsu dari dua bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 4 Cimahi dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan terdaftar sebagai mahasiswa pada Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.