i
DEGRADASI
IN VITRO
ASAM FITAT RUMPUT DAN LEGUM
OLEH KONSORSIUM BAKTERI RUMEN
PENCERNA SERAT ASAL KERBAU
SKRIPSI
TRIYANA ENGGAR SASMITA
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
ii RINGKASAN
Triyana Enggar Sasmita. D24070292. 2013. Degradasi In Vitro Asam Fitat Rumput dan Legum oleh Konsorsium Bakteri Rumen Pencerna Serat Asal Kerbau. Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Toto Toharmat, M.Agr.Sc. Pembimbing Anggota : Dr. Ir. Dwierra Evvyernie A., M.S., M.Sc.
Asam fitat merupakan bentuk penyimpanan fosfor (P) yang terbesar pada tanaman serealia dan leguminosa. Asam fitat mampu didegradasi oleh mikroba rumen sehingga dapat dimanfaatkan oleh ternak ruminansia. Mikroba di dalam rumen tersebut didominasi oleh mikroba pencerna serat, seperti isolat bakteri pencerna serat yang kemampuannya dalam mendegradasi asam fitat belum diketahui. Penelitian ini bertujuan untuk mengkaji degradasi asam fitat pada beberapa jenis rumput dan legum hijauan pakan oleh konsorsium isolat bakteri rumen dan mengetahui korelasi degradasi fitat tersebut dengan Volatile Fatty Acid (VFA), NH3, koefisien cerna bahan kering (KCBK)
dan koefisien cerna bahan organik (KCBO) in vitro.
Penelitian ini dilakukan in vitro dalam dua tahap. Tahap pertama mengkaji degradasi asam fitat pada beberapa jenis rumput dan legum hijauan pakan oleh konsorsium isolat bakteri rumen menggunakan isolat bakteri yang diisolasi dari rumen kerbau yang merupakan koleksi dari laboratorium Ilmu Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan IPB. Pakan yang digunakan dalam penelitian adalah: Pennisetum purpureum, Paspalum notatum, Setaria splendida, Indigofera sp., Gliricidia sepium, Calliandra sp. dan Pollard. Peubah yang diamati yaitu kadar fitat pollard, rumput, dan legum yang difermentasi selama 3, 6 dan 12 jam secara anaerob pada suhu 39°C menggunakan isolat rumen bakteri pencerna serat. Data degradasi asam fitat dianalisis secra deskriptif. Tahap kedua mengkaji fermentasi rumput dan legum in vitro. Peubah yang diamati dalam penelitian ini adalah konsentrasi VFA total, konsentrasi NH3, KCBK dan KCBO. Data dianalisis dengan
mengkaji hubungan antara degradasi asam fitat dengan kadar NH3 dan VFA filtrat hasil
fermentasi bahan pakan selama empat jam.
Hasil penelitian tahap pertama menunjukkan bahwa sebagian asam fitat mampu didegradasi oleh konsorsium bakteri pencerna serat rumen mulai dari tiga jam fermentasi. Kemampuan konsorsium bakteri pencerna serat dalam mendegradasi asam fitat 58,87% hingga 100% pada waktu 12 jam. Tingkat degradasi yang tinggi tersebut menggambarkan bahwa konsorsium bakteri rumen pencerna serat mampu mendegradasi asam fitat baik yang terkandung di dalam hasil ikutan industri pertanian (pollard), leguminosa maupun rumput. Hasil penelitian tahap kedua menunjukkan bahwa hasil total VFA pada sampel Paspalum notatum sebesar 241,45 mM merupakan total VFA tertinggi, sedangkan Pennisetum purpureum menghasilkan VFA terendah. Total NH3 pada
sampel Indigofera sp. sebesar 14,44 mM merupakan total NH3 tertinggi, sedangkan Paspalum notatum menghasilkan NH3 terendah dengan hasil 6,11 mM. KCBK tertinggi
iii
sp. sebesar 63,55%. Tidak terdapat korelasi antara penurunan kadar asam fitat dengan kadar VFA, NH3 dan kecernaan bahan kering serta bahan organik. Asam fitat merupakan
komponen bahan kering pakan. Hal tersebut menunjukkan bahwa asam fitat mempunyai degradasi yang berbeda dengan komponen pakan lainnya.
Hasil penelitian ini dapat disimpulkan bahwa konsorsium bakteri rumen pencerna serat mampu mendegradasi asam fitat dalam berbagai bahan pakan baik hasil samping industri, rumput maupun leguminosa. Tingkat degradasi dipengaruhi oleh jenis bahan tanaman dan lama fermentasi. Tidak terdapat korelasi antara penurunan kadar asam fitat dengan kadar VFA, NH3 dan kecernaan bahan kering serta bahan organik.
iv ABSTRACT
In Vitro Degradation of Phytic Acid in Grass and Legumes by Consortium Bacteria Digesting Fiber Isolated Buffalo Rumen
Sasmita, T. E., T. Toharmat and D. E. Amirroenas
Phytic acid is the major storage of phosphorus in the seeds of legume and cereal. It is degraded by ruminal bacteria. However the ability of bacteria isolates in degrading nutrients and phytic acid is not clear. The objective of this study was to evaluate the ability of sellulolytic bacteria consortium isolated from rumen buffalo to degrade phytic acid and digest dry matter, as well as organic matter. The first trial evaluated the ability of sellulolytic bacteria consortiom in degrading phytic acid. The consortium of 6 rumen bacteria isolates was incubated anaerobically in media containing pollard, legume and grass for 3, 6 and 12 hours. Phytic acid content contained in the media was determined before and after fermentation. Data were analyzed according to simple statistic. The second trial was designed to evaluate the in vitro fermentability of legumes and grasses. The results suggested that phytic acid was partly degraded by the consortium of rumen bacteria. Degradation of phytic acid was influenced by type of plant and fermentation period. There was no correlation between phytic acid degradation and concentration of VFA, NH3, dry matter and organic matter digestibility. It was concluded that consortium
of rumen bacteria was capable in degrading phytic acid contained in grasses and concentrates, but its degradation was not affected by the protein degradation and fermentation of carbohydrate.
v
DEGRADASI
IN VITRO
ASAM FITAT RUMPUT DAN LEGUM
OLEH KONSORSIUM BAKTERI RUMEN
PENCERNA SERAT ASAL KERBAU
TRIYANA ENGGAR SASMITA D24070292
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
vi Judul : Degradasi In Vitro Asam Fitat Rumput dan Legum oleh Konsorsium Bakteri
Rumen Pencerna Serat Asal Kerbau Nama : Triyana Enggar Sasmita
NIM : D24070292
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Prof. Dr. Ir. Toto Toharmat, M. Agr. Sc) NIP. 19590902 198303 1 003
(Dr. Ir. Dwierra Evvyernie Amirroenas) NIP. 19610602 198603 2 001
Mengetahui: Ketua Departemen
Ilmu Nutrisi dan Teknologi Pakan Fakultas Peternakan Institut Pertanian Bogor
(Dr. Ir. Idat Galih Permana, MSc. Agr) NIP: 19670506 199103 1 001
vii RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 28 April 1989 di Klaten, Jawa Tengah. Penulis adalah anak ketiga dari tiga bersaudara dari pasangan Bapak Giyoto dan Ibu Parwiyati. Tahun 1995 penulis mengawali pendidikan dasarnya di Sekolah Dasar Negeri 02 Dompyongan, Klaten, Jawa Tengah dan diselesaikan tahun 2001. Pendidikan lanjutan tingkat pertama dimulai tahun 2001 dan diselesaikan pada tahun 2004 di Sekolah Lanjutan Tingkat Pertama Negeri 1 Jogonalan, Klaten, Jawa Tengah. Penulis melanjutkan pendidikannya di
Sekolah Menengah Atas Negeri 1 Jogonalan pada tahun 2004 dan diselesaikan pada tahun 2007.
Penulis diterima di Institut Pertanian Bogor pada tahun 2007 melalui jalur Seleksi Penerimaan Mahasiswa Baru IPB (SPMB) di Fakultas Peternakan dan pada tingkat dua masuk di Departemen Ilmu Nutrisi dan Teknologi Pakan. Tingkat kedua tahun 2008/2009 penulis aktif di Himpunan Mahasiswa Nutrisi dan Teknologi Pakan Fakultas Peternakan (HIMASITER) bagian Nutrisi dan Industri (NUTRISARI). Penulis pernah mengikuti kegiatan magang selama satu minggu di Balai Embrio Ternak Lembang, Bandung (BIB Lembang) pada tahun 2008.
Bogor, Maret 2013
viii KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Degradasi In Vitro
Asam Fitat Rumput dan Legum oleh Konsorsium Bakteri Rumen Pencerna Serat Asal Kerbau. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar Sarjana Peternakan.
Karya Ilmiah ini bertujuan untuk mengkaji degradasi asam fitat pada beberapa jenis rumput dan legum hijauan pakan oleh konsorsium isolat bakteri rumen dan mengetahui korelasi degradasi fitat dengan VFA, NH3, KCBK dan KCBO in vitro.
Penulis memahami bahwa dalam penulisan skripsi ini masih banyak terdapat kekurangan. Oleh karena itu, besar harapan penulis adanya saran dari berbagai kalangan untuk perbaikan skripsi ini. Penulis pun mengucapkan terima kasih kepada seluruh pihak yang telah ikut berperan sehingga penulisan skripsi ini dapat terselesaikan. Semoga skripsi ini bermanfaat bagi pembaca.
Bogor, Maret 2013
ix
Efektivitas Kecernaan Pakan Hijauan di dalam Rumen ... 5
Rumput dan Legum ... 6
Fermentasi Bahan dalam Cairan Rumen ... 9
Analisis Asam fitat ... 9
Percobaan 2 : Uji Kemampuan Fermentatif Isolat Bakteri in vitro . 11 Fermentasi ... 11
x
Pengukuran Konsentrasi NH3 ... 12
Pengukuran KCBK dan KCBO ... 13
Rancangan dan Analisis Data ... 14
HASIL DAN PEMBAHASAN ... 15
Degradasi Asam Fitat ... 15
Fermentabilitas in vitro Bahan Pakan Hijauan yang Mengandung Asam Fitat ... 19
Total VFA ... 19
Kadar Ammonia (NH3) ... 20
Koefisien Cerna in vitro Bahan Pakan Hijuauan yang Mengandung Asam Fitat ... 21
Koefisien Cerna Bahan Kering (KCBK) ... 21
Koefisien Cerna Bahan Organik (KCBO) ... 21
Korelasi Penurunan Kadar Asam Fitat dengan Kadar VFA, NH3 dan KCBK serta KCBO ... 22
PENUTUP ... 23
Kesimpulan ... 23
Saran ... 23
UCAPAN TERIMA KASIH ... 24
xi DAFTAR TABEL
Nomor Halaman
1. Fermentabilitas dan Koefisien Cerna In Vitro Bahan Pakan
Hijauan yang Mengandung Asam Fitat ... 18 2. Korelasi antara Penurunan Kadar Fitat pada 12 jam Pertama
Fermentasi dengan kadar VFA, NH3 dan Kecernaan
xii DAFTAR GAMBAR
Nomor Halaman
1. Struktur Asam Fitat ... 3 2. Degradasi Asam Fitat Setaria splendida, Calliandra sp. dan
Gliricidia sepium oleh Konsorsium Bakteri Rumen Pencerna Serat ... 16
3. Degradasi Asam Fitat Pollard, Pennisetum purpureum, Paspalum
notatum dan Indigofera sp. oleh Konsorsium Bakteri Rumen
1 PENDAHULUAN
Latar belakang
Produk tanaman biji-bijian banyak digunakan sebagai sumber nutrien yang penting bagi manusia dan hewan. Bahan tersebut dapat digunakan sebagai sumber karbohidrat, protein dan mineral yang penting bagi kesehatan, pertumbuhan dan reproduksi. Penggunaan bahan pakan yang berbasis biji-bijian terkendala beberapa masalah, salah satunya adalah terdapatnya faktor antinutrisi seperti asam fitat.
Asam fitat merupakan bentuk utama penyimpanan fosfor (P) yang tidak dapat dimanfaatkan oleh hewan monogastrik. Syamsir (2010) melaporkan bahwa asam fitat dan senyawa fitat dapat mengikat mineral seperti Ca, Mg, Zn dan Cu sehingga berpotensi mengganggu penyerapan mineral. Selain mengikat mineral, fitat juga bisa berikatan dengan protein sehingga menurunkan nilai cerna protein bahan pakan.
Salah satu cara untuk meningkatkan efisiensi pemanfaatan unsur P dari fitat dan mengurangi pengaruh negatifnya terhadap utilisasi nutrien lain adalah dengan penggunaan fitase. Fitase merupakan fosfomonoesterase yang menghidrolisis asam fitat menjadi ortofosfat anorganik, mio-inositol dan monofosfat (Greiner dan Konietzny, 2006). Menurut Haros et al. (2001) bahwa keuntungan penggunaan enzim fitase adalah meningkatkan nutrisi melalui penurunan kandungan fitat dan mampu meningkatkan aktivitas α-amilase endogen. Praktek penggunaan fitase komersial telah banyak digunakan pada pakan unggas. Hewan ruminansia berbeda dengan monogastrik, hewan tersebut mempunyai mikroba di dalam rumen yang mampu mendegradasi komponen fitat (Hernaman, 2006). Namun degradasi asam fitat dari bahan yang berbeda belum banyak diketahui, demikian juga mikroba pencerna serat yang dominan di dalam rumen, seperti halnya isolat bakteri rumen, kemampuannya dalam mendegradasi asam fitat belum diketahui.
2 tinggi seperti rumput gajah, jerami padi, alang-alang dan serat sawit (Astuti, 2010; Gayatri, 2010). Inokulasi isolat bakteri rumen pencerna tersebut pada pedet periode menyusu meningkatkan pertumbuhannya (Rahayu, 2010; Sihombing, 2011; Hadziq, 2011), namun kemampuan isolat bakteri pencerna serat dalam menghidrolisis molekul asam fitat belum diketahui. Kajian kemampuan isolat bakteri tersebut baik secara tunggal maupun konsorsium dari beberapa bakteri dalam menghasilkan fitase akan sangat bermanfaat dalam memanfaatkan konsorsium bakteri tersebut. Penelitian ini dirancang untuk mengkaji kemampuan konsorsium bakteri rumen dalam mendegradasi asam fitat sebagai indikator dihasilkannya fitase.
Tujuan
3 TINJAUAN PUSTAKA
Asam Fitat
Asam fitat (C6H18O24P6 atau IP6) secara struktural adalah suatu cincin
mio-inositol yang mengikat penuh fosfat disekeliling cincin (Gambar 1). Biji-bijian banyak mengandung 60-90% total fosfor dalam bentuk fitat atau garam fitat (Loren, 2005). Syamsir (2010) menyatakan bahwa asam fitat dan senyawa fitat dapat mengikat mineral seperti Ca, Mg, Zn dan Cu sehingga berpotensi mengganggu penyerapan mineral. Selain mengikat mineral, asam fitat juga bisa berikatan dengan protein sehingga menurunkan nilai cerna protein bahan pakan. Menurut Fredlund et al. (2006) bahwa penambahan fitat dapat mengganggu dalam penyerapan Zn dan Ca.
Gambar 1. Struktur Asam Fitat (Maenz, 2001)
Asam fitat memiliki banyak manfaat bagi kesehatan, Graf dan Eaton (1990) menyatakan bahwa asam fitat memiliki fungsi penting sebagai antioksidan sehingga dapat menghambat terjadinya radikal bebas dan penyakit kanker. Asam fitat merupakan antioksidan alami sebesar 1-5% yang terkandung dalam serealia dan kacang-kacangan.
4 suplementasi fosfor anorganik dalam pakan ternak dan mengurangi dampak lingkungan dari fosfor ekskreta.
Fermentasi Asam Fitat
Penelitian yang dilakukan oleh Morse et al. (1992) menyatakan bahwa enam konsentrat yang diinkubasi secara in vitro untuk menentukan tingkat berkurangnya fitat dari padatan dan cairan. Lebih dari 90% P di fitat berkurang dari padatan antara 6 dan 8 jam inkubasi in vitro (pollard, dedak padi, hominy, bungkil kedelai, biji-bijian kering) atau antara 12 dan 24 jam (bungkil biji kapas). Unsur P di dalam molekul fitat bahan pakan dalam cairan rumen dapat dihidrolisis sempurna dalam waktu 12 jam kecuali untuk bungkil biji kapas yang membutuhkan waktu selama 24 jam. Hidrolisis cincin inositol untuk melepaskan P in vivo lebih besar dari 99%, berdasarkan pengumpulan total feses 11 sapi dan penggunaan Cr sebagai penanda yang dicerna dalam feses dan 94 - 98% untuk sampel yang sama ditetapkan dengan metode indikator menggunakan acid detergent lignin yang tidak tercerna.
Menurut Park et al. (2002) bahwa domba mampu mendegradasi sebagian asam fitat bungkil biji kapas di dalam usus besar, meskipun demikian lebih dari 10% P dalam pakan dalam bentuk inositol fosfat diekskresikan dalam feses. Hal ini menunjukkan bahwa bungkil biji kapas mengandung P yang tidak tersedia untuk domba dan degradasi fitat terutama terjadi didalam rumen.
Aktivitas Fermentasi Rumen
Rumen dihuni oleh tiga jenis mikroorganisme anaerob, yaitu bakteri, protozoa, dan fungi. Tetapi yang paling banyak jenisnya dan lebih beragam macam substratnya adalah bakteri. Populasi bakteri dalam rumen sangat tinggi, yaitu 109 -1010/ml (Theodorou dan France, 2005). Berdasarkan macam substrat yang disukainya, bakteri rumen dapat dikelompokkan sebagai bakteri pencerna selulosa, pencerna hemiselulosa, pencerna pati, pencerna gula dan bakteri pengguna produk sekunder.
5 dapat diserap dan selanjutnya dapat dimanfaatkan oleh ternak. Selain sifatnya yang anaerob, mikroba rumen juga memerlukan kondisi yang pH 6–7 dan suhu 38-42°C.
Bakteri merupakan penghuni terbesar dalam rumen yaitu, 109-1010 /ml cairan rumen, sedangkan populasi protozoa adalah 105-106/ml cairan rumen. jenis bakteri yang umum terdapat dalam rumen secara in vitro adalah Fibrobacter succinogenes,
Ruminococcus flavefaciens, Ruminococcus albus, Streptococcus bovis, Prevotella
ruminicola, dan Megasphaera elsdenii (McDonald et al., 1995). Bakteri rumen merupakan spesies yang penting dan menunjukkan substrat yang digunakan serta produk dari fermentasi. Bakteri rumen yang diisolasi in vitro tidak sepenuhnya berlaku pada in vivo. Jumlah total bakteri dan populasi relatif dari spesies individu dan bervariasi dengan pakan ternak.
Mikroorganisme rumen dan hewan ruminansia hidup dalam simbiosis mutualisme. Keuntungan hewan ruminansia dengan adanya mikroorganisme rumen dapat mencerna pakan atau sebaliknya mampu menggunakan dan menghasilkan nutrien yang dibutuhkan. Hal tersebut yang membuat penetapan pemberian jumlah pakan pada ruminansia lebih rumit, karena pemberian pakan ruminansia tidak hanya untuk hewan sendiri tetapi juga untuk mikroorganisme.
Efektivitas Kecernaan Pakan Hijauan di dalam Rumen
Proses pencernaan karbohidrat di dalam rumen ternak ruminansia akan dihasilkan energi berupa asam-asam lemak antara lain asetat, propionat, dan butirat. Asam-asam lemak tersebut dapat menggambarkan fermentabilitas suatu pakan. Proses pencernaan karbohidrat di dalam rumen dapat dibagi menjadi dua tahap yaitu pertama hidrolisis karbohidrat kompleks menjadi gula sederhana dan yang kedua adalah fermentasi gula sederhana oleh mikroba rumen menghasilkan antara lain VFA yang berupa asam asetat, propionat dan butirat, CO2 dan metan (McDonald et al.,
2002). Konsentrasi VFA yang meningkat dapat mencerminkan tingginya kadar karbohidrat yang mudah larut dalam pakan.
6 Komposisi VFA di dalam rumen berubah dengan adanya perubahan komponen pakan basal, tipe karbohidrat pakan, bentuk fisik pakan, tingkat konsumsi, frekuensi pakan, dan penggunaan aditif kimia (France dan Dijkstra, 2005). Meskipun demikian secara umum perbandingan VFA di dalam rumen berkisar pada 65% asetat, 21% propionat, dan 14% butirat. (McDonald et al., 2002).
Rumput dan Legum
Rumput-rumputan digolongkan ke dalam tanaman family Poaceae
(Gramineae), rumput digunakan untuk melengkapi kebutuhan pakan ternak lokal di dunia. Rumput-rumputan meliputi sod crops dan cereals yang jumlahnya dapat mencapai 10.000 spesies dan dikelompokkan ke dalam 785 genus, sedangkan legum digolongkan ke dalam tanaman family Fabaceae yang jumlahnya 12.000 spesies dan dapat dikelompokkan ke dalam lebih dari 500 genus.
Hijauan pakan yang berupa rumput-rumputan kaya akan lemak, gula, mineral, dan bagian karbohidrat (hemiselulosa, selulosa, dan lignin). Beberapa bagian dari karbohidrat dalam bentuk serat kasar dapat dicerna oleh enzim mikroba rumen. Mikroflora di dalam rumen atau kolon pada herbivora mampu mengubah hemiselulosa dan selulosa menjadi produk yang dapat digunakan oleh herbivora tersebut memberikan keuntungan ekologis pada mikroflora itu sendiri. Banyak faktor-faktor yang dapat mempengaruhi nilai koefisien cerna rumput-rumputan sebagai pakan ternak, diantaranya adalah spesies dan varietas, kedewasaan, kesuburan tanah, lingkungan, dan manajemen hasil panen. Rumput-rumputan mampu menyediakan sumber nutrien utama untuk ternak. Selain menyediakan pakan untuk ternak, rumput dapat digunakan untuk mencegah erosi tanah, memperbaiki struktur tanah, manajemen yang buruk dan melindungi air tanah (Cherney dan Cherney, 2005).
7 karena terdapat hubungan negatif yang kuat antara kematangan dan kecernaan (Cherney dan Cherney, 2005).
Rumput dapat diberikan sesuai dengan jumlah produksi atau performan hewan ternak. Performan ternak merupakan fungsi dari nutrien yang konsentrasi nutrien pakan, kecernaan komponen pakan, absorbsi dan efisiensi metabolisme. Intake dan kecernaan komponen nutrien pakan serta efisiensi penggunaan pakan dapat menentukan performan ternak (Cherney dan Cherney, 2005).
Tingkat pencernaan pakan oleh ternak dapat digunakan untuk memprediksi respon hewan terhadap pakan. Lignin merupakan unsur bahan kimia pokok yang sering diketahui sebagai pembatas kecernaan serat dan pakan secara keseluruhan. Lignin yang tidak dapat dicerna atau dihidrolisis oleh enzim mikroba di dalam rumen ternak ruminansia merupakan penghambat pencernaan hemiselulosa. Setiap spesies mempunyai hubungan yang berbeda dengan komposisi bahan kering lignin dan kecernaan bahan kering.
Legum mempunyai kadar protein yang lebih tinggi dibandingkan dengan rumput. Tanaman tersebut mempunyai hubungan simbiotik dengan bakteri pengikat nitrogen rhizobia, yang mengurangi ketergantungan tanaman tersebut pada pupuk nitrogen. Kadar lignin pada legum yang relatif lebih tinggi daripada rumput mempengaruhi tingkat kecernaan pada ternak ruminansia. Legum umumnya merupakan pakan yang berkualitas tinggi, namun beberapa tanaman legum mengandung beberapa faktor antinutrisi seperti koumarin, mimosin, fitat,
8 MATERI DAN METODE
Waktu dan Lokasi
Penelitian dilaksanakan dari bulan Agustus sampai dengan November 2011. Semua kegiatan dikonsentrasikan di Laboratorium Nutrisi Ternak Perah dan Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Alat
Alat yang digunakan pada penelitian adalah alumunium foil, kertas label, tutup karet, isolasi panfix, plastik tahan panas, spoit, buret, pipet mikro, stirer, pipet volumetrik, bulp, kertas pH, sprayer, botol selai, gelas piala, gelas ukur, labu
Erlenmeyer, tabung reaksi, tabung fermentor, eksikator, magnetic stirrer, tabung gas CO2, oven 105 °C, oven 60 °C, timbangan digital, autoclave, heater, shaker waterbath, vortex dan spektrofotometer UV 200 RS.
Bahan
Bahan yang digunakan pada penelitian adalah cairan rumen yang telah disterilkan didapatkan dari rumah potong hewan (RPH) milik PT. Elders, sumber inokulum yang digunakan yaitu enam isolat bakteri campuran (A27, I8, A9, A3, B61, B6) rumen kerbau koleksi Laboratorium Ilmu Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan Fakultas Peternakan IPB, pollard, legum (Leucaena leucocephala, Indigofera sp., Calliandra sp. dan Gliricidia sepium), rumput (Pennisetum purpureum, Panicum sp., Brachiaria humidicola, Setaria splendida dan Paspalum notatum), aquades, medium brain heart infusion (BHI), glukosa, celubiosa, cystein-HCl, resazurin, hemin, larutan HNO3 0,5 M, sodium
fitat, ferric ammonium sulphate, amyl alcohol, ammonium thycianate (NH4CNS),
dan larutan McDougall.
Prosedur
Pembuatan Media Brain Heart Infucion (BHI)
Bahan-bahan yang digunakan dalam pembuatan media BHI terdiri dari BHI
9 penyusun media adalah: larutan BHI 3,7 g dalam 100 ml, cystein HCl 0,05 g, pati 0,05 g, glukosa 0,05 g, celubiosa 0,05 g, resazurin 0,2 ml, hemin 0,5 ml. Setelah semua bahan dicampurkan ke dalam larutan, larutan tersebut dipanaskan hingga seluruh bahan larut. Selajutnya larutan dialiri dengan CO2 selama 20 menit,
kemudian sebanyak 5 ml larutan dipipet dan dimasukkan ke dalam tabung reaksi untuk disterilisasi dalam autoclave selama 15-20 menit (Schlegel, 1994).
Peremajaan Bakteri
Media basal yang berupa larutan BHI sebanyak 5 ml dimasukkan ke dalam tabung reaksi sambil dialiri gas CO2, kemudian tabung ditutup dengan tutup karet
dan dilapisi panfik agar keadaan media tumbuh bakteri tetap dalam kondisi anaerob. Isolat bakteri disuntikkan sebanyak 0,1 ml dengan konsentrasi bakteri 108 cfu/ml kemudian dikocok supaya bakteri tercampur dan dapat tumbuh pada media yang digunakan. Kemudian disimpan di dalam shaker water bath selama 7 jam dengan suhu 39 ºC.
Percobaan 1: Uji Analisis Fitat Fermentatif in vitro
Fermentasi Bahan dalam Cairan Rumen. Sampel sebanyak 0,5 g dimasukkan ke dalam tabung fermentor, selanjutnya 40 ml larutan McDougell dan 5 ml cairan rumen steril serta 5 ml isolat bakteri campuran konsentrasi bakteri 108 cfu/ml dialiri dengan CO2. Selanjutnya diinkubasi selama 3, 6, dan 12 jam. Setelah fermentasi,
filtrat beserta sampel di dalamnya dianalisis kadar fitatnya dengan menggunakan metode Davies dan Ried (1979). Masing-masing pengamatan dilakukan secara duplo. Analisis Asam fitat. Analisis kadar asam fitat dalam sampel dilakukan menurut metode (Davies dan Ried, 1979).
a. Pembuatan Kurva Standar
Lima buah tabung reaksi masing-masing dimasukkan ke dalamnya 0,1; 0,2; 0,3; 0,4; 0,5 larutan asam sodium fitat 1,1 mM. Kemudian ditambahkan akuades sehingga semua tabung volumenya menjadi 0,5 ml. Selanjutnya 1 ml larutan
ammonium ferry sulphate dan 0,9 ml HNO3 dimasukkan ke dalam
10 Isi tabung diaduk dengan cara menggoyangkan tabung tersebut. Tepat 15 menit setelah penambahan larutan ammonium thiosianat, larutan dalam tabung reaksi diukur absorbansinya dengan spektrofometer pada panjang gelombang 465 nm. Amil alkohol digunakan sebagai larutan blanko. Jumlah asam fitat dalam masing-masing larutan fitat dihitung dengan mengetahui berat molekul asam fitat (BM=660,08). Data kemudian digunakan untuk membuat kurva standar yang menunjukkan hubungan antara jumlah asam fitat dengan absorbansi asam fitat berdasarkan persamaan regresi linier: Y = a + bx; Y = absorbansi larutan asam fitat, x = jumlah asam fitat dalam tiap larutan asam fitat. Persamaaan yang diperoleh tersebut digunakan untuk menghitung jumlah asam fitat dalam bahan uji yang telah diukur absorbansinya pada tahap pengukuran absorbansi filtrat. b. Ekstrak dan Pengukuran Absorbansi Filtrat
Sebanyak 0,5 g bahan disuspensikan dalam 50 ml HNO3 0,5 M, sedangkan
untuk filtrat hasil inkubasi sebanyak 50 ml ditambahkan 1,7 ml HNO3 pekat dan
diaduk selama 3 jam di atas penggoyang elektrik pada suhu ruang, kemudian disaring dan kadar asam fitat dalam filtrat yang diperoleh selanjutnya dianalisis. Sebanyak 0,05 ml filtrat dimasukkan ke dalam tabung reaksi dan
ditambahkan 1,25 ml larutan HNO3 0,5 M serta 0,1 ml larutan ammonium ferry sulphate. Tabung reaksi ditutup dengan aluminium foil dan direndam dalam air mendidih selama 20 menit. Setelah didinginkan sampai mencapai suhu ruang, ditambahkan 5 ml amil alkohol dan 0,1 ml larutan ammonium thiosianat. Isi tabung diaduk dengann cara menggoyangkan tabung tersebut. Tepat 15 menit setelah penambhan larutan ammonium thiosianat, larutan dalam tabung reaksi diukur absorbansinya dengan spektrofotometer pada panjang gelombang 465 nm dengan larutan amil alkohol sebagai blanko. Kadar asam fitat dalam bahan (mg/g bahan kering) dihitung dengan cara membandingkan hasil yang diperoleh dengan kurva standar asam fitat.
Percobaan2:Uji kemampuan Fermentatif Isolat Bakteri In vitro
11 konsentrasi bakteri 108 cfu/ml, tabung dikocok dengan dialiri gas CO2 selama 30
detik. pH (6,5-6,9) dan kemudian ditutup dengan tutup karet, dan difermentasi selama 4 jam.
Setelah 4 jam, tutup karet tabung fermentor dibuka, diteteskan 2-3 tetes HgCl2
jenuh untuk membunuh bakteri mikroba. Tabung fermentor dimasukkan ke dalam sentrifuge, sentrifuge dilakukan dengan kecepatan 4.000 rpm selama 15 menit. Substrat akan terpisah menjadi endapan di bagian bawah dan supernatan yang bening berada di bagian atas.
Pengukuran Konsentrasi VFA (Steam Destilation Method). Supernatan yang berasal dari proses fermentasi diambil sebanyak 5 ml, kemudian dimasukan ke dalam tabung destilasi. Tabung destilasi dimasukkan dalam labu penyulingan yang berisi air mendidih (dipanaskan terus menerus). Erlenmeyer yang berisi 5 ml NaOH 0,5 N diletakkan dibawah selang tampungan. Satu ml H2SO4 15% ditambahkan ke tabung
destilasi yang sudah ada larutan sampel, kemudian penutup kaca segera ditutup, dibilas dengan akuades secukupnya. Uap air panas akan mendesak VFA dan akan terkondensasi dalam pendingin. Air yang terbentuk ditampung labu Erlenmeyer yang berisi 5 ml NaOH 0,5 N sampai mencapai 300 ml. Indikator PP (phenol pthalin) ditambah sebanyak 2–3 tetes dan dititrasi dengan HCl 0,5 N sampai warna titrat berubah dari merah menjadi merah muda. Konsentrasi HCl 0,5 N sebagai titrat telah distandarisasi sehingga didapat konsentrasi dengan 4 digit dibelakang koma.
Produksi VFA total dihitung dengan rumus :
(a-b) ml x N HCl x 1000/5 ml
Pengukuran konsentrasi NH3 (Conway Micro Difussion Method). Supernatan yang sama dengan analisa VFA diambil 1,0 ml kemudian ditempatkan pada salah satu ujung alur cawan Conway. Larutan Na2CO3 jenuh sebanyak 1,0 ml ditempatkan
12
campur). Larutan asam borat berindikator sebanyak 1,0 ml ditempatkan dalam cawan kecil yang terletak di tengah cawan Conway. Cawan Conway yang sudah diolesi vaselin ditutup rapat hingga kedap udara, larutan Na2CO3 dicampur dengan
supernatan hingga merata dengan cara menggoyang – goyangkan dan memiringkan cawan tersebut. Setelah itu dibiarkan selama 24 jam dalam suhu kamar. Setelah 24 jam suhu kamar tutup cawan dibuka, asam borat berindikator dititrasi dengan H2SO4
0,005 N sampai terjadi perubahan warna dari biru menjadi merah. Hasil titrasi dicatat. Perhitungan Kadar NH3 dihitung dengan rumus :
ml H2SO4 x N H2SO4 x 1000
N NH3 (mM) =
g sampel x BKsampel
Pengukuran Koefisien Cerna Bahan Kering (KCBK) dan Koefisien cerna Bahan Organik (KCBO) (Metode Tilley and Terry, 1963). Tabung fermentor yang telah diisi dengan 0,5 g sampel, ditambahkan 40 ml larutan McDougall. Tabung dimasukkan ke dalam shakerwater bath dengan suhu 39 oC, kemudian diisi cairan rumen steril sebanyak 5 ml dan isolat bakteri campuran 5 ml, tabung dikocok dengan dialiri CO2 selama 30 detik, pH dicek (6,5 – 6,9) dan kemudian ditutup dengan tutup
karet prote dan di fermentasi selama 48 jam. Setelah 48 jam tutup karet tabung fermentor dibuka dan diteteskan 2-3 tetes HgCl2 untuk membunuh bakteri mikroba.
13 Berikut rumus perhitungan KCBK dan KCBO :
BKsampel(g)-(BKresidu(g)-BKblanko(g))
%KCBK = x 100%
BKsampel
BOsampel(g)-(BOresidu(g)-BOblanko(g))
%KCBO = x 100% BOsampel
Keterangan : KCBK = Koefisien Cerna Bahan Kering (%), KCBK = Koefisien Cerna Bahan Organik (%), BK = Bahan Kering (g), BO = Bahan Organik (g)
Rancangan dan Analisis Data
Pada kajian yang pertama tujuh sampel pakan bahan percobaan difermentasi dengan inokulan konsorsium bakteri rumen pencerna serat dan dilakukan pengukuran peubah pada jam ke 3, 6 dan 12 jam. Peubah yang diamati yaitu kadar fitat pada pollard, legum dan rumput. Data yang diperoleh dianalisis secara deskriptif.
Kajian yang kedua digunakan enam sampel pakan masing-masing 3 rumput dan 3 legum sebagai percobaan yang difermentasi dengan inokulum isolat bakteri rumen pencerna serat. Peubah yang diamati yaitu VFA, NH3, KCBK, KCBO.
Analisis korelasi (Steel and Torrie, 2006) dilakukan untuk mengetahui hubungan antara degradasi asam fitat dengan kadar NH3 dan VFA filtrat hasil fermentasi bahan
14 HASIL DAN PEMBAHASAN
Degradasi Asam Fitat
Degradasi asam fitat merupakan proses pemecahan ikatan antara gugus mio-inositol dan gugus asam fosfat oleh enzim fitase yang dihasilkan mikroba dalam rumen (Bedford dan Partridge, 2001). Bahan pakan dengan kadar fitat tinggi umumnya berasal dari biji-bijian. Biji serealia mengandung fitat 1–2% BK, bahkan dapat mencapai 3-6% (Febles et al., 2002). Kadar asam fitat dalam bahan pakan legum dan rumput dalam kajian ini sangat bervariasi yaitu berkisar antara 1,91-3,72% BK. Secara umum data yang tersedia menunjukkan bahwa tanaman kelompok rumput mengandung fitat yang lebih tinggi dari kelompok legum. Namun perbedaan antar spesies juga terlihat cukup jelas. Jumlah asam fitat bervariasi tergantung pada varietas, kondisi iklim, lokasi, irigasi, tipe tanah dan keadaan lingkungan selama tanaman itu tumbuh (Reddy et al., 1982). Kadar fitat pada tanaman tergantung kadar fosfor dalam tanah, dan pemupukan tanaman dengan fosfat yang berlebih akan meningkatkan kadar asam fitat atau garam fitat (Maga, 1982).
Gambar 2 dan 3 menunjukkan kemampuan konsorsium bakteri rumen pencerna serat mampu mendegradasi asam fitat, protein dan mencerna bahan kering dan bahan organik. Hasil penelitian ini menunjukkan bahwa konsorsium bakteri rumen mampu mendegradasi antara 58,87% hingga 100% asam fitat rumput dan legum. Tingkat degradasi yang tinggi tersebut menggambarkan bahwa konsorsium bakteri rumen pencerna serat mampu mendegradasi asam fitat baik yang terkandung di dalam hasil ikutan industri pertanian (pollard), leguminosa maupun rumput. Namun perbedaan tingkat dengradasi menggambarkan bahwa karakteristik asam fitat dalam pollard, rumput dan legum berbeda-beda. Menurut Maenz (2001) proses degradasi asam fitat tergantung kepada total aktifitas fitase yang berasal dari tanaman, hewan atau sumber mikroba dan digabungkan dengan faktor lainnya seperti bentuk dan lokasi phytin dalam bagian tanaman dan kondisi reaksi fisik.
Asam fitat dapat didegradasi dalam cairan rumen lebih dari 9 jam (Rahmawati, 2005). Degradasi fitat sangat dipengaruhi oleh jenis sumbernya. Pada bahan pollard, Pennisetum purpureum, Setaria splendida dan Indigofera sp. kadar fitat masih cukup tinggi, namun pada Paspalum notatum, Calliandra sp. dan
15 jam. Morse et al. (1992) melaporkan bahwa enam konsentrat yang di inkubasi in vitro untuk menentukan tingkat berkurangnya fitat dari padatan dan cairan. Lebih dari 90% P terikat molekul fitat berkurang dari padatan antara 6 dan 8 jam inkubasi
in vitro (pollard, dedak padi, hominy, bungkil kedelai, biji-bijian kering) atau antara 12 dan 24 jam (bungkil biji kapas). Molekul yang mengandung P yang merupakan komponen fitat mampu dihidrolisis dalam waktu 12 jam, kecuali fosfor fitat bungkil biji kapas dapat dihidrolisis setelah 24 jam inkubasi.
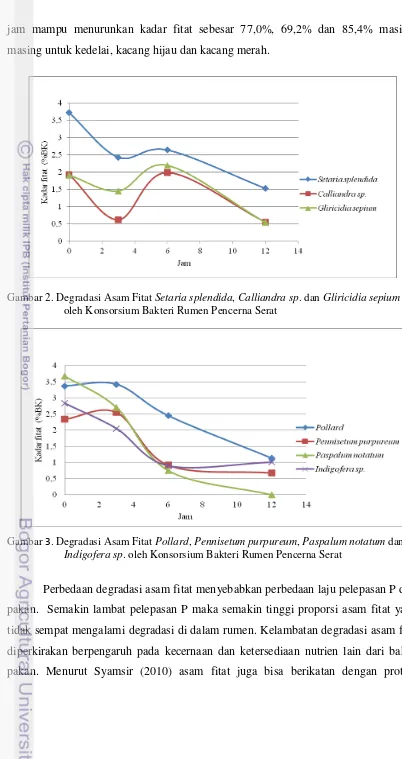
Aktivitas konsorsium bakteri rumen pencerna serat yang tergambarkan oleh degradasi asam fitat Gambar 2 yang diperkirakan sudah mencapai kemampuan degradasi fitat yang tinggi setelah inkubasi selama 12 jam. Inkubasi selama 3 jam dan 6 jam degradasi fitat masih sangat bervariasi antar jenis bahan pakan. Hal ini menggambarkan bahwa kemampuan konsorsium bakteri masih sangat tergantung kepada jenis pakan. Asam fitat dalam bahan pollard, Pennisetum purpureum, Setaria
splendida, Calliandra sp, dan Gliricidia sepium asam fitat pada jam ke 3 dan 6 masih
belum mengalami penurunan yang berarti, bahkan pada pollard dan Pennisetum
purpureum masih tetap seperti kadar semula. Terjadinya variasi degradasi asam fitat
antar waktu pada bahan yang sama, dapat disebabkan akibat pertumbuhan bakteri atau produksi fitase yang masih belum stabil pada awal inkubasi.
Gambar 2. menunjukkan bahwa kadar fitat pada jam ke 3, hijauan rumput
Setaria splendida, legum Calliandra sp. dan Gliricidia sepium namun jam ke-6 mengalami peningkatan. Hal ini dapat menggambarkan bahwa konsorsium bakteri rumen pencerna serat belum mampu menghasilkan fitase dan bekerja dengan baik sebelum masa inkubasi 12 jam dan golongan tanaman legum mengandung kadar protein tinggi serta mengandung tanin yang mampu mengikat asam fitat. Kadar asam fitat pada waktu inkubasi 3 jam menunjukkan bahwa asam fitat masih terikat dengan antinutrisi, sehingga setelah inkubasi 3 jam asam fitat terlepas dan didegradasi oleh bakteri rumen.
16 jam mampu menurunkan kadar fitat sebesar 77,0%, 69,2% dan 85,4% masing-masing untuk kedelai, kacang hijau dan kacang merah.
Gambar 2. Degradasi Asam Fitat Setaria splendida, Calliandra sp. dan Gliricidia sepium oleh Konsorsium Bakteri Rumen Pencerna Serat
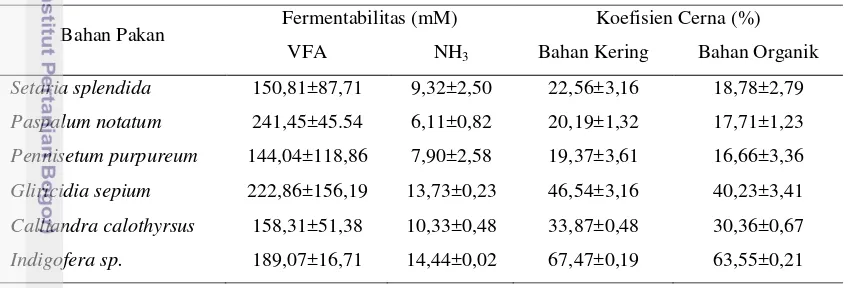
Gambar 3. Degradasi Asam Fitat Pollard, Pennisetum purpureum, Paspalum notatum dan
Indigofera sp. oleh Konsorsium Bakteri Rumen Pencerna Serat
17 sehingga menurunkan nilai cerna protein bahan pakan. Menurut Oatway et al. (2001) asam fitat juga mengikat karbohidrat sehingga memberikan efek merugikan bagi ternak.
Gambar 3. menunjukkan bahwa kadar fitat pada pollard inkubasi 3 jam belum mengalami penurunan, hal ini diperkirakan disebabkan oleh tingginya pati karbohidrat yang dapat terikat dengan asam fitat, sehingga asam fitat belum mampu terdegradasi. Asam fitat rumput Pennisetum purpureum dan Paspalum notatum pada inkubasi 3 jam sudah mampu didegradasi oleh konsorsium bakteri rumen pencerna serat, karena hijauan rumput yang memiliki kadar nutrisi rendah dan tidak mengandung antinutrisi, sedangkan Indigofera sp. termasuk tanaman legum yang mengandung kadar protein tinggi dan mengandung tanin. Hal ini menunjukkan bahwa tanin yang mudah dihidrolisis tidak mempunyai ikatan yang kuat untuk mengikat asam fitat. Konsorsium bakteri rumen pencerna serat lebih mudah mendegradasi asam fitat yang berikatan dengan protein daripada karbohidrat.
Kecernaan protein dapat dipengaruhi oleh degradasi asam fitat. Fitat mampu mengikat molekul protein dan menurunkan kecernaannya. Karakter dari asam fitat dalam hijauan kemungkinan dapat dimanfaatkan untuk melindungi protein yang mudah mengalami degradasi. Setaria splendida dan pollard mempunyai molekul asam fitat yang tahan degradasi hingga 12 jam, sedangkan Calliandra sp. dan
Gliricidia sepium mempunyai molekul fitat yang mampu bertahan hingga 6 jam. Degradasi akan sangat tinggi jika telah mencapai fermentasi 12 jam. Kemampuan daya ikat asam fitat terhadap protein memungkinkan asam fitat tersebut dapat melindungi protein yang mudah didegradasi dari aktifitas enzim asal mikroba rumen. Kondisi tersebut memungkinkan penggunaan komponen asam fitat pakan sebagai pelindung protein yang mudah didegradasi.
18 bervalensi dua bagi bakteri rumen dalam selang waktu tersebut terutama pada awal fermentasi.
Fermentabilitas In Vitro Bahan Pakan Hijauan yang Mengandung Asam Fitat
Total VFA
Total VFA dan NH3 yang dihasilkan dari proses fermentasi oleh mokroba
rumen menggambarkan tingkat fermentabilitas komponen karbohidrat dan protein atau nitrogen bukan protein suatu bahan pakan yang dikaji. Tabel 1. dicantumkan total VFA yang diproduksi selama 4 jam inkubasi dari bahan pakan hijauan yang mengandung asam fitat.
Tabel 1. Fermentabilitas dan Koefisien Cerna In Vitro Bahan Pakan Hijauan yang Mengandung Asam Fitat
Bahan Pakan Fermentabilitas (mM) Koefisien Cerna (%) VFA NH3 Bahan Kering Bahan Organik
Setaria splendida 150,81±87,71 9,32±2,50 22,56±3,16 18,78±2,79
Paspalum notatum 241,45±45.54 6,11±0,82 20,19±1,32 17,71±1,23
Pennisetum purpureum 144,04±118,86 7,90±2,58 19,37±3,61 16,66±3,36
Gliricidia sepium 222,86±156,19 13,73±0,23 46,54±3,16 40,23±3,41
Calliandra calothyrsus 158,31±51,38 10,33±0,48 33,87±0,48 30,36±0,67
Indigofera sp. 189,07±16,71 14,44±0,02 67,47±0,19 63,55±0,21
Sumber energi (VFA) yang dihasilkan ini merupakan produk akhir dari proses fermentasi bahan pakan dalam rumen yang terdiri dari asam utama berupa asetat, propionat, butirat, isobutirat, valerat dan isovalerat. VFA menyediakan sebesar 50-70% dari energi yang dibutuhkan oleh ternak itu sendiri atau induk semang (Damron, 2003).
19 fermentabilitas yang tinggi. Nilai VFA dari bahan yang dikaji menghasilkan kadar VFA yang tinggi. Hal ini berarti bahwa bahan yang dikaji mempunyai fermentabilitas yang tinggi, namun cukup bervariasi. Masing-masing hasil total VFA pada sampel Paspalum notatum sebesar 241,45 mM merupakan total VFA tertinggi, sedangkan Pennisetum purpureum menghasilkan VFA terendah.
Kandungan VFA merupakan hasil aktivitas bakteri pada waktu melakukan fermentasi di dalam rumen, sehingga jika bakteri semakin banyak akan menghasilkan VFA yang semakin banyak pula. Paspalum notatum memiliki konsentrasi VFA yang lebih tinggi jika dibandingkan dengan sampel yang lain, sedangkan Setaria splendida
dan Pennisetum purpureum menghasilkan VFA terendah (144,04 mM), hal ini dapat terjadi karena tingginya kualitas rumput tersebut yang dapat tercermin dari kandungan (Neutral Detergent Fiber) NDF, serat kasar (SK) rendah atau kandungan lignin yang rendah. Sampel hijauan menunjukkan bahwa pakan mudah difermentasi dan konsorsium bakteri rumen mampu memfermentasi komponen karbohidrat baik hijauan legum maupun rumput. Isolat bakteri mampu menghasilkan VFA yang sangat tinggi pada Paspalum notatum sehingga pada kondisi konsentrasi tinggi tersebut menggambarkan bahwa terjadi ketidak seimbangan produksi dan penggunaan VFA oleh isolat bakteri tersebut.
Kadar Ammonia (NH3)
Kadar ammonia (NH3) supernatan merupakan salah satu indikator tingkat
degradasi protein pakan dalam rumen. Ammonia digunakan mikroba untuk membentuk protein mikroba tersebut. Kadar amonia dalam cairan rumen merupakan petunjuk adanya proses degradasi protein di dalam rumen dan proses sintesis protein oleh mikroba rumen. Protein yang masuk ke dalam rumen, sebagian akan mengalami perombakan oleh enzim proteolitik mikroba rumen (Fathul dan Wajizah, 2010). Nilai konsentrasi NH3 bahan pakan hijauan dalam penelitian ini berkisar antara 6,11-14,44
mM (Tabel 1). Masing-masing hasil total NH3 pada sampel Indigofera sp. sebesar
14,44 mM merupakan total NH3 tertinggi, sedangkan Paspalum notatum
menghasilkan NH3 terendah dengan hasil 6,11 mM. Konsentrasi NH3 optimum untuk
pertumbuhan mikroba rumen berkisar antara 6-21 mM (McDonald et al., 2002). Konsentrasi NH3 mencerminkan tingkat fermentabilitas protein di dalam rumen.
20 sehingga dapat meningkatkan perombakan protein menjadi asam amino dan amonia (NH3).
Koefisien Cerna In Vitro Bahan Pakan Hijauan yang Mengandung Asam Fitat
Koefisien Cerna Bahan Kering (KCBK)
Koefisien cerna menunjukkan derajat cerna pakan pada alat-alat pencernaan serta seberapa besar sumbangan suatu pakan bagi ternak (McDonald et al., 2002). Kecernaan bahan kering dapat dijadikan sebagai salah satu indikator untuk menentukan kualitas pakan. Hasil koefisien cerna in vitro bahan kering (KCBK)dari semua bahan pakan hijauan dicantumkan pada Tabel 1. Koefisien cerna bahan kering dari penelitian ini berkisar antara 20,19-67,47%. KCBK golongan rumput lebih rendah daripada KCBK golongan leguminosa. Di golongan rumput KCBK tertinggi dicapai oleh Setaria splendida sebesar 22,56%, sedangkan pada golongan leguminosa dicapai oleh Indigofera sp. sebesar 67,47%. Nilai KCBK semua jenis hijauan dalam penelitian ini menunjukkan hasil yang lebih rendah dari kualitas yang baik kecuali Indigofera sp.Hal ini menunjukkan bahwa Indigofera sp. mengandung komponen bahan kering yang mudah dicerna. Indigofera sp. mengandung protein tinggi dan diperkirakan protein yang dikandungnya mudah terdegradasi dan menyediakan NH3 yang dibutuhkan oleh mikroba rumen.
Koefisien Cerna Bahan Organik (KCBO)
Tabel 1. terlihat bahwa koefisien cerna bahan organik berkisar antara 16,66-63,55%. KCBO golongan rumput lebih rendah daripada KCBO golongan leguminosa. Di golongan rumput KCBO tertinggi dicapai oleh Setaria splendida
sebesar 18,78%, sedangkan pada golongan leguminosa dicapai oleh Indigofera sp. sebesar 63,55%. Koefisien cerna bahan organik legum Gliricidia sepium (40,23%) merupakan kecernaan pakan terbaik ke-2 setelah Indigofera sp. (63,55%), menyusul
Calliandra calothyrsus (30,36%), Setaria splendida (18,78%), Paspalum notatum
21 dengan tingginya KCBK. Hal ini menunjukkan bahwa komponen bahan organik legum tersebut mudah dicerna dan menyediakan nutrien untuk pertumbuhan mikroba dalam rumen. Pennisetum purpureum mempunyai nilai kecernaan terendah diantara ke-5 pakan lainnya. Hal ini mungkin disebabkan oleh komponen-komponen yang sukar dicerna seperti ADF, selulosa, dan lignin. Lignin diketahui sebagai pembatas kecernaan serat, sehingga lignin tidak dapat dicerna oleh ruminan atau mikroba, dan penghambat pencernaan hemiselulosa (Cherney dan Cherney, 2005).
Korelasi Penurunan Kadar Asam Fitat dengan Kadar VFA, NH3, dan Kecernaan
Korelasi penurunan asam fitat dengan kadar VFA, NH3 dan Kecernaan
disajikan dalam Tabel2.
Tabel 2. Korelasi antara Penurunan Kadar Fitat pada 12 jam Pertama Fermentasi dengan kadar VFA, NH3 dan Kecernaan oleh Konsorsium Bakteri Rumen Pencerna
Serat.
Tidak terdapat korelasi antara penurunan kadar asam fitat dengan kadar VFA, NH3 dan kecernaan bahan kering serta bahan organik (Tabel 2). Asam fitat
23 KESIMPULAN DAN SARAN
Kesimpulan
Konsorsium bakteri rumen pencerna serat mampu mendegradasi asam fitat dalam berbagai bahan pakan baik hasil samping industri, rumput maupun leguminosa. Tingkat degradasi dipengaruhi oleh jenis bahan tanaman dan lama fermentasi. Tidak terdapat korelasi antara penurunan kadar asam fitat dengan kadar VFA, NH3 dan kecernaan in vitro.
Saran
24 UCAPAN TERIMA KASIH
Alhamdulillaahirabbil ‘aalamiin. Puji dan syukur ke hadirat Allah SWT atas segala limpahan nikmat, kasih sayang, dan pertolongan-Nya sehingga penulis dapat menyelesaikan skripsi ini.
Penulis mengucapkan terima kasih kepada Prof. Dr. Ir. Toto Toharmat, M.Agr.Sc. dan Dr. Ir. Dwierra E. A., MS.M.Sc. selaku pembimbing akademik dan pembimbing skripsi atas bimbingan, motivasi, kesabaran dan pelajaran hidup yang diberikan serta sehingga penulis dapat menyelesaikan penulisan skripsi ini. Terima kasih penulis ucapkan kepada Dr. Ir. Didid Diapari, M.Si selaku dosen pembahas seminar dan dosen penguji sidang Ir. Anita Sardiana Tjakradidjaja, M.Rur.Sc dan Tuti Suryati, S.Pt, M.Si. yang telah banyak memberi saran dan masukan kepada penulis.
Ucapan terima kasih yang teramat besar kepada keluarga tercinta Bapak Giyoto dan Ibu Parwiyati beserta kedua kakak perempuan Utami Sulistyowati dan Meyla Nurwitasari atas segala kasih sayang, dukungan, motivasi, dan doa yang diberikan selama ini.
Ucapan terima kasih juga penulis sampaikan kepada Dr. Iwan Prihantoro, S.Pt, M.Si Ibu Dian A. dan Ibu Adriani atas bantuannya selama di Laboratorium. Yulfita Sari S.Pt dan Lilis Riyanti S.Pt selaku teman satu bimbingan satu perjuangan.
Terakhir penulis mengucapkan terima kasih kepada teman-teman INTP 44 tidak dapat disebutkan satu persatu. Terima kasih penulis ucapkan kepada semua pihak atas bantuan selama tugas akhir. Semoga Allah selalu membalas amal baiknya dan penulis berharap semoga skripsi ini bermanfaat bagi pembaca. Amin.
Bogor, Maret 2013
25 DAFTAR PUSTAKA
Bedford, M. R. & G. G. Patridge. 2001. Enzymes in Farm Animal Nutrition. CAB International, Wallingford.
Cherney, D. J. R & J. H. Cherney. 2005. Forages: Grasses. In : W.G. Pond & A.W. Bell. Encyclopedia of Animal Science. Marcel Dekker, Inc., New York. Cherney, D. J. R & J. H. Cherney. 2005. Forages: Legumes. In : W.G. Pond & A.W.
Bell. Encyclopedia of Animal Science. Marcel Dekker, Inc., New York. Davies N. T. & H Reid. 1979. An evaluation of phytate, zinc, copper, iron and
manganese contents of, and Zn avaiability from, soy-based tevured-vegetable-protein meat-subtitutes or meat-extenders. British J. Nutr. 41:579-589.
Damron, W. S. 2003. Introduction to Animal Science Global, Biological, Social, and Industry Perspective 2nd. Pearson Education, Inc., New Jersey.
El Hag, M. E., A. H El Tinay & N. E Yousif. 2002. Effect of fermentation and dehulling on starch, total polyphenols, phytic acid content and in vitro protein digestibility of pearl millet. Food Chem. 77: 193–196.
Fathul, F., & S. Wajizah. 2010. Penambahan mikromineral Mn dan Cu dalam ransum terhadap aktivitas biofermentasi rumen domba secara in vitro. JITV 15 (1) T : 9-15.
Febles, C. I., A. Arias, A. Hardisson, C. Rodriguez-Aluez & Sierra. 2002. Phytic acids in level in wheat flour. J. Cereal Sci. 36 : 19 – 23.
France, J. & J. Dijkstra. 2005. Volatile Fatty Acid Production. In : J. Dijkstra, J.M. Forbes & J. France. Quantitative Aspects of Ruminant Digestion and Metabolism 2nd. CABI Publishing, Wallingford.
Fredlund, K., M. Isaksson, L. R. Hulthén, A. Almgren, A.S. Sandberg. 2006. Absorption of zinc and retention of calcium: Dose-dependent inhibition by phytate. Journal of Trace Elements in Medicine and Biology, 20 (1) : 49-57.
Greiner, R. & U. Konietzny. 2006. Phytase for Food Application. Food Technol. Biotechnol. 44 (2) : 125–140.
Harland, B.F. & E.R. Morris. 1995. Phytate: A good or a bad food component?. Nutrition Research, 15 (5) : 733-754.
Loren, K. 2005. Phytic Acid for Chelating. http//www.chelation theraphy online.com.Articles/p220.htm. [16 Februari 2012]
Maenz, D. D. 2001. Enzymatic Characteristics of Phytases as they Relate to Their Use in Animal Feeds. In : M.R. Bedford, G.G. Partridge. Enzymes In Farm Animal Nutrition. CABI Publishing, Wallingford.
26 McDonald, P., R. A. Edwards, J. F. D. Greenhalgh, & C. A. Morgan. 2002. Animal
Nutrition. 6th Ed. Pretice all, London.
Mohamed, R. K., E. A. Abou- Arab, A. Y. Gibriel, N. M. H. Rasmy & F. M. Abu-Dairy Cows. Journal of Abu-Dairy Science, 75 (7) : 1979-1986.
Haros, M., Rosell C. M. & Benedito C. 2001. Use of fungal phytase to improve breadmaking performance of whole wheat bread. J. Agric. Food Chem. 49 (11) : 5450-4.
Oatway, L, Vasanthan T & Helm JH. 2001. Phytic Acid. In Food Reviews International, 17 (4) : 419-431.
Park, W.Y., T. Matsui & H. Yano. 2002. Post-ruminal phytate degradation in sheep. Animal Feed Science and Technology,7 : 55–60.
Rahmawati, A. 2005. Kadar fitat fraksi dedak padi dan efektivitas asam asetat sebagai pelarut dalam ekstrak fitat. Skripsi. Fakultas Peternakan, Institut Pertanian Bogor, Bogor.
Reddy, N. R, S. K. Shate & D. K. Salunkhe. 1982. Pytates in Legumes and Cereals. Advance in Food Research, 28 : 1 – 92.
Schlegel, H. G. 1994. Mikrobiologi Umum. Ed. Keenam. Terjemahan: Baskoro, R. M. T. dan J. R. Wattimena. Gadjah Mada University Press, Yogyakarta.
Steel, R. G. D. & J. H. Torrie. 2006. Prinsip dan Prosedur Statistika (terjemahan) cetakan ke-4 PT. Gramedia Pustaka Utama, Jakarta. Hal 289-300.
Syamsir, E. 2010. Asam Fitat. http://id.shvoong.com/medicine-and-health/1971060-asam-fitat/#ixzz1uU2M2qLQ. [10 Mei 2012].
Tilley, J.M.A., Terry R. A. 1963. A two stage technique for the in vitro digestion of forage crops. J. British. Grass. Soc.,18 : 104-111.