EVALUASI DA
(L.) Merr.) YAN
DENGAN C
RA
DEPARTEM
IN
DAYA SIMPAN BENIH KEDELAI (G
NG DIBERI PERLAKUAN PELAPISA
N CENDAWAN MIKORIZA ARBUSKU
ADEN ENEN RINDI MANGGUNG
A24070026
TEMEN AGRONOMI DAN HORTIKULTU
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2012
Glycine max
ISAN BENIH
SKULA
Perlakuan Pelapisan Benih dengan Cendawan Mikoriza Arbuskula
Evaluation of Soybean Seed (Glycine max (L.) Merr.) Storability Coated with
Arbuscular Mycorrhizal Fungi
ABSTRACT
The aim of this study was to evaluate the effect of seed coating treatment with arbuscular mychorrhizal fungi (AMF) on viability and vigor of soybean seed and viability of AMF after being stored in ambient (27-290C) or air-conditioned (17-180C) rooms. This study consisted of two experiments conducted at different storage rooms i.e. ambient or air-conditioned rooms during the same period of time from May through December 2011. Both experiments were done using randomized complete block design with two factors. The first factor was seed coating consisted of untreated control and seed coating using AMF while the second factor was storage period i.e. 0, 1, 2, 3, 4, 5, and 6 months. Results of experiments showed that soybean seeds still had viability > 88% after 2 months stored in ambient room or > 85% after 4 months stored air-conditioned room. Untreated seeds indicated higher vigor (higher speed of germination, vigor index, uniformity of germination, and lower T50) than coated seeds in both experiments. Seeds coated with AMF showed the rate of increase in moisture content slower than the untreated ones during 6 months storage in ambient room. After 6 months storage in air-conditioned room, the coated seeds had lower moisture content than the untreated. Seed coated with AMF still had seeds viability and AMF during 6 month storage in both experiments.
RINGKASAN
RADEN ENEN RINDI MANGGUNG. Evaluasi Daya Simpan Benih Kedelai
(Glycine Max (L.) Merr.) yang diberi Perlakuan Pelapisan Benih dengan
Cendawan Mikoriza Arbuskula. (Dibimbing oleh SATRIYAS ILYAS dan
YENNI BAKHTIAR).
Penelitian ini bertujuan untuk mengevaluasi pengaruh perlakuan pelapisan benih (seed coating) dengan cendawan mikoriza arbuskula (CMA) terhadap viabilitas dan vigor benih kedelai, serta viabilitas CMA setelah mengalami penyimpanan pada suhu kamar dan suhu AC. Penelitian ini dilaksanakan pada bulan Mei hingga Desember 2011 di Laboratorium Agromikrobiologi Balai Pengkajian Bioteknologi, BPPT PUSPIPTEK, Serpong, Tangerang, Laboratorium Ilmu dan Teknologi Benih, dan Rumah Kaca Kebun Percobaan Cikabayan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB.
Penelitian ini terdiri atas dua percobaan suhu ruang simpan yang berbeda yaitu suhu kamar (27-29°C) dan suhu AC (17-18°C). Kedua percobaan menggunakan metode Rancangan Kelompok Lengkap Teracak (RKLT) yang terdiri atas dua faktor, yaitu faktor pertama adalah perlakuan pelapisan benih (P) terdiri atas dua taraf yaitu, tanpa pelapisan (kontrol) dan pelapisan benih dengan CMA (Khodijah, 2009), sedangkan faktor kedua adalah periode simpan (T) terdiri atas tujuh taraf yaitu, 0, 1, 2, 3, 4, 5, dan 6 bulan. Bahan pelapis yang digunakan pada pelapisan benih dengan CMA berupa gambut dan gipsum dengan perbandingan 50 : 50, sedangkan bahan perekat yang digunakan berupa tapioka 5 % (b/v). Proses pelapisan dilakukan dengan menggunakan modifikasi drum granulator. Benih yang telah dilapisi dikering-anginkan selama 7 hari, kemudian dikemas menggunakan plastik Polypropylene (PP) dengan ketebalan 0.8 mm dan disimpan pada masing-masing suhu ruang simpan (kamar dan AC).
menurun hingga daya berkecambah benih menjadi 50.6% pada periode simpan 6 bulan. Perlakuan kontrol menunjukkan vigor benih yang lebih baik pada tolok ukur KCT, IV, KST danT50 baik yang disimpan pada suhu kamar maupun AC. Laju
EVALUASI DAYA SIMPAN BENIH KEDELAI (Glycine max
(L.) Merr.) YANG DIBERI PERLAKUAN PELAPISAN BENIH
DENGAN CENDAWAN MIKORIZA ARBUSKULA
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
RADEN ENEN RINDI MANGGUNG
A24070026
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul : EVALUASI DAYA SIMPAN BENIH KEDELAI (Glycine max (L.) Merr.) YANG DIBERI PERLAKUAN PELAPISAN BENIH
DENGAN CENDAWAN MIKORIZA ARBUSKULA
Nama : RADEN ENEN RINDI MANGGUNG
NIM : A24070026
Menyetujui, Dosen Pembimbing
Pembimbing I, Pembimbing II,
Prof. Dr. Ir. Satriyas Ilyas M.S. Dr. Yenni Bakhtiar, M.Ag.Sc.
NIP 19590225 198203 2 001 NIP 19660826 199203 2 001
Mengetahui.
Ketua Departemen Agronomi dan Hortikultura
Dr. Ir. Agus Purwito, M.Sc.Agr
NIP 19611101 198703 1 003
RIWAYAT HIDUP
Penulis adalah anak kesepuluh dari tiga belas bersaudara pasangan Bapak Raden Ipin Rosadi Manggung dan Ibu Rosa Ratnaningsih yang dilahirkan di Kota Bogor, Jawa Barat pada tanggal 29 November 1988. Penulis menempuh jenjang Pendidikan dasar di SD Negeri Ciheleut 1, Kota Bogor pada tahun 2000. Pada tahun 2004 penulis berhasil menyelesaikan pendidikan lanjutan tingkat pertama di SLTP Negeri 3 Kota Bogor, Jawa Barat. Penulis menyelesaikan pendidikan menengah umum di SMA Negeri 3 Kota Bogor, Jawa Barat pada tahun 2007. Pada tahun yang sama, penulis diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur USMI dan tercatat sebagai mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB.
KATA PENGANTAR
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT yang telah memberikan hidayah dan karunia sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi yang berjudul “Evaluasi Daya Simpan Benih Kedelai (Glycine Max (L.) Merr.) yang Diberi Perlakuan Pelapisan Benih dengan Cendawan Mikoriza Arbuskula” dibuat sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada semua pihak yang telah membantu dalam pelaksanaan penelitian dan penyusunan skripsi ini. Ucapan terima kasih penulis sampaikan kepada :
1. Prof. Dr. Ir. Satriyas Ilyas, MS. sebagai Dosen Pembimbing I sekaligus pembimbing akademik yang telah membimbing penulis selama studi di IPB dan memberi pengarahan kepada penulis dengan penuh kesabaran dan kearifan selama masa pelaksanaan penelitian dan penyusunan skripsi ini. 2. Dr. Yenni Bakhtiar, M.Ag.Sc. sebagai Dosen Pembimbing II yang telah
memberikan bimbingan dan pengarahan kepada penulis dengan penuh kesabaran dan kearifan selama masa pelaksanaan penelitian dan penyusunan skripsi ini.
3. Dr. Ir. Faiza C. Suwarno, M.S. yang telah bersedia menjadi penguji, terima kasih atas saran dan masukan yang diberikan.
4. Para personil Laboratorium Agromikrobiologi Balai Pengkajian Bioteknologi BPPT Serpong Tangerang, Pak Wahid, Pak Firman, Pak Asep, Pak Mahmud, Mba Nia, Pak Iman, Mba Tina, terima kasih atas fasilitas dan bantuan yang diberikan selama pelaksanaan penelitian.
5. Bapak, Ibu, adik, kakak dan seluruh keluarga atas doa, dukungan, cinta, dan kasih sayang yang tulus diberikan kepada penulis.
7. Teman-teman seperjuangan (Kupil, Cutrisni, Neneng, Lilis, Feni, Enjim, Sofi, Pitri, Okti, Prama, Irfan, Tikul, Ita, Mba Sulis dan anak-anak benih) yang selalu memberikan semangat dan motivasi.
8. Teman-teman AGH 44 atas segala doa, semangat, dukungan dan kebersamaan.
9. M. Nazhri Annas J. atas segala doa, dukungan, motivasi, pengertian, dan kesabarannya selama ini.
10. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini yang tidak dapat penulis sebutkan satu persatu.
Semoga hasil penelitian ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Januari 2012
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Hipotesis ... 3
TINJAUAN PUSTAKA ... 4
Botani Tanaman Kedelai ... 4
Cendawan Mikoriza Arbuskula ... 5
Peranan Cendawan Mikoriza Arbuskula ... 6
Pelapisan Benih (Seed Coating) ... 8
Daya Simpan Benih ... 9
BAHAN DAN METODE ... 11
Waktu dan Tempat ... 11
Bahan dan Alat ... 11
Metode Percobaan ... 12
Pelaksanaan Percobaan ... 14
Pengamatan ... 16
HASIL DAN PEMBAHASAN ... 20
A. Kondisi Simpan pada Suhu Kamar ... 20
B. Kondisi Simpan pada Suhu AC ... 28
Kesimpulan ... 36
Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Nomor Halaman 1. Rekapitulasi Hasil Analisis Ragam Pengaruh Pelapisan Benih,
Periode Simpan, dan Interaksinya terhadap Tolok Ukur Kadar Air,
Viabilitas, dan Vigor Benih Kedelai pada Suhu Kamar……… 20 2. Pengaruh Pelapisan Benih dan Periode Simpan terhadap Kadar Air
Benih Kedelai (%) pada Suhu Kamar……… 21 3. Pengaruh Pelapisan Benih dan Periode Simpan terhadap Daya
Berkecambah Benih Kedelai (%) pada Suhu Kamar………. 21 4. Persentase Jumlah Benih yang Bercendawan pada Suhu Kamar…..
24 5. Pengaruh Interaksi Pelapisan Benih dan Periode Simpan terhadap
Kecepatan Tumbuh Benih Kedelai (%/etmal) pada Suhu
Kamar………. 24
6. Pengaruh Pelapisan Benih dan Periode Simpan terhadap Indeks
Vigor Benih Kedelai (%) pada Suhu Kamar………. 25 7. Pengaruh Pelapisan Benih dan Periode Simpan terhadap
Keserempakan Tumbuh Benih Kedelai (%) pada Suhu Kamar... 26 8. Pengaruh Interaksi Pelapisan Benih dan Periode Simpan terhadap
T50 Benih Kedelai (hari) pada Suhu Kamar………... 26
9. Pengaruh Periode Simpan pada Suhu Kamar terhadap Persentase
Perkecambahan Spora CMA ………. 27 10. Rekapitulasi Hasil Analisis Ragam Pengaruh Pelapisan Benih,
Periode Simpan, dan Interaksinya terhadap Tolok Ukur Kadar Air,
Viabilitas, dan Vigor Benih Kedelai pada Suhu AC………... 28 11. Pengaruh Interaksi Pelapisan Benih dan Periode Simpan terhadap
Kadar Air Benih Kedelai (%) pada Suhu AC……… 29 12. Pengaruh Pelapisan Benih dan Periode Simpan terhadap Daya
Berkecambah Benih Kedelai (%) pada Suhu AC………... 30 13. Persentase Jumlah Benih yang Bercendawan pada Suhu AC……… 31 14. Pengaruh Pelapisan Benih dan Periode Simpan terhadap
15. Pengaruh Pelapisan Benih dan Periode Simpan terhadap Indeks
Vigor Benih Kedelai (%) pada Suhu AC………... 32 16. Pengaruh Pelapisan Benih dan Periode Simpan terhadap
Keserempakan Tumbuh Benih Kedelai (%) pada Suhu AC………. 33 17. Pengaruh Interaksi Pelapisan Benih dan Periode Simpan terhadap
T50 Benih Kedelai (hari) pada Suhu AC……… 33
18. Pengaruh Periode Simpan pada Suhu AC terhadap Persentase
DAFTAR GAMBAR
Nomor Halaman 1. Penampang Membujur Akar Terinfeksi CMA ………. 5 2. Modifikasi Drum Granulator Mini……… 12 3. Bagan Alir Penelitian……… 13 4. Benih Kedelai (A) Tanpa Pelapisan (Kontrol) dan (B) Pelapisan
dengan CMA ……… 15
5. Kemasan Simpan Benih yang Digunakan pada Penelitian………... 16 6. Cendawan (A) Aspergillus niger dan (B) Fusarium sp. di bawah
Mikroskop Cahaya Pembesaran 40 x 10………... 22 7. Benih Kedelai Terinfeksi (A) Aspergillusniger dan (B) Fusarium
DAFTAR LAMPIRAN
Nomor Halaman 1. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Kadar Air Benih Kedelai pada Suhu Kamar……….. 44 2. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Daya Berkecambah Benih Kedelai pada Suhu Kamar…... 44 3. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Kecepatan Tumbuh Benih Kedelai pada Suhu Kamar…... 44 4. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Indeks Vigor Benih Kedelai pada Suhu Kamar…... 45 5. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Keserempakan Tumbuh Benih Kedelai pada Suhu
Kamar……… 45
6. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap T50 Benih Kedelai pada Suhu Kamar…... 45
7. Sidik Ragam Pengaruh Periode Simpan pada Suhu Kamar
terhadap Persentase Perkecambahan Spora CMA……… 46 8. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Kadar Air Benih Kedelai pada Suhu AC…..………... 46 9. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Daya Berkecambah Benih Kedelai pada Suhu AC…... 46 10. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Kecepatan Tumbuh Benih Kedelai pada Suhu AC……… 47 11. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Indeks Vigor Benih Kedelai pada Suhu AC………... 47 12. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap Keserempakan Tumbuh Benih Kedelai pada Suhu AC…. 47 13. Sidik Ragam Pengaruh Pelapisan Benih dan Periode Simpan
terhadap T50 Benih Kedelai pada Suhu AC……….. 48
14. Sidik Ragam Pengaruh Periode Simpan pada Suhu AC terhadap
PENDAHULUAN
Latar Belakang
Kedelai merupakan salah satu bahan pangan yang banyak dikonsumsi dan permintaannya sangat tinggi di Indonesia. Pada tahun 2010 produksi kedelai di Indonesia mencapai 908 111 ton yang menurun sebesar 64 839 ton dari tahun sebelumnya, sedangkan kebutuhan kedelai sebesar 2.4 juta ton. Saat ini rata-rata produktivitas kedelai nasional baru mencapai 1.37 ton per ha (BPS, 2011). Dalam dekade terakhir, luas panen, dan produksi kedelai terus menurun tajam, lebih dari 50%, sedangkan produktivitas meningkat hanya sekitar 3% per tahun (Budiarti dan Hadi, 2005). Penyebab rendahnya produksi kedelai di Indonesia adalah berkurangnya luas areal panen, gagalnya panen karena iklim yang tidak cocok untuk pertumbuhan, gangguan hama dan penyakit tanaman, belum dikuasainya teknologi produksi oleh petani dan sarana produksi yang mahal (Faisal, 2005). Salah satu upaya untuk meningkatkan produksi kedelai dengan penggunaan benih yang bermutu dan bersertifikat.
Salah satu faktor penghambat dalam produksi kedelai adalah ketersediaan benih bermutu. Pengadaan benih bermutu untuk musim tanam berikutnya mengharuskan dilakukannya penyimpanan benih. Benih kedelai cepat sekali mengalami deteriorasi atau penurunan viabilitas dan vigor, terutama bila disimpan pada kondisi simpan yang kurang optimum. Pakar teknologi benih terus berupaya menemukan metode untuk meningkatkan viabilitas dan vigor benih yang telah mundur dengan teknik yang disebut invigorasi. Teknik invigorasi benih kedelai memberikan manfaat perbaikan viabilitas dan vigor benih yang mengalami kemunduran pada saat penyimpanan. Selama proses invigorasi, terjadi peningkatan kecepatan dan keserempakan perkecambahan serta mengurangi tekanan lingkungan yang kurang menguntungkan (Ilyas, 2010). Pelapisan benih (seed coating) merupakan salah satu teknik invigorasi yang telah banyak diterapkan di negara-negara maju (Ilyas et al., 2003).
sintesis (Goenadi et al., 1995). Menurut Menge (1984) adanya simbiosis mutualistik antara cendawan mikoriza arbuskula (CMA) dengan perakaran tanaman sangat bermanfaat bagi tanaman terutama dalam meningkatkan penyerapan unsur hara fosfor (P), nitrogen (N), kalium (K) dan hara mikro seperti seng (Zn), molybdenum (Mo), dan tembaga (Cu). Di samping itu CMA juga dapat meningkatkan ketahanan tanaman terhadap kekeringan dan serangan patogen akar, serta memperbaiki status hara tanah. Zuhri dan Puspita (2008) menyatakan bahwa pemberian CMA dengan dosis 40 g/tanaman pada tanah podsolik merah kuning dapat meningkatkan pertumbuhan dan produksi kedelai.
Berbagai teknik aplikasi inokulan mikroba telah banyak dilakukan dengan mencampur benih dan tanah bekas tanaman kedelai atau mencampurkan benih dengan inokulan yang tersedia di pasaran pada lubang tanam (Faisal, 2005). Namun cara tersebut dinilai kurang efisien, dalam hal waktu, tenaga dan biaya. Salah satu alternatif yang digunakan adalah pelapisan benih yang memanfaatkan bahan perekat dan bahan pelapis benih sebagai agens pembawa inokulum spora CMA. Menurut Khodijah (2009) kombinasi bahan perekat tapioka 5 % dan bahan pelapis gambut:gipsum (50:50) dengan CMA menghasilkan tinggi tanaman 3 minggu setelah tanam, jumlah dan bobot kering bintil akar tertinggi. Selanjutnya Rahayu (2010) menyatakan bahwa pada perlakuan tersebut yang dikombinasikan dengan dosis pemupukan 100 kg SP 18/ha mampu meningkatkan produktivitas kedelai varietas Wilis sampai dengan 3.97 ton/ha yang lebih tinggi dibandingkan kombinasi pemberian pupuk dosis 400 kg SP 18/ha tanpa aplikasi CMA yang hanya mencapai 3.76 ton/ha. Pelapisan benih dengan inokulan CMA berpelapis gambut-gipsum (50:50) dan berperekat tapioka 5% sangat bermanfaat dalam meningkatkan produktivitas kedelai, sehingga perlu dilakukan penelitian mengenai daya simpan benih kedelai yang telah dilapisi CMA.
Tujuan
Hipotesis
1. Perlakuan pelapisan benih dapat mempertahankan viabilitas dan vigor benih kedelai, serta viabilitas CMA selama penyimpanan.
TINJAUAN PUSTAKA
Botani Tanaman Kedelai
Tanaman kedelai termasuk divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledoneae, ordo Rasales, family Leguminosae, genus Glycine, spesies Glycine max (L.) Merril. Di Indonesia tanaman kedelai dapat tumbuh dan berproduksi dengan baik di dataran rendah sampai ketinggian 900 m di atas permukaan laut. Iklim yang paling cocok untuk menanam kedelai adalah suhu antara 25-270C, kelembaban udara (RH) rata-rata 65%, penyinaran 12 jam/hari dan curah hujan 100-200 mm/bulan (Rukmana dan Yuniarsih, 1995).
Pertumbuhan kedelai sangat peka terhadap perubahan lingkungan tumbuh yang disebabkan oleh kondisi iklim, baik mikro maupun makro. Pada stadia pertumbuhan vegetatif, pembungaan, pembentukan dan pengisian polong, ketersediaan air sangat diperlukan. Panen dilakukan pada saat benih kedelai telah mencapai masak fisiologis, yang ditandai oleh sebagian besar daunnya telah gugur dan 95% polong berwarna kecoklatan atau kehitaman (Balitkabi, 2008).
Cendawan Mikoriza Arbuskula
Berdasarkan struktur tubuh dan cara menginfeksi akar, mikoriza dibedakan menjadi dua, yaitu ektomikoriza dan endomikoriza (Setiadi, 2001). Ektomikoriza memiliki jaringan hifa yang tidak masuk sampai sel-sel korteks, tetapi berkembang di antara sel tersebut membentuk mantel pada permukaan akar. Endomikoriza memiliki jaringan hifa yang masuk ke dalam sel korteks, membentuk struktur khas berbentuk oval yang disebut vesikula atau bercabang yang disebut arbuskula, sehingga cendawan kelompok ini sering disebut cendawan mikoriza arbuskula (CMA) (Musfal, 2008). Vesikula merupakan strukur berdinding tipis, berbentuk bulat atau lonjong. Struktur ini mengandung senyawa lipid yang berfungsi sebagai tempat penyimpanan makanan kemudian diangkut ke dalam sel dimana metabolisme sel berlangsung dan sebagai organ reproduktif. Arbuskula merupakan percabangan dikotomus yang intensif dari hifa intraseluler, berperan dalam transfer nutrisi antara cendawan dan tanaman inang (Sylvia, 1998). Penampang akar yang terinfeksi oleh CMA dapat dilihat pada Gambar 1.
Gambar 1. Penampang Membujur Akar Terinfeksi CMA (Brundrett et al., 1994) Arbuskula
Epidermis
Sel korteks
Hifa intraseluler
Vesikula
Endodermis Apresorium
Eksodermis Rambut akar
Hifa eksternal
Widiastuti (2004) menyatakan bahwa infeksi CMA terhadap kelapa sawit menyebabkan perubahan bentuk organ CMA, adanya hifa eksternal, internal, vesikula dan arbuskula dalam korteks akar. Chalimah et al. (2007) menyatakan bahwa perkecambahan spora berperan penting di dalam infeksi akar, yang dipengaruhi oleh beberapa faktor di antaranya kompatibilitas inang, eksudat akar, jenis inokulum dan faktor lingkungan. Menurut Bakhtiar (2002) meskipun CMA menginfeksi dan mengkolonisasi akar berbagai spesies tanaman, namun ada yang lebih disukai dengan memperlihatkan respon kolonisasi akar maksimum.
Cendawan mikoriza arbuskular adalah mikroorganisme yang bersifat simbion obligat, karena tanpa tanaman inang (asimbiotik) pertumbuhan hifanya sangat sedikit dan hanya mampu bertahan hidup 20-30 hari (Mathius et al., 2007). Cendawan mikoriza arbuskula termasuk ke dalam filum Glomeromycota yang memiliki empat ordo (Glomerales, Diversisporales, Paraglomerales, dan Archaeosporales), 11 famili dan 18 genus (Schüßler dan Walker 2010). Cendawan mikoriza arbuskula dapat bersimbiosis dengan sebagian besar (97%) famili tanaman, seperti tanaman pangan, hortikultura, kehutanan, perkebunan, dan tanaman pakan (Musfal, 2010).
Peranan Cendawan Mikoriza Arbuskula
Adanya simbiosis mutualistik antara CMA dengan perakaran tanaman membantu pertumbuhan tanaman dan sebalikmya bagi CMA memperoleh sumber makanan dan tempat berkembang biak. Cendawan mikoriza arbuskula berperan dalam meningkatkan penyerapan unsur hara makro dan mikro, khususnya unsur fosfat (P), meningkatkan daya tahan tanaman terhadap serangan patogen, meningkatkan ketahanan terhadap kekeringan, menghasilkan ZPT nabati, memperbaiki struktur tanah dan membantu pertumbuhan tanaman pada daerah yang tercemar logam berat (Indriyanto, 2008). Menurut Wright dan Upadhyaya (1998) CMA menghasilkan senyawa glikoprotein glomalin yang berkorelasi dengan peningkatan kemantapan agregat tanah.
dan konsentrasi hara pada permukaan penyerapan, serta menghasilkan enzim fosfatase yang dapat melepaskan fosfat yang terikat pada logam dalam tanah sehingga memudahkan penyerapan ke dalam akar tanaman. Bolan (1991) menyatakan bahwa kecepatan masuknya hara P ke dalam hifa CMA dapat mencapai enam kali lebih cepat pada akar tanaman yang terinfeksi CMA dibandingkan dengan yang tidak terinfeksi CMA. Hal ini terjadi karena jaringan hifa eksternal CMA mampu memperluas bidang serapan.
Cendawan mikoriza arbuskula digunakan sebagai inokulan mikroba yang memberikan keuntungan bagi tanaman karena CMA mampu menggantikan kira-kira 50% penggunaan fosfat, 40% nitrogen dan 25% kalium (De La Cruz, 1981). Musfal (2008) menyatakan bahwa pemberian CMA pada tanaman jagung sebanyak 10 g/pot tanpa diikuti pemberian pupuk mampu memberikan ketersediaan P yang tertinggi yaitu 36.87 ppm. Menurut Acquaah (2001) unsur hara P berperan dalam pembelahan sel, merangsang pertumbuhan akar, mempercepat kematangan tanaman, dan sebagai tempat penyimpan energi dan transfer ATP dan ADP. Guntoro et al. (2006) menyatakan bahwa inokulasi CMA dan bakteri Azospirillum sp. meningkatkan serapan hara, meningkatkan efisiensi pemupukan pada turfgrass dan meningkatkan kepadatan pucuk Tidwarf. Selanjutnya Widiastuti et al. (2005) menyatakan bahwa bibit kelapa sawit yang diinokulasi A. tuberculata pada perakaran yang lebih luas memungkinkan bibit menyerap hara lebih tinggi khususnya untuk hara yang tidak mudah bergerak seperti P.
menekan kehilangan air melalui penurunan luas daun. Peranan CMA pada tanaman kedelai tersebut terlihat dengan meningkatnya bobot biji kering pada genotip Lokon sebesar 76,42%, pada genotip Sindoro sebesar 36,68% dan pada genotip MLG 3474 sebesar 34,21%.
Pelapisan Benih (Seed Coating)
Pelapisan benih merupakan proses pembungkusan benih dengan zat tertentu dengan tujuan tertentu. Ilyas (2003) menyatakan bahwa penggunaan seed coating dalam industri benih sangat efektif karena dapat memperbaiki penampilan benih, meningkatkan daya simpan, mengurangi resiko tertular penyakit dari benih di sekitarnya, dan dapat digunakan sebagai pembawa zat aditif, misalnya antioksidan, anti mikroba, repellent, mikroba antagonis, zat pengatur tumbuh dan lain-lain. Kuswanto (2003) menyatakan bahwa bahan pelapis yang dapat digunakan dalam pelapisan benih harus memenuhi beberapa persyaratan diantaranya tidak bersifat toksik terhadap benih, dapat mempertahankan kadar air benih selama penyimpanan, menghambat laju respirasi seminimal mungkin, bersifat mudah pecah dan larut apabila terkena air, bersifat porus, tidak mudah mencair, bersifat higroskopis, bersifat sebagai bahan penambat dan penyimpan panas yang rendah, dan harga relatif murah sehingga dapat menekan harga benih.
Khodijah (2009) memanfaatkan pelapisan benih untuk mengaplikasikan inokulum CMA di lapangan. Pemanfaatan bahan perekat dan pelapis (gambut-gipsum) berfungsi sebagai agens pembawa inokulum spora CMA pada benih kedelai. Gambut berfungsi sebagai sumber bahan organik, sedangkan gipsum sebagai sumber mineral dan lapisan pelindung. Penyediaan benih bermikoriza sebelum ditanam mempermudah dalam proses transportasi. Rahayu (2010) menyatakan bahwa aplikasi inokulan CMA berpelapis dan berperekat menghasilkan jumlah spora tertinggi yaitu sebanyak 74.7 per 100 gram tanah dibandingkan dengan aplikasi CMA langsung pada lubang tanam. Tingginya jumlah spora yang terdapat dalam tanah, berkorelasi positif dengan pertumbuhan tanaman kedelai.
ditunjukkan dengan persentase tingkat infeksi cendawan C. capsici pada benih dan hipokotil yang nyata lebih kecil dibandingkan kontrol. Menurut Wright et al. (2005) pelapisan benih wortel dengan menggunakan biopolimer + bakteri Serratia entomophila dapat mengurangi kematian bibit akibat serangan larva grass grub (Costelytra zealandica) yang ditambahkan pada pot percobaan dan dibiarkan selama 4-5 hari setelah tanam masing-masing sebesar 7% dan 16% dibandingkan kontrol yaitu, 88% dan 64%.
Daya Simpan Benih
Penyimpanan benih merupakan pendekatan yang penting untuk memperoleh dan mempertahankan benih bermutu (Mugnisjah et al., 1994). Benih yang telah disimpan diharapkan dapat mempertahankan viabilitas dan vigor tetap tinggi hingga benih tersebut ditanam. Namun, viabilitas dan vigor benih akan cepat menurun jika disimpan pada kondisi simpan yang kurang baik. Menurut Kuswanto (2003) kadar air merupakan salah satu faktor yang mempengaruhi daya simpan benih. Hal ini dikarenakan benih bersifat higroskopis (mudah menyerap air) dan kadar air benih selalu berkesetimbangan dengan suhu dan kelembaban relatif ruang simpan. Menurut Harrington (1972) terdapat dua kaidah mengenai efek kadar air benih dan suhu lingkungan terhadap daya simpan benih, yaitu setiap peningkatan kadar air sebesar 1%, daya simpan benih turun setengahnya (pada kisaran kadar air 5-14%) dan setiap suhu turun 5.6°C, maka daya simpan benih meningkat dua kali lipat (pada kisaran suhu 0 – 50° C).
10.5-11% menjadi 12-13.5%, tergantung pada kelembaban udara di lingkungan penyimpanan.
Sadjad (1980) menyatakan bahwa ada tiga sifat benih (selain genetik) yang mempengaruhi daya simpan benih. Pertama, benih yang disimpan masih melakukan respirasi yang menghasilkan CO2, air dan panas. Peningkatan panas
dan air yang dihasilkan dapat menyebabkan metabolisme benih semakin aktif, sehingga benih kehilangan energi untuk tumbuh. Kedua, benih bersifat higroskopis, artinya kadar air benih selalu berkesetimbangan dengan udara di sekitarnya. Hal ini menyebabkan metabolisme benih semakin aktif, sehingga benih kehilangan energi untuk tumbuh. Ketiga, difusibilitas termal benih rendah, artinya kemampuan benih untuk meneruskan panas secara konduktif rendah. Dengan demikian apabila terjadi kenaikan suhu pada ruang simpan benih, panas yang dihasilkan akibat kenaikan suhu tersebut tidak cepat dipancarkan ke segala arah, sehingga dapat terjadi hot-spot bahkan terjadi moulding (pertumbuhan cendawan) apabila cukup lembab.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Mei sampai Desember 2011 di Laboratorium Agromikrobiologi, Balai Pengkajian Bioteknologi, BPPT PUSPIPTEK Serpong, Tangerang Selatan; Laboratorium Ilmu dan Teknologi Benih dan Rumah Kaca Kebun Percobaan Cikabayan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Dramaga, Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah benih kedelai varietas Wilis yang dipanen pada bulan Juli 2010 di Kebun Percobaan Leuwikopo, IPB, Dramaga, disimpan pada kondisi ruang AC (suhu 16-20ºC dan RH 58–59%) selama 11 bulan. Kadar air benih pada saat digunakan (18 Mei 2011) sebesar 7.44%, sedangkan daya berkecambah dan indeks vigor sebesar 99% dan 68% yang diuji dengan UKDdp (Uji Kertas Digulung didirikan dalam plastik). Bahan lain yang digunakan adalah gipsum, gambut, tapioka, spora CMA (campuran spesies Glomus sp. dan Gigaspora sp.) produksi Balai Pengkajian Bioteknologi BPPT, media bacto agar, kompos, arang sekam, larutan streptomycin (200 mg/L), gentamycin (100 ml/L), larutan chloramine-T (2%) dan Tween 20 (0.05%).
Gambar 2. Modifikasi Drum Granulator Mini
Metode Percobaan
Penelitian ini terdiri atas dua percobaan suhu ruang simpan yang berbeda yaitu suhu kamar dan suhu AC. Kedua percobaan menggunakan metode Rancangan Kelompok Lengkap Teracak (RKLT) yang terdiri atas dua faktor, yaitu faktor pertama adalah perlakuan pelapisan benih (P) terdiri atas dua taraf yaitu, tanpa pelapisan (kontrol) dan pelapisan benih dengan CMA (Khodijah, 2009), sedangkan faktor kedua adalah periode simpan (T) yang terdiri atas tujuh taraf yaitu, 0, 1, 2, 3, 4, 5, dan 6 bulan. Dengan demikian terdapat empat belas kombinasi perlakuan dan setiap perlakuan terdiri atas tiga ulangan, sehingga seluruhnya terdapat 42 satuan percobaan pada satu kondisi suhu.
Model linier rancangan percobaan yang digunakan yaitu, sebagai berikut: Yijk = µ + αi + τj + βk + (ατ)ij + εijk
i = 1,2 j = 0, 1, 2, 3, 4, 5, 6 k = 1, 2, 3 Keterangan:
Yijk = nilai pengamatan kelompok ke-k pada perlakuan benih ke-i dan periode
simpan ke-j µ = nilai tengah umum
αi = pengaruh taraf ke-i dari faktor perlakuan benih
τj = pengaruh taraf ke-j dari faktor periode simpan
βk = pengaruh kelompok ke-k
(ατ)ij= pengaruh interaksi faktor perlakuan benih ke-i dan periode simpan ke-j
εijk = pengaruh galat percobaan pada perlakuan benih ke-i, periode simpan ke-j,
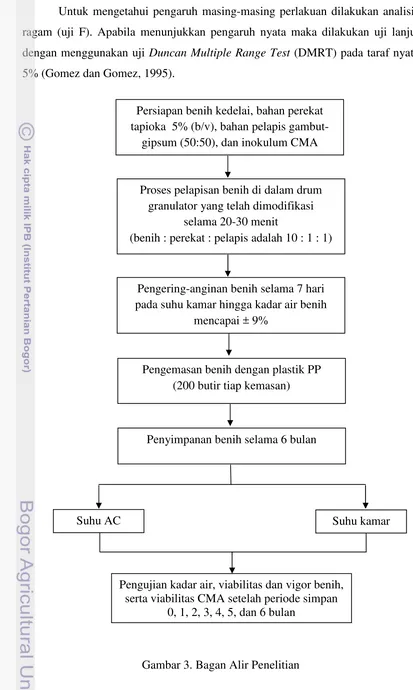
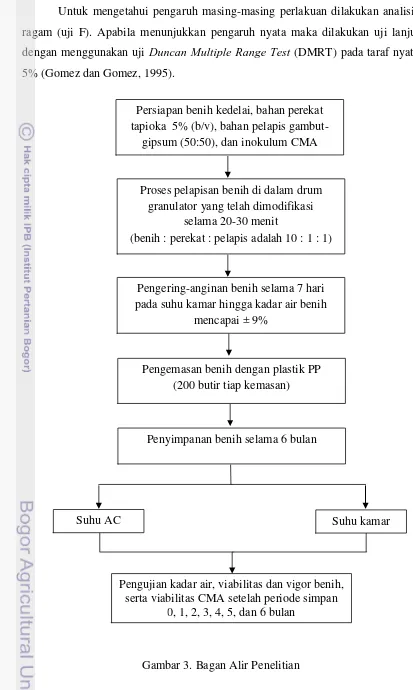
Untuk mengetahui pengaruh masing-masing perlakuan dilakukan analisis ragam (uji F). Apabila menunjukkan pengaruh nyata maka dilakukan uji lanjut dengan menggunakan uji Duncan Multiple Range Test (DMRT) pada taraf nyata 5% (Gomez dan Gomez, 1995).
Gambar 3. Bagan Alir Penelitian Persiapan benih kedelai, bahan perekat tapioka 5% (b/v), bahan pelapis
gambut-gipsum (50:50), dan inokulum CMA
Pengering-anginan benih selama 7 hari pada suhu kamar hingga kadar air benih
mencapai ± 9%
Pengemasan benih dengan plastik PP (200 butir tiap kemasan)
Penyimpanan benih selama 6 bulan
Suhu kamar
Pengujian kadar air, viabilitas dan vigor benih, serta viabilitas CMA setelah periode simpan
0, 1, 2, 3, 4, 5, dan 6 bulan Proses pelapisan benih di dalam drum
granulator yang telah dimodifikasi selama 20-30 menit
(benih : perekat : pelapis adalah 10 : 1 : 1)
Pelaksanaan Percobaan
Pelapisan Benih
Benih kedelai dilapisi dengan gambut dan gipsum (50:50) sebagai bahan pelapis, dan tapioka 5% (b/v) sebagai bahan perekat. Perbandingan benih : perekat : pelapis adalah 10 : 1 : 1 (Khodijah, 2009).
a. Persiapan Bahan Perekat dan Bahan Pelapis
Bahan perekat yang digunakan adalah tapioka dengan konsentrasi 5% (b/v) dimasukkan ke dalam gelas beker yang berisi air, kemudian dididihkan, dan didinginkan sebelum digunakan. Gambut yang akan digunakan adalah gambut dari Rawapening yang mengandung hemiselulosa, selulosa, lignin, kutin, bitumens, dan asam humik. Gambut ini termasuk jenis gambut berserat yang subur dan kaya akan hara mineral dengan kisaran pH 6-7. Gambut dan gipsum yang digunakan berukuran halus yang lolos saringan 100 mesh. Kedua bahan tersebut terlebih dahulu disterilisasi dalam autoklaf pada suhu 121° C selama 2 jam. Gambut dan gipsum kemudian dicampur (Khodijah, 2009).
b. Pelapisan Benih
Benih kedelai dibersihkan menggunakan kertas merang lembab dan dikering-anginkan dengan kipas angin selama 15 menit. Benih kemudian dilapisi dengan bahan perekat yang dicampur dengan inokulum CMA berupa spora, kemudian diberi bahan pelapis gambut dan gipsum. Proses pelapisan benih dilakukan di dalam modifikasi drum granulator selama 20-30 menit.
Gambar 4. Benih Kedelai (A) Tanpa Pelapisan (Kontrol) dan (B) Pelapisan dengan CMA
c. Penghitungan Spora pada Benih
Jumlah spora yang akan dilapiskan pada benih ditentukan sebanyak 50 spora per benih. Sebelum diaplikasikan, kerapatan spora dihitung dengan mengambil sampel zeolit berisi spora CMA sebanyak 0.1 gram. Sampel tersebut dimasukkan ke dalam gelas beker 250 ml dan direndam dalam air selama 1 jam, kemudian diaduk, dan larutannya dituang ke dalam saringan (50–100 µm). Spora hasil saringan dicuci dengan air, kemudian dituang ke dalam cawan petri dan dihitung jumlah spora di bawah mikroskop stereo (Rahayu, 2010).
Untuk memastikan jumlah spora yang menempel pada benih adalah sebanyak 50 spora, maka dilakukan penghitungan jumlah spora CMA pada benih yang telah dilapisi. Sampel benih diambil sebanyak 10 ulangan masing-masing dua butir untuk satu ulangan. Cara penghitungan spora yang menempel pada benih sama seperti di atas (Rahayu, 2010).
Pelaksanaan Penyimpanan Benih
a. Pengemasan dan Penyimpanan Benih
Benih disimpan dalam kemasan plastik polypropylene sebanyak 200 butir tiap kemasan. Masing-masing kemasan yang telah berisi benih dimasukkan dalam keranjang plastik yang ditutup jaring-jaring kawat pada bagian atas (Gambar 5), selanjutnya disimpan pada suhu AC (17-18°C) dan suhu kamar (27-29°C) di Laboratorium Ilmu dan Teknologi Benih, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Dramaga, selama
6 bulan. Pada setiap akhir periode simpan dilakukan pengamatan terhadap kadar air, viabilitas dan vigor benih kedelai, serta viabilitas CMA.
[image:30.595.127.483.145.277.2]
Gambar 5. Kemasan Simpan Benih yang Digunakan pada Penelitian
b. Pengujian Viabilitas dan Vigor Benih
Pengujian viabilitas dan vigor benih dilakukan setelah periode simpan 0, 1, 2, 3, 4, 5, dan 6 bulan. Benih ditanam pada boks plastik berukuran 25 cm x 20 cm menggunakan media tanam campuran kompos dan arang sekam
dengan perbandingan 1 : 1 di rumah kaca Kebun Percobaan Cikabayan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Dramaga. Setiap perlakuan diulang sebanyak empat kali masing-masing 25 butir benih untuk satu ulangan.
Pengamatan
Viabilitas dan Vigor Benih Kedelai
Pengamatan viabilitas dan vigor benih dilakukan pada setiap periode simpan yang telah ditentukan yaitu 0, 1, 2, 3, 4, 5 dan 6 bulan pada suhu kamar dan suhu AC. Tolok ukur yang diamati adalah kadar air benih, daya berkecambah, kecepatan tumbuh, indeks vigor, keserempakan tumbuh, dan T50.
1. Kadar Air Benih (KA)
ditimbang, benih di dalam cawan dioven pada suhu konstan rendah 103 ± 2º C selama 17 ± 1 jam (ISTA, 2007). Benih yang telah dioven dimasukkan dalam desikator selama 30 menit. Setelah dingin ditimbang berat kering benih. Kadar air benih dihitung dengan rumus :
KA % = M2-M1 - (M3-M1)
(M2-M1) ×100% Keterangan :
M1 = berat cawan kosong (g)
M2 = berat awal (benih + cawan sebelum dioven) (g) M3 = berat akhir (benih + cawan setelah dioven) (g)
2. Daya Berkecambah (DB)
Pengukuran daya berkecambah benih (%) dihitung berdasarkan persentase jumlah kecambah normal pada hitungan pertama (5 HST) dan hitungan kedua (8 HST) yang dibandingkan dengan jumlah total benih yang ditanam (ISTA, 2007). Daya berkecambah benih dihitung dengan rumus :
DB % = ∑KN I+ ∑KN II
∑benih yang ditanam ×100% Keterangan :
KN = kecambah normal
3. Kecepatan Tumbuh (KCT)
Kecepatan tumbuh diukur berdasarkan persentase kecambah normal pada waktu tanam sampai akhir pengamatan. Pengamatan dilakukan setiap hari terhadap pertambahan persentase kecambah normal dibagi dengan etmal (24 jam). Nilai etmal kumulatif dimulai saat benih ditanam sampai dengan waktu pengamatan. Kecepatan tumbuh dihitung dengan rumus :
KCT (%/etmal) =
Ni
ti 8
Keterangan :
ti = waktu pengamatan ke-i
N = pertambahan % kecambah normal setiap waktu pengamatan ke-i
4. Indeks Vigor (IV)
Indeks vigor dihitung berdasarkan persentase jumlah kecambah normal pada hitungan pertama (first count ) dibagi dengan jumlah benih yang ditanam pada uji daya berkecambah. Indeks vigor dihitung dengan rumus :
IV % = ∑kecambah normal pada hitungan pertama
∑benih yang ditanam ×100%
5. Keserempakan Tumbuh (KST)
Keserempakan tumbuh benih diukur berdasarkan kecambah normal kuat pada hari antara hitungan pertama dan hitungan kedua (hari ke-7). Kecambah normal kuat adalah kecambah yang memiliki kinerja kuat diantara kecambah yang tumbuh normal. Keserempakan tumbuh dihitung dengan rumus :
KST (%) =
∑kecambah normal kuat hari ke-7
∑benih yang ditanam × 100% 6. T50
T50 merupakan pengukuran waktu untuk mencapai 50 % dari
perkecambahan total dihitung berdasarkan jumlah benih yang berkecambah setiap hari hingga mencapai 50 % dari total perkecambahan benih. Satuan yang digunakan adalah hari. Rumus perhitungan yang telah dimodifikasi oleh Ilyas (2005) :
T50 (hari) = ti +
n50% - ni
nj - ni
Keterangan :
ti = waktu atau hari batas bawah sebelum mencapai 50% total perkecambahan
n50% = jumlah kecambah 50% dari total perkecambahan
ni = jumlah kecambah batas bawah sebelum mencapai 50% total
nj = jumlah kecambah batas atas setelah mencapai 50% total perkecambahan
Viabilitas Cendawan Mikoriza Arbuskula (CMA)
Benih kedelai yang telah dilapisi dan disimpan, kemudian diuji viabilitas CMA dengan uji perkecambahan spora. Pengujian tersebut dilakukan berdasarkan modifikasi metode Azcón-Aguilar et al. (1986). Benih kedelai yang sudah diberi perlakuan CMA diamati viabilitas sporanya sebanyak 20 butir setiap kemasan. Benih tersebut direndam dalam air untuk melepaskan spora dari benih. Spora CMA disterilisasi dengan dua tahap yaitu (1) sterilisasi spora di dalam larutan chloramine-T (2%) dan Tween 20 (0.05%) selama 2 menit, dan (2) sterilisasi spora di dalam larutan streptomycin (200 mg/L) dan gentamycin (100 ml/L) selama 10 menit. Larutan chloramine-T dan Tween 20 digunakan untuk sterilisasi permukaan spora, sedangkan streptomycin dan gentamycin untuk membunuh kuman bersifat gram positif maupun negatif.
HASIL DAN PEMBAHASAN
A. Kondisi Simpan pada Suhu Kamar
Rekapitulasi hasil analisis ragam (uji F) pengaruh pelapisan benih, periode simpan dan interaksi antara pelapisan benih dan periode simpan terhadap tolok ukur kadar air, viabilitas dan vigor benih kedelai dapat dilihat pada Tabel 1.
Tabel 1. Rekapitulasi Hasil Analisis Ragam Pengaruh Pelapisan Benih, Periode Simpan, dan Interaksinya terhadap Tolok Ukur Kadar Air, Viabilitas, dan Vigor Benih Kedelai pada Suhu Kamar
Tolok Ukur Perlakuan dan Interaksinya
P T P x T
Kadar air * ** tn
Viabilitas :
Daya berkecambah tn ** tn
Vigor :
Kecepatan tumbuh * ** *
Indeks vigor * ** tn
Keserempakan tumbuh tn ** tn
T50 ** ** **
Keterangan: P (perlakuan pelapisan benih), T (periode simpan), * (berpengaruh nyata pada taraf 5 %), ** (berpengaruh sangat nyata pada taraf 1 %), tn (tidak berpengaruh nyata).
Rekapitulasi hasil analisis ragam (Tabel 1) menunjukkan bahwa faktor tunggal pelapisan benih memberikan pengaruh nyata terhadap kadar air, kecepatan tumbuh, dan indeks vigor benih, serta berpengaruh sangat nyata terhadap T50. Faktor tunggal periode simpan memberikan pengaruh sangat nyata
terhadap semua tolok ukur. Interaksi antara pelapisan benih dan periode simpan memberikan pengaruh nyata terhadap kecepatan tumbuh benih dan berpengaruh sangat nyata terhadap T50.
antara 27 - 28°C dengan RH 70-85%, sedangkan pada sore hari berkisar antara 28-29°C dengan RH 60-90%. Menurut Justice dan Bass (2002) benih bersifat higroskopis dan berkesetimbangan dengan suhu dan RH lingkungan di sekitarnya.
Tabel 2. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Kadar Air Benih Kedelai (%) pada Suhu Kamar
Perlakuan benih Periode simpan (bulan) Rata-rata
0 1 2 3 4 5 6
Kontrol 8.8 9.4 9.6 9.7 9.7 11.4 11.1 9.9a Pelapisan benih
dengan CMA 8.8 9.7 9.3 9.2 9.2 10.5 9.9 9.5b Rata-rata 8.8b 9.5b 9.5b 9.4b 9.4b 10.9a 10.5a
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 6.37 %.
Kadar air pada perlakuan pelapisan benih dengan CMA lebih rendah dibandingkan kontrol setelah disimpan selama 6 bulan yaitu sebesar 9.5%. Hal ini diduga karena bahan pelapis gambut-gipsum yang digunakan pada penelitian mampu menahan masuknya uap air ke dalam benih. Yuningsih (2009) menyatakan bahwa perlakuan pelapisan benih buncis dengan Arabic gum 0.25 g/ml menunjukkan bahwa laju peningkatan kadar air selama penyimpanan 20 minggu nyata lebih lambat pada suhu kamar (27-31°C) dibandingkan dengan benih tanpa pelapis. Kadar air benih yang tinggi akan meningkatkan laju respirasi sehingga benih cepat kehilangan energi dan persediaan cadangan makanan untuk berkecambah. Daya berkecambah benih kedelai mengalami penurunan setelah disimpan selama 6 bulan pada suhu kamar.
Tabel 3. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Daya Berkecambah Benih Kedelai (%) pada Suhu Kamar
Perlakuan benih Periode simpan (bulan) Rata-rata
0 1 2 3 4 5 6
Kontrol 97.6 92.3 91.0 77.0 70.3 54.6 44.0 75.2 Pelapisan benih
dengan CMA 96.6 82.9 85.0 80.6 73.6 56.6 46.0 74.5 Rata-rata 97.1a 87.6b 88.0b 78.8c 72.0c 55.6d 45.0e
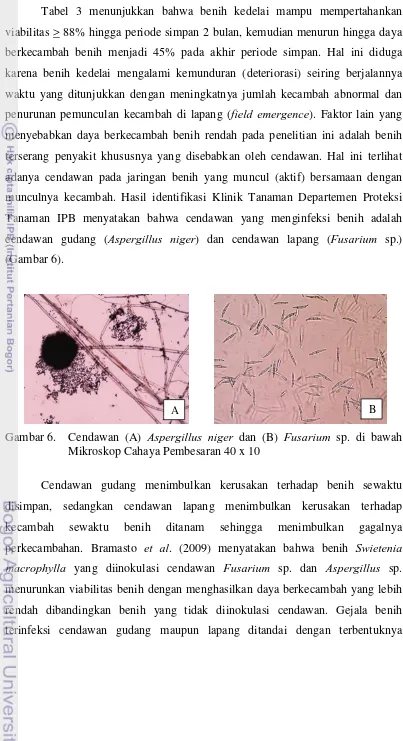
Tabel 3 menunjukkan bahwa benih kedelai mampu mempertahankan viabilitas > 88% hingga periode simpan 2 bulan, kemudian menurun hingga daya berkecambah benih menjadi 45% pada akhir periode simpan. Hal ini diduga karena benih kedelai mengalami kemunduran (deteriorasi) seiring berjalannya waktu yang ditunjukkan dengan meningkatnya jumlah kecambah abnormal dan penurunan pemunculan kecambah di lapang (field emergence). Faktor lain yang menyebabkan daya berkecambah benih rendah pada penelitian ini adalah benih terserang penyakit khususnya yang disebabkan oleh cendawan. Hal ini terlihat adanya cendawan pada jaringan benih yang muncul (aktif) bersamaan dengan munculnya kecambah. Hasil identifikasi Klinik Tanaman Departemen Proteksi Tanaman IPB menyatakan bahwa cendawan yang menginfeksi benih adalah cendawan gudang (Aspergillus niger) dan cendawan lapang (Fusarium sp.) (Gambar 6).
Gambar 6. Cendawan (A) Aspergillus niger dan (B) Fusarium sp. di bawah Mikroskop Cahaya Pembesaran 40 x 10
Cendawan gudang menimbulkan kerusakan terhadap benih sewaktu disimpan, sedangkan cendawan lapang menimbulkan kerusakan terhadap kecambah sewaktu benih ditanam sehingga menimbulkan gagalnya perkecambahan. Bramasto et al. (2009) menyatakan bahwa benih Swietenia macrophylla yang diinokulasi cendawan Fusarium sp. dan Aspergillus sp. menurunkan viabilitas benih dengan menghasilkan daya berkecambah yang lebih rendah dibandingkan benih yang tidak diinokulasi cendawan. Gejala benih terinfeksi cendawan gudang maupun lapang ditandai dengan terbentuknya
[image:36.595.108.511.81.822.2]kumpulan spora berwarna hitam (Aspergillusniger) dan warna kuning (Fusarium sp.) pada benih (Gambar 7).
Gambar 7. Benih Kedelai Terinfeksi (A) Aspergillusniger dan (B) Fusarium sp.
Pada periode simpan 1 bulan benih sudah mulai terserang cendawan dan persentasenya semakin tinggi pada periode simpan 6 bulan yaitu sebesar 35% pada perlakuan kontrol dan 32% pada pelapisan benih dengan CMA (Tabel 4). Hal ini diduga karena tingginya suhu dan kelembaban ruang simpan kamar (27-29°C, 60-90% RH), serta kadar air benih yang mengalami peningkatan (Tabel 2). Selain itu, benih yang digunakan telah mengalami penyimpanan yang cukup lama (11 bulan) kemungkinan benih terinfeksi cendawan di ruang simpan atau cendawan terbawa benih sebelum simpan. Semakin lama waktu penyimpanan maka semakin tinggi perkembangan cendawan. Pakki dan Talanca (2006) menyatakan bahwa kontaminasi Aspergillus sp. dimulai dari infeksi di pertanaman dan terbawa ke tempat penyimpanan, kemudian menjadi sumber inokulum awal penyebab kontaminasi di gudang-gudang penyimpanan. Peluang perkembangan Aspergillus sp. semakin besar apabila benih disimpan pada kadar air tinggi.
Tabel 4. Persentase Jumlah Benih yang Bercendawan pada Suhu Kamar
Periode Simpan (bulan) Perlakuan benih
Kontrol Pelapisan benih dengan CMA
0 0 0
1 0 7.0
2 4.3 4.3
3 12.3 9.0
4 12.3 13.7
5 25.7 26.7
6 35.0 32.0
Kecepatan tumbuh (KCT) merupakan salah satu tolok ukur vigor
kekuatan tumbuh. Tabel 5 menunjukkan bahwa kecepatan tumbuh benih mengalami penurunan selama penyimpanan. Nilai kecepatan tumbuh benih tertinggi pada perlakuan kontrol sebelum disimpan yaitu sebesar 23.3 %/etmal. Pada periode simpan 1 dan 2 bulan kecepatan tumbuh benih pada perlakuan kontrol nyata lebih tinggi dibanding perlakuan pelapisan benih dengan CMA. Namun, pada periode simpan 3 bulan nilai kecepatan tumbuh pada perlakuan pelapisan benih dengan CMA nyata lebih tinggi dibanding kontrol, sedangkan pada periode simpan 4 hingga 6 bulan tidak berbeda nyata antara kontrol dan pelapisan benih dengan CMA.
Tabel 5. Pengaruh Interaksi Pelapisan Benih (P) dan Periode Simpan (T) terhadap Kecepatan Tumbuh Benih Kedelai (%/etmal) pada Suhu Kamar
Perlakuan benih Periode simpan (bulan)
0 1 2 3 4 5 6
Kontrol 23.3 a 20.7 abc 21.1 ab 17.7 c-f 16.0 f 11.0 g 7.9 g Pelapisan benih
dengan CMA 20.3 a-d 16.2 ef 17.1 def 19.4 b-e 16.2 ef 10.1 g 8.4 g
Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT 5% dengan KK = 10.94%.
Kecepatan tumbuh mengindikasikan vigor benih secara individual, meskipun kecepatan tumbuh diukur sebagai persentase bibit atau kecambah normal terhadap seluruh benih yang ditanam atau dikecambahkan untuk waktu yang ditentukan (Sadjad et al., 1999) . Pada benih yang memiliki KCT yang tinggi
Perlakuan seed coating pada umumnya meningkatkan kecepatan tumbuh benih, namun beberapa bahan kimia dan zat aditif yang digunakan ada yang bersifat fitotoksik terhadap tanaman. Setiyowati (2007) menyatakan bahwa perlakuan seed coating dengan Benomil dan tepung curcuma harus hati-hati dalam penggunaannya karena dapat menurunkan daya berkecambah, indeks vigor dan kecepatan tumbuh benih cabai.
Indeks vigor merupakan persentase kecambah normal pada hitungan pertama pengujian daya berkecambah benih (Copeland dan McDonald, 2001). Indeks vigor merupakan salah satu tolok ukur vigor kekuatan tumbuh. Tabel 6 menunjukkan bahwa indeks vigor benih kedelai mengalami penurunan dari semula 88.6% menjadi 74% setelah 1 bulan penyimpanan, hingga akhir periode simpan 6 bulan menjadi 18.1%. Nilai rata-rata indeks vigor benih yang dilapisi CMA (55.8%) lebih rendah dibandingkan kontrol (61.6%). Kekerasan bahan pelapis gipsum diduga dapat memperlambat munculnya kecambah.
Tabel 6. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Indeks Vigor Benih Kedelai (%) pada Suhu Kamar
Perlakuan benih Periode simpan (bulan) Rata-rata
0 1 2 3 4 5 6
Kontrol 93.0 85.6 79.6 67.0 65.0 24.0 17.3 61.6a Pelapisan benih
dengan CMA 84.3 62.4 73.0 75.0 59.6 17.3 19.0 55.8b Rata-rata 88.6a 74.0b 76.3b 71.0bc 62.3c 20.6d 18.1d
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 13.24 %.
Tabel 7. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Keserempakan Tumbuh Benih Kedelai (%) pada Suhu Kamar
Perlakuan benih Periode simpan (bulan) Rata-rata
0 1 2 3 4 5 6
Kontrol 97.0 91.3 90.0 75.6 69.3 47.6 35.3 72.3 Pelapisan benih
dengan CMA 95.0 81.6 83.6 79.6 73.6 46.6 39.3 71.3 Rata-rata 96.0a 86.4b 86.8b 77.6c 71.5c 47.1d 37.3e
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 9.34 %.
Benih yang vigor, selain dituntut cepat tumbuh yang diukur dengan KCT
juga dituntut untuk tumbuh dengan serempak. Keserempakan ini menunjukkan kinerja yang homogen dalam pertumbuhan benih di lapang. Menurut Sadjad et al. (1999) homogenitas pertanaman diawali oleh keserempakan tumbuh bibit sehingga selain cepat tumbuh, benih yang vigor mampu tumbuh serempak. Sari (2009) menyatakan bahwa nilai keserempakan tumbuh formulasi coating Arabic gum + Tokoferol, Alginat + TD-L2, dan Alginat + Tokoferol pada benih kacang panjang nyata mengalami peningkatan hingga akhir periode simpan (12 minggu). Tingginya nilai keserempakan tumbuh menunjukkan bahwa benih masih memiliki viabilitas yang tinggi.
T50 merupakan waktu pemunculan kecambah mencapai 50% dari total
perkecambahan. Semakin rendah nilai T50 menunjukkan semakin tinggi kecepatan
tumbuh benih. Hasil uji lanjut interaksi pelapisan benih dan periode simpan terhadap T50 dapat dilihat pada Tabel 8.
Tabel 8. Pengaruh Interaksi Pelapisan Benih (P) dan Periode Simpan (T) terhadap T50 Benih Kedelai (hari) pada Suhu Kamar
Perlakuan benih Periode simpan (bulan)
0 1 2 3 4 5 6
Kontrol 3.7 d 3.9 d 3.7 d 3.8 d 3.8 d 5.2 b 5.5 b Pelapisan benih
dengan CMA 4.3 c 4.7 c 4.5 c 3.6 d 3.8 d 5.9 a 5.3 b Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata
Tabel 8 menunjukkan bahwa perlakuan kontrol nyata menghasilkan benih dengan T50 lebih singkat dibanding perlakuan pelapisan benih dengan CMA
hingga periode simpan 2 bulan. Pada periode simpan 3 bulan perlakuan pelapisan benih dengan CMA mampu menurunkan 50% waktu pemunculan kecambah tersingkat sebesar 3.6 hari, namun pada periode berikutnya nilai T50 mengalami
peningkatan. Pada akhir periode simpan, tidak terdapat perbedaan nyata dalam T50
antara kontrol (5.5 hari) dan pelapisan benih (5.3 hari).
Uji viabilitas spora CMA spesies Glomus sp. dilakukan untuk mengetahui persentase perkecambahan spora setelah disimpan selama 6 bulan pada suhu kamar. Mathius et al. (2007) menyatakan bahwa perkecambahan spora berperan penting di dalam infeksi akar karena menghasilkan pertumbuhan hifa yang akan membantu akar tanaman menyerap hara, selain itu juga untuk perbanyakan CMA sendiri dan memperbanyak infeksi pada akar. Tabel 9 menyajikan data rata-rata persentase perkecambahan spora CMA yang dihitung setelah 16 hari inkubasi.
Tabel 9. Pengaruh Periode Simpan pada Suhu Kamar terhadap Persentase Perkecambahan Spora CMA
Periode simpan Persentase perkecambahan (%)
0 bulan 8.6 a (75.0)
1 bulan 8.3 a (70.8)
2 bulan 9.1 a (83.3)
3 bulan 9.1 a (83.3)
4 bulan 9.5 a (91.6)
5 bulan 8.4 a (70.8)
6 bulan 7.8 a (62.5)
Keterangan: Angka rataan yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT 5% dengan KK = 13.01%. Data yang dianalisis adalah data yang sudah ditransformasi √(x+0.5). Angka dalam kurung merupakan data asli sebelum ditransformasi.
Indriyanto (2008) asosiasi akan terjadi apabila CMA dan akar tanaman merupakan pasangan yang sesuai (compatible). Asosiasi CMA dengan akar tanaman membentuk jalinan interaksi yang komplek. Interaksi ini antara lain berupa pengambilan unsur hara dan adaptasi tanaman yang lebih baik. Menurut Rajapakse dan Miller (1992) kriteria persentase CMA mengkolonisasi akar tanaman yaitu sangat rendah (< 5%), rendah (6 – 25%), sedang (26 – 50%), tinggi (51 – 75%), dan sangat tinggi (> 75%).
B. Kondisi Simpan pada Suhu AC
Rekapitulasi hasil analisis ragam (Tabel 10) pengaruh pelapisan benih, periode simpan dan interaksi antara pelapisan benih dan periode simpan terhadap kadar air, viabilitas dan vigor benih kedelai menunjukkan bahwa faktor tunggal pelapisan benih memberikan pengaruh nyata terhadap kecepatan tumbuh dan berpengaruh sangat nyata terhadap T50. Faktor tunggal periode simpan
memberikan pengaruh sangat nyata terhadap semua tolok ukur. Interaksi antara pelapisan benih dan periode simpan memberikan pengaruh yang sangat nyata terhadap kadar air dan T50.
Tabel 10. Rekapitulasi Hasil Analisis Ragam Pengaruh Pelapisan Benih, Periode Simpan, dan Interaksinya terhadap Tolok Ukur Kadar Air, Viabilitas, dan Vigor Benih Kedelai pada Suhu AC
Tolok Ukur Perlakuan dan Interaksinya
P T P x T
Kadar air tn ** **
Viabilitas :
Daya berkecambah tn ** tn
Vigor :
Kecepatan tumbuh * ** tn
Indeks vigor tn ** tn
Keserempakan tumbuh tn ** tn
T50 ** ** **
Kadar air benih merupakan salah satu faktor yang sangat mempengaruhi daya simpan benih. Hasil uji lanjut interaksi antara pelapisan benih dan periode simpan terhadap kadar air benih dapat dilihat pada Tabel 11.
Tabel 11. Pengaruh Interaksi Pelapisan Benih (P) dan Periode Simpan (T) terhadap Kadar Air Benih Kedelai (%) pada Suhu AC
Perlakuan benih Periode simpan (bulan)
0 1 2 3 4 5 6
Kontrol 9.0 de 8.4 e 8.4 e 8.4 e 8.6 de 9.7 bc 10.7 a Pelapisan benih
dengan CMA 9.6 bc 9.2 cd 8.8 de 8.4 e 9.0 de 9.6 bc 9.9 b Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata
berdasarkan uji DMRT 5% dengan KK = 3.56 %.
Tabel 12. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Daya Berkecambah Benih Kedelai (%) pada Suhu AC
Perlakuan benih Periode simpan (bulan) Rata-rata 0 1 2 3 4 5 6
Kontrol 95.7 97.3 88.3 85.0 81.6 67.0 51.6 80.9 Pelapisan benih
dengan CMA 96.3 80.7 91.1 87.3 89.0 65.0 49.6 79.8 Rata-rata 96.0a 89.0a 89.7a 86.1a 85.3a 66.0b 50.6c
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 12.06 %.
Tabel 12 menunjukkan bahwa daya berkecambah benih kedelai masih tinggi (> 85%) hingga periode simpan 4 bulan, kemudian menurun hingga akhir periode simpan menjadi 50.6%. Penurunan daya berkecambah benih dari sebelum simpan hingga periode simpan 4 bulan tidak berbeda nyata, namun nyata pada periode simpan 5 dan 6 bulan. Hal ini diduga karena adanya peningkatan kadar air benih. Menurut kaidah Harrington setiap peningkatan kadar air sebesar 1%, daya simpan benih turun setengahnya (pada kisaran kadar air 5-14%). Kadar air yang tinggi akan meningkatkan laju respirasi benih sehingga mempercepat kemunduran benih. Benih ortodoks yang disimpan pada suhu rendah mampu mempertahankan viabilitas lebih lama. Pada suhu rendah, respirasi berjalan lambat dibanding suhu tinggi. Purwanti (2004) menyatakan bahwa benih kedelai varietas Wilis yang disimpan pada kemasan plastik maupun kaleng selama 6 bulan dengan suhu rendah (21-23°C) dapat mempertahankan daya tumbuh (> 80%), vigor dan pertumbuhan bibit yang tinggi.
pada permukaan benih, dan patogen secara terpisah terbawa biji (berada dalam sisa tanaman, butiran tanah atau dalam bentuk struktur tertentu) (Soekarno, 2003).
Tabel 13. Persentase Jumlah Benih yang Bercendawan pada Suhu AC
Periode Simpan (bulan)
Perlakuan benih
Kontrol Pelapisan benih dengan CMA
0 0 0
1 0 8.0
2 5.3 3.0
3 12.7 7.7
4 10.3 2.7
5 22.3 17.7
6 28.0 29.0
Hasil uji lanjut pengaruh perlakuan pelapisan benih dan periode simpan terhadap kecepatan tumbuh benih (Tabel 14) menunjukkan bahwa pada awal penyimpanan hingga periode simpan 4 bulan nilai kecepatan tumbuh benih cenderung konstan, namun pada bulan berikutnya mengalami penurunan hingga akhir periode simpan. Penurunan nilai kecepatan tumbuh pada benih menunjukkan bahwa benih telah mengalami kemunduran. Copeland dan McDonald (2001) menyatakan bahwa benih yang mundur dapat diamati dari penampilan kecambah, yaitu terlambatnya perkecambahan benih.
Tabel 14. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Kecepatan Tumbuh Benih Kedelai (%/etmal) pada Suhu AC
Perlakuan benih Periode simpan (bulan) Rata-rata 0 1 2 3 4 5 6
Kontrol 21.2 23.5 20.9 20.6 20.0 14.7 10.5 18.8 a Pelapisan benih
dengan CMA 20.2 15.5 19.2 20.9 21.1 13.0 9.9 17.1 b Rata-rata 20.7a 19.5a 20.1a 20.8a 20.5a 13.9b 10.2c
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 13.64 %.
karena bahan pelapis (gambut-gipsum) yang melapisi benih tidak larut sempurna ketika terkena air, sehingga menghambat proses perkecambahan, terutama proses pemunculan plumula. Hal ini disebabkan oleh butiran granul yang terlalu keras. Oleh karena itu, ketika benih telah terlapisi oleh bahan pelapis gambut-gipsum (50 : 50) sebaiknya tidak dilakukan pelapisan kembali dengan gipsum.
Indeks vigor yang tinggi menunjukkan benih berkecambah lebih cepat, sehingga digolongkan dalam vigor. Tabel 15 menunjukkan bahwa selama penyimpanan nilai indeks vigor mengalami penurunan dari semula 85.3% menjadi 24.8% hingga akhir periode simpan (6 bulan). Penurunan nilai indeks vigor disebabkan oleh benih yang telah mengalami kemunduran selama penyimpanan.
Tabel 15. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Indeks Vigor Benih Kedelai (%) pada Suhu AC
Perlakuan benih
Periode simpan (bulan) Rata-rata
0 1 2 3 4 5 6
Kontrol 87.3 90.3 80.7 81.7 77.7 40.3 23.6 68.8 Pelapisan benih
dengan CMA 83.3 52.0 83.9 79.3 79.3 39.0 26.0 63.2 Rata-rata 85.3
a 71.1 a 82.3 a 80.5 a 78.5
a 39.6b 24.8c
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 17.69 %.
Tabel 16 menunjukkan bahwa keserempakan tumbuh benih selama penyimpanan mengalami penurunan dari semula 95.1% hingga akhir periode simpan menjadi 43.6%. Penurunan nilai keserempakan tumbuh tidak berbeda
nyata hingga periode simpan 4 bulan, sedangkan pada periode simpan 5 dan 6 bulan penurunannya nyata. Hal ini diduga karena terjadinya peningkatan
kadar air benih (lihat Tabel 11) yang dapat meningkatkan laju respirasi benih sehingga mempercepat kemunduran benih.
Tabel 16. Pengaruh Pelapisan Benih (P) dan Periode Simpan (T) terhadap Keserempakan Tumbuh Benih Kedelai (%) pada Suhu AC
Perlakuan benih Periode simpan (bulan) Rata-rata
0 1 2 3 4 5 6
Kontrol 95.3 97.0 87.6 84.3 81.6 61.6 43.6 78.7 Pelapisan benih
dengan CMA 95.0 78.6 90.1 86.0 87.3 55.0 43.6 76.5 Rata-rata 95.1a 87.8a 88.9a 85.1a 84.5a 58.3b 43.6c
Keterangan: Angka yang diikuti oleh huruf yang berbeda menunjukkan berbeda nyata berdasarkan uji DMRT 5% dengan KK = 12.99 %.
Kadar air merupakan faktor yang paling mempengaruhi kemunduran benih. Kemunduran benih meningkat sejalan dengan meningkatnya kadar air benih. Pada umumnya semakin lama benih disimpan maka benih mengalami kemunduran. Hal ini dapat dilihat dengan menurunnya keserempakan tumbuh benih. Benih ortodoks akan menurun vigornya akibat suhu dan kelembaban yang tidak menunjang (Sadjad et al., 1999).
Hasil uji lanjut pengaruh perlakuan pelapisan benih dan periode simpan terhadap tolok ukur T50 dapat dilihat pada Tabel 17.
Tabel 17. Pengaruh Interaksi Pelapisan Benih (P) dan Periode Simpan (T) terhadap T50 Benih Kedelai (hari) pada Suhu AC
Perlakuan benih Periode simpan (bulan)
0 1 2 3 4 5 6
Kontrol 4.1 d 3.6 e 3.6 e 3.6 e 3.6 e 4.3 cd 5.4 a Pelapisan benih
dengan CMA 4.3 cd 4.7 bc 4.4 cd 3.6 e 3.6 e 4.7 bc 5.0 ab Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata
Tabel 17 menunjukkan bahwa secara umum perlakuan kontrol menghasilkan benih dengan T50 lebih singkat dibanding perlakuan pelapisan benih
dengan CMA hingga periode simpan 5 bulan, tetapi tidak berbeda nyata pada akhir periode simpan. Nilai T50 yang rendah mengindikasikan kecepatan benih
untuk berkecambah lebih tinggi. Bahan pelapis yang terlalu keras diduga menghambat proses perkecambahan benih.
Munculnya hifa dari spora CMA merupakan tanda bahwa spora CMA telah berkecambah. Tabel 18 menyajikan data rata-rata persentase perkecambahan spora CMA yang dihitung setelah 16 hari inkubasi. Selama penyimpanan 6 bulan terjadi peningkatan persentase perkecambahan walaupun tidak berbeda nyata dengan sebelum simpan. Hal ini menunjukkan bahwa viabilitas spora CMA dapat dipertahankan selama penyimpanan 6 bulan. Adanya bahan perekat tapioka dan pelapis gambut-gipsum pada aplikasi pelapisan benih diduga memberikan tambahan nutrisi bagi perkecambahan spora CMA selama penyimpanan.
Tabel 18. Pengaruh Periode Simpan pada Suhu AC terhadap Persentase Perkecambahan Spora CMA
Periode simpan Persentase perkecambahan (%)
0 bulan 2.4 a (50.2)
1 bulan 3.0 a (75.0)
2 bulan 2.9 a (66.6)
3 bulan 3.1 a (83.3)
4 bulan 3.0 a (75.0)
5 bulan 3.0 a (79.1)
6 bulan 2.9 a (62.5)
Keterangan: Angka rataan yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT 5% dengan KK = 13.97%. Data yang dianalisis adalah data yang sudah ditransformasi √(x+0.5). Angka dalam kurung merupakan data asli sebelum ditransformasi.
Komposisi kimia pati tapioka (per 100 gram bahan) adalah energi 307 kalori, kadar air 9.1%, karbohidrat 88.2%, protein 1.1%, lemak 0.5%, fosfor 125 mg, kalsium 84 mg, dan besi 1 mg (Yengkokpam et al., 2007), sedangkan bahan pelapis gambut-gipsum memberikan tambahan hara mineral berupa karbon (C), kalsium (Ca), dan sulfat (SO4) bagi CMA. Inokulum CMA dengan bahan
KESIMPULAN DAN SARAN
Kesimpulan
Benih kedelai yang disimpan pada suhu kamar mampu mempertahankan viabilitas > 88 % hingga periode simpan 2 bulan, sedangkan pada suhu AC > 85% hingga periode simpan 4 bulan. Benih yang dilapisi dengan CMA memiliki kadar air yang lebih rendah dibanding kontrol baik yang disimpan pada suhu kamar maupun AC. Akan tetapi, perlakuan kontrol menunjukkan vigor benih yang lebih baik pada tolok ukur KCT, IV, KST, dan T50 baik pada ruang simpan AC maupun
kamar. Perlakuan pelapisan benih kedelai dengan CMA dapat mempertahankan viabilitas benih dan CMA selama penyimpanan 6 bulan baik pada suhu kamar maupun AC.
Saran
DAFTAR PUSTAKA
Abbott, L.K. and A.D. Robson. 1982. The role of VA mycorrhizae fungi in agriculture and the selection of fungi for inoculation. Aust. J. Agric. Res. 33:389-395.
Acquaah, G. 2001. Principles of Crop Production: Theory, Techniques, and Technology. Pearson Education. New Jersey. 460 p.
Ashworth, S. 2002. Seed to Seed. Seed Savers Exchange, Inc. United States of America. 228 p.
Badan Pusat Statistik. 2011. Data Kedelai 2010. http://www.bps.go.id. [26 Januari 2011].
Bakhtiar.Y. 2002. Selection of vascular mycorrhiza (VAM) fungi, host plants and spore numbers for producing inoculum. J. Biosains dan Bioteknologi Indonesia 2 (1): 36-40.
Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian. 2008. Benih kedelai: sistem dan teknologi produksi. http://pustaka.litbang.deptan.go.id. [20 Febuari 2012].
Bolan, N.S. 1991. A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants. Plant Soil 134:189-207.
Bramasto, Y., K.P. Putri, dan T. Suharti. 2009. Pengaruh cendawan Aspergillus sp. dan Fusarium sp. terhadap viabilitas benih dan pertumbuhan bibit Swietenia macrophylla. Jurnal Penelitian Hutan Tanaman 6 (5):289-295. Brundrett, M., N. Bougher, B. Dell, T. Grove, and N. Malajczuk. 1994. Working
with Mycorrhizas in Forestry and Agriculture. Bernie Dell, Murdoch University. Murdoch, WA. 374 p.
Budiarti, T. dan S. Hadi. 2005. Komersialisasi Varietas Unggul dan Perbenihan Kedelai di Indonesia. Prosiding Seminar Balitkabi. Pusat penelitian dan pengembangan tanaman pangan. Bogor. hal 350-361.
Chalimah, S., Muhadiono, L. Aznam, S. Haran, dan N. T. Mathius. 2007. Perbanyakan Gigaspora sp. dan Acaulospora sp. dengan kultur pot di rumah kaca. Biodiversitas 7 (4):12-19.
Copeland, L.P. and M.B. McDonald. 2001. Principles of Seed Science and Technology, Third Edition. Chapman & Hall. USA. 409 p.
De La Cruz, R.E. 1981. Mycorrhizae Indispensable Allies in Forest Regeneration. Symposium on Forest Regeneration in South East Asia. BIOTROP. Bogor. Indonesia.
Direktorat Jenderal Perkebunan. 2010. Pengembangan Metode Formulasi Jamur Mikoriza. http://ditjenbun/deptan.go.id. [5 Febuari 2012].
Faisal. 2005. Perlakuan Benih Menggunakan Matriconditioning plus Inokulan Mikroba untuk Meningkatkan Efisiensi Pemupukan Nitrogen, Pertumbuhan dan Hasil Tanaman Kedelai. Tesis. Program Pascasarjana, Institut Pertanian Bogor. Bogor. 79 hal.
Goenadi, D.H., R. Saraswati, N.N. Nganro, dan J.A.S. Adiningsih. 1995. Nutrient solubilizing and aggregate-stabilizing microbes isolate from selected humic tropic soil. Menara Perkebunan 63(2):133-185.
Gomez, K.A. dan A.A Gomez. 1995. Prosedur Statistika untuk Penelitian Pertanian (diterjemahkan dari : Statistical Procedures for Agricultural Research, penerjemah : E. Sjamsudin dan J.S. Baharsjah). Penerbit Universitas Indonesia. Jakarta. 698 hal.
Guntoro, D., M.A. Chozin, B. Tjahjono, dan I. Mansur. 2006. Pemanfaatan cendawan mikoriza arbuskula dan bakteri Azospirillum sp. untuk meningkatkan efisiensi pemupukan pada Turfgrass. Buletin Agronomi 34(1) : 62-70.
Hapsoh, S. Yahya, B.S. Purwoko, dan A.S. Hanafiah. 2005. Hasil beberapa genotip kedelai yang diinokulasi MVA pada berbagai tingkat cekaman kekeringan tanah ultisol. Jurnal Ilmiah 40:77-83.
Harrington, J.F. 1972. Seed storage and longevity, p. 145-246. In T.T. Kozlowski (Ed.). Seed Biology Vol. III. Academic Press. New York.
Husnayati, N. 2011. Pengaruh Tingkat Kemasakan Benih dan Periode Simpan terhadap Viabilitas dan Vigor Benih Kacang Bogor (Vigna subterranea (L). Verdc.) pada Ruang Simpan AC dan Kamar. Skripsi. Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Bogor. 40 hal. <