EFEK PAKAN MENGANDUNG ISOFLAVON KEDELAI
TERHADAP BOBOT BADAN DAN KADAR
ANDROGEN SERUM TIKUS JANTAN
BINA PERTAMASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
BINA PERTAMASARI.
Efek
Pakan Mengandung Isoflavon Kedelai terhadap
Bobot Badan dan Kadar Androgen Serum Tikus Jantan. Dibimbing oleh EDY
DJAUHARI PURWAKUSUMAH dan WARAS NURCHOLIS.
Isoflavon merupakan fitoestrogen yang dapat memberikan efek estrogenik
dan atau antiestrogenik. Kedelai adalah sumber utama penghasil isoflavon.
Isoflavon kedelai diduga antiestrogenik terhadap bobot badan dan kadar androgen
tikus jantan. Penelitian ini bertujuan menguji pengaruh pemberian pakan
mengandung isoflavon kedelai terhadap bobot badan dan kadar androgen tikus
jantan
Sprague-Dawley
. Dua puluh delapan ekor tikus dibagi ke dalam 7
kelompok yaitu satu kelompok kontrol negatif dan enam kelompok perlakuan
(tiga kelompok diberikan pakan isoflavon serbuk kacang kedelai (K1, K2, K3)
dan tiga kelompok diberikan pakan isolat kacang kedelai (I1, I2, I3)). Parameter
yang diamati meliputi bobot badan, konsumsi-efisiensi pakan, berat feses, dan
kadar androgen serum (testosteron dan dihidrotestosteron). Hasil penelitian
menunjukkan bahwa pemberian pakan isoflavon K2, K3, I1, I2, dan I3
berpengaruh meningkatkan bobot badan tikus jantan sedangkan pakan K1
menurunkan. Semua pakan isoflavon kedelai dalam penelitian ini berpengaruh
signifikan (p<0.05) menurunkan kadar androgen testosteron serum. Presentase
rata-rata penurunan testosteron tertinggi adalah kelompok K2 (95.11%), yang
diamati pada kelompok tikus yang diberi pakan K2 sedangkan persentase terendah
adalah 16.24%, yang diamati pada kelompok pakan I2. Namun, setiap pakan
isoflavon kedelai dalam penelitian ini berpengaruh tidak signifikan (p>0.05)
meningkatkan kadar androgen dihidrotestosteron. Persentase rata-rata tertinggi
dari peningkatan tersebut diamati pada kelompok pakan K2 (325.44%), dan
terendah adalah pada kelompok pakan K1 (175.05%).
ABSTRACT
BINA PERTAMASARI.
The Effect of Soybean Isoflavone Containing Feed
against Serum Androgen Level of Male Rats. Under supervision of EDY
DJAUHARI PURWAKUSUMAH and WARAS NURCHOLIS.
Isoflavone is a phytoestrogen. It can trigger both of estrogenic and
antiestrogenic effects. Soybean was known as main source of isoflavone. It was
suspected that soybean isovlavone had an antiestrogenic effect against body
weight and androgen level of male rats. The objective of this research was to
examine the influence of soybean isoflavone feeding against the body weight and
androgen level of
Sprague-Dawley
male rats. Twenty eight rats were divided into
seven groups which consist of one negative control group and six experimental
groups (three groups were given soybean powder feedings (K1, K2, and K3) and
three groups on soybean isolate feedings (I1, I2, and I3). The examined
parameters were body weight, feeding consumption-efficiency, feces weight, and
serum androgen levels (testosterone and dihydrotestosterone). The result showed
that K2, K3, I1, I2, and I3 feeding increased body weight of male rats, whereas
K1 feeding decreased them. The isoflavones used in this research has significantly
reduced (p<0.05) androgen testosterone serum level. The highest reduction
average percentage was on group K2 (95.11%), whiles the lowest percentage, on
the other hand (16.24%) was observed on the group of I2 feeding. However, each
soybean isoflavone-containing feed has insignificantly increased (p>0.05)
androgen dihydrotestosterone. The highest average percentage of this increase
was seen at the group of K2 feeding (325.44%), while the lowest one was on
group of K1 feeding (175.05%).
EFEK PAKAN MENGANDUNG ISOFLAVON KEDELAI
TERHADAP BOBOT BADAN DAN KADAR
ANDROGEN SERUM TIKUS JANTAN
BINA PERTAMASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi :
r
Efek Pakan Mengandung Isoflavon Kedelai terhadap Bobot
Badan dan Kadar Androgen Serum Tikus Jantan
Nama
: Bina Pertamasari
NIM
: G84070008
Disetujui,
Komisi Pembimbing
Drs. Edy Djauhari Purwakusumah, M.Si
Waras Nurcholis, S.Si, M.Si
Ketua
Anggota
Diketahui,
Dr. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
PRAKATA
Assalamu’alaikum Wr. Wb.
Puji dan syukur Penulis panjatkan kehadirat Allah SWT yang atas rahmat,
nikmat, dan karunia-Nya sehingga memberikan kekuatan bagi Penulis untuk dapat
menyelesaikan penelitian dan penulisan karya ilmiah yang diberi judul Efek
Pakan Mengandung Isoflavon Kedelai terhadap Bobot Badan dan Kadar
Androgen Serum Tikus Jantan. Penelitian ini dilaksanakan mulai bulan April
2011 sampai dengan Desember 2011 di
Animal Laboratory
, Pusat Studi
Biofarmaka dan Laboratorium Biokimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Edy Djauhari dan Bapak
Waras Nurcholis selaku komisi pembimbing atas bimbingan, saran, dan motivasi
yang telah diberikan. Ungkapan terima kasih terdalam penulis sampaikan kedua
orang tua Penulis Baban Aswin (alm.) dan Rina Suminarsih, S.Pd, M.Pd, serta
kedua adik Penulis Deta Lestari dan Tiray Winandasari yang selalu memberikan
kasih sayang, doa, dan dukungan bagi Penulis. Terima kasih pula kepada Elsa,
Kurnia, Danio selaku rekan kerja, Bapak Aulia, Ibu Susi, dan Ibu Salina, yang
telah memberikan bantuan. Akhir kata, penulis berharap karya ilmiah ini dapat
berguna bagi Penulis sendiri maupun bagi kemajuan ilmu pengetahuan.
Wassalamu’alaikum Wr. Wb.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada 1 Oktober 1989 dari ayah Baban
Aswin (alm.) dan ibu Rina Suminarsih, S.Pd, M.Pd. Penulis merupakan anak
pertama dari tiga bersaudara. Tahun 2007, Penulis lulus dari SMA Negeri 1
Cicurug dan di tahun yang sama Penulis diterima di Institut Pertanian Bogor (IPB)
melalui undangan seleksi masuk (USMI) di Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama perkuliahan, penulis pernah aktif di sejumlah unit kegiatan
mahasiswa (UKM) dan organisasi kemahasiswaan. Tahun 2007-2008 Penulis
menjadi staf
human resources development
(HRD) Century IPB. Penulis di tahun
2008-2009 aktif di Badan Eksekutif Mahasiswa Keluarga Mahasiswa (BEM KM)
IPB menjadi staf Kementerian Pendidikan, dan dilanjutkan pada tahun 2009-2010.
Selain itu di tahun yang sama (2008-2009), Penulis juga aktif di Himpunan
Profesi
Community of Research and Education in Biochemistry
(CREBs) sebagai
staf divisi Bioanalisis. Tahun 2010-2011 Penulis menjadi sekretaris kementerian
di Kementrian Pengembangan Potensi Sumber Daya Manusia (PPSDM) BEM
KM IPB.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA... 1
Kedelai ... 1
Isoflavon ... 2
Bobot Badan ... 4
Estrogenik dan Antiestrogenik ... 4
Androgen ... 4
Hewan Coba ... 6
Enzym-Linked Immunosorbent Assay
(ELISA) ... 7
BAHAN DAN METODE ... 7
Bahan dan Alat ... 7
Metode ... 7
HASIL DAN PEMBAHASAN ... 9
Pengaruh Perlakuan Pemberian Pakan terhadap Bobot Badan Hewan Coba .... 9
Pengaruh Perlakuan Pemberian Pakan terhadap Kadar Testosteron dan
dihidrotestosteron Hewan Coba ... 13
SIMPULAN DAN SARAN ... 17
Simpulan ... 17
Saran ... 18
DAFTAR PUSTAKA ... 18
DAFTAR TABEL
Halaman
1 Komposisi zat gizi kedelai 100 gram bahan kering ... 2
2 Kadar isoflavon pada berbagai bahan makanan ... 3
3 Kadar protein pakan perlakuan ... 8
4 Bobot badan, konsumsi pakan, efisiensi pakan, dan berat feses ... 13
5 Kadar testosteron dan DHT ... 17
DAFTAR GAMBAR
Halaman
1 Tanaman kedelai ... 2
2 Biosintesis isoflavon ... 3
3 Biosintesis androgen ... 5
4 Tikus
Sprague-Dawley
... 7
5
ELISA
reader
... 7
6 Bobot badan selama perlakuan ... 10
7 Konsumsi pakan kelompok tikus ... 11
8 Berat feses selama perlakuan ... 12
DAFTAR LAMPIRAN
Halaman
1 Diagram penelitian secara umum ... 24
2 Rancangan percobaan ... 25
3 Komposisi bahan untuk pembuatan 50 kg pakan ... 26
4 Analisis testosteron ... 27
5 Analisis dihidrotestosteron ... 28
6 Koefisien korelasi Pearson bobot badan, konsumsi pakan, efisiensi pakan,
dan berat feses hewan coba ... 29
7 Data bobot badan tikus selama perlakuan ... 30
8 Data konsumsi pakan tikus selama perlakuan ... 31
9 Data berat feses tikus selama perlakuan ... 32
10 Koefisien korelasi Pearson kadar testosteron dan dihidrotestosteron ... 33
11 Hasil analisis statistik kadar testosteron dan dihidrotestosteron... 34
12 Data dan kurva standar testosteron hewan coba ... 35
13 Data dan kurva standar dihidrotestosteron hewan coba ... 37
PENDAHULUAN
Kedelai merupakan komoditas tanaman pangan terpenting ketiga setelah padi dan jagung. Tanaman ini kaya akan protein nabati yang sangat penting dalam rangka peningkatan gizi masyarakat karena aman bagi kesehatan dan murah harganya. Kedelai biasanya dikenal sebagai tanaman pangan dan sayuran. Namun kini diketahui bahwa kedelai juga berkhasiat sebagai obat. Hal ini dikarenakan oleh adanya senyawa bioaktif pada kedelai yang bermanfaat menjaga dan memperbaiki sistem fisiologis, maupun pencegahan penyakit, terutama terdapat pada bagian biji (Asih 2009). Senyawa bioaktif tersebut adalah isoflavon (Okamato et al. 2006). Isoflavon umum ditemukan pada kacang-kacangan dan utama ditemukan pada kedelai (Cornwell et al. 2004).
Isoflavon dikenal sebagai fitoestrogen karena struktur molekul isoflavon mirip dengan struktur estrogen endogen. Hal ini menyebabkan isoflavon dapat berikatan dengan reseptor estrogen (RE), dan mampu memberikan efek estrogenik dan atau efek antiestrogenik (Robertson 2000).
Penelitian banyak menyoroti efek estrogenik isoflavon di antaranya isoflavon dapat membantu meringankan gejala pascamenopause dan melindungi terhadap penyakit kronik, seperti kanker payudara dan endometrium (Anupongsanugool et al. 2005). Namun perlu diketahui isoflavon dapat pula bersifat antiestrogenik. Rendahnya kejadian kanker prostat dan ginekomastia pada pria di negara-negara Asia, seperti Cina dan Jepang dibandingkan dengan kejadian di Amerika, diduga akibat efek antiestrogenik dari isoflavon kedelai yang dikonsumsi tinggi di Asia (White et al. 2010).
Efek antiestrogenik isoflavon pada pria berbentuk kompetisi isoflavon dengan estrogen endogen dalam mengikat RE. Keterikatan isoflavon dengan RE mengakibatkan estrogen endogen tinggi. Normalnya ketika estrogen endogen tinggi, akan terjadi umpan balik negatif sekresi
gonadotropin releasing hormone (GnRH) hipotalamus, yang selanjutnya mengurangi sensivitas hipofisis anterior dalam memproduksi luteinizing hormone (LH), kemudian menurunkan sintesis testosteron di sel Leydig, menyebabkan kadar testosteron berkurang, dan menghambat aromatisasi testosteron (Hoffman et al. 2009). Namun, ketika isoflavon berikatan dengan RE, isoflavon diduga memicu terjadinya inhibisi
mekanisme umpan balik negatif estrogen terhadap GnRH (Shabsigh et al. 2005).
Isoflavon berikatan dengan RE, diduga mencegah estrogen dari membatasi pelepasan GnRH. GnRH kemudian menstimulasi hipofisis anterior untuk melepaskan LH, sehingga terjadi peningkatan sintesis testosteron oleh testis, dan terjadi peningkatan kadar testosteron (Shabsigh et al. 2005). Menurut Astuti dan Sutyarso (2010), pemberian tepung kedelai kaya isoflavon dengan dosis isoflavon 1.5 mg/ekor/hari terhadap tikus jantan strain Sprague-Dawley
dapat menyebabkan peningkatan kadar hormon testosteron serum.
Efek antiestrogenik isoflavon lainnya adalah isoflavon diduga dapat meningkatkan katabolisme sel lemak sehingga dapat menurunkan kadar lemak tubuh, dan berakibat pada turunnya bobot badan (Tolman et al. 2008). Hal ini bermanfaat karena obesitas dan kelebihan berat badan merupakan faktor risiko penyakit kronis, termasuk diabetes tipe 2, penyakit kardiovaskular, serta rendahnya kadar testosteron (Kuntana 2009). Menurut Zhang et al. (2009) konsumsi isoflavon kedelai dosis 1.5 dan 4.5 g/kg bb/ekor/hari dapat menyebabkan penurunan bobot badan pada tikus jantan Sprague-Dawley. Namun penelitian mengenai pengaruh berbagai macam pakan isoflavon kedelai (serbuk kacang kedelai dan isolat kacang kedelai) terhadap bobot badan dan kadar androgen tikus jantan Sprague-Dawley belum dilakukan.
Penelitian ini bertujuan menguji pengaruh pemberian pakan mengandung isoflavon kedelai terhadap bobot badan dan kadar androgen tikus jantan Sprague-Dawley. Hipotesis penelitian ini adalah pemberian pakan mengandung isoflavon kedelai mampu menurunkan bobot badan, serta meningkatkan kadar testosteron dan dihidrotestosteron tikus jantan Sprague-Dawley. Penelitian ini diharapkan memberikan informasi kepada masyarakat mengenai manfaat isoflavon kedelai sehingga dapat dijadikan pengobatan alternatif penyakit kekurangan androgen.
TINJAUAN PUSTAKA
Kedelai
daerah dengan ketinggian maksimal 500 m di atas permukaan laut. Akar kedelai adalah akar tunggang dengan bintil-bintil yang menempel pada akar yang merupakan kumpulan bakteri Rhizobium. Batang kedelai beruas-ruas 3-6 cm, cabang tumbuh tegak, berdaun lebar, dan tinggi berkisar antara 30-100 cm. Daun kedelai termasuk daun majemuk dengan tiga buah anak daun, bentuk oval, dan ujung lancip. Bunga kedelai berbentuk seperti kupu-kupu, warnanya ungu atau putih, dan muncul pada ketiak daun. Buah kedelai berbentuk polong, berisi 4 biji setiap polong, dan warna polong kuning kecoklatan atau abu-abu (Marsudi 2007). Biji kedelai dibedakan atas tiga warna, yaitu kuning, hitam, dan hijau, yang secara kimia tidak terdapat perbedaan komposisi gizi (Astawan 2009).
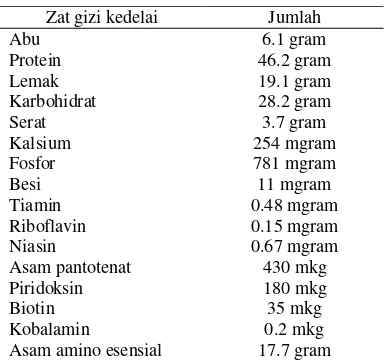
Kedelai mengandung sekitar 35-45% protein, 12-30% karbohidrat, 18-32% lemak, dan 7% air per 100 gram (Ristek 2012), serta sejumlah vitamin, yakni vitamin B kompleks (Fafioye et al. 2005), mineral seperti kalsium, tembaga, besi, magnesium, mangan, kalium, natrium, seng (Ibrahim et al. 2008), dan serat (Tabel 1). Kedelai memiliki 8 asam amino esensial yaitu isoleusin, leusin, lisin, treonin, valin, metionin, fenilalanin, dan triptofan, dengan asam amino pembatas metionin dan sistein, serta kandungan asam amino yang cukup tinggi lisin dan treonin. Kandungan lisin yang tinggi dalam kedelai sangat menguntungkan, karena pada umumnya makanan pokok sangat miskin akan lisin. Kombinasi kedelai dengan sumber karbohidrat seperti beras, jagung, sagu, terigu, dan singkong adalah sangat baik untuk kelengkapan gizi (Astawan 2009). Kedelai juga kaya akan asam amino glisin dan arginin yang berperan aktif menurunkan kadar kolesterol, rendah kandungan asam amino bersulfur yang dapat mencegah osteoporosis, dan komponen antikanker antara lain inhibitor protease, fitat, saponin, fitosterol, dan asam lemak omega-3 (Silalahi 2006).
Gambar 1 Tanaman kedelai (Deptan 2012)
Tabel 1 Komposisi zat gizi kedelai dalam 100 gram bahan kering
Zat gizi kedelai Jumlah
Abu 6.1 gram
Protein 46.2 gram
Lemak 19.1 gram
Karbohidrat 28.2 gram
Serat 3.7 gram
Kalsium 254 mgram
Fosfor 781 mgram
Besi 11 mgram
Tiamin 0.48 mgram
Riboflavin 0.15 mgram
Niasin 0.67 mgram
Asam pantotenat 430 mkg
Piridoksin 180 mkg
Biotin 35 mkg
Kobalamin 0.2 mkg
Asam amino esensial 17.7 gram Sumber: Astawan (2009)
Isoflavon
Isoflavon termasuk golongan senyawa flavonoid, salah satu metabolit sekunder tanaman, dicirikan sebagai deretan senyawa C6-C3-C6, dan melimpah pada tanaman polong-polongan (Gueven 2011). Isoflavon pada tanaman berfungsi sebagai fitoaleksin (Robinson 1995). Fitoaleksin adalah suatu senyawa antimikrobial yang dibiosintesis dan diakumulasikan oleh tanaman setelah terjadi infeksi dari mikroorganisme patogen, terpapar senyawa kimia tertentu, atau iradiasi dengan sinar ultraviolet yang berguna mencegah patogenisasi. Isoflavon juga merupakan persinyalan yang dibentuk oleh kedelai guna menarik bakteri rizhobial (Barnes 2010). Biosintesis isoflavon ditunjukkan pada Gambar 2.
Naringenin kalkon dan isoliquiritigenin kemudian dikonversi ke flavanon. Naringenin kalkon dikonversi ke naringenin flavanon dan isoliquiritigenin dikonversi ke liquiritigenin oleh enzim kalkon isomerase (CHI). Migrasi aril untuk menciptakan isoflavon dimediasi oleh isoflavon sintase (IFS). Reaksi ini juga membutuhkan reduksi nicotinamide adenine dinucleotide phosphate (NADPH) dan molekul oksigen sehingga menghasilkan hidroksiisoflavanon. Hasil reaksi dari IFS, 2-hidroksiisoflavanon, sangat tidak stabil dan mengalami dehidrasi dengan membentuk ikatan ganda antara C2 dan C3 oleh dehidratase untuk membentuk genistein atau daidzein (Dhaubhadel et al. 2003).
Empat bentuk isoflavon pada kedelai, yaitu aglikon (bentuk bebas) yang terdiri atas genistein, daidzein, dan glisitein, bentuk glikosida yang beranggotakan genistin, daidzin, dan glisetin, bentuk asetilglikosida yang terdiri atas asetilgenistin, 6''-O-asetildaidzin, dan 6''-O-asetilglisetin, dan bentuk malonilglikosida yang terbagi atas malonilgenistin, 6''-O malonildaidzin, 6''-O-malonilglisetin. Isoflavon pada olahan kedelai non-fermentasi umumnya berada dalam bentuk glikosida, yaitu 64 % genistin, 23 % daidzin, dan 13 % glisetin. Bentuk fermentasi kedelai seperti tempe, isoflavon berada dalam bentuk aglikon (Astawan 2009).
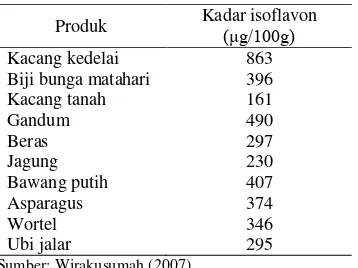
Tabel 2 Kadar isoflavon pada berbagai bahan makanan
Produk Kadar isoflavon (µg/100g)
Kacang kedelai 863 Biji bunga matahari 396 Kacang tanah 161
Gandum 490
Beras 297
Jagung 230
Bawang putih 407
Asparagus 374
Wortel 346
Ubi jalar 295
Sumber: Wirakusumah (2007)
Kedelai serta produk olahannya merupakan sumber isoflavon, dan hanya sejumlah kecil ditemukan di tanaman lain (Tabel 2) (Barnes 2010). Konsumsi isoflavon dari kedelai diketahui dapat melindungi terhadap penyakit yang berkaitan dengan usia misalnya penyakit jantung dan osteoporosis, kanker tertentu misalnya payudara dan prostat, dan gejala postmenopausal misalnya
hot flushes (Lephart 2004).
Telah diketahui berbagai teknik pengolahan kedelai utuh. Tempe, tauco, tahu, susu kedelai, kecap merupakan produk hasil olahan kedelai. Proses pengekstrakan minyak dari kedelai akan menghasilkan bungkil kedelai dengan kadar protein hingga 40%, dan
dapat diolah lebih lanjut menjadi konsentrat protein kedelai atau isolat protein kedelai. Isolat protein kedelai merupakan salah satu hasil isolasi protein dari kedelai yang memiliki kemurnian protein paling tinggi (di atas 90% berdasarkan berat kering) sehingga produk ini hampir terbebas dari zat-zat lain, seperti karbohidrat, serat, dan lemak (Permadi 2011).
Menurut Astawan (2009), isolat protein kedelai dibuat dengan cara melarutkan protein tepung kedelai dengan larutan basa encer pada pH 7-9, serta membuang endapan tidak larutnya dengan cara pemusingan atau penyaringan. Ekstrak yang didapat kemudian diasamkan sampai pH-nya mencapai 4.5 agar terjadi pengendapan protein. Endapan protein ini selanjutnya dinetralkan dengan basa dan dikeringkan dengan pengering semprot (spray dryer) sampai diperoleh bentuk tepung. Jadi, pada prinsipnya isolat protein kedelai diperoleh dengan cara pengendapan seluruh protein pada titik isoelektrik yaitu pH sehingga seluruh protein menggumpal. Isolat protein kedelai telah banyak diaplikasikan dalam industri pangan seperti produk daging tiruan, karena isolat protein kedelai memiliki sifat fungsional (di luar sifat nutrisi) yang dapat menyumbangkan karakteristik yang diinginkan pada makanan.
Bobot Badan
Bobot badan adalah ukuran tubuh dalam sisi beratnya yang ditimbang dalam keadaan tanpa perlengkapan apapun. Bobot badan diukur dengan alat ukur bobot badan dengan satuan gram (g) atau kilogram (kg). Bobot badan merupakan ukuran yang lazim atau sering dipakai untuk menilai kesehatan atau keadaan gizi. Bobot badan diketahui maka akan dapat memperkirakan tingkat kesehatan atau gizi. Bobot badan dianjurkan untuk mengukur kesehatan dan keadaan gizi karena mudah dilihat perubahannya dalam waktu singkat, memberikan gambaran keadaan gizi pada saat sekarang dan kesehatan bila dilakukan secara periodik, ketelitian pengukuran tidak dipengaruhi oleh keterampilan yang mengukur, dan alat ukur mudah diperoleh (Muntaha 2011).
Pertumbuhan bobot badan dapat dikatakan secara sederhana adalah perubahan ukuran yang meliputi perubahan berat, bentuk, dimensi linear, dan komposisi tubuh, termasuk perubahan komponen-komponen tubuh seperti otot, lemak, tulang, dan organ, serta komponen-komponen kimia, terutama air, lemak, protein, dan abu. Faktor jenis kelamin,
hormon, kastrasi, serta genotif mempengaruhi pertumbuhan bobot badan. Konsumsi protein dan energi yang lebih tinggi akan menghasilkan laju pertumbuhan bobot badan yang lebih cepat (Soeparno 1992).
Estrogenik dan Antiestrogenik
Estrogen diproduksi dalam ovarium dan testis. Reseptor estrogen berada di inti, sebagian kecil (2-3%) berada pada membran sel, dan membentuk dimer ketika berikatan dengan estrogen. Dimer kemudian berinteraksi dengan elemen reseptor estrogen (ERE) yang mengatur transkripsi gen responsif estrogen untuk menghasilkan efek estrogenik atau agonis estrogen. Bentuk dominan estrogen endogen dalam tubuh adalah 17β-estradiol, meskipun senyawa yang dapat menginduksi dimerisasi reseptor estrogen, dan selanjutnya mengikat ERE, bisa dianggap estrogen. Efek antiestrogenik atau antagonis estrogen dapat terjadi ketika senyawa mampu dapat berikatan dengan reseptor estrogen namun menghambat respon estrogen dengan cara pembentukan dimer tidak terjadi atau konfigurasi yang benar untuk mengaktifkan ERE tidak tercapai (Robertson 2000). Beberapa senyawa bertindak sebagai estrogenik dan juga antiestrogenik disebut sebagai selektif estrogen receptor modulator (SERM) (Vissac-Sabatier 2003).
Senyawa-senyawa SERM secara struktural mirip dengan 17β-estradiol sehingga molekul-molekul senyawa yang mirip dengan estradiol ini dianggap memiliki aktivitas agonis sekaligus antagonis estrogen (Vissac-Sabatier 2003). Antiestrogen tamoxifen, sebagai, contoh bertindak sebagai antiestrogenik dalam jaringan payudara tetapi sebagai estrogenik dalam rahim, tulang, dan sistem pembuluh darah (Cornwell et al. 2004).
Androgen
Biosintesis androgen memerlukan kolesterol sebagai prekursornya. Kolesterol dapat disintesis di dalam kelenjar andrenal atau diambil dari plasma darah. Kolesterol yang diambil dari plasma darah memerlukan
high density lipoprotein (HDL), sebagai komponen plasma darah yang memberikan kolesterol kepada kelenjar adrenal. Pengambilan kolesterol dari HDL dipacu oleh
adrenocorticotropic hormone (ACTH) (Kapsul 2007).
Kolesterol dengan demikian jika diambil dari darah, sintesis kolesterol oleh kelenjar adrenal dihambat tetapi jika pengambilan kolesterol dari plasma darah menurun, sintesis kolesterol oleh kelenjar adrenal meningkat. Bila kolesterol tidak segera digunakan untuk sintesis androgen dan hormon steroid lainnya, maka kolesterol disimpan di dalam kelenjar adrenal sebagai ester kolesterol. Ester kolesterol yang akan digunakan untuk sintesis androgen atau steroid lainnya dihidrolisis oleh hidrolase ester sterol yang diaktifkan oleh fosforilasi melalui protein kinase yang kerjanya bergantung pada cyclic adenosine monophosphate (cAMP) (Kapsul 2007).
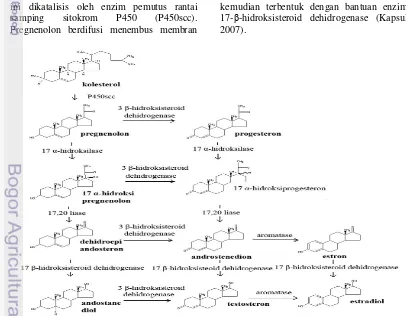
Langkah awal dalam jalur biosintesis testosteron tersebut adalah konversi C27 kolesterol ke C21 steroid pregnenolon. Reaksi ini dikatalisis oleh enzim pemutus rantai samping sitokrom P450 (P450scc). Pregnenolon berdifusi menembus membran
mitokondria dengan bantuan steroidogenic acute regulatory protein (StAR) dan selanjutnya dimetabolisme oleh enzim yang ada di retikulum endoplasma halus. Pregnenolon dalam sel Leydig dikonversi ke progesteron oleh kerja enzim 3-β-hidroksisteroid dehidrogenase (3β HSD) (Kapsul 2007).
Enzim 17-α-hidroksilase mengkatalisis pengubahan progesteron menjadi 17-α-hidroksiprogesteron, yang selanjutnya diubah menjadi androstenedion, prekursor testosteron, oleh enzim C17,20–liase. Androstenedion kemudian dikatalisis oleh 17–
β-hidroksisteroid dehidrogenase menjadi
testosteron. Sel Leydig juga mengekspresikan sitokrom P450 aromatase, yang mengkatalisis aromatisasi dari testosteron ke estradiol (Kapsul 2007).
Androgen juga memiliki jalur biosintesis lain, tidak melalui progesteron tetapi melalui dehidroepiandrosteron. Pregnenolon yang terbentuk dari kolesterol diubah menjadi 17-α-hidroksipregnenolon dengan bantuan enzim 17-α-hidroksilase. 17-α-hidroksipregnenolon selanjutnya diubah oleh C17,20–liase menjadi dehidroepiandrosteron, dan androstenedion terbentuk dengan bantuan enzim 3β -hidroksisteroid dehidrogenase. Testosteron kemudian terbentuk dengan bantuan enzim 17-β-hidroksisteroid dehidrogenase (Kapsul 2007).
Tiga komponen penting dalam produksi androgen dalam sistem reproduksi pria yaitu hipotalamus, hipofisis anterior, dan testis, yang membentuk sistem yang disebut dengan hipotalamus-hipofisis-gonad atau HHG (Emanuele dan Emanuele 1998). GnRH dari hipotalamus menstimulasi hipofisis anterior untuk mensekresikan FSH dan LH. FSH bertugas menstimulasi sel Sertoli untuk memproduksi androgen binding protein
(ABP), dengan adanya ABP, testosteron mendukung spermatogonesis, sementara LH bertugas menstimulasi sel Leydig untuk memproduksi testosteron. Jika testis mulai memproduksi testosteron terlalu banyak, hal ini dirasakan oleh otak, dan hipotalamus akan mengirimkan sinyal GnRH ke hipofisis untuk mereduksi sintesis LH. LH berkurang pada gilirannya memicu produksi perlambatan sintesis testosteron. Jika testis mulai memproduksi testosteron terlalu sedikit, hipotalamus akan mengirimkan sinyal ke kelenjar hipofisis untuk membuat LH berlebih, yang merangsang testis untuk membuat testosteron lebih banyak (Cunningham et al. 2003).
Hewan Coba
Hewan percobaan adalah hewan yang sengaja dipelihara dan diternakkan untuk dipakai sebagai hewan model dalam mempelajari dan mengembangkan berbagai bidang ilmu dalam skala penelitian atau pengamatan laboratorik (Malole dan Pramono 1989). Syarat hewan sebagai hewan coba adalah sedapat mungkin hewan percobaan bebas dari mikroorganisme patogen, mempunyai kemampuan dalam memberikan reaksi imunitas yang baik, kepekaan terhadap sesuatu penyakit, performa atau prestasi hewan percobaan yang dikaitkan dengan sifat genetiknya (Sulaksono 1987). Hewan percobaan terbagi atas 5 kelompok, yaitu hewan laboratorium berukuran kecil, seperti mencit, tikus, dan kelinci, karnivora, seperti kucing dan anjing, primata, seperti Macaca
dan babon, kelompok domestik besar, seperti domba, sapi, dan kelompok hewan lainnya, seperti unggas (Wolfensohn dan Lloyd 1998).
Pemilihan hewan percobaan untuk penelitian biasanya didasarkan pada tujuan penelitian yang akan dilakukan. Kelinci misalnya merupakan hewan percobaan yang cocok dan paling sering digunakan untuk penelitian tentang hiperkolesterolemia karena kelinci memiliki cadangan lemak tubuh yang banyak (Sirois 2005) dan peka terhadap kolesterol (Muliasari 2009). Berbeda dengan
anjing, kucing, dan tikus yang resisten terhadap pakan kolesterol (Sirois 2005).
Primata merupakan hewan yang sangat cocok digunakan dalam penelitian ilmiah yang ada kaitannya dengan manusia karena kekerabatan, serta kemiripan anatomis, fisiologis, dan patologis. Namun penggunaan hewan coba primata menemui banyak kendala seperti sulitnya pengadaan hewan, perawatan yang rumit dan mahal, penanganan yang sulit, serta adanya bahaya penyakit menular (Sirois 2005). Hewan percobaan lain yang memiliki karakter fisiologis mirip dengan manusia maupun mamalia lain adalah tikus. Tikus terdiri atas dua spesies, yaitu tikus hitam (Rattus rattus) dan tikus putih (Rattus norvegicus). Spesies yang sering dipakai sebagai hewan model pada penelitian mengenai mamalia adalah Rattus norvegicus
(Malole dan Pramono 1989).
Rattus norvegicus merupakan kingdom Animalia, famili Muridae, sub famili Murinae, ordo Rodentia, sub ordo Myomorpha, genus Rattus, dan spesies Rattus norvegicus. Tikus putih memiliki 5 macam basic stock yaitu
Long Evans, Osborne Mendel, Sherman,
Sprague-Dawley, dan Wistar (Lane dan Petter 1976). Rattus norvegicus memiliki ciri rambut berwarna putih dan mata berwarna merah (Malole dan Pramono 1989). Tikus yang baru lahir biasanya memiliki berat badan 5-6 gram dan memiliki kecepatan tumbuh 5 gram/hari. Berat badan tikus dewasa rata-rata 200-250 gram, tetapi bervariasi tergantung pada galurnya. Tikus jantan tua dapat mencapai 500 gram dan tikus betina jarang lebih dari 350 gram. Galur Sprague-Dawley paling besar hampir sebesar tikus liar (Gambar 4) (Smith dan Mangkoewidjojo 1988).
Gambar 4 Tikus Sprague-Dawley
Tikus Sprague-Dawley memiliki ciri-ciri berwarna albino putih, berkepala kecil, dan ekornya lebih panjang daripada badannya. Keuntungan utamanya adalah ketenangan dan kemudahan penanganannya. Dua sifat utama yang membedakan tikus dengan hewan percobaan lain, yaitu tikus tidak dapat muntah karena struktur anatomi yang tidak lazim pada tempat bermuara esofagus ke dalam lambung sehingga mempermudah dalam perlakuan pencekokan, dan tidak mempunyai kantong empedu (Smith dan Mangkoewidjojo 1988).
Enzym-linked immunosobent assay (ELISA)
ELISA merupakan suatu metode uji serologis. Prinsip kerja dari ELISA adalah adanya ikatan antigen dengan antibodi spesifik. Ikatan antigen antibodi akan dilabel dengan enzim dan substrat yang akan memberikan warna, dan dibaca pada ELISA reader (Rasmana 2009). Metode ELISA dibagi 2 jenis teknik yaitu teknik kompetitif dan non kompetitif. Teknik non kompetitif ini dibagi menjadi dua yaitu sandwich dan
indirect. Pemeriksaan hormon biasanya menggunakan teknik kompetitif dan sandwich
(Asihara dan Kasahara 2001).
Keuntungan metode ELISA yaitu sangat sensitif, spesifik, analisisnya cepat, hasil analisis dapat disimpan dalam jangka waktu yang lama, dapat memeriksa beberapa parameter sekaligus, peralatan mudah didapat, dan tidak menggunakan zat radiasi. Kerugian metode ELISA adalah pemeriksaan menggunakan enzim sebagai label cukup kompleks karena aktivitas enzim dipengaruhi oleh berbagai faktor (Asihara dan Kasahara 2001). Hasil uji ELISA dibaca menggunakan
ELISA reader.
ELISA reader adalah jenis spektrofotometer khusus (Gambar 5). Berbeda dengan spektrofotometer konvensional yang memfasilitasi pembacaan pada berbagai panjang gelombang, ELISA reader memiliki filter atau kisi-kisi difraksi yang membatasi rentang panjang gelombang, umumnya antara
400-750 nm (nanometer). Beberapa pembacaan beroperasi dijangkauan ultraviolet dan melakukan analisis antara 340-700 nm. Sistem optik yang banyak digunakan adalah serat optik untuk memasok cahaya ke sumur
microplate berisi sampel. Beberapa ELISA reader juga menggunakan sistem cahaya berkas ganda. Sampel uji diletakkan di plate
khusus. Plate umumnya terdiri atas 8 kolom dengan 12 baris dengan total 96 sumur, namun ada juga plate dengan jumlah sumur yang lebih besar. Lokasi dari sensor optik
ELISA reader bervariasi, ada yang terletak di atas plate sampel atau langsung di bawah sumur plate (WHO 2009).
Gambar 5 ELISA reader
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian adalah kasein, serbuk kacang kedelai, isolat kacang kedelai, minyak jagung, mineral, serat, vitamin, maizena, air, eter, kit ELISA testosteron, dihidrotestosteron, tisu, dan tikus putih jantan galur Sprague-Dawley
berumur ±2 bulan yang diperoleh dari Pusat Studi Biofarmaka, Bogor.
Alat-alat yang digunakan dalam penelitian adalah masker, sarung tangan, kandang ukuran 50x30x10 cm, serbuk kayu, timbangan digital, neraca analitik, tabung reaksi kecil, toples, gunting, pinset, nampan, spoit,
Eppendorf, sentrifus, freezer, mikropipet, pipet multichannel, tip, dan seperangkat alat ELISA.
Metode
Pembuatan Pakan Perlakuan
daidzein bebas, total, genistein bebas, dan total di Southeast Asian Food and Agricultural Science and Technology Center
IPB (SEAFAST Center IPB).
Perlakuan dan Rancangan Percobaan
Penelitian ini menggunakan hewan percobaan berupa tikus putih jantan Sprague-Dawley sebanyak 28 ekor. Tikus ditempatkan dalam kandang berukuran 50x30x10 cm, 1 ekor per kandang, beralaskan serbuk kayu, dengan kondisi cahaya dan ventilasi cukup, dan suhu ruang. Tikus dibagi menjadi 7 kelompok secara acak. Setiap kelompok terdiri atas 4 ekor tikus.
Pemberian perlakuan dilakukan selama 1 bulan. Perlakuan yang digunakan adalah perlakuan pakan. Kelompok kontrol adalah kelompok kontrol negatif yang selama perlakuan diberi pakan kasein dan air. Pakan kasein merupakan pakan yang seluruh kandungan proteinnya bersumber dari kasein dan tanpa mengandung isoflavon. Kelompok lainnya merupakan kelompok perlakuan. Pakan perlakuan merupakan pakan yang masing-masing kandungan protein dan isoflavon bersumber dari masing-masing isoflavon kedelai (serbuk kacang kedelai atau isolat kacang kedelai).
Kelompok K1 diberikan pakan perlakuan serbuk kacang kedelai 100% dan air. Kelompok K2 diberikan pakan perlakuan serbuk kacang kedelai 50% dan air. Kelompok K3 diberikan pakan perlakuan serbuk kacang kedelai 10% dan air. Kelompok I1 diberikan pakan perlakuan isolat kacang kedelai 100% dan air. Kelompok I2 diberikan pakan perlakuan isolat kacang kedelai 50% dan air. Kelompok I3 diberikan pakan perlakuan isolat kacang kedelai 10% dan air.
Pakan 100% merupakan pakan yang seluruh kandungan proteinnya masing-masing dan isoflavonnya bersumber dari masing-masing isoflavon kedelai (serbuk kacang kedelai atau isolat kacang kedelai). Kelompok pakan 50% merupakan pakan yang 50% kandungan proteinnya dan isoflavonnya bersumber dari masing-masing isoflavon kedelai dan 50% bersumber dari kasein. Kelompok 10% merupakan 10% kandungan protein dan isoflavon pakan bersumber dari masing-masing isoflavon kedelai dan 90% dari kasein. Komposisi pakan per kelompok dapat dilihat pada Lampiran 3. Kadar protein pada masing-masing pakan perlakuan ditunjukkan pada Tabel 3. Konsumsi pakan dan berat feses hewan coba ditimbang, dan diamati setiap harinya.
Pengambilan Darah
Pengambilan darah dilakukan melalui pembuluh darah vena ekor. Sebelum pengambilan darah suhu tubuh tikus ditingkatkan terlebih dahulu dengan tikus ditempatkan dibawah terik matahari. Hal ini membantu untuk melebarkan pembuluh darah sebelum perdarahan. Namun tidak boleh terlalu panas karena dapat menyebabkan dehidrasi dan hipertemia. Ekor tikus dibersihkan dengan alkohol 70%. Alkohol berfungsi sebagai disinfeksi ekor (Joslin 2009). Ujung ekor dipotong 1 cm dengan menggunakan gunting. Ketika dibutuhkan penambahan darah, ekor dapat dipotong kembali hanya 2-3 mm. Pemotongan ekor terlalu pendek dapat menyebabkan trauma pada tulang rawan (Hoff 2002). Ekor tikus diurut hingga darah menetes. Tetesan darah ditampung dalam tabung reaksi kecil. Tikus kemudian dikorbankan dengan cara dibius dengan eter, dan dilakukan nekropsi untuk pengambilan darah dari jantung. Darah kemudian didiamkan 15 menit, disentrifus pada 3000 g selama 30 menit, dan diambil serumnya. Serum dimasukkan tabung
Eppendorf dan disimpan -2°C sampai siap dianalisis.
Penentuan Kadar Testosteron
Penentuan kadar testosteron dilakukan dengan menganalisis serum darah tikus percobaan dengan menggunakan kit ELISA. Metode yang digunakan mengacu pada
Innovation Beyond Limits International (IBL International) (2007). Sebanyak 25 µL blanko, standar, dan sampel serum darah tikus masing-masing dimasukkan ke dalam sumur
microtiter plate, ditambahkan masing-masing 200 µL enzim konjugat, kemudian diaduk selama 10 detik. Campuran larutan diinkubasikan selama 60 menit pada suhu ruang (tanpa menutup plat). Isi sumur-sumur dikeluarkan secara cepat, dicuci sebanyak 3 kali dengan menggunakan wash solution (400
µL per sumur). Sumur-sumur diletakkan
secara terbalik pada kertas absorben untuk membuang sisa-sisa tetesan yang ada. Setelah itu ditambahkan 200 µL substrate solution
pada tiap-tiap sumur, kemudian diinkubasikan selama 15 menit pada suhu ruang. Sebanyak
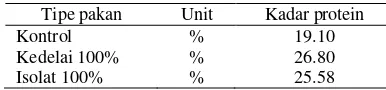
Tabel 3 Kadar protein pakan perlakuan
Tipe pakan Unit Kadar protein
Kontrol % 19.10
100 µL stop solution pada tiap-tiap sumur ditambahkan untuk menghentikan reaksi enzimatik, dan diamkan selama 10 menit. Setelah 10 menit, densitas optik (OD) dibaca pada panjang gelombang 415 nm dengan menggunakan microtiter plate reader.
Penentuan Kadar Dihidrotestosteron
Penentuan kadar dihidrotestosteron didasarkan pada metode IBL International (2006) dengan menganalisis serum darah tikus percobaan dengan menggunakan kit ELISA.
Sebanyak 50 µL dipipet dari masing-masing
blanko, standar, dan sampel serum darah tikus ke dalam sumur berlabel yang sesuai beberapa kali, kemudian 100 µL larutan konjugat dipipet ke dalam tiap-tiap sumur (dengan pipet multichannel). Campuran larutan diinkubasi di dalam plate shaker (sekitar 200 rpm) selama 1 jam dalam suhu ruang. Sumur-sumur dicuci sebanyak 3 kali dengan menggunakan 300 µL bufer pencuci yang telah diencerkan per sumur dan plat diletakkan secara perlahan-lahan pada kertas tisu untuk memastikan bahwa plat benar-benar kering. Setelah itu 150 µL substrat 3,3,5,5-tetrametilbenzidin (TMB) dipipet ke dalam tiap-tiap sumur dengan interval waktu yang tepat, kemudian diinkubasi di dalam plate shaker selama 10-15 menit pada suhu ruang (sampai kalibrator A memiliki warna biru tua untuk mendapatkan nilai OD yang diinginkan). Sebanyak 50 µL stopping solution dipipet ke dalam tiap-tiap sumur dengan interval waktu yang tepat, dan diamkan selama 20 menit. Setelah 20 menit, plat dibaca dengan menggunakan microwell plate reader dengan panjang gelombang 490 nm.
Analisis Data
Analisis data penelitian yang diperoleh mengacu pada Mattjik (2002). Rancangan percobaan yang digunakan adalah rancangan acak lengkap. Model persamaan yang digunakan adalah sebagai berikut:
Yij= µ + τi+ εij Keterangan:
yij= pengamatan perlakuan ke-i dan ulangan ke-j
µ = pengaruh rataan umum
τi = pengaruh perlakuan ke-i, i=1,2,3,4,5,6,7 εij= pengaruh galat perlakuan ke-i dan ulangan ke-j
i1 = kelompok kontrol i2 = kelompok perlakuan K1 i3 = kelompok perlakuan K2 i4 = kelompok perlakuan K3
i5 = kelompok perlakuan I1 i6 = kelompok perlakuan I2 i7 = kelompok perlakuan I3
Data bobot badan, konsumsi pakan, efisiensi pakan, berat feses, dan kadar androgen diolah dengan analisis one-way analysis of varians (ANOVA) pada tingkat
kepercayaan 95% dan taraf α=0.05, dan uji
lanjut yang digunakan adalah uji Duncan. Pengolahan data statistika ini menggunakan perangkat lunak Statistical Product and Service Solution (SPSS) versi 17.0. Korelasi antara data yang diperoleh dihitung menggunakan koefisien korelasi Pearson (r).
HASIL DAN PEMBAHASAN
Pengaruh Perlakuan Pemberian Pakan terhadap Bobot Badan Hewan Coba
Hewan coba yang digunakan pada penelitian ini adalah tikus Sprague-Dawley
jantan berumur ±2 bulan. Tikus betina tidak digunakan karena kondisi hormonal yang berfluktuasi pada waktu beranjak dewasa, sehingga dikhawatirkan akan memberikan respon yang berbeda, dan dapat mempengaruhi hasil penelitian. Selain itu parameter yang diuji pada penelitian ini adalah androgen. Kadar androgen pada betina lebih rendah jika dibandingkan dengan jantan sehingga untuk memudahkan dalam mendapatkan kadar androgen digunakan tikus jantan (Dabbs et al. 1997).
Hewan percobaan yang sehat merupakan faktor penting dan merupakan syarat untuk memenuhi asumsi percobaan. Kondisi hewan yang sehat berguna untuk memperkecil galat percobaan. Bobot badan merupakan parameter yang mudah diukur dan diamati untuk memantau kondisi kesehatan tikus (Tara 2011). Bobot badan tikus rata-rata pada akhir adaptasi atau awal perlakuan (minggu ke-0) sebesar 142.61 gram dengan bobot badan berkisar antara 116-162 gram (Lampiran 7). Menurut lembaga riset Ace Animal (2006) dalam Meutia (2011), bobot badan tikus jenis
Sprague-Dawley pada usia 59-61 hari adalah 275-299 gram. Bobot tikus Sprague-Dawley
penelitian lebih rendah 50.31% yang dilaporkan Ace Animal (2006). Hal ini diduga disebabkan perbedaan kadar protein pada pakan, konsumsi pakan, ataupun faktor genetik tikus percobaan.
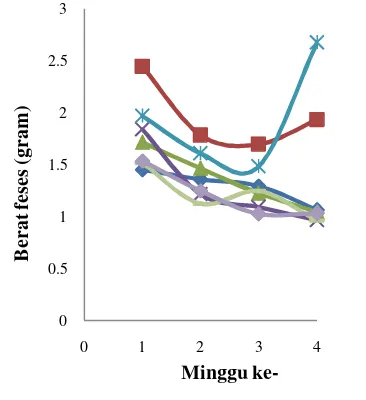
Peningkatan bobot badan terjadi pada K2, K3, dan I1. Kontrol, I2, dan 13 juga mengalami peningkatan bobot badan tetapi fluktuatif. Bobot badan kelompok tikus meningkat dari rata-rata 142.83±10.31 g menjadi 165.29±17.80 g dengan presentase kenaikan sebesar 15.72%. Berbeda dengan kelompok lainnya, kelompok K1 mengalami penurunan bobot badan dengan presentase penurunan sebesar 3.72%, menurun dari rata-rata bobot badan 141.25±14.75 g menjadi 136±20.51 g (Gambar 6). Penurunan bobot badan ini diduga disebabkan tikus mengalami sakit diare selama masa perlakuan. Fluktuasi bobot badan yang terjadi diduga karena nafsu makan yang berbeda-beda antar tikus dengan tikus yang lainnya.
Bobot badan kelompok tikus yang diberikan pakan perlakuan kecuali K1 lebih besar jika dibandingkan dengan bobot badan kelompok tikus yang diberi pakan kontrol (tanpa kandungan isoflavon) (Tabel 4). Hal ini menunjukkan bahwa isoflavon yang terkandung dalam pakan diduga berpengaruh meningkatkan bobot badan. Hasil uji korelasi Pearson juga menunjukkan terdapat korelasi antara kandungan isoflavon pada pakan dengan pertambahan bobot badan kelompok tikus perlakuan pakan kacang kedelai (K) (0.7<r<1) dan isolat kacang kedelai (I) (0.2<r<0.4) (Lampiran 6).
Peningkatan bobot badan yang terjadi pada kelompok tikus perlakuan penelitian ini sejalan dengan hasil penelitian Astuti (1999) yang melaporkan bahwa terjadi peningkatan bobot badan tikus jantan setelah pemberian kedelai dan Suharma (2011) yang menunjukkan bahwa pemberian isolat protein juga memberikan peningkatan bobot badan pada tikus jantan. Namun menurut Weber et al. (2001), konsumsi fitoestrogen justru menurunkan bobot badan tikus Sprague-Dawley jantan dengan meningkatkan aktivitas fisik dan menurunkan kadar leptin. Hal ini didukung juga oleh penelitian Oh et al. (2005) yang menyatakan bahwa konsumsi kedelai pada tikus jantan dapat meningkatkan kadar adiponektin dan berakibat menurunkan bobot badan. Hal ini terjadi karena adiponektin menurunkan resistensi insulin dan menurunkan kadar trigliserida otot dan hati (Yamauchi et al. 2001). Isoflavon juga mampu mendorong lipolisis dan menghambat adipogenesis baik pada kultur sel maupun in vivo sehingga berpotensi mengurangi lemak tubuh (Harmon dan Harp 2001). Hasil penelitian ini berbeda dengan pernyataan diatas. Hal ini diduga karena isoflavon dapat bersifat estrogenik atau antiestrogenik, termasuk pada bobot badan (Tolman et al. 2008).
Korelasi negatif terjadi antara isoflavon yang terkandung pada pakan kacang kedelai dengan pertambahan bobot badan tikus perlakuan pakan kacang kedelai (Lampiran 6). Hal ini menunjukkan bahwa semakin tinggi kandungan isoflavon kacang kedelai semakin menurunkan bobot badan. Hasil ini serupa dengan pengaruh testosteron terhadap bobot badan tikus jantan dan menandakan isoflavon kacang kedelai pada penelitian bersifat antiestrogenik terhadap bobot badan. Menurut Davis et al (2012), testosteron mengurangi bobot badan tikus jantan dengan bertindak antiadipogenik melalui aktivitas lipolisis. Hal ini terjadi karena kemampuan katekolamin meningkat untuk menstimulasi lipolisis pada sel-sel lemak akibat adanya peningkatan reseptor β-adrenergik, aktivitas adenilat siklase, aktivitas protein kinase A, atau hormon sensitif lipase (Oh et al. 2005).
Korelasi antara kandungan isoflavon pada pakan isolat kacang kedelai dengan pertambahan bobot badan kelompok tikus perlakuan pakan isolat kacang kedelai adalah korelasi positif (Lampiran 6). Semakin tinggi kandungan isoflavon pakan isolat kacang kedelai berarti semakin meningkatkan bobot badan. Hal ini serupa dengan pengaruh
0 20 40 60 80 100 120 140 160 180 200
0 1 2 3 4
B o b o t b ad an (gr am ) Minggu
ke-Gambar 6 Bobot badan selama perlakuan ( kontrol, K2, K3, I3, I1, I2, K1). Keterangan: K1=
estrogen terhadap bobot badan tikus betina dan menandakan konsumsi isoflavon isolat kacang kedelai mengakibatkan efek estrogenik pada bobot badan tikus jantan. Menurut Hardjopranjoto (1995) dalam Suprihatin (2008), pada metabolisme tubuh, estrogen meningkatkan sintesis dan sekresi hormon pertumbuhan sehingga dapat menstimulasi pertumbuhan sel-sel dalam tubuh, mempercepat pertambahan bobot badan, dan merangsang kelenjar korteks adrenal untuk meningkatkan metabolisme karena adanya retensi nitrogen yang meningkat. Oh et al. (2005) juga menyatakan bahwa estrogen juga dapat bertindak proandrogenik, meningkatkan jumlah adiposit melalui proliferasi dan diferensiasi sehingga meningkatkan massa jaringan adiposa.
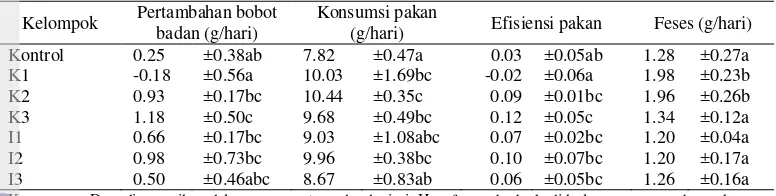
Hasil uji statistika menunjukkan bahwa perlakuan kelompok pakan berpengaruh signifikan terhadap bobot badan (p<0.05) (Tabel 4). Hasil uji lanjut Duncan menunjukkan peningkatan bobot badan K2, K3, I1, I2, I3 dan penurunan bobot badan K1 tidak berbeda signifikan dengan kelompok kontrol sedangkan peningkatan bobot badan K3 berbeda signifikan dengan kontrol. Hal ini menunjukkan bahwa pakan K3 merupakan pakan yang paling berpengaruh meningkatkan bobot badan. Faktor penyebabnya diduga karena tikus K3 memiliki konsumsi pakan dan efisiensi pakan yang tinggi (Tabel 4).
Pertambahan bobot badan dipengaruhi oleh konsumsi pakan, semakin tinggi konsumsi pakan semakin tinggi pula pertambahan bobot badan (Farida et al. 2008). Peningkatan bobot badan kelompok kontrol, K2, K3, dan I3 didukung oleh konsumsi pakan tikus yang juga mengalami peningkatan, walaupun fluktuatif (Gambar 7). Lain halnya pada K1, I1, dan I2, terjadi penurunan bobot badan pada K1 tetapi konsumsi pakan kelompok ini meningkat sedangkan terjadi peningkatan bobot badan pada I1 dan I2 tetapi konsumsi pakan kelompok ini menurun (Gambar 6 dan Gambar 7). Namun konsumsi pakan rata-rata kelompok yang diberikan pakan perlakuan lebih tinggi dibandingkan kelompok yang diberikan pakan kontrol (Tabel 4). Hal ini menunjukkan bahwa isoflavon yang terkandung pada pakan diduga berakibat pula pada pola konsumsi pakan tikus. Uji korelasi Pearson juga menunjukkan bahwa isoflavon yang terkandung pada pakan juga berkorelasi dengan konsumsi pakan kelompok tikus perlakuan kacang kedelai (K) (0.4<r<0.7) dan isolat kacang kedelai (I) (0.2<r<0.4) (Lampiran 6).
Weickert et al. (2006) menunjukkan bahwa estradiol atau senyawa mirip estradiol dapat berinteraksi dengan peptida YY (PYY), suatu hormon yang mempengaruhi rasa kenyang. Konsumsi isoflavon kedelai diketahui meningkatkan konsentrasi PYY dan berakibat menurunkan nafsu makan. Namun hasil penelitian ini tidak sesuai dengan pernyataan di atas. Hal ini diduga disebabkan sifat estrogenik atau antiestrogenik isoflavon terhadap konsumsi pakan (Dixit et al. 2011).
Selain PYY terdapat senyawa lain yang mempengaruhi nafsu makan yaitu ghrelin dan leptin. Ghrelin merupakan hormon yang disekresikan ke dalam darah dan berfungsi merangsang nafsu makan sedangkan leptin merangsang rasa kenyang (Hyde et al. 2010). Keberadaan testosteron dapat meningkatkan konsentrasi ghrelin dan menurunkan leptin, yang berarti testosteron bertindak meningkatkan nafsu makan (Klatz dan Goldman 2004). Hasil ini serupa dengan yang terjadi pada K1, K2, dan K3, dan I1. Kelompok ini mengalami peningkatan nafsu makan atau konsumsi pakan selama perlakuan. Hal ini menunjukkan bahwa pakan K1, K2, dan K3, dan I1, bersifat antiestrogenik terhadap konsumsi pakan tikus. Penurunan bobot badan terjadi pada K1 namun konsumsi pakan pada kelompok ini tinggi. Hal ini diduga karena tikus mengalami sakit diare selama perlakuan. Menurut Harianto (2004), bahaya utama diare adalah
0 2 4 6 8 10 12 14 16
0 1 2 3 4
K o n su m si p ak an (gr am ) Minggu
kematian yang disebabkan karena tubuh banyak kehilangan air dan garam terlarut yang disebut dehidrasi. Dehidrasi yang terjadi pada penderita diare karena usus bekerja tidak sempurna sehingga sebagian besar air dan zat-zat yang terlarut didalamnya dibuang bersama feses sampai akhirnya tubuh kekurangan cairan. Derajat dehidrasi diukur menurut persentase terjadinya penurunan bobot badan selama diare.
Terlihat pada Gambar 8 dan Tabel 4 berat feses K1 tinggi dan meningkat sedangkan kelompok lain berat fesesnya menurun. Selain itu selama penelitian feses kelompok ini juga terlihat lembek, berwarna hijau tua, dan lebih berbau padahal normalnya feses tikus seharusnya berwarna hitam dan padat. Meningkatnya frekuensi feses disertai adanya perubahan bentuk, dan konsistensi feses (Harianto 2004), feses menjadi lembek atau cair menandakan bahwa K1 terkena diare (Adnyana et al. 2004). Kondisi ini terjadi diduga karena zat nutrisi yang terkandung dalam pakan kacang kedelai terutama serat (Mardiah et al. 2006).
Kedelai merupakan bahan makanan yang tinggi serat (Mardiah et al. 2006). Serat kedelai diketahui dapat mempercepat waktu transit makanan (waktu yang diperlukan sejak dimakan sampai dikeluarkan berupa feses) sehingga meningkatkan volume feses. Serat yang terlalu banyak juga merupakan salah satu faktor penyebab diare (Hartiningrum 2010). Serat mempunyai daya serap air yang tinggi. Adanya serat makanan dalam feses menyebabkan feses dapat menyerap air yang banyak sehingga volumenya menjadi besar dan teksturnya menjadi lunak (Mardiah et al. 2006).
Kelompok I1 dan I2 mengalami peningkatkan bobot badan tetapi tidak disertai dengan konsumsi pakan yang mengalami peningkatan melainkan konsumsi pakan kelompok ini menurun (Gambar 6 dan Gambar 7). Hal ini sejalan dengan pengaruh estrogen terhadap bobot badan dan konsumsi pakan. Estrogen dapat menyebabkan peningkatan bobot badan dan bertindak menurunkan nafsu makan. Hal ini dikarenakan adanya leptin, suatu protein yang disekresi oleh sel lemak putih, yang dengan adanya estrogen kadarnya akan meningkat dan berpengaruh mengurangi nafsu (Nirwana et al. 1998).
Kandungan isoflavon pada pakan kacang kedelai maupun isolat kacang kedelai berkorelasi positif dengan konsumsi pakan kelompok tikus perlakuan (Lampiran 6).
Tabel 4 menunjukkan pakan K1 dan K2 juga I1 dan I2 lebih banyak meningkatkan konsumsi pakan tikus dibandingkan K3 atau I3. Berdasarkan hasil uji statistik didapatkan bahwa perlakuan kelompok pakan berpengaruh signifikan terhadap konsumsi pakan (p<0.05) (Tabel 4). Uji lanjut Duncan menunjukkan konsumsi pakan I1 dan I3 tidak berbeda signifikan dengan kontrol sedangkan konsumsi pakan K1, K2, K3, dan I2 berbeda signifikan dengan kontrol. Hal ini menunjukkan bahwa pakan K1, K2, K3, dan I2 merupakan pakan yang paling berpengaruh terhadap konsumsi pakan. Pakan K1, K2, dan K3 berpengaruh meningkatkan konsumsi pakan tikus sedangkan pakan I2 menurunkan. Adapun faktor-faktor lain yang mempengaruhi konsumsi pakan di antaranya keadaan lingkungan, kondisi tikus, serta kondisi pakan (bau, rasa, tekstur dan temperatur) (Rasmada 2008).
Pengamatan efisiensi pakan bertujuan untuk mengetahui kemampuan hewan coba untuk secara efisien memanfaatkan pakan. Efisiensi pakan merupakan perbandingan antara pertambahan bobot badan dengan jumlah konsumsi pakan dalam jangka waktu tertentu (Farida et al. 2008). K3 memiliki efisiensi pakan tertinggi sebesar 12, disusul dengan I2, K2, I1, I3, dan kontrol. K1 memiliki efisiensi pakan yang rendah bahkan bernilai minus (Tabel 4). Ketidakefisienan pakan K1 disebabkan karena tikus mengalami sakit diare selama masa perlakuan.
0 0.5 1 1.5 2 2.5 3
0 1 2 3 4
B e r at fe se s (gr am ) Minggu
ke-Gambar 8 Berat feses selama perlakuan ( kontrol, K2, K3, I3,
Menurut Usman dan Susilowati (2006), pakan yang berkualitas akan digunakan seefisien mungkin oleh hewan untuk produksi atau pertumbuhan maksimal sehingga konversi pakannya rendah. Efisiensi pakan selanjutnya dikatakan merupakan salah satu tolok ukur untuk menilai tingkat efisiensi penggunaan pakan, dengan semakin tinggi efisiensi pakan berarti penggunaan pakan lebih efisien. Efisiensi pakan tinggi berarti kualitas pakan lebih baik karena hewan coba dengan mengkonsumsi pakan sedikit dapat meningkatkan pertambahan bobot badan tinggi.
Kualitas pakan dapat diukur dari ketersediaan zat-zat nutrisi seperti protein, lemak, dan karbohidrat dalam pakan karena zat-zat ini dapat mempengaruhi terbentuknya jaringan-jaringan tubuh dan menyebabkan pertumbuhan bobot badan (Linder 1992 dalam Astuti 1999). Pakan perlakuan kacang kedelai dan isolat kacang kedelai memiliki kadar protein yang tinggi jika dibandingkan dengan pakan kontrol (Tabel 3) dan dapat dilihat pada Tabel 4, efisiensi pakan keduanya juga tinggi. Konsumsi pakan tikus perlakuan kacang kedelai dan isolat kacang kedelai juga lebih tinggi jika dibandingkan dengan kontrol (Tabel 4). Kandungan protein juga konsumsi pakan yang tinggi ini diduga menyebabkan kelebihan protein yang dikonversi menjadi lemak, disimpan dalam jaringan adiposa, dan dapat mempengaruhi pertambahan bobot badan (Astuti 1999).
Efisiensi pakan kelompok yang diberi pakan perlakuan kecuali pakan K1 lebih tinggi dibandingkan dengan kelompok yang diberi pakan kontrol. Hal ini menunjukkan bahwa isoflavon yang terkandung pada pakan diduga juga mempengaruhi efisiensi pakan. Uji korelasi Pearson juga menunjukkan terdapat korelasi antara kandungan isoflavon pada pakan dengan efisiensi pakan kelompok
perlakuan kacang kedelai (K) (0.7<r<1) dan isolat kacang kedelai (I) (0.2<r<0.4) (Lampiran 6).
Efisiensi pakan dipengaruhi oleh beberapa faktor seperti spesies hewan, jenis kelamin, dan usia. Menurut Payne et al. (2001) dalam Qian dan Sun (2009), konsumsi isoflavon pada tikus betina meningkatkan bobot badan sedangkan pada tikus jantan menurunkan bobot badan dan efisiensi pakan. Pernyataan ini tidak sejalan dengan hasil penelitian. Hal ini diduga dikarenakan efek estrogenik atau antiestrogenik isoflavon terhadap efisiensi pakan (Jo dan Choi 2008).
Korelasi negatif terjadi antara kandungan isoflavon pada pakan kacang kedelai dengan efisiensi pakan tikus perlakuan pakan kacang kedelai (Lampiran 6). Tikus jantan diketahui mempunyai testosteron yang jauh lebih tinggi dibandingkan betina (Ostner et al. 2003). Isoflavon pada pakan kacang kedelai diduga bersifat antiestrogenik terhadap efisiensi pakan sehingga menurunkan efisiensi pakan dan juga bobot badan tikus jantan. Namun antara isoflavon yang terkandung pada isolat kacang kedelai dengan efisiensi pakan kelompok perlakuan isolat kacang kedelai terjadi korelasi positif. Estrogen lebih tinggi pada betina dibandingkan jantan (Shabsigh et al. 2005) dan isoflavon isolat kacang kedelai diduga bersifat estrogenik pada efisiensi pakan tikus sehingga meningkatkan efisiensi pakan dan bobot badan tikus jantan penelitian (Payne et al. 2001 dalam Qian dan Sun 2009).
Analisis statistik menunjukkan bahwa perlakuan kelompok pakan berpengaruh signifikan terhadap efisiensi pakan (p<0.05) (Tabel 4). Berdasarkan uji lanjut Duncan efisiensi pakan K2, I1, I2, dan I3 dan ketidakefisienan pakan K1 tidak berbeda signifikan dengan kontrol sedangkan efisiensi pakan K3 berbeda signifikan dengan kontrol. Hal ini menunjukkan pakan yang paling Tabel 4 Bobot badan, konsumsi pakan, efisiensi pakan, dan berat feses
Kelompok Pertambahan bobot badan (g/hari)
Konsumsi pakan
(g/hari) Efisiensi pakan Feses (g/hari) Kontrol 0.25 ±0.38ab 7.82 ±0.47a 0.03 ±0.05ab 1.28 ±0.27a K1 -0.18 ±0.56a 10.03 ±1.69bc -0.02 ±0.06a 1.98 ±0.23b K2 0.93 ±0.17bc 10.44 ±0.35c 0.09 ±0.01bc 1.96 ±0.26b K3 1.18 ±0.50c 9.68 ±0.49bc 0.12 ±0.05c 1.34 ±0.12a I1 0.66 ±0.17bc 9.03 ±1.08abc 0.07 ±0.02bc 1.20 ±0.04a I2 0.98 ±0.73bc 9.96 ±0.38bc 0.10 ±0.07bc 1.20 ±0.17a I3 0.50 ±0.46abc 8.67 ±0.83ab 0.06 ±0.05bc 1.26 ±0.16a Keterangan: Data disampaikan dalam rata-rata±standar deviasi. Huruf yang berbeda di kolom yang sama bermakna
berpengaruh terhadap efisiensi pakan adalah pakan K3. Ini terjadi diduga akibat konsumsi pakan dan pertambahan bobot badan K3 yang juga berbeda signifikan dengan kontrol karena nilai efisiensi pakan secara kuantitatif dipengaruhi oleh banyaknya konsumsi pakan dan nilai pertambahan bobot badan (Usman dan Susilowati 2006).
Pengaruh Perlakuan Pemberian Pakan terhadap Kadar Testosteron dan
Dihidrotestosteron Hewan Coba
Fitoestrogen memiliki dua gugus hidroksil (OH) yang berjarak 11.0 – 11.5 amstrong pada intinya, sama persis dengan estrogen. Selain itu cincin fenolat fitoestrogen juga memiliki kemiripan dengan struktur cincin fenolat estrogen pada mamalia. Gugus OH dengan jarak 11 amstrong dan cincin fenolat inilah yang menjadi struktur pokok suatu substrat agar mempunyai efek estrogenik sehingga mampu berikatan dengan reseptor estrogen. Fitoestrogen juga merupakan kompetitor aktif untuk reseptor estrogen, terutama reseptor estrogen β. Mekanisme kompetisi fitoestrogen terhadap estrogen endogen adalah dengan menghambat aktivitas enzim DNA isomerase II sehingga ekspresi protein dalam sel terhambat. Mekanisme tersebut juga terjadi dalam penghambatan fitoestrogen terhadap siklus sel (Sitasiwi 2009).
Empat senyawa fenolik yang dihasilkan oleh tanaman yang dianggap fitoestrogen yaitu isoflavon, stilben, lignan dan coumestan (Cornwell et al. 2004). Dua isoflavon yang berlimpah pada kedelai adalah genistein dan daidzein (Fanti 1999). Genistein dan daidzein pada tumbuhan terutama terdapat dalam bentuk glikosida yang bersifat tidak aktif yaitu genistin dan daidzin. Namun, ketika residu gula terputus melalui dekonjugasi oleh bakteri dalam usus, genistin dan daidzin akan berubah menjadi bentuk aglikon yang aktif yaitu genistein dan daidzein (Pan et al. 2008). Genistein menyumbang sekitar 50% dari total isoflavon kedelai sedangkan daidzein sekitar 40% (Rimbach et al. 2008).
Testosteron adalah bentuk androgen dominan pada jantan. Tempat produksi utama testosteron pada jantan adalah sel Leydig testis (Fargo et al. 2009). Sejumlah kecil testosteron juga diproduksi di kelenjar adrenal dan perifer (Murray et al. 2003).
Isoflavon berkompetisi dengan estrogen endogen untuk mengikat reseptor estrogen. Konsumsi isoflavon yang tinggi dapat menyebabkan afinitas isoflavon yang rendah
jika dibandingkan dengan 17β-estradiol untuk mengikat reseptor estrogen, dengan isoflavon kedelai memiliki sekitar 1/1000 dan 1/3 dari
afinitas 17β-estradiol masing-masing untuk
ERα dan ERβ, menjadi dapat mengikat reseptor estrogen, dan mengakibatkan estrogen endogen meningkat (Rimbach et al. 2008). Normalnya ketika estrogen endogen meningkat, estrogen akan menghambat hipotalamus dan hipofisis anterior melalui reaksi umpan balik negatif. Estrogen menghambat secara langsung sekresi GnRH pada hipotalamus, akibatnya pengeluaran LH yang dipicu oleh GnRH menjadi tertekan, tetapi efek primernya terhadap hipofisis anterior yakni menurunkan kepekaan sel penghasil gonadotropin (Nasution 2011). Sintesis testosteron di sel Leydig menurun, kadar testosteron berkurang, dan aromatisasi testosteron terhambat sehingga produksi estrogen endogen menurun (Hoffman et al. 2009).
Ketika isoflavon berikatan dengan reseptor estrogen, isoflavon diduga memicu inhibisi umpan balik negatif estrogen terhadap GnRH. Isoflavon berikatan dengan reseptor, mencegah estrogen dari membatasi pelepasan GnRH. Hipotalamus kemudian melepaskan GnRH dan mensekresinya ke hipotalamus-hipofisis. Setelah mencapai hipofisis anterior, GnRH merangsang pelepasan LH maupun FSH. LH diambil oleh sel-sel Leydig yang berikatan pada reseptor spesifik membran, dan menyebabkan sekresi testosteron (Wahyuni 2012). Hal ini diduga efek antiestrogenik isoflavon. Senyawa antiestrogenik bertindak sebagai estrogen antagonis yang dapat berikatan dengan reseptor estrogen namun menghambat respon estrogen sedangkan senyawa estrogenik adalah senyawa yang kemampuannya untuk bertindak sebagai estrogen agonis yang dapat berikatan dengan RE dan menstimulasi respon estrogen. Isoflavon bersifat antiestrogenik ketika kadar estrogen tinggi, sebaliknya isoflavon dapat juga bersifat estrogenik ketika kadar estrogen rendah (Robertson 2000).
sementara testosteron menurun pada jantan. Selain itu genistein dan biochanin A juga inhibitor 17-β-hidroksisteroid dehidrogenase, enzim yang mengubah androgen menjadi estrogen (Gaynor et al. 2003).
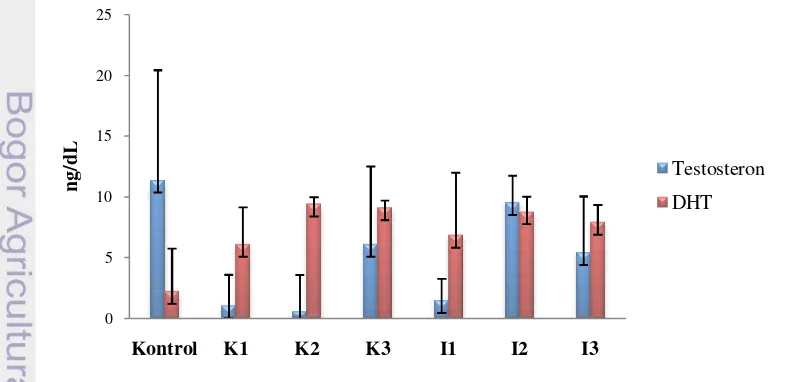
Gambar 9 menunjukkan adanya penurunan rata-rata kadar hormon testosteron pada kelompok yang diberi isoflavon (kelompok perlakuan) dibandingkan dengan kelompok yang tidak diberi isoflavon (kelompok kontrol) pada tikus jantan. Hasil uji korelasi Pearson menunjukkan terdapat korelasi antara kandungan isoflavon pada pakan dengan kadar testosteron kelompok tikus perlakuan pakan kacang kedelai (K) (0.7<r<1) dan isolat kacang kedelai (I) (0.4<r<0.7) (Lampiran 10). Hasil penelitian ini sejalan dengan penelitian yang dilakukan oleh Wahyuni et al. (2012) yang menyatakan bahwa pemberian isoflavon dosis 1.26 mg per 200 gram berat badan tikus secara oral selama 48 hari pada tikus jantan juga menyebabkan penurunan kadar hormon testosteron. Hasil penelitian Akinola et al. (2007) juga menunjukkan bahwa kadar testosteron tikus jantan menurun secara signifikan dengan pemberian isoflavon 1.5 mg/kg/ekor/hari.
Penurunan kadar testosteron pada penelitian ini terjadi diduga karena tikus jantan yang digunakan normal, tidak mengalami kekurangan testosteron, atau umur kekurangan testosteron (>6 bulan) sehingga hormon dan organ reproduksi tikus dalam keadaan normal. Induksi testosteron eksogen atau senyawa upregulation testosteron eksogen pada tikus normal (pada penelitian berupa isoflavon kedelai) diduga dapat menyebabkan kadar testosteron berlebih dan menjadikan umpan balik negatif bagi ketersediaan testosteron (Ibekwe et al. 2009).
Kadar testosteron yang tinggi akan menghambat sekresi LH dari hipofisis anterior melalui suatu efek langsung pada hipofisis dan suatu efek penghambat pada tingkatan hipotalamus untuk menghambat sintesis testosteron dan mengakibatkan produksi testosteron menurun. Selain itu efek umpan balik negatif lain diduga diperantarai oleh estradiol yang dapat dihasilkan lokal dari aromatisasi testosteron (Wahyuni 2012). Hal ini dapat terjadi karena baik reseptor androgen dan estrogen terletak di bagian otak, hipotalamus dan hipofisis. Jadi estrogen juga dapat memicu respon umpan balik negatif dalam organ ini (Akinola et al. 2007). Selain itu, isoflavon pada konsentrasi tinggi juga menghambat kerja enzim 17-β-hidroksisteroid dehidrogenase, enzim yang dibutuhkan untuk
sintesis testosteron untuk mengkonversi androstenedion menjadi testosteron (Rice dan Whitehead 2006).
Reseptor estrogen dalam jaringan tubuh terdiri atas dua macam, reseptor estrogen α (REα) dan reseptor estrogen β (REβ) dengan tempat distribusi yang berbeda. REα lebih banyak terdistribusi pada jaringan penyusun organ reproduksi sedangkan REβ terdistribusi di luar jaringan reproduksi. REα terdapat jaringan reproduksi, ginjal, tulang, jaringan adiposa putih, dan hati, sedangkan REβ berada pada prostat, paru, saluran pencernaan, kandung kemih, sel-sel hematopoietik, dan sistem saraf pusat (Matthews dan Gustafsson 2003). Perbedaan letak reseptor ini menyebabkan perbedaan efek paparan isoflavon pada hewan uji. Fitoestrogen memiliki afinitas yang lebih kuat pada REβ yang terdistribusi pada jaringan di luar organ reproduksi (Sitasiwi 2009). Hal ini juga diduga menyebabkan isoflavon tidak memberikan peningkatan kadar testosteron pada tikus jantan pada penelitian ini.
Selain itu menurut Lehninger et al. (1982), pada saat penghentian sekresi, konsentrasi hormon kembali dengan cepat ke taraf istirahat. Kehadirannya tidak diperlukan lagi, dengan cepat hormon dijadikan tidak aktif. Hormon-hormon dalam darah berada pada kondisi istirahat konsentrasinya sangat rendah, berkisar dalam satuan mikromolar (10-6 M) sampai pikomolar (10-12 M). Pengambilan darah pada waktu yang tepat misalnya saat hormon aktif disintesis atau disekresikan penting dilakukan. Faktor lain yang mempengaruhi pemeriksaan hormon antara lain usia, jenis kelamin, keadaan stres, dan
obat-obatan (Howaritz dan Henry 2001). Allen dan Key (2000) mengungkapkan
bahwa nutrisi atau gizi sangat mempengaruhi metabolisme hormon. Salah satunya pada keadaan kekurangan gizi. Situasi ini paling jelas pada betina, dengan penurunan dalam konsentrasi gonadotropin dan estrogen darah, serta terganggunya siklus menstruasi. Kekurangan gizi kronis pada jantan juga dapat menyebabkan konsentrasi yang sangat rendah pada testosteron dan LH. Penurunan testosteron pada K1 diduga karena tikus mengalami diare sehingga meningkatkan waktu transit makanan di usus dan menyebabkan menurunnya laju absorpsi nutrisi untuk mendukung ketersediaan testosteron (Sinthamurniwaty 2006).
presentase rata-rata penurunan terbesar terjadi pada kelompok perlakuan pakan K2 sebesar 95.11% (Tabel 5). Bila penurunan ini diakibatkan perlakuan pakan memicu testosteron yang berlebih pada tikus, bisa dikatakan pemurnian kedelai menjadi isolat dengan protein 90% ternyata tidak memberikan kadar testosteron lebih tinggi jika dibandingkan dengan kedelai.
Kandungan isoflavon pada pakan berkorelasi negatif dengan kadar testosteron tikus baik kelompok tikus perlakuan pakan kedelai maupun isolat. Semakin tinggi kandungan isoflavon pada pakan berarti semakin menurunkan kadar testosteron. Pakan K3 dengan kosentrasi isoflavon 0.01±0.0005 mg daidzein total/g menurunkan kadar testosteron kelompok tikus K3 sebesar 46.58%. Kadar testosteron semakin menurun menjadi sebesar 95.11% ketika kelompok tikus diberikan pakan K2 (0.08±0.0003 mg daidzein total/g pakan) (Tabel 5).
Penurunan kadar testosteron sebesar 16.24% terdapat pada kelompok tikus perlakuan pakan I2 (0.07±0.0026 mg daidzein total/g pakan). Penurunan kadar testosteron menjadi sebesar 87.24% pada kelompok tikus yang diberikan pakan pakan I1 (0.14±0.0052 mg daidzein total/g pakan). Penurunan kadar testosteron yang lebih rendah pada kelompok I3 jika dibandingkan dengan I1 dan I2 diduga disebabkan isoflavon yang terkandung pada pakan I3 belum cukup untuk dapat meningkatkan kadar testosteron. Selain itu kandungan isoflavon lebih tinggi pada K1 (0.15 mg daidzein total/g pakan) dibandingkan K2 (0.08 mg daidzein total/g pakan) namu