ABSTRACT
EFFECT OF FEEDING SOY TEMPE ON FASTING BLOOD GLUCOSE LEVELS IN OBESE DEUTSCHLAND-DENKEN-YOKEN (ddY) STRAIN
MALE MICE (MUS MUSCULUS L.)
By
TRI SUHANDA
Obesity is a predisposing factor for the onset of elevated blood sugar levels, this is due to the toxic effects of lipid accumulation in body tissues which causes a decrease in insulin sensitivity so that disrupt the use and storage of glucose. Obesity can be avoided by adjusting lifestyle and diet. Food that is associated with a decrease in blood glucose levels is soy tempe. Soy tempe has a high isoflavone content in the form of genistein, glisitein, daidzein and factor-II. Isoflavones improving insulin sensitivity, improve insulin secretion, blocking intestinal glucose absorption and are antioxidants. The aim of this study is to know the significant difference in groups of K1 vs K2 (p = 0.000), K2 vs KP1 (p = 0.000) and K2 vs KP2 (p = 0.000). The conclusion of this study is feeding soy tempe gives impact on lowering blood glucose levels in obese ddY strain male mice.
ABSTRAK
PENGARUH PEMBERIAN PAKAN TEMPE KEDELAI TERHADAP KADAR GLUKOSA DARAH MENCIT (Mus musculus L.) JANTAN
GALUR DEUTSCHLAND-DENKEN-YOKEN (ddY) OBESITAS
Oleh
TRI SUHANDA
Obesitas merupakan faktor predisposisi untuk timbulnya peningkatan kadar gula darah, hal ini disebabkan efek toksis dari akumulasi lipid di jaringan tubuh yang menyebabkan penurunan sensitivitas insulin sehingga menganggu penggunaan dan penyimpanan glukosa. Obesitas dapat dihindari dengan mengatur gaya hidup dan pola diet. Bahan makanan yang dihubungkan dengan penurunan kadar glukosa darah adalah tempe kedelai. Tempe kedelai memiliki kandungan isoflavon yang tinggi berupa genestein, glisitein, daidzein dan faktor-II. Isoflavon berperan dalam meningkatkan sensitivitas insulin, memperbaiki sekresi insulin, menghalangi penyerapan glukosa usus dan bersifat antioksidan. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian pakan tempe terhadap kadar glukosa darah puasa mencit jantan galur ddY obesitas. Jenis penelitian ini adalah true experimental dengan pre-post test with randomized control group design. Penelitian ini dilakukan selama 28 hari dengan menggunakan 25 ekor mencit (Mus musculus L.) jantan galur ddY yang di bagi kedalam 4 kelompok, yaitu kelompok kontrol normal (K1), kelompok kontrol obesitas (K2), kelompok yang diberi pakan tempe 2gram/hari (KP1) dan kelompok yang diberi pakan tempe 4gram/hari (KP2). Hasil analisis dengan uji t-berpasangan terdapat perbedaan bermakna pada kelompok KP1 (p = 0,016) dan KP2 (p = 0,016). Pada uji One
Way˗Anova perbedaan bermakna didapatkan pada kelompok K1 vs K2 (p = 0,000), K2 vs KP1 (p = 0,000) dan K2 vs KP2 (p = 0,000). Kesimpulan dari
penelitian ini adalah pemberian pakan tempe kedelai berpengaruh dalam menurunkan kadar glukosa darah mencit jantan galur ddY obesitas.
Oleh : TRI SUHANDA
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA KEDOKTERAN
Pada
Program Studi Pendidikan Dokter Fakultas Kedokteran Universitas Lampung
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
PENGARUH PEMBERIAN PAKAN TEMPE KEDELAI TERHADAP KADAR GLUKOSA DARAH PUASA MENCIT (Mus musculus L.) JANTAN GALUR DEUTSCHLAND-DENKEN-YOKEN (ddY) OBESITAS
(Skripsi)
Oleh : TRI SUHANDA
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Tabel Halaman
1. Struktur senyawa isoflavon pada tempe ...15
2. Jalur utama metabolisme karbohidrat ...19
3. Metabolisme glukosa ...22
4. Glukosa transporter pada manusia...23
5. Mekanisme Translokasi GLUT-4 di sel otot dan adipose ...25
6. Jalur sinyal insulin dalam metabolism glukosa di sel otot dan adipose ....26
7. Skema reaksi umum yang terjadi pada strip Accu-chek...30
8. Tes glukosa darah menggunakan Glukometer...32
9. Pemeriksaan glukosa darah denganautonomic monitoring...34
10. Mencit (Mus musculus L.) ...35
11. Mencit galur ddY model TSNO dan TSOD ...38
12. Grafik berat badan, glukosa darah dan glukosa dalam urin...40
13. Kerangka Teori ...41
14. Kerangka Konsep...38
15. Diagram Alur Penelitian ...51
16. Rerata kadar GDP 8 jamPre-testpada masing-masing kelompok ...58
17. Rerata kadar GDP 8 jamPost-testpada masing-masing kelompok ...59
2.6. Kerangka Konsep...42
3.5. Identifikasi Variabel dan Definisi Operasional Variabel ...47
3.5.1. Identifikasi Variabel...47
3.5.2. Definisi Operasional Variabel...47
3.6. Prosedur Penelitian ...48
3.6.1. Alur Penelitian ...48
3.6.2. Prosedur Pemberian Tempe ...50
3.6.3. Prosedur Pengambilan Darah Mencit ...50
3.7. Diagram Alur Penelitian ...51
3.8. Rancangan Analisis Data ...52
3.8.1. Uji Normalitas Data (p>0,05) ...52
3.8.2. Uji Homogenitas Data (p>0,05)...52
3.8.3. Uji Parametrik (Dependent t-test) ...53
3.8.4. Uji Parametrik (One Way-Anova) ...53
3.9. Etika Penelitian ...53
IV. HASIL DAN PEMBAHASAN 4.1. Hasil Penelitian ...56
4.1.1. Hasil pengukuran GDPpre-testdanpost-testmasing-masing kelompok ...56
4.1.2. Hasil Uji normalitas dan homogenitas ...57
4.1.3. Hasil uji t-berpasangan ...58
4.1.4. Hasil UjiOne-way Anova...57
Lampiran
1. Perhitungan Uji Statistik 2. Dokumentasi Penelitian
DAFTAR TABEL
Tabel Halaman
1. Status gizi berdasarkan IMT menurut WHO ...10
2. Status gizi berdasarkan IMT menurut Kementerian Kesehatan RI ...11
3. Jenis-jenis tempe...12
4. Kandungan tempe ...13
5. Pengangkut glukosa yang utama ...23
6. Kadar glukosa darah ...28
7. Kadar glukosa berdasarkan persentase nilai tes HbA1C ...34
8. Klasifikasi hewan dengan diabetes tipe 2 ...40
9. Definisi Operasional Variabel ...48
10. Hasil pengukuran GDP pre-test dan post-test pada masing-masing kelompok ...56
11. Hasil uji normalitas saphiro-wilk terhadap kadar GDP pre-test dan post-testpada masing-masing kelompok ...57
12. Hasil uji homogenitas levene terhadap kadar GDP pre-test dan post-testpada masing-masing kelompok ...57
13. Rerata kadar GDP 8 jampre-testpada masing-masing kelompok ...58
14. Rerata kadar GDP 8 jamPost-testpada masing-masing kelompok ...59
15. Hasil uji t-berpasangan di masing-masing kelompok...56
Ayahanda, Ibunda, adik-adik dan
Penulis dilahirkan di kota Menggala kabupaten Tulang Bawang, Lampung pada tanggal 16 April 1994, sebagai anak pertama dari 5 bersaudara, dari Bapak Hi.Subirlan dan Ibu Hj.Rosada.
Pendidikan Sekolah Dasar (SD) diselesaikan di SDN 03 DWT Jaya pada tahun 2005, Sekolah Menengah Pertama (SMP) diselesaikan di SMPN 03 Banjar Agung pada tahun 2008 dan Sekolah Menengah Atas (SMA) diselesaikan di SMAN 02 Menggala pada tahun 2011.
Alhamdulillahirabbil 'alamin, Puji syukur penulis haturkan kepada Allah SWT, Tuhan Yang Maha Pengasih dan Penyayang, yang melimpahkan nikamt dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Shalawat beriring salam semoga senantiasa tercurah kepada suri tauladan dan nabi akhir zaman Rasulullah Muhammad SAW beserta para keluarganya, para sahabatnya dan kita selaku umatnya sampai akhir zaman.
Skripsi dengan judul “Pengaruh Pemberian Pakan Tempe Kedelai Terhadap
Kadar Glukosa Darah Puasa Mencit (Mus Musculus L.) Jantan Galur Deutschland-Denken-Yoken (ddy) Obesitas” adalah salah satu syarat untuk memperoleh gelar Sarjana Kedokteran di Universitas Lampung.
Penghargaan dan ucapan terimakasih yang tak terhingga penulis haturkan kepada semua pihak yang telah berperan atas dorongan, bantuan, saran, kritik dan bimbingan sehingga skripsi ini dapat terselesaikan antaralain kepada :
1. Bapak Prof. Dr. Ir. Hasriadi Mat Akin, M.P., selaku Rektor Universitas Lampung;
dan kritik dalam proses penyelesaian skripsi ini secara langsung di kampus maupun dengan media email, tanpa mengurangi perhatiannya walaupun harus membagi waktu dengan banyak mahasiswa bimbingan lainnya. Terimakasih atas kebaikan hati dokter yang mengijinkan saya untuk mengikuti penelitian dokter sehingga saya dapat menyusun skripsi ini, terimakasih pula atas nasihat dan dukungannya selama ini, hal ini tidak akan pernah saya lupakan;
4. Ibu dr. Putu Ristyaning Ayu, M.Kes., Sp.PK selaku Pembimbing Kedua yang sangat baik hati dan sabar dalam memberikan bimbingan, saran dan kritik dalam proses penyelesaian skripsi ini;
5. Bapak dr. Ade Yonata, M.MolBiol., Sp.PD., selaku Pembahas pada Seminar Proposal dan Seminar Hasil. Terimakasih atas waktu, ilmu dan saran-saran yang telah diberikan;
6. Ibu dr. Rika Lisiswanti, M.MedEd., selaku Penguji Utama pada Ujian Skripsi. Terimakasih atas kesediannya untuk menjadi penguji utama. Terimakasih pula atas saran dan kritiknya yang sangat membangun;
7. Ibu dr. Indri Windarti, Sp.PA., selaku pembimbing akademik hingga semester 6, terimakasih atas nasihatnya;
8. Ibu dr.Ratna Dewi Puspita Sari, Sp.og., selaku pembimbing akademik saat semester 7, terimakasih atas nasihatnya;
kelak;
10. Umi, Hj. Rosada, yang selalu mendoakan anak-anaknya dalam setiap solatnya, yang selalu memberikan nasihat dan dukungan demi kebaikan anak-anaknya, sosok ibu yang sangat perhatian dan pengertian, terimakasih umi atas segala kasih sayang mu, engkau adalah ibu terbaik di dunia ini, semoga Allah selalu melindungi dan menjadikan ladang pahala di akhirat kelak;
11. Adik-adik saya, Suhendra, Eki Tri Suenda, Rehan Jaya dan Putri Wulan Dari, yang selalu menjadi penyemangat saya dalam menuntut ilmu;
12. Seluruh keluarga besar saya kakek dan nenek, paman dan bibi, serta keluarga besar lainnya yang tidak bisa saya sebutkan satu-persatu, terimakasih atas doa dan dukungannya;
13. Ibu Nuriah, yang sangat sabar mengajari dan membimbing mengenai prosedur penelitian. Terimakasih telah meluangkan waktunya dalam membimbing kami sehingga kami menjadi paham dan bisa melakukan penelitian;
14. Seluruh Dosen FK Universitas Lampung atas ilmu yang telah diberikan kepada penulis untuk menambah wawasan yang menjadi landasan untuk menggapai cita-cita;
Terrimakasih atas bantuan dan dukungannya;
17. Rekan-rekan satu tim penelitian dan seperjuangan, Eduard, Kharisma MR, Lana Asfaradila, Huzaimah, Kurnia Fitri dan Nindriya Kurniandari yang telah berkontribusi baik dalam pikiran, waktu, tenaga dan materi sejak sebelum, selama dan setelah penelitian ini. Terimakasih untuk bantuan dan kerjasama selama ini;
18. Seluruh sejawat, teman angkatan 2012 yang tidak bisa disebutkan satu persatu atas kekompakan, canda, tawa selama 3,5 tahun yang telah memberikan warna serta makna tersendiri. Semoga kebersamaan dan kekompakkan selalu terjalin baik sekarang maupun kedepan nanti;
19. Teman satu kosan saya Amri Yusuf, Andika Yusuf R, Andrian Prasetya Wicaksono, M.Ridho Ansori, Marco Manza, M.Muhlis R, Widyan HP yang selalu berbagi cerita, semangat, keluh kesah, tawa dan kebersamaannya;
20. Kakak-kakak dan adik-adik tingkat (angkatan 2002-2015) yang sudah memberikan semangat kebersamaan dalam satu kedokteran;
21. Terimakasih banyak untuk Yuda Ayu Kusuma Wardani yang selalu memberikan motivasi, semangat doa dan dukungannya. Terimakasih atas kebersamaannya selama ini;
membalas semua kebaikan yang telah diberikan;
Penulis menyadari skripsi ini masih banyak kekurangan dan jauh dari kesempurnaan. Namun, Penulis berharap skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Semoga segala perhatian, kebaikan dan keikhlasan yang diberikan selama ini mendapat balasan dari Allah SWT.
Bandar Lampung, 7 Januari 2016 Penulis
I. PENDAHULUAN
1.1. Latar Belakang
Obesitas adalah peningkatan berat badan melampaui batas kebutuhan fisik dan skeletal, akibat penimbunan lemak tubuh yang berlebihan (Dorlan, 2012). Obesitas terjadi akibat asupan energi lebih tinggi daripada energi yang dikeluarkan. Asupan energi tinggi disebabkan oleh konsumsi makanan sumber energi dan lemak tinggi, sedangkan pengeluaran energi yang rendah disebabkan karena kurangnya aktivitas fisik dan sedentary life style (Kementerian Kesehatan RI, 2013). Apabila dibiarkan obesitas dapat menyebabkan masalah kesehatan seperti penyakit jantung koroner, diabetes melitus tipe 2, hipertensi, dislipidemia, stroke, gangguan fungsi hati dan empedu, gangguan pernafasan, osteoarthritis, kanker, gangguan menstruasi, infertilitas, impotensi, dan lain-lain (Lebowitzet al., 2012).
Berdasarkan hasil Riset Kesehatan Dasar (RISKESDAS) tahun 2013 penduduk berusia > 18 tahun yag mengalami obesitas sebesar 15,4%. Dari 15,4% penduduk yang obesitas tersebut terdiri dari laki-laki 19,7% dan perempuan 32,9%. Sedangkan prevalensi obesitas pada usia 5-12 tahun, 13-15 tahun dan 16-18 tahun berturut-turut sebesar 8,8%, 2,5% dan 1,6% (Kementerian Kesehatan RI, 2013).
Obesitas merupakan faktor predisposisi untuk timbulnya peningkatan kadar gula darah, hal ini disebabkan karena efek toksik dari akumulasi lipid di jaringan seperti otot rangka dan hati sehingga menyebabkan penurunan sensitivitas jaringan terhadap efek metabolisme insulin, yaitu suatu kondisi yang dikenal dengan resistensi insulin. Penurunan sensitivitas insulin menganggu penggunaan dan penyimpanan glukosa, sehingga akan meningkatkan kadar glukosa di dalam darah (Guyton & Hall, 2012).
Obesitas dapat di hindari dengan mengatur gaya hidup, salah satunya adalah mengatur pola diet. Pengaturan diet merupakan perubahan gaya hidup yang cukup efektif dalam menurunkan glukosa darah. Salah satu bahan makanan yang dihubungkan dengan penurunan glukosa darah adalah tempe (Ghozaliet al., 2010).
dan menjadi pasar kedelai terbesar di Asia. Sebanyak 50% dari konsumsi kedelai Indonesia dijadikan untuk memproduksi tempe, 40% tahu, dan 10% dalam bentuk produk lain (seperti tauco, kecap dan lain-lain). Konsumsi tempe rata-rata pertahun di Indonesia saat ini sekitar 6,45 kg/orang (Badan Standardisasi Nasional, 2012).
Tempe merupakan hasil fermentasi kedelai dengan menggunakan kapang Rhizopus oryzae sp. Proses fermentasi menyebabkan pemecahan ikatan peptida pada kedelai sehingga protein kedelai mudah dicerna (Setyowati et al, 2008). Tempe termasuk sumber protein nabati yang lazim dikonsumsi oleh masyarakat Indonesia. Tempe tergolong sumber makanan dengan kandungan asam amino esensial dan non esensial yang lengkap, kadar lemak jenuh rendah, isoflavon tinggi, serat tinggi, indeks glikemik rendah (glycemic index <55) dan mudah dicerna. Kandungan isoflavon pada tempe diduga berperan dalam proses pengendalian gula darah, beberapa penelitian juga telah menghubungkan pengaruh konsumsi isoflavon pada tempe terhadap kondisi diabetes. Selain itu serat tinggi pada tempe memperlambat absorbsi glukosa di dalam usus. indeks glikemik yang rendah juga menjadikan respon glukosa darah tubuh rendah (Rahadiyanti, 2011).
1,4% dan isoflavon (genistein) 0,22 g/kg, diet menunjukkan penurunan kadar glukosa darah dari 281,5 mg/dl menjadi 187,66 mg/dl setelah 14 hari pemberian (Ghozaliet al., 2010).
Penelitian mengenai pengaruh tempe terhadapa glukosa darah tikus diabetes sudah pernah dilakukan. Namun, penelitian mengenai pengaruh pemberian pakan tempe terhadap glukosa darah mencit obesitas belum pernah dilakukan. Hal inilah yang mendasari peneliti untuk melakukan penelitian tentang pengaruh pemberian pakan tempe terhadap glukosa darah mencit obesitas.
1.2. Rumusan Masalah
Berdasarkan Latar belakang diatas maka rumusan masalah dalam penelitian ini adalah “apakah pemberian pakan tempe kedelai pada mencit (Mus musculus L.) jantan obesitas galur ddY mampu menurunkan kadar glukosa darah puasa?”.
1.3. Tujuan Penelitian
1.3.1. Tujuan Umum
1.3.2. Tujuan Khusus
Adapaun tujuan khusus pada penelitian ini adalah sebagai berikut : a. Untuk mengetahui rerata kadar glukosa darah puasa mencit normal. b. Untuk mengetahui rerata kadar glukosa darah puasa mencit obesitas. c. Untuk mengetahui rerata kadar glukosa darah puasa mencit obesitas
yang di beri pakan tempe 2 gr/hari.
d. Untuk mengetahui rerata kadar glukosa darah puasa mencit obesitas yang di beri pakan tempe 4 gr/hari.
e. Untuk mengetahui pengaruh pemberian pakan tempe 2 gr/hari dan 4 gr/hari terhadap penurunan kadar glukosa darah puasa mencit obesitas.
1.4. Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan manfaat, yaitu :
1. Dapat diketahui manfaat tempe dalam menurunkan kadar glukosa darah. 2. Menjadikan tempe sebagai makanan yang memenuhi kebutuhan gizi
seimbang.
3. Meningkatkan keinginan masyrakat untuk gemar mengkonsumsi tempe.
II. TINJAUAN PUSTAKA
2.1.Obesitas
2.1.1.Definisi Obesitas
Obesitas berasal dari bahasa latin yang berarti makan berlebihan. Obesitas merupakan istilah yang digunakan dalam menunjukkan adanya kelebihan berat badan (Rahmawati, 2009). Istilah obesitas sendiri menurut kamus kedokteran Dorland (2012), adalah peningkatan berat badan melampaui batas kebutuhan fisik dan skeletal, akibat penimbunan lemak tubuh yang berlebihan. Sedangkan menurut World Health Organization (WHO), Obesitas didefinisikan sebagai akumulasi lemak abnormal atau berlebihan yang dapat mengganggu kesehatan (WHO, 2015).
disimpan oleh tubuh dalam bentuk timbunan lemak yang akan tersebar di bagian-bagian tertentu seperti pinggang, perut, lengan bagian atas, dan bagian tubuh lainnya yang dapat berdampak buruk bagi kesehatan (Putri, 2012).
2.1.2.Penyebab Obesitas
Penyebab mendasar terjadinya kegemukan dan obesitas adalah ketidakseimbangan energi antara energi yang masuk dan energi yang keluar. Energi yang masuk adalah jumlah energi berupa kalori yang di dapatkan dari makanan dan minuman. Sedangkan energi yang keluar adalah jumlah energi atau kalori yang digunakan tubuh dalam hal seperti bernapas, digesti dan juga melakukan kegiatan fisik (NIH, 2012).
Asupan energi dan pengeluaran energi di pengaruhi oleh berbagai faktor yang dapat dikelompokan menjadi lebih spesifik seperti faktor dari individu berupa genetik dan proses metabolisme tubuh, faktor dari perilaku hidup seperti kurangnya beraktifitas fisik dan faktor dari luar termasuk faktor lingkungan seperti murahnya harga suatu makanan (Kaestner, 2009).
obesitas antaralain gaya hidup tak aktif, lingkungan, genetik dan riwayat keluarga, kondisi kesehatan, obat-obatan, faktor emosional, merokok, umur, kehamilan dan kurang tidur dapat menjadi faktor resiko yang menyebabkan obesitas (NIH, 2012).
Adapun faktor resiko yang dapat menyebabkan obesitas antara lain : 1) Gaya hidup tak aktif
Saat ini kebanyakan orang menghabiskan waktu didepan televisi (TV) dan komputer saat bekerja, di sekolah dan di rumah. Selain itu banyak orang yang memiliki kendaraan pribadi untuk berpergian walau hanya dengan jarak tempuh yang pendek. Orang-orang yang tidak aktif lebih mungkin untuk menambah berat badan karena mereka tidak membakar kalori yang mereka ambil dari makanan dan minuman. Gaya hidup tidak aktif juga menimbulkan risiko untuk penyakit jantung koroner, tekanan darah tinggi, diabetes, kanker usus besar dan masalah kesehatan lainnya (NIH, 2012).
2) Faktor Genetika
bahwa individu yang berasal dari keluarga yang obesitas, memiliki kemungkinan obesitas 2-8 kali lebih besar dibandingkan dengan keluarga yang tidak obesitas. Sangat besar kemungkinan bahwa penyebab obesitas tersebut bukan hanya pada suatu gen tunggal tapi adanya mutasi pada beberapa gen (Rankinen et al., 2006).
3) Hormonal
Beberapa masalah hormon dapat menyebabkan kelebihan berat badan dan obesitas, seperti hipotiroidisme, cushing syndrome, dan polycystic ovarian syndrome.
4) Obat-obatan
Obat-obatan tertentu dapat menyebabkan resiko terjadinya kegemukan seperti kortikosteroid dan antidepresan.
5) Faktor emosional
Beberapa orang makan lebih banyak dari biasanya ketika mereka bosan, marah atau stres. Seiring waktu, makan berlebihan akan menyebabkan penambahan berat badan dan dapat menyebabkan kelebihan berat badan atau obesitas (NIH, 2012). Dan masih banyak faktor-faktor lain yang menjadi penyebab obesitas.
2.1.3.Penentuan Obesitas
kilogram dibagi dengan kuadrat tinggi badan dalam meter (kg/m2). Seseorang dikategorikan kegemukan jika IMT >25 kg/m2 dan obesitas jika IMT>30 kg/m2 (WHO, 2015).
Rumus menentukan IMT :
Keterangan :
1. BB : berat badan (kg) 2. TB : tinggi badan (m)
IMT dapat digunakan untuk menunjukan status gizi pada orang dewasa yang dapat dilihat dalam dalam tabel 1 dan tabel 2.
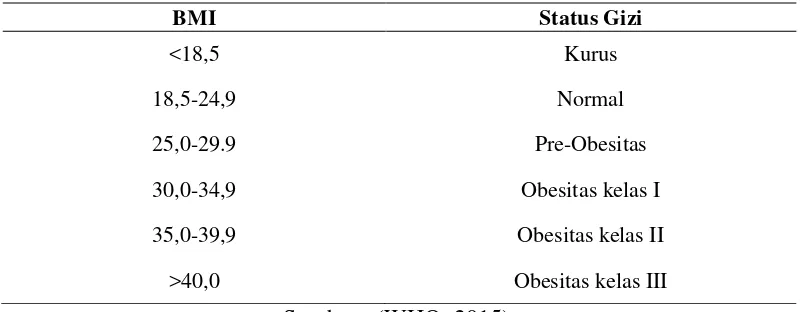
Tabel 1. Status gizi berdasarkan IMT menurut WHO
BMI Status Gizi
<18,5 Kurus
18,5-24,9 Normal
25,0-29.9 Pre-Obesitas
30,0-34,9 Obesitas kelas I
35,0-39,9 Obesitas kelas II
>40,0 Obesitas kelas III
Sumber : (WHO, 2015). IMT =
Tabel 2. Status gizi berdasarkan IMT menurut Kementerian Kesehatan RI
Status Gizi Kategori IMT
Kurus Kekurangan berat badan tingkat berat <17,0 Kekurangan berat badan tingkat ringan 17,0-18,4
Normal 18,5-25,5
Gemuk Kelebihan berat badan tingkat ringan >25,0-27,0 Kelebihan berat badan tingkat berat >27,0-29,9
Obesitas Kelebihan berat badan tingkat sangat berat >30 Sumber : (Kementerian Kesehatan RI, 2012).
2.2.Tempe
2.2.1.Definisi Tempe
Tempe adalah salah satu makanan tradisional khas Indonesia. Tempe merupakan makanan yang terbuat biji kedelai atau beberapa bahan lain yang diproses melalui fermentasi dari apa yang secara umum dikenal sebagai “ragi tempe”. Lewat proses fermentasi ini, biji kedelai
mengalami proses penguraian menjadi senyawa sederhana sehingga mudah dicerna (Badan Standardisasi Nasional, 2012).
2.2.2.Jenis Tempe
Tabel 3. Jenis-jenis tempe
No Bahan Baku Jenis/Nama Tempe
1 Kedelai (Glycine max) Tempe Kedelai
2 Ampas tahu/kedelai Tempe gembus
3 Bungkil kacang tanah Tempe bungkil (Jateng)
4 Ampas kelapa Tempe bongkrek
5 Bungkil kacang + ampas tahu Tempe enjes (Malang)
6 Koro Bengkuk (Mucuna pruriens) Tempe bengkuk (Yogya)
7 Lamtoro (Laucaena glau) Tempe Lamtoro (Yogya)
Sumber : (Priastiti, 2013).
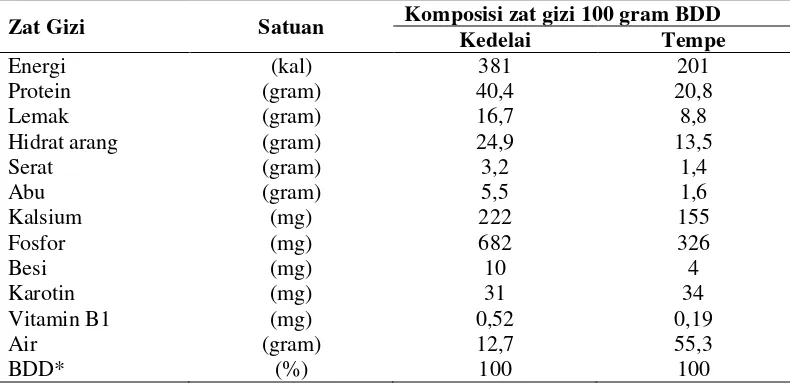
2.2.3.Kandungan tempe
Tabel 4. Kandungan tempe
Zat Gizi Satuan Komposisi zat gizi 100 gram BDD Kedelai Tempe
*BDD = Berat yang dapat dimakan
Sumber : (Badan Standardisasi Nasional, 2012).
Fermentasi yang terjadi pada proses pembuatan tempe menghasilkan perubahan pada tekstur kedelai, menjadi empuk dan nilai zat gizi tempe lebih baik dari kacang kedelai.
Nilai Gizi Tempe : Protein
Enzim -enzim yang dihasilkan kaping, menghasilkan asam amino bebas, sehingga kadarnya meningkat sampai 85 kali kadar protein kedelai.
Karbohidrat
Lemak
Enzim dalam kaping dapat menurunkan kadar lemak total dari 22,2% menjadi 14,4%.
Mineral
Didalam kedelai terdapat asam fitat yang merupakan senyawa forfose, yang tidak dapat dimanfaatkan oleh tubuh. Dengan fermentasi, kaping menghasilkan enzim fitase yang menguraikan asam fitat, sehingga forfosenya dapat dimanfaatkan tubuh.
Vitamin
Proses fermentasi dapat meningkatkan kadar vitamin B (Riboferum), Vitamin Bb (Piridoksin), asam folat, asam panthotenat dan asam nikotinat. Sedangkan kadar vitamin B1 menurun karena untuk pertumbuhan kaping dan terbentuk pula vitamin B12 oleh bakteri yang tidak ada dalam produk nabati lainnya (Kurniawan, 2012).
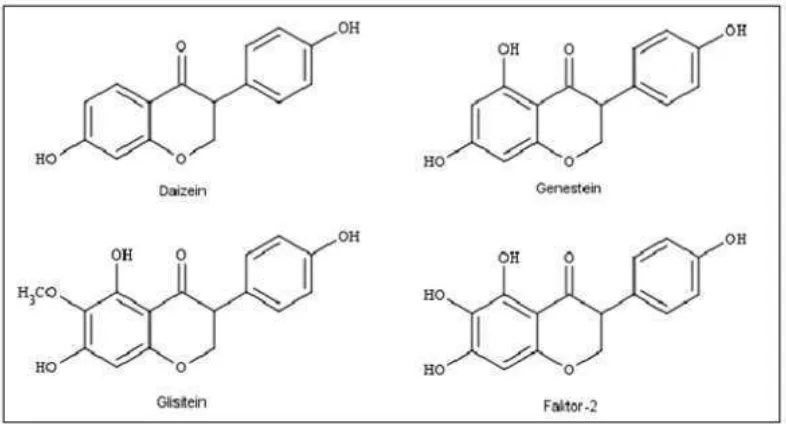
Gambar 1. Struktur senyawa isoflavon pada tempe Sumber : (Ariani & Hastuti, 2009).
Genistein dan daidzein berperan sebagai antihiperglikemik melalui aktivasi glukokinase (GK), penghambatan glukosa-6-fosfatase (G6pase), phospoenol pyruvate carboxykinase (PEPCK), fatty acid sinthase (FAS), -oxidation dan carnitine palmitoyltransferase (CPT) di hati (Ghozali et al., 2010). Selain itu Genistein dapat menghambat
α-glukosidase yakni enzim yang berfungsi untuk menghidrolisis
karbohidrat menjadi gula sederhana (glukosa) pada usus sehingga berpotensi sebagai antidiabetes karena dapat menurunkan kadar gula darah dengan cara memperlambat penyerapan karbohidrat postprandial (Bintanah & Kusuma, 2010).
mempunyai aktivitas antioksidan lebih baik dari daidzein dan genistein. Aktivitas antioksidan ini dapat mengatasi radikal bebas yang ditimbulkan keadaan hiperglikemia (Ariani & Hastuti, 2009).
Selain kandungan isoflavon yang tinggi tempe juga mengandung serat yang tinggi. serat pada tempe mengandung pectin, galactomannans dan arabinogalactans dengan viskositas tinggi, bentuk polisakarida ini memperlambat pengosongan lambung dan absorbsi glukosa sehingga diet serat dari tempe dapat menurunkan kadar toleransi glukosa (Bintanah & Kusuma, 2010).
2.2.4.Proses Pembuatan tempe
Berikut ini adalah langkah-langkah proses pembuatan tempe :
1) Agar benar-benar mendapatkan biji kedelai yang bagus, dilakukan penyortiran. Caranya, tempatkan biji kedelai pada tampah, kemudian ditampi.
2) Biji kedelai dicuci dengan air yang mengalir.
3) Biji kedelai yang sudah bersih dimasukkan ke dalam panci berisi air, kemudian direbus selama 30 menit atau sampai mendekati setengah matang.
5) Keesokan harinya, kulit arinya dikupas. Caranya, kedelai dimasukkan ke dalam air, kemudian diremas sambil dikuliti hingga akhirnya didapatkan keping-keping kedelai.
6) Keping kedelai dicuci sekali lagi, dengan cara yang sama seperti mencuci beras yang hendak ditanak.
7) Keping kedelai dimasukkan ke dalam dandang lalu ditanak, mirip seperti menanak nasi.
8) Setelah matang, angkat, lalu dihamparkan tipis-tipis di atas tampah. Ditunggu sampai dingin, airnya menetes habis dan keping kedelai mengering.
9) Proses selanjutnya adalah menambahkan ragi. Pemberian ragi pada kedelai dicampurkan sambil diaduk hingga merata. Ukurannya, 1 kg kedelai menggunakan sekitar 1 gram ragi. 10) Bungkus kedelai yang sudah bercampur rata dengan ragi
menggunakan daun pisang atau plastik.
11) Peram bungkusan kedelai. Bila pembungkusnya berupa plastik, pemeraman dilakukan di atas kajang-kajang bambu yang diletakkan pada rak-rak. Bila pembungkusnya berupa daun, pemeraman dilakukan pada keranjang bambu yang ditutup goni. 12) Sesudah diperam semalaman, dilakukan penusukan dengan lidi.
Tujuannya agar udara segar dapat masuk ke dalam bahan tempe. 13) Peram lagi semalaman, keesokan harinya tempe yang dibuat telah
2.3.Glukosa Darah
2.3.1.Definisi Glukosa Darah
Glukosa darah merupakan jenis utama dari gula yang ditemukan dalam darah dan menjadi sumber energi utama bagi tubuh. Pankreas melepaskan hormon insulin ke dalam darah. Insulin tersebut kemudian akan membantu glukosa untuk masuk kedalam semua sel tubuh. Bila produksi insulin tidak cukup atau insulin tidak bekerja dengan cara yang seharusnya maka glukosa akan tetap didalam darah dan tidak dapat mencapai sel tubuh. Hal ini menyebabkan kadar glukosa darah meningkat sehingga terjadi pradiabetes atau diabetes (National institute of Diabetes and digestive and kidney diseases, 2013).
Dalam keadaan normal, konsentrasi glukosa darah manusia saat postabsorbsi berkisar antara 80-100 mg/dl. Kemudian setelah mengkonsumsi karbohidrat, kadar glukosa darah dapat meningkat sampai sekitar 120-130 mg/dl. Sedangkan selama puasa kadarnya turun sampai sekitar 60-70 mg/dl (Permana, 2011).
2.3.2.Metabolisme Glukosa Darah
terutama adalah polimer-polimer hexosa dan yang penting adalah glukosa, laktosa, fruktosa dan galaktosa. Kebanyakan monosakarida dalam tubuh berada dalam bentuk D-isomer. Hasil yang utama dari metabolisme karbohidrat yang terdapat dalam darah adalah glukosa (Guyton & Hall, 2012).
Glukosa adalah karbohidrat terpenting, kebanyakan karbohidrat dalam makanan diserap ke dalam aliran darah sebagai glukosa dan gula lain diubah menjadi glukosa di hati. Glukosa adalah prekursor untuk sintesis semua karbohidrat lain di tubuh, termasuk glikogen untuk penyimpanan, ribosa dan deoksiribosa dalam asam nukleat, galaktosa dalam laktosa susu dan glikolipid serta sebagai kombinasi dengan protein dalam glikoprotein dan proteoglikan (Murray et al., 2012).
Setelah makanan dikonsumsi, komponen makanan akan dicerna oleh serangkaian enzim di dalam tubuh. Karbohidrat dicerna oleh α-amilase di dalam air liur dan α-amilase yang dihasilkan oleh pankreas yang
bekerja di usus halus. Disakarida diuraikan menjadi monosakarida. Sukrase mengubah sukrosa menjadi glukosa dan fruktosa, laktase mengubah laktosa menjadi glukosa dan galaktosa. Sel epitel usus akan menyerap monosakarida, glukosa dan fruktosa bebas dan dilepaskan dalam vena porta hepatika (Harvey & Ferrier, 2011).
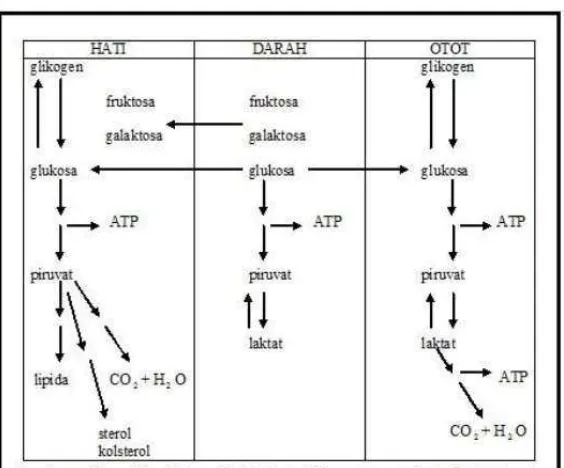
Berikut adalaha metabolisme glukosa di beberapa organ tubuh : a) Metabolisme glukosa di hati
b) Metabolisme glukosa di otot
Glukosa dari usus yang tidak dimobilisis oleh hati, akan mengalir dalam darah menuju ke jaringan perifer. Glukosa akan dioksidasi menjadi karbon dioksida dan air. Banyak jaringan misalnya otot menyimpan glukosa dalam jumlah kecil dalam bentuk glikogen. Otot rangka yang sedang bekerja menggunakan glukosa dari darah atau dari simpanan glikogennya sendiri, untuk diubah menjadi laktat melalui glikosis. Setelah makan, glukosa digunakan oleh otot untuk memulihkan simpanan glikogen yang berkurang selama otot bekerja melalui proses yang dirangsang oleh insulin. Otot yang sedang bekerja juga menggunakan bahan bakar lain dari darah, misalnya asam-asam lemak(Wolfe, 2015).
c) Metabolisme glukosa di jaringan adiposa
Insulin merangsang penyaluran glukosa ke dalam sel-sel adiposa. Glukosa dioksidasi menjadi energi oleh adiposit. Selain itu, glukosa digunakan sebagai sumber untuk membentuk gugus gliserol pada triasilgliserol yang disimpan di jaringan adiposa (Bell, 2001).
d) Metabolisme glukosa di otak dan jaringan saraf
Gambar 3. Metabolisme Glukosa Sumber : (Rahadiyanti, 2011)
2.3.3.Pengangkut Glukosa
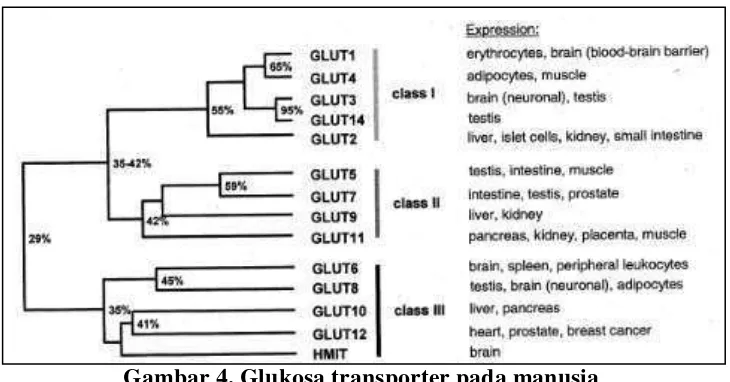
Membran plasma pada sel berstruktur lipid bilayer (lapis ganda lemak) sehingga menyebabkan glukosa yang bersifat hidrofilik dan ukuran molekul yang besar tidak dapat melewati membran sel. (Sherwood, 2012). Oleh karena itu, dibutuhkan suatu sistem transport untuk mengangkut glukosa. Glukosa dapat masuk kedalam ke dalam sel melalui facilitated diffusion (difusi terfasilitasi) yakni menggunakan pengangkut glukosa atau glucose transporter (GLUT) (Wilcox, 2005).
Gambar 4. Glukosa transporter pada manusia Sumber : (Scheepers et al., 2004)
Namun pengangkut glukosa yang utama dan sudah diketahui dengan jelas mekanisme serta fungsinya adalah GLUT 1, GLUT 2, GLUT 3, GLUT 4 dan GLUT 5 (Bender & Mayes, 2012).
Tabel 5. Pengangkut glukosa yang utama
Lokasi Jaringan Fungsi
Pengangkut dua-arah fasilitatif
GLUT 1 Otak, ginjal, kolon, plasenta, eritrosit
Penyerapan Glukosa
GLUT 2 Hati, sel pankreas, usus halus, ginjal
Penyerapan atau pembebasan glukosa secara cepat
GLUT 3 Otak, ginjal, plasenta Penyerapan glukosa GLUT 4 Otot jantung dan rangka,
jaringan adiposa
Penyerapan glukosa yang dirangsang oleh insulin
GLUT 5 Usus halus Penyerapan glukosa
Pengangkut satu-arah dependen-natrium
Kadar glukosa darah diatur agar tetap stabil melalui suatu mekanisme homeostatik yang diatur secara ketat yang melibatkan hati, jaringan ektrahepatik dan beberapa hormon. Sel hati bersifat permeabel bebas untuk glukosa dikarenakan pada hati terdapat GLUT 2 yang memungkinkan penyerapan dan pelepasan glukosa secara cepat. Sedangkan sel jaringan ekstrahepatik selain sel pulau Langerhans
pankreas bersifat relatif impermeabel dan pengankut glukosa jaringannya diatur oleh insulin (Bender & Mayes, 2012).
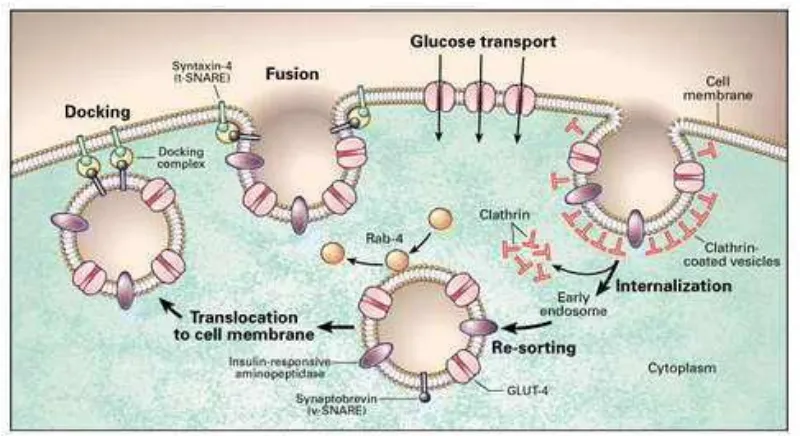
Insulin cepat menurunkan kadar glukosa darah dengan meningkatkan pemindahan glukosa kedalam jaringan adiposa dan otot dengan merekrut pengangkut glukosa (GLUT 4) dari bagian dalam sel ke membran plasma (Bender & Mayes, 2012).
memaksimalkan kecepatan pengangkutan glukosa ke dalam sel (Shepherd & Kahn, 1999).
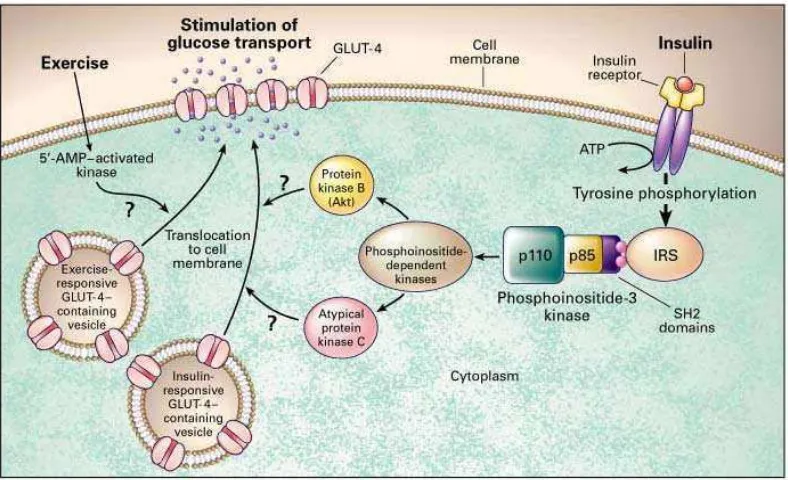
Berbeda dengan GLUT 4 yang terutama terdapat pada sel otot dan sel adiposa, pada sel otak terdapat GLUT 1 yang memungkinkan perbindahan glukosa dari darah ke dalam sel tanpa membutuhkan insulin sehingga mampu membertahankan asupan glukosa untuk otak (Shepherd & Kahn, 1999).
Gambar 6. Jalur sinyal insulin dalam metabolism glukosa di sel otot dan adiposa
Sumber : (Shepherd & Kahn, 1999)
2.3.4.Kadar Glukosa Darah
Semua sel dengan tiada hentinya mendapat glukosa. Tubuh mempertahankan kadar glukosa dalam darah yang konstan, yaitu sekitar 80-100 mg/dl bagi dewasa dan 80-90 mg/dl bagi anak, walaupun pasokan makanan dan kebutuhan jaringan berubah-ubah sewaktu kita tidur, makan dan bekerja (Cranmer, 2014).
glukonoegenesis dan melalui pelepasan asam lemak dari simpanan jaringan adiposa apabila pasokan glukosa tidak mencukupi. Kadar glukosa darah yang tinggi yaitu hiperglikemia dicegah oleh perubahan glukosa menjadi glikogen dan perubahan glukosa menjadi triasilgliserol di jaringan adiposa. Keseimbangan antarjaringan dalam menggunakan dan menyimpan glukosa selama puasa dan makan terutama dilakukan melalui kerja hormon homeostasis metabolik yaitu insulin dan glukagon (Sinha, 2013).
Glukosa yang dihasilkan begitu masuk dalam sel akan mengalami fosforilasi membentuk glukosa-6-fosfat, yang dibantu oleh enzim hexokinase sebagai katalisator. Hati memiliki enzim yang disebut glukokinase, yang lebih spesifik terhadap glukosa. Seperti halnya hexokinase, glukosa akan meningkat kadarnya oleh insulin dan berkurang pada saat kelaparan dan diabetes. Glukosa-6-fosfat dapat berpolimerisasi membentuk glikogen, sebagai bentuk glukosa yang dapat disimpan, terdapat dalam hampir semua jaringan tubuh, tetapi terutama dalam hati dan otot rangka (Guyton & Hall, 2012).
Berdasarkan NIH, 2013. Kadar glukosa darah normal pada orang yang bukan diabetes adalah :
Antara 70-130 mg/dl sebelum makan
Tabel 6. Kadar glukosa darah Kadar Glukosa Darah mg/dl (mmol/L)
Sangat Tinggi 400-800 (22.2-44.4) Sakit perut Sulit bernafas
Tinggi 200-400 (11.1-22.2) Rendah Energi
Normal
< 5 tahun 80-200 (4.5-11.1)
5-11 tahun 70-180 (3.9-10.0) Baik
≥ 1β tahun 70-150 (3.9-8.3)
Rendah <60 ( < 3.3) Berkeringat, lapar, gemetar Sumber : (Chase & Maahs, 2011).
2.3.5.Pemeriksaan Kadar Glukosa Darah
Setelah pencernaan makanan yang mengandung banyak glukosa, secara normal kadar glukosa darah akan meningkat, namun tidak melebihi 170 mg/dl. Banyak hormon ikut serta dalam mempertahankan kadar glukosa darah yang adekuat baik dalam keadaan normal maupun sebagai respon terhadap stres. Pengukuran glukosa darah sering dilakukan untuk memantau keberhasilan mekanisme regulatorik ini. Penyimpangan yang berlebihan dari normal, baik terlalu tinggi atau terlalu rendah, menandakan terjadinya gangguan homeostatis dan sudah semestinya mendorong tenaga analis kesehatan melakukan pemeriksaan untuk mencari etiologinya (Sacher & McPherson, 2004).
1) Tes glukosa darah
Tes glukosa darah dapat dilakukan dengan self testing atau autonomic monitoring.
a) Self testing
Menggunakan meteran glukosa darah (Glukometer) untuk menguji tingkat gula darah dengan cara menempatkan setetes darah dari jari ke strip pengujian. Meteran membaca strip, dan hasilnya muncul sebagai angka di layar monitor (National institute of Diabetes and digestive and kidney diseases, 2013).
Gambar 7. Skema reaksi umum yang terjadi pada strip Accu-chek Sumber : (Hönes J et al, 2008).
Selain metode enzematis yang terdapat pada glukometer, terdapat pula metode lainnya untuk mengukur kadar glukosa darah yakni: Metode oksidasi-reduksi
Pengukuran kadar glukosa darah berdasarkan pada sifatnya sebagai zat pereduksi dalam larutan alkali panas. Metode ini tidak spesifik karna adanya zat-zat non glukosa lain yang bersifat mereduksi.
Metode Kondensasi
Keuntungan menggunakan glukometer :
Cukup akurat untuk memantau glukosa darah sehari-hari
Dapat menyimpan setidaknya 100 hasil pembacaan
Mudah di gunakan di klinis ataupun dirumah
Ukurannya kecil
Waktu pembacaan nilai cepat
Cukup dengan setetes darah (darah kapiler)
Darah hanya di tempelkan pada ujung strip tidak perlu
dimasukan dalam glukometer
Pembersihan mudah bahkan mungkn tidak perlu
(Chase & Maahs, 2011).
Kekurangan menggunakan glukometer:
Dapat tejadi false low bila strip tidak dipasang dengan tepat,
tetesan darah yang terlalu sedikit atau meremas jari pasien terlalu kuat
Dapat terjadi false high bila jari pasien yang diperiksa
terkontaminasi dengan gula atau produk lain yang mengandung glukosa
Strip yang rusak menghasilkan false low/false high
Pasien shock dan penderita Polycythemia tidak dianjurkan
karna dapat menghasilkan false low
Pasien dehidrasi dan anemia tidak dianjurkan karna dapat
Power baterai dalam keadaan rendah menghasilkan kode error
pada monitor (Food and Drug Administration, 2015).
Gambar 8. Tes glukosa darah menggunakan Glukometer. Sumber : (Eisenberg, 2012).
Penggunaan glukometer dengan sampel darah kapiler telah banyak dilakukan karena mudah melakukan, tidak menyakitkan bagi penderita dan biayanya lebih murah dibandingkan plasma vena serta memiliki keakuratan yang cukup baik. pemeriksaan glukosa darah kapiler yang diukur dengan alat glukometer ternyata memiliki sensitivitas 70% dan spesifisitas 90% (Rolka et al., 2001).
(untuk menilai adanya hipoglikemia nokturnal yang kadang tanpa gejala) (Permana, 2011).
Macam-macam waktu pemeriksaan glukosa darah antaralain : Glukosa darah sewaktu
Pemeriksaan gula darah yang dilakukan setiap waktu sepanjang hari tanpa memperhatikan makanan terakhir yang dimakan dan kondisi tubuh orang tersebut (Permana, 2011). Glukosa darah puasa dan 2 jam setelah makan
Pemeriksaan glukosa darah puasa adalah pemeriksaan glukosa yang dilakukan setelah pasien berpuasa selama 8-10 jam, sedangkan pemeriksaan glukosa 2 jam setelah makan adalah pemeriksaan yang dilakukan 2 jam dihitung setelah pasien menyelesaikan makan (Permana, 2011).
b) Autonomic monitoring
Gambar 9. Pemeriksaan glukosa darah dengan autonomic monitoring Sumber : (Eisenberg, 2012).
2) Tes HbA1C
Tes HbA1C atau tes hemoglobin terglikosilasi, disebut juga sebagai glikohemoglobin atau hemoglobin glikosilasi merupakan cara yang digunakan untuk menilai efek perubahan terapi 8-12 minggu sebelumnya. Pemeriksaan HbA1C dianjurkan dilakukan setiap 3 bulan, minimal 2 kali dalam setahun. Memiliki kadar HbA1C 7 persen atau di bawah itu berarti gula darah telah dikendalikan dengan baik selama 3 bulan terakhir (National institute of Diabetes and digestive and kidney diseases, 2013).
Tabel 7. Kadar glukosa berdasarkan persentase nilai tes HbA1C HbA1C (%) Rerata glukosa darah (mg/dl)
6% 135 mg/dl
7% 170 mg/dl
8% 205 mg/dl
9% 240 mg/dl
10% 275 mg/dl
11% 310 mg/dl
12% 345 mg/dl
2.4.Mencit (Mus musculus L).
Menurut Kimbal (1996), mencit diklasifikasikan sebagai berikut :
Kingdom : Animalia Phyllum : Chordata Classis : Mamalia
Ordo : Rodentia
Familia : Muridae
Genus : Mus
Spesies : Mus Musculus L.
Gambar 10. Mencit (Mus muculus L.) Sumber : (Departemen Kesehatan RI, 2001).
Mencit merupakan hewan yang paling banyak digunakan sebagai hewan model laboratorium dengan kisaran penggunaan antara 40-80%. Kadar glukosa darah mencit normal berkisar 62-175 mg/dl. (Nicholas 2003). Mencit banyak digunakan sebagai hewan coba dikarenakan siklus hidup relatif pendek, jumlah anak perkelahiran banyak, variasi sifat-sifatnya tinggi, mudah ditangani, serta sifat produksi dan karakteristik reproduksi mirip hewan lain, seperti sapi, kambing, domba dan babi (Molole & Pramono, 1989).
2.4.1.Jenis-jenis mencit
Saat ini mencit model obesitas menjadi hal penting dalam penelitian untuk memahami interaksi diet tinggi lemak dan perkembangan obesitas. Makanan yang kaya lemak telah terbukti menghasilkan peningkatan berat badan dan diabetes dalam berbagai strain tikus dan mencit. Dalam 20-30 tahun terakhir, telah banyak penelitian yang mempelajari karakteristik respon dari hewan uji yang diberikan diet tinggi lemak (Wang & Liao, 2013).
Banyak model mencit yang telah dilaporkan bisa mengalami diabetes secara spontan. Masing-masing galur memiliki perbedaan proses dalam mecapai kondisi diabetes dan tidak memuaskan saat digunakan untuk mempelajari komplikasi dari diabetes itu sendiri, sehingga diperlukan galur baru dalam mempelajari diabetes. Tsumura dkk telah menemukan mencit model baru dari galur ddY, yakni mencit jantan TSOD (Tsumura, Suzuki, Obese Diabetes). Nama ddY sendiri diambil dari nama Deutschland, Denken dan Yoken yang menunjukkan daerah asal mencit tersebut sedangkan nama TSOD diambil dari nama peneliti yang menemukan mencit model obesitas tersebut. Selain mencit ddY TSOD terdapat juga turunan dari mencit galur ddY yakni TSNO (Tsumura, Suzuki, Non Obesity) yang merupakan mencit galur ddY yang tidak menunjukkan tanda obesitas dan urinary glucose (Suzuki et al., 1999).
Gambar 11. Mencit galur ddY model TSNO dan TSOD Sumber : (Institute for Animal Reproduction, 2005).
TSOD adalah mencit yang secara alami dapat menjadi obesitas dan dapat menunjukkan gejala poliuria, polidipsia, polifagia. Glukosa dapat ditemukan di dalam urin mencit (urinary glucose) serta terjadi peningkatan asupan makan dan minum, juga telihat terjadi penambahan berat badan dan lemak tubuh. pada pemeriksaan darah terlihat adanya peningkatan kadar dari parameter diabetes di dalam darah seperti glukosa, insulin dan lipid. Pada studi histologi ditemukan kondisi hypertropi pada pulau pankreas tanpa ada tanda dari insulitis atau pembentukan jaringan fibrosa. Kondisi hyperglikemia, hyperinsulinemia dan hyperthropy terlihat sangat menonjol pada usia produktif mencit. Melihat dari hal tersebut mencit model TSOD jantan galur ddY sangat berguna pada penelitian mengenai obesitas, diabetes serta komplikasinya (Suzuki et al, 1999).
Tabel 8. Klasifikasi hewan dengan diabetes tipe 2 Kategori Model Model diabetes type 2
Obesitas Non Obesitas I Hewan diabetes spontan
atau karena genetik
II Induksi Diet/nutrisi hewan diabetes
Tikus Sand Mencit C57/BL 6J Mencit Spiny
---
III Induksi kimiawi hewan diabetes
Mencit obesitas diberi GTG Tikus dewasa, mencit dengan dosis rendah ALX atau STZ Tikus Neonatal STZ IV Hewan bedah diabetes Tikus diet obes diabetes lesi
VHM
Mencit 3 reseptor knockout
2.5.Kerangka Teori
Gambar 13. Kerangka Teori
Sumber : (Lebowitz et al., 2012; Wulan et al., 2011)
Herediter
2.6.Kerangka Konsep
Gambar 11. Kerangka Konsep
2.7.Hipotesis
H0 : Tidak terdapat pengaruh pemberian tempe kedelai terhadap glukosa
darah puasa mencit jantan galur ddY obesitas.
H1: Terdapat pengaruh pemberian tempe terhadap glukosa darah puasa
mencit jantan galur ddY obesitas.
Variabel Independent : OBESITAS
TEMPE
Variabel Dependent :
KADAR GLUKOSA DARAH↓
III. METODE PENELITIAN
3.1.Desain Penelitian
Jenis penelitian ini adalah true experimental dengan pre-post test with randomized control group design. Pemilihan subjek penelitian untuk pengelompokan dan pemberian perlakuan menggunakan metode random sampling. Penelitian ini menggunakan mencit jantan galur ddY yang dibagi menjadi 4 kelompok. Terdiri atas kelompok kontrol normal (K1), kelompok kontrol obesitas (K2), kelompok pemberian pakan tempe 2 gr/hari (KP1) dan kelompok pemberian pakan tempe 4 gram/hari (KP2).
3.2.Tempat dan Waktu
3.2.1.Tempat
3.2.2.Waktu
Penelitian ini dilaksanakan dari bulan September sampai bulan Oktober 2015.
3.3.Populasi dan Sampel
3.3.1.Populasi
Populasi dari penelitian ini adalah mencit (Musmusculus L.) jantan galur ddY berusia 6-8 minggu dengan berat badan rata-rata 20-40 gram. Mencit diperoleh dari Institut Pertanian Bogor (IPB).
3.3.2.Sampel
Sampel yang digunakan dalam penelitian ini sebanyak 20 ekor mencit. Dimana dibagi atas 4 kelompok. Sesuai rumus Federer. rumus penentuan besar sampel untuk uji eksperimental rancangan acak lengkap (RAL) adalah:
Dimana t merupakan jumlah kelompok percobaan dan n merupakan jumlah sampel tiap kelompok. Penelitian ini akan menggunakan 4 kelompok sehingga perhitungan sampel menjadi :
t(n-1) ≥15
Jadi sampel yang digunakan pada tiap kelompok adalah 5 ekor mencit jantan (n ≥4,75). Sehingga pada penelitian ini digunakan 20 ekor mencit
jantan dan dibagi menjadi empat kelompok secara acak. Pembagian empat kelompok mencit, yaitu :
Kelompok K1 : 5 mencit kontrol normal yang diberi pakan standar dan minum secara ad libitum
Kelompok K2 : 5 mencit kontrol obesitas yang diberi pakan tinggi lemak tinggi protein dan minum secara ad libitum
Kelompok KP1 : 5 mencit obesitas yang diberi pakan tinggi lemak tinggi protein + tempe 2gr/hari dan minum secara ad libitum
Kelompok KP2 : 5 mencit obesitas yang diberi pakan tinggi lemak tinggi protein + tempe 4gr/hari dan minum secara ad libitum.
3.3.3.Kriteria Penelitian a. Kriteria inklusi :
1) Mencit jantan galur ddY obesitas 2) Berumur 6-8 minggu
3) Berat badan mencit normal rata-rata 20-30 gram 4) Berat badan mencit obes rata-rata 31- 40 gram 5) Bergerak aktif
7) Tidak tampak adanya kelainan anatomis ataupun bekas luka. b. Kriteria eksklusi :
1) Terjadi penuruanan berat badan selama proses pemeliharaan lebih dari 10% dari awal penelitian
2) Tampak sakit selama proses pemeliharaan (gerak terbatas, bulu terlihat kusam, terdapat luka gigitan, kotoran cair).
3.4.Alat dan Bahan
3.4.1.Alat
a. Timbangan analitik b. Gunting
c. Alat tulis d. Glukometer e. Kandang mencit f. Tempat makan mencit 3.4.2.Bahan
a. Tempe kedelai b. Pakan standar mencit
c. Pakan tinggi lemak tinggi protein d. Aquades
3.5.Identifikasi variabel dan Definisi Operasional Variabel
3.5.1.Identifikasi Variabel
1. Variabel perlakuan adalah pemberian tempe dengan dosis 2 gram/hari dan 4 gram/hari
2. Variabel respon pada penelitian ini adalah perubahan kadar glukosa darah puasa mencit jantan galur ddY.
3.5.2.Definisi Operasional Variabel
Tabel 9. Definisi Operasional Variabel
kelompok besar yang terdiri dari 5 mencit jantan tiap kelompoknya. Sehingga total keseluruhan melibatkan 20 ekor mencit jantan. Pada penelitian ini terdiri atas kelompok kontrol normal (K1), kontrol obesitas (K2), kelompok pemberian tempe 2 gram/hari (KP1) dan kelompok pemberian tempe 4 gram/hari.
Pengukuran kadar gula darah puasa dilakukan dilaboratorium Biologi-Biokimia Molekuler Fakultas Kedokteran Universitas
Lampung. Hasil penelitian berupa data dan ditabulasi untuk mengetahui pengaruh pemberian tempe terhadap kadar glukosa darah puasa mencit jantan galur ddY obesitas.
3.6.2.Prosedur Pemberian Tempe
Berdasarkan data dari Guidelines for the Housing Of Mice In Scientific Institutions 2012. Konsumsi pakan mencit berkisar dari 4-8 gram/hari dan konsumsi air 5-8 ml/hari. (Fawcett, 2012). Pakan tempe diberikan dengan dosis 2 gram/hari pada KP1 dan 4 gram/hari pada KP2. Tempe diberikan satu kali pada pagi hari dengan meletakkan pada tempat makan mencit dan dipastikan agar habis ketika siang hari setelah itu mencit tetap diberikan pakan tinggi lemak tinggi protein untuk mencit obesitas dan pakan standar untuk mencit normal.
3.6.3.Prosedur Pengambilan Darah Mencit
3.7.Diagram Alur Peneliian
Gambar 15. Diagram Alur Penelitian Hari ke-29 mencit di puasakan selama 8 jam
Analisis data
Sampel diperiksa di Laboratorium Biologi-Biokimia Molekuler Fakultas Kedokteran Universitas Lampung
Pengambilan sampel darah melalui vena cauda ekor mencit Mencit Obesitas Hari ke-1 mencit dipuasakan selama 8 jam, kemudian diukur kadar
glukosa darahnya dan dicatat
K1 K2 KP1 KP2
Mencit diadaptasikan di laboratorium selama 7 hari
Mencit dipilih secara acak (simple random sampling) untuk menghindari bias, kemudian di kelompokkan
Keterangan :
K1 = Kelompok kontrol normal K2 = Kelompok kontrol obesitas
KP1 = Kelompok perlakuan pemberian pakan tempe 2 gram/hari KP2 = Kelompok Perlakuan pemberian pakan tempe 4 gram/hari.
3.8.Rancangan Analisis Data
Analisis data pada penelitian ini diproses dengan program SPSS Version 21.0.0.0 for windows 64 bit, dengan prosedur sebagai berikut :
3.8.1.Uji Normalitas Data (p>0,05)
Pengujian normalitas data menggunakan Shapiro Wilk test untuk mengetahui data berdistribusi normal atau tidak normal karena populasi <50. Hasil uji normalitas ini untuk menetukan analisis data berikutnya, yaitu analisis parametrik bila data berdistribusi normal atau non parametrik apabila data tidak berdistribusi normal.
3.8.2.Uji Homogenitas Data (p>0,05)
3.8.3.Uji Parametrik (Dependent t-test)
Untuk menguji pengaruh kelompok kontrol normal (K1), kelompok kontrol obesitas (K2), kelompok pemberian tempe 2 gram/hari (KP1) dan kelompok pemberian tempe 4 gram/hari (KP2) sebelum dan 28 hari setelah perlakuan. Apabila distribusi data tidak normal maka digunakan uji alternatif berupa uji Wilcoxon. Hipotesis dianggap bermakna bila p<0,05.
3.8.4.Uji Parametrik (One way- Anova)
Dilakukan untuk menguji perbedaan pengaruh kelompok kontrol 1 (K1), kelompok kontrol 2 (K2), kelompok perlakuan (KP1) dan kelompok perlakuan 2 (KP2) terhadap glukosa darah mencit obesitas yang diberi tempe. Bila tidak memenuhi syarat uji parametrik, digunakan uji non parametrik Kruskal-Wallis. Hipotesis dianggap bermakna bila p<0,05. Jika pada uji One way-Anova atau Kruskal-Wallis menghasilkan nilai p<0,05, maka dilanjutkan dengan melakukan analisis Post-Hoc LSD untuk melihat perbedaan antar kelompok.
3.9.Etika Penelitian
1. Replacement
Adalah keperluan memanfaatkan hewan percobaan sudah diperhitungkan secara seksama, baik dari pengalaman terdahulu maupun literatur untuk menjawab pertanyaan penelitian dan tidak dapat digantikan oleh makhluk hidup lain seperti sel atau biakan jaringan. 2. Reduction
Adalah pemanfaatan hewan dalam penelitian sesedikit mungkin, tetapi tetap dapat mendapatkan hasil yang optimal. Dalam penelitian ini sampel dihitung berdasarkan rumus Frederer yaitu t(n-1) ≥ 15, Dimana t merupakan jumlah kelompok percobaan dan n merupakan jumlah pengulangan atau jumlah sampel tiap kelompok.
3. Refinement
Adalah memperlakukan hewan percobaan secara manusiawi dengan prinsip dasar membebaskan hewan coba dalam beberapa kondisi, yaitu sebagai berikut.
a. Bebas dari rasa lapar dan haus, dalam penelitian ini hewan coba diberikan pakan dan minum standar secara ad libitum.
c. Bebas dari nyeri dan penyakit. Dengan menjalankan program kesehatan, pencegahan, dan pemantauan, serta pengobatan terhadap hewan coba jika diperlukan.
Prosedur perlakuan dan pengambilan sampel selama penelitian telah dijelaskan dengan mempertimbangkan tindakan manusiawi dan prinsip etika penelitian hewan coba. Hal ini dilakukan untuk menghargai kehidupan hewan coba sesuai dengan etika penelitian yang berlaku. (Ridwan, 2013).
V. KESIMPULAN DAN SARAN
5.1.Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat diambil kesimpulan sebagai berikut :
1. Rerata kadar glukosa darah puasa mencit normal sebelum dan 28 hari setelah penelitian adalah 107 mg/dl dan 122 mg/dl.
2. Rerata kadar glukosa darah puasa mencit obesitas sebelum dan 28 hari setelah penelitian adalah 160 mg/dl dan 171 mg/dl.
3. Rerata kadar glukosa darah puasa mencit obesitas yang diberi pakan tempe 2gr/hari sebelum dan 28 hari setelah penelitian adalah 153 mg/dl dan 118 mg/dl.
4. Rerata kadar glukosa darah puasa mencit obesitas yang diberi pakan tempe 4 gr/hari sebelum dan 28 hari setelah penelitian adalah 175 mg/dl dan 116 mg/dl.
5.2.Saran
Adapun saran yang ingin peneliti sampaikan adalah :
1. Penelitian ini mendapatkan hasil yang bermakna bahwa konsumsi tempe menurunkan kadar glukosa darah. Sehingga dianjurkan kepada masyrakat untuk mengkonsumsi tempe secara rutin.
DAFTAR PUSTAKA
American Diabetes Association. 2004. All About Blood Glucose for People with Type 2 Diabetes, USA.
Ariani, S.R.D. & Hastuti. 2009. Analisis Isoflavon dan Uji Aktivitas Antioksidan Pada Tempe dengan Variasi Lama Waktu Fermentasi dan Metode Ekstraksi [report]. Surakarta: UNS Surakarta.
Aswani, V. 2010. How Well Do You Understand Blood Glucose Levels? Medscape. [di akses September 16, 2015] tersedia di : http://www.medscape.com/viewarticle/438144.
Badan Standardisasi Nasional, 2012. Tempe : Persembahan Indonesia untuk Dunia, Jakarta.
Bell, D.S. 2001. Importance of Postprandial Glucose Control. Medscape. [di akses
September 16, 2015] tersedia di :
http://www.medscape.com/viewarticle/410819
Bender, D.A. & Mayes, P.A., 2012. Glukoneogenesis & Kontrol Glukosa Darah. Dalam: Biokimia Harper. Jakarta: EGC. hlm. 174–83.
Bintanah, S. & Kusuma, H.S. 2010. Pengaruh Pemberian Bekatul dan Tepung Tempe Terhadap Profil Gula Darah Pada Tikus Yang Diberi Alloxan. Jurnal Pangan dan Gizi. 10(02):1–9.
Chase, H.P. & Maahs, D.M. 2011. Blood Sugar (Glucose) Testing. Dalam: A First Book for Understanding Diabetes. New York: The Pink Panther. hlm 49–61.
Departemen Kesehatan RI. 2001. Pedoman Pengendalian Tikus di Rumah Sakit [report]. Jakarta.
Dorland, W.A.N. 2012. Kamus Saku Kedokteran Dorland 28th ed. Jakarta: EGC.
Dubowsky, K.M. 2008. An O-toluidine Method for Body-Fluid Glucose Determination. Clin Chem. 11(54):1919–20.
Eisenberg, J.M. 2012. Methods for Delivering Insulin and Monitoring Blood Sugar [report]. Texas.
Fawcett, A. 2012. Guideline 22 Guidelines for the Housing of Mice in Scientific Institutions Table of Contents. West Pennant Hills.
Food and Drug Administration. 2015. Common Problems with the Use of Glucose Meters at the Point of Care. USA.
Ghozali, D.S., Handharyani, E. & Rimbawan. 2010. Pengaruh tempe terhadap kadar gula darah dan kesembuhan luka pada tikus diabetik. Cdk. 37(3):167– 173.
Guyton, A.C. & Hall, J.E. 2012. Metabolisme Karbohidrat dan Pembentukan Adenosin Trifosfat. Dalam: Buku Ajar Fisiologi Kedokteran Jakarta: EGC. hlm. 871–81.
Harvey, R.A. & Ferrier, D.R. 2011. Intermediary Metabolism. Dalam:
Lippincott’s Illustrated Reviews Biochemistry. USA: Lippincott Wiliams & Wilkans. hlm 83–137.
Hönes J, Müller P & Surridge N. 2008. The technology behind glucose meters: test strips. Diabetes Technol Ther. 10(suppl1):s10–s26.
Institute for Animal Reproduction. 2005. Mouse TSOD (Metabolic syndrome model animal) TSNO (Control of TSOD) [report]. Japan.
Kaestner, R. 2009. Obesity : Causes, Consequences and Public Policy Solutions. Chicago : The Illinois Report. hlm 94–102.
Kementerian Kesehatan RI, 2013. Riset Kesehatan Dasar. Jakarta : Badan Penelitian dan Pengembangan Kesehatan Kementerian Kesehatan RI. hlm 216–25.
Kimball, J., Tjitrosomo SS., Soegiri N. 1996. Biology. Addison Wisley Publishing Company.
Kurniawan, A., 2012. Gizi seimbang untuk mencegah hipertensi [report]. Jakarta : Direktorat Gizi Masyarakat.
Lebowitz, J., Pazirandeh, M. & Stern, C. 2012. The Effects of Obesity and Overweight on Health Monitoring for BMI at Every Visit. California : California Pharmacist.
Lieberman, M. & Marks, A.D. 2013. Carbohydrate Metabolism. Dalam: Basic Medical Biochemistry A Clinical Approach, Edisi 4. Philadelphia: Lippincott Williams & Wilkins. hlm 478–80.
McKee, T. & McKee, J.R. 2011. Carbohydrate metabolism. Dalam: Biochemistry: The Molecular Basis of Life. OUP. hlm 1–43.
Molole, M.B. & Pramono, C.S. 1989. Penggunaan Hewan-hewan Percobaan Laboratorium [report]. Departemen Pendidikan dan Kebudayaan. Bogor : Institut Pertanian Bogor
Murray, R.K., Granner, D.K. & Rodwell, V.W. 2012. Bioenergetika & Metabolisme Karbohidrat & Lipid. Dalam: Biokimia Harper. Jakarta: EGC. hlm 119–27.
National institute of Diabetes and digestive and kidney diseases. 2013. Your Guide to Diabetes Type 1 and Type 2. Chicago : National Institute of Healt.
National Institutes of Healt. 2012. What Are Overweight and Obesity?. [di akses August 20, 2015] tersedia di: http://www.nhlbi.nih.gov/health/health-topics/topics/obe
Nicholas, J.B. 2003. The Laboratory Mouse [report]. Florida: University Veterinarian.
Permana, C. 2011. Perbedaan Pemeriksaan Kadar Glukosa Darah Puasa yang Diperiksa Segera dengan Ditunda Selama 1 Jam pada Suhu Ruang [skripsi]. Semarang: Universitas Muhammadiyah Semarang.
Priastiti, D.A. 2013. Perbedaan Kadar Kolesterol Ldl Penderita Dislipidemia Pada Pemberian Tempe Kedelai Hitam Dan Tempe Kedelai Kuning [skripsi]. Semarang: Universitas Diponogoro.
Putri, R. 2012. Hubungan Obesitas dengan Citra Tubuh pada Mahasiswa Ilmu Pengetahuan Budaya Universitas Indonesia (FIB UI) [skripsi]. Jakarta: Universitas Indonesia.
Rahadiyanti, A. 2011. Pengaruh Tempe Kedelai Terhadap Kadar Glukosa Darah pada Prediabetes [skripsi]. Semarang: Universitas Diponegoro Semarang.
Rahmawati, N. 2009. Aktifitas fisik, konsumsi makanan cepat saji (fastfood) dan keterpaparan media serta faktor-faktor lain yang berhubungan dengan kejadian obesitas pada siswa SD Islam Al-Azhar 1 Jakarta Selatan tahun 2009 [skripsi]. Jakarta: Universitas Indonesia.
Rankinen, T. et al. 2006. The human obesity gene map: the 2005 update. Obesity 14(4):529–644.
Rolka, D.B. et al. 2001. Performance of recommended screening tests for undiagnosed diabetes and dysglycemia. Diabetes care 24(11):1899–903.
Sacher, R.A. & McPherson, R.A. 2009. Tinjauan klinis hasil pemeriksaan laboratorium 11th ed. Jakarta: EGC.
Setyowati, R., Sarbini, D. & Rejeki, S. 2008. Pengaruh Penambahan Bekatul Terhadap Kadar Serat Kasar, Sifat Organoleptik dan Daya Terima pada Pembuatan Tempe Kedelai (Glycine max (L) Meriil). Jurnal Penelitian Sains & Teknologi 9(1):52–61.
Scheepers, A. Joost, H.-G. & Schurmann, A., 2004. The Glucose Transporter Families SGLT and GLUT: Molecular Basis of Normal and Abberant Function. Parenteral and Enternal Nutrition, 28(5):364–71.
Sinha, S. 2013. Fructose 1,6-Diphosphatase Deficiency. Medscape. [di akses
September 16, 2015] tersedia di:
http://emedicine.medscape.com/article/943882-overview
Srinivasan, K. & Ramarao, P. 2007. Animal models in type 2 diabetes research: an overview. The Indian journal of medical research 125(3):451–72.
Suarsana, I.N. et al. 2008. Aktivitas Daya Hambat Enzim α−Glukosidase dan Efek Hipoglikemik Ekstrak Tempe pada Tikus Diabetes. Jurnal Veteriner.9(3):122–27.
Suarsana, I.N., Priosoeryanto, B.P. & Wresdiyati, T. 2010. Sintesis Glikogen Hati dan Otot pada Tikus Diabetes yang Diberi Ekstrak Tempe. Jurnal Veteriner. 11(3):190–95.
Suzuki, W. et al. 1999. A new mouse model of spontaneous diabetes derived from ddY strain. Exp anim 48(3):181–89.
Wang, C. & Liao, J.K. 2013. A Mouse Model of Diet-Induced Obesity and Insulin Resistance. Methods Mol Biol 10(5):421–33.
Wilcox, G. 2005. Insulin and insulin resistance. The Clinical Biochemist Reviews, 26(2):19–39.
Wolfe, L.C. 2015. G6PD Deficiency. Medscape. [di akses September 16, 2015] tersedia di: http://emedicine.medscape.com/article/119184-overview.
World Health Organization. 2015. Obesity and overweight [report]. WHO Media centre.