ANALISIS PERBANDINGAN TIGA KLON TORBANGUN
(
Plectranthus amboinicus
(Lour.) Spreng)
BERDASARKAN KARAKTERISTIK FENOTIPE DAN
KANDUNGAN SENYAWA FENOLIK
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2013
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Analisis Perbandingan Tiga Klon Torbangun (Plectranthus amboinicus (Lour.) Spreng) Berdasarkan Karakteristik Fenotipe dan Kandungan Senyawa Fenolik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ELVA HASNA. Analisis Perbandingan Tiga Klon Torbangun (Plectranthus amboinicus (Lour.) Spreng) Berdasarkan Karakteristik Fenotipe dan Kandungan Senyawa Fenolik. Dibimbing oleh NURI ANDARWULAN dan SANDRA ARIFIN AZIZ.
Torbangun (Plectranthus amboinicus (Lour.) Spreng) merupakan salah satu sayuran berkhasiat obat yang dikonsumsi di Indonesia. Khasiat merupakan efek dari komponen bioaktif yang berada dalam tanaman, yang dipengaruhi oleh faktor lingkungan. Pada penelitian ini dilakukan perbandingan tiga klon torbangun berdasarkan karakteristik fenotipe, fenolik, serta dikuatkan dengan PLS-DA (Partial Least Square - Discriminant Analysis). Dari hasil identifikasi fenotipe menggunakan deskriptor torbangun yang disusun berdasarkan panduan dari IPGRI diketahui bahwa terdapat dua tipe torbangun: klon A merupakan torbangun bertipe daun tebal, sedangkan klon B dan C bertipe daun tipis. Namun, ketiga klon berbeda signifikan dalam kuantitas total fenolnya, yaitu antara 78.68-149.78 mg GAE/100 g BK. Lain halnya dengan kadar total antosianin yang tidak berbeda signifikan pada klon A dan C, dengan kisaran konsentrasi antara 0.08-0.18 mg C3GE/100 g BK. Metode ekstraksi dan hidrolisis flavonoid yang dilakukan, yaitu selama 2 jam, [HCl] 1.2 M (metode flavonol) dan selama 4 jam, [HCl] 2.0 M (metode flavon). Dengan kedua metode tersebut kelima flavonoid utama (myricetin, quercetin, kaempferol, luteolin, dan apigenin) berhasil dikuantifikasi, dimana kadar yang diperoleh bervariasi mulai 2.35 hingga 86.87 mg/100 g BK. Luteolin diketahui merupakan flavonoid terbanyak yang teridentifikasi, sedangkan yang terendah adalah myricetin. Hasil PLS-DA terhadap data spektrum HPLC yang diperoleh dari kedua metode tersebut mengilustrasikan perbedaan karakteristik flavonoid dari ketiga klon. Dari metode flavonol, senyawa marker klon A adalah unknown peak-4 dan 6; senyawa marker klon B adalah myricetin dan quercetin; sedangkan klon C hanya kaempferol. Dari metode flavon, diketahui bahwa senyawa marker dari klon A adalah apigenin, kaempferol, unknown peak-4, dan 6; bagi klon B, yaitu myricetin dan quercetin; sedangkan bagi klon C, yaitu kaempferol.
ABSTRACT
ELVA HASNA. Comparative Analysis of Three Clones Torbangun (Plectranthus amboinicus (Lour.) Spreng) Based on Phenotype Characteristics and Phenolics Content. Supervised by NURI ANDARWULAN and SANDRA ARIFIN AZIZ.
Torbangun (Plectranthus amboinicus (Lour.) Spreng) is a medicinal vegetable consumed in Indonesia. Efficacy of bioactive components within the plant are influenced by environmental factors. In this study, comparison of three clones of torbangun (A, B, and C clones) were analysed through its phenotype and phenolic characteristics, then strengthened by PLS-DA (Partial Least Square - Discriminant Analysis). Initially, the results of the phenotype identification using torbangun descriptor, which was prepared under IPGRI guidelines, showed two types of torbangun: A clone is a thick-leaved torbangun, whereas clones B and C were thin-leaved. These three clones differed significantly in total phenolics content, between 78.68-149.78 mg GAE/100 g DB. Total anthocyanins content was not significantly different in clones A and C, the concentrations are between 0.08-0.18 C3GE/100 mg g DB. Methods of extraction and hydrolysis of flavonoids are flavonol method (2 hours extraction, [HCl] 1.2 M) and flavon method (4 hours extraction, [HCl] 2.0 M). Both methods were successfully quantified the five main flavonoids (myricetin, quercetin, kaempferol, luteolin, and apigenin), where the contents obtained varied from 2.35-86.87 mg/100 g DB. Luteolin was the highest identified flavonoid, while the lowest one was myricetin. PLS-DA of HPLC flavonoids spectral data which obtained from both methods, illustrated the different characteristics of the three clones torbangun. In flavonol method, the marker compounds for A clone were unknown peak-4 and 6; while marker compounds for B clone were myricetin and quercetin, and C clone had only kaempferol. In flavone method, the marker compounds of A clone were apigenin, kaempferol, unknown peak-4, and 6; for B clone, myricetin and quercetin; whereas C clone had only kaempferol.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
ANALISIS PERBANDINGAN TIGA KLON TORBANGUN
(
Plectranthus amboinicus
(Lour.) Spreng)
BERDASARKAN KARAKTERISTIK FENOTIPE DAN
KANDUNGAN SENYAWA FENOLIK
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2013
Judul Skripsi : Analisis Perbandingan Tiga Klon Torbangun (Plectranthus amboinicus (Lour.) Spreng) Berdasarkan Karakteristik Fenotipe dan Kandungan Senyawa Fenolik
Nama : Elva Hasna
NIM : F24080123
Disetujui oleh
Prof. Dr. Ir. Nuri Andarwulan, M.Si Pembimbing I
Dr. Ir. Sandra Arifin Aziz M.S Pembimbing II
Diketahui oleh
Dr. Ir. Feri Kusnandar M.Sc Ketua Departemen
PRAKATA
Alhamdulillahilladzi bi ni’matiHi tatimmush-shalihat. Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia dan pertolongan-Nya sehingga karya ilmiah ini berhasil diselesaikan.
Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2012 hingga Februari 2013 ini ialah flavonoid, dengan judul Analisis Perbandingan Tiga Klon Torbangun (Plectranthus amboinicus (Lour.) Spreng) Berdasarkan Karakteristik Fenotipe dan Kandungan Senyawa Fenolik.
Terima kasih penulis sampaikan kepada Ibu Prof. Dr. Ir. Nuri Andarwulan M.Si dan Ibu Dr. Ir. Sandra Arifin Aziz M.S selaku pembimbing, serta Ibu Dr. Nancy Dewi Yuliana, S.TP, M.Sc. yang telah menjadi penguji dan memberi banyak masukan. Di samping itu, penghargaan penulis sampaikan kepada Mbak Ria Noviar, Mbak Ria CN, dan Mbak Irin yang telah membantu dan memberi masukan selama proses analisis kimia, Ibu Sekaryati yang telah banyak membantu penulis selama di lapangan. Ungkapan terima kasih juga saya sampaikan kepada Papa, Ibu, serta adik saya atas segala doa dan kasih sayangnya. Tak lupa kepada teman-teman sebimbingan (Hilda, Atikah, Harum), juga teman-teman ITP 45 yang selalu memberi dukungan terutama Lathifah, Intan, Diah, serta teman-teman lab mikrobiologi-SEAFAST (Riyah, Yani, Sarah, dan Ranti). Semoga Allah membalas kebaikan kalian dengan yang lebih baik.
Akhir kata, semoga karya ilmiah ini bermanfaat dan memperberat timbangan kebaikan bagi penulis dan pembimbing di akhirat kelak. Shalawat dan salam semoga tercurah atas Nabi Muhammad shallallahu ‘alaihi wa sallam, kepada keluarganya, para sahabatnya, serta umatnya yang setia hingga akhir zaman.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Torbangun 2
Komponen Bioaktif 6
Partial Least Square – Discriminant Analysis 12
METODE PENELITIAN 12
Bahan Penelitian 12
Peralatan Penelitian 13
Lokasi dan Waktu Penelitian 14
Prosedur Penelitian 14
HASIL DAN PEMBAHASAN 28
Identifikasi Tiga Klon Torbangun Secara Agronomis 28
Komponen Bioaktif Tanaman Torbangun 32
SIMPULAN DAN SARAN 49
Simpulan 50
Saran 50
DAFTAR PUSTAKA 51
LAMPIRAN 55
DAFTAR TABEL
1 Kandungan gizi daun torbangun 5
2 Hasil analisis kualitatif buah takokak 6
3 Spesifikasi HPLC 13
4 LOD kelima senyawa flavonoid 18
5 Perbandingan morfologi tanaman torbangun 32
6 Linieritas standar dan limit deteksinya 38
7 Kadar senyawa flavonol dan flavon yang terdeteksi dari tiga klon
torbangun (mg/100 g BK) 41
8 Perbandingan kadar flavonoid sampel daun torbangun dengan daun
katuk 42
9 Peak yang terdeteksi pada tiga klon daun torbangun 44
10 Senyawa marker dari tiap klon dan metode 46
DAFTAR GAMBAR
1 Torbangun (Plectranthus amboinicus (Lour.) Spreng) 3 2 Struktur dasar antosianin (Sumber: Lee et al. 2005) 8 3 Struktur dasar flavonoid dan ringkasan struktur flavonol dan flavon
yang diidentifikasi 9
4 Ukuran pucuk yang dipanen 15
5 Alat refluks berkondensor spiral yang digunakan 17
6 Persiapan sampel 21
7 Prosedur analisis total fenol 22
8 Prosedur analisis total antosianin 23
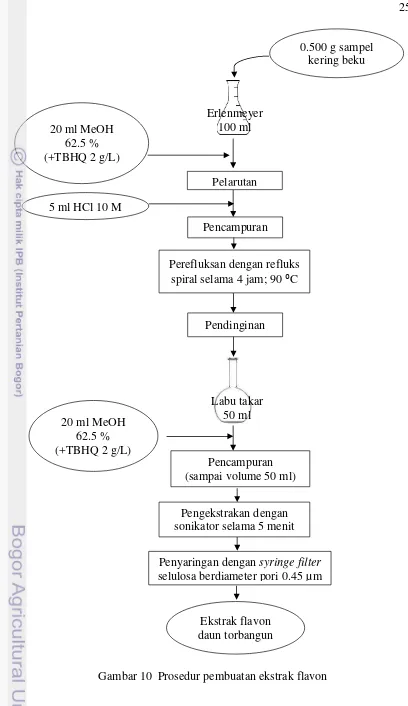
9 Prosedur pembuatan ekstrak flavonol 24
10 Prosedur pembuatan ekstrak flavon 25
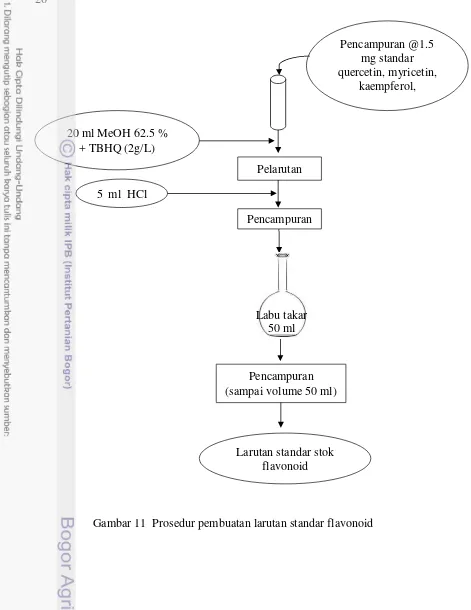
11 Prosedur pembuatan larutan standar flavonoid 26
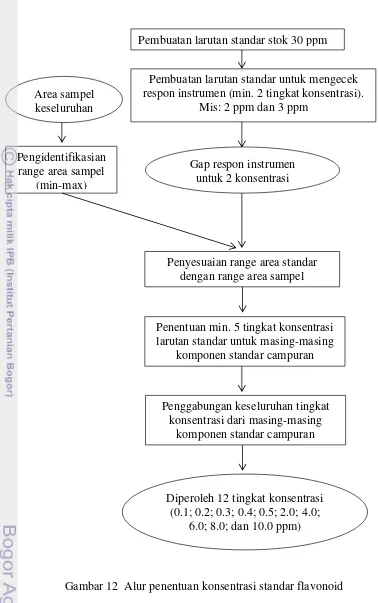
12 Alur penentuan konsentrasi standar flavonoid 27
13 Keadaan lahan pembudidayaan torbangun 29
14 Ketiga klon torbangun yang digunakan dalam penelitian 29 15 Penampang daun dari ketiga klon torbangun (ki-ka: klon A, B, dan C) 30
16 Diagram total fenol tiga klon torbangun. 34
17 Perubahan struktur antosianin pada pH berbeda (diadaptasi dari Lee et
al. 2005) 36
18 Diagram total antosianin tiga klon torbangun (diekspresikan dalam
cyanidin-3-glucoside/C3G) 36
19 Tipikal kromatogram standar campuran (konsentrasi 10 ppm, kecuali
apigenin [20 ppm]) 38
20 Tipikal kromatogram klon B yang dihasilkan dari metode ekstraksi dan
hidrolisis flavonol (atas) dan flavon (bawah) 40
21 Profil senyawa flavonol dan flavon pada tiga klon torbangun 41 22 Kromatogram HPLC tipikal untuk senyawa flavonoid dari tiap klon dan
waktu reaksi. Peak: myricetin (M), quercetin (Q), kaempferol (K), luteolin (L), apigenin (A), unknown peaks didefinisikan dengan nomor
23 (a) Score SP dan (b) Loading SP PLS-DA dari spektrum HPLC torbangun klon A, B, dan C dengan metode hidrolisis flavonol. 48 24 (a) Score SP dan (b) Loading SP PLS-DA dari spektrum HPLC
torbangun klon A, B, dan C dengan metode hidrolisis flavon. 49
DAFTAR LAMPIRAN
1 Dokumen hasil identifikasi/determinasi tumbuhan 55
2 Tata letak pembudidayaan tanaman di lahan 56
3 Deskriptor torbangun (Plectranthus amboinicus (Lour.) Spreng) 57
4 Kadar air ketiga klon daun torbangun segar 63
5 Kadar air ketiga klon daun torbangun setelah freeze drying 64
6 Kurva standar asam galat 65
7 Total fenol ketiga klon daun torbangun 66
8 Hasil ANOVA total fenol (BK) 67
9 Total antosianin tiga klon daun torbangun 68
10 Hasil ANOVA total antosianin (BK) 69
11 Kurva standar flavonoid (myricetin, quercetin, kaempferol, luteolin,
dan apigenin) 71
12 Kadar flavonoid ketiga klon daun torbangun dengan lama reaksi 2 jam,
konsentrasi HCl 1.2 M 73
13 Kadar flavonoid ketiga klon daun torbangun dengan lama reaksi 4 jam,
konsentrasi HCl 2.0 M 74
PENDAHULUAN
Latar Belakang
Torbangun (Plectranthus amboinicus (Lour.) Spreng.) merupakan salah satu tanaman obat (medicinal plants) yang daunnya telah digunakan
selama ratusan tahun oleh masyarakat Batak sebagai sayuran untuk meningkatkan kualitas dan kuantitas ASI yang telah terbukti pada manusia (Damanik et al. 2006). Daun torbangun juga dikonsumsi sebagai sayuran oleh masyarakat suku Batak secara umum, tidak hanya oleh ibu-ibu pasca melahirkan. Selain itu, efek farmakologis dari daun ini juga telah dikenal, antara lain sebagai penurun panas (antipiretik), antiseptik, peluruh angin (karminatif), penghilang rasa nyeri (analgesik), pengobat batuk, sakit tenggorokan, hidung tersumbat, serta rematik (Wijayakusuma 2006; Dalimartha 2008; Grace 2011).
Berbagai macam khasiat dari tanaman tersebut berkaitan dengan komponen bioaktifnya (Polya 2003). Komponen bioaktif adalah zat-zat ekstranutrisi yang biasa terdapat dalam jumlah sedikit di dalam makanan. Pengonsumsian senyawa ini dapat meningkatkan status kesehatan, serta mengurangi risiko penyakit-penyakit kronis seperti kanker, penyakit-penyakit jantung koroner, stroke, dan mungkin juga penyakit Alzheimer (Denny dan Buttriss 2005). Masih banyak informasi yang diperlukan untuk mengevaluasi kemanfaatannya bagi kesehatan, salah satunya mengenai kuantitas komponen bioaktif dalam bahan pangan.
Analisis menunjukkan bahwa torbangun mengandung komponen bioaktif antara lain alkaloid, terpenoid, saponin, tanin, dan flavonoid (Sathasivam dan Elangovan 2011; Kundu et al. 2011; dan Thenmozhi et al. 2011). Roshan et al. (2009) menuliskan bahwa senyawa flavonoid yang dikandung tanaman ini antara lain apigenin, luteolin, dan quercetin.
Jayadeepa (2011) menyatakan bahwa flavonoid seperti quercetin dan kaempferol berpotensi mengaktifkan reseptor prolaktin untuk menginduksi sekresi ASI. Oleh karena itu, penelitian ini dikerucutkan pada senyawa flavonoid, yang merupakan bagian dari senyawa fenolik. Lebih lanjut, flavonoid terbutkti mencegah oksidasi LDL secara in vitro. Studi in vivo dan in vitro menunjukkan bahwa senyawa flavonol dalam diet dapat menghambat kanker pada manusia dengan perannya sebagai antioksidan dalam plasma darah (Hollman dan Katan 1999). Dari sekian banyak kelas senyawanya, flavonoid yang dominan terkandung dalam sayuran dan dipelajari secara luas dalam studi antikarsinogenesis, antara lain flavonol; yaitu quercetin, kaempferol, dan myricetin; dan flavon; yaitu apigenin dan luteolin (Hertog 1992b dan Lee 2000).
sianidin dengan penambahan atau pengurangan gugus hidroksil, atau dengan metilasi atau glikosilasi (Harborne 1984).
Objek yang akan diteliti dalam penelitian ini adalah tiga klon (tanaman yang didapat dari perbanyakan secara vegetatif) tanaman torbangun berbeda fenotipe yang dapat ditemukan di toko-toko tanaman obat. Masing-masing klon diberi identitas A, B, dan C. Perbedaan fenotipe yang mudah diamati dari ketiga klon tanaman torbangun ini adalah pada ukuran dan tebal daun, serta warna batangnya. Istilah klon berarti kelompok tanaman yang berasal dari induk yang sama dan disebarkan secara aseksual (vegetatif), seperti penyetekan, pencangkokan, pembelahan, atau penyambungan (grafting) (Reed 2007).
Kandungan komponen bioaktif dalam tanaman terutama dipengaruhi oleh faktor lingkungan seperti iklim, tanah, dan pemupukan. Namun, variasi atau perbedaan genetik memegang peran yang paling penting (Bernhoft 2010). Oleh sebab itu, dalam penelitian ini peneliti melakukan kontrol terhadap lingkungan hidup tanaman torbangun yang berasal dari tiga klon berbeda. Dari ketiga klon tanaman ini dapat dipelajari lebih lanjut perbedaan senyawa bioaktif yang dikandung.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi perbandingan tiga klon torbangun berdasarkan karakteristik fenotipe, data kuantitatif senyawa fenolik, serta menganalisis spektrum hasil HPLC dengan metode PLS-DA untuk memperkuat karakterisasinya.
TINJAUAN PUSTAKA
Torbangun
Botani dan Taksonomi Torbangun
Torbangun berasal dari famili Lamiaceae, genus Plectranthus (ITIS 2012). Peringkat taksonominya adalah sebagai berikut:
Kingdom : Plantae
Subkingdom : Tracheobionta Superdivisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Subkelas : Asteridae
Ordo : Lamiales
Famili : Lamiaceae
Genus : Plectranthus L'Hér.
Tanaman ini memiliki beberapa sinonim secara botani, yaitu Coleus amboinicus Lour., Solenostemon scutellarioides (L.) Codd (ITIS 2012), Coleus aromaticus Benth., Coleus carnosus Hassk., Coleus suborbiculata Zoll & Mor., Plectranthus aromaticus (Benth.) Roxb (Dalimartha 2008). Dari keseluruhan sinonim nama botaninya, torbangun secara resmi memiliki nama latin Plectranthus amboinicus (Lour.) Spreng. yang berlaku secara internasional (ITIS 2012).
Dalam Bahasa Inggris, torbangun dikenal dengan beragam nama, seperti country-borage, Cuban-oregano, French-thyme, Indian-borage, Indian-mint, Mexican-mint, soup-mint, dan Spanish-thyme.
Dalam bahasa lain, tanaman ini juga dikenal dengan nama berbeda seperti oreille (Prancis), Jamaica-thymian (Jerman), orégano (Spanyol), orégano de cartagena (Kuba), torongil de limon (Filipina), kryddkarlbergare (Swedia) (GRIN 2010). Sedangkan, di Indonesia sendiri penamaannya juga beragam untuk daerah yang berbeda, seperti torbangun atau bangun-bangun, daun jinten, daun ati-ati, sukan, dan tramun di daerah Sumatera; acerang, ajeran (Sunda), daun jinten, daun kucing (Jawa), daun kambing, dan majha nereng (Madura) di daerah Jawa; iwak (Bali), golong (Flores), dan kumu etu (Timor) di daerah Nusa Tenggara (Dalimartha 2008).
Gambar 1 Torbangun (Plectranthus amboinicus (Lour.) Spreng)
panjang 5-7 cm, lebar 4-6 cm, warna hijau muda, jika diremas berbau harum. Permukaan majemuk berupa tandan dengan panjang 20 cm, keluar dari ujung percabangan dan ketiak daun, berwarna biru keunguan. Biji keras, berbentuk pipih, berwarna cokelat muda. Perbanyakan torbangun dilakukan dengan stek batang atau biji (Dalimartha 2008). Torbangun memiliki bunga yang dalam bentuk mayang, yang memuat sekitar 10-20 bunga dalam satu mayang. Pada bunganya dipenuhi rambut halus. Satu mayang berukuran sekitar 10-20 cm. Tangkai bunga berbentuk ramping, panjangnya hanya mencapai 5 mm. Kelopak bunganya berbentuk lonceng, sekitar 1.5-4 mm. Mahkota bunga berwarna biru pucat, lembayung muda, hingga merah muda, berukuran 8-12 mm. Filamen benang sari menyatu dalam sepal (Joshi 2013).
Torbangun mudah tumbuh pada kondisi kering dan area semi-teduh. Demikian pula pada daerah sub-tropis dan tropis, iklim dingin, di dalam pot, di dalam ruangan, atau pada lokasi terlindung yang hangat saat musim dingin (Grace et al. 2011). Dalimartha (2008) menyatakan bahwa tanaman ini biasa tumbuh liar di pegunungan atau tempat-tempat lainnya yang terlindung, terkadang ditanam di halaman dan kebun sebagai tanaman obat.
Terdapat berbagai literatur mengenai asal tanaman torbangun. Kundu et al. (2011) menyatakan bahwa spesies ini berasal dari India dan Mediterania. Germplasm Resources Information Network-GRIN (2010), sebuah proyek perangkat lunak online dari National Genetic Resources Program USDA yang menangani basis data dari seluruh koleksi plasma nutfah yang dimiliki National Plant Germplasm System, menuliskan bahwa tanaman torbangun berasal dari Afrika atau Asia. Lain halnya dengan Integrated Taxonomic Information System/ITIS (2011), yang menginformasikan bahwa tanaman tersebut berasal dari Karibia, Benua Amerika, dan Hawai. Dalimartha (2008) menyatakan bahwa torbangun diperkirakan berasal dari India kemudian tersebar di kawasan tropika dan pantropika.
Metabolisme Sekunder Tumbuhan dan Perkembangbiakan Vegetatif Tanaman Torbangun
Metabolisme utama pada tumbuhan, atau biasa disebut metabolisme primer, merupakan jalur metabolisme yang menghasilkan produk berupa polisakarida, protein, lemak, dan senyawa lainnya yang digunakan untuk kebutuhan hidup tumbuhan tersebut. Metabolit primer seringkali merupakan senyawa nutrisional bagi manusia. Lain halnya dengan metabolisme sekunder, produknya dapat berupa alkaloid, antosianin, flavonoid, quinon, lignan, steroid, dan terpenoid. Disebut “metabolisme sekunder” karena produknya dihasilkan melalui jalur turunan dari metabolit primer (Oksman-Caldentey 2002). Jumlah besar dari metabolit sekunder ini memiliki cakupan efikasi yang beragam, baik yang bersifat racun maupun kuratif terhadap kesehatan (Bernhoft 2010). Menjaga kesehatan agar tetap optimal dan mereduksi risiko berkembangnya jumlah penyakit degeneratif merupakan landasan pesatnya studi tentang hal ini. Dalam berbagai pustaka, istilah metabolit sekunder tanaman dapat berkembang menjadi fitokimia (phytochemical) atau komponen bioaktif (bioactive compound).
dengan cara penyetekan (Joy et al. 1998). Istilah klon berkaitan dengan varietas dan kultivar. Sekelompok tanaman dikatakan satu klon yang memiliki gen identik jika berasal dari satu individu, yang direproduksi secara vegetatif. Klon merupakan tipe spesifik dari sebuah kultivar, tetapi kultivar belum tentu dikatakan satu klon, karena kultivar dapat dihasilkan secara seksual (dengan biji) atau secara aseksual (Pittenger 2004). Oleh karena itu, istilah klon digunakan dalam penelitian ini.
Fitonutrien Torbangun
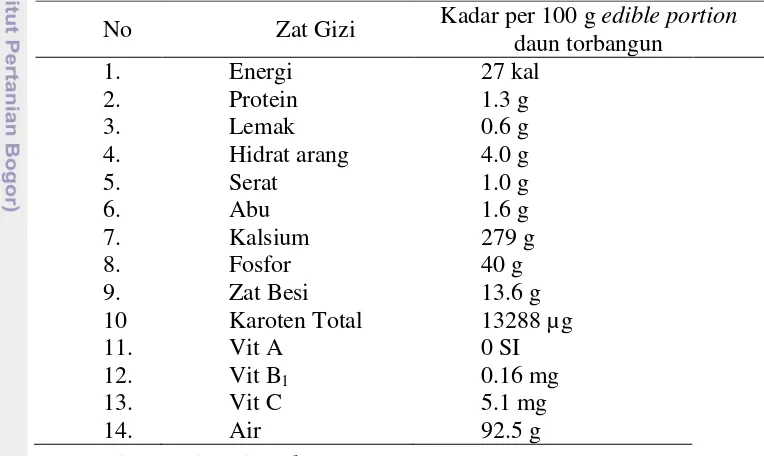
Bagian yang biasa dikonsumsi dari tanaman torbangun adalah bagian daunnya (Joy et al. 1998), yang memiliki rasa agak pedas, agak asam, getir, membuat rasa tebal di lidah, serta berbau tajam (khas torbangun) (Dalimartha 2008). Analisis proksimat untuk menunjukkan bahwa dalam setiap 100 g edible portion daun torbangun terkandung kalsium dan total karoten yang cukup tinggi, berturut-turut 279 g dan 13288 µg (Mahmud et al. 1990). Adapun zat gizi lain yang terkandung dalam daun torbangun dapat dilihat pada Tabel 1.
Tabel 1 Kandungan gizi daun torbangun
No Zat Gizi Kadar per 100 g edible portion daun torbangun
1. Energi 27 kal
2. Protein 1.3 g
3. Lemak 0.6 g
4. Hidrat arang 4.0 g
5. Serat 1.0 g
6. Abu 1.6 g
7. Kalsium 279 g
8. Fosfor 40 g
9. Zat Besi 13.6 g
10 Karoten Total 13288 µg
11. Vit A 0 SI
12. Vit B1 0.16 mg
13. Vit C 5.1 mg
14. Air 92.5 g
Sumber: Mahmud et al. (1990) Fitokimia Torbangun
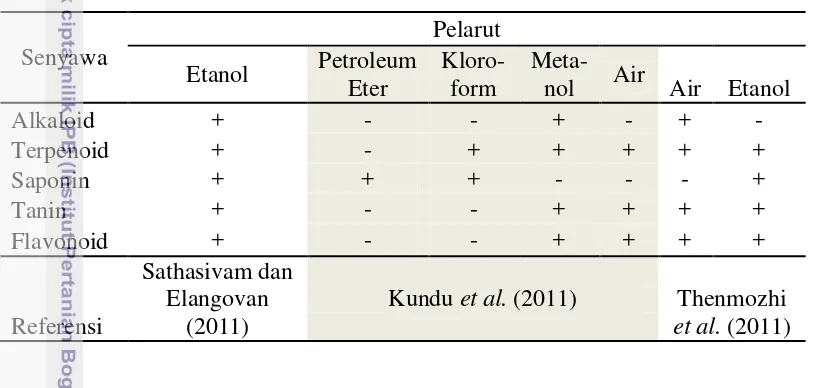
Selain bermanfaat dari segi nilai gizi, mengonsumsi daun torbangun juga bermanfaat dari segi fitokimia yang terkandung di dalamnya. Analisis bahan secara kualitatif dengan kromatografi lapis tipis yang dilakukan Sathasivam dan Elangovan (2011), serta dikuatkan pula oleh Kundu et al. (2011), dan Thenmozhi et al. (2011), bahwa secara kualitatif daun torbangun mengandung senyawa alkaloid, terpenoid, saponin, tanin, dan flavonoid (Tabel 2). Roshan et al. (2009) dalam jurnal ulasannya tentang tanaman torbangun menuliskan bahwa tanaman ini mengandung beragam senyawa flavonoid, antara lain apigenin, luteolin, dan quercetin.
Tabel 2 Hasil analisis kualitatif buah takokak
Senyawa
Pelarut Etanol Petroleum
Eter
Kloro- form
Meta-nol Air Air Etanol
Alkaloid + - - + - + -
Terpenoid + - + + + + +
Saponin + + + - - - +
Tanin + - - + + + +
Flavonoid + - - + + + +
Referensi
Sathasivam dan Elangovan
(2011)
Kundu et al. (2011) Thenmozhi et al. (2011)
Efikasi Torbangun
Wanita-wanita suku Batak di Simalungun, Sumatera Utara, memiliki kepercayaan yang telah bertahan selama ratusan tahun bahwa daun torbangun yang dimasak menjadi sup, dengan campuran ikan atau ayam, dapat meningkatkan produksi ASI. Di daerah tersebut, wanita yang baru melahirkan biasa mengonsumsi sup torbangun minimal selama satu bulan (Damanik 2009). Selain oleh ibu-ibu pasca melahirkan, sayur torbangun juga biasa dikonsumsi oleh masyarakat suku Batak secara umum. Selain itu, efek farmakologis dari daun ini juga telah dikenal, antara lain sebagai penurun panas (antipiretik), antiseptik, peluruh angin (karminatif), penghilang rasa nyeri (analgesik), pengobat batuk, sakit tenggorokan, hidung tersumbat, serta rematik (Wijayakusuma 2006; Dalimartha 2008; dan Grace 2011).
Komponen Bioaktif
Senyawa Fenolik
Senyawa fenol merupakan metabolit sekunder yang disintesis tanaman selama perkembangan normal, sebagai respon terhadap stres seperti infeksi, luka, radiasi ultraviolet, dan sebagainya. Senyawa ini tersebar luas pada tanaman dan merupakan metabolit sekunder yang melimpah dalam tumbuhan, dengan lebih dari 8000 struktur fenol yang telah diketahui, bentuk molekul beragam dari yang sederhana seperti asam fenolat hingga substansi yang sangat terpolimerasi seperti tanin. Dalam tanaman fenolat berperan dalam pertahanan terhadap radiasi ultraviolet atau agresi patogen, parasit, dan predator, sebagaimana kontribusinya dalam pemberian warna bagi tanaman.
Komponen ini tersebar dalam seluruh organ tumbuhan dan merupakan bagian dari diet manusia. Fenol merupakan konstituen yang tersebar luas dalam makanan nabati (buah-buahan, sayuran, sereal, zaitun, kacang-kacangan, coklat, dll) dan minuman (teh, kopi, bir, anggur, dll), dan sebagian mempengaruhi sifat organoleptik keseluruhan makanan nabati. Contohnya, kontribusi senyawa fenol dalam rasa pahit dan rasa asam buah dan jus buah, karena interaksi antar-fenolat, terutama procyanidin, dan glikoprotein dalam air liur (Naczk dan Shahidi 2004). Komponen fenol juga berpengaruh pada penampakan pangan, seperti timbulnya warna gelap yang berkaitan dengan fenomena browning pada produk buah-buahan dan sayuran (Lee 2000).
Istilah senyawa fenolik meliputi aneka ragam senyawa yang berasal dari tumbuhan, yang mempunyai ciri yang sama, yaitu cincin aromatik yang mengandung satu atau dua gugus hidroksil. Senyawa fenol cenderung mudah larut dalam air karena umumnya seringkali berikatan dengan gula sebagai glikosida, biasanya terdapat dalam vakuola sel (Harborne 1984).
Struktur kimia fenolat dari tanaman bervariasi mulai yang sederhana hingga yang terpolimerasi seperti asam fenolat, fenilpropanoat, antosianin, tanin, dan lain-lain. Senyawa ini juga ada yang terkompleks dengan karbohidrat, protein, serta komponen lainnya, dimana senyawa fenol yang memiliki berat molekul yang tinggi menjadi agak sulit larut. Oleh karena itu, hasil ekstrak fenolik dari tanaman merupakan campuran dari kelompok senyawa fenol yang berbeda, tergantung dari sistem pelarut yang digunakan Metode kimia dan alat analisis seperti kromatografi dan spektrofotometri digunakan untuk kuantifikasi senyawa ini.
Metode ekstraksi fenol dipengaruhi oleh substansi kimia dasar, metode ekstraksi, ukuran partikel sampel, waktu dan kondisi penyimpanan, serta senyawa lain yang mempengaruhinya. Fenolik dapat diekstrak dari sampel segar, beku, atau yang telah dikeringkan. Umumnya, sebelum ekstraksi sampel tanaman digiling dan dihomogenisasi, yang sebelumnya telah dikeringkan dengan oven udara atau freeze dryer. Kelarutan senyawa fenolik dipengaruhi oleh polaritas pelarut yang digunakan, tingkat kepolimeran fenolik, interaksi senyawa fenolik dengan komponen lainnya yang terdapat dalam pangan, dan ikatan dengan substansi yang sulit larut. Oleh karena itu, tidak ada prosedur yang sangat sempurna/sesuai untuk mengekstrak seluruh senyawa fenolik maupun kelompok fenolik tertentu dari sampel tanaman. Metanol, etanol, aseton, air, etil-asetat, hingga pelarut yang jarang dipakai seperti propanol, dimetilformamide, dan campurannya sering digunakan dalam mengekstraksi komponen fenolik.
untuk teroksidasi tanpa perlu menambahkan reagen. Deshpande, dalam disertasinya yang dikutip Naczk dan Shahidi (2004), mendemonstrasikan bahwa waktu optimum untuk ekstraksi senyawa fenolik kacang kering adalah sekitar 50-60 menit.
Antosianin
Senyawa antosianin merupakan bagian dari senyawa flavonoid yang mencakup berbagai warna termasuk biru, ungu, magenta violet, merah, dan oranye. Antosianin terdapat paling banyak dalam buah beri dan anggur, serta terdapat dalam anggur merah, sereal jenis tertentu, dan beberapa sayuran dan akar seperti kubis, kacang, bawang, dan lobak. Sianidin adalah antosianin yang paling umum terdapat dalam makanan (Erdman 2007).
Molekul antosianin terdiri dari aglikon antosianidin dan beberapa gugus gula. Satu atau lebih molekul gula dapat dihubungkan dengan antosianidin melalui ikatan glikosidik. Terdapat lebih dari 600 jenis antosianin di alam. Warnanya yang cerah dan kelarutannya yang tinggi dalam air, antosianin menjadi pigmen alami yang potensial untuk menggantikan pewarna makanan buatan (Mazza 1993). Struktur senyawa antosianin dapat dilihat pada Gambar 2.
Gambar 2 Struktur dasar antosianin (Sumber: Lee et al. 2005)
Selain berfungsi sebagai pewarna, antosianin dalam makanan juga memiliki kapasitas antioksidan untuk meningkatkan status kesehatan, antosianin diyakini mengurangi risiko penyakit kardiovaskuler. Antosianin berperan sebagai antioksidan karena dapat menyumbang atom hidrogen kepada radikal bebas yang sangat reaktif untuk menghambat reaksi berantai radikal bebas (Rice-Evans et al. 2009). Konsumsi makanan yang kaya antosianin dapat meningkatkan status kesehatan dan mencegah penyakit tertentu, termasuk penyakit kardiovaskuler dan beberapa penyakit peradangan (Huang 2009).
Flavonoid
tanaman berbunga, sebagai faktor pertumbuhan, perkembangan, serta pertahanan bagi tanaman (Erdman 2007).
Dalam makanan, flavonoid muncul dalam berbagai bentuk dan berkonjugasi kompleks dengan gula dan asam organik (Lee 2000). Glukosa merupakan bentuk gula yang paling sering ditemukan terikat dengan flavonoid; tetapi galaktosa, ramnosa, xilosa, arabinosa dan berbagai bentuk gula lainnya juga sering ditemukan terikat dengan flavonoid (Markham 1982).
Flavonoid merupakan komponen berkarbon 15/C15 (C6-C3-C6), sebagai
aglikon atau glikosida yang berikatan dengan beragam jenis gula seperti arabinosa, glukosa, galaktosa, ramnosa, dan xilosa (Lee 2000). Struktur kimia dasar flavonoid dapat dilihat pada Gambar 3. Secara struktural, flavonoid terdiri dari 2 cincin aromatik (cincin A dan B) yang dihubungkan oleh sebuah cincin heterosiklik berkarbon 3 yang teroksigenasi (cincin C). Variasi dari struktur umum cincin C heterosiklik (dipengaruhi kondisi oksidasi dan gugus fungsional dari cincin C pusat) membuat flavonoid terklasifikasi sebagai flavonol, flavon, flavanon, flavan-3-ol (flavan), flavanol, dan antosianin (Erdman 2007). Variasi struktur dari tiap kelompok ini disebabkan tingkat dan pola hidroksilasi, metoksilasi, prenilasi, atau glikosilasi yang berbeda (Naczk dan Shahidi 2004). Keterikatan cincin C dengan cincin B pada karbon ke-2 disebut isoflavon. Proantosianidin merupakan oligomer dari flavan-3-ol. Antosianidin dibedakan dari flavonoid lain dalam kelas terpisah berdasarkan kemampuannya untuk membentuk kation flavylium.
Sumber: Hertog et al. (1992b)
Gambar 3 Struktur dasar flavonoid dan ringkasan struktur flavonol dan flavon yang diidentifikasi
Gugus hidroksil fungsional terdapat pada semua cincin yang memiliki sisi yang berpotensi untuk berikatan dengan karbohidrat. Flavonoid yang terikat dengan satu atau lebih molekul gula dikenal sebagai glikosida, sedangkan flavonoid yang tidak terikat ke molekul gula disebut aglikon. Kecuali untuk flavan-3-ol, flavonoid terkandung dalam tanaman dan sebagian besar makanan dalam bentuk glikosida. Struktur flavonoid akan semakin kompleks dengan terikatnya gugus asetil dan malonil dengan gugus gula (Erdman 2007).
Flavonol dan flavon merupakan komponen yang memiliki fungsi sebagai antioksidan dan menghentikan reaksi berantai radikal bebas dalam dalam bahan pangan. Flavonol merupakan flavonoid yang paling tersebar luas pada makanan, flavonol yang paling banyak terdapat dalam pangan adalah quercetin, kemudian
Senyawa X R1 R2
Flavonol yang diidentifikasi
Myricetin OH OH OH
Quercetin OH OH H
Kaempferol OH H H
Flavon yang diidentifikasi
Luteolin H OH H
kaempferol, sedangkan myricetin termasuk komponen yang biasa terdapat dalam sayuran (Lee 2000). Sumber utama dari ketiga flavonol ini adalah bawang, kangkung keriting, brokoli, bluberi, tomat, dan teh. Flavon terdapat dalam jumlah yang lebih sedikit dibanding flavonol dalam buah dan sayuran. Jenis flavon yang dominan terdapat dalam bahan pangan adalah luteolin dan apigenin. Sumber utamanya adalah peterseli dan seledri (Erdman et al. 2007). Seluruh flavonoid ini merupakan komponen yang dipelajari secara luas dalam studi antikarsinogenesis (Hertog et al. 1992a).
Flavonoid pada tumbuhan sangat bervariasi komposisinya karena perbedaan faktor genetik, iklim, kualitas tanah, dan faktor-faktor eksternal lainnya. Seleksi dan kultivasi yang terkontrol merupakan langkah awal untuk menghasilkan konsentrasi yang konsisten dari komponen tertentu. Langkah kedua, yaitu produk yang dihasilkan dari ekstraksi komponen herbal dengan pelarut haruslah dikontrol secara hati-hati untuk memisahkan komponen yang penting bagi fungsi dan efikasi (khasiat) produk.
Sebagian besar flavonoid memiliki aktivitas sebagai inflamasi, anti-alergi, anti-gumpal, imunomodulator, dan anti-tumor. Selain itu, flavonoid juga berfungsi menghambat beberapa enzim, termasuk lipoksigenase, fosfolipase A2,
protein kinase, dan lain-lain (Rice-Evans 2003).
A. Ekstraksi Senyawa Flavonoid dari Tumbuhan
Flavonoid umumnya terdapat dalam bentuk O-glikosida, dimana satu atau lebih dari gugus hidroksil flavonoidnya terikat dengan satu atau lebih gula dengan ikatan hemiasetal yang labil terhadap asam. Dalam identifikasinya, sering dilakukan proses glikosilasi dengan tujuan menurunkan kereaktifan dan membuat senyawa flavonoid lebih larut air. Flavonoid umumnya berada di bagian vakuola dari tanaman.
Selain dalam bentuk O-glikosida, flavonoid juga dapat berikatan dengan gula dari gugus karbonnya. Kondisi ini diistilahkan dengan C-glikosida. Gula berikatan langsung dengan inti gugus benzen dari flavonoid, dimana ikatan tersebut merupakan ikatan yang lebih tahan asam. Ikatan jenis ini umumnya ditemukan hanya pada karbon nomor 6 atau 8 dari inti flavonoid. Jenis gula yang terikat juga lebih sedikit dibanding gula yang terikat dengan O-glikosida. Jenis flavonoid yang terikat pun lebih terbatas, semisal apigenin, luteolin, chrysoeriol, kaempferol, naringenin, daidzein, dan genistein (Markham 1982).
B. Identifikasi Senyawa Flavonoid
Senyawa flavonoid pada sayuran, dewasa ini banyak dipelajari dan dianalisis dengan metode HPLC (Andarwulan et al. 2010, 2012; Hertog et al 1992a). HPLC merupakan teknik analisis yang cepat, serta memiliki presisi dan akurasi yang tinggi dalam memisahkan campuran menjadi zat tunggal (Nollet 2000). HPLC termasuk metode analisis kromatografi, yang menurut definisi IUPAC (International Union of Pure and Applied Chemistry), merupakan metode separasi fisik dimana komponen yang akan dipisahkan dialirkan di antara dua fase, yaitu fase yang tetap (fase diam) dan fase yang bergerak ke arah yang telah ditentukan (fase gerak) (Ettre 1993).
Komponen utama dari HPLC adalah pompa, injektor, kolom, detektor dan rekorder/integrator/sistem data. Terdapat berbagai cara pengklasifikasian jenis-jenis HPLC. Jika didasarkan pada cara pemisahannya, terdapat lima tipe HPLC menurut Rounds dan Gregory (1998), yaitu HPLC tipe normal phase, reversed phase, ion exchange, size exclusion, serta pemisahan yang berdasarkan afinitas.
Pada berbagai penelitian tentang pemisahan senyawa flavonoid, sistem yang digunakan berbasis pada kromatografi reversed phase dengan silika C18 sebagai
fase yang terikat pada kolom. Sebagian besar metode HPLC untuk analisis fenolik pada pangan menggunakan eluen isokratik dengan mengunakan campuran pelarut asam asetat, format, atau fosfat dengan metanol atau asetonitril sebagai larutan organik. Variasi kekuatan solven yang digunakan sebagai gradien elusi dan waktu yang dibutuhkan untuk analisis bergantung pada jumlah dan jenis komponen fenolik pada matriks pangan. Untuk sampel yang kompleks, seringkali dibutuhkan beberapa tahap gradien. Namun, untuk ekstrak yang telah dipurifikasi sebagian atau ekstrak kasar yang hanya mengandung sedikit komponen dengan polaritas yang sama dapat digunakan metode isokratik (Lee 2000). Agar pemisahan komponen target dari sampel dapat berhasil dengan baik, ada dua metode elusi yang biasa digunakan, yaitu elusi isokratik dan elusi gradien. Tipe elusi isokratik adalah eluen yang menggunakan satu pelarut dari awal hingga akhir. Sedangkan, elusi gradien adalah eluen yang menggunakan campuran dua atau lebih pelarut yang berbeda sehingga komposisi fase gerak berubah seiring waktu. Pelarut diganti mulai dari yang memiliki kemampuan elusi paling rendah hingga yang paling tinggi. Hal ini dilakukan untuk meningkatkan kemampuan resolusi dan mempersingkat waktu elusi (Rubinson 2000).
Lebih dari 70 % teknik pemisahan dengan HPLC menggunakan tipe reversed phase. Fase diamnya terbuat dari silika dengan fase terikatnya berupa octadecylsilyl (ODS) yang merupakan salah satu bahan reversed-phase yang banyak digunakan. HPLC reversed phase menggunakan fase gerak polar, biasanya berupa campuran air dengan metanol, asetonitril, atau tetrahidrofuran. Larutan tersebut tertahan karena interaksi hidrofobik dengan fase diam non-polar dan terelusi untuk menurunkan polaritas (meningkatkan hidrofobisitas) (Rounds dan Gregory 1998).
Flavonoid, yang merupakan salah satu bagian dari komponen fenolik, memiliki ikatan aromatik sehingga dapat diserap dengan baik pada panjang gelombang sinar UV. Panjang gelombang untuk komponen ini berada pada kisaran 320-380 nm dan 240-270 nm (Lee 2000).
kaempferol, luteolin, dan apigenin. Flavonol dan flavon merupakan bagian dari flavonoid yang penting karena memiliki aktivitas antioksidan (Lee 2000).
Panjang gelombang UV maksimum dan urutan elusi untuk flavonol dan flavon sebagaimana yang dikutip Lee (2000) dari Justesen et al. (1998) adalah sebagai berikut:myricetin 375 nm, quercetin 374 nm, kaempferol 366 nm, luteolin 351 nm, apigenin 341 nm. Lee (2000) melanjutkan bahwa kuantifikasi quercetin lebih sulit dibanding aglikon lainnya karena lebih tidak stabil. Degradasi komponen dapat dicegah dengan pendinginan tabung sampel, pelindungan vial dari cahaya UV, serta penyiapan standar yang baru untuk setiap analisis.
Hertog et al. (1992b) mengembangkan metode identifikasi yang cepat dengan HPLC untuk kuantifikasi lima komponen besar dari aglikon flavonoid (quercetin, kaempferol, myricetin, luteolin, apigenin) untuk sayuran dan buah yang dikeringbekukan. Pada prinsipnya, sampel diekstrak kemudian dihidrolisis asam untuk memecah gula, kemudian dianalisis jumlahnya dengan HPLC. Identifikasi senyawa flavonoid dilakukan dengan menggunakan fase gerak 25 % asetonitril dalam buffer fosfat 0.025 M, laju aliran 0.9 ml/menit. Kolom yang digunakan adalah kolom HPLC C18 phase, Develosil ODS-UG-3.
Partial Least Square – Discriminant Analysis
Partial Least Square – Discriminant Analysis (PLS-DA) merupakan salah satu metode analisis multivariat yang dapat mempertajam pemisahan antara kelompok pengamatan. PLS-DA dihasilkan dari pemutaran komponen PCA (Principal Components Analysis) sedemikian rupa sehingga dapat menghasilkan pemisahan maksimum antarkelas. Dari PLS-DA dapat diketahui variabel mana yang memisahkan sampel berdasarkan kelas-kelas tersebut. PLS-DA termasuk dalam PLS-regresi klasik, di mana variabel respon kategori mengekspresikan keanggotaan kelas pada unit statistik. Oleh karena itu, PLS-DA tidak memungkinkan variabel respon selain variabel untuk mendefinisikan kelompok (CAMO 2013).
Seperti halnya PCA, PLS-DA menghasilkan dua plot grafik, yaitu score plot dan loading plot. Score plot menggambarkan hubungan antara sampel yangdiamati, sedangkan loading plot merupakan rangkuman dari variabel (misal: waktu retensi). Loading plot digunakan untuk menginterpretasikan pola yang tergambar pada score plot. Kedua plot ini bersifat komplementer satu sama lain. Arah dari plot yang satu berkorelasi dengan arah yang sama pada plot lainnya (Umetrics 2006).
METODE PENELITIAN
Bahan Penelitian
satu klon (klon C) dari kebun pribadi keluarga bersuku Batak yang berdomisili di Bekasi. Bahan-bahan yang digunakan adalah etanol, metanol, reagen Folin-Ciocalteu, HCl, Na2CO3, Na2COOH, KCl, dan KH2PO4 dari Merck (Darmstadt,
Germany). TBHQ (Tertiary Butyl Hydroquinone), asam galat, standar quercetin, kaempferol, myricetin, apigenin, dan luteolin dari Sigma-Aldrich (St. Louis, MO, USA). Acetonitril HPLC grade, metanol HPLC grade, dan water HPLC grade dari JT Baker (Phillipsburg, NJ, USA).
Peralatan Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat untuk budidaya tanaman, alat-alat persiapan sampel, dan alat untuk analisis. Alat yang digunakan untuk budidaya tanaman, yaitu alat-alat pertanian, polibag kecil untuk persemaian, gunting, cutter, pupuk kandang, arang sekam, paranet, plastik UV, bambu, kawat, serta paku. Alat-alat yang digunakan untuk persiapan sampel adalah plastik tahan panas ukuran 2 kg, tray plastik, freezer, freeze dryer, blender kering, plastik klip, serta toples kedap udara untuk penyimpanan sampel bubuk kering beku. Alat-alat yang digunakan untuk analisis adalah oven, neraca analitik, desikator, gegep, sudip, cawan aluminium, gelas piala, erlenmeyer, gelas ukur, mikropipet, labu takar, tabung reaksi bertutup beserta raknya, alumunium foil, botol gelap ukuran kecil (5-10 ml) dan besar (100-500 ml), magnetic stirrer, batang pengaduk, botol semprot, parafilm, sonikator, sentrifus, tabung sentrifus, alat vorteks, syringe, syringe filter selulosa 0.45 µm (Minisart, Sartorius Stedim Biotech, Germany).
Tabel 3 Spesifikasi HPLC Komponen HPLC Tipe
Solvent cabinet Shimadzu LC-20 AD
Degasser Shimadzu DGU-20A5
Pump Shimadzu LC-20 AD
Detector UV-Vis Shimadzu SPD-20A
Manual injector Hewlett Packard Series 1100
Injector Rheodyne 20 µl
Syringe Agilent Technologies, LC 50 µl
Column C-18 phase; Develosil ODS-UG-3, Nomura Chemical Mobile phase 25% acetonitrile in 0.025 M KH2PO4
Flow rate 0.9 ml/min (isocratic)
Lokasi dan Waktu Penelitian
Secara garis besar, penelitian dilakukan dalam dua tahap, yaitu tahap budidaya tanaman torbangun di Kampung Konservasi Toga, Gunung Leutik, Desa Benteng, Bogor; dan tahap analisis kimia di Food Chemistry Laboratory SEAFAST (South East Asia Food Agricultural Science and Technology) Center, Institut Pertanian Bogor. Tahap budidaya tanaman dilaksanakan mulai Maret hingga Mei 2012, sedangkan tahap analisis kimia dilakukan sejak Mei 2012 hingga Februari 2013.
Prosedur Penelitian
Dalam penelitian ini dilakukan tiga tahap penelitian, yaitu tahap budidaya, tahap identifikasi fenotipe, dan tahap analisis komponen bioaktif dari tiga klon tanaman torbangun. Penjabaran ketiga tahap tersebut adalah sebagai berikut: Tahap Budidaya
Tahap awal yang akan dilakukan pada penelitian ini adalah tahap pembudidayaan tanaman torbangun klon A, B, dan C. Ketiga klon tanaman ini diidentifikasi oleh Pusat Penelitian Biologi (Lampiran 1), kemudian dibudidayakan di Kampung Konservasi Toga, Gunung Leutik, Desa Benteng, Bogor. Setiap klon torbangun dibudidayakan di bedeng seluas 1 m x 4.5 m, sebanyak 42 stek. Tata letak pembudidayaan stek torbangun di lahan disajikan pada Lampiran 2.
Persiapan bibit. Penanaman dilakukan saat musim kemarau. Sebelum penanaman di bedeng, terlebih dahulu dilakukan penyemaian stek yang memiliki tiga buku pada polibag kecil berisi media tanam. Media tanam dimasukkan ke dalam polibag hingga memenuhi ¾ volumenya. Bibit disiapkan lebih banyak dari kebutuhan untuk keperluan penyulaman tanaman yang dilakukan jika tanaman mati. Persemaian bibit ini dilakukan di tempat yang diberi naungan, disiram setiap dua hari sekali.
Persiapan media tanam dan pupuk. Media tanam yang digunakan adalah campuran tanah, arang sekam, dan pupuk kandang dengan perbandingan 1:1:1. Dosis pupuk kandang yang dipakai adalah 1 ton/ha.
Penanaman. Setelah kira-kira 14 hari disemai dalam polibag, bibit yang akarnya sudah cukup kuat dipindahkan ke bedeng dengan jarak tanam 30 cm. Media tanam yang digunakan pada penanaman sama dengan yang digunakan pada persemaian agar air lebih lama tertahan dalam media tanam karena penanaman dilakukan ketika musim kemarau (Maret-Juni).
Pembuatan naungan. Paranet 60 % dipasang pada bagian atas dan sekeliling lahan membentuk rumah berukuran 5x2.2 m, tinggi sekitar 2 m. Paranet 60 % berarti cahaya yang ditahan adalah 60 %, yang lolos sebesar 40 %.
Pengamatan. Pengamatan pertumbuhan tanaman dilakukan saat usia panen, yaitu kira-kira delapan minggu. Peubah yang diamati mengacu pada deskriptor tanaman yang dibuat pada tahap identifikasi fenotipe.
Pemanenan. Tahap ini dilakukan pada saat tanaman dan daun torbangun mencapai ukuran yang cukup besar untuk dipanen (sekitar 8 minggu). Bagian yang dipanen dari tanaman adalah bagian daun utuh (tidak terserang hama), yang tumbuh sekitar 10 cm dari pucuk (Gambar 4). Sampel yang digunakan adalah daun hingga batang daunnya (porsi edibel).
Gambar 4 Ukuran pucuk yang dipanen Tahap Identifikasi Fenotipe
Identifikasi fenotipe dilakukan dengan cara mengamati morfologi dari ketiga klon torbangun yang digunakan. Identifikasi dilakukan secara keseluruhan, mulai dari akar, batang, daun, hingga bunganya, dengan kriteria yang telah ditetapkan dalam lembar deskriptor tanaman yang dimodifikasi dari deskriptor tanaman pala (Marzuki 2007). Deskriptor torbangun dapat dilihat di Lampiran 3. Setiap klon diambil gambarnya untuk perbandingan secara visual.
Tahap Analisis Kimia Komponen Bioaktif
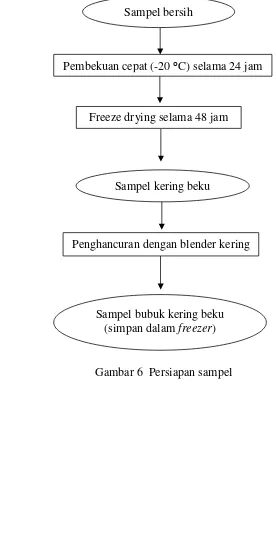
A. Persiapan Sampel (Andarwulan et al. 2010)
Sampel yang digunakan adalah porsi sampel yang biasa dikonsumsi, yaitu daun berikut sebagian batang daunnya. Setelah pemanenan, sampel bersih segera disimpan pada -20 ºC selama 12 jam (tidak dicuci untuk menghindari kerusakan permukaan daun yang berambut halus akibat gesekan) hingga benar-benar beku, kemudian di-liofilisasi selama 48 jam dengan freeze dryer (FreeZone 6 l Console Freeze Dry System, Labconco, Kansas City, MO). Setelah itu, sampel hasil freeze dry diblender dengan blender kering, lalu disaring dengan saringan 30 mesh. Bubuk daun torbangun disimpan pada suhu -20 ºC di tempat gelap hingga analisis selanjutnya (Gambar 6).
B. Analisis Kadar Air (3.7.01, AOAC 1984)
mengeringkan cawan alumunium terlebih dahulu pada suhu 105 ºC selama 15 menit, kemudian didinginkan di desikator selama 10 menit. Setelah dingin, cawan kosong ditimbang dengan neraca analitik dan dicatat bobotnya. Sampel dimasukkan sebanyak 1-2 gram (dicatat bobot tepatnya), lalu dikeringkan dalam oven bersuhu 105 ºC selama 3 jam, didinginkan dalam desikator, dan ditimbang. Sampel tersebut dimasukkan kembali ke dalam oven selama 30 menit, lalu ditimbang. Tahap ini terus dilakukan hingga tercapai bobot yang relatif konstan (bobot dianggap konstan jika selisihnya ≤0.0010 g).
Kadar air (%) = -( - ) x 100% Keterangan:
W = bobot sampel sebelum dikeringkan
W1 = bobot (sampel+cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
C. Analisis Total Fenol (dimodifikasi dari Shetty et al. 1995)
Bubuk sampel yang telah diliofilisasi dimasukkan sebanyak 50 mg ke dalam tabung sentrifus 15 ml, ditambahkan 2.5 ml etanol 95 %, kemudian divorteks. Kemudian, campuran tersebut disentrifus selama 15 menit dengan kecepatan putaran 2500 rpm. Supernatan diambil sebanyak 0.1 ml dan dimasukkan ke dalam tabung reaksi. Setelah itu, ditambahkan 0.9 ml etanol 95 %, 2.5 ml akuades, dan 2.5 ml reagen Folin Ciocalteu 50 %. Campuran tersebut didiamkan dahulu selama 5 menit, lalu ditambahkan 0.5 ml Na2CO3 5 %, kemudian divorteks kembali.
Setelah itu, sampel disimpan dalam ruang gelap selama satu jam, lalu dilakukan pengukuran dengan spektrofotometer pada panjang gelombang 725 nm. Standar yang digunakan dalam penentuan total fenol adalah asam galat. Standar asam galat dibuat dengan variasi konsentrasi antara 250 – 1250 mg/L (Gambar 7).
D. Analisis Antosianin
Ekstraksi antosianin (dimodifikasi dari Sims dan Gamon 2002)
Sebanyak 50.0 mg bubuk sampel kering beku diekstrak dengan 4 ml larutan metanol:HCl:air dengan perbandingan 90:1:1. Campuran ini divorteks hingga rata, kemudian disentrifus dengan kecepatan 2500 rpm selama 15 menit, hingga diperoleh filtratnya. Supernatan/filtrat tersebut dipisahkan dari endapan dan dianalisis kandungan antosianinnya dengan metode AOAC (2005) (Gambar 8).
Penentuan konsentrasi total antosianin (diadaptasi dari Lee et al. 2005)
Sebanyak 0.5 ml supernatan dimasukkan ke dalam dua tabung reaksi bertutup. Ke dalam salah satu tabung ditambahkan 6.5 ml buffer pH 1, sedangkan ke dalam tabung lainnya ditambahkan 6.5 ml buffer pH 4.5, kemudian divorteks. Campuran tersebut disimpan selama 20 menit, kemudian masing-masing diukur absorbansinya pada panjang gelombang 520 nm dan 700 nm.
Total antosianin (ekivalen dengan sianidin-3-glukosida, mg/l)=
Ket: A = (A520nm– A700nm) pH 1.0 - (A520nm– A700nm) pH 4.5
Mr = 449.2 g/mol (sianidin-3-glukosida) FP = Faktor Pengenceran
Ԑ = 26900 L x mol-1 x cm-1 103 = faktor konversi g ke mg E. Analisis Flavonoid
Ekstraksi Senyawa Flavonoid dari Daun Torbangun (diadaptasi dari Hertog et al. 1992b)
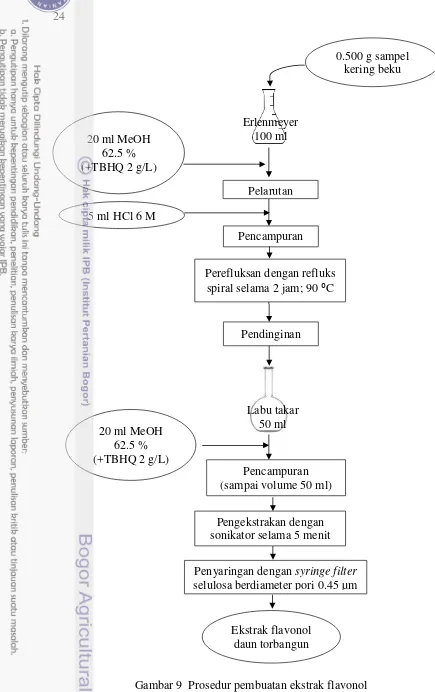
Terdapat dua metode ekstraksi yang dilakukan untuk menguantifikasi jumlah flavonoid pada sampel. Menurut Hertog et al (1992a), flavonoid jenis flavonol (myricetin, quercetin, dan kaempferol) lebih optimum diperoleh apabila metode ekstraksi menggunakan HCl 1.2 M, dengan lama reaksi hidrolisis 2 jam. Flavonoid golongan flavon (luteolin dan apigenin) lebih optimum diperoleh menggunakan HCl 2.0 M, dengan waktu reaksi selama 4 jam. Berikut ini diuraikan metode untuk mengekstrak komponen flavonoid dari golongan flavonol, adapun untuk golongan flavon hanya berbeda dari segi konsentrasi HCl dan waktu reaksi.
[image:31.595.103.490.18.820.2]Tahap ekstraksi sampel diawali dengan pelarutan sebanyak 0.5 gram sampel kering beku ke dalam 20 ml metanol HPLC grade 62.5 % yang telah dicampurkan dengan g/L TBHQ (selanjutnya disebut “metanol TBHQ”) sebagai antioksidan. Kemudian, ditambahkan 5 ml HCl 6 M, lalu direfluks dengan refluks berkondensor spiral (Gambar 5). Suhu reaksi dijaga stabil 90 ºC selama dua jam. Tujuan penambahan asam adalah untuk menjaga komponen agar tidak terdegradasi, sedangkan perefluksan dilakukan untuk menghidrolisis gula pada
sampel. Flavonoid terkandung dalam tanaman dan sebagian besar makanan dalam bentuk glikosida. Ikatan ini perlu diputus secara maksimal agar flavonoid dapat terdeteksi oleh instrumen pengukur (HPLC).
Setelah dua jam, larutan didinginkan, lalu ditambahkan metanol TBHQ hingga volume larutan menjadi 50 ml. Larutan tersebut diekstrak kembali menggunakan sonikator selama 5 menit untuk menyempurnakan ekstraksi flavonoid. Proses pembuatan ekstrak flavonol dan flavon dari sampel secara ringkas dapat dilihat pada Gambar 9 dan 10.
Pembuatan larutan dan kurva standar campuran (Hertog et al. 1992b)
Pembuatan larutan standar stok
Masing-masing sebanyak 1.5 mg standar myricetin, luteolin, quercetin, dan kaempferol ditimbang, lalu dilarutkan dengan 3 ml metanol TBHQ. Standar apigenin dilarutkan sebanyak dua kali lipat, yaitu 3.0 mg dalam 3 ml metanol TBHQ. Konsentrasi standar apigenin dibuat dua kali dari standar yang lainnya karena apigenin memiliki respon yang paling rendah, dilihat dari nilai limit deteksi yang paling tinggi dibanding keempat senyawa lainnya (Batari 2007 dan Rahmat 2009). Nilai LOD kelima senyawa tersebut dapat dilihat di Tabel 4. Keseluruhan wadah penimbangan standar dibilas berulang kali dengan metanol TBHQ. Kemudian, larutan tersebut dicampurkan dengan 5 ml HCl 6 M untuk menjaga agar larutan tetap asam agar komponen flavonoid tidak terdegradasi. Setelah itu, larutan ditepatkan volumenya hingga 50 ml, sehingga diperoleh larutan standar stock dengan konsentrasi 30 ppm untuk standar myricetin, luteolin, quercetin, dan kaempferol; sedangkan untuk standar apigenin sebesar 60 ppm. Secara ringkas, proses pembuatan larutan standar stok flavonoid dapat dilihat pada Gambar 11.
Tabel 4 LOD kelima senyawa flavonoid
Komponen LOD (ppm)
Batari (2007) Rahmat (2009)
Myricetin 0.026 0.039
Luteolin 0.038 0.056
Quercetin 0.022 0.028
Apigenin 0.190 0.220
Kaempferol 0.037 0.047
Penentuan konsentrasi larutan standar flavonoid
Sebelum membuat larutan standar, terlebih dahulu diperkirakan konsentrasi yang dapat terdeteksi oleh instrumen serta mencakup kuantitas senyawa yang dimaksud pada sampel. Oleh karena itu, konsentrasi larutan standar dapat ditentukan setelah diketahui respon instrumen untuk keseluruhan sampel. Cara ini dapat memaksimalkan efisiensi penggunaan larutan, termasuk fase gerak. Alur penentuan konsentrasi larutan standar dapat dilihat pada Gambar 12.
diperoleh respon gambaran (berupa area) dari instrumen pada tingkat konsentrasi tersebut. Data respon ini digunakan untuk memperkirakan respon yang akan diberikan instrumen untuk beragam tingkat konsentrasi larutan standar.
Setelah didapat range respon instrumen untuk keseluruhan sampel, range kurva standar kemudian disesuaikan sehingga didapat sedikitnya 5 tingkat konsentrasi standar bagi masing-masing komponen standar campuran. Tingkat konsentrasi yang digunakan untuk standar myricetin adalah 0.2; 0.4; 2.0; 4.0; dan 6.0 ppm. Luteolin 0.5; 2.0; 4.0; 6.0; 8.0; dan 10.0 ppm. Quercetin 0.3; 0.4; 0.5; 2.0; 4.0; 6.0; dan 8.0 ppm. Apigenin ; 0.2; 0.4; 0.6; 1.0; dan 4.0 ppm. Kaempferol 0.5; 2.0; 4.0; 6.0; dan 8.0 ppm. Jika digabungkan, maka keseluruhan konsentrasi larutan standar ada 10 tingkat, yaitu 0.1; 0.2; 0.3; 0.4; 0.5; 2.0; 4.0; 6.0; 8.0; dan 10.0 ppm. Angka-angka ini berlaku untuk standar myricetin, luteolin, quercetin, dan kaempferol, sedangkan apigenin 2 kali lipatnya.
Pembuatan kurva standar
Setelah larutan standar campuran dari ke-10 konsentrasi tersebut dibuat, larutan tersebut diinjeksikan ke kolom HPLC C-18 phase; Develosil ODS-UG-3 yang memiliki dimensi panjang 75 mm dan diameter dalam 4.6 mm. Fase gerak yang digunakan adalah 25 % acetonitril di dalam 0.025 M KH2PO4, dengan laju
aliran 0.9 ml/menit. Komponen-komponen flavonoid dideteksi dengan panjang gelombang 370 nm, sehingga instrumen memberi respon berupa peak yang dapat diketahui luas areanya. Respon dari instrumen HPLC ditampilkan dalam suatu kromatogram. Setelah kromatogram standar campuran pada berbagai konsentrasi yang diperoleh, selanjutnya disatukan ke dalam satu grafik untuk tiap komponen standar. Kemudian, dibuat persamaan garis masing-masing kurva standar. Persamaan ini akan digunakan pada perhitungan komponen flavonoid pada sampel.
Injeksi ekstrak sampel dan larutan standar ke kolom HPLC (Hertog et al. 1992b)
Sampel yang telah selesai diekstrak, kemudian disaring dengan syringe filter selulosa berdiameter pori 0.45 μm hingga menghasilkan sedikitnya 2 mL sampel yang siap untuk diinjeksikan ke kolom HPLC. Berbeda dengan sampel, penginjeksian larutan standar dapat dilakukan tanpa harus terlebih dahulu menyaring larutan dengan syringe filter. Volume yang diinjeksikan ke dalam kolom yaitu sebanyak 20 µL.
Identifikasi flavonoid
dihitung dengan memasukkan luas area ke dalam persamaan kurva standar campuran yang telah diperoleh.
Analisis Data
Analisis data dalam penelitian ini dilakukan dengan dua metode, yaitu: A. Analisis of Variance (ANOVA)
Analisis ragam (Analysis of variance) dilakukan untuk mengetahui ada tidaknya perbedaan antara variabel-variabel yang diuji, dalam hal ini yaitu perbandingan komponen bioaktif antarklonal. Jika ditemukan perbedaan yang signifikan (output Anova menunjukkan angka yang kurang dari α yang digunakan, yaitu 0,05), maka dilanjutkan dengan uji lanjut yang mengkaji seberapa besar perbedaan yang terjadi antar variabel. Uji lanjut dilakukan dengan Tukey HSD apabila dari analisis ragam diketahui adanya perbedaan signifikan antarsampel pada taraf nyata (α) 5 %. Analisis data dilakukan menggunakan software SPSS 20.0 (IBM, New York, USA).
B. Partial Least Square – Discriminant Analysis (PLS-DA)
Seluruh spektrum yang dihasilkan oleh instrumen HPLC dikonversi ke bentuk ASCII dalam format berekstensi .txt, kemudian dipindahkan ke Microsoft Excel (Microsoft Corp. USA) dan dilakukan bucketing data dengan selang waktu 0.08 menit, lalu diimpor ke software SIMCA-P 13.0 (Umetrics AB, Umea, Sweden).
Set data disusun sedemikian rupa sehingga baris matriks data berupa klon dengan ulangannya, sedangkan kolom berupa waktu retensi setiap 0.08 menit. Data spektrum yang diperoleh dari metode ekstraksi dan hidrolisis flavonol dipisahkan dengan metode ekstraksi dan hidrolisis flavon agar dapat diketahui perubahan karakter data akibat perubahan metode yang digunakan. Ukuran set data dari tiap metode yaitu 276x12.
Gambar 6 Persiapan sampel Pembekuan cepat (-20 ⁰C) selama 24 jam
Freeze drying selama 48 jam
Penghancuran dengan blender kering Sampel kering beku
Sampel bubuk kering beku (simpan dalam freezer)
Pereaksian dalam ruang gelap selama 1 jam
Pembacaan absorbansi dengan spektrofotometer pada panjang gelombang 725 nm
50.0 mg sampel kering beku
(bubuk)
Pelarutan 2.5 ml
etanol 95 %
Pemisahan supernatan dan endapan dengan sentrifus selama 15 menit; 2500 rpm
Supernatan Endapan
0.1 ml supernatan
Pencampuran dengan vorteks 0.9 ml etanol 95 %
2.5 ml air deion
0.5 ml Na2CO3 5 %
Pereaksian selama 5 menit
Pencampuran dengan vorteks 2.5 ml Folin
[image:36.595.73.539.66.777.2]Ciocalteu 50 %
50.0 mg sampel kering beku (bubuk)
4 ml larutan metanol:HCl: air (90:1:1)
Supernatan
Pembacaan absorbansi dengan spektrofotometer pada panjang gelombang 520 dan 700 nm. Pemisahan supernatan dan endapan dengan
sentrifus selama 15 menit; 2500 rpm
6.5 ml buffer pH 1 6.5 ml buffer pH 4.5
Penyimpanan selama 20 menit Pencampuran dengan vorteks
Gambar 9 Prosedur pembuatan ekstrak flavonol Erlenmeyer
100 ml
5 ml HCl 6 M
Pencampuran (sampai volume 50 ml)
Ekstrak flavonol daun torbangun
0.500 g sampel kering beku
(bubuk)
Pelarutan 20 ml MeOH
62.5 % (+TBHQ 2 g/L)
Penyaringan dengan syringe filter selulosa berdiameter pori 0.45 µm
Pencampuran
Perefluksan dengan refluks spiral selama 2 jam; 90 ⁰C
Pendinginan
Pengekstrakan dengan sonikator selama 5 menit
Labu takar 50 ml 20 ml MeOH
Gambar 10 Prosedur pembuatan ekstrak flavon Erlenmeyer
100 ml
5 ml HCl 10 M
Pencampuran (sampai volume 50 ml)
Ekstrak flavon daun torbangun
0.500 g sampel kering beku
(bubuk)
Pelarutan 20 ml MeOH
62.5 % (+TBHQ 2 g/L)
Penyaringan dengan syringe filter selulosa berdiameter pori 0.45 µm
Pencampuran
Perefluksan dengan refluks spiral selama 4 jam; 90 ⁰C
Pendinginan
Pengekstrakan dengan sonikator selama 5 menit
Labu takar 50 ml 20 ml MeOH
Gambar 11 Prosedur pembuatan larutan standar flavonoid Pencampuran
Pencampuran (sampai volume 50 ml)
Larutan standar stok flavonoid 5 ml HCl
6 M
Pencampuran @1.5 mg standar quercetin, myricetin,
kaempferol, luteolin, dan 3 mg
Pelarutan 20 ml MeOH 62.5 %
+ TBHQ (2g/L)
Gambar 12 Alur penentuan konsentrasi standar flavonoid Pembuatan larutan standar stok 30 ppm
Pembuatan larutan standar untuk mengecek respon instrumen (min. 2 tingkat konsentrasi).
Mis: 2 ppm dan 3 ppm
Gap respon instrumen untuk 2 konsentrasi Area sampel
keseluruhan
Pengidentifikasian range area sampel
(min-max)
Penyesuaian range area standar dengan range area sampel
Penentuan min. 5 tingkat konsentrasi larutan standar untuk masing-masing
komponen standar campuran
Penggabungan keseluruhan tingkat konsentrasi dari masing-masing
komponen standar campuran
Diperoleh 12 tingkat konsentrasi (0.1; 0.2; 0.3; 0.4; 0.5; 2.0; 4.0;
HASIL DAN PEMBAHASAN
Identifikasi Tiga Klon Torbangun Secara Agronomis
Determinasi Tanaman Torbangun
Determinasi tanaman dilakukan oleh pihak “Herbarium Bogoriense”, Bidang Botani Pusat Penelitian Biologi-LIPI, Bogor, dengan Kepala Bidang Botani LIPI, yaitu Dr. Joeni Setijo Rahajoe. Dokumen hasil identifikasi dapat dilihat pada Lampiran 1. Hasil determinasi menyatakan bahwa seluruh tanaman yang diidentifikasi (klon A, B, dan C) memiliki nama latin Coleus amboinicus Lour. Untuk menjustifikasi kevalidan nama ilmiah tersebut, dilakukan crosscheck dengan mencocokkan nama tersebut dengan database nama ilmiah yang dimiliki oleh Integrated Taxonomic Information System (ITIS). ITIS merupakan sebuah lembaga internasional yang dirancang untuk menyediakan informasi taksonomi yang konsisten dan terpercaya. Menurut ITIS (2012), nama latin Coleus amboinicus Lour. sudah tidak berlaku lagi untuk tanaman torbangun. Saat ini, nama latin yang diterima secara internasional untuk torbangun, yaitu
Plectranthus amboinicus (Lour.) Spreng. Oleh karena itu, nama latin tersebut digunakan dalam penulisan karya ilmiah ini.
Hasil Pembudidayaan Tanaman Torbangun
Tiga klon torbangun yang digunakan dalam penelitian ini dibudidayakan ketika musim peralihan hujan ke kemarau, pada bulan Maret hingga Mei 2012. Ketika awal penanaman, bibit tanaman stek dari indukannya ditanam langsung pada lahan terbuka. Namun kemudian, untuk melindungi rebahnya bibit yang sedang tumbuh karena paparan hujan serta cepatnya respirasi dari tanaman karena panas yang tinggi, area pembudidayaan dipindah ke area greenhouse dengan atap berupa plastik UV yang berlapis paranet 60 %. Penentuan paranet berdasar penelitian Urnemi (2002), bahwa taraf naungan hingga 75 % meningkatkan pertumbuhan tanaman torbangun. Tata letak pembudidayaan tanaman di lahan dapat dilihat pada Lampiran 2, keadaan lahan pada Gambar 13.
Klon torbangun ditanam dalam tiga bedeng terpisah, masing-masing memliki tiga lajur. Bedeng klon A dan C berada di area tepi lahan, sedangkan bedeng klon B berada di tengah. Bentuk greenhouse dan posisi penanaman membuat cahaya matahari lebih banyak memapar bagian tengah lahan, bedeng klon B. Cahaya, khususnya panjang gelombang biru meningkatkan pembentukan flavonoid (Salisbury dan Ross 1995). Dengan demikian, dari teori tersebut dapat diduga bahwa klon B akan mengandung senyawa flavonoid lebih banyak dari dua klon lainnya.
Gambar 13 Keadaan lahan pembudidayaan torbangun Identifikasi Fenotipe Tanaman
Bagian yang dapat diamati pada tanaman torbangun yang dibudidayakan pada penelitian ini hanya daun, batang, dan akarnya. Bagian bunga tidak dapat diamati karena belum tumbuh semasa pengamatan. Mugnisjah dan Setiawan (1995) memaparkan bahwa sebagian besar spesies tanaman tidak akan memasuki masa reproduktif jika pertumbuhan vegetatifnya belum selesai dan belum mencapai tahapan yang matang untuk berbunga. Sehubungan dengan ini, terdapat dua rangsangan yang menyebabkan perubahan itu terjadi, yaitu suhu dan panjang hari. Pembudidayaan tanaman dilakukan ketika musim kemarau. Dengan meninjau ulang faktor yang dipaparkan Mugnisjah dan Setiawan (1995), ketidaksesuaian tanaman dengan musim, terutama faktor suhu, merupakan faktor utama yang mungkin menghambat pertumbuhan bunga torbangun. Penampakan tanaman dari ketiga klon torbangun yang telah dibudidayakan dalam lingkungan yang sama disajikan pada Gambar 14.
[image:43.595.111.506.534.732.2]Untuk membedakan ketiga klon dari tanaman ini, diperlukan deskripsi karakteristik dari masing-masing tanaman. Karakteristik tanaman torbangun secara umum dapat digambarkan dalam sebuah deskriptor tanaman. Deskriptor didefinisikan sebagai sebuah alat yang digunakan untuk mengarakterisasi atau mengukur ciri dari tanaman. Identifikasi tanaman dilakukan dengan menggunakan deskriptor tanaman yang disusun berdasarkan panduan yang disediakan oleh Bioversity International (IPGRI 2007). Untuk membantu penyusunan deskriptor torbangun, digunakan pula beberapa deskriptor tanaman yang telah dipublikasi oleh IPGRI (International Plant Genetic Resources Institute) seperti deskriptor ubi dan cabe. Deskriptor tanaman torbangun yang telah dibuat dapat dilihat pada Lampiran 3. Pada Tabel 5 disajikan hasil ringkasan dari data yang dikoleksi di lapangan menggunakan deskriptor torbangun.
Perbedaan penampang daun dari ketiga klon torbangun dapat dilihat pada Gambar 15. Penampang daun klon B dan C tampak mirip, sedangkan klon A lebih tebal. Pengkarakterisasian lebih lanjut dari ketiga klon tanaman tersebut adalah sebagai berikut :
Gambar 15 Penampang daun dari ketiga klon torbangun (ki-ka: klon A, B, dan C) 1. Torbangun Klon A
Tanaman torbangun yang diberi kode A memiliki bentuk daun bulat telur, ketika dewasa ukuran daunnya sekitar 5.2-6 cm, berwarna hijau kekuningan yang disebabkan karena cuaca yang sangat panas. Tangkai daun yang panjangnya kurang lebih 2-2.6 cm berwarna hijau, terkadang berwarna hijau keunguan. Kerapatan daunnya tergolong sedang. Tanaman torbangun memiliki rambut halus di seluruh permukaan tanamannya. Pada klon A ini, rambut halus yang menyelimutinya tergolong tipis. Daun dari torbangun klon A lebih tebal dan agak keras dari kedua klon lain yang digunakan pada penelitian ini, tebalnya antara 1.5-2.2 mm, serta memiliki aroma daun yang kuat dan khas. Jika daun telah cukup dewasa, daunnya akan memiliki gerigi yang agak dalam.
40 cm pada umur kurang lebih 3 bulan, dengan pola pertumbuhan batang yang kompak sehingga sudut-sudut percabangannya tidak mencapai 45 ⁰, dan tinggi tanaman berkisar antara 24-41 cm.
2. Torbangun Klon B
Tanaman torbangun yang diberi kode B memiliki ciri bentuk daun berbentuk bulat telur juga seperti klon sebelumnya. Saat dewasa ukuran daunnya sekitar 7.1-8.8 cm, lebih lebar dari klon A. Warna daunnya hijau tua, tangkai daun berwarna hijau keunguan dengan panjang sekitar 3.1-4.4 cm, dengan kerapatan daun yang tergolong sedang. Pada klon B, rambut halus yang menyelimutinya juga tergolong tipis. Daun torbangun klon B lebih tipis dari klon A, yakni tebalnya antara 0.5-0.8 mm, serta memiliki kekuatan aroma daun yang tergolong sedang, namun khas. Gerigi daun yang agak dalam akan terbentuk saat daun telah cukup dewasa.
Batang dari torbangun klon B berwarna hijau keunguan, pertumbuhan batangnya termasuk ke dalam kategori menengah (tidak rimbun), diameter batangnya antara 6-7 mm. Lebar dari kanopi tanaman ini dapat mencapai 33 cm (minimalnya 22 cm), pada umur kurang lebih 3 bulan, dengan pola pertumbuhan batang yang tegak, sudut-sudut percabangannya tidak mencapai 45⁰, dan tinggi tanaman berkisar antara 31-56 cm.
3. Torbangun Klon C
Tanaman torbangun yang diberi kode C memiliki bentuk daun kurang lebih sama seperti kedua klon sebelumnya, yaitu bulat telur. Saat dewas