UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI, SELEKSI, DAN UJI AKTIVITAS
ANTIBAKTERI DARI KAPANG ENDOFIT DAUN
PARIJOTO (
Medinilla speciosa
Blume) TERHADAP
Staphylococcus aureus
,
Bacillus subtilis
,
Escherichia coli
,
dan
Shigella dysenteriae
SKRIPSI
RACHMA AYUNDA
NIM. 1111102000054
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI, SELEKSI, DAN UJI AKTIVITAS
ANTIBAKTERI DARI KAPANG ENDOFIT DAUN
PARIJOTO (
Medinilla speciosa
Blume) TERHADAP
Staphylococcus aureus
,
Bacillus subtilis
,
Escherichia coli
,
dan
Shigella dysenteriae
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
RACHMA AYUNDA
NIM. 1111102000054
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ABSTRAK
Nama : Rachma Ayunda
Program Studi : Farmasi
Judul Skripsi : Isolasi, Seleksi, dan Uji Aktivitas Antibakteri dari Kapang
Endofit Daun Parijoto (Medinilla speciosa Blume)
Terhadap Staphylococcus aureus, Bacillus subtilis,
Escherichia coli, dan Shigella dysenteriae
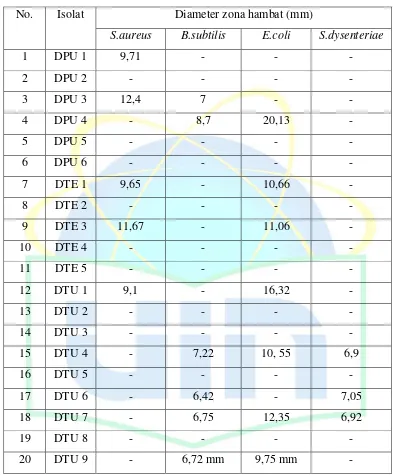
Kapang endofit adalah mikroba yang hidup di dalam jaringan tumbuhan pada periode tertentu dan mampu membentuk koloni dalam jaringan tumbuhan tanpa membahayakan inangnya, bahkan seringkali bersimbiosis secara mutualistis. Kapang endofit dapat menghasilkan metabolit sekunder yang berpotensi sebagai senyawa antimikroba. Penelitian ini bertujuan untuk mengisolasi, menseleksi, dan menguji aktivitas antibakteri dari kapang endofit daun parijoto (Medinilla speciosa Blume) terhadap Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan Shigella dysenteriae. Tanaman Parijoto (Medinilla speciosa Blume) merupakan tanaman yang tumbuh di Desa Colo Kecamatan Dawe Kabupaten Kudus Jawa Tengah yang secara tradisional yang digunakan sebagai obat diare, sariawan, antiradang, dan antibakteri. Metode yang digunakan untuk uji aktivitas antibakteri adalah metode difusi cakram atau Kirby-Baurer. Dari hasil penelitian ini diperoleh 20 isolat kapang endofit yang didapat dari daun yang berwarna hijau muda, hijau tua, dan hijau kekuningan. Berdasarkan hasil uji aktivitas antibakteri diperoleh 10 isolat kapang endofit, yaitu isolat DPU 1, DPU 3, DPU 4, DTE 1, DTE 3, DTU 1, DTU 4, DTU 6, DTU 7, dan DTU 9 yang aktif terhadap bakteri uji tertentu, yaitu Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan
Shigella dysenteriae. Penelitian ini memperlihatkan bahwa daun Medinilla speciosa Blume mengandung kapang endofit yang berpotensi sebagai antibakteri.
ABSTRACT
Name : Rachma Ayunda
Program Study : Pharmacy
Title : Isolation, Selection, and Antibacterial Activity from Mold
Endophytic of Medinilla speciosa Blume Leaves Against Staphylococcus aureus, Bacillus subtilis, Escherichia coli, and Shigella dysenteriae
Endophytic mold are microbes that live inside plant tissue at a certain period and are able to form colonies in plant tissue without harming the host, often symbiotic mutualism. Endophytic mold can produce secondary metabolites as a potential antimicrobial compounds. This study aims to isolate, selecting, and antibacterial activity from endophytic mold of leaves parijoto (Medinilla speciosa Blume) against Staphylococcus aureus, Bacillus subtilis, Escherichia coli, and Shigella dysenteriae. Parijoto (Medinilla speciosa Blume) is a plant that grows in the village of the District Dawe Colo Kudus, Central Java which has traditionally been used as medicine for diarrhea, mouth sores, anti-inflammatory, and antibacterial. The method used to the antibacterial activity was disc diffusion method or the Kirby-Baurer. The results of this study was obtained 20 isolates of endophytic mold that was obtained from young green, dark green, and yellowish green leaves. Based on results antibacterial activity was obtained ten isolates of endophytic mold, which is isolates DPU 1, DPU 3, DPU 4, DTE 1, DTE 3, DTU 1, DTU 4, DTU 6, DTU 7, and DTU 9 active against certain bacteria test, which is
Staphylococcus aureus, Bacillus subtilis, Escherichia coli, and Shigella dysenteriae. This study shows that the leaves of Medinilla speciosa Blume containing endophytic mold that have a potential as an antibacterial.
KATA PENGANTAR
Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT
atas segala nikmat, rahmat, dan karunianya-Nya sehingga penulis dapat
menyelesaikan penelitian dan penulisan skripsi ini. Shalawat serta salam
senantiasa penulis sampaikan kepada Nabi Muhammad SAW yang memberikan
petunjuk bagi umat manusia, semoga kelak kita mendapat syafaatnya di hari
akhir.
Skripsi dengan judul “Isolasi, Seleksi, dan Uji Aktivitas Antibakteri dari
Kapang Endofit Daun Parijoto (Medinilla speciosa Blume) Terhadap
Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan Shigella
dysenteriae” ini disusun untuk memenuhi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi di Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa dalam penulisan skripsi ini banyak mendapat
doa, bantuan, bimbingan dan dukungan dari berbagai pihak. Oleh karena itu,
penulis mengucapkan terima kasih kepada :
1. Ibu Puteri Amelia, M,Farm., Apt selaku pembimbing pertama dan Bapak Saiful
Bahri, M.Si selaku pembimbing kedua yang senantiasa memberikan arahan,
dukungan, semangat, saran, dan solusi selama melaksanakan penelitian dan
penyelesaian skripsi ini. Semoga segala bantuan dan bimbingan Ibu dan Bapak
mendapatkan imbalan yang lebih baik di sisi Allah SWT.
2. Dr. H. Arif Sumantri, S.KM., M.Kes selaku Dekan Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Bapak Yardi, Ph.D., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
4. Bapak dan Ibu Dosen serta karyawan Farmasi Universitas Islam Negeri Syarif
Hidayatullah Jakarta yang telah memberikan motivasi, nasihat, bimbingan dan
ilmu kepada penulis selama menjalankan studi.
pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Semua laboran FKIK dan PLT yang telah membantu keseharian penulis selama
penelitian dan memberikan informasi tentang teknis pengerjaan di laboratorium
kepada penulis.
7. Ayahanda Alm. Eddyzal Zumartin, S.H dan Ibunda Diah Ernawati, M.M. yang
tiada hentinya memberikan dukungan, doa, nasihat, dan bantuan baik materil
maupun non materil selama penulis melaksanakan penelitian dan penyusunan
skripsi ini. Serta adikku Suci Rachmadani, Eyang Haryanti, H. Alpha
Nugerahajati, S.Kom yang telah memberikan keceriaan dan kebahagiaan dalam
kehidupan ini.
8. Teman-teman seperjuangan penelitian di bidang mikrobiologi Ambar, Ati,
Arini, Puput, Brasti, Meri, Adit, Bachtiar, Karimah, Sumiati, Syaima, Fitri,
Faradhilla, dan Mozer, teman-teman Farmasi 2011, dan terkhusus untuk
sahabat terbaik Fitri dan Happy yang selalu menyemangatiku ketika lelah dan
menjadi motivator bagiku serta memberikan keceriaan semasa perkuliahan
sehingga penulisan skripsi ini selesai.
9. Pihak-pihak lain yang terlibat dalam penulisan skripsi ini yang tidak dapat
ditulis satu persatu, penulis akan selalu mengingat atas kebaikan dan
doa-doanya.
Penulis menyadari bahwa masih banyak kekurangan dalam skripsi ini.
Oleh karena itu, dengan segala kerendahan hati penulis mengucapkan terima kasih
terhadap kritik dan saran yang membangun demi kesempurnaan skripsi ini.
Saya berharap skripsi ini dapat bermanfaat dan dapat menjadi sumbangan
pengetahuan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah Jakarta dan pembaca pada
umumnya.
Ciputat, 18 Juni 2015
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
3.3.6. Fermentasi Kapang Endofit ... 29
3.3.7. Cek Kemurnian Bakteri Uji ... 30
3.3.8. Uji Aktivitas Antibakteri ... 30
3.3.8.1. Peremajaan Bkateri Uji ... 30
3.3.8.2. Peremajaan Bkateri Uji ... 31
3.3.8.3. Peremajaan Bkateri Uji ... 31
BAB 4. HASIL DAN PEMBAHASAN ... 33
BAB 5 KESIMPULAN DAN SARAN ... 66
5.1. Kesimpulan ... 66
5.2. Saran ... 67
DAFTAR GAMBAR
Halaman
Gambar 2.1. Tumbuhan Parijoto (Medinilla speciosa Blume) ... 6
Gambar 4.1. Hasil Isolasi Kapang Endofit Daun Medinilla speciosa Blume pada Daun Berwarna Hijau Muda ... 36
Gambar 4.2. Kontrol Sterilisasi Permukaan Daun Kapang Endofit Medinilla speciosa Blume pada Daun Berwarna Hijau Muda ... 36
Gambar 4.3. Hasil Isolasi Kapang Endofit Daun Medinilla speciosa Blume pada Daun Berwarna Hijau Tua... 37
Gambar 4.4. Kontrol Sterilisasi Permukaan Daun Kapang Endofit Medinilla speciosa Blume pada Daun Berwarna Hijau Tua ... 37
Gambar 4.5. Hasil Isolasi Kapang Endofit Daun Medinilla speciosa Blume pada Daun Berwarna Hijau Kekuningan ... 37
Gambar 4.6. Kontrol Sterilisasi Permukaan Daun Kapang Endofit Medinilla speciosa Blume pada Daun Berwarna Hijau Kekuningan ... 38
Gambar 4.7. Hasil Skrining Kapang Endofit terhadap Staphylococcus aureus dan Bacillus ... 41
Gambar 4.8. Hasil Skrining Kapang Endofit terhadap Escherichia coli dan Shigella dysenteriae ... 43
Gambar 4.9. Karakterisasi Makroskopik dan Mikroskopik Isolat DPU 1 ... 45
Gambar 4.10.Karakterisasi Makroskopik dan Mikroskopik Isolat DPU 3 ... 46
Gambar 4.11. Karakterisasi Makroskopik dan Mikroskopik Isolat DPU 4 ... 47
Gambar 4.12. Karakterisasi Makroskopik dan Mikroskopik Isolat DTE 1 ... 48
Gambar 4.13. Karakterisasi Makroskopik dan Mikroskopik Isolat DTE 3 ... 49
Gambar 4.14. Karakterisasi Makroskopik dan Mikroskopik Isolat DTU 1 ... 50
Gambar 4.15. Karakterisasi Makroskopik dan Mikroskopik Isolat DTU 4 ... 51
Gambar 4.16. Karakterisasi Makroskopik dan Mikroskopik Isolat DTU 6 ... 52
Gambar 4.17. Karakterisasi Makroskopik dan Mikroskopik Isolat DTU 7 ... 53
aureus ... 56
Gambar 4.20. Identifikasi Makroskopis dan Mikroskopis Bacillus subtilis .... 56
Gambar 4.21. Identifikasi Makroskopis dan Mikroskopis Escherichia coli .... 57
Gambar 4.22. Identifikasi Makroskopis dan Mikroskopis Shigella
dysenteriae ... 57
DAFTAR TABEL
Halaman
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alur Penelitian ... 76
Lampiran 2. Determinasi Tumbuhan Parijoto (Medinilla speciosa Blume) ... 77
Lampiran 3. Bagan Kerja Isolasi Kapang Endofit ... 78
Lampiran 4. Bagan Kerja Pemurnian Kapang Endofit ... 79
Lampiran 5. Bagan Kerja Skrining Kapang Endofit yang Berpotensi Sebagai Antibakteri ... 80
Lampiran 6. Bagan Kerja Karakterisasi Kapang Endofit yang Berpotensi Sebagai Antibakteri ... 81
Lampiran 7. Bagan Kerja Fermentasi Kapang Endofit ... 82
Lampiran 8. Bagan Kerja Identifikasi Bakteri Uji ... 83
Lampiran 9. Kerja Peremajaan Bakteri Uji ... 84
Lampiran 10. Bagan Kerja Pembuatan Kurva Pertumbuhan Bakteri Uji ... 85
Lampiran 11. Bagan Kerja Uji Aktivitas Antibakteri ... 86
Lampiran 12. Hasil Fermentasi Kapang Endofit ... 87
Lampiran 13. Absorbansi Kurva Pertumbuhan Bakteri Uji ... 89
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara berkembang, dimana tingkat kesadaran
masyarakat untuk menjaga kesehatan masih sangat kurang. Hal ini menyebabkan
masyarakat mudah untuk terjangkit suatu penyakit terutama penyakit infeksi
(Sumampouw et al., 2010). Penyakit infeksi ini dapat disebabkan beberapa
mikroba patogen seperti virus, bakteri, dan fungi.
Mikroba patogen merupakan mikroba penyebab penyakit infeksi yang
sering terjadi di masyarakat. Pengendalian mikroba patogen penting dilakukan
untuk mencegah penyebaran penyakit infeksi (Liana, 2010). Penyakit infeksi
dapat ditangani dengan menggunakan antibiotik. Terapi antibiotik beberapa tahun
lalu dinyatakan berhasil dalam mengatasi penyebaran mikroba patogen. Akan
tetapi, maraknya penggunaan antibiotik yang tidak tepat dapat menyebabkan
resistensi terhadap mikroba patogen (Sjahrurrahman et al., 1999). Hal ini
menyebabkan pencarian obat antimikroba (senyawa bioaktif) yang baru terus
dilakukan. Senyawa bioaktif dapat diperoleh dari beberapa sumber, diantaranya
dari tumbuhan, hewan, mikroba dan mikroorganisme laut (Prihatiningtias, 2005).
Salah satu sumber senyawa bioaktif yang berasal dari mikroba adalah
mikroba endofit. Mikroba endofit adalah mikroba yang hidup di dalam jaringan
tumbuhan pada periode tertentu dan mampu membentuk koloni dalam jaringan
tumbuhan tanpa membahayakan inangnya (Tan RX et al., 2001 dalam Radji,
2005). Tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang
menghasilkan metabolit sekunder (Rante et al., 2013). Mikroba endofit mampu
menghasilkan metabolit sekunder seperti alkaloid, terpen, steroid, flavonoid,
kuinon, fenol dan sebagainya. Senyawa-senyawa ini sebagian besar mempunyai
potensi besar sebagai senyawa bioaktif (Tan RX et al., 2001 dalam
Prihatiningtias, 2005). Mikroba endofit dapat berupa bakteri atau kapang, tetapi
saat ini yang lebih banyak dieksplorasi adalah kelompok kapang endofit (Sinaga
2
antibiotik, antivirus, antimalaria, antikanker, antioksidan, antidiabetes, dan
imunosupresif (Radji, 2005).
Mikroba endofit dapat memproduksi senyawa-senyawa bioaktif, baik yang
sama dengan inangnya ataupun berbeda tetapi seringkali memiliki aktivitas
biologis yang serupa dengan senyawa bioaktif yang diproduksi inangnya (Sinaga
et al., 2009). Strobel dan Daisy (2003) dalam Sinaga et al, 2009 bahkan
menyatakan bahwa senyawa yang dihasilkan oleh mikroba endofit seringkali
memiliki aktivitas yang lebih besar dibandingkan dengan inangnya.
Kemampuan mikroba endofit memproduksi senyawa bioaktif merupakan
peluang yang sangat menantang dalam penyediaan bahan baku obat. Pembiakan
atau kultur mikroba endofit dapat dilakukan dalam jumlah yang sangat besar
tanpa memerlukan lahan yang luas sebagaimana halnya tumbuh-tumbuhan.
Pemanfaatan mikroba endofit sebagai sumber bahan baku obat juga akan
mereduksi kerusakan alam yang disebabkan oleh penebangan tumbuhan obat
dalam jumlah besar (Sinaga et al.,2009).
Banyak kelompok kapang endofit yang mampu memproduksi senyawa
antibiotik yang aktif melawan bakteri maupun fungi patogen terhadap manusia,
hewan dan tumbuhan terutama dari genus Coniothirum dan Microsphaeropsis
(Petrini et al., 1992 dalam Prihatingtias, 2005). Penelitian Dreyfuss et al., (1986)
dalam Prihatingtias, 2005 menunjukkan bahwa aktivitas isolat-isolat endofit
Pleurophomopsis sp. dan Cryptosporiopsis sp. yang diisolasi dari tumbuhan
Cardamin heptaphylla mempunyai aktivitas antimikroba yang tinggi. Isolat-isolat
tersebut menghasilkan penisilin N, sporiofungin A, B, C. Suatu penelitian yang
dilakukan oleh Tscherter dan Dreyfuss (1982) dalam Petrini et al., (1992)
menghasilkan suatu kesimpulan bahwa galur-galur endofit Cryptosporiopsis pada
umumnya merupakan penghasil senyawa antibiotik berspektrum luas. Sebagai
contoh lain adalah phomopsikhalasin yang merupakan golongan sitokhalasin dan
merupakan senyawa metabolik kapang endofit Phomopsis sp. Dengan metode
difusi, senyawa ini mampu menghambat aktivitas bakteri Bacillus subtilis,
Salmonella gallinarium, dan Staphylococcus aureus (Horn et al., 1995 dalam
3
Salah satu kekayaan alam di Indonesia adalah Parijoto atau Medinilla
speciosa Blume. Medinilla merupakan genus yang berasal dari familia
Melastomataceae yang memiliki sekitar 418 spesies dan varietas genus. Medinilla
pertama kali ditemukan pada tahun 1800an di Philiphina yang digunakan sebagai
tanaman hias, spesies yang ditemukan adalah Medinilla magnificient (Mariana et
al., 2012). Medinilla speciosa Blume merupakan tanaman khas dari Desa Colo
Kecamatan Dawe Kabupaten Kudus Jawa Tengah yang tumbuh liar di lereng
gunung atau di hutan-hutan dan kadang dibudidayakan sebagai tanaman hias
(Wibowo et al., 2012). Daun dan buah Medinilla speciosa Blume digunakan
secara tradisional bagi masyarakat sebagai obat diare, sariawan, antiradang, dan
antibakteri, khususnya daun M. speciosa yang digunakan sebagai obat diare
(Anonim, 2014).
Berdasarkan penelitian sebelumnya, ekstrak metanol, etil asetat dan
n-heksan buah Medinilla speciosa Blume memiliki aktivitas antibakteri pada
konsentrasi 200 mg/mL, 100 mg/mL, 50 mg/mL, 25 mg/mL, dan 12,5 mg/mL
terhadap bakteri Staphylococcus aureus dan Escherichia coli. Pada konsentrasi
200 mg/mL, 100 mg/mL, 50 mg/mL, 25 mg/mL, dan 12,5 mg/mL ekstrak etil
asetat mempunyai aktivitas antibakteri lebih besar daripada ekstrak metanol dan
ekstrak n-heksan dengan diameter hambat 17,67 mm; 16,3 mm; 15,67 mm; 14,67
mm; 13,33 mm terhadap bakteri Staphylococcus aureus dan 12,33 mm; 11,33
mm; 10,67 mm; 9 mm; 8 mm terhadap bakteri Escherichia coli (Niswah, 2014).
Senyawa metabolit sekunder seperti glikosida, saponin, tanin, flavonoid,
terpenoid, dan alkaloid telah dilaporkan mempunyai aktivitas antibakteri (Okeke
et al., 2001 dan Rahman et al., 2010 dalam Niswah, 2014).
Sejauh ini, belum ditemukan adanya penelitian mengenai aktivitas
antibakteri yang terdapat dalam kapang endofit tumbuhan Medinilla speciosa
Blume. Oleh karena itu, tujuan penelitian ini adalah melakukan isolasi, seleksi,
dan uji aktivitas antibakteri dari kapang endofit daun parijoto (Medinilla speciosa
Blume) terhadap Staphylococcus aureus, Bacillus subtilis, Escherichia coli, dan
4 1.2 Rumusan Masalah
Berdasarkan latar belakang diatas, maka dapat dibuat rumusan masalah
sebagai berikut :
1. Apakah pada daun parijoto (Medinilla speciosa Blume) dapat ditemukan
kapang endofit?
2. Apakah kapang endofit dari daun parijoto (Medinilla speciosa Blume)
memiliki aktivitas antibakteri terhadap Staphylococcus aureus, Bacillus
subtilis, Escherichia coli, dan Shigella dysenteriae?
I.3 Hipotesis
Kapang endofit yang diisolasi dari daun parijoto (Medinilla speciosa
Blume) mempunyai aktivitas antibakteri terhadap Staphylococcus aureus, Bacillus
subtilis, Escherichia coli, dan Shigella dysenteriae.
1.4 Tujuan Penelitian
Berdasarkan rumusan masalah diatas, tujuan penelitian ini adalah sebagai
berikut :
1. Untuk melakukan isolasi kapang endofit pada daun parijoto (Medinilla
speciosa Blume).
2. Untuk melakukan seleksi kapang endofit pada daun parijoto (Medinilla
speciosa Blume).
3. Untuk mengetahui aktivitas kapang endofit dari daun parijoto sebagai
senyawa antibakteri terhadap Staphylococcus aureus, Bacillus subtilis,
Escherichia coli, dan Shigella dysenteriae.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah sebagai berikut :
1. Memberikan informasi tentang keberadaan kapang endofit yang diisolasi dari
daun parijoto (Medinilla speciosa Blume).
2. Menambah pengetahuan peneliti di bidang mikrobiologi, khususnya tentang
kapang endofit yang mempunyai potensi sebagai penghasil senyawa
BAB II
TINJAUAN PUSTAKA
2.1 Medinilla speciosa Blume 2.1.1 Taksonomi
Klasifikasi tanaman Medinilla speciosa Blume adalah sebagai berikut :
Kingdom : Plantae
Filum : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Myrtales
Famili : Melastomataceae
Genus : Medinilla
Spesies : Medinilla speciosa Blume
(GBIF, 2013)
2.1.2 Morfologi
Parijoto merupakan tanaman perdu dengan tinggi 1-2 m; batang bulat,
kulit dengan lapisan gabus jika tua, bergerigi kasar, putih kecoklatan; daun
tunggal, bersilang berhadapan, tangkai pendek, bulat, lunak, warna ungu
kemerahan, helaian daun bentuk lonjong, pangkal dan ujung runcing, tepi rata,
panjang 10-20 cm, lebar 4-15 cm, pertulangan melengkung, permukaan atas licin,
berwarna hijau, permukaan bawah kasar, warna hijau kelabu; bunga majemuk, di
ketiak daun, sempurna, berkelamin ganda, kelopak 5 helai, ujung runcing, pangkal
berlekat, panjang 3-8 mm, warna ungu tua, benang sari 2 kali lipat jumlah
mahkota, kepala sari berupa kuncup membengkok, warna merah keunguan, kepala
putik duduk di atas bakal buah, kepala putik bulat, ungu, mahkota lepas, 5 helai,
bentuk kuku, panjang 5-8 mm, warna merah muda; buah bulat, bagian ujung
berbenjol bekas pelekatan kelopak, diameter 5-8 mm, warna merah keunguan; biji
6
Gambar 2.1 Tumbuhan Parijoto / Medinilla speciosa Blume
[Sumber : Koleksi Niswah, 2014]
2.1.3 Tempat Tumbuh
Merupakan tumbuhan liar di lereng-lereng gunung atau di hutan-hutan dan
kadang dibudidayakan sebagai tanaman hias. Tumbuh baik pada tanah yang
berhumus tinggi dan lembab, pada ketinggian 800 m sampai 2.300 m di atas
permukaan laut. Berbunga pada bulan November-Januari dan waktu panen tepat
bulan Maret-Mei (Anonim, 2014).
2.1.4 Kandungan Kimia
Daun dan buah parijoto mengandung saponin dan kardenolin, di samping
itu buahnya mengandung flavonid dan daunnya mengandung tanin (Anonim,
2014). Selain itu, buah parijoto juga mengandung terpenoid dan glikosida
(Niswah, 2014 dan Mukkaromah, 2015).
2.1.5 Khasiat
Secara tradisional parijoto digunakan sebagai obat sariawan, diare,
antiradang dan antibakteri, khususnya daun parijoto yang digunakan sebagai obat
diare (Anonim, 2014). Parijoto dipercaya oleh masyarakat di daerah Gunung
Merapi dapat meningkatkan kesuburan janin dan kesehatan ibu hamil (Anggana,
7 2.2 Mikroba Endofit
2.2.1 Definisi
Endofit berasal dari bahasa Yunani, “endo” berarti di dalam dan “fit”
(phyte) berarti tumbuhan (Agusta, 2009). Mikroba endofit adalah mikroba yang
hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan
membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya.
Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang
mampu menghasilkan senyawa biologi atau senyawa metabolit sekunder yang
diduga sebagai akibat koevolusi atau transfer genetik (genetic recombination) dari
tanaman inangnya ke dalam mikroba endofit (Tan RX et al., 2001 dalam Radji,
2005). Endofit mampu hidup pada variasi suhu yang luas, dengan suhu optimum
pada suhu 20°C sampai 26°C (Labeda, 1990).
Mikroba endofit terdiri atas bakteri, kapang, dan aktinomicetes, namun
yang paling banyak ditemukan adalah golongan kapang dan aktinomicetes.
Mikroba endofit mendapat perhatian besar karena dapat menghasilkan senyawa
bioaktif yang dapat berpotensi sebagai antibiotik disebabkan karena aktivitasnya
yang besar dalam membunuh beberapa mikroba patogen. Disamping itu, mikroba
endofit juga mampu menghasilkan senyawa-senyawa yang berpotensi sebagai
antikanker, antimalaria, anti HIV, antioksidan, dan sebagainya (Prihatiningtias,
2006).
Mikroba endofit yang diisolasi dari tumbuhan obat akan memiliki aktivitas
yang lebih besar dibandingkan dengan aktivitas tumbuhan inangnya. Dilihat dari
segi efisiensi, hal ini menguntungkan, karena siklus hidup mikroba endofit lebih
singkat dibandingkan siklus hidup tumbuhan inangnya, sehingga dapat
menghemat waktu yang dibutuhkan untuk mendapatkan senyawa tersebut. Jumlah
senyawa yang diproduksi dapat dibuat dengan skala besar dengan menggunakan
proses fermentasi. Disamping itu, keuntungan lain yang diperoleh, yaitu menjaga
kelestarian tumbuhan obat, terutama yang termasuk jenis tumbuhan langka, agar
tidak dieksploitasi secara terus menerus yang mengakibatkan kepunahan
8 2.2.2 Isolasi Kapang Endofit
Prosedur untuk mengisolasi kapang endofit pada umumnya relatif mudah.
Salah satu hal yang penting dalam mengisolasi kapang endofit adalah
mempertahankan kesegaran sampel. Bila sampel disimpan dalam waktu yang
cukup lama, akan terjadi kematian jaringan. Meskipun demikian, masih
memungkinkan untuk mengisolasi sejumlah kapang endofit dari jaringan yang
telah layu setelah penyimpanan beku (Freezing) dalam waktu lebih dari satu tahun
(Wahyudi, 1997).
Isolasi dimulai dengan melakukan sterilisasi permukaan. Pada umumnya,
untuk sterilisasi permukaan organ tumbuhan dengan cara merendamnya dalam
alkohol (70%-95%). Akan tetapi, kemampuan alkohol untuk mensterilkan
permukaan organ tumbuhan tersebut mempunyai spektrum yang sempit atau
sangat terbatas sehingga perlu dikombinasi dengan bahan kimia lainnya, dan
biasanya sering dikombinasikan dengan 5,3% larutan Natrium Hipoklorit
(NaOCl). Di samping itu, bahan kimia yang bersifat sebagai oksidan, seperti H2O2
(3%) dan KMnO4 (2%) juga dapat dipakai untuk mensterilkan permukaan organ
tumbuhan (Zang et al., 2006). Etanol merupakan derivat alkohol yang efektif dan
dapat diandalkan untuk sterilisasi dan disinfeksi. Natrium Hipoklorit adalah klorin
yang paling banyak dipakai untuk disinfeksi dan menghilangkan bau, karena
bersifat relatif tidak membahayakan bagi jaringan manusia, mudah ditangani,
tidak berwarna dan tidak mewarnai, meskipun dapat memudarkan warna (Block
SS, 1977 dan Chatim et al., 1993).
Sterilisasi dilakukan dengan cara mencuci tanaman yang masih segar
dengan air mengalir selama 10 menit. Setiap sampel dipotong menjadi
potongan-potongan kecil berukuran 1 cm, selanjutnya disterilisasi dengan cara
merendamkan ke dalam etanol dan NaOCl dan terakhir dibilas kembali dengan
etanol selama setengah menit (Wahyudi, 1997).
Proses isolasi selanjutnya dilakukan dengan metode tanam langsung yaitu
setelah perendaman berakhir pada etanol selama setengah menit, potongan sampel
dibiarkan kering di udara dalam Laminar Air Flow dan diletakkan di atas kertas
tisu steril. Potongan-potongan kecil tersebut kemudian diletakkan di atas media
9
permukaan belahan menempel pada agar medium. Tiap cawan petri bersisi 4
potongan (1, 2, 3 dan 4) (Wahyudi, 1997).
Pemilihan medium tumbuh pada tahap pertama isolasi mungkin juga akan
sangat berpengaruh terhadap jumlah dan jenis kapang endofit yang akan terisolasi.
Sebagai contoh, pada proses isolasi kapang endofit dari tanaman teh yang
menggunakan medium Corn Meal Malt Agar (CMMA) dengan antibiotik
kloramfenikol telah dilaporkan hanya 6 jenis kapang endofit yang berhasil
diperoleh (Agusta et al., 2006). Namun, pada proses isolasi kapang endofit dari
tanaman teh dengan menggunakan medium dari agar tanpa penambahan antibiotik
memberikan dua jenis kapang yang sama sekali berbeda dengan yang diperoleh
dari proses isolasi dengan medium CMMA dan antibiotik. Pada medium agar,
khamir memperlihatkan pertumbuhan yang lambat sehingga dapat digunakan
untuk purifikasi isolat kapang filamen yang tercampur dengan khamir (Agusta et
al., 2006).
Pembiakan isolat mikroba endofit membutuhkan waktu yang bervariasi.
Isolasi kapang endofit membutuhkan waktu yang relatif lama kurang lebih 5
sampai 21 hari diinkubasi pada suhu ruang (27-29°C). Waktu inkubasi yang
cukup lama ini disebabkan bahwa kebanyakan kapang endofit mempunyai sifat
sebagai mikroorganisme lambat tumbuh (Wahyudi, 1997).
Zhang et al., (2006) merekomendasikan bahwa kapang endofit akan mulai
tumbuh pada minggu kedua setelah inkubasi dan kapang yang tumbuh sebelum
waktu tersebut kemungkinan besar adalah kontaminan. Namun, perlu diingat
bahwa medium yang digunakan selama proses isolasi adalah medium yang kaya
akan nutrisi sehingga sangat mungkin untuk mempercepat pertumbuhan kapang
endofit. Pada medium yang kaya akan nutrisi seperti CMMA dan PDA, pada hari
ketiga atau keempat sudah terlihat adanya kapang endofit yang tumbuh.
Sementara pada medium yang relatif miskin nutrien, seperti medium agar,
membutuhkan waktu 1 sampai 2 minggu untuk pemunculan koloni kapang. Untuk
itu, cara yang paling rasional untuk mengidentifikasi kontaminan adalah dengan
melakukan isolasi kapang endofit berulang kali (paling tidak 3 kali) (Agusta et al.,
10 2.2.3 Fermentasi Mikroba Endofit
Fermentasi adalah proses yang memanfaatkan kemampuan mikroba untuk
menghasilkan metabolit primer dan metabolit sekunder dalam suatu lingkungan
yang dikendalikan. Pengendalian dilakukan dengan pengaturan kondisi medium,
komposisi medium, suplai O2 dan agitasi. Pada fermentasi terjadi perubahan
struktur kimia dan bahan-bahan organik dengan memanfaatkan agen-agen
biologis terutama enzim sebagai bioakatalis. Produk fermentasi dapat digolongkan
menjadi 4 jenis yaitu : produk biomassa, produk enzim, produk metabolit, dan
produk transformasi (Judoamidjojo et al., 1990).
Dalam bioproses, fermentasi memegang peranan penting karena
merupakan proses utama bagi produksi senyawa-senyawa berbasis biologi.
Senyawa yang dihasilkan merupakan hasil metabolit dari mikroba seperti
antibiotik, asam-asam organik, aldehid, dan alkohol. Medium yang digunakan
dalam fermentasi harus memenuhi syarat seperti: mengandung nutrisi yang
dibutuhkan bagi pertumbuhan sel mikroba, mengandung nutrisi yang dapat
digunakan sebagai sumber energi bagi mikroba, tidak mengandung zat yang dapat
membahayakan pertumbuhan sel, dan tidak terdapat kontaminan yang dapat
meningkatkan persaingan dalam penggunaan substrat (Judoamidjojo et al., 1990).
2.2.4 Kapang Endofit Penghasil Antimikroba
Berdasarkan hasil penelitian sebelumnya, diperoleh beberapa kapang
endofit yang menghasilkan antimikroba. Fisher (1989) menyatakan bahwa lebih
dari 30% kapang endofit yang berhasil diisolasi memiliki aktivitas terhadap
bakteri dan fungi patogen.
Banyak kelompok kapang endofit yang mampu memproduksi senyawa
antibiotik yang aktif melawan bakteri maupun fungi patogen terhadap manusia,
hewan dan tumbuhan, terutama dari genus Coniothrium dan Microsphaeropsis
(Petrini, 1992). Penelitian Dreyfuss et al., (1986) dalam Widyati Prihatiningtias
(2006), menunjukkan aktivitas yang tinggi dari penisilin N, sporiofungin A, B
serta C yang dihasilkan oleh isolat-isolat endofit Pleurophomopsis sp. dan
Cryptosporiopsis sp. yang diisolasi dari tumbuhan Cardamin heptaphylla. Kapang
11
dapat menghambat pertumbuhan Candida albicans dan Bacillus subtilis
(Simartama et al., 2007).
Cryptocandin adalah senyawa kapang yang dihasilkan oleh mikroba
endofit Cryptosporiopsis quercina yang berhasil diisolasi dari tanaman obat
Tripterigeum wilfordii, dan berkhasiat sebagai antifungi yang patogen terhadap
manusia yaitu Candida albicans dan Trichopyton sp. Pestalotiopsis micrispora
merupakan mikroba endofit yang paling sering ditemukan di tanaman hutan
lindung di seluruh dunia. Endofit ini menghasilkan metabolit sekunder ambuic
acid yang berkhasiat sebagai antifungi (Li, JY et al., 2001 dalam Radji, 2005).
Phomopsichalasin merupakan metabolit yang diisolasi dari mikroba endofit
Phomopsis sp., berkhasiat sebagai antibakteri Bacillus subtilis, Salmonella
enterica, Staphylococcus aureus, dan juga dapat menghambat pertumbuhan fungi
Candida tropicalis (Horn WS et al., 1995 dalam Radji, 2005).
2.3 Antimikroba 2.3.1 Definisi
Antimikroba merupakan obat pembasmi mikroba, khususnya mikroba
yang merugikan manusia. Obat yang digunakan untuk membasmi mikroba
penyebab infeksi pada manusia harus memiliki toksisitas selektif setinggi
mungkin. Artinya, obat tersebut haruslah bersifat sangat toksik untuk mikroba,
tetapi relatif tidak toksik untuk hospes (Setiabudy, 2007).
Antibiotik adalah zat yang dihasilkan oleh suatu mikroba, terutama fungi,
yang dapat menghambat atau membasmi mikroba jenis lain. Banyak antibiotik
dewasa ini dibuat secara semisintetik atau sintetik penuh. Namun, antimikroba
sintetik yang tidak diturunkan dari produk mikroba (misalnya sulfonamid dan
kuinolon) juga sering digolongkan sebagai antibotik (Setiabudy, 2007).
2.3.2. Antibakteri
Antibakteri adalah zat aktif yang memiliki efek menghambat atau
12
Berdasarkan sifat toksisitas selektifnya, antibakteri terbagi menjadi
(Ganiswarna et al.,1995) :
a. Bakteriostatik : yaitu zat yang hanya menghambat pertumbuhan bakteri.
b. Bakterisidal : yaitu zat yang dapat membunuh bakteri.
Berdasarkan spektrumnya, antibakteri terbagi menjadi (Ganiswarna et al.,
1995) :
a. Spektrum luas : zat yang aktif terhadap bakteri Gram negatif dan Gram
positif. Contohnya adalah tetrasiklin dan kloramfenikol.
b. Spektrum sempit : zat yang aktif terhadap Gram negatif atau Gram positif
saja. Contonya adalah penisilin yang aktif terhadap bakteri Gram positif.
Kadar minimal yang diperlukan untuk menghambat pertumbuhan mikroba
atau membunuhnya, masing-masing dikenal dengan kadar hambat minimal
(KHM) dan kadar bunuh minimal (KBM). Antimikroba tertentu aktivitasnya
dapat meningkat dari bakteriostatik menjadi bakterisidal bila kadar
antimikrobanya ditingkatkan melebihi KHM (Setiabudy, 2007).
Berdasarkan mekanisme kerjanya, antibakteri dibagi dalam lima kelompok
(Setiabudy, 2007), yaitu :
1. Antibakteri yang menggangu metabolisme sel bakteri
Bakteri membutuhkan asam folat untuk kelangsungan hidupnya.
Bakteri mensintesis sendiri asam folat dari asam amino benzoat (PABA)
untuk kebutuhan hidupnya. Apabila antibakteri menang bersaing dengan
PABA, maka terbentuk analog asam folat yang nonfungsional. Akibatnya
kehidupan bakteri akan terganggu. Antibiotik yang termasuk dalam kelompok
ini adalah sulfonamid, trimetropin, asam p-aminosalisilat (PAS) dan sulfon.
2. Antibakteri yang menghambat sintesis dinding sel bakteri
Antibakteri menghambat reaksi dalam proses pembentukan dinding sel.
Hal ini disebabkan karena tekanan osmotik dalam sel bakteri lebih tinggi
daripada di luar sel, maka kerusakan dinding sel bakteri akan menyebabkan
terjadinya lisis yang merupakan dasar efek bakterisidal pada bakteri yang
peka. Antibiotik yang termasuk dalam kelompok ini adalah penisilin,
13
3. Antibakteri yang mengganggu keutuhan membran sel bakteri
Antibakteri dapat merusak membran sel setelah bereaksi dengan fosfat
pada fosfolipid membran sel mikroba. Antibakteri yang mengubah tegangan
permukaan, dapat merusak permeabilitas selektif dari membran sel bakteri.
Kerusakan membran sel menyebabkan keluarnya berbagai komponen penting
dari dalam sel bakteri, yaitu protein, asam nukleat, nukleotida, dan lain-lain.
Antibiotik yang termasuk dalam kelompok ini adalah polimiksin, golongan
polien, serta berbagai antimikroba kemoteurapetik.
4. Antibakteri yang menghambat sintesis protein sel bakteri
Untuk kehidupannya, sel bakteri perlu mensintesis berbagai protein.
Sintesis protein bakteri berlangsung di ribosom, dengan bantuan mRNA dan
tRNA. Pada bakteri, ribosom terdiri dari 2 subunit berdasarkan konstanta
sedimentasi dinyatakan sebagai ribosom 30S dan 50S. Untuk berfungsi pada
sintesis protein, kedua komponen ini akan bersatu pada pangkal rantai mRNA
menjadi ribosom 70S. Antibiotik yang termasuk dalam golongan ini adalah
aminoglikosida, makrolida, linkomisin, tetrasiklin dan kloramfenikol.
Penghambatan sintesis terjadi dengan berbagai cara, diantaranya :
a. Antibakteri berikatan dengan komponen ribosom 30S dan menyebabkan
kode pada mRNA salah dibaca oleh tRNA pada waktu sintesis protein.
Akibatnya akan terbentuk protein yang abnormal.
b. Antibakteri berikatan dengan ribosom 50S dan menghambat translokasi
kompleks tRNA-peptida dari lokasi asam amino ke lokasi peptida.
Akibatnya, rantai polipeptida tidak dapat diperpanjang karena lokasi asam
amino tidak dapat menerima kompleks tRNA-asam amino yang baru.
c. Antibakteri berikatan dengan ribosom 30S dan menghalangi masuknya
kompleks tRNA-asam amino pada lokasi asam amino.
d. Antibakteri berikatan dengan ribosom 50S dan menghambat pengikatan
asam amino baru pada rantai polipeptida oleh enzim peptidil transferase.
5. Antibakteri yang menghambat sintesis asam nukleat sel bakteri
Antibakteri berikatan dengan enzim polimerasi-RNA sehingga
menghambat sintesis RNA dan DNA. Selain itu, antibakteri juga
14
kromosom yang sangat panjang menjadi bentuk spiral hingga bisa muat
dalam sel bakteri yang kecil. Antibiotik yang termasuk dalam kelompok ini
adalah rifampisin dan golongan kuinolon.
2.4 Uji Aktivitas Antimikroba
Metode yang dapat digunakan untuk mendeteksi aktivitas antimikroba
dalam produk alam terbagi menjadi dua kelompok, yaitu metode difusi dan dilusi.
Metode difusi dikenal dengan teknik kualitatif karena metode ini hanya
memberikan informasi mengenai ada atau tidaknya aktivitas antimikroba dalam
suatu sampel uji. Sedangkan metode dilusi merupakan teknik kuantitatif yang
dapat digunakan untuk mengukur Konsentrasi Hambat Mininum (KHM) dan
Konsentrasi Bunuh Minimum (KBM) (Vanden & Vlientink, 1991 dalam Valgas
et al., 2007).
2.4.1 Metode Difusi
Pada metode ini, zat antimikroba yang akan ditentukan aktivitasnya
berdifusi pada lempeng agar yang telah diinokulasi mikroba uji. Dasar
pengamatannya adalah dengan melihat ada atau tidaknya zona hambat
pertumbuhan mikroba (Lorian, 1980). Metode difusi dibagi menjadi tiga
kelompok, yaitu :
a. Metode disc diffusion (tes Kirby & Bauer)/Metode cakram
Pada metode ini, kertas filter cakram (dengan diameter ± 6 mm), berisi
senyawa uji yang ditempatkan pada permukaan yang sebelumnya telah
diinokulasi dengan mikroba uji. Kemudian, diinkubasi pada suhu kamar
(27-29°C) selama 1 sampai 2 minggu untuk fungi dan pada suhu 37°C selama
18-24 jam untuk bakteri. Agen antimikroba akan berdifusi ke dalam agar dan
menghambat pertumbuhan mikroba uji. Kemudian ada atau tidaknya zona
hambat dapat diamati di sekeliling cakram (Lorian, 1980).
Pembacaan hasil percobaan didasarkan atas besarnya zona hambat yang
terbentuk dan dinyatakan dalam tiga kategori (Lorian, 1980) :
1. Zona hambat total : bila zona hambat yang terbentuk disekitar cakram
15
2. Zona hambat parsial : bila di dalam zona hambat yang terbentuk masih
terlihat adanya pertumbuhan beberapa koloni baru.
3. Zona hambat nol : bila tidak ada zona hambat yang terbentuk di sekitar
cakram.
Kriteria kekuatan daya hambat adalah sebagai berikut (Davis dan Stout,
1971) :
1. Sangat kuat (zona hambat > 20 mm)
2. Kuat (zona hambat 10-20 mm)
3. Sedang (zona hambat 5-10 mm)
4. Lemah (zona hambat < 5 mm)
b. Ditch-plate technique/Metode parit
Pada metode ini sampel uji berupa agen antimikroba yang diletakkan
pada parit yang dibuat dengan cara memotong media agar dalam cawan petri
pada bagian tengah secara membujur. Mikroba uji (maksimum 6 macam)
digoreskan ke arah parit yang berisi agen antimikroba (Pratiwi, 2008). Lalu,
diinkubasi pada suhu kamar (27-29°C) selama 1 sampai 2 minggu untuk
fungi dan pada suhu 37°C selama 18-24 jam untuk bakteri. Kemudian,
diamati ada atau tidaknya zona hambat terhadap pertumbuhan mikroba uji
disekeliling parit (Lorian, 1980).
c. Cup-plate technique/Metode lubang atau cawan
Metode ini serupa dengan metode disc diffusion, di mana dibuat lubang
pada media agar yang telah ditanami dengan mikroorganisme. Pada lubang
tersebut diberi agen antimikroba yang akan diuji (Pratiwi, 2008). Lalu,
diinkubasi pada suhu kamar (27-29°C) selama 1 sampai 2 minggu untuk
fungi dan pada suhu 37°C selama 18-24 jam untuk bakteri. Kemudian,
diamati ada atau tidaknya zona hambat terhadap pertumbuhan mikroba uji
disekeliling lubang (Lorian, 1980).
2.4.2 Metode Dilusi
Pada metode ini zat antimikroba yang akan diuji dicampur dengan media
yang kemudian diinokulasi dengan mikroba. Dasar pengamatannya adalah dengan
16
ditentukan sebagai konsentrasi hambat minimal (KHM) dan konsentrasi bunuh
minimal (KBM) (Lorian, 1980).
Metode ini dilakukan dengan beberapa cara :
a. Metode dilusi cair
Cara yang dilakukan adalah dengan membuat seri pengenceran agen
antimikroba pada medium cair yang ditambahkan dengan mikroba uji.
Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa
adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang
ditetapkan sebagai KHM selanjutnya dikultur ulang pada media cair tanpa
penambahan mikroba uji ataupun agen antimikroba dan diinkubasi selama
18-24 jam. Media cair yang tetap terlihat jernih setelah diinkubasi ditetapkan
sebagai KBM (Pratiwi, 2008)
b. Metode dilusi padat
Metode ini serupa dengan metode dilusi cair namun menggunakan
media padat (solid). Keuntungan metode ini adalah satu konsentrasi agen
antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji
(Pratiwi, 2008).
2.5 Kapang
Kapang adalah organisme kemoheterotrof yang memerlukan senyawa
organik untuk nutrisinya (sumber karbon dan energi). Bila sumber nutrisi tersebut
diperoleh dari bahan organik mati, maka kapang tersebut bersifat saprofit. Kapang
saprofit mendekomposisi sisa-sisa tumbuhan dan hewan yang kompleks dan
menguraikannya menjadi zat yang lebih sederhana. Dalam hal ini, kapang bersifat
menguntungkan sebagai elemen daur ulang yang vital (Pratiwi, 2008).
Beberapa kapang juga bersifat menguntungkan karena merupakan bahan
makanan, misalnya cendawan (mushroom), dan beberapa kapang dapat
bersimbiosis dengan akar tanaman tertentu yang membantu penyerapan air dan
mineral tanah oleh akar. Simbiosis ini dikenal dengan nama mikoriza. Beberapa
kapang dapat bersifat parasit dengan memperoleh senyawa organik dari
mikroorganisme hidup. Dalam hal ini, kapang bersifat merugikan karena
17 2.5.1 Identifikasi Kapang Endofit
Identifikasi kapang dilakukan dengan mengamati beberapa karakter
morfologi baik secara makroskopis maupun secara mikroskopis. Pengamatan
makroskopis meliputi warna dan permukaan koloni (granular, seperti tepung
menggunung, licin), tekstur, zonasi, daerah tumbuh, garis-garis radial dan
konsentris, warna balik koloni (reverse color) dan tetes eksudat (Ilyas, 2007).
Pengamatan secara mikroskopis meliputi sekat hifa (bersekat atau tidak
bersekat), pertumbuhan hifa (bercabang atau tidak bercabang), warna hifa (hialin,
transparan, atau gelap), ada tidaknya konidia dan bentuk konidia (bulat, lonjong,
berantai atau tidak beraturan) (Ariyono, 2014).
2.6 Bakteri Gram Positif dan Negatif
Bakteri merupakan sel prokariotik yang khas, uniseluler (sel tunggal) dan
tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya.
Sel-selnya secara khas, berbentuk bola seperti batang atau spiral. Bakteri mempunyai
diameter sekitar 0,5-1,0 µm dan panjangnya 1,5 sampai 2,5 µm. Reproduksi
terutama dengan pembelahan biner sederhana, yaitu proses aseksual. Beberapa
bakteri dapat tumbuh pada suhu 0°C, ada juga yang tumbuh dengan baik pada
sumber air panas yang suhunya 90°C atau lebih. Kebanyakan bakteri tumbuh pada
berbagai suhu di antara kedua suhu esktrim ini (Pelczar et al., 2008).
Berdasarkan komposisi dinding selnya, bakteri dibagi menjadi dua
golongan, yaitu bakteri Gram positif dan bakteri Gram negatif. Bakteri Gram
negatif mengandung lipid, lemak atau susbtansi seperti lemak dalam persentase
lebih tinggi daripada yang dikandung bakteri Gram positif. Dinding sel bakteri
Gram negatif juga lebih tipis daripada sel bakteri Gram positif (Pelczar et al.,
18
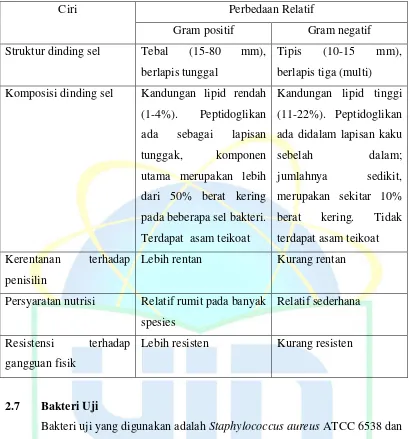
Tabel 2.1 Ciri bakteri Gram positif dan Gram negatif (Pelczar et al., 2008)
Ciri Perbedaan Relatif
Komposisi dinding sel Kandungan lipid rendah
(1-4%). Peptidoglikan
Persyaratan nutrisi Relatif rumit pada banyak
spesies
Bakteri uji yang digunakan adalah Staphylococcus aureus ATCC 6538 dan
Bacillus subtilis ATCC 6633 yang merupakan bakteri Gram positif dan
Escherichia coli ATCC 8739 dan Shigella dysenteriae ATCC 13313 yang
merupakan bakteri Gram negatif.
a. Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram positif dengan klasifikasi
sebagai berikut (Depkes RI, 1989 dan Syahrurahman et al.,1992) :
Kingdom : Prokaryota
Divisi : Bacteria
Kelas : Schizomycetes
19
Famili : Micrococaceae
Genus : Staphylococcus
Spesies : Staphylococcus aureus
Morfologi bakteri ini selnya berbentuk bulat (kokus) dengan diameter
antara 0,8-1,0 µm tunggal atau bepasangan, tidak bergerak dan tidak berspora.
Suhu pertumbuhan optimumnya adalah 35°C dengan pH optimum 7,4.
Pertumbuhan terbaik pada suasana aerob fakultatif. Bakteri ini sering ditemukan
di tanah, air tawar, dan selaput lendir pada binatang berdarah panas termasuk
manusia (Sleigh et al., 1994 dan Gibson JM, 1996).
Beberapa Staphylococcus tergolong flora normal pada kulit dan selaput
lendir manusia. Staphylococcus aureus dapat ditemukan pada kulit, saluran
pencernaan, udara, makanan, air, dan pakaian yang terkontaminasi. Bakteri ini
mudah tumbuh pada kulit yang mengalami peradangan, kulit yang mengalami
luka yang mengarah pada infeksi kulit dan proses-proses bernanah lainnya. Pada
saluran pernafasan dapat menyebabkan infeksi intra abdomen yang dapat timbul
karena komplikasi pasca bedah. Selain itu, Staphylococcus aureus dapat
menyebabkan infeksi traktus urinarius dan infeksi traktus genetali pada wanita
(Salle, 1961).
b. Bacillus subtilis
Bacillus subtilis adalah bakteri aerobik Gram positif berbentuk batang dan
memproduksi endospora dengan klasifikasi sebagai berikut (Singelton et al.,
1981) :
Spesies : Bacillus subtilis
Bakteri ini merupakan spesies basili yang dapat bergerak, menghasilkan
20
lingkaran tidak rata, kekuningan, tidak mengkilap, berdiameter sampai 5 mm.
Bakteri ini dapat tumbuh pada agar darah membentuk zona hemolisis. Dapat juga
tumbuh pada larutan kaldu dan media lain. Bakteri ini tidak membuat toksin
apapun namun kadang dapat membuat hemolisis yang dapat larut. Bakteri ini
bersifat patogen, menyebabkan infeksi pada telur dan dapat mencemari botol
transfusi darah sehingga melisiskan sel darah (Singelton et al., 1981).
c. Escherichia coli
Escherichia coli adalah bakteri Gram negatif dengan klasifikasi sebagai
berikut (Singelton et al., 1981) :
Kingdom : Prokaryota
Divisi : Bacteria
Kelas : Schizomycetes
Ordo : Eubacteriales
Famili : Enterobacteriaceae
Genus : Escherichia
Spesies : Escherichia coli
Escherichia coli biasanya tumbuh berpasang-pasangan atau menyendiri.
Mikroba ini kebanyakan dapat bergerak dan kadang membentuk rantai-rantai
koloni. Koloni pada nutrisi agar (setelah 24 jam pada temperatur 37°C) biasanya
berbentuk bulat, berdiameter 2 sampai 3 mm, berwarna keputihan dengan
permukaan mengkilat. Koloni Escherichia coli terlihat seperti tepung ketika diuji
dengan sengkelit/loop. Kebanyakan Escherichia coli dapat memfermentasi
laktosa, mannitol, dan karbohidrat lain (Singelton et al., 1981).
Spesies ini adalah satu-satunya anggota genus Escherichia. Escherichia
coli terdapat pada saluran pencernaan manusia dan binatang, dapat pula
ditemukan di sungai, danau, tanah dan tempat lain yang telah terkontaminasi
feses. Escherichia coli dapat memproduksi endotoksin sehingga dapat
menyebabkan penyakit saluran urin, gangguan pencernaan seperti diare,
pneumonia, dan meningitis. Namun sebagai bagian dari flora normal saluran
21
dengan memproduksi vitamin K dan materi-materi yang tidak tercernakan di usus
besar (Singelton et al., 1981 dan Anonim, 2014).
Escherichia coli adalah bakteri yang banyak ditemukan di dalam usus
besar manusia sebagai flora normal. Sifatnya unik karena dapat menyebabkan
infeksi primer pada usus misalnya diare pada anak dan travelers diarrhea, serta
memiliki kemampuan menimbulkan infeksi pada jaringan tubuh yang lain di luar
usus (Gibson JM, 1996). Tempat yang paling sering terkena infeksi Escherichia
coli adalah saluran kemih, saluran empedu, dan tempat-tempat lain di rongga
perut (Jawetz et al., 2011). Bakteri ini juga menghasilkan enterotoksin penyebab
diare. Escherichia coli memproduksi enterotoksin yang tahan panas dan dapat
menyebabkan diare yang ringan, sedangkan enterotoksin yang tidak tahan panas
dapat menyebabkan sekresi air dan klorida ke dalam lumen usus dan menghambat
reabsorbsi natrium (Volk dan Wheeler, 1990).
d. Shigella dysenteriae
Shigella dysenteriae adalah bakteri Gram negatif dengan klasifikasi
sebagai berikut (Singelton et al., 1981) :
Kingdom : Prokaryota
Shigella dysenteriae merupakan bakteri berbentuk batang pendek, tumbuh
baik pada suasana aerob dan fakultatif anaerob, tidak dapat bergerak, tidak
berkapsul, tidak berflagel, tidak membentuk spora, dan bersifat patogen pada
pencernaan. Koloni bakteri berbentuk bulat, transparan dengan pinggir utuh, dan
mencapai diameter kira-kira 2 mm dalam media agar 24 jam (Jawetz et al., 2011).
Infeksi Shigella disebut dengan Shigellosis yang merupakan salah satu dari
gangguan yang ditandai dengan peradangan usus, terutama kolon dan disertai
22
lendir. Shigella dapat mengeluarkan lipopolisakarida yang bersifat toksik.
Enterotoksin yang dihasilkan bersifat termolabil dan menyebabkan penggumpalan
cairan di ileum. Enterotoksin bertanggung jawab atas terjadinya watery diarrhea
pada tahap dini dan timbul gejala klasik disentri basiler setelah bakteri
meninggalkan usus halus dan masuk ke usus besar. Shigella dysenteriae juga
memproduksi eksotoksin tidak tahan panas yang mempengaruhi saluran
pencernaan dan susunan saraf pusat. Pada manusia, eksotoksin juga dapat
menghambat absorpsi gula dan asam amino pada usus kecil (Jawetz et al., 2011).
2.8 Fase Pertumbuhan Mikroorganisme
Ada empat macam fase pertumbuhan mikroorganisme, yaitu fase lag, fase
log (fase eksponensial), fase stasioner, dan fase kematian. Fase lag, merupakan
fase adaptasi, yaitu fase penyesuaian mikroorganisme pada suatu lingkungan baru.
Ciri fase lag adalah tidak adanya peningkatan jumlah sel, yang ada hanyalah
peningkatan ukuran sel. Lama fase lag tergantung pada kondisi dan jumlah awal
mikroorganisme dan media pertumbuhan. Bila sel-sel mikroorganisme diambil
dari kultur yang sama sekali berlainan, maka yang sering terjadi adalah
mikroorganisme tersebut tidak mampu tumbuh dalam kultur (Pratiwi, 2008).
Fase log (fase eksponensial), merupakan fase dimana mikroorganisme
tumbuh dan membelah pada kecepatan maksimum, tergantung pada genetika
mikroorganisme, sifat media, dan kondisi pertumbuhan. Sel baru terbentuk
dengan laju konstan dan massa yang bertambah secara eksponensial. Hal yang
dapat menghambat laju pertumbuhan adalah bila satu atau lebih nutrisi dalam
kultur habis, sehingga hasil metabolisme yang bersifat racun akan tertimbun dan
menghambat pertumbuhan. Untuk organisme aerob, nutrisi yang membatasi
pertumbuhan biasanya adalah oksigen. Bila konsentrasi sel mikroorganisme
melebihi 1 x 107/mL, maka laju pertumbuhan akan berkurang, kecuali bila
oksigen dimasukkan secara paksa ke dalam kultur dengan cara pengadukan atau
penggojlokan (shaking). Bila konsentrasi sel mencapai 4-5 x 109/mL, laju
penyebaran oksigen tidak dapat memenuhi kebutuhan meskipun dalam kultur
tersebut diberikan udara yang cukup dan pertumbuhan akan diperlambat secara
23
Pada fase stasioner, pertumbuhan mikroorganisme berhenti dan terjadi
keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati.
Pada fase ini terjadi akumulasi produk buangan yang toksik. Pada sebagian besar
kasus, pergantian sel terjadi dalam fase stasioner ini. Terdapat kehilangan sel yang
lambat karena kematian diimbangi oleh pembentukan sel-sel baru melalui
pertumbuhan dan pembelahan dengan nutrisi yang dilepaskan oleh sel-sel yang
mati karena mengalami lisis. Pada fase kematian, jumlah sel yang mati meningkat.
Faktor penyebabnya adalah ketidaktersediaan nutrisi dan akumulasi produk
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Farmakognosi dan Fitokimia
serta Laboratorium Mikrobiologi Pusat Lembaga Terpadu (PLT), Universitas
Islam Negeri Syarif Hidayatullah Jakarta sejak bulan Januari hingga bulan Mei
2015.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah cawan petri
(Normax), tabung reaksi (Pyrex), cover glass (Assistent), kaca objek (Sail Brand),
pipet tetes, pipet volumetrik, kaca arloji, labu erlenmeyer (Duran Schott), gelas
ukur (Ex 20°C MC YZ), gelas beker (Duran Schott), batang L, Laminar Air Flow
(LAF) (Minihelix II), spektrofotometer uv-vis, inkubator (France Etuves),
autoclave, oven (Memmert), shaker, timbangan analitik (Ogawa Seiki),
centrifuge, vortex, mikroskop cahaya (Olympus), hot plate, water bath, magnetic
stirrer, jarum ose, spatula, mikropipet dan tip (Mettler Toledo), tube, jangka
sorong, pinset, bunsen, gunting steril, kertas saring steril, kapas, kassa, indikator
pH, dan paper disc 6 mm dan 5,5 mm.
bagian daunnya yang berwarna hijau muda, hijau tua, dan hijau kekuningan.
3.2.2.2Bahan untuk Sterilisasi Permukaan
Air bersih yang mengalir, etanol 70%, natrium hipoklorit (NaOCl) 5,25%,
25 3.2.2.3Media Pertumbuhan Mikroba
Potato Dextrose Agar (Merck), Potato Dextrose Broth (Merck); Yeast
Extract (Merck); kalsium karbonat (CaCO3); Nutrient Agar (Merck); Nutrient
Broth (Merck); Mueller Hinton Agar (Merck).
3.2.2.4Bakteri Uji
Bakteri uji diperoleh dari Bagian Mikrobiologi Fakultas Kedokteran,
Universitas Indonesia dan DIPA Pharmalab Intersains.
Bakteri : Gram positif : a. Staphylococcus aureus ATCC 6538
b. Bacillus subtilis ATCC 6633
Gram negatif : a. Escherichia coli ATCC 8739
b. Shigella dysenteriae ATCC 13313
3.2.2.5 Bahan Karakterisasi Kapang Endofit
Aquades steril.
3.2.2.6 Bahan Skrining Kapang Endofit dan Uji Antibakteri
NaCl 0,9%, cork borer, blank disc (cakram steril), cakram kloramfenikol,
dan aquades steril.
3.3 Prosedur Penelitian
3.3.1 Pembuatan Media Pertumbuhan Mikroba a. Pembuatan Media PDA
Media PDA digunakan untuk isolasi dan pemurnian kapang endofit.
Ditimbang Potato Dextrose Agar 39 gram dan ditambahkan aquades sampai 1
liter. Media tersebut dipanaskan sampai mendidih di atas hot plate dan diaduk
dengan magnetic stirrer hingga homogen. Dilakukan sterilisasi dengan
autoclave selama 15 menit pada suhu 121°C. Media dituang ke dalam cawan
petri masing-masing 10 mL, biarkan media memadat di dalam Laminar Air
26 b. Pembuatan Media PDA Miring
Media PDA miring digunakan untuk pemurnian kapang endofit.
Ditimbang Potato Dextrose Agar 39 gram dan ditambahkan aquades sampai 1
liter. Media tersebut dipanaskan sampai mendidih di atas hot plate dan diaduk
dengan magnetic stirrer hingga homogen. Media dimasukkan ke dalam tabung
masing-masing 5 mL. Dilakukan sterilisasi dengan autoclave selama 15 menit
pada suhu 121°C. Tabung diletakkan dalam posisi miring ± 45°, biarkan media
memadat di dalam Laminar Air Flow (Rustanti, 2007).
c. Pembuatan Media PDY Broth
Media PDY digunakan untuk fermentasi kapang endofit. Ditimbang Potato
Dextrose Broth 24 gram; Yeast Extract 2 gram; kalsium karbonat (CaCO3) 5
gram; dan ditambahkan aquades sampai 1 liter. Semua bahan kecuali kalsium
karbonat dimasukkan ke dalam labu Erlenmeyer dan ditambahkan aquades
hingga 1 liter, dan dihomogenkan dengan magnetic stirrer di atas hot plate.
Kalsium karbonat dimasukkan sedikit demi sedikit ke larutan media tersebut
hingga mencapai pH 6. Dilakukan sterilisasi dengan autoclave selama 15 menit
pada suhu 121°C (Ramadhan, 2011).
d. Pembuatan Media NA
Media NA digunakan untuk seleksi kapang endofit yang berpotensi
sebagai antibakteri. Ditimbang Nutrient Agar sebanyak 20 gram dan
ditambahkan aquades sampai 1 liter. Media tersebut dipanaskan sampai
mendidih di atas hot plate dan dihomogenkan dengan magnetic stirrer.
Dilakukan sterilisasi dengan autoclave selama 15 menit pada suhu 121°C.
Media dituang ke dalam cawan petri masing-masing 10 mL, biarkan memadat
di dalam Laminar Air Flow (Rustanti, 2007).
e. Pembuatan Media NA Miring
Media NA miring digunakan untuk peremajaan bakteri uji. Ditimbang
Nutrient Agar sebanyak 20 gram dan ditambahkan aquades sampai 1 liter.
27
dihomogenkan dengan magnetic stirrer. Media dimasukkan ke dalam tabung
masing-masing 5 mL. Dilakukan sterilisasi dengan autoclave selama 15 menit
pada suhu 121°C. Letakkan tabung dalam posisi miring ± 45°, biarkan media
memadat di dalam Laminar Air Flow (Rustanti, 2007).
f. Pembuatan Media NB
Media NB digunakan untuk pembuatan kurva pertumbuhan bakteri uji.
Ditimbang Nutrient Broth sebanyak 8 gram dan ditambahkan aquades sampai 1
liter dalam labu Erlenmeyer. Media tersebut dipanaskan sampai mendidih di
atas hot plate dan dihomogenkan dengan magnetic stirrer. Dilakukan sterilisasi
dengan autoclave selama 15 menit pada suhu 121°C di dalam Laminar Air
Flow (Himedia Laboratories, 2011).
g. Pembuatan Media MHA
Media MHA digunakan untuk uji aktivitas antibakteri. Ditimbang Mueller
Hinton Agar sebanyak 38 gram dan ditambahkan aquades sampai 1 liter. Media
tersebut dipanaskan sampai mendidih di atas hot plate dan dihomogenkan
dengan magnetic stirrer. Dilakukan sterilisasi dengan autoclave selama 15
menit pada suhu 121°C. Media dituang ke dalam cawan petri masing-masing
10 mL, biarkan memadat di dalam Laminar Air Flow (Laboratories Conda,
2014).
3.3.2 Isolasi Kapang Endofit Endofit
Isolasi kapang endofit dilakukan dengan teknik tanam langsung (direct
seed planting) potongan daun tanaman Parijoto yang sebelumnya dilakukan
proses sterilisasi permukaan daun terlebih dahulu (Ramadhan, 2011). Daun yang
masih segar dicuci dibawah air mengalir selama 10 menit. Daun tersebut
direndam ke dalam etanol 70% selama 1 menit kemudian langsung direndam
dalam NaOCl 5,25% selama 5 menit, lalu direndam kembali dengan etanol 70%
selama 30 detik. Lalu dibilas dengan air destilasi steril selama 3-5 detik (Radji et
al., 2011). Daun tersebut dikeringkan di atas kertas saring steril, biarkan kering di
28
cm2 (dikalibrasi dengan menggunakan penggaris) pada daun yang berwarna hijau
muda, hijau tua, dan hijau kekuningan dengan gunting yang telah disterilkan
(Ramadhan, 2011).
Potongan sampel ditempatkan pada cawan petri yang berisi media PDA.
Bagian daun tersebut harus menempel pada permukaan media. 2 cawan petri
masing-masing berisi 2 bagian potongan daun. Lalu media yang telah diinokulasi
dengan potongan daun diinkubasi pada suhu ruang selama 14 hari (Rustanti,
2007). Aquades bilasan terakhir diambil 1 mL dan diisolasi ke PDA lainnya,
perlakuan ini berfungsi sebagai kontrol sterilisasi permukaan daun (Ariyono et al.,
2014). Semua proses sterilisasi hingga proses isolasi dilakukan secara aseptis di
dalam Laminar Air Flow.
3.3.3 Pemurnian Kapang Endofit
Kapang endofit yang tumbuh pada media isolasi PDA selanjutnya
dimurnikan ke dalam media PDA dengan cara menginokulasi sedikit hifa dengan
ose steril dari setiap koloni endofit yang berbeda. Lalu diinkubasi selama 5 hari
pada suhu ruang. Tiap koloni kapang dipindahkan ke dalam masing-masing satu
cawan PDA, dikerjakan secara duplo untuk working culture dan stock culture.
Tiap koloni kapang yang tumbuh pada media PDA dipindahkan ke agar miring
PDA dan diinkubasi pada suhu ruang selama 5 hari. Tiap isolat kapang dibuat
duplo pada agar miring, masing-masing sebagai working culture dan stock culture
(Rustanti, 2007).
3.3.4 Skrining Kapang Endofit yang Berpotensi sebagai Antibakteri
Skrining kapang endofit yang berpotensi sebagai antibakteri dilakukan
dengan metode difusi agar padat (Diffusion Agar Plate Method). Bakteri uji yang
digunakan yaitu Staphylococcus aureus ATCC 6538, Bacillus subtilis ATCC
6633, Escherichia coli ATCC 8739, dan Shigella dysenteriae ATCC13313.
Biakan bakteri uji dalam NB (biakan bakteri dibuat menggunakan kurva
pertumbuhan) dipipet 0,1 mL dimasukkan secara aseptis ke dalam media agar NA
yang telah memadat dan disebarkan secara merata dengan menggunakan batang L.