KAJIAN PENGOLAHAN MI SUBSTITUSI SORGUM INSTAN
BERANTIOKSIDAN TINGGI
SKRIPSI
DESSYANA F24062061
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PROCESSING REVIEW OF INSTANT SORGHUM
SUBSTITUTION NOODLE
WITH HIGH ANTIOXIDANT CONTENT
Dessyana1, Nurheni Sri Palupi1,2, dan Sutrisno Koswara1,2
1
Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Kampus IPB Darmaga, PO. Box 220, Bogor 16002, Indonesia
2Southeast Asia Food and Agricultural Science and Technology (SEAFAST) Center
Jl. Puspa Lingkar Kampus IPB Darmaga, Bogor 16680, Indonesia
ABSTRACT
Instant sorghum substitution noodle is a food product alternative as source of carbohydrate with high antioxidant content. Research methodology was divided into 3 stages: sorghum flour processing, instant sorghum noodles production, and instant sorghum noodle analysis. Sorghum was hulled 0, 20, and 60 seconds before the flour will be used in the formulation. Concentrations of sorghum flour for substitution were 30%, 40%, and 50%. Addition of water about 40% by weight of the mixed flour and frying for 120 seconds at 160oC were the most optimum parameters. Based on organoleptic tests, formulation was made from hulled sorghum about 20 seconds with 30% concentration of substitution was the most preferred formulation. Based on physical analysis, elongation value of formulation selected was 72.68%, hardness value was 3609.50 gf, adhesiveness value was 977.42 gf, springiness value was 0.2706 gs, water absorption (DSA) value was 146.96% and cooking loss value was 9.20%. Based on chemical analysis, formulation selected had 3.56% moisture content, 1.64% ash content, 17.32% fat content, 9.55% protein content, 67.91% carbohydrate content, and 0.61% crude fiber content. Sorghum flour was used had 8.37% moisture content, 1.18% ash content, 3.86% fat content, 6.15% protein content, 80.43% carbohydrate content, and 2.40% crude fiber content. Based on antioxidants analysis, total phenol content of formulation selected was 0.05 mg GAE (Gallic Acid Equivalent)/g, antioxidant activity was 0.58 mg AEAC (Ascorbic acid Equivalent Antioxidant Capacity)/g, and antioxidant capacity was 18.17%. Sorghum flour was used had total phenol content was 0.12 mg GAE/g, antioxidant activity was 0.73 mg AEAC/g, and antioxidant capacity was 23.13%.
Dessyana. F24062061. Kajian Pengolahan Mi Substitusi Sorgum Instan Berantioksidan Tinggi. Di bawah bimbingan Dr. Ir. Nurheni Sri Palupi, M.Si. dan Ir. Sutrisno Koswara, M.Si.
RINGKASAN
Sorgum (Sorghum bicolor L. Moench) merupakan salah satu jenis tanaman serealia yang memiliki potensi sebagai sumber kalori di dunia, bahkan menduduki peringkat keempat setelah beras, gandum, dan jagung. Sorgum mempunyai prospek yang baik untuk dimanfaatkan sebagai bahan pangan, tidak hanya dikarenakan daya adaptasinya yang baik pada lahan kering dan relatif tahan hama, tetapi kandungan nutrisi sorgum tidak kalah jika dibandingkan dengan serealia lainnya. Untuk meningkatkan nilai tambah dan penerimaan masyarakat terhadap komoditas tersebut, rekayasa cara pengolahan sorgum menjadi mi instan dapat dilakukan. Mi substitusi sorgum instan yang dihasilkan masih menggunakan bahan baku terigu untuk memperbaiki karakteristik mi yang dihasilkan.
Penelitian ini bertujuan secara umum untuk memanfaatkan sorgum sebagai bahan substitusi dalam pembuatan mi substitusi sorgum instan berantioksidan tinggi dan bertujuan secara khusus untuk mendapatkan formula mi substitusi sorgum instan yang paling disukai, menentukan karakteristik tepung sorgum yang digunakan beserta mi substitusi sorgum instan yang dihasilkan, mengukur kandungan total fenol dan aktivitas serta kapasitas antioksidan pada formula mi substitusi sorgum instan yang paling disukai. Penelitian yang dilakukan terdiri dari 3 tahap, diantaranya tahap pembuatan tepung sorgum, tahap pembuatan mi substitusi sorgum instan, dan tahap analisis mi substitusi sorgum instan terpilih beserta tepung sorgum yang digunakan pada formula terpilih.
Tepung sorgum diproduksi melalui proses penyosohan dan penepungan biji sorgum. Penyosohan biji sorgum dilakukan dengan waktu sosoh selama 0, 20, dan 60 detik. Tepung sorgum yang digunakan dalam pembuatan mi substitusi sorgum instan merupakan tepung sorgum yang telah melalui tahap pengayakan menggunakan pengayak bergetar (vibrating screen)berskala 100 mesh.
Proses pembuatan mi substitusi sorgum instan mengacu pada proses pembuatan mi instan terigu pada umumnya meliputi pencampuran, pembentukan adonan dan lembaran, pencetakan mi dan pemotongan, pengukusan, penggorengan dan pendinginan. Penentuan jumlah air yang ditambahkan dalam formula dan penentuan waktu penggorengan yang optimum merupakan langkah awal dalam pembuatan mi substitusi sorgum instan. Berdasarkan pengujian yang dilakukan, penambahan air sebanyak 40% dari berat campuran tepung dipilih untuk selanjutnya diberlakukan pada semua formula dan waktu yang paling optimum dalam proses penggorengan mi substitusi sorgum instan adalah selama 120 detik (2 menit) pada suhu 160°C.
KAJIAN PENGOLAHAN MI SUBSTITUSI SORGUM INSTAN
BERANTIOKSIDAN TINGGI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh DESSYANA
F24062061
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kajian Pengolahan Mi Substitusi Sorgum Instan Berantioksidan
Tinggi
Nama : Dessyana
NRP : F24062061
Menyetujui,
Pembimbing I Pembimbing II
(Dr. Ir. Nurheni Sri Palupi, M.Si) (Ir. Sutrisno Koswara, M.Si)
NIP 19610802.198703.2.002 NIP 9640505.199103.1.003
Mengetahui :
Ketua Departemen,
(Dr. Ir. Dahrul Syah, MSc.) NIP 19650814.199002.1.001
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul
Kajian Pengolahan Mi Substitusi Sorgum Instan Berantioksidan Tinggi adalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum
diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi
yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan
dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka
di bagian akhir skripsi ini.
Bogor, Oktober 2010
Yang membuat pernyataan
Dessyana
© Hak Cipta mlik Dessyana, tahun 2010 Hak Cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik
BIODATA PENULIS
Penulis dilahirkan di Jakarta pada tanggal 31 Desember 1987
sebagai anak kedua dari pasangan Alim Soehayrman dan
Mirayati. Penulis menempuh pendidikan dasar di SD. Maria
Fransiska, SLTP Pax Ecclesia, dan SMA Marsudirini Bekasi.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor
pada tahun 2006 melalui jalur Seleksi Penerimaan
Mahasiswa Baru (SPMB) pada Departemen Ilmu dan
Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Selama masa studi di IPB, penulis merupakan anggota
HIMITEPA dan KEMAKI. Pengalaman organisasi yang pernah dijalani penulis
adalah menjadi anggota Biro Pendidikan dan Pengembangan Kemaki (2007-2009),
anggota Food Processing Club divisi Confectionery (2007) serta divisi Ice Cream
(2008), dan berpartisipasi sebagai penyuluh dalam Penyuluhan Keamanan Pangan
untuk Pedagang Sekitar Kampus IPB (2008), Pengalaman kerja yang pernah dilalui
penulis adalah menjadi guru les privat, asisten praktikum teknologi pengolahan
pangan, dan praktek lapang di KPB PT Perkebunan Nusantara.
Selama mengikuti perkuliahan, seminar dan pelatihan yang pernah
diikuti penulis adalah seminar Kewirausahaan IPB (2006), seminar Another Bussines
Hour IPB “From The Spirit Get Profit” (2007), seminar dan pelatihan Auditor
Sistem HACCP (2008), serta seminar dan pelatihan Sistem Manajemen Pangan Halal
(2009). Prestasi yang pernah diraih penulis adalah peraih beasiswa PPA-IPB
(2008-2010), penerima dana dari program Dikti untuk PKMI 2007 yang berjudul “Efek
Perubahan pH dan Penambahan Senyawa Logam Terhadap Stabilitas Warna Pigmen
Curcumin pada Kunyit (Curcuma longan Linn.)” dan untuk PKMP 2009 yang
berjudul “Aplikasi Limbah Bawang Merah (Alium cepa L.) sebagai Antibrowning
Agent pada Apel Fresh Cut”.
KATA PENGANTAR
Puji dan syukur kepada Tuhan atas segala berkat dan penyertaan-Nya
sehingga penulis dapat menyelesaikan skripsi ini. Penelitian dengan judul Kajian
Pengolahan Mi Substitusi Sorgum Instan Berantioksidan Tinggi dilaksanakan di
Institut Pertanian Bogor sejak bulan Februari sampai dengan Juli 2010.
Dengan telah selesainya penelitian hingga tersusunnya skripsi ini, penulis
ingin menyampaikan penghaargaan dan terim kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Nurheni Sri Palupi, M.Si yang telah memberikan arahan, bimbingan,
saran, dan nasihat selama penulis menempuh pendidikan dan penelitian.
2. Ir. Sutrisno Koswara, M.Si yang telah memberikan izin, kesempatan, arahan,
bimbingan, saran, dan nasihat selama proses penelitian kepada penulis.
3. Ir. Elvira Syamsir, M.Si atas kesediaannya menjadi dosen penguji serta atas
segala masukan dan pencerahan yang diberikan kepada penulis.
4. Papa, mama, kakak, keluarga besar, dan teman-teman Legio Mariae atas cinta
kasih, doa, semangat, dan dukungannya kepada penulis.
5. Febri, Narita, Bayang, Daniel Pramuita, Adel, dan Agnes. Terima kasih atas
dukungan, rasa saling berbagi, dan kebersamaan kita selama ini.
6. Saffiera, Septi, Dewi, Eka, Erinna, Stephanie, Wonojatun, Arius, Riza dan semua
teman, adik kelas, dan kakak kelasku yang tak dapat dituliskan satu persatu.
Terima kasih atas masukan, dukungan, dan kebersamaan kita.
7. Seluruh dosen ITP, staff dan teknisi laboratorium di ITP maupun di SEAFAST,
serta setiap individu dan institusi terkait, atas segala pengajaran, pendidikan,
moral, dan bantuan yang telah diberikan kepada penulis.
Penulis berharap semoga skripsi ini bermanfaat dan memberikan kontribusi
yang nyata terhadap perkembangan ilmu pengetahuan di bidang teknologi pangan.
Bogor, Oktober 2010
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 3
C. MANFAAT ... 3
II. TINJAUAN PUSTAKA ... 4
A. SORGUM ... 4
1. Botani Sorgum ... 4
2. Morfologi dan Anatomi Biji Sorgum ... 5
3. Komposisi Kimia Biji Sorgum ... 7
B. MI INSTAN SORGUM ... 11
1. Definisi Mi Instan ... 11
2. Proses Pembuatan Mi Substitusi Sorgum Instan ... 13
C. ANTIOKSIDAN ... 14
1. Definisi Antioksidan ... 14
2. Mekanisme Reaksi Antioksidan ... 15
3. Komponen Bioaktif Sorgum ... 17
III. METODOLOGI PENELITIAN ... 22
A. ALAT DAN BAHAN .. ... 22
B. TAHAPAN PENELITIAN ... 22
1. Pembuatan Tepung Sorgum ... 22
2. Pembuatan Mi Substitusi Sorgum Instan ... 25
a. Penentuan Jumlah Air dan Waktu penggorengan ... 25
b. Formulasi Mi Substitusi Sorgum Instan ... 26
Halaman
C. METODE ANALISIS... 28
1. Analisis Sensori ... 28
2. Analisis Fisik ... 29
3. Analisis Kimia ... 31
4. Analisis Total Fenol... 35
5. Analisis Anti Radikal Bebas DPPH... 36
IV. HASIL DAN PEMBAHASAN ... 38
A. Proses Pembuatan Tepung Sorgum ... 38
B. Proses Pembuatan Mi Substitusi Sorgum Instan ... 39
C. Formula Mi Substitusi Sorgum Instan Terpilih ... 41
D. Karakteristik Fisik Mi Substitusi Sorgum Instan Terpilih Setelah Rehidrasi ... 47
E. Karakteristik Kimia Mi Substitusi Sorgum Instan dan Tepung Sorgum Terpilih ... 51
F. Ketersediaan Senyawa Antioksidan pada Mi Substitusi Sorgum Instan Terpilih ... 56
V. SIMPULAN DAN SARAN ... 64
DAFTAR PUSTAKA ... 66
DAFTAR TABEL
Halaman
1. Hasil analisis kimia terhadap bagian-bagian biji sorgum ... 7
2. Kandungan vitamin pada biji sorgum utuh dan bagian-bagiannya ... 9
3. Komposisi kimia sorgum, gandum, dan jagung dalam 100 gram bahan
yang dapat dimakan ... 10
4. Syarat mutu mi instan ... 12
5. Formulasi mi substitusi sorgum instan ... 26
6. Pengaturan Texture Analyzer dalam mode TPA
(Texture Profile Analysis) ... 30
7. Bobot total biji sorgum dan rendemen tepung sorgum ... 39
8. Karakteristik warna dan waktu rehidrasi produk mi substitusi sorgum
instan pada variasi waktu penggorengan ... 41
9. Rekapitulasi hasil uji rating ... 43
10. Karakteristik fisik mi substitusi sorgum instan terpilih dan mi instan
komersial ... 47
DAFTAR GAMBAR
Halaman
1. Tanaman sorgum ... 4
2. Struktur biji sorgum ... 6
3. Reaksi reduksi terhadap warna dari senyawa DPPH ... 17
4. Struktur asam fenolik pada sorgum yaitu asam benzoat dan asam Sinamat ... 18
5. Struktur antosianin pada sorgum yaitu apigenidin dan luteolinidin ... 19
6. Struktur proantosianidin atau tanin pada sorgum ... 20
7. Tahapan penelitian ... 23
8. Tahap pembuatan tepung biji sorgum dengan waktu penyosohan 0 detik ... 24
9. Tahap pembuatan tepung biji sorgum dengan waktu penyosohan 20 dan 60 detik ... 24
(a) Mesinpenepung cakram ... 25
(b) Pengayak bergetar... 25
11. Mesin pembuat mi ... 26
12. Proses pembuatan mi substitusi sorgum instan ... 27
13. Tepung sorgum yang dihasilkan ... 39
14. Proses penggorengan dengan mesin penggoreng ... 42
15. Mi substitusi sorgum instan terpilih ... 47
16. Total fenol mi substitusi sorgum instan dan tepung sorgum terpilih ... 57
17. Aktivitas antioksidan mi substitusi sorgum instan dan tepung sorgum terpilih beserta biji sorgum dengan perlakuan waktu penyosohan 60, 20, dan 0 detik ... 60
DAFTAR LAMPIRAN
Halaman
1. Formulir uji rating hedonik ... 73
2. Pengolahan data uji rating hedonik terhadap atribut rasa ... 74
3. Pengolahan data uji rating hedonik terhadap atribut elastisitas ... 75
4. Pengolahan data uji rating hedonik terhadap atribut kelengketan ... 76
5. Pengolahan data analisis elongasi ... 77
6. Pengolahan data kekerasan dan kelengketan ... 77
7. Pengolahan data analisis kekenyalan ... 77
8. Pengolahan data analisis daya serap air (DSA) ... 78
9. Pengolahan data analisis kehilangan padatan akibat pemasakan (KPAP) ... 78
10. Pengolahan data analisis kadar air ... 79
11. Pengolahan data analisis kadar abu ... 79
12. Pengolahan data analisis kadar lemak ... 79
13. Pengolahan data analisis kadar protein ... 80
14. Pengolahan data analisis kadar karbohidrat ... 80
15. Pengolahan data analisis kadar serat kasar ... 80
16. Kurva standar asam galat (untuk analisis total fenol mi substitusi sorgum instan dan tepung sorgum terpilih) ... 81
17. Kurva standar asam galat (untuk analisis total fenol mi instan komersial ... 81
18. Pengolahan data analisis total fenol ... 82
19. Kurva standar asam askorbat ... 82
20. Pengolahan data analisis aktivitas dan kapasitas antioksidan ... 83
II. PENDAHULUAN
A. LATAR BELAKANG
Kesadaran masyarakat untuk mengonsumsi makanan yang bergizi dan
bervariasi saat ini sudah semakin meningkat. Kesadaran ini dipengaruhi oleh
semakin majunya teknologi dan media informasi di bidang pangan. Telah banyak
penelitian yang membuktikan adanya hubungan antara pangan dan kesehatan
sehingga hal ini menstimulir munculnya aneka produk pangan fungsional.
Kebiasaan masyarakat dalam mengonsumsi produk pangan juga
dipengaruhi oleh gaya hidup masyarakat yang semakin dinamis dikarenakan oleh
tuntutan pekerjaan. Tingginya aktivitas yang didorong oleh semakin tingginya
kebutuhan, menyebabkan pola konsumsi pangan yang praktis dalam
penyajiannya menjadi tren konsumsi saat ini. Mi instan merupakan salah satu
jenis pangan yang dapat menjadi alternatif pengganti pangan pokok, selain
karena kepraktisannya, mi instan juga dapat mengenyangkan. Seiring dengan
perkembangan zaman, peningkatan pendapatan dan kesadaran masyarakat akan
kesehatan serta pentingnya nilai gizi dalam makanan yang mereka konsumsi
menyebabkan kebutuhan akan mi instan yang menyehatkan (mi sehat) pun
meningkat.
Konsumsi mi instan yang mampu menggantikan konsumsi beras
merupakan bentuk partisipasi terhadap program diversifikasi pangan, yang dalam
perjalanannya diartikan sebagai program yang bertujuan untuk menurunkan
tingkat konsumsi beras. Maksud dari program diversifikasi pangan pada dasarnya
adalah menganekaragamkan jenis pangan dan meningkatkan mutu gizi makanan
rakyat baik secara kualitas maupun kuantitas sebagai usaha untuk meningkatkan
kualitas sumber daya manusia (Ariani 2006). Mi instan yang umumnya
dikonsumsi adalah mi instan yang berbahan baku terigu.
Pemanfaatan terigu sebagai bahan baku pangan di Indonesia meningkat
sangat signifikan dari 9.9 kg per kapita pada tahun 2002, menjadi 17.11 kg per
kapita pada tahun 2007 atau sekitar 12% dari konsumsi pangan Indonesia. Pada
tahun 2007, 100% kebutuhan dalam negeri dipenuhi oleh gandum impor. Volume
daripada periode yang sama tahun 2008 (Melyani 2009). Berdasarkan data Badan
Pusat Statistik, volume impor terigu selama bulan Januari 2010 bahkan naik
menjadi 60029 ton (Zuhri 2010). Ketidakseimbangan antara impor terigu dengan
produksi terigu dalam negeri yang secara tidak langsung dipengaruhi pula oleh
kebijakan pemerintah, tentu akan berdampak negatif bagi perekonomian
Indonesia (Dinas Komunikasi dan Informatika Prov. Jatim 2009). Substitusi
terigu menggunakan tepung sorgum diharapkan mampu mendukung secara utuh
program diversifikasi pangan yang mengindahkan ketersediaan bahan baku
lainnya di dalam negeri sekaligus manfaatnya yang baik bagi kesehatan.
Sorgum merupakan salah satu komoditas hayati dari Afrika. Sorgum
sebenarnya sudah dikenal di Indonesia sejak tahun 1925, tetapi
perkembangannya tidak sebaik padi dan jagung. Hal ini dikarenakan masih
sedikitnya daerah yang memanfaatkan tanaman sorgum sebagai bahan pangan.
Sorgum di berbagai wilayah Indonesia mempunyai istilah yang berbeda-beda,
seperti cantel di berbagai desa di Jawa Tengah dan Jawa Timur, jagung cantrik di
daerah Jawa Barat, batara tojeng di berbagai desa di Sulawesi Selatan. Sorgum
baru berkembang baik pada tahun 1973 di beberapa daerah seperti Demak,
Kudus, Grobogan, Purwodadi, Lamongan, dan Bojonegoro (Suprapto dan
Mudjisihono 1987).
Sorgum merupakan salah satu jenis tanaman serealia yang memiliki
potensi sebagai sumber kalori di dunia, bahkan menduduki peringkat keempat
setelah beras, gandum, dan jagung (FAO 1996). Sorgum mempunyai prospek
yang baik untuk dimanfaatkan sebagai bahan pangan, tidak hanya dikarenakan
daya adaptasinya yang baik pada lahan kering dan relatif tahan hama, tetapi
kandungan nutrisi sorgum tidak kalah jika dibandingkan dengan serealia lainnya.
Jika dibandingkan dengan jagung, kadar protein sorgum lebih tinggi. Namun jika
dibandingkan dengan gandum, kadar protein sorgum masih lebih rendah. Dari
segi kandungan mineral, sorgum memiliki kandungan kalsium, besi, dan tiamin
yang lebih tinggi daripada gandum dan jagung (Hubeis 1984).
Sorgum mengandung komponen fenolik yang memiliki sifat antioksidan.
Menurut Wall dan Blessin (1970), meskipun kandungan karotennya tidak
khususnya tanin. Beberapa sumber menyatakan bahwa senyawa tanin memiliki
manfaat kesehatan, diantaranya dapat menghambat oksidasi asam linoleat pada
hemoglobin, mampu menurunkan kadar kolestrol darah, memiliki potensial untuk
diaplikasikan pada makanan penderita diabetes dan obesitas, serta memiliki
aktivitas anti mutagenik.
B. TUJUAN
Tujuan umum penelitian ini adalah memanfaatkan sorgum sebagai bahan
substitusi dalam pembuatan mi substitusi sorgum instan berantioksidan tinggi.
Tujuan khusus dari penelitian ini adalah untuk mendapatkan formula mi
substitusi sorgum instan yang paling disukai, menentukan karakterisitik mi
substitusi sorgum instan terpilih beserta tepung sorgum yang digunakan, dan
mengukur kandungan total fenol dan aktivitas serta kapasitas antioksidan pada
formula mi substitusi sorgum instan yang paling disukai.
C. MANFAAT
Manfaat dari penelitian ini adalah memberikan informasi yang terkait
dengan potensi sorgum sekaligus meningkatkan nilai tambah dari sorgum sebagai
II. TINJAUAN PUSTAKA
A. SORGUM
1. Botani Sorgum
Sorgum (Sorghum bicolor L. Moench) merupakan salah satu jenis
tanaman yang termasuk dalam kelas Monocotyledon, famili Gramineae dan
sub famili Panicoideae (Matz 1991). Sebenarnya sorgum merupakan daging
biji terlindung pada sekam dari malai yang berdiri tegak pada batang. Namun
dalam kenyataan praktisnya, yang dimaksud dengan sorgum menurut Hubeis
(1984), yaitu butir sorgum yang telah dipisahkan dari sekamnya dengan cara
perontokan dan berdasarkan Badan Standarisasi Nasional (1992) merupakan
biji dari tanaman sorgum yang telah dikeringkan dan dibuang kelopaknya.
Tanaman ini dapat tumbuh baik di daerah tropik dan subtropik, dari
dataran rendah (daerah pantai) sampai ketinggian 700 m di atas permukaan
laut. Suhu optimum yang diperlukan untuk pertumbuhan tanaman sorgum
antara 23o-30oC dengan kelembapan relatif 20-40%, sedangkan suhu tanah
yang baik untuk pertumbuhannya adalah ± 25oC (Suprapto dan Mudjisihono
1987). Tanaman sorgum dapat tumbuh mencapai ketinggian antara 2-15 kaki.
Batang tanaman sorgum hampir menyerupai tanaman jagung, hanya saja
tanaman sorgum memiliki lebih banyak akar sekunder dan luas daun yang
lebih kecil (Kramer 1959). Bentuk tanaman sorgum dapat dilihat pada
Gambar 1.
Sorgum berasal dari Afrika dan diperkirakan masuk ke Indonesia pada
tahun 1925 dengan istilah yang berbeda-beda tiap daerah (Suprapto dan
Mudjisihono 1987). Sorgum berpotensi besar untuk berkembang di Indonesia
karena sorgum mempunyai daerah adaptasi yang luas, meliputi daerah
beriklim kering atau musim hujan pendek serta tanah yang kurang subur.
Selain itu, sorgum dapat ditanam sebagai tanaman sisipan atau tumpang sari
dengan padi gogo, kedelai, kacang tanah, ataupun tembakau sehingga luas
tanaman sorgum yang sesungguhnya agak sulit diukur. Penghasil sorgum
terbesar di Indonesia terdapat di Jawa Tengah, disusul Jawa Timur, DI
Yogyakarta, serta NTB dan NTT (Sirrapa 2003).
2. Morfologi dan Anatomi Biji Sorgum
Biji sorgum pada umumnya berbentuk bulat lonjong atau bulat telur
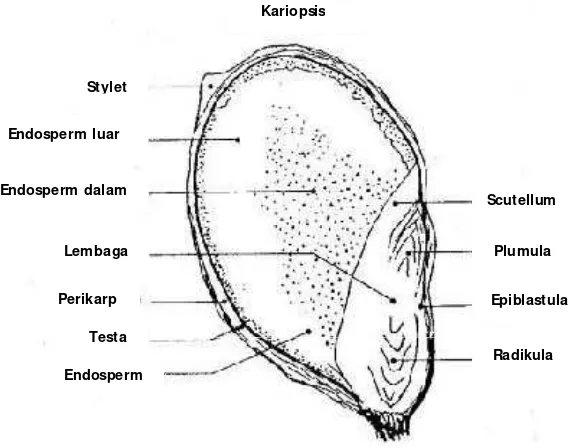
dan terdiri dari tiga bagian utama, yaitu kulit luar, lembaga, dan endosperm.
Komposisi dari bagian-bagian bijinya, yaitu kulit luar 7.9%, lembaga 9.8%,
dan endosperm 82.3% (Hoseney 1998). Menurut Watson (1984), biji sorgum
berbentuk bulatan dengan ukuran panjang sekitar 4.0 mm, lebar 3.5 mm, dan
tebal 2.5 mm. Berat biji sorgum bervariasi antara 8 sampai 50 mg dengan
berat rata-rata sebesar 28 mg. Biji sorgum termasuk jenis kariopsis
(caryopsis) dimana seluruh perikarp bergabung dengan endosperm. Gambar
penampang biji sorgum dapat dilihat pada Gambar 2.
Perikarp atau kulit luar merupakan bagian terluar dari biji yang
melapisi endosperm. Menurut Suprapto dan Mudjisihono (1987), perikarp
terdiri dari tiga lapisan, yaitu epikarp, mesokarp, dan endokarp. Epikarp
tersusun atas dua sampai tiga lapis sel memanjang, berbentuk segi empat,
memiliki ketebalan tertentu, dan mengandung zat pigmen. Zat pigmen yang
terdapat pada perikarp berwarna putih, kuning, jingga, dan merah, dimana zat
pigmen ini dapat mengalir masuk ke dalam endosperm.
Lapisan tengah dari perikarp adalah mesokarp yang merupakan
lapisan paling tebal dari ketiga lapisan yang menyusun perikarp. Sel
mesokrap mengandung granula pati kecil, berbentuk poligonal dan dapat
merupakan satu-satunya jenis serealia yang memiliki pati pada bagian
mesokarp.
Gambar 2.Struktur biji sorgum (FSD 2010)
Lapisan paling dalam dari perikarp adalah endokarp. Lapisan
endokarp terdiri atas sel-sel melintang berbentuk tabung. Salah satu fungsi
dari sel berbentuk tabung tersebut, yaitu mengangkut air. Tepat di bawah
endokarp, terdapat lapisan testa yang mengelilingi endosperm. Beberapa
peneliti berpendapat bahwa senyawa polifenol kadar tinggi terdapat dalam
testa (Felicia 2006). Hoseney (1998) menyatakan bahwa pada lapisan testa
terdapat senyawa polifenol dalam jumlah tinggi, yaitu berupa tanin dalam
bentuk terkondensasi (condensed tannin). Lapisan testa terkait sangat kuat
dengan lapisan perikarp dan sulit dihilangkan.
Lembaga terdiri dari keping biji dan terikat kuat dengan endosperm.
Hal ini menyebabkan lembaga sulit dihilangkan dengan proses penggilingan.
Lembaga kaya akan protein, lemak, serta sejumlah mineral dan vitamin B
(Suprapto dan Mudjisihono 1987). Dua bagian utama dari lembaga adalah
embryonic axis (bakal embrio) dan scutellum. Scutellum merupakan jaringan
penyimpan yang kaya akan lemak, protein, enzim, dan mineral. Minyak pada Kariopsis
Lembaga Stylet
Endospermdalam
Radikula Plumula
Epiblastula Perikarp
Endosperm Testa Endospermluar
lembaga sorgum kaya akan asam lemak tak jenuh ganda dan mirip seperti
minyak jagung (FAO 1995).
Endosperm merupakan bagian terbesar dari biji serealia dengan
proporsi sekitar 81-84% dan terdiri atas lapisan luar endosperm (corneous
endosperm) dan lapisan dalam endosperm (floury endosperm) (Suprapto dan
Mudjisihono 1987). Corneous endosperm merupkan lapisan keras dan bening
seperti kaca, sedangkan floury endosperm merupakan lapisan yang lebih
lembut dan agak keruh. Proporsi corneous dan floury endosperm bervariasi
antar jenis sorgum. Secara umum, corneous endosperm paling banyak
terdapat pada lapisan luar, sedangkan floury endosperm banyak terdapat pada
pusat endosperm. Lapisan luar endosperm berupa sel-sel aleuron yang
mengandung protein dalam jumlah tinggi, sedangkan bagian dalam
endosperm mengandung sedikit protein. Sel-sel penyusun aleuron berukuran
kecil dan berbentuk kotak serta mengandung granula pati yang terselebung
oleh gumpalan protein matriks terutama glutelin (protein larut dalam alkali)
dan prolamin (protein larut dalam alkohol).
3. Komposisi Kimia Biji Sorgum
Komposisi kimia biji sorgum bervariasi tergantung bagian bijinya,
varietas, tanah, dan kondisi lingkungan penanaman. Adapun hasil analisis
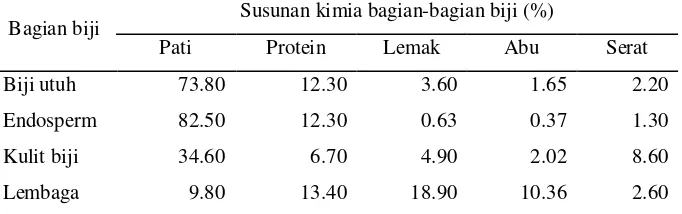
kimia terhadap bagian-bagian biji sorgum dapat dilihat pada Tabel 1.
Tabel 1. Hasil analisis kimia terhadap bagian-bagian biji sorgum
Bagian biji Susunan kimia bagian-bagian biji (%)
Pati Protein Lemak Abu Serat
Biji utuh 73.80 12.30 3.60 1.65 2.20
Endosperm 82.50 12.30 0.63 0.37 1.30
Kulit biji 34.60 6.70 4.90 2.02 8.60
Lembaga 9.80 13.40 18.90 10.36 2.60
Sumber: Suprapto dan Mudjisihono (1987)
Kandungan karbohidrat pada sorgum sebagian besar terdiri atas
dan Mudjisihono (1987), polisakarida pati merupakan bentuk karbohidrat
yang paling banyak terdapat dalam sorgum, khususnya pada bagian
endosperm. Berdasarkan kandungan amilosanya, biji sorgum dapat
digolongkan menjadi jenis beras (non waxy sorgum) dan jenis ketan (waxy
sorgum). Kadar amilosa jenis beras sekitar 25%, sedangkan untuk jenis ketan
sekitar 2%. Polisakarida non pati merupakan jenis karbohidrat yang tidak
dapat dicerna enzim-enzim pencernaan manusia.
Polisakarida non pati yang terkandung pada sorgum terdiri atas
selulosa, β-glucan, hemiselulosa, dan lignin. Menurut Rooney dan
Serna-Saldivar (1999), sorgum mengandung serat tidak larut (Insoluble Dietary
Fiber/IDF) dalam jumlah tinggi, sedangkan kandungan serat larut (Soluble
Dietary Fiber/SDF) dan β-glucan cukup rendah.
Kandungan lemak dalam biji sorgum utuh sekitar 3.6% dengan
kandungan lemak tertinggi pada bagian lembaga, yaitu sekitar 18.9%
(Suprapto dan Mudjisihono 1987). Menurut Chung dan Ohm (1999), lemak
pada biji sorgum terdiri dari dua jenis, yaitu lemak bebas (2.8-4.4%) dan
lemak dalam bentuk terikat (0.6-0.8%). Jenis asam lemak yang menyusunnya
terdiri atas asam palmitat (11-13%), asam oleat (30-45%), dan asam linoleat
(33-49%) Hulse et al. (1980) menyatakan bahwa hampir 80% kandungan
lemak pada sorgum terdiri atas asam lemak tidak jenuh dengan proporsi
paling besar, yaitu asam linoleat.
Kandungan protein sorgum cukup unggul jika dibandingkan dengan
beras maupun jagung. (FAO 1995). Menurut Lasztity (2000), seperti jenis
serealia lainnya, distribusi protein pada biji sorgum tidak merata. Hal ini
ditegaskan oleh Suprapto dan Mudjisihono (1987) yang menyatakan bahwa
jumlah protein yang terdapat dalam perikarp, lembaga, dan endosperm
berbeda-beda. Bagian-bagian biji tersebut juga memiliki jenis protein yang
berbeda. Lebih dari 80% total protein terdapat pada bagian endosperm biji,
terutama pada lapisan luar endosperm. Sebaliknya, bagian perikarp memiliki
kandungan protein yang paling rendah (Lazistity 2000). Menurut Suprapto
dan Mudjisihono (1987), protein yang terkandung dalam bagian lembaga
terkandung dalam endosperm (Suprapto dan Mudjisihono 1987). Kandungan
asam amino dalam lembaga meliputi lisin (4.1%), treonin (3.4%), metionin
(1.5%), dan sistin (1.0%), sedangkan kandungan asam amino dalam
endosperm meliputi lisin (1.1%), treonin (2.8%), metionin (1.0%), dan sistin
(0.8%).
Seperti serealia lainnya, protein pada biji sorgum dapat dicirikan
menjadi empat jenis, yaitu albumin (larut dalam air), globulin (larut dalam
garam), prolamin (larut dalam alkohol), dan glutelin (larut dalam alkali).
Protein albumin dan globulin paling banyak terdapat pada lapisan aleuron,
sedangkan protein prolamin dan glutelin banyak menyelubungi granula pati
yang terdapat dalam lapisan aleuron (Suprapto dan Mudjisihono 1987).
Menurut Lasztity (2000), jenis protein yang dominan pada sorgum, yaitu
kafirin (sekitar 32.6-58.8% dari total protein). Kafirin ini termasuk ke dalam
jenis protein prolamin. Selain itu, pada sorgum juga terdapat protein glutelin
(19.0-37.4%), albumin (1.3-7.7%), dan globulin (2.0-9.3%). Sorgum tidak
memiliki protein glutenin dan gliadin yang mampu membentuk gluten seperti
halnya terigu.
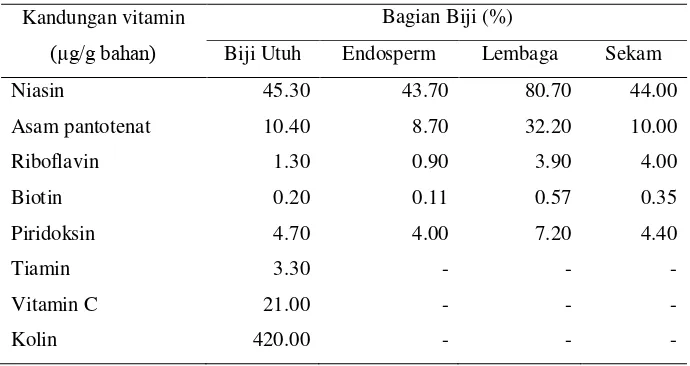
Menurut Suprapto dan Mudjisihono (1987), kandungan vitamin yang
terdapat pada biji sorgum utuh dan bagian biji lainnya berbeda-beda. Susunan
vitamin pada biji sorgum utuh dan bagian-bagiannya terdapat dalam Tabel 2.
Tabel 2. Kandungan vitamin pada biji sorgum utuh dan bagian-bagiannya
Kandungan vitamin
(µg/g bahan)
Bagian Biji (%)
Biji Utuh Endosperm Lembaga Sekam
Niasin 45.30 43.70 80.70 44.00
Asam pantotenat 10.40 8.70 32.20 10.00
Riboflavin 1.30 0.90 3.90 4.00
Biotin 0.20 0.11 0.57 0.35
Piridoksin 4.70 4.00 7.20 4.40
Tiamin 3.30 - - -
Vitamin C 21.00 - - -
Kolin 420.00 - - -
Bagian lembaga lebih kaya akan vitamin, bahkan jumlahnya dapat
mencapai 2-5 kali lebih banyak, jika dibandingkan dengan kandungan
vitamin dalam perikarp dan endosperm. Perikarp dan lembaga mengandung
riboflavin dalam jumlah yang hampir sama, demikian pula dengan kandungan
niasin, asam pantotenat, dan piridoksin dalam bagian perikarp dan endosperm
hampir sama pula. Apabila dibandingkan dengan biji jagung, biji sorgum
mengandung riboflavin dan piridoksin dalam jumlah yang sama, sedangkan
asam pantotenat, asam nikotinat, dan biotin pada biji sorgum memiliki jumlah
yang lebih tinggi. Kadar tiamin dan niasin dalam biji sorgum lebih baik
daripada terigu dan beras, namun kadar riboflavinnya lebih rendah.
Wall dan Blessin (1970) menyatakan kandungan mineral biji sorgum
dan bagian tanaman lainnya bergantung pada banyak faktor, antara lain
varietas, kondisi tanah, suhu, curah hujan, dan penggunaan pupuk. Jenis
mineral utama pada biji sorgum antara lain fosfor, magnesium, potasium, dan
silikon. Jenis mineral lainnya seperti kalsium dan natrium terdapat dalam
jumlah sedikit. Secara keseluruhan kandungan nutrisi sorgum tidak kalah jika
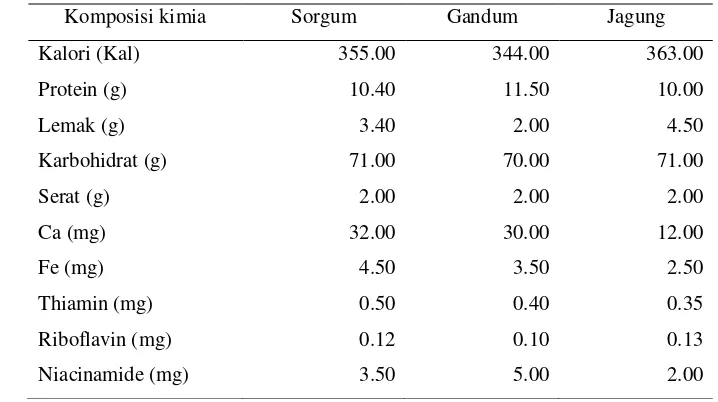
dibandingkan dengan serealia lainnya (gandum dan jagung). Komposisi kimis
sorgum, gandum, dan jagung dapat dilihat pada Tabel 3.
Tabel 3. Komposisi kimia sorgum, gandum, dan jagung dalam 100 gram bahan yang dapat dimakan
Komposisi kimia Sorgum Gandum Jagung
Kalori (Kal) 355.00 344.00 363.00
Protein (g) 10.40 11.50 10.00
Lemak (g) 3.40 2.00 4.50
Karbohidrat (g) 71.00 70.00 71.00
Serat (g) 2.00 2.00 2.00
Ca (mg) 32.00 30.00 12.00
Fe (mg) 4.50 3.50 2.50
Thiamin (mg) 0.50 0.40 0.35
Riboflavin (mg) 0.12 0.10 0.13
Niacinamide (mg) 3.50 5.00 2.00
B. MI INSTAN
1. Definisi Mi Instan
Menurut Hou dan Kruk (1998), produk mi pada mulanya berasal dari
daratan Cina. Saat ini mi cukup populer bukan hanya di Asia bagian timur,
tetapi juga di Indonesia. Mi dapat dikategorikan sebagai salah satu komoditi
pangan substitusi karena mi berfungsi sebagai bahan pangan utama yang
mengandung karbohidrat dalam jumlah tinggi (Indriani 2005). Menurut
Astawan (1999), produk mi dapat dikelompokkan menjadi mi mentah, mi
basah, mi kering, dan mi instan.
Mi instan merupakan salah satu jenis produk pasta atau ekstrusi.
Berdasarkan Standar Nasional Indonesia (SNI) nomor 01-3551-2000, mi
instan dibuat dari adonan tepung terigu atau tepung beras atau tepung lainnya
sebagai bahan utama dengan atau tanpa penambahan bahan lainnya, dan
dapat diberi perlakuan dengan bahan alkali (Badan Standarisasi Nasional,
2000). Syarat mutu mi instan menurut SNI dapat dilihat pada Tabel 4.
Menurut Astawan (1999), bahan dasar pembuatan mi instan adalah
terigu. Terigu memiliki keistimewaan dibandingkan tepung dari jenis serealia
lainnya karena dapat membentuk gluten pada saat terigu bercampur air. Sifat
elastik gluten pada adonan mi menyebabkan mi yang dihasilkan tidak mudah
putus pada proses pencetakan dan pemasakan. Berdasarkan kandungan
glutennya, terigu yang digunakan adalah jenis hard flour. Tepung ini
berkualitas paling baik dengan kandungan proteinnya sekitar 12-13%.
Air berfungsi sebagai media reaksi antara karbohidrat dengan gluten,
pelarut garam, dan pembentukan sifat kenyal gluten. Fungsi garam adalah
memberi rasa, memperkuat tekstur, mengikat air, meningkatkan elastisitas
dan fleksibilitas mi. Air abu berfungsi untuk mempercepat pembentukan
gluten dan meningkatkan sifat kenyal. Bahan pengembang digunakan untuk
mempercepat pengembangan adonan. CMC (Carboxyl Metil Cellulose)
umumnya ditambahkan dalam pembuatan mi sebagai bahan pengembang dan
bahan ini dapat mempengaruhi sifat adonan, memperbaiki ketahanan terhadap
air serta mempertahankan keempukan mi selama penyimpanan. Bahan-bahan
adalah pewarna kuning, seperti tartarzine yellow ataupun larutan brine.
Menurut Baik et al. (1994), larutan brine merupakan larutan dengan
komposisi 5.18% natrium klorida, 0.26% natrium karbonat, dan 0.26%
kalium karbonat. Fungsi dari zat warna adalah memberi warna khas mie
sedangkan bumbu-bumbu digunakan untuk memberi flavor tertentu.
Tabel 4. Syarat mutu mi instan (SNI 01-3551-2000)
No. Kriteria Uji Satuan Persyaratan
1. Keadaan 2)
Berlaku untuk keping mi dan bumbu
Berdasarkan proses pengeringan, dikenal dua macam mi instan.
Pengeringan dengan cara menggoreng menghasilkan mi instan goreng
(instant fried noodle), sedangkan pengeringan dengan udara panas disebut mi
instan kering (instant dried noodle). Mi instan goreng mampu menyerap
minyak hingga 20% selama penggorengan (dalam pembuatan mi) sehingga
mi instan goreng memiliki keunggulan rasa dibandingkan mi jenis lainnya.
Namun demikian, mi instan goreng disyaratkan agar pada saat perebusan
tidak ada minyak yang terlepas ke dalam air dan hasilnya mi harus cukup
kompak dan permukaannya tidak lengket (Astawan 1999).
2. Proses Pembuatan Mi SubstitusiSorgum Instan
Proses pembuatan mi substitusi sorgum instan memiliki kesamaan
dalam proses pembuatan mi instan yang umumnya terbuat dari terigu.
Adapun tahapan proses pembuatan mi substitusi sorgum instan terdiri atas
tahap persiapan bahan, pencampuran bahan (mixing), pembentukan lembaran
(sheeting) dan pembentukan untaian mi (slitting), pemotongan untaian mi
(cutting), pengukusan (steaming), penggorengan (frying), pendinginan
(cooling), dan pengemasan (packaging).
Tahap persiapan bahan meliputi penimbangan bahan sesuai formula
dan pembuatan larutan garam. Bahan-bahan yang telah ditimbang beserta
larutan garam dicampur menjadi satu. Pencampuran bahan bertujuan untuk
mendistribusikan bahan secara seragam dan membentuk adonan yang
kompak serta memiliki kadar air yang cukup. Pada tahap ini sangat sedikit
sekali terjadi pengembangan gluten. Pengembangan gluten baru terjadi pada
saat pembentukan lembaran. Pembentukan lembaran yang dimaksud adalah
tahap pembentukan lembaran tipis dengan ukuran yang disesuaikan
kebutuhan. Tahap pembentukan lembaran bertujuan membentuk struktur
gluten dengan arah yang sama secara merata sehingga lembar adonan
menjadi lembut dan elastis. Setelah terbentuk, lembaran adonan dipotong
atau disisir menjadi untaian mi. Pada tahap pembentukan untaian mi, tekstur
Mi yang dihasilkan dari tahap pembentukan untaian mi masih berupa
untaian panjang sehingga perlu dilakukan tahap pemotongan untuk
memperoleh mi dengan ukuran yang diinginkan. Pengukusan adalah salah
satu tahap pemasakan untaian mi. Tahap ini bertujuan memasak mi mentah
menjadi mi solid (Kim 1996). Tahap lanjutan setelah pengukusan, yaitu tahap
penggorengan. Penggorengan adalah proses pengeringan dengan
menggunakan minyak sebagai media. Menurut Syamsir (2008), proses
penggorengan mi instan dilakukan dengan menggunakan minyak goreng
bersuhu 140-160oC selama 1-2 menit sehingga mi menjadi kering dan padat
dengan kadar air sekitar 2-5%. Tahap berikutnya sebelum mi dikemas, yaitu
tahap pendinginan (cooling). Menurut Astawan (1999), proses pendinginan
akan menyebabkan pengerasan minyak yang terserap dan menempel pada mi
sehingga mi akan menjadi keras. Apabila proses pendinginannya tidak
sempurna, uap air yang tersisa akan mengembun dan menempel pada
permukaan sehingga memacu tumbuhnya jamur. Setelah didinginkan, mi
langsung dikemas biasanya dengan menggunakan plastik polipropilen.
C. ANTIOKSIDAN
1. Definisi Antioksidan
Antioksidan secara umum didefinisikan sebagai senyawa yang dapat
menunda, memperlambat dan mencegah proses oksidasi. Dalam arti khusus,
antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi
oksidasi radikal bebas. Antioksidan dinyatakan sebagai senyawa yang secara
nyata dapat memperlambat oksidasi, walaupun dengan konsentrasi yang lebih
rendah dibanding substrat yang dapat dioksidasi. Selain berbentuk zat gizi,
seperti vitamin C, E dan β-karoten, antioksidan dapat pula berupa zat non
gizi, seperti pigmen (karoten, likopen, flavonoid, klorofil) dan enzim
(glutation peroksida, koenzim, Q-10 atau ubiquinon) (Pokorny et al. 2008).
Menurut Madhavi et al. (1996), antioksidan dapat dikategorikan
menjadi 2 kelompok, yaitu antioksidan sintetik dan antioksidan alami.
Antioksidan sintetik merupakan antioksidan yang diperoleh dari hasil sintesis
antioksidan hasil ekstraksi bahan alami. Antioksidan alami di dalam makanan
dapat berasal dari senyawa antioksidan yang sudah ada dari satu atau dua
komponen makanan, terbentuk dari reaksi-reaksi selama proses pengolahan,
maupun diisolasi dari sumber alami dan ditambahkan ke makanan sebagai
bahan tambahan pangan (Madhavi et al. 1996).
Senyawa antioksidan alami yang berasal dari tumbuhan umumnya
adalah senyawa fenolik atau polifenolik yang dapat berupa golongan
flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam-asam organik
polifungsional. Menurut Pokorny et al. (2008), golongan flavonoid yang
memiliki aktivitas antioksidan meliputi flavon, flavanol, isoflavon, katekin
dan flavonol. Sementara turunan asam sinamat meliputi asam kafeat, asam
fenolat, asam klorogenat dan lain-lain. Senyawa antioksidan alami polifenolik
ini bersifat multifungsional dan dapat bereaksi sebagai pereduksi, penangkap
radikal, pengkelat logam dan peredam terbentuknya singlet oksidan. Sekitar
2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah menjadi
flavonoid atau senyawa yang berkaitan erat dengannya, sehingga flavonoid
merupakan salah satu golongan fenol yang terbesar. Lebih lanjut disebutkan
bahwa sebenarnya flavonoid terdapat dalam semua jenis tumbuhan, sehingga
pastilah flavonoid ditemukan pula pada setiap ekstrak tumbuhan. Kebanyakan
golongan flavonoid dan senyawa yang berkaitan erat dengannya memiliki
sifat-sifat antioksidan.
2. Mekanisme Reaksi Antioksidan
Menurut Gordon (1990), proses oksidasi yang disebabkan oleh radikal
bebas terdiri dari tiga tahap utama, yaitu inisiasi, propagasi dan terminasi.
Reaksi yang terjadi adalah sebagai berikut ;
Inisiasi : RH → R• + H• (1)
Propagasi : R• + O2→ ROO• (2)
: ROO• + RH → ROOH + R• (3)
Terminasi : ROO• + ROO• (4)
R• + ROO•
Pada tahap inisiasi terjadi pembentukan senyawa radikal yang bersifat
tidak stabil dan sangat reaktif akibat dari hilangnya satu atom hidrogen (1).
Pada tahap propagasi, radikal asam lemak akan bereaksi dengan oksigen
membentuk radikal peroksi (2). Radikal peroksi akan menyerang asam lemak
menghasilkan hidroperoksida dan radikal asam lemak baru (3). Tanpa adanya
antioksidan, reaksi oksidasi lemak akan mengalami terminasi dengan
membentuk kompleks radikal bebas (4). Hidroperoksida yang terbentuk
bersifat tidak stabil kemudian terdegradasi lebih lanjut menghasilkan
senyawa-senyawa karbonil rantai pendek seperti aldehida, keton dan alkohol.
Tang (1991) menyatakan bahwa senyawa fenolik dapat mencegah
terjadinya autooksidasi yang disebabkan radikal bebas karena termasuk
golongan antioksidan. Peranan senyawa fenolik sebagai antioksidan berkaitan
dengan peranannya sebagai donor atom hidrogen pada senyawa radikal.
Penambahan antioksidan (AH) dengan konsentrasi rendah dapat menghambat
atau mencegah reaksi autooksidasi lemak dan minyak. Penambahan tersebut
dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi (4
dan 5). Radikal-radikal antioksidan (A•) yang terbentuk pada reaksi tersebut
relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan
molekul lipida lain membentuk radikal lipida baru (Gordon 1990).
Inisiasi : R• + AH → RH + A• (4)
Propagasi : ROO• + AH → ROOH + A• (5)
Gordon (1990) menyatakan besarnya konsentrasi antioksidan yang
ditambahkan dapat berpengaruh pada laju oksidasi. Pada konsentrasi tinggi,
aktivitas antioksidan grup fenolik sering lenyap bahkan antioksidan tersebut
menjadi prooksidan. Pengaruh jumlah konsentrasi pada laju oksidasi
tergantung pada struktur antioksidan, kondisi dan sampel yang akan diuji.
Salah satu metode yang banyak digunakan untuk menentukan
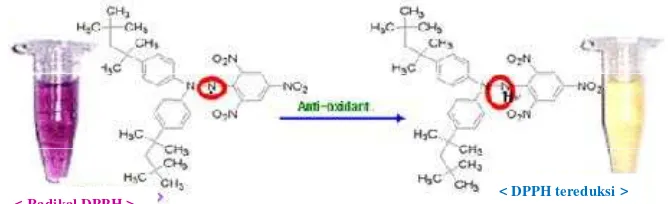
kapasitas antioksidan suatu bahan adalah metode DPPH. DPPH (
2,2-dyphenyl-1-picrylhydrazil atau 1.1-diphenyl-2-picrylhydrazil) merupakan
senyawa radikal bebas berwarna ungu tua yang stabil dalam larutan metanol.
Reaksi reduksi terhadap warna dari senyawa DPPH dapat dilihat pada
Gambar 3. Reaksi reduksi terhadap warna dari senyawa DPPH (Vaya dan Aviram 2001)
Mekanisme reaksi yang terjadi adalah proses reduksi senyawa DPPH
oleh antioksidan yang menghasilkan pengurangan intensitas warna dari
larutan DPPH. Pemudaran warna akan mengakibatkan penurunan nilai
absorbansi sinar tampak dari spektrofotometer. Reaksi yang terjadi adalah
pembentukan α,α-diphenyl-β-picrylhydrazine, melalui kemampuan
antioksidan dalam menyumbang hidrogen. Semakin pudarnya warna DPPH
setelah direaksikan dengan antioksidan menunjukkan kapasitas antioksidan
yang semakin besar pula (Benabadji et al. 2004).
3. Komponen Bioaktif Sorgum
Menurut Awika dan Rooney (2004), sorgum mengandung berbagai
senyawa bioaktif, beberapa diantaranya adalah komponen fenolik, fitosterol,
dan polisakanol. Fenol membantu dalam pertahanan alami tanaman melawan
hama dan penyakit, sedangkan fitosterol dan polisakanol merupakan
komponen penting dari lilin dan minyak tanaman. Singh et al. (2003)
menyatakan bahwa jumlah fitosterol sekitar 0.5 mg/g biji sorgum sedangkan
polisakanol sekitar 38-92 mg/100g biji sorgum. Senyawa fenolik pada
sorgum memiliki aktivitas antioksidan, sifat menurunkan kolestrol dan
kegunaan lain untuk kesehatan. Fenol dalam sorgum dibagi menjadi dua
kategori yaitu asam fenolat dan flavonoid. Asam fenolat merupakan turunan
asam sinamat dan benzoat, sedangkan flavonoid meliputi tanin dan antosianin
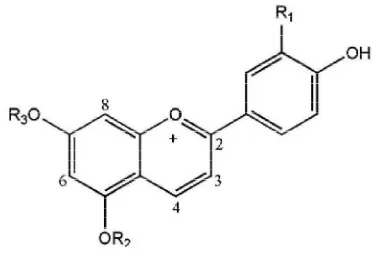
Rooney 2004). Struktur asam fenolik dari sorgum dapat dilihat pada Gambar 4.
Gambar 4.Struktur asam fenolik pada sorgum yaitu asam benzoat dan asam sinamat (Awika dan Rooney 2004)
Antosianin merupakan salah satu kelas utama dari flavonoid yang
paling banyak dipelajari dari sorgum (Awika dan Rooney 2004). Awika et al
(2003) melaporkan bahwa antosianin dari sorgum tidak seperti antosianin
pada umumnya. Antosianin pada sorgum dinilai unik karena strukturnya tidak
memiliki gugus hidroksil pada cincin karbon (C) nomor 3 sehingga
dinamakan 3-deoksiantosianidin. Keunikan tersebut menyebabkan antosianin
pada sorgum lebih stabil pada pH tinggi dibanding antosianin yang diisolasi
dari buah-buahan atau sayur-sayuran pada umumnya sehingga berpotensi
untuk digunakan sebagai pewarna alami makanan. Antosianin pada sorgum
belum diteliti lebih jauh karena hingga kini data kuantitatif mengenai
antosianin pada sorgum dan kemampuan antioksidannya belum
dipublikasikan sehingga peranannya bagi kesehatan belum dapat diketahui
pasti. Antosianin pada sorgum yang telah diidentifikasi adalah apigenidin dan
luteolinidin (Wu dan Prior 2005). Struktur apigenidin dan luteolinidin dapat
dilihat pada Gambar 5.
Komponen flavonoid selain antosianin pada sorgum yaitu senyawa
Asam galat (11): R1=H, R2=R3=R4=OH
Asam gent isat (12): R1=R4= OH, R2=R3=H
Asam salisilat (13): R1=OH, R2=R3=R4=H
Asam p-hidroksibenzoat (14): R1=R2=R4=H, R3=OH Siringat (15): R1=H, R2=R4=OCH3, R3=OH
Prot okat ekik (16): R1=R4=H, R2=R3=OH
Asam kaf eat (17): R1=R4=H, R2=R3=OH
Asam ferulat (18): R1=R4=H, R2=OCH3, R3=OH
Asam 0-kum arat (19): R1=OH, R2=R3=R4=H Asam p-kum arat (20): R1=R2=R4=H, R3=OH Sinapat (21): R1=H, R2=R4=OCH3, R3=OH
Asam Benzoat (11-16)
senyawa fenolik yang larut dalam air dengan berat molekul antara 500-3000.
Kadar tanin dalam biji sorgum berkisar antara 0.4-3.6% yang sebagian besar
terdapat dalam lapisan testa (Suprapto dan Mudjisihono 1987).
R1 = H, R2 = H, R3 = H: apigenidin
R1 = OH, R2 = H, R3 = H: lut eolinidin
Gambar 5. Struktur antosianin pada sorgum yaitu apigenidin dan luteolinidin (Awika dan Rooney 2004)
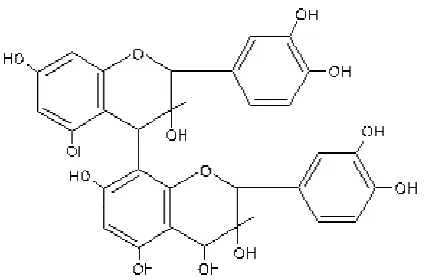
Menurut Waniska et al. (1989), senyawa tanin pada sorgum memiliki
berbagai peranan, antara lain untuk melindungi biji dari predator burung,
serangga, dan kapang (Fusarium tapsinum dan Aspergillus flavus). Tanin dari
sorgum menunjukkan aktivitas antioksidan yang sangat tinggi secara in vitro
(Riedl dan Hagerman 2001). Menurut Hagerman (1998), tanin dengan berat
molekul tinggi memiliki aktivitas antioksidan terbaik dibandingkan
antioksidan alami lainnya. Hal tersebut berhubungan dengan banyaknya
jumlah cincin aromatik dan gugus hidroksil yang dimiliki oleh tanin, dimana
semakin banyak jumlah cincin aromatik dan gugus hidroksil, maka tanin akan
semakin tinggi aktivitas antioksidannya. Selain itu, penelitian dari Hagerman
(1998) juga melaporkan bahwa tanin tidak dapat berperan sebagai prooksidan
sehingga dinilai merupakan salah satu antioksidan yang potensial. Struktur
tanin pada sorgum dapat dilihat pada Gambar 6.
Sorgum memiliki berbagai efek positif bagi kesehatan yang berkaitan
erat dengan berbagai komponen bioaktif terutama senyawa fenolik yang
dimilikinya (Awika dan Rooney 2004). Peranan sorgum dalam mencegah
penyakit kardiovaskular (cardiovascular disease/CVD) dilaporkan oleh Cho
et al. (2000) yang menyatakan bahwa ekstrak heksan sorgum dapat
reduktase pada sel hati tikus. Penelitian dari Lee dan Pan (2003) juga
melaporkan bahwa senyawa tanin sorgum dapat menghambat 63-97%
oksidasi asam linoleat pada hemoglobin dibandingkan kedelai (13%) dan
dedak padi (78%). Kemampuan sorgum dalam menurunkan kadar kolestrol
darah juga dilaporkan oleh Rooney et al. (1992) yang menyatakan bahwa
dedak sorgum memiliki kemampuan menurunkan kadar kolestrol darah lebih
baik dibanding gandum dan jagung.
Gambar 6. Struktur proantosianidin atau tanin pada sorgum (Rooney dan Serna 2000)
Manfaat kesehatan sorgum lainnya adalah peranannya dalam
membantu ketersediaan pangan bagi penderita diabetes militus dan obesitas
yang dibuktikan oleh penelitian Awika dan Rooney (2004), yang menyatakan
bahwa senyawa tanin pada sorgum menyebabkan sorgum dicerna lebih
lambat dibandingkan jenis serealia lainnya. Pernyataan tersebut dipertegas
oleh Suarni (2004)yang menyatakan bahwa komponen protein dan pati pada
sorgum lebih lambat dicerna daripada serealia lain sehingga komoditi ini
dinilai potensial untuk diaplikasikan pada makanan penderita diabetes dan
obesitas. Menurut Muriu et al. (2002), mekanisme yang terjadi disebabkan
senyawa tanin yang terdapat pada sorgum akan menurunkan nilai nutrisi dari
makanan yang dikonsumsi dengan cara berikatan dengan protein (Hagerman
dan Butler 1981) dan karbohidrat (Lizardo et al. 1995) membentuk suatu
komplek yang sulit didegradasi oleh enzim-enzim pencernaan. Mekanisme
seperti sukrase, amylase, tripsin, kimotripsin dan lipase (Lizardo et al., 1995;
Al-Mamary et al., 2001).
Aktivitas anti mutagenik sorgum dibuktikan oleh penelitian Grimmer
et al. (1992) yang menunjukkan bahwa senyawa tanin pada sorgum memiliki
aktivitas anti mutagenik lebih tinggi dibanding senyawa tanin dengan berat
molekul lebih rendah. Sebuah studi yang dilakukan oleh Turner (2006)
melaporkan bahwa tanin dari dedak sorgum dapat mereduksi kanker kolon
pada tikus percobaan, dimana studi dilakukan dengan cara pemberian diet
berupa dedak sorgum hitam, selulosa dan sorgum putih. Aktivitas anti kanker
kolon terbaik ada pada dedak sorgum hitam dimana hasil yang didapat,
diduga berkorelasi dengan adanya aktivitas antioksidan dari sorgum.
Mekanisme anti kanker kolon dari sorgum memiliki hubungan erat dengan
senyawa tanin pada sorgum. Mekanisme tersebut mengacu pada penelitian
yang telah dilakukan oleh Rios (2002) yang melaporkan bahwa senyawa
tanin tidak terdegradasi setelah melewati saluran pencernaan pada manusia.
Menurut Rios (2002), tanin baru akan terdegradasi oleh mikroflora yang
terdapat di kolon menjadi asam fenolik yang dapat berperan sebagai
antioksidan dalam sistem pencernaan di kolon.
Van Rensburg (1981) menyatakan bahwa konsumsi sorgum secara
konstan akan berkorelasi dengan penurunan insiden kanker esofagus
dibandingkan dengan konsumsi gandum maupun jagung yang justru dapat
meningkatkan insiden kanker esofagus. Berdasarkan bukti yang terkait,
sorgum diduga kuat mampu menyumbangkan komponen nutrisi yang dapat
menghambat terjadinya kanker esofagus. Pernyataan ini dipertegas dengan
penelitian Chen et al. (1993), berdasarkan data epidemiologi dari studi yang
dilakukan terhadap 21 komunitas di Cina yang telah mengonsumsi sorgum
selama lebih dari 6 tahun, tingkat kematian yang disebabkan oleh kanker
esofagus menurun 1.4-3.2 kali dibandingkan ketika masih mengonsumsi
III. METODOLOGI PENELITIAN
A. ALAT DAN BAHAN
Alat yang digunakan meliputi mesin penyosoh, mesin penepung cakram
(pin disc mill), pengayak bergetar (vibrating screen), mesin pembuat mi (noodle
machine), pengukus (steamer), oven, neraca, desikator, wadah plastik, peralatan
masak, mesin penggoreng (deep fat fryer) dengan kapasitas minyak goreng
sebanyak 6 liter, alat analisis tekstur (texture analyzer), peralatan gelas untuk
analisis kimia, sentrifuse, penangas, alat pengocok (shaker), dan
spektrofotometer.
Bahan-bahan yang digunakan dalam pembuatan mi terdiri atas tepung
sorgum, terigu Cakra Kembar, air, garam, baking powder, dan CMC.
Bahan-bahan yang digunakan untuk analisis proksimat dan serat kasar, analisis fisik,
pengujian total fenol, dan analisis anti radikal bebas DPPH, diantaranya air,
kertas saring, heksana teknis, HCl, K2SO4, HgO, larutan tris, H2SO4,
Na2S2O3.5H2O, NaOH, H2BO3, larutan indikator, etanol 95%, air akuades, asam
metafosfat, natrium asetat, asam asetat glasial, buffer asetat, etanol PA, metanol
PA, asam askorbat, DPPH, reagen Folin-Ciocalteu, dan asam galat.
B. TAHAPAN PENELITIAN
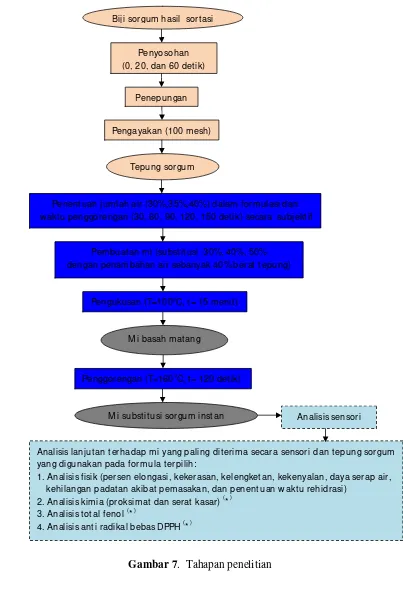
Tahapan penelitian dapat dilihat pada Gambar 7, dengan pewarnaan yang berbeda untuk setiap tahapan. Penelitian yang dilakukan terdiri dari 3 tahap,
diantaranya tahap pembuatan tepung sorgum yang ditandai dengan warna merah,
tahap pembuatan mi substitusi sorgum instan yang ditandai dengan warna
kuning, dan tahap analisis mi substitusi sorgum instan terpilih beserta tepung
sorgum yang digunakan pada formula terpilih ditandai dengan warna biru.
1. Pembuatan Tepung Sorgum
Tahap awal dalam penelitian ini adalah penyosohan biji sorgum yang
bertujuan untuk mengupas sebagian kulit biji sorgum. Penyosohan dilakukan
Gambar 7. Tahapan penelitian
Biji sorgum hasil sort asi
Penyosohan (0, 20, dan 60 det ik)
Penepungan
Pengayakan (100 mesh)
Pembuat an mi (subst it usi 30%, 40%, 50% dengan penam bahan air sebanyak 40% berat t epung)
Tepung sorgum
Penggorengan (T=160oC, t = 120 det ik) M i basah mat ang
M i subst it usi sorgum inst an Analisis sensori
Analisis lanjut an t erhadap mi yang paling dit erima secara sensori dan t epung sorgum yang digunakan pada formula t erpilih:
1. Analisis fisik (persen elongasi, kekerasan, kelengket an, kekenyalan, daya serap air, kehilangan padat an akibat pemasakan, dan penent uan w akt u rehidrasi)
2. Analisis kimia (proksimat dan serat kasar) (*) 3. Analisis t ot al fenol (*)
4. Analisis ant i radikal bebas DPPH (*)
Penent uan jumlah air (30%,35%,40%) dalam formulasi dan w akt u penggorengan (30, 60, 90, 120, 150 det ik) secara subjekt if
Pengukusan (T=100oC, t = 15 m enit )
(
Penentuan waktu sosoh dilakukan berdasarkan penelitian terdahulu
mengenai pengaruh waktu sosoh terhadap aktivitas antioksidan serealia non
beras (Yanuwar 2009). Setelah melalui tahap penyosohan, biji sorgum digiling
dengan menggunakan mesin penepung cakram sehingga dapat dihasilkan
tepung sorgum. Agar memperoleh tepung sorgum yang halus, tepung sorgum
yang telah digiling kemudian disaring dengan pengayakbergetar berskala 100
mesh. Tahap pembuatan tepung sorgum dengan waktu sosoh biji sorgum
selama 0 detik serta 20 dan 60 detik dapat dilihat pada Gambar 8 dan Gambar 9. Perbedaan dalam proses pembuatan tepung sorgum dengan waktu sosoh 0 detik dengan proses pembuatan tepung sorgum dengan waktu sosoh 20 dan 60
detik terletak pada perlakuan perendaman dan penirisan serta pengeringan biji
sorgum yang tidak mengalami penyosohan (waktu sosoh 0 detik). Ilustrasi
mesin penepung cakram dan pengayak bergetar dapat dilihat pada Gambar 10.
Perendaman dalam air
Gambar 8. Tahap pembuatan tepung biji sorgum dengan waktu sosoh 0 detik
(a) (b)
Gambar 10. Mesin penepung cakram (a) dan Pengayak bergetar (b)
2. Pembuatan Mi Substitusi Sorgum Instan
Langkah awal dalam tahap pembuatan mi substitusi sorgum instan,
yaitu penentuan jumlah air dan waktu penggorengan. Setelah diperoleh jumlah
air dan waktu penggorengan yang optimum maka dilakukan produksi mi
dengan metode pembentukan lembaran dan untaian mi sesuai formulasi.
a. Penentuan Jumlah Air dan Waktu Penggorengan
Melalui uji coba yang dilakukan, jumlah air yang ditambahkan ke
dalam formula, yaitu 30%, 35%, dan 40% dari bahan campuran tepung.
Pengamatan dilakukan terhadap karakter adonan pada saat pembentukan
lembaran. Parameter proses yang juga berpengaruh terhadap produk mi
sorgum substitusi instan adalah waktu penggorengan sehingga perlu
dilakukan uji coba penggorengan pada suhu 160oC dengan waktu yang
berbeda. Waktu penggorengen yang diujicobakan, diantaranya 30, 60, 90,
120, dan 150 detik (s), sehingga akan diperoleh waktu penggorengan yang
tepat untuk menghasilkan produk mi substitusi sorgum instan yang baik
berdasarkan pengujian visual secara subjektif dan waktu rehidrasi yang
dibutuhkan mi substitusi sorgum instan untuk menjadi mi yang siap
dikonsumsi. Waktu penggorengan yang tepat selanjutnya akan diberlakukan
b. Formulasi Mi Substitusi Sorgum Instan
Prinsip dan bahan penunjang pembuatan mi substitusi sorgum instan
pada dasarnya sama dengan prinsip dan bahan penunjang dalam proses
pembuatan mi instan berbasis terigu. Formula mi substitusi sorgum instan
yang akan diproduksi dapat dilihat pada Tabel 5.
Tabel 5. Formulasi mi substitusi sorgum instan
Komposisi Waktu sosoh 0 s Waktu sosoh 20 s Waktu sosoh 60 s F 1 F 2 F 3 F 4 F 5 F 6 F 7 F 8 F9
Tepung sorgum 30% 40% 50% 30% 40% 50% 30% 40% 50%
Terigu 70% 60% 50% 70% 60% 50% 70% 60% 50%
Air 40% 40% 40% 40% 40% 40% 40% 40% 40%
CMC 1% 1% 1% 1% 1% 1% 1% 1% 1%
Garam 1% 1% 1% 1% 1% 1% 1% 1% 1%
Baking powder 0.3% 0.3% 0.3% 0.3% 0.3% 0.3% 0.3% 0.3% 0.3%
Proses pembuatan mi substitusi sorgum instan mengacu pada proses
pembuatan mi instan terigu pada umumnya meliputi pencampuran,
pembentukan adonan dan lembaran, pencetakan mi dan pemotongan,
pengukusan, penggorengan dan pendinginan. Ilustrasi mesin pembuat mi
dapat dilihat pada Gambar 11.
Bahan kering berupa tepung sorgum, terigu, CMC, dan baking powder
dicampur, kemudian ditambahkan dengan larutan garam hingga homogen.
Selanjutnya dilakukan proses pembentukan lembaran pada adonan dengan
cara melewatkan adonan pada dua gilingan pengepres dimulai dari jarak yang
lebar hingga jarak antara keduanya semakin menyempit, yaitu sekitar 1.4
mm. Pembentukan lembaran dilakukan berulang sampai dihasilkan lembaran
mi yang elastis dengan ketebalan yang sesuai. Lembaran mi selanjutnya
disisir menjadi untaian mi, lalu dibentuk bergelombang, diletakkan pada
wadah untuk pengukusan, dan dipotong sesuai ukuran yang dikehendaki.
Mi basah lalu dikukus pada suhu sekitar 100⁰C, selama 15 menit.
Setelah dilakukan pengukusan, selanjutnya dilakukan proses penggorengan
menggunakan mesin penggoreng dengan kapasitas minyak goreng yang
digunakan sebanyak 6 liter dan pengaturan suhu sebesar 160oC serta variasi
waktu penggorengan selama 30, 60, 90, 120, dan 150 detik. Proses
pembuatan mi subst it usi sorgum instan dapat dilihat pada Gambar 12.
Gambar 12. Proses pembuatan mi substitusi sorgum instan Larutan garam
Penggorengan (T= 160oC, t= 120
Pembuatan lembaran dan untaian mi (ketebalan 1.4 mm)
Pemotongan untaian mi
Pendingina
Mi sorgum Proses pencampuran Tepung sorgum, terigu,
CMC, bakingpowder
Tahap setelah penggorengan, yaitu pendinginan yang disertai
penirisan minyak pada mi setelah penggorengan. Pendinginan dilakukan
dengan cara mengeringanginkan mi sebelum dikemas. Tujuannya untuk
mencegah terjadinya pengembunan uap panas akibat penggorengan. Tahap
terakhir yang dilakukan adalah pengemasan mi yang umumnya menggunakan
plastik polipropilen (Astawan 1999).
3. Analisis Mi Substitusi Sorgum Instan dan Tepung Sorgum
Tahap analisis yang pertama kali dilakukan adalah analisis sensori
terhadap mi substitusi sorgum instan dari keseluruhan formula yang diujikan
sehingga diperoleh satu formula terpilih. Setelah mendapatkan satu formula
terpilih dilakukan tahap analisis lainnya. Analisis yang dilakukan, meliputi
analisis fisik, analisis kimia, analisis total fenol, dan analisis anti radikal bebas
DPPH. Selain melakukan analisis terhadap mi substitusi sorgum instan dari
formula terpilih, analisis terhadap tepung sorgum yang digunakan pun
dilakukan. Analisis yang dilakukan terhadap tepung sorgum tersebut,
diantaranya analisis kimia, analisis total fenol, dan analisis anti radikal bebas
DPPH.
C. METODE ANALISIS
1. Analisis Sensori (Waysima dan Adawiyah 2008)
Analisis sensori merupakan analisis yang menggunakan indera manusia
sebagai instrumennya. Analisis sensori yang dilakukan adalah uji afektif berupa
rating hedonik, yang menyangkut penerimaan terhadap sifat atau kualitas
sampel yang diujikan dan melibatkan panelis tidak terlatih sebanyak 30 orang.
Panelis diminta mengungkapkan tanggapan pribadinya dengan nilai
skala terhadap rasa, elastisitas, dan kelengketan dari setiap sampel pada uji
rating hedonik. Data yang diperoleh akan ditabulasi dan dianalisis dengan
analisis ragam (ANOVA) yang dapat dilanjutkan dengan uji Duncan. Parameter
yang diujikan pada uji rating hedonik terdiri dari tiga atribut sensori, yaitu rasa,