DETEKSI DAN IDENTIFIKASI
Erwinia chrysanthemi
YANG BERASOSIASI DENGAN PENYAKIT BUSUK LUNAK
PADA TANAMAN KENTANG DI JAWA
HAERANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi dan Identifikasi Erwinia chrysanthemi yang Berasosiasi dengan Penyakit Busuk Lunak pada Tanaman Kentang di Jawaadalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
HAERANI. Deteksi dan Identifikasi Erwinia chrysanthemi yang Berasosiasi dengan Penyakit Busuk Lunak pada Tanaman Kentang di Jawa. Dibimbing oleh ABDJAD ASIH NAWANGSIH dan TRI ASMIRA DAMAYANTI.
Kentang (Solanum tuberosum L.) merupakan komoditas hortikultura yang banyak dikonsumsi masyarakat. Kebutuhan kentang yang cukup tinggi belum dapat dipenuhi pasar dalam negeri sehingga Indonesia masih mengimpor kentang baik untuk konsumsi maupun benih. Dalam proses importasi ada kemungkinan terbawanya patogen dari negara lain. Salah satu patogen penting pada tanaman kentang adalah Erwinia chrysanthemi (direklasifikasi sebagai Dickeya spp.) yang menyebabkan gejala busuk lunak dan layu. Sampai saat ini Badan Karantina
Pertanian (Barantan) masih melakukan pemutakhiran data wilayah sebar E. chrysanthemi di Indonesia.
Sebanyak 400 sampel tanaman kentang yang menunjukkan gejala layu serta busuk lunak diambil dari Jawa Barat (Pangalengan dan Garut), Jawa Tengah (Dieng), dan Jawa Timur (Batu-Malang). Insidensi E. chrysanthemi ditentukan berdasarkan uji serologi dengan indirect enzyme-linked immunosorbent assay (I-ELISA) menggunakan antiserum E. chrysanthemi. Sampel yang menunjukkan hasil positif pada pengujian ELISA kemudian diisolasi menggunakan media casamino acid peptone glucose (CPG). Beberapa sifat fisiologi yang diuji yaitu Gram, oksidase, katalase, oksidasi-fermentasi, dan kemampuan menyebabkan busuk pada umbi kentang. Isolat bakteri yang memiliki ciri fisiologi mirip dengan E. chrysanthemi kemudian diidentifikasi menggunakan GEN III OmniLog® ID System (Biolog, Hayward, CA, USA) yang dikonfirmasi melalui deteksi asam nukleat polymerase chain reaction (PCR) menggunakan primer spesifik E.chrysanthemi, 16S rRNA dan perunutan DNA.
Pantoea agglomerans, dan Pseudomonas viridiflava dengan homologi yang tinggi
terhadap isolat yang telah dideposit di Genbank, kecuali homologi P. agglomerans (80.5-83.8%). E. chrysanthemi tidak ditemukan di semua wilayah
pengambilan sampel.
SUMMARY
HAERANI. Detection and Identification of Erwinia chrysanthemi Associated with Soft Rot Disease on Potato in Java. Supervised by ABDJAD ASIH NAWANGSIH and TRI ASMIRA DAMAYANTI.
Potato (Solanum tuberosum L.) is an important horticulture commodity. Demand of potato in Indonesia is quite high and domestic market can not comply, thus Indonesia is still importing potatoes for consumption and seed, although there is possibility of pathogen carried by the process of importation. One of the emerging pathogens on potato plants is Erwinia chrysanthemi (reclassified as Dickeya spp.). This bacteria causing soft rot and wilting symptoms. Until now the Agricultural Quarantine Agency of Indonesia (AQAI) is still updating data and information related to E. chrysanthemi distribution on potato plant in Java.
A total of 400 samples of potato plants with of wilting and soft rot symptoms was obtained from West Java (Pangalengan and Garut), Central Java (Dieng) and East Java (Batu-Malang). The incidence of E. chrysanthemi tested serologically by indirect enzyme-linked immunosorbent assay (I-ELISA) using antisera E. chrysanthemi. Samples which showed positive results on ELISA were isolated using casamino acid-peptone-glucose medium (CPG). Ten samples showed positive result. Further, bacteria were isolated, purified, and subjected to several tests such as physiology (Gram, oxidase, catalase, and oxidation-fermentation test), the carbon source utilization test using GEN III OmniLog® ID System, PCR and sequencing of the 16S rRNA sequence.
Among 400 samples, there were 105 samples showed positive result for E. chrysanthemi consists of 3 samples (3%), 1 sample (1%), 3 samples (3%), and 98 samples (98%) from Pangalengan, Garut, Malang, and Dieng, respectively. All positive samples of E. chrysanthemi was isolated except for samples from Malang and Dieng. There was only 2 out of 3 samples from Malang were able to be isolated. Furthermore, only 4 samples with ELISA highest absorbancy value isolated from Dieng. Therefore only 10 samples isolated from total 400 samples and 37 bacterial isolates was obtained. A total of 18 isolates showed local lesions reaction on tobacco plants.
Based on physiological characters, there were 4 isolates similar to the genus Erwinia i.e. 49P -5, 71G-1, 71G-6, and 14M-6. By the carbon source utilization tests using GEN III OmniLog ID System, 4 bacterial isolates was identified as Flavimonas oryzihabitans, Pantoea dispersa, Pantoea agglomerans, and Pseudomonas syringae pv. primulae. However, PCR using specific primer and nucleotide sequences analysis of the 16S rRNA indicated that those isolates are not E. chrysanthemi. Those 4 isolates identified as Pseudomonas oryzihabitans, Pantoea agglomerans, and Pseudomonas viridiflava with highest homology to corresponding isolates deposited in Genbank, except homology of P. agglomerans (80.5-83.8%). E. chrysanthemi was not found in the potato sampling area in Java.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Fitopatologi
DETEKSI DAN IDENTIFIKASI
Erwinia chrysanthemi
YANG BERASOSIASI DENGAN PENYAKIT BUSUK LUNAK
PADA TANAMAN KENTANG DI JAWA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema penelitian yang dilaksanakan sejak bulan Juli 2014 sampai dengan Januari 2015 ini ialah Deteksi dan Identifikasi Erwinia chrysanthemi yang Berasosiasi dengan Penyakit Busuk Lunak pada Tanaman Kentang di Jawa.
Terima kasih penulis ucapkan kepada Dr Ir Abdjad Asih Nawangsih, MSi dan Dr Ir Tri Asmira Damayanti, MAgr selaku pembimbing yang telah banyak memberi saran dan masukan selama penelitian dan penulisan tesis. Penulis juga menyampaikan penghargaan kepada Prof Dr Ir Sri Hendrastuti Hidayat, MSc selaku ketua Program Studi Fitopatologi, Dr Ir Pudjianto, MSi selaku ketua Program Studi Entomologi, dan Prof Dr Ir Supriadi, MSc selaku dosen penguji tamu yang telah memberikan saran dan masukan, serta staf pengajar Departemen Proteksi Tanaman IPB yang telah memberikan ilmu selama penulis mengikuti pendidikan sehingga dapat dijadikan bekal penulisan karya ilmiah ini. Ucapan terima kasih juga disampaikan kepada semua pihak yang telah memberikan rekomendasi hingga penulis dapat melanjutkan studi S2 di IPB yaitu: Prof Dr Ir Sri Hendrastuti Hidayat, MSc, Dr Ir Purnama Hidayat, MSc, Dr Ir Kikin Hamzah Mutaqin, MSi, Dr Antarjo Dikin, MSc, dan Dr Ir Agus Sunanto, MP. Penulis juga mengucapkan terima kasih kepada Dr Ir Giyanto, MSi dan Refa Firgianto, SP yang telah berkenan memberikan isolat kontrol positif. Ucapan terimakasih juga disampaikan kepada Badan Karantina Pertanian sebagai penyandang dana beasiswa Program Khusus Karantina pada Sekolah Pascasarjana IPB, Ir Purwo Widiarto, MMA selaku Kepala Balai Besar Karantina Pertanian Tanjung Priok dan Iyar, SP selaku Kepala Wilayah Kerja Kantor Pos Bogor atas bantuan sarana dalam kegiatan penelitian ini. Selain itu, penulis juga menyampaikan rasa terima kasih kepada rekan kerja di Laboratorium BBKP Tanjung Priok; Eneng Rina, Iman Mardian, Didiet, serta rekan-rekan satu angkatan (Kelas 2013-2014) dan teman-teman di laboratorium Bakteriologi PTN atas bantuan dan dukungannya. Penulis juga menyampaikan rasa terima kasih kepada Mbak Sari Nurulita dan Tatit Sastrini yang telah membimbing dalam pengujian di laboratorium. Selain itu penulis juga mengucapkan terima kasih kepada Bapak Alit, Miftachul Huda, Bapak Agus Susilo, Mbak Mintarsih, Devi Ayu Komalaningrat, Sari, Dede Sri Rahayu, Sylvia Herli Dianti, dan Sisca Prayudani Usman yang telah membantu penulis selama proses pengambilan sampel di lapangan.
Ungkapan terima kasih juga disampaikan kepada ibu, kakak, suami, anak-anak, dan seluruh keluarga, atas segala doa, dukungan, dan kasih sayangnya. Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah membantu dalam proses penelitian ini yang namanya tidak dapat disebutkan satu per satu.
Semoga tulisan ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 2
TINJAUAN PUSTAKA 3
Penyakit Penting pada Tanaman Kentang yang disebabkan oleh Bakteri 3
Penyakit Busuk Lunak 5
Perkembangan E. chrysanthemi 7
Deteksi dan Identifikasi 8
BAHAN DAN METODE 10
Waktu dan Tempat 10
Alat dan Bahan 10
Pengambilan Sampel Tanaman 10
Deteksi Serologi 10
Isolasi dan Pemurnian Isolat 11
Uji Hipersensitivitas 11
Identifikasi Bakteri Busuk Lunak yang diduga E. chrysanthemi 12
HASIL DAN PEMBAHASAN 17
Gejala layu yang ditemukan di lapangan 17
Insidensi E. chrysanthemi berdasarkan Uji Serologi 18
Isolasi dan Pemurnian Isolat 19
Uji Hipersensitivitas 20
Identifikasi Isolat yang diduga E. chrysanthemi 21
SIMPULAN DAN SARAN 30
Simpulan 30
Saran 30
DAFTAR PUSTAKA 31
LAMPIRAN 35
DAFTAR TABEL
1 Penamaan terbaru anggota genus Dickeya dan inang utamanya 8 2 Ciri morfologi isolat bakteri asal tanaman kentang 19 3 Hasil pengujian hipersensitivitas isolat bakteri asal tanaman kentang
pada daun tembakau 20
4 Hasil pengujian patogenisitas dan fisiologi isolat bakteri asal tanaman kentang dari beberapa sentra pertanaman kentang di Jawa 21 5 Hasil identifikasi isolat bakteri asal tanaman kentang berdasarkan
pemanfaatan sumber karbon dengan GEN III OmniLog ID System 22 6 Hasil BLAST nukleotida 16S rRNA isolat bakteri asal tanaman kentang 23 7 Homologi sikuen nukleotida gen 16S DNA isolat 49P-5, 71G-1, 71G-6,
dan 14M-6 dengan isolat-isolat dari negara lain 24
DAFTAR GAMBAR
1 Gejala penyakit yang disebabkan oleh R. solanacearum pada umbi kentang; (a) oose keluar dari mata tunas umbi kentang (tertutup tanah), (b) gejala pada jaringan vaskular berupa perubahan warna menjadi kecoklatan serta adanya eksudat bakteri berwarna krem 3 2 Gejala penyakit kudis pada umbi kentang; (a) tipe menonjol, (b) tipe
cork lesion 4
3 Pengujian Gram, Isolat bakteri Gram negatif akan lengket apabila dicampurkan dengan KOH 3% (a) sedangkan Gram positif tidak
lengket (b) 12
4 Uji katalase positif (a) dan negatif (b) 12
5 Uji katalase positif (kanan) dan oksidase negatif (kiri) 13 6 Pengujian O-ksidasi dan Fermentasi (O/F); (a) media O-F tanpa
glukosa, diinokulasi isolat kontrol +, (b) media O-F tanpa inokulasi, (c) media O-F tanpa inokulasi dengan minyak parafin, (d) pengujian kontrol +, (e) pengujian kontrol + dengan parafin 13 7 Pengujian pembusukan pada irisan umbi kentang, (a) diinokulasi isolat
kontrol positif (E. chrysanthemi asal anggrek), (b) tanpa inokulasi 14 8 Gejala layu dan busuk lunak pada tanaman kentang pada lokasi
pertanaman kentang di Pangalengan (a, e, dan i), Garut (b, f, dan j),
Dieng (c, g, dan k) dan Malang (d, h, dan l) 18
9 Hasil uji hipersensitif isolat bakteri asal tanaman kentang (a) isolat 14M-6 dan kontrol setelah 24 jam, (b) isolat 49P-5 setelah 48 jam (c)
isolat 71G-1 dan 71G-6 setelah 48 jam 21
10 Dendogram hasil pengujian GEN III OmniLog ID System terhadap
beberapa isolat asal tanaman kentang dan kontrol positif
E. chrysanthemi 22
71G-1, 3= isolat 71G-6, 4= isolat 14M-6, K(-) = kontrol negatif, K(+) =
E. chrysanthemi 23
12 Pohon filogeni P. oryzihabitans asal Indonesia (dicetak tebal) yang diisolasi dari tanaman kentang bergejala busuk lunak dibandingkan dengan E. chrysanthemi (PNG/ EF530559.1), D. zeae (Mexico/ KJ438953.1), D. paradisiaca (NCPPB2511), D. chrysanthemi (NZ/ EF178670.1), D. dadantii (Jepang/ AB713545.1), D. dianthicola (Jepang/ AB713574.1), P. oryzihabitans (Jepang/ KP278170.1), dan P. oryzihabitans (Cina/EU709757.1), P. oryzihabitans (Cina/
JX067903.1) 25
13 Pohon filogeni P. viridiflava asal Indonesia (dicetak tebal) yang diisolasi dari tanaman kentang bergejala busuk lunak dibandingkan dengan E. chrysanthemi (PNG/ EF530559.1), D. zeae (Mexico/ KJ438953.1), D. paradisiaca (NCPPB2511), D. chrysanthemi (NZ/ EF178670.1), D. dadantii (Jepang/ AB713545.1), D. dianthicola (Jepang/ AB713574.1), P. viridiflava (Hungaria/ HE585219.1), dan
P. viridiflava (Spanyol/ GQ398129.1) 26
DAFTAR LAMPIRAN
1 Nilai absorbansi ELISA sampel komposit tanaman kentang asal Pangalengan Jawa Barat pada reaksi indirect ELISA menggunakan
antisera E. chrysanthemi 36
2 Nilai absorbansi ELISA sampel individu tanaman kentang asal
Pangalengan pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi 37
3 Nilai absorbansi ELISA sampel komposit tanaman kentang asal Garut
Jawa Barat pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi 38
4 Nilai absorbansi ELISA sampel individu tanaman kentang asal Garut
Jawa Barat pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi 38
5 Nilai absorbansi ELISA sampel komposit tanaman kentang asal Dieng Jawa Tengah pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi 39
6 Nilai absorbansi ELISA sampel individu tanaman kentang asal Dieng Jawa Tengah pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi (Plate-1) 40
7 Nilai absorbansi ELISA sampel individu tanaman kentang asal Dieng Jawa Tengah pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi (Plate-2) 41
8 Nilai absorbansi ELISA sampel individu tanaman kentang asal Dieng Jawa Tengah pada reaksi indirect ELISA menggunakan antisera
9 Nilai absorbansi ELISA sampel komposit tanaman kentang asal Batu-Malang Jawa Timur pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi 43
10 Nilai absorbansi ELISA sampel individu tanaman kentang asal Batu-Malang Jawa Timur pada reaksi indirect ELISA menggunakan antisera
E. chrysanthemi (Plate-3) 43
11 Morfologi koloni isolat yang diduga genus Erwinia pada media NA 44 12 Hasil pembacaan pemanfaatan sumber karbon isolat 49P-5
menggunakan GEN III OmniLog ID System 45
13 Hasil pembacaan pemanfaatan sumber karbon isolat 71G-1
menggunakan GEN III OmniLog ID System 46
14 Hasil pembacaan pemanfaatan sumber karbon isolat 71G-6
menggunakan GEN III OmniLog ID System 47
15 Hasil pembacaan pemanfaatan sumber karbon isolat 14M-6
menggunakan GEN III OmniLog ID System 48
PENDAHULUAN
Latar Belakang
Berdasarkan data rata-rata produksi kentang nasional tahun 2008-2012, sentra produksi kentang di Indonesia tersebar di 6 provinsi yang memberikan kontribusi 92.81% dari produksi nasional. Jawa Barat merupakan sentra utama produksi kentang di Indonesia dengan kontribusi sebesar 25.57% diikuti oleh Jawa Tengah sebesar 24.63%, Sulawesi Utara sebesar 11.91%, Sumatera Utara sebesar 11.91%, Jawa Timur sebesar 11.08% dan Jambi sebesar 7.70%. Sementara provinsi lainnya hanya berkontribusi 7.19%. Kebutuhan kentang di Indonesia cukup tinggi akan tetapi belum dapat dipenuhi oleh pasar dalam negeri sehingga sampai saat ini Indonesia masih mengimpor kentang baik untuk konsumsi maupun benih. Apabila dibandingkan dengan produksi kentang di Eropa yang rata-ratanya mencapai sekitar 25.5 ton per hektar, produksi kentang di Indonesia masih sangat rendah yaitu hanya sekitar 16 ton per hektar. Hal ini kemungkinan terkait dengan ketersediaan benih kentang berkualitas yang baru mencapai sekitar 10% dari kebutuhan nasional. Adapun volume impor kentang untuk bibit tahun 2010 sampai 2012 berturut-turut sebesar 1 906.40 ton, 2 254.93 ton, 2 018.15 ton, sedangkan untuk konsumsi berturut-turut sebesar 89 271.81 ton, 106 899.26, dan 83 158.47 ton (Baharuddin et al. 2012; Barantan 2013; Pusdatin 2013).
Importasi kentang ke dalam wilayah Negara Republik Indonesia harus melalui pemeriksaan untuk menghindari kemungkinan terbawanya Organisme Pengganggu Tumbuhan Karantina (OPTK). Berdasarkan lampiran Peraturan Menteri Pertanian No. 93/Permentan/OT. 140/12/2011 tanggal 29 Desember 2011 tentang Jenis OPTK, terdapat 30 target pemeriksaan pada komoditas kentang. Salah satu OPTK penting yang saat ini banyak diperhatikan adalah Erwinia chrysanthemi (direklasifikasi sebagai Dickeya spp.) terkait dengan introduksi dan penyebarannya yang saat ini meningkat di Eropa (Toth et al. 2011). Hingga saat ini E. chrysanthemi tergolong kedalam OPTK A2 yang persebarannya tercatat masih terbatas di wilayah Sumatera (Lampung) dan Jawa Barat (Bogor). Terkait dengan reklasifikasi E. chrysanthemi menjadi Dickeya spp., status patogen ini diusulkan menjadi A1 (belum ada di Indonesia) yang terdiri atas 7 spesies yaitu: D. chrysanthemi, D. dadantii, D. dianthicola, D. dieffenbachiae, D. paradisiaca, D. solani, dan D. zeae.
Sampai saat ini Badan Karantina Pertanian (Barantan) masih melakukan pemutakhiran data mengenai wilayah sebar E. chrysanthemi. Dalam kegiatan Pemantauan OPTK Barantan tahun 2011 E. chrysanthemi ditemukan pada tanaman kentang dan cabai di wilayah Jawa Tengah (Kabupaten Batang dan Brebes). Tahun 2013 E. chrysanthemi ditemukan pada tanaman jagung, kentang, dan pisang di wilayah Jawa Tengah (Kabupaten Banjarnegara, Banyumas, dan Purbalingga), dan Jawa Timur (Kabupaten Malang). Akan tetapi temuan tersebut masih harus divalidasi karena deteksi yang dilakukan hanya berdasarkan uji serologi menggunakan antisera poliklonal.
pada daun dan pangkal batang tanaman lidah buaya di Semplak, Bogor, Jawa Barat (Supriadi et al. 2002). Beberapa informasi mengenai perkembangan E. chrysanthemi di Indonesia mengarah pada D. dadantii (Hanudin et al. 2013). Muharam et al. (2012) juga melaporkan bahwa salah satu penyebab penyakit busuk lunak pada tanaman anggrek Phalaenopsis yang berasal dari DKI Jakarta, Jawa Barat, dan DI Yogyakarta ialah D. dadantii. Selain itu E. chrysanthemi biovar 3 (sinonim dengan D. dadantii) diisolasi dari tanaman lidah buaya pada lahan gambut di Kalimantan Barat (Supriyanto et al. 2011).
Kehilangan hasil pada tanaman kentang yang disebabkan oleh infeksi Dickeya spp. di negara Israel yang merupakan pengimpor utama benih umbi kentang dari Eropa mencapai 20-25% dengan kejadian penyakit lebih dari 15%. Kerugian akibat infeksi patogen ini terhadap produksi kentang di Eropa disebabkan oleh penolakan dan penurunan grade benih umbi kentang pada proses sertifikasi benih karena diberlakukannya standar sertifikasi benih yang cukup ketat oleh Uni Eropa. Infeksi Pectobacterium dan Dickeya pada tanaman kentang
di Belanda menyebabkan kerugian hingga €30 M, sedangkan di Finlandia kejadian penyakit berdasarkan gejala busuk umbi kentang di lapangan mencapai 5-6% (Toth et al. 2011). Sebagai salah satu negara pengimpor kentang dari Eropa, Indonesia harus mewaspadai kemungkinan masuknya patogen tersebut melalui umbi bibit kentang. Beberapa wilayah yang menjadi daerah produksi kentang di Pulau Jawa yaitu Pangalengan, Garut (Jawa Barat), Dieng (Jawa Tengah), dan Batu-Malang (Jawa Timur). Pada lokasi tersebut diduga menjadi tempat introduksi patogen dari luar negeri karena petani menanam kentang varietas Atlantik yang benihnya merupakan benih impor. Perlu ditelusuri kemungkinan masuk dan tersebarnya E. chrysanthemi ke wilayah Indonesia dengan mendeteksi keberadaan patogen tersebut di lapangan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendeteksi dan mengidentifikasi E. chrysanthemi penyebab busuk lunak pada tanaman kentang di Jawa.
Manfaat Penelitian
Penelitian ini diharapkan memberikan informasi yang dapat menjadi masukan bagi Barantan terkait status dan sebaran E. chrysanthemi penyebab busuk lunak pada tanaman kentang di Jawa.
Hipotesis
TINJAUAN PUSTAKA
Penyakit Penting pada Tanaman Kentang yang disebabkan oleh Bakteri
Beberapa penyakit penting disebabkan oleh bakteri pada tanaman kentang menjadi ancaman utama terhadap produksi kentang yaitu layu bakteri, kudis, dan busuk lunak. Penyakit layu bakteri masih merupakan kendala utama dalam produksi kentang di Indonesia. Gejala layu bakteri yang disebabkan oleh Ralstonia solanacearum mirip dengan gejala layu yang disebabkan oleh kekurangan air atau karena infeksi patogen lain seperti Fusarium dan Verticillium. Untuk mengetahui penyebab layu dapat dilakukan perendaman potongan batang tanaman sakit dalam air jernih. Apabila gejala layu disebabkan oleh bakteri, maka dalam beberapa menit potongan batang tersebut akan mengeluarkan cairan putih keruh yang merupakan eksudat bakteri. Di Indonesia, penyakit layu bakteri dapat ditemukan di seluruh daerah sentra produksi kentang di Pulau Jawa. Penyakit ini menyebabkan kematian tanaman kentang hingga 10-30% bahkan dapat menurunkan hasil produksi kentang sampai 80%. Selain pada tanaman kentang, penyakit layu bakteri juga merupakan penyakit utama pada tanaman tomat, terung, cabai, lada, jahe, kacang tanah, pisang, dan tembakau baik di daerah tropis maupun subtropis (Semangun 1989; Arora dan Khurana 2004; Purwito dan Wattimena 2008).
Bagian mata tunas umbi kentang yang terinfeksi R. solanacearum mengeluarkan lendir yang merupakan eksudat bakteri, bagian ini biasanya terutup oleh tanah yang menempel pada lendir (Gambar 1a). Gejala penyakit ini ditemukan di tempat pengambilan sampel Pangalengan, Jawa Barat yang mirip dengan gejala yang dideskripsikan oleh Arora dan Khurana (2004). Apabila umbi dibelah, maka akan terlihat jaringan vaskular yang berwarna kecoklatan dan adanya eksudat bakteri berwarna krem sampai kelabu (Gambar 1b). Gejala busuk ini mirip dengan penyakit busuk cincin yang disebabkan oleh Clavibacter michiganensis subsp. sepedonicus, namun pada jaringan vaskular umbi yang terinfeksi penyakit busuk cincin akan terlihat masa seperti keju berbau busuk dengan warna kuning pucat sampai coklat muda, umbi yang terserang busuk
a b
cincin mata tunasnya tidak mengeluarkan lendir (Semangun 1989; Duriat et al. 2006).
Penyakit kudis terdapat pada beberapa area penanaman kentang di Afrika, Asia, Eropa, Amerika Selatan, dan Amerika Utara. Penyakit ini menyebabkan lesio pada bagian permukaan umbi kentang dan berpengaruh terhadap kualitas produk. Umbi kentang yang bergejala penyakit kudis akan turun harga jualnya karena tampilannya yang kurang menarik dan juga perlu dikupas lebih dalam sebelum dapat dikonsumsi. Lembaga sertifikasi benih di India menetapkan kejadian penyakit kudis pada benih kentang tidak boleh melebihi 5% per lot, hal tersebut menimbulkan kerugian yang cukup besar pada industri benih. Penyebab penyakit kudis adalah Streptomyces scabies, S. acidiscabies, S. turgidscabis, S. collinus, S. griseus, S. longisporoflavus, S. cinereus, S. violaceoruber, S. arbogriseolus, S. griseoflavus, dan S. catenulae (Arora dan Khurana 2004).
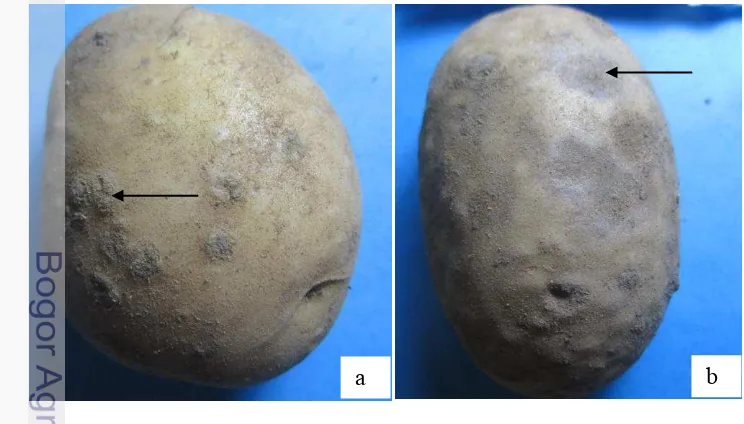
Patogen utama penyebab penyakit kudis adalah S. scabies yang telah dilaporkan menyebabkan lesio seperti kudis pada permukaan umbi kentang. Patogen ini dapat menginfeksi tanaman umbi-umbian yang lain diantaranya lobak, parsnip (wortel putih), bit, dan wortel. Gejala penyakit kudis pada permukaan umbi kentang bervariasi seperti corklike lesion, menonjol, dan lesio berlubang. Gejala kudis biasanya terlambat ditemukan pada akhir musim tanam atau pada saat panen. Lesio berawal dari spot kecil kecoklatan yang kemudian melebar menjadi lesio sirkular water-soaked. Lesio sirkular tersebut kemudian bersatu membentuk area kudis yang lebar. Pada kasus infeksi yang parah, lesio dapat menutupi seluruh permukaan umbi. Patogen penyebab kudis pada umbi kentang dapat bertahan pada tanah, permukaan umbi, maupun sisa-siasa tanaman. Populasi patogen dapat ditekan dengan cara melakukan rotasi tanaman bukan inang, akan tetapi tidak dapat menghilangkan keberadaanya di dalam tanah (Wharton et al. 2007).
Gambar 2 Gejala penyakit kudis pada umbi kentang; (a) tipe menonjol, (b) tipe cork lesion (Sumber foto: Aprilyani)
Bakteri S. scabies termasuk kelompok Actinobacteria. Patogen ini dapat membentuk miselium bercabang, spora berbentuk seperti rantai spiral yang dapat terlepas dan membentuk spora individu. Apabila spora sudah matang akan terbentuk pigmen warna abu-abu. Ketika spora kontak dengan inang yang sesuai
maka spora akan berkecambah dan proses infeksi dimulai (Wharton et al. 2007). Gejala kudis yang ditemukan pada tempat pengambilan sampel di kawasan Dieng, Kecamatan Batur, Kabupaten Banjarnegara Jawa Tengah adalah tipe menonjol dan cork lesion (Gambar 2).
Penyakit busuk lunak bakteri dapat ditemukan di hampir semua lokasi penanaman kentang dan dapat memengaruhi tanaman pada semua tahapan pertumbuhan. Penyakit ini menyebabkan busuk lunak pada saat pemanenan, transit, penyimpanan, dan menyebabkan gejala busuk kaki pada daun selama masa tanam. Gejala black leg terjadi terutama pada daerah beriklim temperate dengan kondisi daun tanaman yang rimbun/rapat. Kehilangan hasil pada proses penyimpanan atau transit dalam kondisi ventilasi yang buruk dapat mencapai 80%. Bakteri yang dilaporkan dapat menimbulkan gejala busuk lunak adalah E. carotovora subsp. carotovora, E. carotovora subsp. atroseptica (sinonim Pectobacterium carotovorum), E. chrysanthemi, Bacillus polymixa, B. subtilis, B. mesentericus, B. megaterium, Pseudomonas marginalis, P. viridiflava, Clostridium spp., Micrococcus spp., dan Flavobacterium (Arora dan Khurana 2004).
Penyakit Busuk Lunak
Bakteri penting penyebab penyakit busuk lunak pada tanaman kentang maupun pertanaman hortikultura yang lain adalah Pectobacterium (soft rot Enterrobacteriaceae) dan Erwinia spp. (pectinolitic) yang direklasifikasi sebagai Dickeya spp (Czajkowski et al. 2014).
Gejala busuk lunak
Gejala penyakit busuk lunak pada tanaman kentang di lapangan yang disebabkan oleh E. chrysanthemi maupun Pectobacterium spp. sangat mirip. Kisaran gejala bergantung pada spesies, isolat, kondisi lingkungan dan jenis kultivar yang digunakan. Penyakit yang disebabkan oleh E. chrysanthemi (Dickeya spp.) pada kondisi basah dan hangat akan menunjukkan gejala busuk batang (stem rotting) yang mirip dengan gejala infeksi P. atrosepticum. Tanaman yang terserang P. atrosepticum secara khas menunjukkan gejala black leg pada kondisi lingkungan yang dingin dan lembab, sedangkan gejala penyakit yang desebabkan oleh Dickeya spp. sebagian besar ditemukan pada kondisi hangat ketika suhu melebihi 25 ᵒC. D. dianthicola dan D. solani dapat berkembang dengan baik pada suhu 21 ᵒC dan 27 ᵒC sedangkan Pectobacterium atrosepticum dapat tumbuh pada suhu 21ᵒC akan tetapi tidak mampu berkembang pada suhu 27
ᵒC. Dickeya lebih agresif menyerang tanaman kentang dibandingkan Pectobacterium atrosepticum karena mampu menyerang jaringan vaskular lebih cepat (Elphinstone dan Toth 2007; Toth et al. 2011).
dengan tepian daunnya mengering bahkan hingga keseluruhan daun. Gejala seperti ini akan terlihat pada daun di bagian bawah, pada kasus yang ekstrim keseluruhan tanaman akan mengering. Seringkali hanya satu bagian batang saja yang menunjukan gejala. Perkembangan gejala biasanya berhubungan dengan busuk lunak pada umbi yang menjadi indukan. Jaringan vaskular berwarna kecoklatan, perkembangannya dari bagian bawah menuju ke atas hingga akhirnya jaringan batang mengalami nekrosis. Sedangkan pada bagian luar batang tetap terlihat hijau hingga daun menjadi layu secara keseluruhan. Pada kondisi hangat dan kering gejala biasanya akan terlihat ketika suhu udara mencapai 25 ᵒC (Drive 2007; Elphinstone dan Toth 2007; Toth et al 2011).
Gejala busuk lunak dan busuk kaki yang disebabkan oleh Pectobacterium spp. mudah dibedakan dengan gejala yang disebabkan oleh patogen lain secara
sangat mirip yaitu memucatnya warna dan membusuknya jaringan cincin vaskular pada bagian dalam umbi kentang.
Penyebaran patogen
Dickeya spp. menyebar luas melewati batas-batas negara, terbawa oleh bagian tanaman yang terinfeksi. Penyebaran yang paling penting dari patogen ini yaitu melalui benih umbi kentang yang terinfeksi laten. Patogen dapat terbawa pada permukaan umbi, lentisel, dan pada sistem vaskular tanaman yang secara sistematik memasuki tanaman melalui stolon (dari tanaman indukan) atau melalui akar. Patogen menginfeksi lentisel melalui permukaan umbi yang basah, menyebabkan permukaan tersebut tertekan secara sirkuler. Umbi busuk menyebar dengan cepat pada saat pengangkutan atau penyimpanan di gudang. Baik di lapangan maupun di gudang, busuk lunak sering dipicu oleh kerusakan mekanis atau kerusakan oleh serangan hama dan penyakit lainnya pada umbi. Selain melalui umbi kentang, patogen ini juga dilaporkan dapat terbawa aliran air sungai (Toth et al. 2011).
Pengendalian penyakit busuk lunak
Perkembangan E. chrysanthemi
Bakteri E. chrysanthemi merupakan Gram-negatif, anaerobik fakultatif, rod-shaped berukuran 1.1-3.8 × 0.5-1 µm, biasanya tunggal, motile dengan beberapa flagel tipe peritrik. Bakteri ini memiliki sifat oksidase-negatif, katalase-positif, dapat memfermentasikan glukosa dan mereduksi nitrat. Ciri utama yang membedakan Erwinia yang menyebabkan busuk lunak dari spesies Erwinia yang lain adalah kemampuan untuk memproduksi enzym pectolytic dalam jumlah yang sangat besar sehingga dapat melunakkan jaringan parenkim pada berbagai jenis tumbuhan. Kisaran tanaman inang E. chrysanthemi cukup luas, terutama pisang, Chrysanthemum spp., Dianthus spp., jagung, kentang dan tomat (Samson et al. 2005; CABI 2007).
Pada awal perkembangannya E. chrysanthemi dibagi kedalam kelompok patovarnya sesuai dengan inangnya masing-masing. E. chrysanthemi telah diisolasi dari lebih 50 jenis tanaman yang berbeda. Sistem klasifikasi lainnya dengan menggunakan kriteria biokimia dan fisiologi seperti pertumbuhan pada 39
ᵒC, produksi arginin dihidrolase, dan kemampuan untuk mengatabolisis beberapa jenis gula telah disampaikan oleh Samigon dan Nassan-Agha (1978), akan tetapi pengelompokkan berdasarkan biovar ini tidak berkorelasi dengan patovar. Boccara et al. (1991) mengklasifikasi E. chrysanthemi dengan menggunakan restriction fragment length polymorphisms (RFLP) dari 52 strain E. chrysanthemi yang telah diisolasi dari beberapa inang dengan lokasi yang berbeda dan mengelompokannya ke dalam 10 grup.
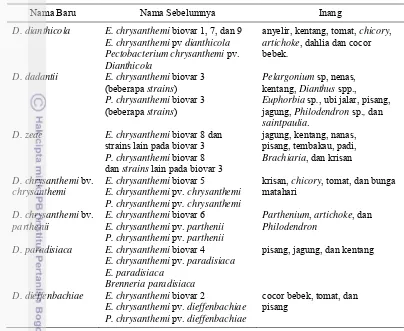
Tabel 1 Penamaan terbaru anggota genus Dickeya dan inang utamanya
Nama Baru Nama Sebelumnya Inang
D. dianthicola E. chrysanthemi biovar 1, 7, dan 9 E. chrysanthemi pv dianthicola
D. dadantii E. chrysanthemi biovar 3 (beberapa strains)
D. zeae E. chrysanthemi biovar 8 dan
strainslain pada biovar 3
D. paradisiaca E. chrysanthemi biovar 4 E. chrysanthemi pv. paradisiaca E. paradisiaca
Brenneria paradisiaca
pisang, jagung, dan kentang
D. dieffenbachiae E. chrysanthemi biovar 2
E. chrysanthemi pv. dieffenbachiae P. chrysanthemi pv. dieffenbachiae
cocor bebek, tomat, dan pisang
Sumber tabel: Samson et al. 2005
Dickeya spp. pertama kali dilaporkan ditemukan pada tanaman kentang di Eropa yaitu di Belanda pada tahun 1970an, kemudian juga dilaporkan telah ditemukan pada beberapa negara lain di Eropa. Sebagian besar isolat Dickeya spp. yang ditemukan di Eropa adalah D. dianthicola. Patogen ini secara luas telah dilaporkan ditemukan pada berbagai inang termasuk kentang. Selain dapat berkembang pada iklim dingin, patogen ini pun dapat beradaptasi pada iklim hangat. Pada 5 tahun terakhir kehilangan hasil pada tanaman kentang yang disebabkan oleh Dickeya spp. telah meningkat secara signifikan pada beberapa kultivar di sejumlah negara Eropa dan Israel (merupakan negara pengimpor utama benih umbi kentang dari Eropa). Hal ini berkaitan dengan munculnya patogen baru Dickeya spp. yang menyebar melalui perdagangan benih umbi kentang, dan kemungkinan bisa memberikan dampak yang lebih besar sebagai konsekuensi dari perubahan iklim (Toth dan Elphinston 2007; Toth et al. 2011; Garlant et al. 2013).
Deteksi dan Identifikasi
violet pectate (CVP) yang mengandung NaNO3, sodium polypectate, dan crystal violet. Selain Erwinia, bakteri lain yang juga menyebabkan busuk lunak dapat tumbuh pada media CVP. Pada media tersebut Erwinia penyebab busuk lunak dapat dibedakan dari Pseudomonas spp. dari cekungan yang terbentuk pada permukaan media datar (Cuppels dan Kelman 1973). Pada media CVP Erwinia akan membentuk cekungan setelah 48 jam. E. carotovora subsp. atroseptica membentuk cekungan hanya pada suhu 27 ºC, sedangkan E. carotovora subsp. carotovora hingga suhu 33.5 ºC dan E. chrysanthemi hingga suhu 37 ºC (De Boer dan Kelman 2001).
Metode serologi sangat berguna untuk identifikasi awal isolat bakteri yang dimurnikan dari sampel tanaman maupun tanah. Antisera dan kit ELISA telah tersedia secara komersial dan dapat medeteksi Dickeya spp., antibodi umumnya secara langsung mendeteksi O-serogroup 1 dan hanya mengenali 68% strain. Kit ELISA komersial dapat memberikan hasil false positive, juga memiliki keterbatasan terkait sensitivitas deteksi. Telah ditemukan pula antibodi monoklonal yang dapat mendeteksi isolat D. dianthicola dan beberapa spesies Dickeya yang lain dengan metode triple antobody sandwich (TAS) ELISA. Akan tetapi sensitivitasnya terbatas hanya 107 cfu/mL Alternatif lain dari metode serologi adalah Luminex xMAP® technology yang dapat digunakan untuk mendeteksi P. atrosepticum dan D. dianthicola, akan tetapi perlu dilakukan pengayaan bakteri pada media semi selektif polypectate broth agar kerapatan bakteri berada pada tingkat yang dapat terdeteksi (Elphinstone dan Toth 2007).
Metode PCR dengan pasangan primer ADE1/ADE2 dapat digunakan untuk mendeteksi E. chrysanthemi dengan sensitivitas hingga 103 cfu/mL. Bagian conserved region gen pectate lyase (pelADE) berukuran 420 pb sangat spesifik pada E. chrysanthemi. Tidak ada produk PCR diperoleh dari sampel yang diekstrak baik dari bakteri pektinolitik maupun non pektinolitik genus lain (Nassar
et al. 1996). Pasangan primer lain yang dapat digunakan untuk mendeteksi E. chrysanthemi adalah Ec3F/Ec4R. Primer ini didisain untuk membedakan 2
bakteri penyebab busuk lunak yaitu E. chrysanthemi dan E. carotovora subsp. carotovora. Fragmen DNA berukuran 548 pb teramplifikasi dari E. chrysanthemi, sedangkan E. carotovora subsp. carotovora berukuran 497 pb (Hseu et al. 2007).
Teknik lain yang dapat digunakan untuk mengidentifikasi bakteri adalah uji pemanfaatan sumber karbon yang telah dikomersialkan, yaitu GEN III OmniLog® ID System (Biolog, Hayward, CA, USA). Metode ini didesain untuk menganalisis reaksi biokimia yang terdiri atas 94 senyawa karbon yang berbeda termasuk gula, asam karboksilat, asam amino, dan peptida (71 diantaranya merupakan sumber karbon dan 23 uji kimiawi, termasuk pH, toleransi terhadap garam, dan uji sensitivitas terhadap bahan kimia). GEN III OmniLog ID System merupakan metode cepat yang telah distandardisasi untuk menentukan reaksi oksidasi bakteri terhadap berbagai sumber karbon secara simultan. Hasil dari reaksi tersebut kemudian dibandingkan dengan basis data melalui analisis hasil
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Bakteriologi Departemen Proteksi Tanaman, Institut Pertanian Bogor dan Balai Besar Karantina Pertanian Tanjung Priok, Wilayah Kerja Bogor. Penelitian dilakukan sejak bulan Juli 2014 sampai dengan Januari 2015.
Alat dan Bahan
Alat yang digunakan adalah Thermo Scientific Multiscan® FC Microplate Photometer (ELISA Reader), Biolog MicroStation Reader, turbidimeter, dan thermocycler PCR. Bahan yang digunakan adalah kit ELISA E. chrysanthemi (kode: 1080, Agdia), GEN III OmniLog® ID System (Biolog, Hayward, CA, USA), primer spesifik E. chrysanthemi Ec3F dan Ec4R, serta primer universal 16S rRNA 27F dan 1429R.
Pengambilan Sampel Tanaman
Sampel tanaman kentang diambil dari 4 lokasi pertanaman yaitu Kecamatan Pangalengan Jawa Barat pada posisi S 07’ 11 851’ E 107’ 36 476’ di ketinggian 1459 m, Kecamatan Cikajang Kabupaten Garut Jawa Barat pada posisi S 07’ 24
22 26’ E 107’ 49 38 76’ pada ketinggian 1380 m, kawasan Dieng Kecamatan Batur Kabupaten Banjarnegara Jawa Tengah pada posisi S 07’ 12 087’ E 109’ 46
057’ pada ketinggian 1400 m, dan Kecamatan Bumiaji Kota Batu-Malang Jawa Timur pada posisi S 07’44 937’ E 112’ 32 049’ di ketinggian 1656 m. Tiap lokasi diambil 100 tanaman yang menunjukkan gejala layu serta busuk basah. Bagian tanaman yang diambil adalah pangkal batang dan umbi. Umur tanaman berkisar antara 50-90 hari setelah tanam (HST). Sampel dimasukkan ke dalam amplop coklat, diberi nomor dan disusun dalam wadah yang tidak terlalu rapat agar tidak basah/busuk, disimpan dalam kulkas bersuhu 4 ᵒC sampai digunakan untuk pengujian.
Deteksi Serologi
Deteksi serologi terhadap sampel tanaman bergejala layu dilakukan untuk menentukan insidensi E. chysanthemi dan seleksi awal sampel yang akan diisolasi. Deteksi serologi dilakukan dengan indirect enzyme-linked immunosorbent assay (I-ELISA) menggunakan probe antibody (IgG Rabbit) dan conjugate [Goat anti-Rabbit (IgG-AP) enzym conjugate] E. chrysanthemi (Adgen). Sampel tanaman dari lapangan dibuat menjadi 20 sampel komposit dari tiap lokasi; 1 sampel komposit terdiri atas 5 tanaman. Pada sampel komposit yang positif, selanjutnya dideteksi lagi tiap individu untuk mengetahui insidensidari tiap lokasi. Bagian pangkal batang dan umbi tanaman kentang digerus dalam coating buffer dengan perbandingan 1:4 (b:v), kemudian dimasukkan ke dalam sumuran pada plat mikrotiter ELISA sebanyak 100 µL dan diinkubasi pada suhu 4
o
µL blocking buffer (5 g non fat dried milk powder dalam 100 ml PBST) dan diinkubasi selama 1 jam pada suhu 37 oC. Plat dicuci 3 kali dengan PBST, dan diberi 100 µL antiserum pertama E. chrysanthemi (dilarutkan dalam bufer konjugat dengan perbandingan 1:8000), dan selanjutnya diinkubasi selama 2 jam pada suhu 37 oC. Setelah 2 jam, plat dicuci 3 kali kemudian diisi 100 µL GAR-AP conjugate yang dilarutkan dalam bufer konjugat (1:4000). Setelah diinkubasi selama 1 jam pada suhu 37 oC plat dicuci 3 kali dengan PBST. Sumuran diisi dengan 100 µL pNPP yang dilarutkan dalam bufer pNPP dengan perbandingan 1:1. Setelah diinkubasi pada suhu ruang selama 30 menit dilakukan pengamatan secara kuantitatif menggunakan ELISA reader pada panjang gelombang 405 nm. Reaksi dihentikan dengan cara menambahkan larutan NaOH 3 M sebanyak 50 µL ke dalam masing-masing sumuran. Pada setiap pengujian disertakan kontrol negatif, kontrol positif, dan bufer. Uji dinyatakan positif jika nilai absorbansi ELISA (NAE) sampel uji ≥ 2 kali NAE kontrol negatif (tanaman sehat).
Isolasi dan Pemurnian Isolat
Sampel individu yang menunjukkan positif E. chrysanthemi pada pengujian ELISA, kemudian diisolasi menggunakan media selektif casamino acid peptone glucose (CPG) (Cuppels dan Kelman 1974). Batang dan umbi dari tanaman kentang bergejala layu dan busuk dicuci dengan air mengalir kemudian disterilisasi permukaan menggunakan alkohol 70%. Selanjutnya batang dan umbi dicacah menggunakan skalpel steril (sebelumnya telah dicelupkan dalam alkohol 70% dan dibakar api bunsen). Potongan sampel direndam dalam akuades steril hingga keluar masa bakteri (oose), kemudian divortex. Suspensi diencerkan bertingkat, dan sebanyak 100 µL dari masing-masing pengenceran ditumbuhkan pada media CPG.
Koloni tunggal bakteri yang tumbuh setelah 24-48 jam diambil menggunakan jarum ose steril (dicelupkan dalam alkohol 70% dan dibakar api bunsen), dan digores pada media nutrient agar (NA) dengan metode kuadran. Koloni tunggal yang tumbuh kemudian digores kembali pada media NA untuk memastikan bahwa bakteri yang tumbuh berasal dari koloni tunggal. Isolat murni bakteri yang diduga E. chrysanthemi kemudian diidentifikasi.
Sebelum dilakukan identifikasi, isolat bakteri terlebih dahulu diuji sifat patogennya melalui uji hipersensitivitas sehingga diharapkan hanya bakteri yang memiliki sifat patogen saja yang disertakan dalam rangkaian pengujian.
Uji Hipersensitivitas
Identifikasi Bakteri Busuk Lunak yang diduga E. chrysanthemi
Karakter fisiologi
Menurut Hyman et al. (2002), beberapa pengujian sifat fisiologi yang perlu dilakukan untuk mengetahui karakter Erwinia yaitu uji oksidase, katalase, oksidasi-fermentasi, dan kemampuan untuk menyebabkan busuk pada umbi kentang. Tahapan pengujian dikerjakan sesuai dengan prosedur yang telah dilakukan oleh De Boer dan Kelman (2001).
Uji Gram. Gelas objek steril, ditetesi larutan KOH 3% pada bagian tengahnya. Koloni bakteri diambil menggunakan jarum ose, kemudian dicampurkan dalam larutan KOH tersebut. Perlahan ose diangkat dari campuran tersebut. Apabila campuran bakteri dan KOH menempel/lengket pada jarum ose saat terangkat, maka koloni bakteri tersebut tergolong Gram negatif. Sebaliknya apabila campuran tidak menempel/lengket menunjukkan bakteri Gram positif (Gambar 3).
Uji katalase. Gelas objek steril, ditetesi larutan H2O2 (hidrogen peroksida)
pada bagian tengah. Koloni bakteri diambil menggunakan jarum ose, kemudian dicampurkan dalam larutan H2O2 tersebut. Apabila muncul gelembung maka
koloni bakteri tersebut bersifat katalase positif dan sebaliknya jika tidak muncul gelembung (Gambar 4).
Uji oksidase. Uji katalase dilakukan pada kertas saring steril. Kertas ditetesi larutan tetramethyl-p-phenylenediamine dihydrochloride 1%. Koloni bakteri diambil menggunakan ujung pipet tips kemudian digoreskan pada kertas saring tersebut.
b a
a b
Gambar 3 Pengujian Gram, Isolat bakteri Gram negatif akan lengket apabila dicampurkan dengan KOH 3% (a) sedangkan Gram positif tidak lengket (b)
Apabila setelah 10 detik terjadi perubahan warna menjadi ungu maka koloni bakteri tersebut memiliki sifat oksidase positif (Gambar 5).
Uji oksidasi/fermentasi (O/F). Uji O/F dilakukan menggunakan media yang mengandung larutan glukosa 1% dalam tabung reaksi. Untuk sekali pengujian digunakan 2 tabung reaksi paralel. Kedua tabung diinokulasi bakteri dengan cara menusukkan inokulum bakteri umur 48 jam, dan diberi minyak parafin steril hingga ketinggian 1 cm pada salah satu tabung dan kedua tabung diinkubasikan pada suhu 27 ᵒC selama 24-48 jam. Terbentuknya warna pada kedua tabung mengindikasikan bakteri yang bersifat fermentatif (+/+). Terbentuknya warna hanya pada tabung tanpa minyak parafin mengindikasikan bakteri bersifat oksidatif (+/-). Sebagai kontrol, digunakan media yang sama tanpa glukosa diinokulasi bakteri dan media tanpa glukosa dan tanpa bakteri dengan dan tanpa lapisan minyak parafin (Gambar 6).
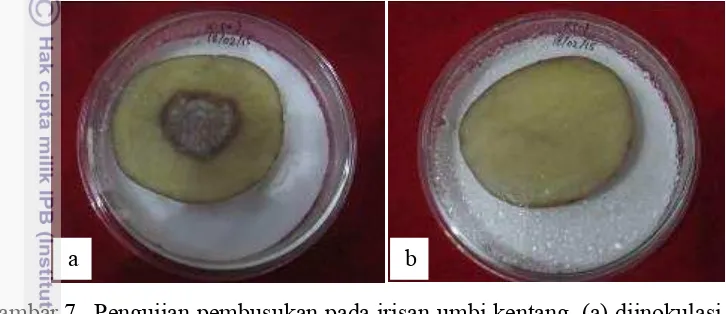
Uji pembusukan umbi kentang. Pada uji ini digunakan umbi kentang yang belum bertunas yang disterilisasi permukaannya menggunakan NaOCl 5% yang mengandung setetes deterjen selama 10 menit. Kentang dibilas dengan aquabides
a b c d e
-
+Gambar 5 Uji katalase positif (kanan) dan oksidase negative (kiri)
steril dan dikering anginkan pada suhu ruang. Umbi kentang diiris dengan ketebalan 7-8 mm menggunakan skalpel steril, kemudian setiap irisan diletakan dalam cawan petri yang sudah dialasi beberapa lembar kertas saring yang sudah dilembabkan. Permukaan umbi kentang tidak boleh basah. Kultur bakteri yang berumur 48 jam pada media NA kemudian dioleskan pada bagian tengah potongan umbi menggunakan jarum ose, kemudian diinkubasikan pada suhu ruang selama 48 jam. Jika positif E.chrysanthemi, maka kentang akan membusuk setelah 48 jam (Gambar 7).
Identifikasi bakteri berdasarkan penggunaan sumber karbon
Isolat bakteri yang memiliki ciri fisiologi mirip dengan E. chrysanthemi kemudian diidentifikasi berdasarkan penggunaan sumber karbon menggunakan GEN III OmniLog® ID System (Biolog, Hayward, CA, USA) yang telah divalidasi oleh Sandle et al. (2013). Koloni tunggal bakteri berumur 24-48 jam diambil menggunakan cotton swab steril secara vertikal pada permukaan agar kemudian digosokkan pada dinding tabung yang berisi inoculation fluid (IF-A) agar bakteri terlepas. Tabung dibolak-balik perlahan sehingga konsentrasi bakteri dalam larutan merata, selanjutnya kepadatan sel bakteri diukur menggunakan Biolog Turbidimeter. Kepadatan sel untuk bakteri aerobik yang disarankan oleh produsen alat adalah adalah 93-98% Transmisi (% T). Suspensi bakteri dimasukkan ke dalam GEN III Microplates TM sebanyak 100 µL per sumuran, kemudian diinkubasi pada suhu 33 °C selama 4 jam, apabila belum terjadi perubahan warna ungu pada mikroplat maka inkubasi dilanjutkan hingga 24 jam. Pembacaan hasil identifikasi menggunakan Biolog MicroStation Reader. Dalam pengujian ini disertakan juga isolat kontrol positif E. chrysanthemi asal tanaman anggrek (isolat milik Giyanto dan Refa Firgianto).
Perbandingan identitas isolat bakteri yang diuji dengan basis data akan terlihat pada nilai probability, similarity, dan distance. Nilai probability merupakan persentase kemungkinan kesamaan antara isolat yang diuji dengan basis data GEN III OmniLog ID System. Nilai similarity merupakan kemiripan pola hasil pengujian isolat dengan basis data dan nilainya untuk masing-masing organisme berbeda-beda. Nilai probability dan similarity berkisar antara 0-1 (0-100%). Identitas isolat valid apabila pada pembacaan hasil 4 jam pertama setelah inkubasi nilai similarity ≥ 0.75 (75%), akan tetapi apabila pembacaan hasil
a b
dilakukan setelah 24 jam maka nilai similarity ≥ 0.5 (50%). Nilai distance menunjukkan perbedaan hasil pengujian antara isolat sampel yang diuji dengan basis data Biolog yang berkisar antara 0-10, artinya apabila terdapat perbedaan lebih dari 10 sumuran uji, maka isolat bakteri yang diuji tidak dapat teridentifikasi.
Deteksi asam nukleat dengan polymerase chain reaction (PCR)
Deteksi asam nukleat dengan PCR dilakukan jika identifikasi berdasarkan uji fisiologi dan penggunaan sumber karbon menunjukkan hasil yang kurang jelas. DNA bakteri dideteksi dengan menggunakan primer spesifik E. chrysanthemi. Jika deteksi menggunakan primer spesifik E. chrysanthemi DNA tidak teramplifikasi, maka dilakukan deteksi DNA menggunakan primer universal 16S rRNA dan perunutan DNA.
Ekstraksi DNA. DNA diekstraksi berdasarkan metode yang telah dilakukan oleh Rahma (2013), yaitu dengan mengambil seujung pipet tips koloni bakteri, dimasukkan dalam tabung 1.5 mL yang berisi 100 µL ddH2O. Pada metode
sebelumya suspensi bakteri direbus selama 10 menit, sedangkan pada pengujian ini dilakukan pemanasan pada suhu 95 ºC selama 1 menit. Selanjutnya suspensi bakteri tersebut menjadi cetakan untuk reaksi PCR.
Amplifikasi DNA dengan primer spesifik E. chrysanthemi. Metode
amplifikasi berdasarkan Hseu et al. (2007) menggunakan primer spesifik E. chrysanthemi Ec3F (5’-AAA TGC TGG C(T/C)G GTA TGC CGT A-3’) dan
Ec4R (5’-CAG CGT CAG GAA CGG ACA TAC-3’). Proses amplifikasi dilakukan dengan tahapan sebagai berikut: satu siklus predenaturasi pada suhu 94
ᵒC selama 5 menit, 30 siklus yang terdiri atas tahap denaturasi DNA pada suhu 94
ᵒC selama 30 detik, tahap penempelan primer ke DNA target pada suhu 60 ᵒC selama 30 detik, dan tahap pemanjangan DNA pada suhu 72 ᵒC selama 30 detik, 1 siklus pemanjangan DNA pada suhu 72 ᵒC selama 10 menit yang diakhiri pada suhu 10 ᵒC untuk penyimpanan. Produk hasil amplifikasi akan berukuran 548 pb.
Amplifikasi DNA dengan primer universal 16S rRNA. Metode
amplifikasi menggunakan primer universal 16S DNA yaitu 27F (5’-AGA GTT TGA TCM TGG CTC AG -3’) dan 1429R (5’-CGG TTA CCT TGT TAC GAC TT-3’) dengan ukuran produk amplifikasi adalah ~1500 pb (Pradhap et al. 2011). Tahapan amplifikasi adalah sebagai berikut: satu siklus predenaturasi pada suhu 95 ᵒC selama 5 menit., 35 siklus yang terdiri atas tahap denaturasi DNA pada suhu 95 ᵒC selama 1 menit, tahap penempelan primer ke DNA target pada suhu 55 ᵒC selama 1 menit, dan tahap pemanjangan DNA pada suhu 72 ᵒC selama 2 menit, 1 siklus pemanjangan DNA pada suhu 72 ᵒC selama 10 menit yang diakhiri pada suhu 4 ᵒC untuk penyimpanan.
Reaksi PCR menggunakan total volume reaktan 25 µL yang terdiri atas 12.5
Perunutan DNA
DNA produk PCR dikirim ke First Base, Malaysia untuk dirunut sikuennya. Sikuen gen 16S DNA dibandingkan dengan sekuen DNA bakteri yang sama asal negara lain yang terdeposit dalam GenBank menggunakan program Basic Local Alignment Search Tool (BLAST) (www.ncbi.nlm.nih.gov). Homologi gen 16S DNA dilakukan menggunakan program ClustalW BioEdit yang dikalkulasi
HASIL DAN PEMBAHASAN
Gejala layu yang ditemukan di lapangan
Gejala layu yang ditemukan di lokasi pengambilan sampel bervariasi. Di Pangalengan pengambilan sampel dilakukan pada 2 petakan lahan yang berdekatan. Varietas tanaman kentang di kedua lokasi tersebut adalah Granola-L yang benihnya berasal dari Lembang. Pada petakan pertama umur tanaman sekitar 70 HST, daun tanaman yang bergejala layu menggulung ke atas, bagian pangkal batang berwarna coklat kehitaman. Beberapa umbi kentang ditemukan busuk dan terlihat adanya nekrosis setelah umbi dibelah. Pada petakan kedua umur tanaman sekitar 90 HST. Di lokasi ini gejala layu agak samar karena tanaman sudah mendekati panen, sehingga sebagian besar daun mulai berwarna kekuningan dan tepiannya mengering. Pangkal batang tanaman yang diambil sebagai sampel berwarna coklat kehitaman dan agak mengecil (Gambar 8a, e, dan i).
Pengambilan sampel di Garut juga dilakukan pada 2 petakan lahan yang berdekatan. Pada petakan pertama umur tanaman sekitar 70 HST, varietas tanaman kentang di lokasi ini adalah Atlantik asal Scotlandia yang benihnya disediakan oleh PT Indofood. Di lokasi ini tidak ditemukan gejala layu, semua tanaman terlihat sehat. Pada petakan kedua umur tanaman sekitar 60 HST, varietas kentang Granola-L. Pada bagian batang tanaman terlihat gejala busuk lunak. Beberapa umbi kentang yang ditemukan di lokasi ini bergejala busuk lunak dan tercium bau yang khas (Gambar 8b, f, dan j).
Pengambilan sampel di daerah Dieng dilakukan pada satu petakan lahan. Varietas tanaman kentang di lokasi ini adalah Granola, umur tanaman sekitar 50 HST. Pada lokasi ini tanaman yang bergejala layu menunjukkan pertumbuhan yang lebih lambat, tanaman terlihat lebih kecil dibandingkan dengan tanaman yang sehat. Gejala pada batang berupa busuk basah (Gambar 8c, g, dan k).
Di lokasi Malang juga ditemukan gejala penyakit yang diduga disebabkan oleh cendawan berupa bercak nekrosis kehitaman pada bagian tepi dan ujung daun, serta ditemukan lapisan kelabu-putih pada bagian bawah daun.
Insidensi E. chrysanthemi berdasarkan Uji Serologi
Hasil uji ELISA terhadap total 400 sampel tanaman kentang yang
menunjukkan gejala layu, sebanyak 105 sampel dinyatakan positif E. chrysanthemi. Insidensi sampel yang positif E. chrysanthemi pada lokasi
pengambilan sampel di Pangalengan, Garut, Malang, dan Dieng berturut-turut sebesar 3%, 1%, 3% dan 98% dari masing-masing 100 sampel.
Isolasi bakteri dilakukan terhadap seluruh sampel yang positif E. chrysanthemi, kecuali sampel yang berasal dari Malang dan Dieng. Hanya 2
dari 3 sampel asal Malang yang masih dapat diisolasi karena kondisi sampelnya sudah sangat kering. Dari lokasi Dieng hanya diisolasi 4 sampel yang memiliki NAE tertinggi, sehingga total sampel yang diisolasi bakterinya ada 10 sampel yaitu 35P, 49P, 96P, 71G, 12M, 14M, 3D, 11D, 23D, dan 44D (angka didepan:
nomor sampel; huruf kapital menunjukkan lokasi pengambilan sampel; P, Pengalengan; G, Garut; M, Malang dan D, Dieng).
a b c d
e h
j k
g f
i l
Isolasi dan Pemurnian Isolat
Sebanyak 37 isolat berhasil diisolasi dari 10 sampel tanaman yang positif E. chrysanthemi berdasarkan uji serologi yaitu: 35P (5 isolat), 49P (2 isolat), 96P (3 isolat), 71G (8 isolat), 12M (5 isolat), 14M (4 isolat), 3D (2 isolat), 11D (2 isolat), 23D (2 isolat), dan 44D (4 isolat) (Tabel 2).
Dari semua isolat bakteri yang berhasil diisolasi dari tanaman kentang sakit
tidak diperoleh isolat yang memiliki ciri morfologi seperti kontrol positif E. chrysanthemi, sehingga semua isolat disertakan dalam uji hipersensitivitas.
Tabel 2 Ciri morfologi isolat bakteri asal tanaman kentang
No Asal Sampel Nama Isolat Deskripsi Koloni
1 Pangalengan 35P-1 Koloni sedang, krem kekuningan, mengkilat 2 Pangalengan 35P-2 Koloni melebar, krem agak kusam
3 Pangalengan 35P-3 Koloni sedang, putih krem 4 Pangalengan 35P-4 Koloni sedang, putih krem 5 Pangalengan 35P-5 Koloni besar, melebar, putih krem 6 Pangalengan 49P-1 Koloni sedang, pink
7 Pangalengan 49P-5 Koloni sedang, putih krem 8 Pangalengan 96P-1 Koloni kecil, putih krem 9 Pangalengan 96P-2 Koloni kecil, putih krem 10 Pangalengan 96P-3 Koloni sedang, putih krem
11 Garut 71G-1 Koloni sedang, melebar, kuning tepian putih
12 Garut 71G-2 Koloni sedang dan besar, putih kusam, tepian putih melebar 13 Garut 71G-3 Koloni sedang dan besar, putih kusam, tepian putih melebar 14 Garut 71G-4 Koloni sedang dan besar, putih kusam, tepian putih melebar 15 Garut 71G-5 Koloni sedang, melebar, putih kusam kekuningan
16 Garut 71G-6 Koloni sedang, kuning tepian putih 17 Garut 71G-7 Koloni sedang, kuning tepian putih
18 Garut 71G-8 Koloni sedang dan besar, putih kusam, tepian putih melebar 19 Dieng 3D-2 Koloni sedang, putih keruh
20 Dieng 3D-3 Koloni sedang, putih keruh 21 Dieng 11D-1 Koloni sedang, putih keruh 22 Dieng 11D-2 Koloni sedang, putih keruh 23 Dieng 23D-2 Koloni sedang, putih keruh 24 Dieng 23D-3 Koloni sedang, putih keruh 25 Dieng 44D-1 Koloni sedang, putih keruh 26 Dieng 44D-2 Koloni sedang, putih keruh 27 Dieng 44D-3 Koloni sedang, putih keruh 28 Dieng 44D-4 Koloni sedang, putih keruh
29 Malang 12M-1 Koloni sedang dan besar, putih krem 30 Malang 12M-2 Koloni sedang dan besar, putih krem 31 Malang 12M-3 Koloni sedang dan besar, putih krem 32 Malang 12M-4 Koloni sedang dan besar, putih krem 33 Malang 12M-5 Koloni sedang dan besar, putih krem
34 Malang 14M-1 Koloni sedang dan besar, melebar, krem kuning 35 Malang 14M-4 Koloni sedang, melebar, putih kusam
36 Malang 14M-6 Koloni kecil dan sedang, krem kekuningan, melebar 37 Malang 14M-9 Koloni kecil dan sedang, putih keruh
38 Kontrol (+)* K (+) Koloni sedang, putih krem, tepian bening
Uji Hipersensitivitas
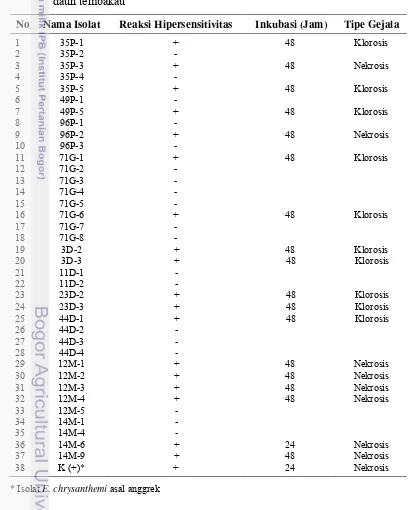
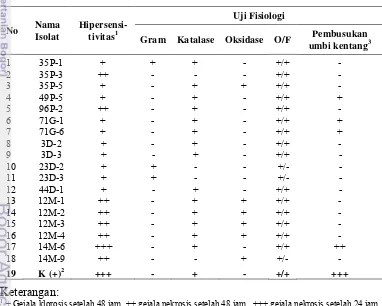
Sebanyak 18 dari 37 isolat menunjukkan reaksi lesio lokal pada tanaman tembakau dengan reaksi yang beragam. Hanya isolat 14M-6 yang menghasilkan lesio lokal nekrosis setelah 24 jam seperti kontrol positif. Isolat 35P-3, 96P-2, 12M-1, 12M-2, 12M-3, 12M-4, dan 14M-9 menimbulkan nekrosis setelah 48 jam, sedangkan isolat 35P-1, 35P-5, 49P-5, 71G-1, 71G-6, 3D-2, 3D-3, 23D-2, 23D-3, dan 44D-1 (angka didepan: nomor sampel; huruf kapital menunjukkan lokasi pengambilan sampel P, Pengalengan; G, Garut; M, Malang dan D, Dieng; angka di belakang: nomor koloni) hanya menimbulkan klorosis setelah 48 jam (Tabel 3; Gambar 9). Selanjutnya 19 isolat tersebut diuji sifat-sifat fisiologinya.
Tabel 3 Hasil pengujian hipersensitivitas isolat bakteri asal tanaman kentang pada daun tembakau
No Nama Isolat Reaksi Hipersensitivitas Inkubasi (Jam) Tipe Gejala
1 35P-1 + 48 Klorosis
Identifikasi Isolat yang diduga E. chrysanthemi
Uji fisiologi
Berdasarkan hasil uji fisiologi diketahui bahwa dari 18 isolat bakteri yang positif HR terdapat 4 isolat yang memiliki ciri-ciri fisiologi mirip dengan genus Erwinia yaitu isolat 49P-5, 71G-1, 71G-6, dan 14M-6 (Tabel 4).
Tabel 4 Hasil pengujian patogenisitas dan fisiologi isolat bakteri asal tanaman kentang dari beberapa sentra pertanaman kentang di Jawa
No Nama Isolat
Hipersensi-tivitas1
Uji Fisiologi
Pemanfaatan sumber karbon
Berdasarkan uji pemanfaatan sumber karbon menggunakan GEN III OmniLog ID System, keempat isolat bakteri tersebut teridentifikasi sebagai Flavimonas oryzihabitans, Pantoea dispersa, Pantoea agglomerans, dan Pseudomonas syringae pv. primulae (Tabel 5).
Tabel 5 Hasil identifikasi isolat bakteri asal tanaman kentang berdasarkan pemanfaatan sumber karbon dengan GEN III OmniLog ID System
a
PROB: probability; b SIM: similarity; c DIST: distance Nilai PROB dan SIM berkisar antara 0-1 (0-100%)
Nilai DIST berkisar antara 0-10 (jika >10 maka isolat yang diuji tidak dapat teridentifikasi)
Berdasarkan pemanfaatan sumber karbon, isolat bakteri yang diuji terdiri atas 2 kelompok yaitu genus Pseudomonas (sinonim Flavimonas) dan Pantoea. Setelah dibandingan antara masing-masing isolat dengan basis data patogen pada GEN III OmniLog ID System, terdapat perbedaan hasil pengujian yang cukup tinggi; nilai DIST berkisar antara 3-6, dengan nilai SIM berkisar antara 54.8-64.6%. Dengan hasil tersebut kedekatan keempat isolat ditunjukkan dalam Gambar 10.
Gambar 10 Dendogram hasil pengujian GEN III OmniLog ID System terhadap
beberapa isolat asal tanaman kentang dan kontrol positif E. chrysanthemi
Berdasarkan pemanfaatan sumber karbon dengan GEN III OmniLog ID System kontrol positif E. chrysanthemi teridentifikasi sebagai D. chrysanthemi, sedangkan melalui perunutan basa nukleotida gen 16S rRNA isolat tersebut teridentifikasi sebagai Dickeya dadantii (Giyanto dan Refa Firgianto 2015, komunikasi pribadi). Perbedaan ini disebabkan karena pada basis data GEN III OmniLog ID System, spesies Dickeya yang terdaftar hingga tahun 2013 hanya D. chrysanthemi, sedangkan menurut reklasifikasi terbaru yang diusulkan oleh Samson et al. (2005) terdapat setidaknya 7 spesies Dickeya. Sehingga apabila isolat Dickeya spp. diuji, apapun spesiesnya maka akan teridentifikasi sebagai
Isolat Spesies PROBa (%) SIMb (%) DISTc
49P-5 Flavimonas oryzihabitans 64.6 64.6 5.161
71G-1 Pantoea dispersa 84.7 64.1 3.410
Pseudomonas syringae pv. primulae (14M-6) Dickeya chrysanthemi (K+)
Pantoea dispersa (71G-1)
Pantoea agglomerans (71G-6)
D. chrysanthemi. Hasil identifikasi berdasarkan pemanfaatan sumber karbon, tidak ada satu pun isolat yang teridentifikasi sebagai E. chrysanthemi, padahal ciri-ciri fisiologi menunjukkan genus Erwinia. Hal ini karena identifikasi dengan GEN III OmniLog ID System terbatas pada spesies yang ada dalam basis data. Oleh karena itu identitas keempat bakteri perlu dikonfirmasi dengan deteksi DNA melalui PCR (menggunakan primer spesifik) dan jika hasilnya negatif, deteksi dilakukan terhadap gen 16S rRNA.
Deteksi molekuler
Konfirmasi hasil uji fisiologi dan GEN III OmniLog ID System terhadap isolat dilakukan dengan PCR menggunakan primer spesifik E. chrysanthemi. Hasil deteksi tersebut menunjukkan bahwa keempat isolat adalah spesies bakteri selain E. chrysanthemi karena tidak ada DNA yang teramplifikasi (Gambar 11a). Hasil yang sama juga ditunjukkan oleh PCR DNA dari tanaman sakit (data tidak ditampilkan). Oleh karena tidak diketahui identitas bakteri tersebut, maka dilakukan deteksi 16S DNA keempat isolat dan keempat isolat bakteri berhasil teramplifikasi gen 16S DNAnya dengan ukuran ± 1500 pb (Gambar 11b ).
Gambar 11 Visualisasi hasil PCR menggunakan primer spesifik E. chrysanthemi (a) dan primer universal 16S rRNA (b). M = penanda DNA(a)100 pb dan (b) = 1 Kb (Thermo Scientific). Kolom 1= isolat 49P-5, 2= isolat 71G-1, 3= isolat 71G-6, 4= isolat 14M-6, K(-) = control negatif, K(+) =E.chrysanthemi
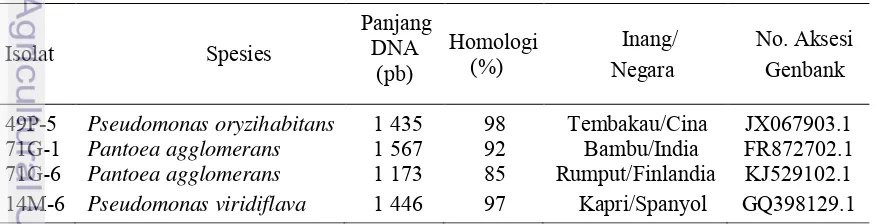
Hasil perunutan gen 16S DNA isolat 49P-5, 71G-1, 71G-6, dan 14M-6 berturut-turut memiliki homologi tertinggi dengan Pseudomonas oryzihabitans, Pantoea agglomerans, dan Pseudomonas viridiflava. Homologi Pseudomonas oryzihabitans dan Pseudomonas viridiflava cukup tinggi terhadap isolat yang telah dideposit di Genbank (Tabel 6).
Tabel 6 Hasil BLAST nukleotida 16S rRNA isolat bakteri asal tanaman kentang
Isolat Spesies
49P-5 Pseudomonas oryzihabitans 1 435 98 Tembakau/Cina JX067903.1
71G-1 Pantoea agglomerans 1 567 92 Bambu/India FR872702.1
71G-6 Pantoea agglomerans 1 173 85 Rumput/Finlandia KJ529102.1
14M-6 Pseudomonas viridiflava 1 446 97 Kapri/Spanyol GQ398129.1
1500 pb 548 pb
b
a
K-Tabel 7 Homologi sikuen nukleotida gen 16S DNA isolat 49P-5, 71G-1, 71G-6, dan 14M-6 dengan isolat-isolat dari negara lain
a
Homologi sikuen nukleotida isolat 49P-5, 71G-1, 71G-6, dan 14M-6 dihitung menggunakan program Bioedit versi 6.05
Meskipun memiliki identitas yang sama, homologi antara isolat 71G-1 dan 71G-6 hanya sekitar 71.9%. P. agglomerans seringkali terdeteksi sebagai kompleks P.agglomerans-Erwinia herbicola-Enterobacter agglomerans, sehingga untuk menentukan identitasnya berdasarkan analisa gen 16S rRNA minimal harus memiliki homologi 97% dengan isolat bakteri yang telah dideposit di GenBank (Rezzonico et al. 2010).
Homologi sikuen nukleotida isolat 49P-5, 71G-1, 71G-6, dan 14M-6 rendah jika dibandingkan dengan isolat E. chrysanthemi asal kentang dari Papua Nugini (PNG) (Tabel 7). Hal ini menunjukkan bahwa keempat isolat tersebut bukan
P. oryzihabitans strain Y75 Tembakau/Cina 98.5 JX067903.1
P. oryzihabitans Tanah/USA 98.5 Q661238.1
P. oryzihabitans Padi/ Afghanistan 98.3 LC015573.1
P. oryzihabitans Jarak pagar/ Singapura 98.3 JQ660200.1
P. oryzihabitans Salsa/ Cina 98.5 HM038118.1
Erwinia chrysanthemi Kentang/ Papua Nugini 84.1 EF530559.1
71G-1 Kentang/Indonesia ID -
Erwinia herbicola ATCC 33243T 80.2 EHU80202
P. agglomerans isolat HTC2 Bambu/India 80.5 FR872702.1
P . agglomerans strainPGHL22 Jagung/Mexico 80.4 EF050808.1
P. agglomerans strain U2-22 Rapa/China 80.2 EU849108.1
P. agglomerans strain Sc-4 Kapas/USA 80.4 AY924376.1
Erwinia chrysanthemi Kentang/Papua Nugini 76.6 EF530559.1
71G-6 Kentang/Indonesia ID -
P. agglomerans strain SGS9 Rumput/ Finlandia 83.4 KJ529102.1
P. agglomerans ATY79 Akar Jeruk/USA 83.8 HQ219998.1
P. agglomerans strain +Y16 Tembakau/ Cina 83.6 JX134632.1
Pantoea vagans strain +Y41 Tembakau/ Cina 83.8 JX094940.1
Pantoea brenneri strain +Y31 Tembakau /Cina 83.6 JX113245.1
Erwinia chrysanthemi Kentang/Papua Nugini 78.8 EF530559.1
14M-6 Kentang/Indonesia ID -
P. viridiflava strain 45 Kapri/Spanyol 96.9 GQ398129.1
P. viridiflava strain PE31 Jagung/Polandia 96.9 KJ127245.1
P. viridiflava Rapa/Korea Selatan 96.9 NR117825.1
P. viridiflava strain NZCX09 Wortel/Selandia Baru 96.9 AF364097.1
P. viridiflava strain TPNO2 Tomat/Taiwan 96.3 KM357830.1