ABSTRACT
AYU SYLVITA AMANDA. Differential of Leucocytes and Neutrophil/Lymphocyte (N/L) Ratio of Female Swamp Buffaloes (Bubalus bubalis). Under direction of HERA MAHESHWARI and ARYANI SISMIN SATYANINGTIJAS.
The goal of this research was to study the total number of leucocytes and its variant of leucocytes, also neutrophil/lymphocyte (N/L) ratio as stress index of four female swamp buffaloes for ten weeks. Blood sampling was done every two days for ten weeks. Blood samples were collected from jugularis veinby using an EDTA coated tube. White blood cells was counted on hemocytometer and the blood smears were stained by Giemsa to count the number of total variant of leukocytes. The average of total number of leucocyte was 10845,89±2518,20 cells/mm3, neutrophil was 6084,29±2214,96 cells/mm3, eosinophil was 170,88±156,77 cells/mm3, monocyte was 231,65±172,89 cells/mm3, dan lymphocyte was 4361,17±1926,58 cells/mm3. Neutrophil/lymphocyte (N/L) ratio was 1,76±1,13.
ABSTRAK
AYU SYLVITA AMANDA. Diferensial Leukosit dan Rasio Neutrofil/Limfosit (N/L) pada Kerbau Lumpur (Bubalus bubalis) Betina. Dibimbing oleh HERA MAHESHWARI dan ARYANI SISMIN SATYANINGTIJAS.
Penelitian ini dilakukan untuk mengetahui jumlah total leukosit, jenis-jenis leukosit, dan rasio neutrofil/limfosit (N/L) sebagai indeks stres pada kerbau lumpur (Bubalus bubalis) betina selama sepuluh minggu. Darah kerbau lumpur diambil setiap dua hari sekali selama sepuluh minggu. Darah diambil melalui vena jugularis menggunakan tabung berisi EDTA. Sel darah putih dihitung dengan kamar hitung (hemocytometer) dan preparat ulas darah untuk menghitung jenis leukosit diwarnai dengan pewarnaan giemsa. Rataan dari total leukosit adalah 10845,89±2518,20 sel/mm3, dengan total neutrofil 6084,29±2214,96 sel/mm3, eosinofil 170,88±156,77 sel/mm3, monosit 231,65±172,89 sel/mm3, dan limfosit 4361,17±1926,58 sel/mm3. Rasio N/L pada kerbau 1,76±1,13.
DIFERENSIAL LEUKOSIT DAN RASIO
NEUTROFIL/LIMFOSIT (N/L) PADA KERBAU LUMPUR
(
Bubalus bubalis
) BETINA
AYU SYLVITA AMANDA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Diferensial Leukosit dan Rasio
Neutrofil/Limfosit (N/L) pada Kerbau Lumpur (Bubalus bubalis) Betina adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam
bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
ABSTRACT
AYU SYLVITA AMANDA. Differential of Leucocytes and Neutrophil/Lymphocyte (N/L) Ratio of Female Swamp Buffaloes (Bubalus bubalis). Under direction of HERA MAHESHWARI and ARYANI SISMIN SATYANINGTIJAS.
The goal of this research was to study the total number of leucocytes and its variant of leucocytes, also neutrophil/lymphocyte (N/L) ratio as stress index of four female swamp buffaloes for ten weeks. Blood sampling was done every two days for ten weeks. Blood samples were collected from jugularis veinby using an EDTA coated tube. White blood cells was counted on hemocytometer and the blood smears were stained by Giemsa to count the number of total variant of leukocytes. The average of total number of leucocyte was 10845,89±2518,20 cells/mm3, neutrophil was 6084,29±2214,96 cells/mm3, eosinophil was 170,88±156,77 cells/mm3, monocyte was 231,65±172,89 cells/mm3, dan lymphocyte was 4361,17±1926,58 cells/mm3. Neutrophil/lymphocyte (N/L) ratio was 1,76±1,13.
ABSTRAK
AYU SYLVITA AMANDA. Diferensial Leukosit dan Rasio Neutrofil/Limfosit (N/L) pada Kerbau Lumpur (Bubalus bubalis) Betina. Dibimbing oleh HERA MAHESHWARI dan ARYANI SISMIN SATYANINGTIJAS.
Penelitian ini dilakukan untuk mengetahui jumlah total leukosit, jenis-jenis leukosit, dan rasio neutrofil/limfosit (N/L) sebagai indeks stres pada kerbau lumpur (Bubalus bubalis) betina selama sepuluh minggu. Darah kerbau lumpur diambil setiap dua hari sekali selama sepuluh minggu. Darah diambil melalui vena jugularis menggunakan tabung berisi EDTA. Sel darah putih dihitung dengan kamar hitung (hemocytometer) dan preparat ulas darah untuk menghitung jenis leukosit diwarnai dengan pewarnaan giemsa. Rataan dari total leukosit adalah 10845,89±2518,20 sel/mm3, dengan total neutrofil 6084,29±2214,96 sel/mm3, eosinofil 170,88±156,77 sel/mm3, monosit 231,65±172,89 sel/mm3, dan limfosit 4361,17±1926,58 sel/mm3. Rasio N/L pada kerbau 1,76±1,13.
©Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penuisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
DIFERENSIAL LEUKOSIT DAN RASIO
NEUTROFIL/LIMFOSIT (N/L) PADA KERBAU LUMPUR
(
Bubalus bubalis
) BETINA
AYU SYLVITA AMANDA
Skripsi
Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
JudulSkripsi : Diferensial Leukosit dan Rasio Neutrofil/Limfosit pada Kerbau Lumpur (Bubalus bubalis) Betina.
Nama Penulis : Ayu Sylvita Amanda
NRP : B04080168
Disetujui,
DosenPembimbing I DosenPembimbing II
Dr. Drh. Hera Maheshwari, M.Sc., AIF Dr. Drh. Aryani Sismin S., M. Sc. AIF NIP. 19640526 198403 1 001 NIP. 19600914 198603 2 001
Diketahui
WakilDekanFakultasKedokteranHewan
Drh. AgusSetyono M. S, Ph. D APVet NIP. 19630810 198803 1 004
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga skripsi ini dapat terselesaikan. Penelitian dilaksanakan sejak bulan Mei sampai Agustus 2011. Skripsi yang berjudul “Diferensial Leukosit dan Rasio Neutrofil/Limfosit (N/L) pada Kerbau Lumpur (Bubalus bubalis) Betina”
merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. drh. Hera Maheshwari, M. Sc dan Dr. drh. Aryani Sismin Satyaningtijas, M.Sc. selaku pembimbing yang telah banyak memberi saran dan kritik. Penulis juga menyampaikan terima kasih kepada teman-teman satu penelitian, Ibu Ida, Ibu Sri, dan Bapak Kosasih yang telah membantu selama penelitian. Penulis mempersembahkan skripsi ini kepada Ayahanda dan Ibunda tercinta, Akhmad Munawar dan Misna Darlena atas segala perjuangan beliau membesarkan dan mendidik penulis selama ini, serta seluruh keluarga dan sahabat yang telah mendoakan.
Penulis berharap semoga skripsi ini bermanfaat bagi semua pihak yang membutuhkannya dan mudah-mudahan bermanfaat untuk dunia kedokteran hewan Indonesia.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Sukajadi pada tanggal 10 Juni 1991 sebagai anak pertama dari dua bersaudara, dari ayah yang bernama Akhmad Munawar dan ibu Misna Darlena. Penulis menempuh pendidikan di Sekolah Menengah Atas Negeri 1 Pangkalan Balai-Kabupaten Banyuasin mulai tahun 2005 sampai tahun 2008. Penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan-Institut Pertanian Bogor pada tahun 2008 melalui jalur Seleksi Nasional Masuk Perguruan
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA... 3
Tinjauan Umum Kerbau ... 3
Darah ... 5
Neutrofil ... 8
Eosinofil ... 9
Basofil ... 11
Monosit ... 12
Limfosit ... 13
Stres ... 15
METODOLOGI PENELITIAN ... 17
Waktu dan Tempat Penelitian ... 17
Materi Penelitian ... 17
Hewan coba ... 17
Alat dan bahan... 17
Metode Penelitian... 17
Tahap Persiapan ... 17
Pengambilan darah kerbau ... 17
Penghitungan jumlah leukosit ... 18
Pembuatan preparat ulas darah dan diferensial leukosit ... 19
Analisis Data ... 19
HASIL DAN PEMBAHASAN ... 20
Leukosit ... 20
Neutrofil ... 22
Basofil ... 25
Monosit ... 25
Limfosit ... 27
Neutrofil/limfosit... 28
SIMPULAN DAN SARAN ... 30
Simpulan ... 30
Saran ... 30
DAFTAR TABEL
Halaman
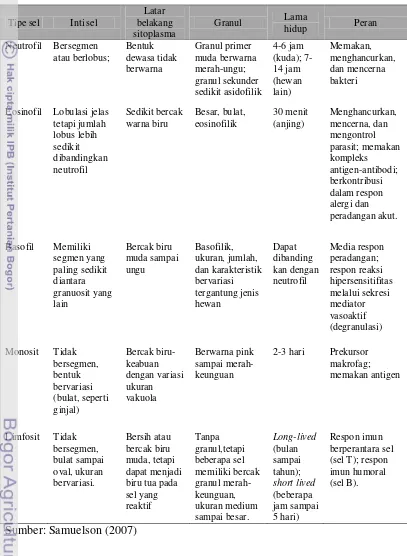
1 Karakteristik jenis-jenis sel darah putih ... 7 2 Rataan jumlah leukosit, jenis-jenis leukosit, dan rasio N/L kerbau rawa
DAFTAR GAMBAR
Halaman
1 Neutrofil ... 8
2 Eosinofil ... 10
3 Basofil ... 11
4 Monosit ... 12
5 Limfosit ... 14
6 Kamar hitung (hemocytometer) ... 18
7 Jumlah leukosit kerbau rawa selama sepuluh minggu ... 20
8 Neutrofil... 22
9 Jumlah neutrofil kerbau rawa selama sepuluh minggu ... 23
10 Eosinofil ... 24
11 Jumlah eosinofil kerbau rawa selama sepuluh minggu ... 24
12 Monosit ... 26
13 Jumlah monosit kerbau rawa selama sepuluh minggu ... 26
14 Limfosit ... 27
15 Jumlah limfosit kerbau rawa selama sepuluh minggu ... 28
PENDAHULUAN
Latar Belakang
Indonesia memiliki plasma nutfah yang berlimpah termasuk hewan ruminansia besar maupun kecil yang sangat berguna bagi kehidupan sehari-hari, terutama ruminansia besar seperti kerbau. Perkembangan populasi kerbau di Indonesia kurang menggembirakan karena selama 70 tahun, dari tahun 1923 sampai tahun 1993 populasi kerbau hanya mengalami sedikit peningkatan, yaitu
dari 2.146.437 ekor menjadi 3.060.300 ekor. Berdasarkan data statistik tahun 2006-2011, jumlah kerbau di Indonesia mengalami angka yang fluktuatif. Pada tahun 2006-2008, jumlah kerbau terus menurun, namun pada tahun 2009 dan 2010 mengalami peningkatan, angka sementara pada tahun 2011 adalah 1.305.000 ekor (Ditjennak 2010). Jumlah populasi ini tidak lepas dari pengaruh faktor internal dan faktor eksternal terhadap produksi dan reproduksi kerbau. Faktor internal yang mempengaruhi misalnya berahi diam (silent heat), lama kebuntingan, panjang jarak antar kelahiran (calving interval), dan tingkat kematian yang cukup tinggi pada anak kerbau. Sementara itu, faktor eksternal yang mempengaruhi jumlah populasi yaitu keterbatasan bibit unggul, kualitas pakan yang rendah, perkawinan silang dalam (inbreeding), keterbatasan modal, kelangkaan tenaga, kurangnya pengetahuan ternak tentang produksi kerbau serta kurang tersedianya tenaga penyuluh dan teknologi tepat guna (Suryana 2007).
Pencegahan dan pengendalian terhadap penyakit dilakukan sebagai salah satu usaha untuk menanggulangi faktor internal dan eksternal pada kerbau, sehingga dapat mewujudkan program swasembada daging dan penyediaan daging aman, sehat, utuh, dan halal (ASUH). Kesehatan hewan menjadi penting karena jika terdapat infeksi penyakit, dikhawatirkan akan dapat mengganggu kesehatan
Respon pertahanan tubuh terhadap penyakit terdiri atas berbagai cara, salah satunya adalah sistem pertahanan yang dilakukan oleh sel darah putih (leukosit) (Frandson 1992). Sel darah putih dapat melakukan perannya dalam sistem pertahanan melalui jenis-jenis sel yang dimiliki seperti limfosit, monosit, neutrofil, eosinofil, dan basofil. Masing-masing jenis sel darah putih ini memiliki fungsi yang berbeda-beda di dalam menjalankan mekanisme pertahanan tubuh. Indikasi adanya stres, infeksi atau kelainan dalam tubuh karena suatu penyakit dapat dilihat dari perubahan jumlah sel darah putih secara keseluruhan atau salah satu dari jenis sel darah putih. Kesehatan hewan ini erat kaitannya dengan kondisi fisiologis seekor hewan, oleh karena itu, aspek kesehatan hewan harus dijaga. Salah satu penegakan diagnosa adanya penyakit adalah melakukan pemeriksaan darah. Penelitian ini mengulas tentang pemeriksaan sel darah putih dan komponennya sebagai data dasar kerbau lumpur dan untuk mengetahui status
kesehatannya.
Tujuan
Tujuan penelitian ini adalah untuk mengetahui jumlah rataan leukosit, neutrofil, eosinofil, basofil, monosit, dan limfosit, serta melihat indeks stres kerbau lumpur.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tinjauan Umum Kerbau
Menurut Bhattacharya (1993), semua kerbau domestik diduga berevolusi dari arni (Bubalus arnee) yaitu kerbau liar dari India yang masih dijumpai di hutan-hutan di daerah Assam. Domestikasi kerbau sudah terjadi sejak lama dan tidak diketahui pasti kapan terjadinya. Namun, penemuan-penemuan arkeologis di India menyatakan bahwa kerbau didomestikasi sekitar 4500 tahun yang lalu. Berdasarkan tipe habitatnya, kerbau dibedakan menjadi kerbau sungai (river buffalo) dan kerbau lumpur (swamp buffalo). Kerbau sungai lebih menyukai berada di air yang bersih dan mengalir, sedangkan kerbau lumpur lebih suka berada di lumpur, rawa-rawa, dan air yang menggenang (Bhattacharya 1993). Kedua kerbau ini merupakan kerbau Asia yang didomestikasi dan memiliki
jumlah kromosom yang berbeda, yaitu 48 kromosom untuk kerbau lumpur dan 50 kromosom untuk kerbau sungai (Bahri & Talib 2008).
Kerbau tersebar di beberapa propinsi di Indonesia, mulai dari populasi terbanyak sampai terendah secara berturut-turut yaitu di Nanggroe Aceh Darussalam, Sumatera Barat, Sumatera Utara, Sulawesi Selatan, Nusa Tenggara Barat, Maluku, dan Papua (Ditjennak 2010). Penyebaran populasi ini merupakan dampak dari adanya zona ideal bagi kerbau untuk dapat hidup dan beradaptasi. Berdasarkan data statistik Direktorat Jendral Peternakan, populasi kerbau lebih banyak terdapat di daerah pulau Sumatera yang relatif memiliki musim panas lebih singkat dan berudara relatif lembab. Kondisi demikianlah yang menjadi kemungkinan populasi kerbau lebih banyak terdapat di daerah Indonesia bagian barat dari pada di Indonesia bagian timur (Bamualim & Muhammad 2008).
Kingdom : Animalia Filum : Chordata Kelas : Mamalia Ordo : Artiodactyla Subordo : Ruminansia Famili : Bovidae Genus : Bubalus
Spesies : Bubalus bubalis
Secara fenotip, kerbau memiliki tulang yang besar, agak kompak dengan badan yang tergantung rendah pada kaki yang kuat dan kuku yang besar. Kerbau tidak mempunyai glambir maupun punuk. Kerbau mempunyai tanduk yang lebih padat dibandingkan dengan sapi, bahkan beberapa jenis dapat dibedakan melalui
bentuk tanduk yang khas (Bhattacharya 1993). Ketika lahir, kulit kerbau berwarna abu-abu. Tanduk, kaki, dan rambut secara normal memiliki warna yang sama
dengan kulit, tetapi cenderung sedikit gelap. Pada kerbau sungai, warna rambut biasanya hitam. Kerbau lumpur biasanya memiliki kaki yang berwarna putih atau abu-abu terang dan garis putih atau abu-abu terang menyerupai kalung di bawah dagu dan leher (Robbani 2009).
Kerbau merupakan hewan tropik yang memiliki daya tahan rendah terhadap panas. Oleh karena itu, kerbau lebih suka berkubang dan sebaiknya berada di daerah dengan suhu relatif rendah. Hasil penelitian menyatakan bahwa zona paling ideal bagi kerbau untuk bermukim yakni pada kisaran suhu 16o-24oC, dengan batas toleransi 27,6oC. Suhu tubuh kerbau dalam kisaran normal 37,4o -37,8oC, pulsus jantung 38,6-44,7 kali/menit, dan respirasi 25,6-29,4 kali/menit (Bamualim & Muhammad 2008). Adaptasi kerbau lumpur terhadap panas lebih rendah dibandingkan dengan kerbau sungai. Kerbau lumpur membutuhkan air yang lebih banyak dan tidak terbatas untuk mempertahankan agar dirinya tetap sejuk. Kerbau memiliki kulit yang gelap dan rambut yang jarang, sehingga absorbsi panas pada tubuhnya akan lebih besar. Kemampuan evaporasi pendinginan dari tubuh kerbau kurang efisien dikarenakan kemampuan berkeringat yang rendah. Oleh karena itu, kerbau yang dipekerjakan di bawah
sinar matahari langsung akan menunjukkan tanda-tanda sakit. Jika dibandingkan dengan sapi, kemampuan adaptasi kerbau terhadap panas memang lebih baik,
namun pada kondisi dingin sapi mampu beradaptasi lebih baik (Bhattacharya 1993).
Perbedaan yang cukup mencolok antara kerbau dan sapi dapat dilihat dari tingkat efisiensi pakan. Kerbau dapat bertahan hidup dengan kondisi pakan yang berkualitas rendah. Kelebihan ini dapat menjadi keuntungan bagi peternak karena dengan input yang rendah dapat menghasilkan output yang tinggi. Kerbau juga memiliki daya adaptasi yang besar, misalnya pada kondisi dimana terdapat banyak jerami atau rumput air yang tidak dimakan oleh sapi, maka kerbau akan tetap memakan pakan tersebut. Pada kondisi seperti ini, sapi akan memburuk kondisinya, sedangkan kerbau dapat terus bertahan (Bhattacharya 1993).
Darah
(leukosit), dan trombosit (platelet). Bentuk cairan dan padatan ini dapat dipisahkan melalui sentrifugasi. Bentuk cairan lebih ringan dibandingkan dengan bentuk padatan, oleh karena itu pada tabung sentrifugasi (centrifuge tube) plasma terletak dibagian atas dari bentuk padatan (Cunningham & Klein 2007).
Sebagian besar sel-sel darah beredar di pembuluh darah. Eritrosit dan trombosit tidak dapat menembus pembuluh darah, sedangkan leukosit dapat bermigrasi ke jaringan dengan cara menembus pembuluh darah untuk melakukan pertahanan terhadap infeksi. Leukosit merupakan sel darah yang istimewa karena merupakan satu-satunya sel darah mamalia yang bernukleus dan memiliki organel. Leukosit tidak mengandung hemoglobin (Hb). Meskipun jumlahnya hanya 1% dari volume darah, namun leukosit adalah komponen yang sangat penting dalam sistem imun (Akers & Denbow 2008).
Leukosit, terutama neutrofil, dapat meninggalkan sistem sirkulasi dan
keluar dari pembuluh darah melalui proses yang disebut emigrasi. Menurut Akers & Denbow (2008) proses emigrasi ini terdiri atas beberapa tahap yaitu:
1. Di dekat daerah peradangan atau inflamasi, sel-sel endotel kapiler mengeluarkan molekul adhesi yang dinamakan selektin pada permukaannya. Neutrofil juga memiliki molekul adhesi yang dinamakan integrin pada permukaannya yang dapat mengenali selektin. Hal ini akan menyebabkan leukosit berbaris pada permukaan dalam kapiler di dekat daerah peradangan. Proses ini disebut marginasi.
2. Leukosit dapat bergerak keluar kapiler melalui proses yang disebut diapedesis.
3. Setelah meninggalkan aliran darah, leukosit bermigrasi secara amoeboid mengikuti sinyal kimia yang dihasilkan oleh jaringan yang rusak. Proses demikian disebut kemotaksis positif.
4. Neutrofil dan makrofag akan menjadi fagosit dan mencerna bakteri dan sel-sel yang mati.
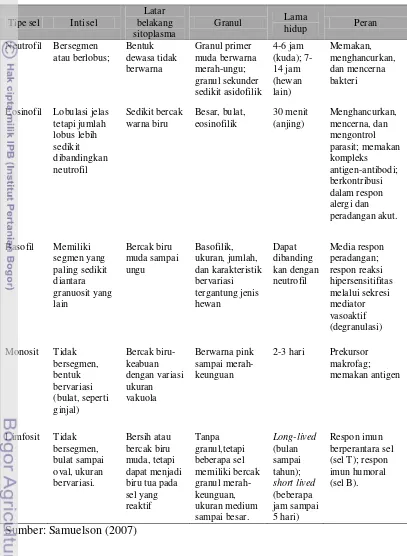
ada granul pada sitoplasma, terdiri atas monosit dan limfosit (Samuelson 2007). Karakteristik jenis-jenis sel darah putih secara singkat dapat dilihat pada Tabel 1.
Tabel 1 Karakteristik Jenis-Jenis Sel Darah Putih
Neutrofil
Neutrofil merupakan komponen terbanyak dari leukosit. Jumlah neutrofil bervariasi pada setiap spesies hewan. Jumlah neutrofil pada hewan dapat mencapai 40% hingga 70% Pada anjing dan kucing, neutrofil adalah jenis leukosit yang paling banyak, sedangkan jumlah neutrofil pada kuda sedikit melampaui jumlah limfosit (Dellmann & Eurell 1998). Nama neutrofil berasal dari bahasa Latin (neuter=neither) dan bahasa Yunani (Philein=to love) yang berarti bahwa granul neutrofil tidak bersifat asidofilik mapun basofilik. Jika dilihat pada preparat ulas darah, inti sel neutrofil bersifat heterokromatik, banyak segmen (2-5 segmen), lobulasi jelas yang dipisahkan oleh benang kromatin tipis
dan nukleoplasma. Neutrofil memiliki diameter 9-15 m, lebih kecil dari eosinofil dan hampir sama dengan basofil (Samuelson 2007).
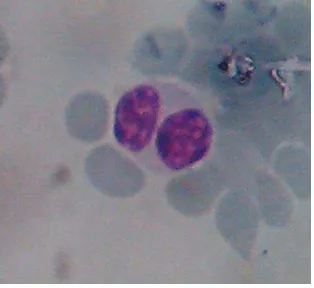
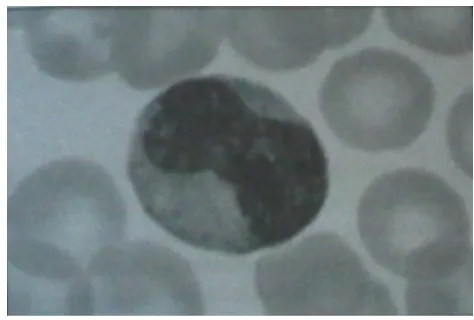
Gambar 1 Neutrofil (Hoffbrand 2006)
Sitoplasma neutrofil berisi granul-granul kecil berukuran 0,3-0,8 m. Granul pada neutrofil ada dua jenis yaitu granul primer atau azurofilik dan granul sekunder atau spesifik. Granul primer mengandung enzim lisosom dan peroksidase, sedangkan granul sekunder yang berukuran lebih kecil mengandung alkalin fosfatase dan zat-zat bakterisidal (protein kationik) yang dinamakan fagositin. Granul pada neutrofil secara umum pucat, tetapi pada kambing dan
domba sedikit eosinofilik. Selain granul-granul pada sitoplasma, neutrofil juga memiliki organel sel. Neutrofil jarang mengandung retikulum endoplasma
Neutrofil diproduksi di sumsum tulang. Neutrofil yang keluar dari sumsum tulang akan bersirkulasi dalam pembuluh darah selama 6 sampai 14 jam sebelum bermigrasi ke jaringan untuk melakukan tugasnya selama periode tertentu. Dalam keadaan sehat, hanya neutrofil dewasa yang bersirkulasi dalam sirkulasi. Neutrofil yang belum matang secara normal berada di dalam sumsum tulang, tetapi dapat dilepaskan ke sirkulasi selama respon granulositik terhadap suatu penyakit (Dellmann & Eurell 1998). Neutrofil merupakan garis pertahanan utama terhadap adanya benda asing yang masuk ke jaringan tubuh. Kemampuan neutrofil untuk menuju ke jaringan tubuh dipengaruhi oleh agen kemotakrik (Samuelson 2007). Pada daerah yang terinfeksi, neutrofil akan memfagosit benda asing secara aktif dan mencernanya dengan bantuan enzim lisosom. Kemampuan neutrofil untuk memfagosit benda asing terbatas, sehingga ada saatnya neutrofil menghancurkan diri melalui autolisis. Neutrofil terdestruksi dan mengeluarkan zat-zat hasil
degradasi ke dalam jaringan yang kemudian akan diangkut oleh limfe (Frandson 1992). Neutrofil memiliki metabolisme yang sangat aktif dan mampu melakukan
glikolisis baik secara aerob dan anaerob. Kemampuan neutrofil untuk hidup dalam lingkungan anaerob sangat menguntungkan karena dapat membunuh bakteri dan membantu membersihkan debris pada jaringan nekrotik (Efendi 2003).
Jumlah neutrofil meningkat pada kejadian infeksi, peradangan atau pun stres. Contoh adanya peningkatan jumlah neutrofil yaitu pada domba priangan yang mengalami stres transportasi. Peningkatan jumlah neutrofil terjadi pada jam ke-8 sampai dengan ke-12 dan mencapai puncak stres pada jam ke-12 setelah transportasi (Satyaningtijas et al. 2010). Di sisi lain, neutrofil pun dapat berkurang jumlahnya akibat infeksi yang mengganggu atau menyebabkan destruksi leukosit secara umum, seperti pada kasus theileriosis (Mahmmod et al. 2011).
Eosinofil
ruminansia dan babi memiliki granul dominan berwarna orange terang daripada merah, sedangkan granul pada eosinofil anjing berwarna pinkish atau orange
muda (Dellmann & Eurell 1998). Sama halnya seperti neutrofil, eosinofil juga memiliki dua tipe granul yaitu granul azurofilik dan granul spesifik. Granul azurofilik lebih banyak terdapat pada saat proses perkembangan sel di sumsum tulang. Setelah dewasa, granul azurofilik akan digantikan oleh granul spesifik. Granul spesifik berbentuk bulat atau persegi panjang tergantung jenis hewan. Selain granul, sitoplasma eosinofil juga terdiri atas polisom, retikulum endoplasma kasar, mitokondria yang menyebar, dan apparatus Golgi (Samuelson 2007).
Gambar 2 Eosinofil (Hoffbrand 2006)
Eosinofil merupakan sel fagositik lain yang aktif dan tergantung pada respirasi anaerob untuk memperoleh energi. Target fagositosis eosinofil berbeda dengan neutrofil. Eosinofil berperan dalam memakan kompleks antigen-antibodi, tetapi tidak memakan dan menghancurkan mikroorganisme. Eosinofil tidak mempunyai lisosom yang cukup, seperti yang dimiliki granul neutrofil, untuk membunuh bakteri. Namun, granul eosinofil memiliki protein kationik yang dapat membunuh parasit cacing secara efektif (Samuelson 2007; Akers & Denbow 2008).
Membran sel eosinofil dapat berikatan dengan leukotrin, histamin, dan
eosinophil chemotactic factor (ECF), yang dapat membawa eosinofil menuju ke lokasi peradangan, invasi cacing, atau reaksi alergi. Ketika sampai ke lokasi,
mengontrol respon peradangan (Samuelson 2007). Jadi, keadaan peningkatan jumlah eosinofil (eosinofilia) terjadi jika terdapat parasit cacing, peradangan, atau alergi. Sebaliknya, penurunan jumlah eosinofil dapat terjadi jika terdapat parasit darah sepert Theileriaannulata. Berdasarkan penelitian Mahmmod et al. (2011), infeksi Theileria annulata pada kerbau sungai menyebabkan jumlah eosinofil atau leukosit secara umum akan menurun karena destruksi leukosit yang terdapat pada kelenjar limfoid dan organ lainnya.
Basofil
Basofil adalah jenis leukosit yang paling sedikit ditemukan di dalam darah, yaitu sekitar 0 sampai 3% dari jumlah total leukosit. Basofil memiliki nukleus yang bervariasi, misalnya pada satu contoh memiliki segmen yang jelas namun pada contoh lain memiliki dua lobus yang sederhana. Pada hewan,
misalnya kuda, nukleus tertutupi oleh granul sehingga sulit untuk melihat bentuk nukleus (Samuelson 2007).
Basofil memiliki granul yang berwarna biru jika diberi pewarnaan Giemsa. Sama halnya seperti neutrofil dan eosinofil, basofil juga memiliki granul azurofilik dan granul spesifik. Granul yang paling banyak adalah granul spesifik yang terletak di sitoplasma, bersama dengan organel sel lain seperti retikulum endoplasma kasar, mitokondria, dan aparatus Golgi. Basofil juga mengandung substansi yang terdapat pada sel mast, seperti heparin, histamin, dan eosinophilic chemotactic factor (ECF). Ukuran granul bervariasi tergantung jenis hewan. Anjing memiliki jumlah basofil yang sedikit dan ukuran lebih besar dibandingkan pada hewan lain, khususnya kuda dan sapi (Samuelson 2007).
Fagositosis oleh basofil sangat terbatas. Basofil muncul utamanya pada aktivitas peradangan langsung dengan mekanisme yang hampir sama seperti yang dilakukan oleh sel mast. Mekanisme terjadinya ikatan antara imunoglobulin E (IgE) pada membran sel basofil membentuk ikatan Fc reseptor sel permukaan yang mirip dengan terjadinya pada sel mast. Ikatan reseptor tersebut akan berikatan dengan antigen sehingga dapat menyebabkan pelepasan isi granul (Samuelson 2007).
Monosit
Monosit adalah leukosit terbesar diantara jenis leukosit lainnya. Monosit
berdiameter 15 sampai 20 m dan berjumlah 3 sampai 9% dari total leukosit. Monosit memiliki nukleus yang berbentuk lonjong, seperti ginjal atau tapal kuda. Monosit menjadi sulit dibedakan dengan adanya transisi antara limfosit kecil dan besar, karena terdapat kemiripan pada bentuk nucleus, terutama pada ulas darah sapi (Dellmann & Brown 1992). Nukleus monosit memiliki warna yang lebih pucat dari limfosit, sitoplasma lebih banyak dari limfosit dan berwarna biru abu-abu pucat. Butir azurofilik yang halus seperti debu juga sering ditemukan. Secara ultrastruktur, sitoplasma mengandung banyak lisosom dengan berbagai stadium aktivitas (lisosom primer dan sekunder), retikulum endoplasma kasar, polisom, mitokondria, dan glikogen.
Peran monosit hampir sama dengan neutrofil, yaitu sebagai fagositik yang berkemampuan memakan antigen, seperti bakteri. Perbedaan monosit dengan neutrofil adalah neutrofil bekerja untuk mengatasi infeksi yang akut, sedangkan monosit mulai bekerja pada infeksi yang tidak terlalu akut seperti tuberkulosis (Frandson 1992). Monosit dalam darah tidak pernah mencapai dewasa penuh
sampai bermigrasi ke jaringan menjadi makrofag (Aspinall & O’Reilly 2004) dan
menetap di jaringan, seperti pada sinusoid hati, sumsum tulang, alveoli paru-paru, dan jaringan limfoid. Selain sebagai makrofag, monosit juga berperan dalam sistem imun. Kontak yang dekat antara permukaan limfosit dan monosit diperlukan untuk respon imunologis yang maksimal (Dellmann & Brown 1992). Monosit berada di dalam darah hanya beberapa hari, tetapi saat meninggalkan pembuluh darah dan memasuki jaringan akan bertahan sampai berbulan-bulan (Samuelson 2007).
Limfosit
Limfosit adalah jenis leukosit yang juga memiliki jumlah bervariasi pada spesies hewan. Limfosit memiliki jumlah yang dominan pada total leukosit ruminansia, tikus, dan mencit, yaitu mencapai 60-70%. Pada anjing, kucing, dan kuda, jumlah limfosit berkisar antara 40 sampai 60% (Dellmann & Eurell 1998). Limfosit dibentuk di jaringan limfoid, meskipun berasal dari sel batang primordial
di sumsum tulang (Aspinall & O’Reilly 2004).
Limfosit memiliki ukuran dan penampilan yang bervariasi. Limfosit memiliki nukleus yang relatif besar, berbentuk bulat atau sedikit berlekuk, yang dikelilingi oleh sitoplasma. Pada sediaan ulas darah yang telah diwarnai dapat terlihat adanya limfosit besar dan limfosit kecil. Limfosit kecil berdiameter 6 sampai 9 m, memiliki nukleus yang besar yang kuat mengambil warna,
sitoplasma sedikit dan berwarna biru pucat. Limfosit besar berdiameter 12 sampai 15 m, nukleus lebih besar dan sedikit pucat jika dibandingkan dengan limfosit kecil, sitoplasma lebih banyak. Limfosit besar memiliki apparatus Golgi yang
Fungsi utama limfosit yaitu sebagai respon terhadap adanya antigen dengan cara membentuk antibodi yang bersirkulasi di dalam darah atau dalam pengembangan imunitas seluler (Frandson 1992). Limfosit bertanggung jawab dalam respon imun spesifik dan terdiri atas dua tipe sel yaitu sel B dan sel T. Sel B memproduksi antibodi dan berperan dalam humoral immunity, sedangkan sel T berperan dalam cellular immune response (Aspinall & O’Reilly 2004). Samuelson
(2007) menyebutkan bahwa berdasarkan fungsi dasar, limfosit dapat dikategorikan menjadi tiga tipe yaitu sel yaitu sel T, sel B, dan sel natural killer
(NK). Ketiga tipe sel tersebut tidak dapat dibedakan hanya dengan mikroskop cahaya. Untuk membedakan ketiga sel tersebut, maka dapat digunakan metode imunohistokimia yang dapat menunjukkan perbedaan dari reseptor permukaan sel tersebut (Samuelson 2007).
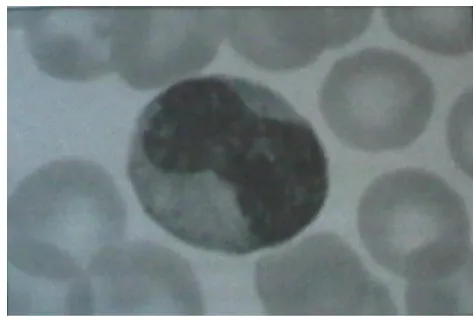
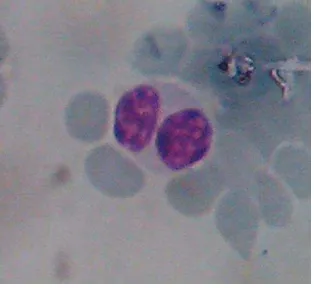
Gambar 5 Limfosit (Hoffbrand 2006)
Sel T merupakan sel yang paling banyak yaitu sekitar 60-70% dari total
limfosit darah dan berperan dalam imunitas seluler. Sel B memiliki jumlah yang sedikit yaitu 10-12% dari total limfosit darah dan beberapa diantaranya tumbuh
Stres
Stres adalah kondisi tubuh sebagai respon terhadap suatu ancaman tertentu sehingga tubuh melakukan penyesuaian terhadap kondisi tersebut. Selama proses penyesuaian terhadap kondisi stres terjadi perubahan fisiologis dan tingkah laku hewan sampai proses adaptasi tercapai. Stres dapat dibagi menjadi dua bentuk yaitu stres akut dan stres kronis. Stres akut adalah stres yang muncul cukup kuat, tetapi dapat menghilang dengan cepat, terutama jika penyebab stres dihilangkan. Stres kronis adalah stres yang tidak terlalu kuat, tetapi dapat bertahan lama sampai berhari-hari, berminggu-minggu, bahkan berbulan-bulan (NSC 2004).
Stres (misalnya akibat trauma, infeksi, peradangan atau kerusakan jaringan) akan memicu impuls saraf ke hipotalamus. Hipotalamus akan melepaskan hormon pelepas kortikotropin (corticotropin-releasing hormone) yang melewati sistem portal hipotalamus-hipofisis menuju kelenjar pituitari
anterior (adenohipofise). Kelenjar pituitari anterior akan dirangsang untuk melepaskan adrenocorticotropin hormone (ACTH). ACTH akan bersirkulasi di dalam darah menuju kelenjar adrenal yang berfungsi untuk mensekresikan glukokortikoid. Zona fasikulata dan zona retikularis lebih sensitif terhadap ACTH untuk menghasilkan glukokortikoid dibandingkan dengan zona glomerulosa yang menghasilkan mineralokortikoid. Glukokortikoid inilah yang mengakibatkan peningkatan persediaan asam amino, lemak, dan glukosa dalam darah untuk membantu memperbaiki kerusakan yang disebabkan oleh stres dan menstabilkan membran lisosom untuk mencegah kerusakan lebih lanjut (Frandson 1992).
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dimulai pada bulan Mei sampai Agustus 2011 di Laboratorium Fisiologi, Bagian Fisiologi dan Farmakologi Departemen Anatomi, Fisiologi, dan Farmakologi dan di Unit Reproduksi dan Rehabilitasi (URR) Departemen Klinik, Reproduksi, dan Patologi Fakultas Kedokteran Hewan-Institut Pertanian Bogor.
Materi Penelitian
Hewan Coba
Hewan percobaan yang digunakan dalam penelitian ini adalah empat ekor kerbau lumpur (Bubalus bubalis) betina berumur 2 sampai 2,5 tahun.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah syringe/spuit steril, jarum ukuran 18G, tabung darah, gelas objek, gelas penutup, kamar hitung (hemocytometer), pipet leukosit, label, mikroskop, dan counter. Bahan yang digunakan adalah darah, antikoagulan Ethylene Diamine Tetraacetic Acid
(EDTA), tissue, alkohol 70%, kapas, methanol, minyak emersi, pewarna Giemsa 10%, dan larutan Turk.
Metode Penelitian
Tahap Persiapan
Kerbau lumpur diadaptasikan selama dua minggu sebelum dilakukan pengambilan sampel darah. Masing-masing kerbau dipelihara di dalam kandang berukuran 2x2,5 meter, diberi pakan rumput dan air minum ad libitum. Kerbau juga diberi obat cacing albendazol dan diberi vitamin B-kompleks untuk menjaga kondisi kerbau agar tetap optimal.
Pengambilan Darah Kerbau
Pengambilan darah kerbau dilakukan setiap dua hari sekali pada pagi hari
ukuran 18G melalui vena jugularis yang terletak di lateral leher (Sulong et al.
1980) yang telah dibersihkan dengan kapas yang diberi alkohol 70%. Jumlah darah yang diambil sebanyak 2 ml dan dimasukkan ke tabung yang telah diberi EDTA, lalu dihomogenkan. Tabung darah disimpan di dalam cool box dan dibawa ke laboratorium untuk dihitung jumlah leukosit.
Penghitungan Jumlah Leukosit
Darah pada tabung yang telah dicampur dengan EDTA dihisap dengan pipet hingga tanda 0,5 dan ujung pipet dibersihkan dengan tissue. Kemudian hisap larutan Turk dengan pipet yang sama hingga mencapai batas angka 11. Pipet kemudian dikocok kurang lebih selama tiga menit hingga homogen. Selanjutnya, buang dua atau tiga tetes larutan sebelum dimasukkan ke kamar hitung. Larutan yang telah dimasukkan ke kamar hitung ditunggu selama satu menit, setelah itu leukosit dihitung menggunakan perbesaran 10 kali atau 40 kali pada lensa
objektif. Leukosit yang dihitung adalah leukosit yang terdapat pada empat sudut kamar hitung bertuliskan huruf W yang masing masing memiliki 16 kotak kecil
yang dapat dilihat pada Gambar 6. Rumus perhitungan jumlah leukosit adalah:
Pembuatan Preparat Ulas Darah dan Diferensial Leukosit
Pembuatan preparat ulas langsung dilakukan di tempat pengambilan darah yaitu di URR. Pertama-tama, dipersiapkan dua gelas objek. Darah segar yang terdapat pada spuit diteteskan di bagian ujung gelas objek pertama dengan posisi permukaan datar. Lalu, ujung gelas objek kedua disentuhkan pada bagian gelas objek pertama yang ditetesi darah tersebut. Darah akan menyebar ke sisi bagian ujung gelas objek kedua, kemudian posisikan gelas objek kedua agar membentuk sudut 30-45o terhadap gelas objek pertama. Gelas objek kedua didorong di atas permukaan gelas objek pertama agar darah dapat menyebar ke permukaan secara rata dan membentuk lapisan tipis (Samuelson 2007). Ulas darah tidak boleh terlalu tebal karena sel darah akan terlihat sangat padat, sehingga sulit dalam menghitung dan membedakan leukosit. preparat dibiarkan mengering di udara terbuka.
Preparat yang telah kering segera difiksasi menggunakan metil alkohol (methanol) selama 3-5 menit, setelah itu diambil dan dikeringkan kembali di
udara. Setelah kering, preparat diwarnai dengan Giemsa 10% selama 30 menit. Preparat yang telah diwarnai segera dicuci dengan air dan dibiarkan mengering. Penghitungan persentase jenis leukosit dilakukan dengan perbesaran lensa objektif 100 kali, dengan beberapa lapangan pandang hingga jumlah total leukosit yang ditemukan mencapai 100 leukosit. Penggunaan lensa objektif dengan perbesaran 100 kali harus menggunakan minyak emersi dan dibersihkan dengan xylol. Penghitungan jumlah absolut dari masing-masing jenis leukosit dihitung dengan rumus:
Analisis Data
Jumlah total leukosit dan jenis-jenis leukosit akan dihitung rataan dan
HASIL DAN PEMBAHASAN
Berdasarkan penelitian yang dilakukan pada kerbau lumpur betina, diperoleh jumlah rataan dan simpangan baku dari total leukosit, masing-masing jenis leukosit, serta rasio neutrofil/limfosit (N/L).
LEUKOSIT
Berdasarkan perhitungan leukosit pada ulas darah, diperoleh jumlah rata-rata dan simpangan baku dari total leukosit, jenis-jenis leukosit, dan rasio N/L seperti yang ditampilkan pada Tabel 2.
Tabel 2 Rataan jumlah leukosit, jenis-jenis leukosit, dan rasio N/L kerbau lumpur betina selama sepuluh minggu
Minggu
Rataan 10845,89±2518,20 6084,29±2214,96 170,88±156,77 231,65±172,89 4361,17±1926,58 1,76±1,13
Gambar 7 Jumlah leukosit kerbau lumpur selama sepuluh minggu
Tabel 2 menunjukkan jumlah total leukosit yang paling rendah selama pengamatan pada minggu ke-5 yaitu 9871,88 sel/mm3 dan jumlah leukosit tertinggi diperoleh pada minggu ke-9 yaitu 11608,33 sel/mm3. Secara keseluruhan, rataan jumlah leukosit kerbau lumpur selama sepuluh minggu adalah 10845,89±2518,20 sel/mm3. Jumlah leukosit pada penelitian kali ini dapat dibandingkan dengan penelitian yang dilakukan oleh Sulong et al. (1980) terhadap kerbau lumpur di Malaysia yaitu sebesar 10700±3100 sel/mm3. Penelitian lain menunjukkan jumlah leukosit kerbau sungai yaitu 9100±400 sel/mm3 (Mahmmod
et al. 2011). Jumlah leukosit kerbau lumpur pada penelitian yang dilakukan oleh Sulong et al. (1980) lebih tinggi dibandingkan dengan jumlah leukosit sapi (8000 sel/mm3) dan kerbau sungai (9110 sel/mm3).
Berdasarkan Gambar 7 terlihat sedikit penurunan pada minggu ke-2, kemudian meningkat kembali hingga minggu ke-4. Pada minggu ke-5 terjadi
penurunan yang cukup drastis. Penurunan jumlah total leukosit dipengaruhi oleh penurunan dari salah satu atau beberapa jenis leukosit. Adanya penurunan
neutrofil pada minggu ke-2 dan ke-5 serta penurunan limfosit pada minggu ke-5 menyebabkan jumlah total leukosit juga menurun. Frandson (1992) menyatakan bahwa neutrofil merupakan komponen paling banyak dari total leukosit. Hal ini dapat dilihat pada rataan neutrofil (6084,29±2214,96 sel/mm3) yang lebih tinggi dari pada rataan limfosit (4361,17±1926,58 sel/mm3).
NEUTROFIL
Neutrofil merupakan jenis leukosit yang jumlahnya cukup dominan. Neutrofil juga merupakan garis pertahanan utama terhadap adanya benda asing yang masuk ke jaringan tubuh (Samuelson 2007). Neutrofil yang ditemukan pada penelitian dapat dilihat pada Gambar 8. Tabel 2 menunjukkan rataan neutrofil kerbau lumpur selama sepuluh minggu. Rataan neutrofil paling rendah diperoleh pada minggu ke-6 yaitu 4841,63 sel/mm3, sedangkan rataan paling tinggi diperoleh pada minggu ke-1 yaitu 7248,63 sel/mm3. Secara keseluruhan, rataan jumlah neutrofil selama sepuluh minggu adalah 6084,29±2214,96sel/mm3.
Gambar 8 Neutrofil
Gambar 9 Jumlah neutrofil kerbau lumpur selama sepuluh minggu
Berdasarkan Gambar 9 diatas, terlihat fluktuasi dari jumlah neutrofil. Peningkatan jumlah neutrofil terjadi di beberapa titik yaitu minggu ke-1, minggu ke-3 dan minggu ke-7 hingga ke-8. Jumlah neutrofil yang tinggi atau peningkatan jumlah neutrofil pada minggu-minggu tersebut dapat disebabkan oleh adanya
infeksi, peradangan atau stres. Peradangan atau infeksi akan menstimulasi pengeluaran neutrofil untuk menghancurkan benda asing yang masuk ke dalam tubuh. Neutrofil tersebut akan menerima sinyal yang dihasilkan oleh sel yang
bersangkutan atau racun dari bakteri (Frandson 1992). Pada kondisi stres, adanya kortisol juga dapat mempengaruhi keluarnya neutrofil dari sumsum tulang . Hal
ini menyebabkan peningkatan jumlah neutrofil (Samuelson 2007).
Penurunan jumlah neutrofil terjadi di beberapa minggu yaitu minggu ke-2, minggu ke-4 hingga ke-6, dan minggu ke-9 hingga ke-10. Penurunan ini dapat terjadi jika hewan tidak lagi mengalami infeksi, peradangan atau stres. Namun pada infeksi parasit darah (theileriosis) dapat terjadi penurunan jumlah neutrofil karena akan terjadi destruksi organ-organ limfoid penghasil leukosit (Mahmmod
et al.2011).
EOSINOFIL
Eosinofil merupakan jenis leukosit yang jumlahnya relatif sedikit. Eosinofil berperan aktif dalam mengatur alergi akut dan proses peradangan, mengatur infestasi parasit, dan memfagosit bakteri, kompleks antigen-antibodi, mikoplasma dan ragi (Dellmann & Brown 1992). Eosinofil yang ditemukan pada penelitian ini dapat dilihat pada Gambar 10.
Gambar 10 Eosinofil
Pada penelitian kali ini diperoleh jumlah eosinofil yang disajikan pada Tabel 2, rataan eosinofil paling tinggi dan paling rendah diperoleh pada minggu ke-6 dan ke-7 yaitu 288,70 sel/mm3 dan 99,94 sel/mm3. Secara keseluruhan, rataan eosinofil selama sepuluh minggu adalah 170,88±156,77 sel/mm3. Jika
dipersentasekan, jumlah eosinofil kerbau lumpur ini berkisar antara 1 sampai 3%. Penelitian lain mendapatkan jumlah eosinofil sekitar 6,6%. Pada sapi dan kerbau
sungai, persentase eosinofil sekitar 9,0% dan 4,6% (Sulong et al. 1980).
Gambar 11 Jumlah eosinofil kerbau lumpur selama sepuluh minggu
Gambar 11 menunjukkan jumlah eosinofil yang cenderung semakin meningkat dari minggu ke-1 hingga minggu ke-6. Pada minggu ke-7 terjadi penurunan yang cukup signifikan, namun kembali naik pada minggu 8 dan ke-9. Pada minggu ke-10 terjadi sedikit penurunan. Peningkatan eosinofil diduga karena hewan mengalami alergi akut atau terdapat infestasi parasit. Penurunan
0 50 100 150 200 250 300
1 2 3 4 5 6 7 8 9 10
Ju
m
lah
s
el
(
se
l/m
m
3)
ke-eosinofil terjadi karena tubuh telah dapat mengatasi adanya parasit tersebut atau karena adanya intervensi dari luar yang dapat mengurangi infestasi parasit.
BASOFIL
Basofil merupakan jenis leukosit yang memiliki jumlah paling sedikit. Basofil memiliki fungsi utama dalam membangkitkan reaksi hipersensitif dengan sekresi mediator yang bersifat vasoaktif. Sel ini melepaskan mediator untuk aktivitas peradangan dan alergi. Pada sapi dan kerbau jumlah basofil yaitu 0,5% dan 0,97%, sedangkan jumlah basofil pada kerbau lumpur sekitar 0,3% (Sulong
et al.1980). Penelitian lain menunjukkan jumlah basofil kerbau sungai sekitar 0,02% (Mahmmod et al. 2011).
Pengamatan terhadap darah kerbau lumpur yang dilakukan selama sepuluh minggu ini tidak menemukan adanya basofil. Tidak adanya basofil bukan berarti
hewan tidak mengalami alergi atau peradangan, namun perlu dilihat perubahan dari jenis leukosit lainnya untuk memastikan ada tidaknya peradangan tersebut.
Karena terlibat dalam proses peradangan, maka terjadi suatu keseimbangan yang peka antara basofil dan eosinofil dalam mengawali dan mengontrol peradangan tersebut (Frandson 1992). Selain itu fagosit oleh basofil bersifat terbatas, sehingga basofil lebih jarang ditemukan (Samuelson 2007).
MONOSIT
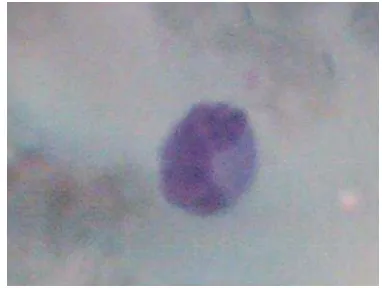
Gambar 12 Monosit
Rataan dan simpangan baku monosit pada kerbau lumpur yang diamati
selama sepuluh minggu disajikan pada Tabel 2. Jumlah monosit paling tinggi diperoleh pada minggu ke-8 yaitu 280,17 sel/mm3, sedangkan jumlah neutrofil
terendah diperoleh pada minggu ke-3 yaitu 164,84 sel/mm3. Secara keseluruhan, rataan jumlah monosit selama sepuluh minggu adalah 231,65±172,89 sel/mm3. Jika dipersentasekan, maka jumlah monosit sekitar 1 sampai 3%. Pada penelitian sebelumnya, jumlah monosit sekitar 3,7%. Pada sapi dan kerbau sungai, persentase jumlah monosit sekitar 4,0% dan 4,2% (Sulong et al.1980).
Gambar 13 Jumlah monosit kerbau lumpur selama sepuluh minggu
Gambar 13 menunjukkan fluktuasi dari monosit selama sepuluh minggu pengamatan. Mulai dari minggu ke-1 terjadi penurunan hingga minggu ke-3, namun kembali meningkat pada minggu ke-4 hingga ke-5. Penurunan terjadi lagi pada minggu ke-6 dan ke-9, kemudian kembali meningkat. Penurunan dan
0 50 100 150 200 250 300
1 2 3 4 5 6 7 8 9 10
Ju
m
lah
s
el
(
se
l/m
m
3)
ke-peningkatan jumlah monosit tidak terjadi secara signifikan, sehingga tidak begitu menggambarkan adanya kelainan. Monosit adalah sel darah yang belum matang sehingga dalam sirkulasi perannya dalam proses fagositosis tidak sebesar ketika monosit menjadi makrofag di jaringan. Monosit muncul jika terdapat antigen yang tidak mampu difagosit oleh neutrofil dengan cara berubah menjadi makrofag yang ukurannya lebih besar (Frandson 1992).
LIMFOSIT
Limfosit dikatakan sebagai leukosit yang dominan pada ruminansia. Limfosit juga merupakan leukosit yang berespon terhadap antigen dengan cara membentuk antibodi yang bersirkulasi di dalam darah atau dalam pengembangan imunitas seluler (Frandson 1992). Limfosit yang ditemukan pada penelitian ini dapat dilihat pada Gambar 14. Jumlah rataan dan simpangan baku limfosit kerbau
lumpur disajikan pada Tabel 2.
Gambar 14 Limfosit
Gambar 15 Jumlah limfosit kerbau lumpur selama sepuluh minggu
Berdasarkan Gambar 15, terlihat adanya fluktuasi jumlah limfosit kerbau lumpur selama sepuluh minggu. Penurunan dan peningkatan terlihat tidak terlalu signifikan, hanya terjadi sedikit perubahan dari jumlah limfosit. Peningkatan limfosit terjadi jika antigen masuk ke dalam tubuh, sehingga tubuh harus memproduksi antibodi (Frandson 1992). Penurunan limfosit dapat dialami jika terjadi imunosupresi atau kerusakan pada jaringan limfoid akibat faktor tertentu atau hewan dalam keadaan tercekam (stres). Pada penelitian kali ini kerbau lumpur diduga mengalami stres yang berakibat turunnya jumlah limfosit. Pada kondisi stres, kadar kortisol dalam darah meningkat. Kortisol dapat menyebabkan limfopenia dengan cara mengurangi mitosis atau pembentukan limfosit. Kortisol juga berpengaruh terhadap berkurangnya limfosit dalam sirkulasi karena terjadi redistribusi limfosit ke sumsum tulang dan bagian lain. Pembentukan DNA juga terhambat (Chastain & Ganjam 1986).
NEUTROFIL/LIMFOSIT (N/L)
Rasio jumlah neutrofil dan limfosit dapat menjadi indikasi adanya stres
pada hewan (Kannan et al. 2000). Rasio neutrofil/limfosit pada kerbau lumpur selama sepuluh minggu disajikan pada Tabel 2 dan Gambar 16. Nilai rasio
neutrofil/limfosit pada kerbau lumpur paling tinggi pada minggu ke-1 dan paling rendah pada minggu ke-6. Kannan et al. (2000) menjelaskan bahwa indeks stres pada kambing normalnya bernilai 1,5. Jika melebihi nilai 1,5 maka hewan tersebut
diduga mengalami stres atau cekaman. Pada sapi dan ruminansia lain, secara normal rasio neutrofil/limfosit sebesar 0,5 (Aiello 2000). Indeks stres tersebut
dapat diperoleh melalui rasio neutrofil/limfosit. Kondisi stres akan menyebabkan peningkatan neutrofil dan penurunan limfosit. Hal ini terbukti dengan tingginya jumlah neutrofil disertai penurunan limfosit pada awal minggu ke-1 dan pada minggu-minggu selanjutnya. Kadar kortisol yang meningkat pada kondisi stres akan menyebabkan neutrofilia karena terjadinya stimulasi pembentukan neutrofil dan pelepasan neutrofil dari sumsum tulang. Kortisol dapat menyebabkan limfopenia, eosinopenia, dan basopenia melalui pelepasan dari sel-sel limpa dan paru-paru dan penurunan mitosis limfosit dari sumsum tulang (Chastain & Ganjam 1986).
Gambar 16 Nilai rasio neutrofil/limfosit (N/L) kerbau lumpur selama sepuluh minggu
SIMPULAN DAN SARAN
Simpulan
Kesimpulan yang didapat dari penelitian ini adalah rataan jumlah leukosit kerbau lumpur selama sepuluh minggu sebanyak 10845,89±2518,20 sel/mm3. Jumlah rataan dari setiap jenis leukosit yaitu neutrofil berjumlah 6084,29±2214,96 sel/mm3, eosinofil berjumlah 170,88±156,77 sel/mm3, monosit berjumlah 231,65±172,89 sel/mm3, dan limfosit berjumlah 4361,17±1926,58 sel/mm3. Kerbau mengalami stres akut dengan indeks stres 1,76±1,13.
Saran
DAFTAR PUSTAKA
Aiello s. 2000. The Merck Veterinary Manual. USA: Merck & Co., Inc.
Akers RM, Denbow DM. 2008. Anatomy & Physiology of Domestic Animals.
USA: Blackwell Publishing.
Aspinall V, O’Reilly. 2004. Introduction to Veterinary Anatomy and Physiology.
China: Butterworth Heinemann an Imprint of Elsevier.
Ambore B, Ravikanth K, Maini S, Rekhe DS. 2009. Haematological profile and growth performance of goats under transportation stress. Veterinary World
2(5): 195-198.
Bahri S, Thalib C. 2008. Strategi pengembangan perbibitan ternak kerbau. Di dalam: Prosiding Seminar dan Lokakarya Nasional Usaha Ternak Kerbau; Jambi, 22-23 Juni 2007. Bogor: Pusat Penelitian dan Pengembangan Peternakan. 2008. hlm 1-11.
Bamualim AM, Muhammad Z. 2008. Situasi dan keberadaan ternak kerbau di Indonesia. Di dalam: Prosiding Seminar dan Lokakarya Nasional Usaha Ternak Kerbau; Jambi, 22-23 Juni 2007. Bogor: Pusat Penelitian dan Pengembangan Peternakan. 2008. hlm 32-39.
Bhattacharya R. 1993. Kerbau. Di dalam: G. Williamson dan W. J. A. Payne.
Pengantar Peternakan di Daerah Tropis. Yogyakarta: Gadjah Mada University Press.
Cunningham JG, Klein BG. 2007. Textbook of Veterinary Physiology. China: Saunders an Imprint of Elsevier Inc.
Chastain CB, Ganjam VK. 1986. Clinical Endocrinology of Companion Animals.
Philadelphia: Lea & Febiger.
Dellmann HD, Brown EM. 1992. Buku Teks Histologi Veteriner I. Jakarta: UI Press.
Dellmann HD, Eurell J. 1998. Text Book of Veterinary Histology. USA: Lippincott Williams & Wilkins.
[Ditjennak] Direktorat Jendral Peternakan. 2010. Statistik Peternakan 2010. [terhubung berkala] http://ditjennak.deptan.go.id/index.php?page= statistikpeternakan&action=info [3 Feb 2012].
Efendi Z. 2003. Peranan Leukosit sebagai Anti Inflamasi alergik dalam Tubuh. Sumatera Utara : Fakultas Kedokteran Universitas Sumatera Utara. [terhubung berkala] http://library.usu.ac.id/download/fk/histologi-zukesti2. pdf&sa=U&ei=H7IZUJSRDIqUiQKSvoCOCg&ved=0CBoQFjAA&usg= AFQjCNHI8pD-y6aYLuLqCTqkErjSnbXddw [2 Jan 2012]
Handayani W. 2008. Asuhan Keperawatan pada Klien dengan Gangguan Sistem Hematologi. Jakarta: Salemba Medika.
Hoffbrand V. 2006. At a Glance Hematology. Jakarta: EMS.
Kannan et al. 2000. Transportation of goats: effects on physiological stress responses and live weight loss. Journal of animal science 78:1450-1457. Maheshwari H. 2008. Rasio Netrofil/Limfosit (N/L) sebagai indikator stres pada
Owa Jawa (Hylobates moloch audebert 1797) di tempat penangkaran. The
Indonesian Journal of Physiology 7(2): 74-154.
Mahmmod YS, Elbalkemy FA, Klaas IC, Elmekkawy MF, Monazie AM. 2011. Clinical and haematological study on water buffaloes (Bubalus bubalis) and crossbread cattle naturally infected with Theileriaannulata in Sharkia province, Egypt. Tick and Tick-borne Diseases 54: 1-4.
McCurnin DM, Bassert JM. 2006. ClinicalTextbook for Veterinary Technicians. USA: Elsevier Inc.
[NSC] National Safety Council. 2004. Manajemen Stres. Widyastuti P, penerjemah; Yulianti D, editor. Boston: Jones and Bartlett Publisher, Inc. Terjemahan dari: Stress Management.
Robbani AR. 2009. Karakteristik fenotipik kerbau lumpur (Swamp Buffalo) di Kabupaten Bogor [skripsi]. Bogor: Fakultas Peternakan Institut Pertanian Bogor.
Roth J. 2004. Bubalusbubalis. [Terhubung berkala]. http://http://animaldiversity. ummz.umich.edu/site/accounts/information/Bubalus_bubalis.html [16 Juli 2012].
Samuelson DA. 2007. Textbook of Veterinary Histology. China: Saunders, an imprint of Elsevier Inc.
Satyaningtijas AS, Andriyanto, Ramadhoni A, Suci Y, Dewi F, Sutisna A. 2010. Efektifitas multivitamin dan meniran (Phyllantus neruri L.) dalam menurunkan stress pada domba selama transportasi. Berita Biologi 10(3): 393-399.
Sulong A, Hilmi M, Jainudeen MR. 1980. Haemotology of the Malaysian swamp buffalo (Bubalusbubalis). Pertanika 3(2): 66-70.
Suryana. 2007. Usaha pengembangan kerbau lumpur di Kalimantan Selatan.
PENDAHULUAN
Latar Belakang
Indonesia memiliki plasma nutfah yang berlimpah termasuk hewan ruminansia besar maupun kecil yang sangat berguna bagi kehidupan sehari-hari, terutama ruminansia besar seperti kerbau. Perkembangan populasi kerbau di Indonesia kurang menggembirakan karena selama 70 tahun, dari tahun 1923 sampai tahun 1993 populasi kerbau hanya mengalami sedikit peningkatan, yaitu
dari 2.146.437 ekor menjadi 3.060.300 ekor. Berdasarkan data statistik tahun 2006-2011, jumlah kerbau di Indonesia mengalami angka yang fluktuatif. Pada tahun 2006-2008, jumlah kerbau terus menurun, namun pada tahun 2009 dan 2010 mengalami peningkatan, angka sementara pada tahun 2011 adalah 1.305.000 ekor (Ditjennak 2010). Jumlah populasi ini tidak lepas dari pengaruh faktor internal dan faktor eksternal terhadap produksi dan reproduksi kerbau. Faktor internal yang mempengaruhi misalnya berahi diam (silent heat), lama kebuntingan, panjang jarak antar kelahiran (calving interval), dan tingkat kematian yang cukup tinggi pada anak kerbau. Sementara itu, faktor eksternal yang mempengaruhi jumlah populasi yaitu keterbatasan bibit unggul, kualitas pakan yang rendah, perkawinan silang dalam (inbreeding), keterbatasan modal, kelangkaan tenaga, kurangnya pengetahuan ternak tentang produksi kerbau serta kurang tersedianya tenaga penyuluh dan teknologi tepat guna (Suryana 2007).
Pencegahan dan pengendalian terhadap penyakit dilakukan sebagai salah satu usaha untuk menanggulangi faktor internal dan eksternal pada kerbau, sehingga dapat mewujudkan program swasembada daging dan penyediaan daging aman, sehat, utuh, dan halal (ASUH). Kesehatan hewan menjadi penting karena jika terdapat infeksi penyakit, dikhawatirkan akan dapat mengganggu kesehatan
Respon pertahanan tubuh terhadap penyakit terdiri atas berbagai cara, salah satunya adalah sistem pertahanan yang dilakukan oleh sel darah putih (leukosit) (Frandson 1992). Sel darah putih dapat melakukan perannya dalam sistem pertahanan melalui jenis-jenis sel yang dimiliki seperti limfosit, monosit, neutrofil, eosinofil, dan basofil. Masing-masing jenis sel darah putih ini memiliki fungsi yang berbeda-beda di dalam menjalankan mekanisme pertahanan tubuh. Indikasi adanya stres, infeksi atau kelainan dalam tubuh karena suatu penyakit dapat dilihat dari perubahan jumlah sel darah putih secara keseluruhan atau salah satu dari jenis sel darah putih. Kesehatan hewan ini erat kaitannya dengan kondisi fisiologis seekor hewan, oleh karena itu, aspek kesehatan hewan harus dijaga. Salah satu penegakan diagnosa adanya penyakit adalah melakukan pemeriksaan darah. Penelitian ini mengulas tentang pemeriksaan sel darah putih dan komponennya sebagai data dasar kerbau lumpur dan untuk mengetahui status
kesehatannya.
Tujuan
Tujuan penelitian ini adalah untuk mengetahui jumlah rataan leukosit, neutrofil, eosinofil, basofil, monosit, dan limfosit, serta melihat indeks stres kerbau lumpur.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tinjauan Umum Kerbau
Menurut Bhattacharya (1993), semua kerbau domestik diduga berevolusi dari arni (Bubalus arnee) yaitu kerbau liar dari India yang masih dijumpai di hutan-hutan di daerah Assam. Domestikasi kerbau sudah terjadi sejak lama dan tidak diketahui pasti kapan terjadinya. Namun, penemuan-penemuan arkeologis di India menyatakan bahwa kerbau didomestikasi sekitar 4500 tahun yang lalu. Berdasarkan tipe habitatnya, kerbau dibedakan menjadi kerbau sungai (river buffalo) dan kerbau lumpur (swamp buffalo). Kerbau sungai lebih menyukai berada di air yang bersih dan mengalir, sedangkan kerbau lumpur lebih suka berada di lumpur, rawa-rawa, dan air yang menggenang (Bhattacharya 1993). Kedua kerbau ini merupakan kerbau Asia yang didomestikasi dan memiliki
jumlah kromosom yang berbeda, yaitu 48 kromosom untuk kerbau lumpur dan 50 kromosom untuk kerbau sungai (Bahri & Talib 2008).
Kerbau tersebar di beberapa propinsi di Indonesia, mulai dari populasi terbanyak sampai terendah secara berturut-turut yaitu di Nanggroe Aceh Darussalam, Sumatera Barat, Sumatera Utara, Sulawesi Selatan, Nusa Tenggara Barat, Maluku, dan Papua (Ditjennak 2010). Penyebaran populasi ini merupakan dampak dari adanya zona ideal bagi kerbau untuk dapat hidup dan beradaptasi. Berdasarkan data statistik Direktorat Jendral Peternakan, populasi kerbau lebih banyak terdapat di daerah pulau Sumatera yang relatif memiliki musim panas lebih singkat dan berudara relatif lembab. Kondisi demikianlah yang menjadi kemungkinan populasi kerbau lebih banyak terdapat di daerah Indonesia bagian barat dari pada di Indonesia bagian timur (Bamualim & Muhammad 2008).
Kingdom : Animalia Filum : Chordata Kelas : Mamalia Ordo : Artiodactyla Subordo : Ruminansia Famili : Bovidae Genus : Bubalus
Spesies : Bubalus bubalis
Secara fenotip, kerbau memiliki tulang yang besar, agak kompak dengan badan yang tergantung rendah pada kaki yang kuat dan kuku yang besar. Kerbau tidak mempunyai glambir maupun punuk. Kerbau mempunyai tanduk yang lebih padat dibandingkan dengan sapi, bahkan beberapa jenis dapat dibedakan melalui
bentuk tanduk yang khas (Bhattacharya 1993). Ketika lahir, kulit kerbau berwarna abu-abu. Tanduk, kaki, dan rambut secara normal memiliki warna yang sama
dengan kulit, tetapi cenderung sedikit gelap. Pada kerbau sungai, warna rambut biasanya hitam. Kerbau lumpur biasanya memiliki kaki yang berwarna putih atau abu-abu terang dan garis putih atau abu-abu terang menyerupai kalung di bawah dagu dan leher (Robbani 2009).
Kerbau merupakan hewan tropik yang memiliki daya tahan rendah terhadap panas. Oleh karena itu, kerbau lebih suka berkubang dan sebaiknya berada di daerah dengan suhu relatif rendah. Hasil penelitian menyatakan bahwa zona paling ideal bagi kerbau untuk bermukim yakni pada kisaran suhu 16o-24oC, dengan batas toleransi 27,6oC. Suhu tubuh kerbau dalam kisaran normal 37,4o -37,8oC, pulsus jantung 38,6-44,7 kali/menit, dan respirasi 25,6-29,4 kali/menit (Bamualim & Muhammad 2008). Adaptasi kerbau lumpur terhadap panas lebih rendah dibandingkan dengan kerbau sungai. Kerbau lumpur membutuhkan air yang lebih banyak dan tidak terbatas untuk mempertahankan agar dirinya tetap sejuk. Kerbau memiliki kulit yang gelap dan rambut yang jarang, sehingga absorbsi panas pada tubuhnya akan lebih besar. Kemampuan evaporasi pendinginan dari tubuh kerbau kurang efisien dikarenakan kemampuan berkeringat yang rendah. Oleh karena itu, kerbau yang dipekerjakan di bawah
sinar matahari langsung akan menunjukkan tanda-tanda sakit. Jika dibandingkan dengan sapi, kemampuan adaptasi kerbau terhadap panas memang lebih baik,
namun pada kondisi dingin sapi mampu beradaptasi lebih baik (Bhattacharya 1993).
Perbedaan yang cukup mencolok antara kerbau dan sapi dapat dilihat dari tingkat efisiensi pakan. Kerbau dapat bertahan hidup dengan kondisi pakan yang berkualitas rendah. Kelebihan ini dapat menjadi keuntungan bagi peternak karena dengan input yang rendah dapat menghasilkan output yang tinggi. Kerbau juga memiliki daya adaptasi yang besar, misalnya pada kondisi dimana terdapat banyak jerami atau rumput air yang tidak dimakan oleh sapi, maka kerbau akan tetap memakan pakan tersebut. Pada kondisi seperti ini, sapi akan memburuk kondisinya, sedangkan kerbau dapat terus bertahan (Bhattacharya 1993).
Darah
(leukosit), dan trombosit (platelet). Bentuk cairan dan padatan ini dapat dipisahkan melalui sentrifugasi. Bentuk cairan lebih ringan dibandingkan dengan bentuk padatan, oleh karena itu pada tabung sentrifugasi (centrifuge tube) plasma terletak dibagian atas dari bentuk padatan (Cunningham & Klein 2007).
Sebagian besar sel-sel darah beredar di pembuluh darah. Eritrosit dan trombosit tidak dapat menembus pembuluh darah, sedangkan leukosit dapat bermigrasi ke jaringan dengan cara menembus pembuluh darah untuk melakukan pertahanan terhadap infeksi. Leukosit merupakan sel darah yang istimewa karena merupakan satu-satunya sel darah mamalia yang bernukleus dan memiliki organel. Leukosit tidak mengandung hemoglobin (Hb). Meskipun jumlahnya hanya 1% dari volume darah, namun leukosit adalah komponen yang sangat penting dalam sistem imun (Akers & Denbow 2008).
Leukosit, terutama neutrofil, dapat meninggalkan sistem sirkulasi dan
keluar dari pembuluh darah melalui proses yang disebut emigrasi. Menurut Akers & Denbow (2008) proses emigrasi ini terdiri atas beberapa tahap yaitu:
1. Di dekat daerah peradangan atau inflamasi, sel-sel endotel kapiler mengeluarkan molekul adhesi yang dinamakan selektin pada permukaannya. Neutrofil juga memiliki molekul adhesi yang dinamakan integrin pada permukaannya yang dapat mengenali selektin. Hal ini akan menyebabkan leukosit berbaris pada permukaan dalam kapiler di dekat daerah peradangan. Proses ini disebut marginasi.
2. Leukosit dapat bergerak keluar kapiler melalui proses yang disebut diapedesis.
3. Setelah meninggalkan aliran darah, leukosit bermigrasi secara amoeboid mengikuti sinyal kimia yang dihasilkan oleh jaringan yang rusak. Proses demikian disebut kemotaksis positif.
4. Neutrofil dan makrofag akan menjadi fagosit dan mencerna bakteri dan sel-sel yang mati.
ada granul pada sitoplasma, terdiri atas monosit dan limfosit (Samuelson 2007). Karakteristik jenis-jenis sel darah putih secara singkat dapat dilihat pada Tabel 1.
Tabel 1 Karakteristik Jenis-Jenis Sel Darah Putih
Neutrofil
Neutrofil merupakan komponen terbanyak dari leukosit. Jumlah neutrofil bervariasi pada setiap spesies hewan. Jumlah neutrofil pada hewan dapat mencapai 40% hingga 70% Pada anjing dan kucing, neutrofil adalah jenis leukosit yang paling banyak, sedangkan jumlah neutrofil pada kuda sedikit melampaui jumlah limfosit (Dellmann & Eurell 1998). Nama neutrofil berasal dari bahasa Latin (neuter=neither) dan bahasa Yunani (Philein=to love) yang berarti bahwa granul neutrofil tidak bersifat asidofilik mapun basofilik. Jika dilihat pada preparat ulas darah, inti sel neutrofil bersifat heterokromatik, banyak segmen (2-5 segmen), lobulasi jelas yang dipisahkan oleh benang kromatin tipis
dan nukleoplasma. Neutrofil memiliki diameter 9-15 m, lebih kecil dari eosinofil dan hampir sama dengan basofil (Samuelson 2007).
Gambar 1 Neutrofil (Hoffbrand 2006)
Sitoplasma neutrofil berisi granul-granul kecil berukuran 0,3-0,8 m. Granul pada neutrofil ada dua jenis yaitu granul primer atau azurofilik dan granul sekunder atau spesifik. Granul primer mengandung enzim lisosom dan peroksidase, sedangkan granul sekunder yang berukuran lebih kecil mengandung alkalin fosfatase dan zat-zat bakterisidal (protein kationik) yang dinamakan fagositin. Granul pada neutrofil secara umum pucat, tetapi pada kambing dan
domba sedikit eosinofilik. Selain granul-granul pada sitoplasma, neutrofil juga memiliki organel sel. Neutrofil jarang mengandung retikulum endoplasma
Neutrofil diproduksi di sumsum tulang. Neutrofil yang keluar dari sumsum tulang akan bersirkulasi dalam pembuluh darah selama 6 sampai 14 jam sebelum bermigrasi ke jaringan untuk melakukan tugasnya selama periode tertentu. Dalam keadaan sehat, hanya neutrofil dewasa yang bersirkulasi dalam sirkulasi. Neutrofil yang belum matang secara normal berada di dalam sumsum tulang, tetapi dapat dilepaskan ke sirkulasi selama respon granulositik terhadap suatu penyakit (Dellmann & Eurell 1998). Neutrofil merupakan garis pertahanan utama terhadap adanya benda asing yang masuk ke jaringan tubuh. Kemampuan neutrofil untuk menuju ke jaringan tubuh dipengaruhi oleh agen kemotakrik (Samuelson 2007). Pada daerah yang terinfeksi, neutrofil akan memfagosit benda asing secara aktif dan mencernanya dengan bantuan enzim lisosom. Kemampuan neutrofil untuk memfagosit benda asing terbatas, sehingga ada saatnya neutrofil menghancurkan diri melalui autolisis. Neutrofil terdestruksi dan mengeluarkan zat-zat hasil
degradasi ke dalam jaringan yang kemudian akan diangkut oleh limfe (Frandson 1992). Neutrofil memiliki metabolisme yang sangat aktif dan mampu melakukan
glikolisis baik secara aerob dan anaerob. Kemampuan neutrofil untuk hidup dalam lingkungan anaerob sangat menguntungkan karena dapat membunuh bakteri dan membantu membersihkan debris pada jaringan nekrotik (Efendi 2003).
Jumlah neutrofil meningkat pada kejadian infeksi, peradangan atau pun stres. Contoh adanya peningkatan jumlah neutrofil yaitu pada domba priangan yang mengalami stres transportasi. Peningkatan jumlah neutrofil terjadi pada jam ke-8 sampai dengan ke-12 dan mencapai puncak stres pada jam ke-12 setelah transportasi (Satyaningtijas et al. 2010). Di sisi lain, neutrofil pun dapat berkurang jumlahnya akibat infeksi yang mengganggu atau menyebabkan destruksi leukosit secara umum, seperti pada kasus theileriosis (Mahmmod et al. 2011).
Eosinofil