Lampiran 2. Bunga lawang (Illicium verum. Hook.f.)
Gambar 1. Simplisia kering bunga lawang
Lampiran 3. Perhitungan pemeriksaan karakterisasi serbuk simplisia bunga
lawang (Illicium verum Hook.f.)
I. Perhitungan penetapan kadar air simplisia
1. % Kadar air = ,
, g
x 100%
= 3,99% 2. % Kadar air = ,
, g
x 100%
= 3,99% 3. % Kadar air = ,
, g
x 100%
= 3,99%
% Kadar air rata-rata = , % + , % + , % = 3,99%
No Berat sampel (gram) Volume air (ml)
1 5,0020 0,2
2 5,0017 0,2
3 5,0020 0,2
% Kadar air = i
Lampiran 3 (lanjutan)
II.Perhitungan penetapan kadar sari larut dalam air
No Berat sampel (gram) Berat sari (gram)
1 5,0020 0,2276
2 5,0015 0,2279
3 5,0024 0,2292
1. % Kadar sari larut dalam air = , g
, g
x
x
%
= 22,75% 2. % Kadar sari larut dalam air = , g
, g
x
x
%
= 22,78% 3. % Kadar sari larut dalam air = , 9 g
, g
x
x
%
= 22,90%
% Kadar sari larut dalam air rata-rata = , % + , % + , % = 22,81%
Lampiran 3 (lanjutan)
III.Perhitungan penetapan kadar sari larut dalam etanol
1. % Kadar sari larut dalam etanol = , 7 g
, g
x
x
%
= 23,70% 2. % Kadar sari larut dalam etanol = , g
, g
x
x
%
= 23,51% 3. % Kadar sari larut dalam etanol = , 9 g
, g
x
x
%
= 23,57%
% Kadar sari larut dalam etanol rata-rata = , % + , % + , % = 23,59%
No Berat sampel (gram) Berat sari (gram)
1 5,0034 0,2372
2 5,0031 0,2353
3 5,0030 0,2359
Lampiran 3 (lanjutan)
IV. Perhitungan penetapan kadar abu total
1. % Kadar abu total = , g
, g
x
%
= 3,85%
2. % Kadar abu total = , g
, g
x
%
= 3,65%
3. % Kadar abu total = , g
, g
x
%
= 3,89%
% Kadar abu total rata-rata = , % + , % + , % = 3,79%
No Berat sampel (gram) Berat abu (gram)
1 2,0015 0,0772
2 2,0013 0,0731
3 2,0015 0,0779
Lampiran 3 (lanjutan)
V.Perhitungan penetapan kadar abu yang tidak larut dalam asam
1. % Kadar abu tidak larut asam = , g
, g
x
%
= 0,70% 2. % Kadar abu tidak larut asam = , g
, g
x
%
= 0,70% 3. % Kadar abu tidak larut asam = , g
, g
x
%
= 0,69%
% Kadar abu tidak larut asam rata-rata = , % + , % + , % = 0,69%
No Berat sampel (gram)
Berat abu tidak larut asam (gram)
1 2,0015 0,0141
2 2,0013 0,0141
3 2,0015 0,0139
Lampiran 4. Bagan penelitian
Dicuci dari pengotor sampai
bersih, ditiriskan dan dikeringkan
Dihaluskan
Dimaserasi selama 5 hari dengan etanol 80%
Dienap tuang
Dimaserasi selama 2 hari Dienaptuang
Dirotary evaporator (± 40OC) Difreeze dryer (-40OC)
Ditambah DMSO dan terbentuk ekstrak etanol dengan konsentrasi 300, 200, 100, 90, 80, 70, 60, 50, 40, 30, 20 dan 10 mg/ml
Diukur daerah hambatan
Ditambah tween 80, sakarin, peppermint oil, aquadest
Bunga lawang
Ampas
Ekstrak etanol
Diuji aktivitas antibakterinya Serbuk simplisia
Simplisia
Maserat
Evaluasi sediaan (pH dan stabilitas fisik) (minggu ke-0, 1, 2, 3 dan 4) Diuji aktivitas antibakteri
(hari ke-1 dan hari ke-28)
Sediaan obat kumur konsentrasi 9, 10 dan 20%
Ampas
Lampiran 5. Bagan uji aktivitas antibakteri
Diambil 1 ose
Disuspensikan ke dalam 10 ml media Nutrient Broth
Dihomogenkan hingga diperoleh kekeruhan yang sama dengan kekeruhan standar Mc. Farland
Dipipet 0,1 ml masukkan kedalam tabung reaksi, ditambahkan 9,9 ml media Nutrient Broth
Dihomogenkan
Dipipet 0,1 ml masukkan kedalam cawan petri, ditambahkan 20 ml media Nutrient Agar
Dihomogenkan, biarkan hingga memadat
Diletakkan cakram kertas yang telah direndam larutan uji dengan berbagai konsentrasi
Diinkubasi pada suhu 36-37OC selama 18-24 jam
Diukur diameter daerah hambatan disekitar cakram kertas dengan menggunakan jangka sorong
Stok kultur
Media padat
Hasil Suspensi bakteri 1,5 x 108 CFU/ml
Lampiran 6. Hasil uji aktivitas antibakteri EBL
I. Hasil diameter daerah hambatan Konsentrasi
ekstrak etanol mg/ml
Diameter daerah hambatan (mm) terhadap bakteri Staphylococcus aureus
I II III Rata-rata
300 18,4 18,4 17,7 18,17
200 15,8 15,7 16,3 15,93
100 13,9 14,6 14,6 14,37
90 14,3 14,3 14,3 14,3
80 13,5 13,4 13,4 13,37
70 12,4 12,4 12,7 12,5
60 11,5 11,4 11,5 11,47
50 10,9 10,9 10,9 10,9
40 10,4 10,4 10,6 10,47
30 9,7 9,8 9,7 9,73
20 8,1 8,3 8,3 8,23
10 - - - -
Blanko - - - -
Konsentrasi ekstrak etanol
mg/ml
Diameter daerah hambatan (mm) terhadap bakteri Streptococcus mutans
I II III rata-rata
300 17,1 16,8 17,1 17
200 15,4 15,4 15,6 15,47
100 14,2 14,2 14,4 14,27
90 14,1 14,1 14,2 14,13
80 13,1 13 13,1 13,07
70 12,2 12,2 12,2 12,2
60 11,2 11,1 11,2 11,17
50 10,6 10,6 10,7 10,63
40 10,2 10,2 10,2 10,2
30 9,3 9,5 9,5 9,43
20 - - - -
10 - - - -
Blanko - - - -
Lampiran 6 (lanjutan)
II.Daerah hambatan EBL
Lampiran 6 (lanjutan)
Lampiran 7. Sediaan obat kumur EBL
Keterangan: A, B, C berturut-turut mengandung ekstrak bunga lawang dengan konsentrasi 9, 10 dan 20%.
Lampiran 8. Hasil uji aktivitas antibakteri SOK EBL
I. Hasil diameter daerah hambatan SOK
Sediaan
Diameter daerah hambatan (mm) terhadap bakteri Streptococcus mutans
I II III rata-rata
F I 14,2 14,1 14,2 14,17
F II 14,2 14,2 14,3 14,23
F III 15,5 15,5 15,6 15,53
Blanko - - - -
Sediaan
Diameter daerah hambatan (mm) terhadap bakteri Staphylococcus aureus
I II III rata-rata
F I 14,3 14,3 14,4 14,3
F II 14,4 14,4 14,6 14,47
F III 15,9 15,9 16,1 15,97
Blanko - - - -
Lampiran 8 (lanjutan)
II.Daerah hambatan SOK EBL
Lampiran 8 (lanjutan)
Lampiran 9. Hasil orientasi formula SOK EBL
I. Hasil orientasi pemakaian Tween 80 pada formula SOK EBL
Bahan OR I OR II OR III
Ekstrak bunga lawang
(Illicium verum Hook.f) 20% 20% 20%
Tween 80 8% 10% 12%
Sakarin 0,1% 0,1% 0,1%
Peppermint oil 0,2% 0,2% 0,2%
Air suling ad 50 ml 50 ml 50 ml
Hasil Larutan
keruh
Larutan keruh
Larutan jernih Keterangan: OR= orientasi formula, I, II dan III SOK yang masing-masing
mengandung 20% EBL dengan konsentrasi tween 80 berturut-turut adalah 8, 10 dan 12%.
Cara Pembuatan:
Dimasukkan EBL ke dalam lumpang, ditambahkan Tween 80 dan gerus hingga homogen, lalu ditambahkan sebagian akuades steril sedikit demi sedikit hingga semua ekstrak larut sempurna, lalu ditambahkan sakarin dan homogenkan. Larutan dimasukkan kedalam botol yang telah dikalibrasi 50 ml. Kemudian ke dalam botol ditambahkan peppermint oil dan dicukupkan volumenya dengan akuades steril hingga tanda batas (Akarina, 2011).
II.Hasil uji aktivitas antibakteri ListerinR dan Obat Kumur BetadinR terhadap bakteri SA dan SM
Sediaan
Diameter daerah hambatan (mm)* Staphylococcus
aureus
Streptococcus mutans
ListerinR 13,7 13,3
Obat Kumur BetadinR 12,1 11,3
DAFTAR PUSTAKA
Aronson, J.K. (2009). Herbal Medicines. USA: Elsevier. Page 137
Agoes, G. (2006). Pengembangan Sediaan Farmasi. Bandung: ITB. Halaman 96, 159.
Akarina, W. (2011). Uji Aktivitas Antibakteri Ekstrak Etanol Daun Ruku-ruku (Ocimum sanctum L) dan Formulasi Sediaan Obat Kumur-kumur. Skripsi. Medan: Fakultas Farmasi USU.
Ali, R.M., Zainon, A.S., Nik, M.M., dan Norhar, H. (2010). ASEAN Herbal and Medicinal Plants. Jakarta: ASEAN Secretariat. Halaman 325-326.
Aneja, K.R., Joshi, R., dan Sharma, C. (2010). The Antimicrobial Potential of Ten Often Used Mouthwashes Againts Four Dental Caries Pathogens. India: Jundishapur. Journal of Microbiology. 3(1): 15-27.
Anerjee, M., dan Miro, M. (2001). Actividad Antimicrobiana de Illicium verum Hook. f. Spain: Granada. Ars Pharmaceutica. 42(3-4): 209-220.
Arum, T.T.D., dan Benny, L. (2011). Formulasi Sediaan Obat Kumur Dengan Ekstrak Daun Sirih (Piper betle Linn). Skripsi. Jakarta: Fakultas Farmasi Universitas Pancasila
Backer, A.K. (1990). Handbook of Nonpresciption Drugs. Edisi ke-9. Washington: American Pharmaceutical. Halaman 435-437.
Brooks, G.F., Butel, J.S., dan Morse, S.A. (2005). Mikrobiologi Kedokteran. Penerjemah Bagian Mikrobiologi Fakultas Kedokteran Universitas Airlangga. Jakarta: Salemba Medika. Halaman 89, 237.
Depkes. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 33.
Depkes. (1980). Materia Medika Indonesia. Jilid IV. Jakarta: Departemen Kesehatan RI. Halaman 166-170.
Depkes. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 7, 629, 687, 748, 854-855.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan pertama. Jakarta: Departemen Kesehatan RI. Halaman 10-17. Dwijoseputro. (2010). Dasar-dasar Mikrobiologi. Jakarta: Djambatan.
Elena, D.L. (2008). Pharmacognostic Methods for Analysis of Herbal Drugs, According to European Pharmacopoeia. Halaman 48-49. Diakses 27 Januari 2014. www.intechopen.com.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Scrining of Plants. Journal of Pharmaceutical Science. 55(3): 257.
Fritz, E., Silvester, M.O., Reinhard, L. (2008). Illicium verum Hook. f. And illicium anisatum l.: Anatomical Characters and Their Value For Differentiation. Journal Sci Pharm. 76: 65-76.
Ismail, J., Runtuwene, M.R.J., dan Fatimah. (2012). Penentuan Total Fenolik dan Uji Aktivitas Antioksidan Pada Biji Dan Kulit Buah Pinang Yaki (Areca vestiaria Giseke). Jurnal Ilmiah Sains. 12(2): 86.
Jas, A. (2007). Perihal Obat Dengan Berbagai Jenis Dan Bentuk Sediaannya. Medan: USU Press. Halaman 47.
Jawetz, et al. (2001). Mikrobiologi Kedokteran. Edisi keduapuluh. Jakarta: Penerbit EGC. Halaman 239-240, 259.
Juliantina, F., Dewa, A.C.M., Bunga, N., Titis, N., dan Endrawati, T.B. (2009). Manfaat Sirih Merah (Piper crocatum) Sebagai Agen Anti Bakterial Terhadap Bakteri Gram Positif Dan Gram Negatif. Jurnal Kedokteran dan Kesehatan Indonesia. 5(3):10.
Mitsui, T. (1997). New Cosmetic Science. Singapore: Elsevier Science. Halaman 483
Ong, H.C. (2008). Rempah Ratus: Khasiat Makanan dan Ubatan. Kuala Lumpur: Print-AD SDN BAD. Halaman 94-95.
Parthasarathy, V.A., Thageerathy, C.T., dan John, A. (2008). Chemistry of Spices. India: Spi. Pondicherry. Halaman 319-330.
Pelczar, J.R., dan Chan, E.C.S. (1998). Dasar-dasar Mikrobiologi. Penerjemah Ratna Siri Hadioetomo. Jakarta: Penerbit UI Press. Halaman 132, 138-140, 144.
Pintauli, S., dan Hamidah, T. (2008). Menuju Gigi dan Mulut Sehat: Pencegahan dan Pemeliharaan. Medan: USU Press. Halaman 2.
Pradewa, M.R. (2008). Formulasi Sediaan Obat Kumur Berbahan Dasar Gambir. Skripsi. Bogor: Fakultas Teknologi Pertanian Institut Pertanian Bogor.
Rawlins, E.A. (2003). Bentley’s Textbook of Pharmaceutics. 18th edition. London: Bailierre Tindal. Pages 22.
Rowe, C.R., Sheskey, J. P., dan Quin, E. M. (2009). Handbook of Pharmaceutical Excipient. Edisi enam. Washington: Pharmaceutical Press. Halaman 605.
Saraswathy, A., Vidhya, B., Amala, K. (2013). Comparative HPTLC fingerprint profile of Illicium verum Hook.f. and Illicium griffithii Hook.f. & Thoms fruits. Journal of Pharmacognosy and Phytochemistry. 1: 5.
Setiabudy, R. (2008). Antimikroba. Dalam buku Farmakologi dan Terapi. Editor Sulistia Gan Gunawan. Jakarta: Balai Penerbit FK UI. Halaman 585 – 586.
Sirait, M. (2007). Penuntun Fitokimia Dalam Farmasi. Bandung: Penerbit ITB. Halaman 5.
Syamsuni, H.A. (2006). Ilmu Resep. Editor Ella Elviana dan Winny R. Syarief. Jakarta: EGC. Halaman 243,249.
Tortora, J.G., Funke, R.B., dan Case, L.C. (2001). Microbiology an Introduction. New York: Addison Wesley Longman Inc. Halaman 687.
Tranggono, R.I., dan Latifah, F. (2007). Buku Pegangan Ilmu Pengetahuan Kosmetik. Jakarta: Gramedia Pustaka Utama. Halaman 19-20.
Tjitrosoepomo, G. (2005). Taksonomi Tumbuhan Obat-obatan. Cetakan ke-2. Yogyakarta: UGM Press. Halaman 1-13, 113-181.
Volk, A.W., dan Wheeler, F.M. (1988). Mikrobiologi Dasar. Editor Soenartono Adisoemarto. Edisi kelima. Jakarta: Erlangga. Halaman 38, 46, 88-89.
Wade, A. (1972). Martindale: The Extra Phamacopoeia-Incorporating
Squire’s Companion. Twenty seventh edition. London: The
Pharmaceutical Press. Page 1012.
Wang, G.W., Wen, T.H., Bao, K.H., dan Lu, P.Q. (2011). Illicium verum: A Review On Its Botany, Traditional Use, Chemistry and Pharmacology. Journal of Ethnopharmacology. 136(1): 10-20.
Widagdo, Y. dan Suntya, K. (2007). Volatile Sulfur Compounds Sebagai Penyebab Halitosis. Denpasar: Kumpulan jurnal FKG Universitas Mahasaraswati. Volume 5 No 3. Halaman 2.
BAB III
METODE PENELITIAN
Pada penelitian ini dilakukan secara eksperimental. Tahap penelitian meliputi penyiapan bahan, identifikasi sampel, pembuatan ekstrak, pembuatan sediaan obat kumur-kumur. Selanjutnya dilakukan uji aktivitas antibakteri dari ekstrak bunga lawang dan sediaan obat kumur secara in vitro terhadap Staphylococcus aureus dan Streptococcus mutans dengan metode difusi agar.
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, blender (Miyako), frezze dryer (Modulio), rotary evaporator (Haake D), tanur (Nabertherm), neraca kasar (Sun), neraca listrik (Vibra AJ), oven (Fisher), kompor (Miyako), penangas air (Yenaco), seperangkat alat penentu kadar air (Pyrex), autoklaf (Fisons), inkubator (Memmert), Laminar Air Flow Cabinet (Astec HLF 1200L), lemari pendingin (Toshiba), pipet mikro (Eppendorf), pH meter (Hanna).
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bunga lawang (Illicium verum Hook.f.), nutrient agar, nutrient broth, Bakteri Staphylococcus aureus (ATCC 6538), bakteri Streptococcus mutans (ATCC 25175), sakarin,
pro analisa, kecuali dinyatakan lain: alfa naftol, amil alkohol, asam klorida p, asam asetat anhidrida, asam nitrat p, asam sulfat p, benzene, besi (III) klorida, bismuth (III) nitrat, dimetil sulfoksida (DMSO), etanol, n-heksan, isopropanol, kloralhidrat, kloroform, metanol, natrium hidroksida, natrium sulfat anhidrat, serbuk magnesium, serbuk zinc dan timbal (II) asetat.
3.3 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi Mayer, Dragendorf, asam klorida 2 N, Bouchardat, besi (III) klorida 1%, Molish, Liebermann-Bourchard dan timbal (II) asetat 0,4 M (Depkes, 1995).
3.3.1 Larutan pereaksi Mayer
Sebanyak 1,35 g raksa (II) klorida dilarutkan dalam 60 ml air suling. Pada wadah lain sebanyak 5 g kalium iodida dilarutkan dalam 10 ml air lalu
campurkan keduanya dan tambahkan air suling hingga 100 ml.
3.3.2 Larutan pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang dan dilarutkan dalam 20 ml asam nitrat p. Pada wadah lain ditimbang sebanyak 27,2 g kalium iodida lalu dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling sampai 100 ml.
3.3.3 Larutan pereaksi asam klorida 2 N
3.3.4 Larutan pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling secukupnya, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling hingga 100 ml.
3.3.5 Larutan pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan air suling hingga 100 ml
3.3.6 Larutan pereaksi Molish
Sebanyak 3 g alfa naftol ditimbang, kemudian dilarutkan dalam asam nitrat 0,5 N hingga volume 100 ml.
3.3.7 Larutan pereaksi Liebberman-Bourchard
Sebanyak 5 ml asam asetat anhidrida dicampurkan dengan 5 ml asam sulfat pekat kemudian ditambahkan etanol hingga 50 ml.
3.3.8 Larutan pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas karbondioksida hingga 100 ml.
3.4 Penyiapan Sampel
Penyiapan sampel meliputi pengambilan, identifikasi, dan pengolahan sampel.
3.4.1 Pengumpulan Sampel
3.4.2 Identifikasi Sampel
Identifikasi tumbuhan dilakukan di laboratorium Herbarium Medanense (MEDA) Universitas Sumatera Utara.
3.4.3 Pengolahan Sampel
Sampel yang telah diperoleh dari pasar dibersihkan dari kotoran yang ada kemudian dicuci dengan air bersih yang mengalir, ditiriskan lalu disebarkan diatas kertas perkamen hingga airnya terserap, setelah itu dikeringkan pada temperatur kamar ± 2 minggu. Selanjutnya sampel diserbuk menggunakan blender. Serbuk disimpan dalam wadah plastik tertutup rapat untuk mencegah pengaruh lembab dan pengotoran lainnya.
3.5 Karakterisasi Simplisia
Karakterisasi simplisia meliputi penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol penetapan kadar abu dan penetapan kadar abu tidak larut dalam asam (Depkes, 1995; WHO, 2011).
3.5.1 Penetapan kadar air
tiap detik. Setelah sebagian besar air terdestilasi, kecepatan tetesan dipercepat menjadi 4 tetes untuk tiap detik (dengan cara menaikkan suhu). Setelah volume air tidak bertambah lagi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Volume air dibaca setelah air dan toluen memisah sempurna. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat di dalam bahan yang diperiksa. Kadar air dihitung dalam persen terhadap berat sampel yang telah dikeringkan di udara.
3.5.2 Penetapan kadar sari yang larut dalam air
Dimaserasi sebanyak 5 g serbuk yang telah dikeringkan di udara selama 24 jam dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan sampai kering pada suhu 105OC hingga bobot tetap. Kadar sari yang larut dalam air dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
3.5.3 Penetapan kadar sari larut dalam etanol
telah ditara. Sisa dipanaskan sampai kering pada suhu 105OC hingga bobot tetap. Kadar sari yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
3.5.4 Penetapan kadar abu
Ditimbang seksama sebanyak 2 g serbuk yang telah digerus, dimasukkan ke dalam krus porselen yang telah terlebih dahulu dipijar dan ditara, kemudian diratakan. Lalu krus dipijarkan perlahan-lahan sampai bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara.
3.5.5 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu dididihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas. Residu dan kertas saring dipijar sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara.
3.6 Skrining Fitokimia
Skrining fitokimia meliputi pemeriksaan senyawa golongan glikosida, flavonoida, saponin, triterpenoida/steroida, tanin dan alkaloida.
3.6.1 Pemeriksaan glikosida
(II) asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran kloroform dan isopropanol (3:2), dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan pada suhu tidak lebih dari 50OC. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan.
Dimasukkan sebanyak 0,1 ml larutan percobaan ke dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat p melalui dinding tabung, terbentuk cincin warna ungu pada batas antara kedua cairan menunjukkan adanya ikatan gula (Depkes, 1980).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g sampel kemudian ditambahkan 100 ml air panas, didihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang diperoleh kemudian diambil 5 ml lalu ditambahkan serbuk Mg dan 1 ml HCl pekat dan 2 ml amil alkohol, dikocok, dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth,1966).
3.6.3 Pemeriksaan saponin
3.6.4 Pemeriksaan triterpenoida/steroida
Dimaserasi sebanyak 1 g sampel dengan 20 ml n-heksan selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap, dan pada sisanya ditambahkan 20 tetes asam asetat anhidrat dan 1 tetes asam sulfat p (pereaksi Liebermann-Bouchard). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru hijau menunjukkan adanya golongan senyawa triterpenoida/steroida (Harborne, 1987).
3.6.5 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, lalu disaring, filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya golongan senyawa tanin (Farnsworth,1966).
3.6.6 Pemeriksaan alkaloida
Ditimbang serbuk simplisia sebanyak 0,5 g, ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, di panaskan di penangas air selama 2 menit, didinginkan lalu disaring dan filtratnya ditampung.
Filtrat dipakai untuk percobaan berikut:
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendroff
3.7 Pembuatan EBL Secara Maserasi
Dimasukkan sebanyak 10 bagian (500 g) serbuk simplisia ke dalam wadah gelas, ditambahkan cairan penyari 75 bagian (3750 ml pelarut etanol 80%), dibiarkan selama 5 hari dan terlindung dari cahaya matahari sambil sesekali diaduk, kemudian dipisahkan dengan cara dienaptuang. Ampas dimaserasi kembali dengan etanol 80% selama 2 hari dengan menggunakan prosedur yang sama hingga diperoleh 100 bagian (5000 ml) maserat diuapkan dengan rotary evaporator pada temperatur tidak lebih 40OC dan dikeringkan dengan freeze dryer pada suhu -40OC sampai diperoleh ekstrak kental (Ditjen POM, 1979). Selanjutnya terhadap ekstrak dilakukan skrining fitokimia seperti yang dilakukan terhadap serbuk simplisia.
3.8 Pembuatan Media
3.8.1 Media nutrient broth (NB)
Komposisi : Lab-Lemco Powder 1,0 g Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g Cara Pembuatan:
3.8.2 Media nutrient agar (NA)
Komposisi : Lab-Lemco Powder 1,0 g Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g Agar 15,0 g Cara Pembuatan :
Ditimbang sebanyak 28 g nutrient agar (NA), disuspensikan kedalam air suling 1000 ml, lalu dipanaskan sampai larut sempurna. Lalu media dimasukkan dalam labu dan disterilkan di dalam autoklaf pada suhu 121OC selama 15 menit (Oxoid).
3.9 Pembuatan Agar Miring
Dimasukkan 5 ml media nutrient agar kedalam tabung reaksi, didiamkan pada suhu kamar sampai sediaan membeku pada posisi miring kira-kira 45OC kemudian disimpan dalam lemari pendingin.
3.10 Pembuatan Stok Kultur Bakteri
3.10.1 Bakteri Staphylococcus aureus
3.10.2 Bakteri Streptococcus mutans
Diambil biakan bakteri Streptococcus mutans dengan menggunakan jarum ose steril, lalu ditanam pada media nutrient agar miring dengan cara menggores. Kemudian diinkubasi dalam inkubator pada suhu 36-37OC selama 18-24 jam (Ditjen POM, 1995).
3.11 Pembuatan Larutan Uji EBL Dengan Berbagai Konsentrasi
Ditimbang EBL sebanyak 3 g dilarutkan dengan menggunakan pelarut DMSO (Dimetil sulfoksida) hingga 10 ml maka konsentrasi ekstrak adalah 300 mg/ml kemudian dibuat pengenceran selanjutnya sampai diperoleh ekstrak dengan konsentrasi 200, 100, 90, 80, 70, 60, 50, 40, 30, 20 dan 10 mg/ml. Kemudian kedalam masing-masing konsentrasi larutan dimasukkan cakram kertas, diamkan 15 menit.
3.12 Pembuatan Suspensi Standar Mc.Farland
Suspensi standar yang menunujukkan konsentrasi kekeruhan suspensi bakteri sama dengan 1,5 x 108 CFU/ml.
Komposisi: Larutan asam sulfat 1% 9,95 ml Larutan barium klorida 1% 0,05 ml Cara Pembuatan:
3.13 Penyiapan Inokulum Bakteri
Diambil koloni bakteri dari stok kultur dengan jarum ose lalu disuspensikan dalam tabung reaksi steril yang berisi 10 ml larutan Nutrient broth, dihomogenkan hingga diperoleh kekeruhan suspensi bakteri yang sama dengan kekeruhan standar Mc.Farland yang berarti konsentrasi suspensi bakteri adalah 1.5 x 108 CFU/ml. Setelah itu dilakukan pengenceran dengan memipet 0,1 ml biakan bakteri (1.5 x 108 CFU/ml), dimasukkan kedalam tabung reaksi steril yang berisi 10 ml larutan Nutrient broth lalu kocok homogen, maka diperoleh suspensi bakteri dengan konsentrasi 1.5 x 106 CFU/ml.
3.14 Metode Uji Aktivitas Antibakteri EBL Secara In Vitro
Dimasukkan 0,1 ml inokulum ke dalam cawan petri, kemudian ditambahkan 20 ml media nutrient agar steril yang telah dicairkan dan ditunggu hingga suhu mencapai 45OC, dihomogenkan dan dibiarkan memadat. Setelah itu diletakkan cakram kertas dengan berbagai konsentrasi EBL ke dalam cawan petri. Kemudian diinkubasi pada suhu 36-37OC selama 18-24 jam. Selanjutnya daerah hambat disekitar cakram kertas diukur dengan menggunakan jangka sorong. Pengujian dilakukan sebanyak 3 kali. Dilakukan pengujian terhadap blanko (Ditjen POM, 1995).
3.15 Pembuatan Formula Sediaan
R/ Bahan aktif : Ekstrak bunga lawang Surfaktan : Tween 80
[image:33.595.115.498.227.351.2]Korigensia : Sakarin (saporis), peppermint oil (odoris) Pelarut : Air suling
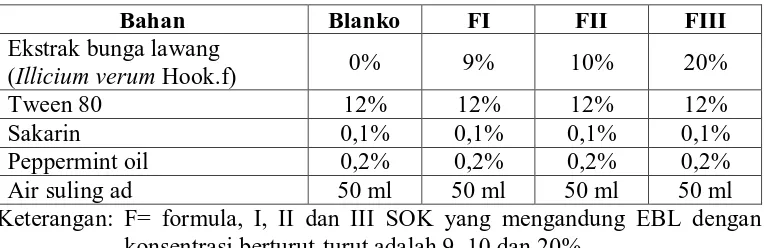
Tabel 3.1 Komposisi formula SOK
Bahan Blanko FI FII FIII
Ekstrak bunga lawang
(Illicium verum Hook.f) 0% 9% 10% 20%
Tween 80 12% 12% 12% 12%
Sakarin 0,1% 0,1% 0,1% 0,1%
Peppermint oil 0,2% 0,2% 0,2% 0,2%
Air suling ad 50 ml 50 ml 50 ml 50 ml
Keterangan: F= formula, I, II dan III SOK yang mengandung EBL dengan konsentrasi berturut-turut adalah 9, 10 dan 20%.
Cara Pembuatan:
Dimasukkan EBL yang telah ditimbang ke dalam lumpang, ditambahkan tween 80 dan gerus hingga homogen, lalu ditambahkan sebagian akuades steril sedikit demi sedikit hingga semua ekstrak larut sempurna, lalu ditambahkan sakarin dan homogenkan. Larutan dimasukkan kedalam botol yang telah dikalibrasi 50 ml. Kemudian ke dalam botol ditambahkan peppermint oil dan dicukupkan volumenya dengan akuades steril hingga tanda batas (Akarina, 2011).
3.16 Evaluasi Formula
3.16.1 Pemeriksaan stabilitas sediaan
Meliputi bentuk, warna, dan bau yang diamati secara visual (Ditjen POM, 1995). Sediaan dinyatakan stabil apabila warna, bau, dan penampilan tidak berubah secara visual selama penyimpanan.
Pengamatan dilakukan pada suhu kamar pada minggu ke 0, 1, 2, 3 dan minggu ke 4.
3.16.2 Penentuan pH sediaan
Penentuan pH sediaan menggunakan pH meter
Cara: alat terlebih dahulu dikalibrasi dengan menggunakan larutan dapar standar pH netral (pH 7,0) dan larutan dapar pH asam (pH 4,0) hingga alat menunjukkan harga pH tersebut. Kemudian elektroda dicuci dengan air suling, lalu dikeringkan dengan kertas tissue. Elektroda dicelupkan dalam larutan obat kumur tersebut. Dibiarkan alat menunjukkan harga pH konstan. Angka yang ditunjukkan pH meter merupakan harga pH sediaan (Rawlins, 2003).
Pengamatan dilakukan pada suhu kamar pada hari ke 0, 7, 14, 21, dan hari ke 28.
3.16.3 Metode uji aktivitas antibakteri sediaan secara in vitro
Metode pengujian ini dilakukan dengan cara:
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tanaman
Hasil identifikasi tanaman yang dilakukan Herbarium Medanese, Universitas Sumatera Utara, hasilnya adalah bunga lawang (Illicium verum Hook.f.) dari famili Illiciaceae. Hasil identifikasi tanaman dapat dilihat pada lampiran 1.
4.2 Hasil Karakterisasi Simplisia
Hasil pemeriksaan karakterisasi simplisia dapat dilihat pada Tabel 4.1 berikut ini.
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia bunga lawang.
No. Pemeriksaan Hasil (%) Syarat (%)
1 Kadar abu total 3,8 < 4*
2 Kadar abu tidak larut dalam asam 0,7 -
3 Kadar sari larut dalam air 22,8 -
4 Kadar sari larut dalam etanol 23,5 -
5 Kadar air 3,9 8-12**
sedangkan penetapan kadar sari larut dalam etanol untuk mengetahui senyawa yang larut dalam etanol, baik yang polar maupun non polar. Penetapan kadar air berhubungan dengan mutu simplisia agar tidak mudah ditumbuhi oleh mikroorganisme (Ditjen POM, 1995).
4.3 Hasil Skrining Fitokimia
[image:37.595.116.499.361.516.2]Hasil skrining fitokimia serbuk bunga lawang (SBL) dan EBL (Tabel 4.2) menunjukkan adanya golongan senyawa, flavonoid, glikosida, saponin, tanin dan triterpenoid/steroid.
Tabel 4.2 Hasil skrining fitokimia SBL dan EBL
No Senyawa Hasil skrining
SBL EBL
1 Alkaloida - -
2 Flavonoida + +
3 Glikosida + +
4 Saponin + +
5 Tanin + +
6 Triterpenoida/Steroida + +
Keterangan: + = mengandung senyawa yang diperiksa; - = tidak mengandung senyawa yang diperiksa
warna ungu yang kemudian berubah menjadi biru hijau, menunjukkan adanya golongan senyawa triterpenoid/steroida. Penambahan serbuk Mg dan asam klorida p dengan amil alkohol memberikan warna kuning pada lapisan amil alkohol, menunjukkan adanya golongan senyawa flavonoid. Pemeriksaan glikosida, dengan penambahan 2 ml air dan 5 tetes pereaksi Molish, kemudian ditambahkan hati-hati 2 ml asam sulfat p, terbentuk cincin ungu, menunjukkan adanya golongan senyawa glikosida. Hasil skrining SBL dan EBL sama-sama dijumpai adanya golongan senyawa flavonoid, glikosida, saponin, tanin dan triterpenoida/steroida, dan tidak mengandung golongan senyawa alkaloid.
Hasil maserasi 500 g SBL diperoleh 54 g EBL (rendemen 10,8%). Hasil rendemen dapat dipengaruhi oleh ukuran bahan yang digunakan. Pengecilan ukuran bahan dapat memperluas permukaan yang kontak dengan pelarut sehingga dapat mempercepat pelarutan, mempercepat reaksi kimia, dan mempertinggi kemampuan penyerapan komponen aktif dalam bahan oleh pelarut (Ismail, 2012).
4.4 Uji Aktivitas Antibakteri EBL Terhadap SA dan SM
SM. Pada tabel 4.3 dibawah, menyatakan bahwa EBL dapat menghambat pertumbuhan SA dan SM sedangkan pada blanko (DMSO) tidak menunjukkan aktivitas antibakteri terhadap kedua bakteri yang digunakan.
Tabel 4.3 Hasil pengukuran diameter daerah hambatan EBL terhadap
pertumbuhan bakteri SA dan SM. Konsentrasi
ekstrak etanol (mg/ml)
Diameter daerah hambatan (mm)*
Staphylococcus aureus Streptococcus mutans
300 18,17 17
200 15,93 15,47
100 14,37 14,27
90 14,3 14,13
80 13,37 13,07
70 12,5 12,2
60 11,47 11,17
50 10,9 10,63
40 10,47 10,2
30 9,73 9,43
20 8,23 -
10 - -
5 - -
Blanko - -
Tanin bekerja pada bakteri dengan cara menciutkan dan mengendapkan protein sel yang dapat mengganggu permeabilitas sel, sehingga pertumbuhannya akan terhambat atau bahkan mati. Flavonoida dapat membentuk senyawa kompleks terhadap protein ekstraseluler, sehingga terjadi koagulasi protein yang dapat mengganggu pertumbuhan sel bakteri (Sirait, 2007).
Data yang diperoleh menunjukkan bahwa EBL memberikan batas daerah hambatan minimum pada konsentrasi 20 mg/ml untuk SA (8,23 mm) dan konsentrasi 30 mg/ml untuk SM (9,43 mm). Batas daerah hambatan yang efektif didapat pada konsentrasi 90 mg/ml terhadap SA (14,3 mm) dan SM (14,13 mm). Hal ini sesuai dengan yang tertera pada Ditjen POM (1995), yang menyatakan batas daerah hambatan yang dinilai efektif yaitu diameter daerah hambatan lebih kurang 14 mm sampai 16 mm.
4.5 Hasil Orientasi Formula
Mitsui (1997) dalam bukunya ‘New Cosmetic Science’ menyatakan
bahwa sebaiknya obat kumur adalah berupa sediaan jernih. Ini dipengaruhi oleh surfaktan yakni yang dipakai adalah Tween 80. Dari orientasi maka konsentrasi Tween 80 yang dipilih untuk digunakan pada formula adalah 12%.
Untuk mengetahui SOK EBL yang telah di buat mempunyai kualitas yang lebih baik maka dilakukan juga orientasi perbandingan aktivitas antibakteri terhadap produk obat kumur yang beredar dipasaran, dan dipilih produk yang banyak dipakai yaitu ListerinR dan Obat Kumur BetadinR. Hasil dapat dilihat pada Lampiran 9.
4.6 Hasil Evaluasi Formula
4.6.1 Hasil pemeriksaan pH sediaan
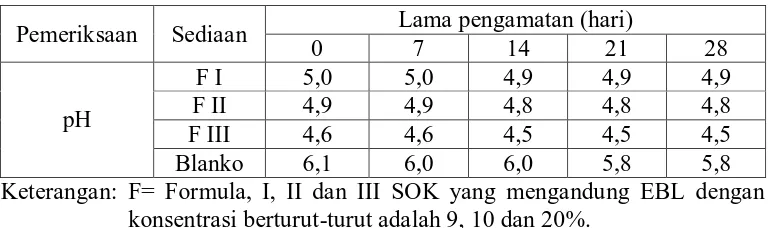
[image:41.595.113.501.420.534.2]Pemeriksaan pH SOK dilakukan pada minggu ke-0, minggu ke-1, minggu ke-2, minggu ke-3, dan minggu ke-4. Data pemeriksaan pH sediaan dapat dilihat pada Tabel 4.4 berikut.
Tabel 4.4 Data pemeriksaan pH sediaan
Pemeriksaan Sediaan Lama pengamatan (hari)
0 7 14 21 28
pH
F I 5,0 5,0 4,9 4,9 4,9
F II 4,9 4,9 4,8 4,8 4,8
F III 4,6 4,6 4,5 4,5 4,5
Blanko 6,1 6,0 6,0 5,8 5,8
Keterangan: F= Formula, I, II dan III SOK yang mengandung EBL dengan konsentrasi berturut-turut adalah 9, 10 dan 20%.
4.6.2 Hasil pemeriksaan stabilitas SOK
[image:42.595.112.499.198.395.2]Hasil pengamatan stabilitas SOK dapat dilihat pada Tabel 4.5, sebagai berikut:
Tabel 4.5 Data pengamatan perubahan bentuk, warna, dan bau SOK
Pengamatan Sediaan Lama pengamatan (hari)
0 7 14 21 28
Bentuk
F I b b b b b
F II b b b b b
F III b b b b b
Warna
FI c c c c c
F II ct ct ct ct ct
F III ct ct ct ct ct
Bau
F I bk bk bk bk bk
F II bk bk bk bk bk
F III bk bk bk bk bk
Keterangan: F = formula, I, II dan III SOK yang mengandung EBL dengan konsentrasi berturut-turut adalah 9, 10 dan 20%; b = baik; c = coklat; ct = coklat tua; bk = bau khas
Parameter yang diamati dalam uji kestabilan fisik ini meliputi perubahan bentuk, warna dan bau sediaan. Hasil uji stabilitas SOK menunjukkan bahwa seluruh sediaan yang dibuat tetap stabil dalam penyimpanan pada suhu kamar selama 28 hari pengamatan. Hasil pengamatan bentuk, menunjukkan bahwa seluruh SOK yang dibuat memiliki bentuk fisik yang baik dan stabil. Bertambahnya konsentrasi EBL yang digunakan maka bertambah pekat warna SOK yang dihasilkan.
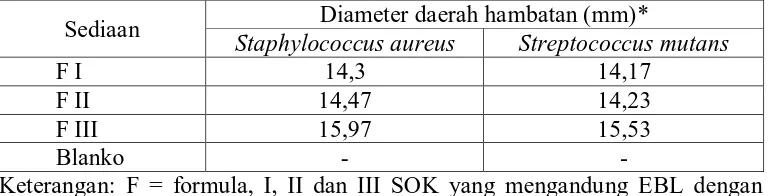
4.6.3 Hasil uji antibakteri SOK
Hasil uji SOK EBL dilakukan dengan metode difusi agar terhadap SA dan SM. Hasil uji dapat dilihat pada Tabel 4.6 berikut.
Tabel 4.6 Hasil uji aktivitas antibakteri SOK EBL terhadap SA dan SM.
Sediaan Diameter daerah hambatan (mm)*
Staphylococcus aureus Streptococcus mutans
F I 14,3 14,17
F II 14,47 14,23
F III 15,97 15,53
Blanko - -
Keterangan: F = formula, I, II dan III SOK yang mengandung EBL dengan konsentrasi berturut-turut adalah 9, 10 dan 20%; *= hasil rata-rata tiga kali pengukuran; - = tidak ada hambatan
[image:43.595.114.500.202.300.2]BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil uji aktivitas antibakteri ekstrak bunga lawang memiliki kemampuan menghambat bakteri Staphylococcus aureus dan Streptococcus mutans, pada konsentrasi 90, 100 dan 200 mg/ml. Dengan diameter daerah hambatan berturut-turut pada tiap bakteri adalah 14,3; 14,37; 15,93 dan 14,13; 14,27; 15,47 mm.
2. Ekstrak bunga lawang dapat diformulasi menjadi sediaan obat kumur dengan komposisi ekstrak bunga lawang sebagai zat aktif, Tween 80 sebagai surfaktan, sakarin sebagai korigensia saporis, peppermint oil sebagai korigensia odoris dan air suling sebagai pelarut.
3. Hasil uji aktivitas antibakteri sediaan obat kumur ekstrak bunga lawang memiliki kemampuan menghambat pertumbuhan Staphylococcus aureus dan Streptococcus mutans, pada konsentrasi 9, 10 dan 20% diperoleh diameter daerah hambatan berturut-turut pada tiap bakteri adalah 14,3; 14,47; 15,97 dan 14,17; 14,23; 15,53 mm.
5.2 Saran
1. Diharapkan peneliti selanjutnya agar membuat bentuk sediaan obat yang lain dari ekstrak bunga lawang seperti pasta gigi.
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Bunga Lawang
2.1.1 Morfologi
Tanaman ini merupakan jenis pohon-pohonan atau perdu, dengan tinggi mencapai 4-6 m. Memiliki daun tunggal, berbintik dengan ujung runcing. Bunganya berwarna kuning kehijau-hijauan. Buah terdiri atas 6-8 folikel, masing-masing folikel berisi 1 biji (Tjitrosoepomo, 2005). Buah berdiameter 2,5-4,5 cm (Ong, 2008). Buah masak berwarna coklat dan akan pecah pada bagian tengahnya yang bentuknya menyerupai bintang. Pada setiap folikel buah yang pecah tadi terdapat biji berwarna coklat, mengkilap dan tidak berbulu (Ali, et al, 2010).
2.1.2 Klasifikasi
Sistematika Tjitrosoepomo (2005): Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledoneae Ordo : Illiciales
Famili : Illiciaceae Genus : Illicium
2.1.3 Sinonim
Sinonim dari tanaman bunga lawang (Illicium verum Hook.f.) adalah Illicium san-ki Perrottet, badian star anise, chinese anise, chinese star anise,
indian anise, star anise, true star anise (Lim, 2012), sternanis, fructus anisi stellati (Tjitrosoepomo, 2005; Upton, et all, 2011), anisum stellatum, anisum badium (Wade, 1972).
2.1.4 Kandungan kimia
Bunga lawang mengandung minyak atsiri (anethole 85-90%), resin, lemak, tanin, pektin, terpen, limoeonene, estradol, safrol, timokuinon, flavonoid, glukosida, saponin, (Ali, et al, 2010). Bijinya mengandung minyak atsiri dan resin (Parthasaratthy, et al, 2008).
2.1.5 Khasiat
Bunga lawang digunakan untuk pengobatan gangguan pencernaan, obat batuk, antirematik, antidiare, antibakteri (Parthasarathy, et al, 2008), pengobatan infeksi saluran pernafasan, dispepsia (Fritz, et al, 2008), stimulan, karminatif (Tjitrosoepomo, 2005), antifungi, antioksidan (Saraswathy, 2013).
2.2 Ekstrak
2.2.1 Pengertian
Ekstraksi adalah suatu cara menarik satu atau lebih zat dari bahan asal menggunakan suatu cairan penarik atau pelarut. Umumnya dikerjakan untuk simplisia yang mengandung zat-zat berkhasiat atau zat-zat lain untuk keperluan tertentu. Tujuan utama ekstraksi dalam bidang farmasi adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan agar lebih mudah dipergunakan (kemudahan diabsorpsi, rasa, pemakaian, dan lain-lain) dan disimpan dibandingkan simplisia asal, dan tujuan pengobatannya lebih terjamin (Syamsuni, 2006).
2.2.2 Metode ekstraksi
Beberapa metode ekstraksi, yaitu : 1. Maserasi
Maserasi berasal dari kata “macerare” artinya melunakkan. Maserat adalah
hasil penarikan simplisia dengan cara maserasi (Syamsuni, 2006). Maserasi adalah proses pengekstrakan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (Ditjen POM, 2000). 2. Perkolasi
3. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan menggunakan alat soklet sehingga terjadi ekstraksi kontiniu dengan jumlah pelarut relative konstan dengan adanya pendingin balik (Ditjen POM, 2000).
4. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dalam jumlah pelarut terbatas yang relative konstan dengan adanya pendingin balik (Ditjen POM, 2000).
5. Digesti
Digesti merupakan maserasi kinetik dengan pengadukan pada temperatur yang tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50OC (Ditjen POM, 2000).
2.3 Bau Mulut
Didalam rongga mulut terdapat substrat protein eksogen (sisa makanan) dan protein endogen (protein saliva) yang banyak mengandung asam amino yang mengandung sulfur. Selain itu mikroorganisme juga banyak terdapat pada sel epitel mulut. Akumulasi dari substrat protein dan bakteri tersebut dapat menyebabkan bau mulut. Bau mulut dapat diatasi dengan cara mekanis (penyikatan gigi dan pembersihan lidah secara teratur) dan cara kimiawi (menggunakan obat kumur-kumur). Saat ini cara mengatasi bau mulut banyak dikembangkan dengan menggunakan obat kumur-kumur umumnya yang mengandung bahan antibakteri (Widagdo, et al., 2007).
2.4 Antibakteri
Menurut Jawetz, et al, 2001, Pengukuran aktivitas antibakteri dapat dilakukan dengan dua metode, yaitu:
1. Metode Dilusi
Metode ini menggunakan antibakteri dengan konsentrasi yang berbeda-beda pada media cair, lalu diinokulasikan dengan bakteri dan diinkubasi. Metode ini membutuhkan waktu pengerjaan yang lama sehingga jarang digunakan. 2. Metode Difusi
Antibakteri adalah zat yang digunakan untuk membasmi bakteri atau mikroba yang merugikan manusia. Antibakteri harus memiliki sifat toksisitas selektif setinggi mungkin. Artinya, zat tersebut haruslah bersifat sangat toksis bagi mikroba, tetapi relatif tidak toksis untuk hospes (Setiabudy, 2008). Berdasarkan sifat toksisistas selektif, aktivitas antibakteri ada yang bersifat menghambat pertumbuhan (bakteriostatik), dan ada yang bersifat membunuh mikroba (bakterisid) (Pratiwi, 2008).
2.5 Bakteri
2.5.1 Uraian umum
Bakteri adalah mikroorganisme bersel satu, berbentuk bola, batang atau
spiral berdiameter sekitar 0,5-1,0 m dan panjangnya 1,5-2,5 m. Berkembang
biak dengan cara membelah diri, serta demikian kecilnya hanya dapat dilihat dengan menggunakan mikroskop (Dwijoseputro, 1978). Walaupun bentuknya sederhana sekali, namun bakteri terdiri dari ribuan spesies yang berbeda (Pratiwi, 2008).
Menurut volk, et al, 1989, morfologi bakteri dibedakan atas tiga bagian: 1. Bentuk basil
yaitu bakteri yang mempunyai bentuk menyerupai batang atau silinder, membelah dalam satu bidang, berpasangan ataupun berbentuk rantai pendek atau panjang.
2. Bentuk kokus
yaitu bakteri yang bentuknya seperti bola-bola kecil, ada yang hidup sendiri dan ada yang berpasang-pasangan.
Contoh: Moonococcus gonorhoe, Diplococcus pneumoniae, Streptococcus viridans, Staphylococcus epydermidis, Sarcina luten.
3. Bentuk spiral
Contoh: Spirillum, Vibrio cholerae, Spirochaeta Palida.
Menurut Pelczar, et al, 1986, pertumbuhan dan perkembangbiakan bakteri dipengaruhi oleh :
1. Nutrisi
Sumber zat makanan bagi bakteri diperoleh dari senyawa karbon, nitrogen, sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi, tembaga dan kobalt), vitamin dan air untuk fungsi-fungsi metabolik dan pertumbuhannya.
2. Keasaman dan kebasaan (pH)
Kebanyakan bakteri mempunyai pH optimum pertumbuhan antara 6,5-7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan sangat asam atau sangat alkali. Bila bakteri dibiakkan dalam suatu medium yang mula-mula pHnya disesuaikan, maka mungkin sekali pH ini berubah karena adanya senyawa asam atau basa yang dihasilkan selama masa pertumbuhan.
3. Temperatur
4. Oksigen
Beberapa spesies bakteri dapat hidup dengan adanya oksigen dan sebaliknya spesies lain akan mati
5. Tekanan Osmosa
Osmosis adalah perpindahan air melewati suatu membran semipermeabel karena keseimbangan material terlarut dalam media. Medium yang baik bagi bakteri adalah medium yang isotonis dengan isi sel bakteri.
Pertumbuhan bakteri meliputi empat fase, yaitu: 1. Fase lag.
Fase lag merupakan fase adaptasi, yaitu fase penyesuaian mikroorganisme pada suatu lingkungan baru. Ciri fase ini adalah tidak adanya peningkatan jumlah sel, yang ada hanyalah peningkatan ukuran sel. Lama fase lag tergantung pada kondisi dan jumlah awal mikroorganisme dan media pertumbuhan (Pratiwi, 2008).
2. Fase eksponensial (fase log).
Fase ini merupakan fase dimana mikroorganisme tumbuh dan membelah pada kecepatan maksimum, tergantung pada genetika bakteri, sifat media, dan kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang bertambah secara eksponensial (Pratiwi, 2008).
3. Fase stasioner.
4. Fase kematian.
Pada fase ini terjadi penurunan nutrisi yang diperlukan oleh bakteri sehingga bakteri memasuki fase kematian. Laju kematian melampaui dari laju pertumbuhan, dan pada akhirnya pertumbuhan bakteri terhenti (Volk, et al., 1988).
2.5.2 Bakteri Staphylococcus aureus
2.5.2.1 Sistematika bakteri Staphylococcus aureus
Sistematika bakteri (Tjtrosoepomo, 2005): Kingdom : Monera
Divisi : Schizophyta Kelas : Schizomycetes Bangsa : Eubacteriales Suku : Micrococcaceae Genus : Staphylococcus
Species : Staphylococcus aureus
2.5.2.2 Uraian bakteri Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, berbentuk bola
atau kokus, berkelompok tidak teratur, diameter 0,8-1,0 m, tidak membentuk
Koloni pada pembenihan padat berwarna abu-abu sampai kuning keemasan, berbentuk bulat, halus, menonjol dan berkilau. Bakteri ini merupakan flora normal manusia, biasanya terdapat pada saluran pernafasan atas, mulut dan kulit, dapat juga ditemukan di udara dan lingkungan sekitar (Tortora, et al., 2001). Menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas dalam jaringan (Jawetz, 2001)
2.5.3 Bakteri Streptococcus mutans
2.5.3.1Sistematika bakteri Streptococcus mutans
Sistematika bakteri (Tjtrosoepomo, 2005): Kingdom : Monera
Divisi : Schizophyta Kelas : Shizomycetes Bangsa : Eubacteriales Suku : Lactobacillaceae Genus : Streptococcus
Species : Streptococcus mutans
2.5.3.2Uraian bakteri Streptococcus mutans
Streptococcus mutans merupakan bakteri gram positif, bersifat
Streptococcus mutans bersifat asidogenik, yaitu menghasilkan asam dan
mampu tinggal pada lingkungan asam. Bakteri ini mampu menempel pada permukaan gigi dan menghidrolisis sisa makanan menjadi komponen glukosa dan fruktosa kemudian oleh enzim glukosiltransferase dan fruktosiltransperase akan diubah menjadi dekstran dan fruktan. Oleh karena kemampuan ini, Streptococcus mutans dapat menyebabkan melekatnya bakteri dan sisa-sisa
makanan pada email gigi. Pada akhirnya terjadilah akumulasi bakteri, dekstran dan fruktan pada permukaan email gigi sehingga membentuk plak sebagai pencetus karies gigi dan menimbulkan bau yang kurang sedap (Brooks, et al., 2005; Tortora, et al., 2001).
2.6 Obat Kumur
Obat kumur adalah sediaan yang digunakan untuk mencuci mulut, tenggorokan dan gigi dengan maksud untuk membasmi mikroorganisme dan menghilangkan bau mulut (Jas, 2007). Sediaan ini sebaiknya aman digunakan setiap hari, tidak mendukung pertumbuhan bakteri, rasa sediaan dapat diterima, sebaiknya larutan jernih dan berbusa untuk mendorong konsep pembersihan mulut, dapat menyegarkan nafas serta meninggalkan rasa segar di mulut setelah menggunakannya (Mitsui, 1997).
Menurut Mitsui (1997) ada 3 tipe obat kumur, yaitu: a. Tipe langsung
Tipe ini digunakan langsung tanpa ada perlakuan tertentu. Sangat mudah digunakan dan banyak diaplikasikan.
b. Tipe konsentrat
Pada tipe ini larutan dasar ditambahkan dengan sejumlah air ketika akan digunakan.
c. Tipe bubuk
Pada tipe ini, sediaan obat kumur berupa bubuk. Bubuk dilarutkan dalam sejumlah air tertentu ketika ingin digunakan.
2.7 Komposisi Obat Kumur
1. Bahan aktif
Secara spesifik dipilih untuk kesehatan rongga mulut. Seperti antimikroba, antiinflamasi.
2. Pelarut
Biasanya air atau alkohol, digunakan untuk melarutkan bahan aktif, bahan perasa atau bahan-bahan tambahan lain untuk memperlama masa simpan. 3. Surfaktan.
Selain bahan tersebut, menurut Jas (2007) obat kumur juga mengandung zat tambahan lain berupa korigensia (saporis, odoris, koloris) untuk memperbaiki rasa, aroma maupun warna. Obat kumur harus memiliki rasa dan aroma yang dapat diterima dan memiliki sensasi rasa yang menyegarkan mulut. Sebagai bahan korigensia yang umum dipakai adalah peppermint oil, mentol, spearmint oil, sakarin.
2.8 Uraian Bahan
2.8.1 Sakarin
Sakarin merupakan serbuk atau hablur putih, tidak berbau atau berbau aromatik lemah. Dalam bentuk larutan encer rasanya sangat manis (Ditjen POM, 1995). Sakarin merupakan salah satu bahan pemanis yang digunakan dalam produk makanan dan minuman, produk kesehatan seperti obat kumur-kumur dan pasta gigi. Bahan ini digunakan untuk melapisi berbagai karakteristik rasa yang kurang menyenangkan atau meningkatkan sistem aroma. Dalam formulasi oral, sakarin digunakan pada konsentrasi 0,02-0,5%. Daya pemanisnya mencapai 300-600 kali sukrosa (Rowe, et.al., 2009).
2.8.2 Tween 80
2.8.3 Peppermint oil
Peppermint oil atau minyak permen adalah minyak atsiri yang diperoleh dengan destilasi uap dari bagian di atas tanah tanaman berbunga Mentha piperita Linne. (Familia Labiatae) yang segar, dimurnikan dengan cara
BAB I
PENDAHULUAN
1.1 Latar Belakang
Mahalnya obat sintesis membuat masyarakat beralih ke tumbuhan obat yang penggunaannya terutama untuk mencegah penyakit maupun menjaga kesegaran tubuh (Pradewa, 2008). Pemanfaatan tanaman obat lebih diminati karena efek samping kecil dan relatif aman daripada obat sintetis, namun informasi yang berkembang di masyarakat hanya sebatas bukti empiris dan belum banyak bukti ilmiah (Juliantina, dkk., 2010). Dari banyaknya tumbuhan obat yang dipakai dalam pengobatan tradisional maka dirasa perlu dilakukan penelitian untuk memperoleh kepastian bahwa masyarakat yang menggunakan berbagai tumbuhan mempunyai alasan, meskipun pemakaian dari bahan tumbuhan itu belum memakai dasar-dasar ilmiah yang tidak dapat dipertanggungjawabkan. Seiring dengan kemajuan ilmu pengetahuan dan teknologi maka para ilmuwan terus melakukan penelitian tentang khasiat tumbuhan obat (Tjitrosoepomo, 2005).
Farmakologi modern menunjukkan bahwa ekstrak buah ini mempunyai efek farmakologi yang luas terutama sebagai antimikroba, antioksida, insektisida, sedativ dan konvulsi (Wang, et al., 2011). Minyak bunga lawang digunakan sebagai stimulan, karminatif (Tjitrosoepomo, 2005), antirematik, gangguan pencernaan, infeksi pernafasan dan insomnia (Elena, 2008). Kandungan kimia bunga lawang yang bersifat antibakteri yaitu minyak atsiri (anetol 85-90%), tanin, flavonoida (Ali, et al., 2010).
Bau mulut sering dikeluhkan dan telah banyak cara yang dilakukan untuk mengatasinya (Pradewa, 2008). Kondisi yang dapat memicu bau mulut ialah meningkatnya bakteri dalam mulut, kurangnya flow saliva, pH rongga mulut yang lebih bersifat alkali dan adanya sisa makanan yang tertinggal yang diproses oleh flora normal mulut (Widagdo, dkk, 2007). Salah satu cara untuk menghilangkan bau mulut adalah berkumur dengan cairan pencuci mulut (obat kumur-kumur) yang berguna untuk membersihkan mulut dan menyegarkan nafas. Obat kumur-kumur yang mengandung antibakteri dapat juga digunakan untuk pencegahan penyakit mulut (Aneja, et al., 2010).
Staphylococcus aureus juga merupakan bakteri patogen utama bagi
manusia. Bakteri ini mampu berkolonisasi dalam tubuh manusia dan hampir setiap orang akan mengalami beberapa tipe infeksi yang ditimbulkannya (Jawetz, 2001). Bakteri ini merupakan flora normal manusia, biasanya terdapat pada saluran pernafasan atas, mulut dan kulit. (Aneja, et al., 2010).
Obat kumur adalah larutan yang biasanya mengandung bahan penyegar nafas, astringen, demulsen, antibakteri untuk menyegarkan dan membersihkan saluran pernafasan, yang pemakaiannya dengan berkumur (Backer, 1990). Formulasi obat kumur selain bahan aktif yang umum digunakan sebagai antibakteri juga digunakan bahan tambahan lain seperti surfaktan dan korigensia (Mitsui, 1997; Jas, 2007).
Dari uraian di atas, untuk mempermudah penggunaan bunga lawang ini maka dilakukan penelitian tentang uji aktivitas antibakteri ekstrak bunga lawang (Illicium verum Hook.f) dalam sediaan obat kumur-kumur terhadap bakteri Staphylococcus aureus dan Streptococcus mutans.
1.2 Perumusan Masalah
1. Apakah ekstrak bunga lawang mempunyai aktivitas antibakteri terhadap Staphylococcus aureus dan Streptococcus mutans?
2. Apakah ekstrak bunga lawang dapat diformulasikan menjadi sediaan obat kumur?
1.3 Hipotesis
1 Ekstrak bunga lawang mempunyai aktivitas antibakteri terhadap Staphylococcus aureus dan Streptococcus mutans.
2 Ekstrak bunga lawang dapat diformulasikan menjadi sediaan obat kumur. 3 Sediaan obat kumur yang mengandung ekstrak bunga lawang mempunyai
aktivitas antibakteri terhadap Staphylococcus aureus dan Streptococcus mutans.
1.4 Tujuan Penelitian
1 Untuk mengetahui aktivitas antibakteri ekstrak bunga lawang terhadap Staphylococcus aureus dan Streptococcus mutans.
2 Untuk mengetahui apakah ekstrak bunga lawang dapat diformulasikan menjadi sediaan obat kumur.
3 Untuk mengetahui adanya aktivitas antibakteri dari sediaan obat kumur yang mengandung ekstrak bunga lawang terhadap Staphylococcus aureus dan Streptococcus mutans
1.5 Manfaat Penelitian
FORMULASI EKSTRAK BUNGA LAWANG
(Illicium verum Hook.f.) SEBAGAI SEDIAAN OBAT KUMUR DAN UJI AKTIVITAS ANTIBAKTERI
ABSTRAK
Bunga lawang dapat digunakan untuk mengatasi bau mulut karena mengandung senyawa polifenol yang berkhasiat sebagai antibakteri. Bau mulut terjadi akibat adanya bakteri pada rongga mulut yang disebabkan oleh sisa-sisa makanan yang tertinggal di sela-sela gigi. Salah satu cara untuk mengatasi bau mulut dengan menggunakan obat kumur yang mengandung antibakteri (flavonoida dan tanin). Tujuan penelitian ini adalah mengetahui aktivitas antibakteri ekstrak etanol bunga lawang dan dapat diformulasi dalam bentuk sediaan obat kumur.
Serbuk bunga lawang dimaserasi dengan menggunakan pelarut etanol 80% selama 5 hari sambil sering diaduk, enap tuangkan atau saring dan tampung maserat I. Ampas kemudian dimaserasi kembali dengan sisa pelarut selama 2 hari, enap tuangkan atau saring dan campurkan dengan maserat I. Maserat yang diperoleh diuapkan dengan rotary evaporator dan selanjutnya dipekatkan dengan freeze dryer hingga diperoleh ekstrak kental. Ekstrak bunga lawang (EBL) yang diperoleh di uji aktivitas antibakteri terhadap Staphylococcus aureus (SA) dan Streptococcus mutans (SM) dengan metode difusi agar. EBL dengan variasi konsentrasi 9, 10 dan 20% diformulasi menjadi sediaan obat kumur (SOK) menggunakan Tween 80, sakarin, dan oleum peppermint. Evaluasi SOK dilakukan terhadap stabilitas fisik, pH dan uji antibakteri SOK.
EBL memberikan aktivitas antibakteri dengan batas daerah hambat yang efektif pada konsentrasi 90, 100 dan 200 mg/ml berturut-turut adalah 14,3; 14,4; 15,9 mm untuk SA dan 14,1; 14,3; 15,5 mm untuk SM. Konsentrasi hambat minimum dari EBL diperoleh 20 mg/ml dengan diameter hambat 8,23 mm untuk SA dan 30 mg/ml dengan diameter hambat 9,43 mm untuk SM. SOK berwarna coklat jernih sampai coklat tua jernih dengan aroma mint dan rentang pH 4,6-5,0. Hasil stabilitas fisik SOK selama penyimpanan 28 hari pada suhu kamar warnanya tidak berubah dengan rentang pH 4,5-5,0. SOK dengan konsentrasi 9, 10 dan 20% memiliki daya hambat berturut-turut 14,3; 14,5; 15,9 mm untuk SA dan 14,1; 14,2; 15,5 mm untuk SM.
FORMULATION OF STAR ANISE
(Illicium verum Hook.f.) EXTRACT AS MOUTHWASH PREPARATIONS AND ANTIBACTERIAL ACTIVITY TEST
ABSTRACT
Star anise can be used to overcome bad breath because its contain polyphenolic compounds are efficacious as an antibacterial. Bad breath caused by bacteria in the oral cavity caused by the remnants of food left in the teeth. One way to address bad breath by using mouthwash that contains antibacterial (flavonoids and tannins). The purpose of this study are to determine antibacterial activity of ethanol extract of star anise and can be formulated in dosage forms mouthwash.
Anise powder macerated using ethanol 80% for 5 days while stirring often, ponder pour or strain and capacity maserat I. Dregs then macerated back with the rest of the solvent for 2 days, ponder pour or strain and mix with maserat I. Maserat obtained evaporated with a rotary evaporator and further concentrated by freeze dryer to obtain a thick extract. Anise extract (AL) obtained in the test antibacterial activity against Staphylococcus aureus (SA) and Streptococcus mutans (SM) by the agar diffusion method. AL with variations in the concentration of 9, 10 and 20% formulated in mouthwash using Tween 80, saccharin and oleum peppermint. Moutwash evaluation conducted on the physical stability, pH and antibacterial test.
AL provide antibacterial activity to limit the area of effective inhibitory concentrations of 90, 100 and 200 mg/ml, respectively, 14,3; 14,4; 15,9 mm for SA and 14,1; 14,3; 15,5 mm for SM. The minimum inhibitory concentration of AL obtained 20 mg/ml with inhibitory diameter 8,23 mm for SA and 30 mg/ml with inhibitory diameter 9,43 mm for SM. The color of mouthwash clear brown to dark brown clear with aromas of mint and a pH range of 4,6-5,0. Results mouthwash physical stability during storage of 28 days at room temperature the color does not change with the pH range of 4,5-5,0. Mouthwash with concentrations of 9, 10 and 20% inhibition has successively 14,3; 14,5; 15,9 mm for SA and 14,1; 14,2; 15,5 mm for SM.
FORMULASI EKSTRAK BUNGA LAWANG
(Illicium verum Hook.f.) SEBAGAI SEDIAAN OBAT KUMUR
DAN UJI AKTIVITAS ANTIBAKTERI
SKRIPSI
atu syarat untuk
memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi Utara
OLEH:
HERLIN ERNITA HUTASOIT
NIM 111524090
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
FORMULASI EKSTRAK BUNGA LAWANG
(Illicium verum Hook.f.) SEBAGAI SEDIAAN OBAT KUMUR
DAN UJI AKTIVITAS ANTIBAKTERI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
HERLIN ERNITA HUTASOIT
NIM 111524090
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
FORMULASI EKSTRAK BUNGA LAWANG
(Illicium verum Hook.f.) SEBAGAI SEDIAAN OBAT KUMUR
DAN UJI AKTIVITAS ANTIBAKTERI
OLEH:
HERLIN ERNITA HUTASOIT
NIM 111524090
Dipertahankan di hadapan panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 15 Juli 2014 Pembimbing I
Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Pembimbing II
Dr. Kasmirul Ramlan Sinaga, M.S., Apt. NIP 195504241983031003
Panitia Penguji,
Prof. Dr. Hakim Bangun, Apt. NIP 195201171980031002
Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dra. Erly Sitompul, M.Si., Apt. NIP 195006121980032001
Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001 Medan, 2014
Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang senantiasa memberikan rahmat dan kasih karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Formulasi Ekstrak Bunga Lawang (Illicium verum Hook.f.) Sebagai Sediaan Obat Kumur dan Uji Aktivitas Antibakteri”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
USU yang telah mendidik dan memberikan arahan serta bimbingan kepada penulis selama masa perkuliahan.
Terima kasih yang sebesar-besarnya kepada kedua orang tua tercinta, suami tersayang dan putri terkasih saya, yang telah memberikan doa, semangat dan motivasi baik moril maupun materil kepada penulis selama masa perkuliahan hingga selesainya penyusunan skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih memiliki banyak kekurangan, oleh karena itu sangat diharapkan kritikan dan saran yang dapat menyempurnakan skripsi ini. Semoga skripsi ini bermanfaat bagi kita semua.
Medan, 2014 Penulis,
FORMULASI EKSTRAK BUNGA LAWANG
(Illicium verum Hook.f.) SEBAGAI SEDIAAN OBAT KUMUR DAN UJI AKTIVITAS ANTIBAKTERI
ABSTRAK
Bunga lawang dapat digunakan untuk mengatasi bau mulut karena mengandung senyawa polifenol yang berkhasiat sebagai antibakteri. Bau mulut terjadi akibat adanya bakteri pada rongga mulut yang disebabkan oleh sisa-sisa makanan yang tertinggal di sela-sela gigi. Salah satu cara untuk mengatasi bau mulut dengan menggunakan obat kumur yang mengandung antibakteri (flavonoida dan tanin). Tujuan penelitian ini adalah mengetahui aktivitas antibakteri ekstrak etanol bunga lawang dan dapat diformulasi dalam bentuk sediaan obat kumur.
Serbuk bunga lawang dimaserasi dengan menggunakan pelarut etanol 80% selama 5 hari sambil sering diaduk, enap tuangkan atau saring dan tampung maserat I. Ampas kemudian dimaserasi kembali dengan sisa pelarut selama 2 hari, enap tuangkan atau saring dan campurkan dengan maserat I. Maserat yang diperoleh diuapkan dengan rotary evaporator dan selanjutnya dipekatkan dengan freeze dryer hingga diperoleh ekstrak kental. Ekstrak bunga lawang (EBL) yang diperoleh di uji aktivitas antibakteri terhadap Staphylococcus aureus (SA) dan Streptococcus mutans (SM) dengan metode difusi agar. EBL dengan variasi konsentrasi 9, 10 dan 20% diformulasi menjadi sediaan obat kumur (SOK) menggunakan Tween 80, sakarin, dan oleum peppermint. Evaluasi SOK dilakukan terhadap stabilitas fisik, pH dan uji antibakteri SOK.
EBL memberikan aktivitas antibakteri dengan batas daerah hambat yang efektif pada konsentrasi 90, 100 dan 200 mg/ml berturut-turut adalah 14,3; 14,4; 15,9 mm untuk SA dan 14,1; 14,3; 15,5 mm untuk SM. Konsentrasi hambat minimum dari EBL diperoleh 20 mg/ml dengan diameter hambat 8,23 mm untuk SA dan 30 mg/ml dengan diameter hambat 9,43 mm untuk SM. SOK berwarna coklat jernih sampai coklat tua jernih dengan aroma mint dan rentang pH 4,6-5,0. Hasil stabilitas fisik SOK selama penyimpanan 28 hari pada suhu kamar warnanya tidak berubah dengan rentang pH 4,5-5,0. SOK dengan konsentrasi 9, 10 dan 20% memiliki daya hambat berturut-turut 14,3; 14,5; 15,9 mm untuk SA dan 14,1; 14,2; 15,5 mm untuk SM.
FORMULATION OF STAR ANISE
(Illicium verum Hook.f.) EXTRACT AS MOUTHWASH PREPARATIONS AND ANTIBACTERIAL ACTIVITY TEST
ABSTRACT
Star anise can be used to overcome bad breath because its contain polyphenolic compounds are efficacious as an antibacterial. Bad breath caused by bacteria in the oral cavity caused by the remnants of food left in the teeth. One way to address bad breath by using mouthwash that contains antibacterial (flavonoids and tannins). The purpose of this study are to determine antibacterial activity of ethanol extract of star anise and can be formulated in dosage forms mouthwash.
Anise powder macerated using ethanol 80% for 5 days while stirring often, ponder pour or strain and capacity maserat I. Dregs then macerated back with the rest of the solven