ULTRAFILTRASI DAN REVERSE OSMOSIS
SOFIA HALIMI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2
RINGKASAN
SOFIA HALIMI. C34052160. Recovery dan Pemurnian Enzim Protease dari Jeroan Ikan Tuna dengan Teknologi Ultrafiltrasi dan Reverse Osmosis.Dibimbing Oleh BAMBANG RIYANTO dan UJU.
Proses ultrafiltrasi (UF) dapat digunakan untuk pemisahan dan pemurnian protein serta berbagai bentuk makromolekul lainnya yang memiliki keunggulan retensi tinggi, namun tercatat ada beberapa kekurangan yang timbul yaitu fouling dan polarisasi konsentrasi yang tinggi. Fouling dan polarisasi konsentrasi pada membran sangat dipengaruhi oleh ukuran pori atau molecular weight cut off (MWCO), bahan penyusun membran, tekanan transmembran (TMP) dan suhu. Tujuan dari penelitian ini adalah (1) memurnikan ekstrak enzim protease dari jeroan ikan tuna dengan proses ultrafiltrasi (UF), (2) mempelajari pengaruh MWCO, material membran serta kondisi operasi (TMP dan suhu) terhadap fluks dan rejeksi dari membran UF, (3) mengetahui pengaruh penggunaan reverse osmosis (RO) sebagai diafiltrasi, (4) analisis tingkat kemurnian dari enzim protease dengan SDS-PAGE.
Penelitian ini dilaksanakan dalam beberapa tahapan yang meliputi preparasi dan analisis proksimat jeroan ikan tuna, pembuatan ekstrak enzim protease dari jeroan ikan tuna dengan penambahan buffer Tris-Cl dan prefiltrasi dengan nilon ukuran 225 mesh dan 375 mesh serta penyaringan vakum menggunakan kertas saring kasar. Tahapan selanjutnya adalah melakukan karakterisasi membran berupa penentuan tingkat permeabilitas dan tahanan membran. Tahapan ini kemudian dilanjutkan dengan melakukan proses filtrasi menggunakan membran ultrafiltrasi dan penentuan waktu tunak (steady state). Variabel bebas yang diteliti meliputi MWCO, TMP, dan suhu, sedangkan variabel tak bebas yang diamati meliputi fluks dan rejeksi (kadar protein dan aktivitas enzim protease). Setelah itu dilakukan proses pemekatan dengan menggunakan membran reverse osmosis. Tahapan terakhir adalah berupa analisis kemurnian dengan SDS-PAGE.
Enzim protease dari jeroan ikan tuna dapat dimurnikan melalui proses filtrasi menggunakan membran UF dan RO. Peningkatan TMP pada membran UF poliakrilonitril MWCO 100 kDa dapat meningkatkan fluks permeat ketika TMP lebih rendah dari 110 kPa dan TMP menjadi tidak berpengaruh ketika TMP lebih besar dari 110 kPa. Hal serupa juga terjadi pada membran UF polisulfon MWCO 50 kDa, yakni pada saat nilai TMP 170 kPa. Fluks permeat pada membran UF poliakrilonitril MWCO 100 kDa lebih besar dibandingkan UF polisulfon MWCO 50 kDa. Nilai rejeksi protein dan aktivitas enzim protease pada kedua membran tidak dipengaruhi oleh TMP dan suhu, akan tetapi lebih dipengaruhi oleh MWCO dan material membran. Membran UF polisulfon MWCO 50 kDa merejeksi lebih besar dibandingkan dengan UF poliakrilonitril MWCO 100 kDa.
SOFIA HALIMI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Nama : Sofia Halimi
Nrp : C34052160
Departemen : Teknologi Hasil Perairan
Menyetujui
Pembimbing I, Pembimbing II,
(Bambang Riyanto, S.Pi, M.Si) (Uju, S.Pi, M.Si)
NIP: 19690603 199802 1 001 NIP: 19730612 200012 1 001
Mengetahui
Ketua Departemen Teknologi Hasil Perairan
(Dr. Ir. Ruddy Suwandi, M.S, M.Phil) NIP: 19580511 198503 1 002
Puji syukur penulis panjatkan kehadirat Allah SWT, karena atas berkat rahmat serta karunia-Nya penulis mampu menyelesaikan penulisan skripsi ini dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin mengucapkan terima kasih sebesar-besarnya kepada:
1. Bapak Bambang Riyanto, S.Pi, M.Si dan Bapak Uju, S.Pi, M.Si selaku komisi pembimbing yang telah banyak memberikan pengarahan dan bimbingan kepada penulis dalam penelitian dan penulisan skripsi ini.
2. Ibu Dr. Tati Nurhayati, S.Pi, M.Si selaku dosen penguji atas arahan dan saran dalam perbaikan skripsi ini.
3. Dosen, laboran dan staf Departemen Teknologi Hasil Perairan atas bantuannya selama penulis menjalani pendidikan di THP FPIK IPB.
4. Bapak Bambang dan karyawan PT Tridaya atas bantuan dan kerjasamanya. 5. Ibu Dewi, laboran Laboratorium Bioteknologi Hewan, PAU atas bantuan dan
kerjasamanya.
6. Bapak Nur, teknisi di Pilot Plan, PAU atas bantuan dan kerjasamanya. 7. Departemen Agama atas beasiswa dan bantuannya.
8. Ayah dan Ibu atas doa serta curahan kasih sayang, perhatian, dukungan dan semangat serta kesabaran yang diberikan kepada penulis.
9. Kakak dan adikku tersayang yang selalu memberikan keceriaan kepada penulis.
10.Keluarga besar di Surabaya, Sidoarjo dan Lawang (kakek, nenek, om, tante, dan sepupu) atas doa, dukungan dan harapan yang besar kepada penulis. Semoga penulis dapat memenuhi semua harapan tersebut.
11.Ameria Ulfa, teman seperjuangan sejak duduk di bangku Aliyah atas pengertian, semangat dan keceriaan selama ini.
v
13.Fitri, Tia, Uut, Erna, Chom, Dini, Sena, Dan, Teteh, Evi, Ade, Jamal, Bayu, Irfan, Adho, Seno, dan seluruh teman-teman THP 42 yang tidak bisa saya sebutkan namanya satu persatu atas bantuan dan dukungan yang diberikan kepada penulis untuk menyelesaikan penelitian dan skripsi ini.
14.CSS MoRA IPB 2005 (Mirza, Near, Isna, Eva, Firoh, Anci, Suci, Rezi, Ila,
Lalu, Ilul, Yana, Yahman, Asro’ dan Priwan) atas persahabatan, semangat dan
kasih sayang yang diberikan serta kesabaran dalam mendengarkan keluh kesah penulis. Semoga kita semua bisa meraih kesuksesan di masa depan. 15.Teman-teman Asrama Putri A3 Lorong 9 khususnya kamar 392, Kosan
Gunarti, dan Kosan D’OCEAN atas kebersamaan, keceriaan dan dukungan
baik moril, materiil dan semuanya sehingga penulis bisa menyelesaikan pendidikan.
16.Terima kasih kepada guru-guru TK sampai Aliyah atas bimbingannya selama ini.
Penulis menyadari bahwa dalam penulisan usulan penelitian ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun sangat diharapkan. Semoga tulisan ini bermanfaat bagi penulis khususnya dan bagi pembaca pada umumnya.
Bogor, April 2010
vi
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi “Recovery dan Pemurnian Enzim Protease dari Jeroan Ikan Tuna dengan Teknologi Ultrafiltrasi dan Reverse Osmosis” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi atau kutipan yang berasal dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, April 2010
Sofia Halimi C34052160
vii
RIWAYAT HIDUP
SOFIA HALIMI dilahirkan di Surabaya, Jawa Timur pada tanggal 15 Oktober 1987. Penulis merupakan putra kedua dari empat bersaudara, pasangan Bapak Achmad Djuwaeni dan Ibu Hariyati. Penulis mengawali pendidikan di TK Kurnia Rachmat, Surabaya dan menyelesaikannya pada tahun 1993. Kemudian melanjutkan pendidikan dasar yang diselesaikan pada tahun 1999 di SDN Tandes Kidul II Surabaya, Jawa Timur. Penulis diterima di SLTP Wachid Hasyim 7, Surabaya, Jawa Timur pada Tahun 1999 sampai dengan 2002. Pada tahun 2005 penulis menyelesaikan pendidikan Sekolah Menengah Atas di Madrasah Aliyah Unggulan Amanatul Ummah Surabaya, Jawa Timur.
Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor sebagai mahasiswa Tingkat Persiapan Bersama melalui jalur Beasiswa Utusan Daerah Departemen Agama. Pada tahun 2006, penulis diterima sebagai mahasiswa program Mayor-Minor di Departemen Teknologi Hasil Perairan dengan Minor Bioproses. Selama menempuh pendidikan, penulis aktif di Forum Keluarga Muslim Fakultas Perikanan dan Ilmu Kelautan divisi Creative and Inovative for Allah periode 2006 - 2007, dan Himpunan Mahasiswa Hasil Perikanan divisi Aquatic Product Scientis Club periode 2007 - 2008. Pada tahun 2009 penulis aktif menjadi asisten praktikum beberapa mata kuliah diantaranya adalah mata kuliah Diversifikasi dan Pengembangan Produk Hasil Perairan, Pengolahan Hasil Samping dan Limbah Hasil Perairan, serta Teknologi Pengolahan Hasil Perairan.
Penulis juga aktif dalam menulis karya ilmiah, diantaranya adalah Fortifikasi Protein Tepung Ikan pada Weaning Food Instan Berbahan Tepung Maizena sebagai Alternatif MP-ASI Lokal (2008), Pelatihan Pertanian Modern untuk Menciptakan Karakter Unggulan Insan Pesantren di Pesantren Darul Fallah, Ciampea, Bogor (2008), dan Pengembangan Industri Pemurnian Enzim Protease dari Jeroan Ikan Tuna dengan Teknologi Ultrafiltrasi dan Reverse Osmosis yang didanai oleh Dikti pada tahun 2009.
vii DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
1 PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA 2.1 Jeroan Ikan ... 3
2.2 Protease ... 4
2.3 Ultrafiltrasi ... 5
2.4 Reverse Osmosis ... 7
3 METODOLOGI 3.1 Waktu dan Tempat ... 10
3.2 Alat dan Bahan ... 10
3.3 Metode Penelitian ... 10
3.3.1 Preparasi jeroan ikan tuna ... 11
3.3.2 Ekstraksi jeroan ikan tuna (ekstrak enzim protease kasar) 12
3.3.3 Penentuan permeabilitas dan tahanan membran ... 13
3.3.4 Proses ulltrafiltrasi ... 13
3.3.5 Proses reverse osmosis untuk pemekatan ... 14
3.4 Analisis dan Karakterisasi ... 15
3.4.1 Fluks (Cheryan 1998) ... 15
3.4.2 Rejeksi (Cheryan 1998) ... 15
3.4.3 Kadar air (AOAC 2007) ... 15
3.4.4 Kadar lemak (AOAC 2007) ... 16
3.4.5 Kadar abu (AOAC 2007) ... 16
3.4.6 Kadar protein (AOAC 2007) ... 17
3.4.7 Kadar protein (Bradford 1976) ... 17
3.4.8 Penentuan aktivitas enzim (Walter 1988) ... 18
viii 4 HASIL DAN PEMBAHASAN
4.1 Komposisi Kimia Jeroan Ikan Tuna ... 21
4.2 Permeabilitas dan Tahanan Membran ... 21
4.2.1 Permeabilitas membran ... 22
4.2.2 Tahanan membran ... 23
4.3 Waktu Tunak (Steady State) Fluks ... 25
4.4 Pengaruh Tekanan Transmembran dan Suhu terhadap Fluks ... 26
4.5 Pengaruh Tekanan Transmembran dan Suhu terhadap Nilai Rejeksi ... 28
4.6 Kadar Protein dan Aktivitas Enzim pada Setiap Tahapan filtrasi serta Penggunaan RO sebagai Diafiltrasi ... 32
4.7 Penentuan Tingkat Kemurnian Enzim Protease dengan SDS-PAGE ... 34
5 KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
ix
DAFTAR TABEL
No. Halaman
1. Karakteristik rejeksi membran RO ... 7
2. Pembuatan larutan standar BSA konsentrasi 0-0,01 mg/ml ... 18
3. Metode analisis aktivitas enzim protease ... 18
4. Komposisi gel SDS-PAGE ... 20
5. Komposisi kimia jeroan tuna ... 21
6. Nilai kadar protein dan aktivitas enzim protease pada ekstrak protease jeroan ikan tuna di setiap tahapan filtrasi ... 32
x
DAFTAR GAMBAR
No. Halaman
1. Kisaran ukuran pori membran ... 6
2. Sistem aliran umpan pada membran ... 8
3. Tahapan penelitian ... 12
4. Diagram alir proses membran ... 14
5. Ekstrak kasar dan hasil prefiltrasi ... 21
6. Pengaruh TMP dan suhu umpan air destilasi terhadap nilai fluks pada membran UF poliakrilonitril MWCO 100 kDa ... 22
7. Pengaruh TMP dan suhu umpan air destilasi terhadap nilai fluks pada membran UF polisulfon MWCO 50 kDa ... 22
8. Pengaruh suhu umpan air distilasi terhadap nilai tahanan membran pada membran UF poliakrilonitril MWCO 100 kDa ... 24
9. Pengaruh suhu umpan air distilasi terhadap nilai tahanan membran pada membran UF polisulfon MWCO 50 kDa ... 24
10. Hubungan antara fluks dengan waktu pada membran UF poliakrilonitril MWCO 100 dan polisulfon MWCO 50 kDa ... 25
11. Pola perubahan nilai fluks permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF poliakrilonitril MWCO100 kDa ... 26
12. Pola perubahan nilai fluks permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF polisulfon MWCO 50 kDa ... 26
13. Pola perubahan nilai rejeksi protein pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF poliakrilonitril MWCO 100 kDa ... 29
14. Pola perubahan nilai rejeksi protein pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF polisulfon MWCO 50 kDa ... 29
15. Pola perubahan nilai rejeksi enzim protease pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF poliakriloniitril MWCO 100 kDa ... 30
16. Pola perubahan nilai rejeksi enzim protease pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF polisulfon MWCO 50 kDa ... 30
xi
DAFTAR LAMPIRAN
No. Halaman
1. Spesifikasi membran yang digunakan ... 44
2. Komposisi bahan untuk membuat gel pemisah maupun gel penahan 45
3. Komposisi bahan untuk membuat larutan yang digunakan dalam proses pewarnaan silver ... 46
4. Data hubungan antara tekanan transmembran (∆P) dan fluks (J) dengan menggunakan air distilasi pada suhu umpan 30 °C, 35 °C dan 40 °C pada membran UF poliakrilonitril MWCO 100 kDa ... 47
5. Data hubungan antara tekanan transmembran (∆P) dan fluks (J) dengan menggunakan air distilasi pada suhu umpan 30 °C, 35 °C dan 40 °C pada membran UF polisulfon MWCO 50 kDa ... 48
6. Data hubungan antara tekanan transmembran (∆P) dan fluks (J) dari ekstrak enzim protease jeroan ikan tuna pada suhu umpan 30 °C, 35 °C dan 40 °C pada membran UF poliakrilonitril MWCO 100 kDa ... 49
7. Data hubungan antara tekanan transmembran (∆P) dan fluks (J) dari ekstrak enzim protease jeroan ikan tuna pada suhu umpan 30 °C, 35 °C dan 40 °C pada membran UF polisulfon MWCO 50 kDa ... 50
8. Data rejeksi enzim protease ... 51
9. Data rejeksi dan kurva standar protein ... 52
10. Data perhitungan bobot molekul enzim protease ... 54
1.1Latar Belakang
Indonesia merupakan salah satu produsen utama ikan tuna dunia. Produksi ikan tuna Indonesia pada tahun 2006-2007 mengalami peningkatan sebesar 20%, yaitu dari 159.404 ton pada tahun 2006 menjadi 191.558 ton pada tahun 2007 (BPS 2009). Industri pengolahan tuna menghasilkan limbah dalam jumlah besar, sebanyak 30% - 35% merupakan limbah cair yang terdiri dari darah, konsentrat dan minyak ikan tuna, sebesar 25% - 30% merupakan limbah padat yang terdiri dari kepala, kulit, dan jeroan (Prasertsan et al. 1988).
Klomklao et al. (2006) melaporkan bahwa jeroan ikan tuna memiliki potensi yang besar sebagai sumber enzim protease. Enzim jeroan ikan tuna, secara umum terdiri dari pepsin (pada bagian gastric mucosa), tripsin, dan kemotripsin (pada bagian pankreas, pyloric caeca, dan usus) (Simpson 2000). Protease merupakan kelompok enzim yang sangat penting dalam industri enzim dunia saat ini, tercatat hampir sekitar 50% total penjualan industri enzim diperoleh dari enzim ini (Rao et al. 1998). Protease yang dihasilkan dari jeroan ikan tuna memiliki sifat unik untuk berbagai aplikasi industri, seperti deterjen, makanan, pharmaceutical, kulit, dan industri tekstil atau kain sutra (Haard 1992). Ekstrak tripsin dari jeroan ikan tuna yang digunakan dalam proses pemurniaan gelatin dari kulit ikan, ternyata dapat menghasilkan gelatin antioksidatif yang memiliki nilai tambah dengan harga jual yang tinggi (Khantaphant dan Benjakul 2008).
Aplikasi enzim yang luas menuntut adanya teknik pemurnian enzim yang ekonomis, efisien, dan dapat diterapkan pada skala besar. Teknik di laboratorium (kromatografi dan affinity purification) dapat digunakan untuk pemurnian enzim (Gallo et al. 2005; Najavi dan Kembhavi 2005), tetapi teknik ini hanya sesuai untuk produksi dalam skala kecil. Selain itu kelemahan dari teknik ini adalah membutuhkan peralatan yang kompleks, efisiensi rendah, dan biaya produksi tinggi.
murah, produktivitas kinerja proses yang tinggi dan kemurnian produk yang dapat diandalkan. Proses ini juga lebih mudah diterapkan pada industri pemurnian skala besar dibandingkan dengan teknik lain seperti kromatografi dan elektroforesis (Li et al. 2008a). Saat ini, UF telah digunakan untuk pemisahan berbagai komponen biologi seperti lisozim dari putih telur ayam (Ghosh dan Cui 2000), protease dari air cucian surimi (Dewit dan Morrissey 2002), protein murni dari jus buah kentang (Zwijnenberg et al. 2002), plasma protein dari darah ayam (Torres 2002), dan enzim protease murni dari ekstrak spleen tuna (Li et al. 2006).
Fouling dan polarisasi konsentrasi dapat menyebabkan penurunan fluks dan umur membran yang relatif singkat. Fouling pada membran sangat dipengaruhi oleh karakteristik membran yang meliputi ukuran pori atau molecular weight cut off (MWCO) dan bahan penyusun membran (Noordmand et al. 2002), sedangkan polarisasi konsentrasi sangat dipengaruhi oleh konsentrasi umpan dan kondisi operasi membran yang meliputi tekanan transmembran (TMP), suhu serta laju alir (Cheryan 1998).
Li et al. (2006) berhasil melakukan pemurnian protease dengan beberapa rangkaian proses meliputi pretreatment dengan nilon mesh, ultrafiltrasi dan diafiltrasi. Diafiltrasi yang digunakan adalah filtrasi menggunakan UF 30 kDa. Permasalahan yang muncul pada proses ini meliputi munculnya fouling dan polarisasi konsentrasi. Berdasarkan hal tersebut, penggunaan membran RO untuk diafiltrasi protease, pemilihan karakteristik membran, serta pengoperasian parameter yang tepat pada proses UF diharapkan akan dapat meningkatkan kinerja proses membran dalam memisahkan dan memurnikan enzim protease dari jeroan ikan tuna.
1.2Tujuan
Tujuan dari penelitian ini adalah:
1. Memurnikan ekstrak enzim protease dari jeroan ikan tuna dengan proses ultrafiltrasi (UF).
2. Mempelajari pengaruh MWCO, material membran, serta kondisi operasi (tekanan transmembran dan suhu) terhadap fluks dan rejeksi dari membran UF. 3. Mengetahui pengaruh penggunaan reverse osmosis (RO) sebagai diafiltrasi. 4.
2.1Jeroan Ikan
Jeroan ikan merupakan salah satu limbah yang dihasilkan dari sebagian besar kegiatan perikanan, baik penangkapan maupun pengolahan. Jeroan ikan yang dihasilkan selama suatu proses pengolahan adalah sumber enzim potensial seperti protease yang memiliki beberapa keunikan untuk aplikasi industri (Klomklao et al. 2005). Jeroan ikan tuna yellowfin, cakalang atau skipjack dan tongkol kaya akan sumber protease potensial yang dapat diekstrak dan dimanfaatkan lebih lanjut. Klomklao et al. (2006) melaporkan bahwa penambahan jeroan atau spleen ikan cakalang (tuna skipjack) pada saus ternyata dapat mempercepat pembentukan hidrolisat protein ikan selama tahapan proses fermentasi. Spleen tuna menyumbang 1,5% dari berat total tubuh ikan tuna dan Guerard et al. (2002) menyatakan bahwa spleen tuna kaya akan protein dengan komposisi asam amino esensial yang seimbang. Sejauh ini spleen tuna diketahui sebagai organ yang memiliki aktifitas enzim proteolitik yang tinggi. Spleen tuna mengandung aktivitas proteolitik, yang diidentifikasi sebagai tripsin (Klomklao et al. 2004). Komposisi utama dari spleen tuna yellowfin adalah 19,29% protein, 0.41% garam, 3,35% lemak, 1,64% abu dan 74,48% kadar air
(Li et al. 2006), 20,56 U ml-1 tripsin dan 12,14 U ml-1 kemotripsin (Li et al. 2008a).
Limbah dari pengolahan perikanan mengandung banyak pengotor, seperti lemak, remah daging, dan darah. Setelah ekstraksi, ekstrak yang didapatkan biasanya keruh dan mengandung banyak padatan tersuspensi yang membatasi fungsi proses UF (Li et al. 2008a). Aplikasi UF untuk industri menghendaki adanya pretreatment untuk umpan. Pretreatment yang sesuai untuk umpan akan menghasilkan proses UF yang lebih baik dan efisiensi tinggi (Li et al. 2006). 2.2Protease
Komisi tatanama International Union of Biochemistry and Molecular Biology mengelompokkan protease ke dalam kelompok enzim 3 (hidrolase) dan subkelompok 4 (EC 3.4). Protease diklasifikasikan berdasarkan tiga kriteria utama (1) jenis reaksi yang dikatalisis, (2) sifat kimia sisi katalitik, dan (3) hubungan evolusi struktur enzim.
Protease terdiri dari dua kelompok utama ditinjau dari jenis reaksi yang dikatalisis, yaitu eksopeptidase dan endopeptidase. Eksopeptidase memotong ikatan peptida dekat dengan ujung amino (aminopeptidase, EC 3.4.11 – EC 3.4.14) atau ujung karboksil (karboksipeptidase EC 3.4.16) dari molekul substrat. Endopeptidase (EC 3.4.21 – EC 3.4.34) memotong ikatan peptida pada bagian dalam rantai polipeptida dan jauh dari ujung amino atau karboksil molekul substrat.
Protease merupakan enzim komersial penting yang telah luas digunakan pada industri pangan, seperti pemisahan protein dari tulang, pelunakan daging, pengurai dan fermentasi (Haard 1998), produksi hidrolisat protein (Haard 1998 dan Nilsang et al. 2005), meningkatkan kualitas glutenin pada tepung dan coklat (Kara et al. 2005), dan meningkatkan volume spesifik dari brown rice bread (Renzetti dan Arendt 2009). Protease dimanfaatkan untuk industri pengolahan, seperti dalam industri susu, pembuatan roti, industri pengolahan kedelai, penghilang rasa pahit dari hasil hidrolisis protein dan untuk pembuatan pemanis buatan rendah kalori (Rao et al. 1998). Selain itu protease juga dapat digunakan pada industri bidang kesehatan, industri kulit (Rao et al. 1998) serta industri deterjen (Rao et al. 1998; Esposito et al. 2009; dan Haddar et al. 2009).
menghasilkan bromelin (Heinicke dan Gortner 1957) dan pepaya menghasilkan papain (Wurtz dan Bouchut 1879 diacu dalam Suhartono 1991). Protease juga dapat diperoleh dari jaringan hewan, diantaranya pepsin yang terdapat pada gastric mucosa, karboksipeptidase A dan B yang dihasilkan oleh pankreas, leusin
aminopeptidase yang diperoleh dari ginjal dan intestinal mucosa (Suhartono 1991). Bakteri penghasil protease antara lain genus Bacillus (B. cereus, B. pumilus, B. subtilis, B. licheniformis, B. stearothermophilus, dan B. polymixa). Kelompok bakteri lain adalah Aeromonas, Lactobacillus, Pseudomonas, Serratia, Streptomyces, dan Staphylococcus. Fungi juga menghasilkan protease, yaitu dari genus Acremonium, Aspergillus, Candida, Sacharomyces, Fusarium, Mucor, dan Rhizopus (Rao et al. 1998).
Spleen tuna yellowfin merupakan sumber dari tripsin dan kemotripsin. Suhu dan pH optimum dari tripsin dan kemotripsin dari spleen yellowfin adalah pada suhu 50 °C dan pH 8,0. Enzim tersebut stabil pada pH berkisar antara 7,0-8,0 (Jantaro 2000 diacu dalam Li et al. 2006). Estimasi berat molekul dari tripsin dan kemotripsin berturut-turut adalah 24 dan 27 kDa (Li et al. 2008b). Protease yang diperoleh dari ekstrak spleen tuna yellowfin memiliki kemampuan yang sama baiknya dengan protease komersial dalam menghidrolisis protein. Hidrolisat protein yang dicampur dengan oligopeptida, polipeptida, dan asam amino bebas merupakan sumber protein yang berfungsi untuk memperbaiki metabolisme tubuh atau sebagai komponen diet (Li et al. 2010).
2.3Ultrafiltrasi
porositas permukaan lebih rendah) sehingga tahanan hidrodinamiknya akan lebih besar (Mulder 1996).
Gambar 1 Kisaran ukuran pori membran (Kubota et al. 2008)
Fraksinasi protein dengan cepat menjadi lebih selektif melalui kemajuan rancangan membran dan modul. Dibandingkan dengan metode kromatografi, teknik separasi dengan membran membutuhkan biaya yang lebih rendah dan dapat digunakan dalam skala besar untuk produksi secara komersial. Bagaimanapun juga, teknik membran memiliki kekurangan, yakni selektivitas membran dan fouling yang disebabkan absorpsi protein selama proses filtrasi yang dapat menjadi penghalang pada aplikasi UF selanjutnya (Larive et al.1999). Oleh karena itu dibutuhkan pretreatment yang sesuai sebelum proses UF. Pretreatment diperlukan untuk menghilangkan padatan tersuspensi dari ekstrak umpan dan menyediakan permeat yang bersih sebagai umpan untuk mendapatkan komponen yang diinginkan dengan proses UF (Li et al. 2008a) sehingga dapat mereduksi fouling.
Kurnik et al. (1995) menyatakan bahwa saat ini UF digunakan secara luas sebagai metode pilihan untuk konsentrat protein dan pertukaran buffer, dan menggantikan kromatografi pada aplikasi tersebut. Li et al. (2006) melakukan pemisahan protease dari spleen tuna yellowfin dengan membran UF. Hasil yang diperoleh menyebutkan bahwa membran UF 30 kDa dapat digunakan untuk memisahkan protease tripsin dan kemotripsin dari ekstrak jeroan tuna serta Kisaran Ukuran Pori
Berat Molekul
Tekanan Operasi Ukuran
Bakteri Virus
Polimer, Protein
Ion Inorganik Sukrosa
1 nm
Bahan Kimia Pertanian, Polipeptida
Reverse Osmosis
(RO) Nanofiltrasi (NF)
Ultrafiltrasi
(UF) Mikrofiltrasi (MF)
> 0,5 MPa 0,05-0,3 MPa 0,01-0,2 MPa H2O
peningkatan nilai aliran silang dan tekanan transmembran (TMP) dapat memperbesar aliran permeat selama UF.
2.4Reverse Osmosis
Membran reverse osmosis (RO) digunakan untuk memisahkan zat terlarut yang memiliki berat molekul yang rendah, seperti garam anorganik atau molekul organik kecil, seperti glukosa dan sukrosa dari larutannya. Membran dengan ukuran pori lebih kecil dan porositas permukaan lebih rendah serta tahanan hidrodinamik yang lebih besar diperlukan pada proses ini. Hal ini menyebabkan tekanan operasi pada RO akan sangat besar untuk menghasilkan fluks yang sama dengan proses mikrofiltrasi dan UF. Tekanan osmotik juga berpengaruh pada proses ini (Lee dan Elimelech 2007 dan Park et al. 2008).
Membran RO telah diaplikasikan secara luas untuk pengolahan air, seperti pemurnian air, pemurnian air dari boiler untuk industri, pengolahan limbah dan penggunaan kembali oleh industri pertanian serta produksi air isi ulang (Uemura dan Henmi 2008), proses desalinasi air laut dan air payau untuk produksi air minum (Lee dan Elimelech 2007; Uemura dan Henmi 2008), proses recovery
protein sebagai bahan flavor pada apel (Matsuura et al. 1975), lemon (Kane et al. 1995), dan mangga (Olle et al. 1997).
Tekanan yang diberikan pada proses reverse osmosis berkisar antara 20-100 bar, jauh lebih tinggi dibandingkan tekanan operasi pada proses mikrofiltrasi dan UF. Fluks permeat dan selektivitas merupakan faktor penting pada membran RO (Wenten 1999). Karakteristik rejeksi membran RO dapat dilihat pada Tabel 1.
Tabel 1 Karakteristik rejeksi membran RO
Zat terlarut RO
Monovalen (Na, K, Cl, NO3) >98 %
Bivalen (Ca, Mg, SO4, CO3) >99%
Bakteri dan virus >99%
Microsolute (Mw > 100) >90%
Microsolute (Mw < 100) 0-90%
2.5Kondisi Proses Filtrasi Membran
Menurut Osada dan Nagawa (1992) kinerja membran pada pemisahan dipengaruhi oleh karakteristik membran yang digunakan. Parameter utama yang digunakan dalam penilaian kinerja membran filtrasi adalah fluks dan rejeksi. Faktor yang dapat mempengaruhi fluks antara lain tekanan transmembran (TMP), kecepatan aliran silang dan konsentrasi larutan. Dipertegas pula oleh Cheryan (1998) bahwa faktor penting yang dapat mempengaruhi fluks pada proses UF, yaitu TMP, konsentrasi larutan umpan, suhu dan laju alir serta jenis aliran bahan.
Secara umum terdapat dua sistem aliran umpan yang digunakan pada membran, yakni dead-end dan cross-flow (Saxena et al. 2008). Gambar sistem aliran umpan pada membran secara dead-end dan crossflow dapat dilihat pada Gambar 2.
Gambar 2 Sistem aliran umpan pada membran (Saxena et al. 2008): (a) dead-end dan (b) crossflow
Kinerja dan efisiensi membran ditentukan oleh dua parameter yaitu fluks dan selektivitas. Fluks adalah jumlah permeat yang diperoleh pada operasi membran per satuan waktu per luas permukaan membran (Wenten 1999). Nilai fluks (Cheryan 1998) dapat diperoleh melalui persamaan berikut ini:
� = � ��
Dimana: J = fluksi (l/ m2 jam) V = Volume permeat (L)
A = Luas permukaan membran (m2) t = waktu (jam)
Umpan
Umpan
Permeat
Permeat
Membran
Membran
Fluks dipengaruhi oleh beberapa faktor antara lain konsentrasi umpan, TMP, kecepatan aliran silang, suhu umpan, dan waktu. Faktor tersebut memberikan pengaruh yang berbeda-beda bagi fluks (Henry 1988). Konsentrasi umpan yang tinggi menyebabkan penurunan fluks sehingga suatu saat fluks akan bernilai nol.
Pada proses filtrasi, terdapat partikel-partikel yang tertahan baik di atas permukaan membran maupun di dalam pori-pori membran. Hal ini menunjukkan bahwa membran memiliki nilai rejeksi terhadap larutan umpan. Nilai atau tingkat rejeksi dihitung dengan mengetahui terlebih dahulu konsentrasi umpan dan konsentrasi permeat. Nilai rejeksi tersebut dapat diperoleh dengan menggunakan suatu persamaan (Cheryan 1998), yakni:
R % = 1− Cpermeat
Cumpan
× 100%
Dimana: R(%) = Persentasi rejeksi (%)
Cumpan = Konsentrasi partikel dalam umpan
Cpermeat = Konsentrasi partikel dalam permeat
3.1Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni 2009 sampai Februari 2010 di Laboratorium Teknologi Pengolahan Hasil Perairan dan Laboratorium Mikrobiologi Hasil Perairan Departemen Teknologi Hasil Perairan FPIK, serta Laboratorium Biologi Hewan dan Laboratorium Bioteknologi Hewan PAU IPB. 3.2Alat dan Bahan
Alat-alat yang digunakan terdiri dari peralatan penelitian yang meliputi membran ultrafiltrasi poliakrilonitril MWCO 100 kDa, membran UF polisulfon MWCO 50 kDa (spesifikasi membran disajikan pada Lampiran 1), membran reverse osmosis, thermostat, nilon ukuran 225 mesh dan 375 mesh, timbangan digital, pH meter, pompa vakum, kertas saring kasar, pengaduk magnetik, pemanas listrik, stopwatch, gelas ukur dan peralatan gelas lainnya. Peralatan untuk pengujian meliputi oven, tanur, desikator, labu Kjeldahl, pembakar (destruksi), destilator, soxhlet (kondensor dan labu lemak), vortex, sentrifuge, inkubator, neraca analitik, spektrofotometer, slab SDS-PAGE, tabung reaksi dan peralatan gelas lainnya.
Bahan-bahan yang digunakan meliputi jeroan ikan tuna, es batu, buffer tris base, HCl, NaN3, CaCl2, akuades, dan NaOH. Bahan untuk pengujian meliputi
selenium, heksana, H2SO4, NaOH 40%, H3BO 2%, brom cresol green methyl red,
HCl 0,1 N, bovine serum albumin (BSA), comassie brilliant blue G-250, etanol 95%, asam fosfat 85%, tirosin, TCA (0,1 M), kasein, buffer tris-Cl (pH 8, 0,2 M), akuades steril, Na2CO3, folin, akrilamid, bis-akrilamid, SDS, ammonium
persulfat, glisin, gliserol, 2-mercaptoethanol, bromofenol blue, asam asetat, formalin, akuades bebas ion, Na2S2O3, AgNO3, N2CO3, dan asam asetat glasial.
3.3Metode Penelitian
Penelitian ini dilaksanakan dalam beberapa tahapan yang meliputi preparasi dan analisis proksimat jeroan ikan tuna, pembuatan ekstrak enzim protease dari jeroan ikan tuna dengan penambahan buffer Tris-Cl (pH 8,0; 0,02 % NaN3;
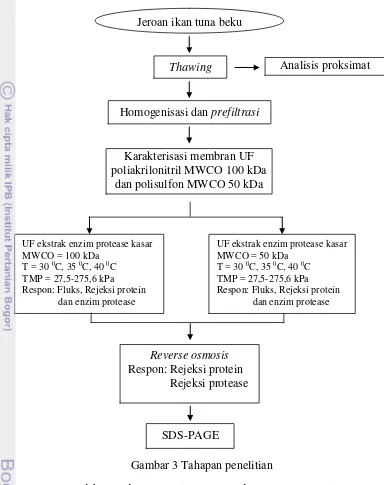
menggunakan nilon ukuran 225 mesh dan 375 mesh serta penyaringan vakum menggunakan kertas saring kasar. Tahapan selanjutnya adalah melakukan karakterisasi membran yang meliputi penentuan tingkat permeabilitas dan tahanan membran (Uju et al. 2008). Kemudian dilanjutkan dengan proses filtrasi menggunakan membran ultrafiltrasi dan penentuan waktu tunak (steady state). Variabel bebas yang diteliti meliputi MWCO (membran UF poliakrilonitril MWCO 100 kDa dan UF polisulfon MWCO 50 kDa), tekanan transmembran (28 kPa - 280 kPa) dan suhu (30 °C, 35 °C dan 40 °C), sedangkan variabel tak bebas yang diamati meliputi fluks dan rejeksi yang terdiri dari pengukuran kadar protein terlarut dan aktivitas enzim protease. Tahapan selanjutnya adalah pemekatan menggunakan membran reverse osmosis, analisisnya adalah pengukuran kadar protein terlarut (Bradford 1976) dan aktivitas enzim protease (Walter 1988). Tahapan terakhir adalah analisis kemurnian enzim protease yang dihasilkan menggunakan SDS-PAGE (Laemmli 1970). Data yang diperoleh dimodelkan menggunakan Microsoft excel 2007. Tahapan penelitian selengkapnya disajikan pada Gambar 3.
3.3.1 Preparasi jeroan ikan tuna
meliputi kadar air, protein, lemak, dan abu (AOAC 2007) sesaat sebelum ekstraksi jeroan ikan tuna.
Gambar 3 Tahapan penelitian
3.3.2 Ekstraksi jeroan ikan tuna (ekstrak enzim protease kasar)
Jeroan ikan tuna dilelehkan (thawing) dengan air mengalir. Ekstraksi jeroan ikan tuna dilakukan dengan menghomogenkan antara jeroan ikan tuna dan buffer tris-Cl (pH 8,0; 0,02 M mengandung 5 mM CaCl2 dan 0,02% NaN3) dengan
perbandingan 1:3 (Li et al. 2006). Ekstrak jeroan ikan tuna yang dibuat adalah sebanyak 15 liter. Buffer tris-Cl (pH 8,0; 0,02 M mengandung 5 mM CaCl2 dan
0,02% NaN3) dibuat dengan cara mencampurkan 2,41 gram Tris base; 0,56 gram
Homogenisasi dan prefiltrasi
Karakterisasi membran UF poliakrilonitril MWCO 100 kDa
dan polisulfon MWCO 50 kDa
UF ekstrak enzim protease kasar MWCO = 100 kDa
T = 30 0C, 35 0C, 40 0C TMP = 27,5-275,6 kPa Respon: Fluks, Rejeksi protein
dan enzim protease
Reverse osmosis Respon: Rejeksi protein
Rejeksi protease
SDS-PAGE
UF ekstrak enzim protease kasar MWCO = 50 kDa
T = 30 0C, 35 0C, 40 0C TMP = 27,5-275,6 kPa Respon: Fluks, Rejeksi protein
dan enzim protease
Jeroan ikan tuna beku
CaCl2; dan 0,2 gram NaN3 ke dalam 800 ml akuades kemudian dilakukan
penambahan HCl 0,1 M ke dalam larutan tersebut hingga diperoleh pH 8,0.
Ekstrak yang telah homogen diprefiltrasi menggunakan nilon 225 Mesh, dilanjutkan dengan penyaringan menggunakan nilon 375 Mesh. Hasilnya disaring mengggunakan penyaringan vakum dengan kertas saring kasar. Ekstrak yang diperoleh diambil secukupnya untuk pengukuran kadar protein terlarut (Bradford 1976) dan pengujian aktivitas enzim protease (Walter 1988). Ekstrak tersebut digunakan sebagai umpan dalam proses UF.
3.3.3 Penentuan permeabilitas dan tahanan membran (Uju 2008)
Permeabilitas membran dan tahanan membran internal diukur menggunakan air destilasi sebagai umpan. Proses pengukuran dilakukan pada suhu 30 °C, 35 °C dan 40 °C dengan kisaran tekanan transmembran yang digunakan 28 kPa - 280 kPa. Fluks permeat diukur pada setiap suhu dan TMP yang diujikan. Data yang diperoleh dimodelkan (regresi) menggunakan Microsoft excel 2007.
Nilai permeabilitas membran (K) ditentukan dengan cara menghitung gradien plot grafik antara nilai fluks (Jw) sebagai sumbu Y dan tekanan
transmembran (∆P) sebagai sumbu X. Penentuan nilai tahanan membran internal
(Rm) dilakukan dengan cara membuat plot grafik nilai 1/Jw sebagai sumbu Y dan
1/∆P sebagai sumbu X. Nilai tahanan membran internal diperoleh dengan cara menghitung gradien pada persamaan garis dari nilai plot 1/Jw dan 1/∆P.
3.3.4 Proses ulltrafiltrasi
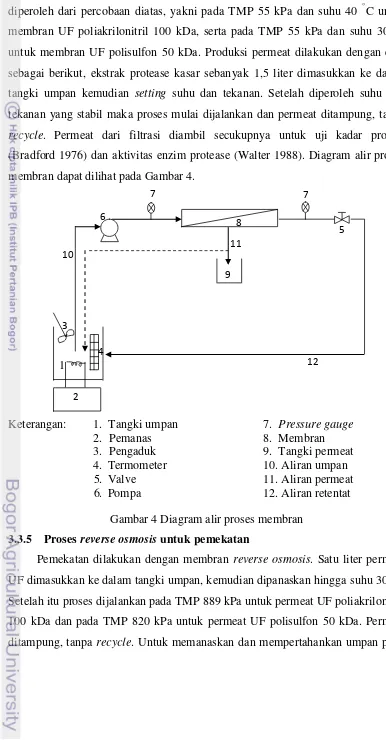
Produksi permeat dilakukan pada kondisi optimum membran UF yang diperoleh dari percobaan diatas, yakni pada TMP 55 kPa dan suhu 40 °C untuk membran UF poliakrilonitril 100 kDa, serta pada TMP 55 kPa dan suhu 30 °C untuk membran UF polisulfon 50 kDa. Produksi permeat dilakukan dengan cara sebagai berikut, ekstrak protease kasar sebanyak 1,5 liter dimasukkan ke dalam tangki umpan kemudian setting suhu dan tekanan. Setelah diperoleh suhu dan tekanan yang stabil maka proses mulai dijalankan dan permeat ditampung, tanpa recycle. Permeat dari filtrasi diambil secukupnya untuk uji kadar protein (Bradford 1976) dan aktivitas enzim protease (Walter 1988). Diagram alir proses membran dapat dilihat pada Gambar 4.
1
Keterangan: 1. Tangki umpan 7. Pressure gauge 2. Pemanas 8. Membran 3. Pengaduk 9. Tangki permeat
4. Termometer 10. Aliran umpan
5. Valve 11. Aliran permeat
6. Pompa 12. Aliran retentat
Gambar 4 Diagram alir proses membran 3.3.5 Proses reverse osmosis untuk pemekatan
Pemekatan dilakukan dengan membran reverse osmosis. Satu liter permeat UF dimasukkan ke dalam tangki umpan, kemudian dipanaskan hingga suhu 30 °C. Setelah itu proses dijalankan pada TMP 889 kPa untuk permeat UF poliakrilonitril 100 kDa dan pada TMP 820 kPa untuk permeat UF polisulfon 50 kDa. Permeat ditampung, tanpa recycle. Untuk memanaskan dan mempertahankan umpan pada
5
3
4
2 6
8
9 10
11
12
suhu tertentu, tangki umpan dilengkapi dengan thermostat dan pemanas listrik. Produk hasil proses membran (retentat) merupakan ekstrak protease murni. Diagram alir proses membran serupa dengan proses ultrafiltrasi (Gambar 4), namun membran yang digunakan adalah membran reverse osmosis.
3.4Karakterisasi dan Analisis
Variabel parameter operasi proses yang diteliti adalah pengaruh tekanan transmembran, suhu, MWCO dan bahan penyusun membran. Indikator kinerja membran dilihat dengan mengukur fluks permeat, sedangkan indikator kualitas produk yang dihasilkan ditentukan dengan mengukur nilai rejeksi membran. 3.4.1 Fluks (Cheryan 1998)
Fluks didefinisikan sebagai jumlah volume cairan yang berhasil melewati membran (fraksi permeat) untuk setiap satuan luasan membran dan satuan waktu. Nilai fluks (J) dihitung dengan persamaan:
3.4.2 Rejeksi (Cheryan 1998)
Rejeksi (R) merupakan kemampuan suatu membran dalam menahan partikel
terlarut tertentu. Nilai rejeksi membran dihitung dengan persamaan dibawah ini: Keterangan: R(%) = Persentasi rejeksi (%)
Cumpan = Konsentrasi partikel dalam umpan
Cpermeat = Konsentrasi partikel dalam permeat
3.4.3 Kadar air (AOAC 2007)
Penentuan kadar air didasarkan pada perbedaan berat sampel sebelum dan sesudah dikeringkan. Mula-mula cawan kosong dikeringkan dalam oven dengan suhu 105 °C selama 15 menit atau sampai diperoleh berat tetap, kemudian didinginkan dalam desikator selama 15 menit dan ditimbang. Sampel ditimbang sebanyak ± 1 gram lalu dimasukkan ke dalam cawan kemudian dikeringkan dalam
Fluks = Volume permeat (Liter)
Luas membran meter2 × Waktu (jam)
R (%) = 1−Cpermeat
Cumpan
oven pada suhu 105 °C selama 8 jam. Cawan didinginkan dalam desikator selama 30 menit dan ditimbang kembali. Persentase kadar air (berat basah) dapat dihitung dengan rumus sebagai berikut:
Keterangan: B = Berat sampel (gram)
B1 = Berat sampel + cawan sebelum dikeringkan B2 = Berat sampel + cawan setelah dikeringkan 3.4.4 Kadar lemak (AOAC 2007)
Metode yang digunakan dalam analisis lemak adalah metode ektraksi soxhlet. Mula-mula labu lemak dikeringkan di dalam oven, kemudian didinginkan dalam desikator dan ditimbang. Dua gram sampel disebar di atas kapas yang beralas kertas saring dioven selama 1 jam sehingga diperoleh sampel kering kemudian digulung membentuk thimble, lalu dimasukkan ke dalam alat ekstraksi soxhlet. Alat kondensor diletakkan diatasnya dan labu lemak diletakkan dibawahnya. Pelarut heksana dimasukkan ke dalam labu lemak secukupnya (± 150 ml). Selanjutnya dilakukan refluks selama minimal 1,5 jam sampai pelarut yang turun kembali ke dalam labu lemak berwarna jernih.
Pelarut yang ada dalam labu lemak didestilasi sehingga semua pelarut lemak menguap dan ditampung kembali. Selanjutnya labu lemak yang berisi lemak hasil ekstraksi kemudian dipanaskan dalam oven pada suhu 100 °C hingga mencapai berat tetap (± 1 jam) dan setelah itu didinginkan dalam desikator. Labu beserta lemak didalamnya ditimbang dan berat lemak dapat diketahui. Kadar lemak dapat dihitung berdasarkan rumus:
Keterangan: Berat lemak = (berat labu+ lemak) – berat labu 3.4.5 Kadar abu (AOAC 2007)
Cawan dibersihkan dan dikeringkan dalam oven pada suhu 105 °C, lalu didinginkan dalam desikator selama 30 menit dan ditimbang. Sampel sebanyak ± 2 gram dimasukkan ke dalam cawan kemudian dioven hingga diperoleh sampel kering. Sampel kering tersebut dibakar (destruksi) sampai tidak berasap. Kemudian diabukan dalam tanur bersuhu 550 °C - 600 °C hingga diperoleh sampel
Lemak % = Berat lemak gram
Berat sampel gram ×100%
Kadar air % =B1−B2
berwarna putih (± 1,5 jam). Setelah itu cawan didinginkan dalam desikator dan ditimbang. Kadar abu ditentukan dengan rumus sebagai berikut:
Keterangan: A = Berat abu (gram) B = Berat contoh (gram) 3.4.6 Kadar protein (AOAC 2007)
Sampel ditimbang sebanyak 0,25 gram, kemudian dimasukkan ke dalam labu kjeldahl 100 ml, ditambahkan 0,25 gram selenium dan 3 ml H2SO4 pekat.
Sampel didestruksi (pemanasan dalam keadaan mendidih) sampai terbentuk larutan bening selama 1 jam. Kemudian dibiarkan sampai dingin, setelah dingin ditambahkan 50 ml akuades dan 20 ml NaOH 40% b/v lalu didestilasi.
Hasil destilasi ditampung dalam labu erlenmeyer yang berisi campuran 10 ml H3BO3 2% dan 2 tetes indikator Brom Cresol Green-Methyl Red berwarna
merah muda. Setelah volume hasil tampungan (destilat) menjadi 10 ml dan berwarna hijau kebiruan, destilasi diihentikan dan dititrasi dengan HCl 0,1 N sampai berwarna merah muda. Larutan blanko dianalisis seperti sampel. Kadar protein dapat dihitung dengan rumus:
3.4.7 Kadar protein (Bradford 1976)
Konsentrasi protein diukur menggunakan standar protein Bovine Serum Albumin (BSA). Persiapan pereaksi Bradford dilakukan dengan melarutkan 100 mg comassie brilliant blue G-250 dalam 50 ml etanol 95 %, lalu ditambahkan dengan 100 ml asam fosfat 85 % (w/v). Jika sudah larut dengan sempurna, lalu ditambahkan akuades hingga mencapai 1 liter dan disaring dengan kertas saring.
Langkah awal untuk menentukan konsentrasi protein sampel adalah membuat serial konsentrasi standar protein Bovine Serum Albumin (BSA) dari 0-0,01 mg/ ml. Masing-masing konsentrasi protein diambil sebanyak 100 µl dan ditempatkan pada tabung rekasi. Lalu pada masing-masing tabung tersebut ditambahkan 5 ml pereaksi Bradford. Campuran ini dihomogenkan dan diinkubasi pada suhu 37 °C selama 5 menit kemudian diukur absorbansinya dengan
Kadar abu % = A
B×100%
Kadar protein = ml HCl−ml blanko × N HCl × 14,007 × 100%
spektrofotometer pada λ = 595 nm. Konsentrasi protein sampel diukur dengan cara yang sama. Tabel komposisi volume larutan dalam pembuatan larutan standar konsentrasi 0-0,01 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml disajikan pada Tabel 2.
Tabel 2 Pembuatan larutan standar BSA konsentrasi 0-0,01 mg/ml Konsentrasi BSA (mg/ml) Volume BSA (ml) Volume akuades (ml)
0 0,000 0,400
0.02 0,080 0,320
0,04 0,160 0,240
0,06 0,240 0,160
0,08 0,320 0,080
0,01 0,400 0,000
3.4.8 Penentuan aktivitas enzim (Walter 1988)
Aktivitas enzim diukur menggunakan metode Walter (1988) dimodifikasi. Metode analisis aktivitas enzim protease dapat dilihat pada Tabel 3.
Tabel 3 Metode analisis aktivitas enzim protease
Pereaksi Contoh (µl) Blanko (µl) Standar (µl)
Buffer Tris-Cl pH 8, 0,2 M 250 250 250
Kasein (1 %) 250 250 250
Enzim 50 - -
H2O steril - 50 -
Tirosin standar (5 mM) 50 - 50
Inkubasi selama 10 menit pada suhu 37 °C
TCA (0,1 mol/ l) 500 500 500
Enzim - 50 50
H20 steril 50 - -
Inkubasi selama 10 menit pada suhu 37 °C dan dilanjutkan dengan sentrifugasi pada 4000 rpm selama 10 menit
Filtrat 375 375 375
Na2CO3 (0,5 mol/ l) 1250 1250 1250
Pereaksi folin 250 250 250
Inkubasi selama 20 menit pada suhu 37 °C, kemudian dibaca absorbansinya pada panjang gelombang 578 nm Sumber: Walter (1988)
masing-masing, dengan menggunakan rumus dibawah ini dapat dihitung unit aktivitas dari enzim.
U =Asp −Abl Ast −Abl
× P ×1
T
Dimana: U = Unit aktivitas protease per ml per menit (U ml-1 menit-1) Asp = Nilai absorbansi contoh
Ast = Nilai absorbansi standard
Abl = Nilai absorbansi blanko
P = Faktor pengenceran T = waktu inkubasi (menit)
3.4.9 Penentuan tingkat kemurnian enzim protease dengan sodium dodecyl
sulphate-poly acrylamide gel electrophoresis (SDS-PAGE)
(Laemmli 1970)
Berat molekul protease hasil pemurnian dianalisis meenggunakan SDS-page (Laemmli 1970). Marker yang digunakan adalah β-galactosidase (116 kDa), BSA (66,2 kDa), Ovalbumin (45 kDa), Lactate dehydrogenase (35 kDa), REas Bsp981 (25 kDa), β-lactoglobulin (18,4 kDa), dan Lysozime (14,4 kDa).
berakhir, gel diwarnai menggunakan pewarnaan silver sehingga diperoleh pita protein berwarna cokelat dengan latar bening.
Tabel 4 Komposisi gel SDS-PAGE
Bahan Separating gel (10%) Stacking gel (4%) Larutan A
Larutan B Larutan C Akuabides APS 10% TEMED
2,7 ml 2,5 ml
- 4,8 ml
50 µl 5,0 µl
0,67 ml - 1,25 ml
3,0 ml 50 µl 5,0 µl Keterangan:
Larutan A terdiri dari : 29,2 gram akrilamid, dan 0,8 gram bis-akrilamid Larutan B terdiri dari : 75 ml Tris HCl 2 M (pH 8,8), dan 4 ml SDS 10 % Larutan C terdiri dari : 50 ml Tris HCl 1 M (pH 6,8), dan 4 ml SDS 10 %
Tahapan pewarnaan dilakukan dengan cara, mula-mula gel direndam selama semalam pada suhu ruang di dalam larutan fiksasi sambil diagitasi pelan-pelan. Setelah itu gel dicuci dengan larutan pencuci selama 20 detik, proses ini diulang sebanyak tiga kali. Gel yang telah dicuci kemudian dibilas dengan akuades bebas ion selama 10 detik lalu gel direndam dalam larutan sensitizen (Na2S2O3 0,001 M)
selama satu menit. Gel dibilas dengan akuades bebas ion selama 20 detik, proses ini diulang sebanyak tiga kali. Kemudian gel diinkubasi di lemari es dengan 0,1% AgNO3 selama 20 menit. Setelah diinkubasi, gel dicuci dengan akuades bebas ion
selama 20 detik sebanyak dua kali. Gel dipindahkan ke wadah yang lain kemudian dicuci dengan akuades bebas ion selama 10 detik. Gel direndam ke dalam larutan developing gel (terdiri dari 6 gram N2CO3, 50 ml formalin dan 2 ml Na2S2O3)
4.1Komposisi Kimia Jeroan Ikan Tuna
[image:34.595.102.510.40.842.2]Komposisi kimia jeroan ikan tuna yang digunakan dalam penelitian ini dapat dilihat pada Tabel 5.
Tabel 5 Komposisi kimia jeroan tuna
Parameter Analisis Nilai
Kadar air (% b/b) 75,42 ± 0,35
Kadar abu (% b/b) 1,44 ± 0,06
Kadar protein (% b/b) 17,11 ± 0,18
Kadar lemak (% b/b) 1,63 ± 0,30
Hasil dari proses ekstraksi jeroan ikan tuna dengan penambahan buffer tris-Cl (pH 8,0; 0,02% NaN3;5 mM CaCl2) memperlihatkan hasil ekstrak enzim
protease yang masih keruh dan banyak bahan pengotor lainnya, seperti remah daging dan lemak. Proses prefiltrasi dengan nilon ukuran 225 mesh dan 375 mesh menghasilkan ekstrak enzim protease yang lebih bersih dari bahan pengotor tersebut, sedangkan hasil proses penyaringan vakum memperlihatkan bahwa ekstrak enzim protease yang dihasilkan makin terlihat lebih jernih. Hasil ekstrak kasar enzim protease dan ekstrak enzim protease hasil prefiltrasi disajikan pada Gambar 5.
Gambar 5 (A) Ekstrak kasar enzim protease, (B) ekstrak enzim protease hasil penyaringan menggunakan nilon ukuran 225 mesh dan 375 mesh, dan (C) ekstrak enzim protease hasil penyaringan menggunakan nilon ukuran 225 mesh dan 375 mesh serta penyaringan vakum
4.2Permeabilitas dan Tahanan Membran
Permeabilitas dan tahanan membran merupakan parameter karakteristik membran yang sangat penting untuk diketahui. Permeabilitas membran menunjukkan kemampuan membran dalam melewatkan air destilasi, sedangkan tahanan membran merupakan kebalikannya.
4.2.1 Permeabilitas membran
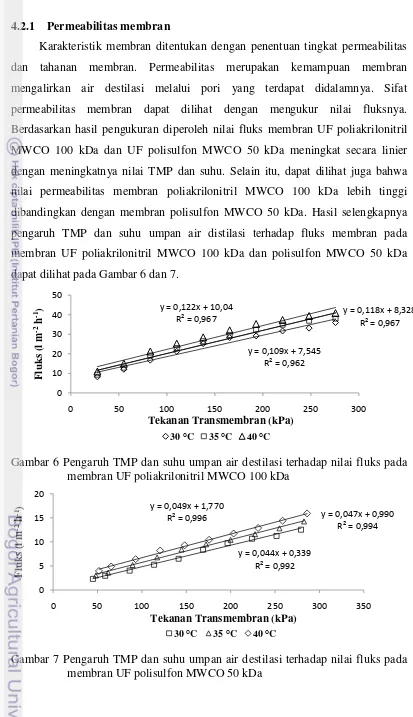
[image:35.595.103.516.66.783.2]Karakteristik membran ditentukan dengan penentuan tingkat permeabilitas dan tahanan membran. Permeabilitas merupakan kemampuan membran mengalirkan air destilasi melalui pori yang terdapat didalamnya. Sifat permeabilitas membran dapat dilihat dengan mengukur nilai fluksnya. Berdasarkan hasil pengukuran diperoleh nilai fluks membran UF poliakrilonitril MWCO 100 kDa dan UF polisulfon MWCO 50 kDa meningkat secara linier dengan meningkatnya nilai TMP dan suhu. Selain itu, dapat dilihat juga bahwa nilai permeabilitas membran poliakrilonitril MWCO 100 kDa lebih tinggi dibandingkan dengan membran polisulfon MWCO 50 kDa. Hasil selengkapnya pengaruh TMP dan suhu umpan air distilasi terhadap fluks membran pada membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa dapat dilihat pada Gambar 6 dan 7.
[image:35.595.115.502.566.707.2]Gambar 6 Pengaruh TMP dan suhu umpan air destilasi terhadap nilai fluks pada membran UF poliakrilonitril MWCO 100 kDa
Gambar 7 Pengaruh TMP dan suhu umpan air destilasi terhadap nilai fluks pada membran UF polisulfon MWCO 50 kDa
y = 0,109x + 7,545 R² = 0,962
y = 0,118x + 8,328 R² = 0,967 y = 0,122x + 10,04
R² = 0,967
0 10 20 30 40 50
0 50 100 150 200 250 300
F luk s (l m -2 h -1)
Tekanan Transmembran (kPa)
30 °C 35 °C 40 °C
y = 0,044x + 0,339 R² = 0,992
y = 0,047x + 0,990 R² = 0,994 y = 0,049x + 1,770
R² = 0,996
0 5 10 15 20
0 50 100 150 200 250 300 350
F luk s (l m -2 h -1)
Tekanan Transmembran (kPa)
Pada Gambar 6 dapat dilihat bahwa nilai R2 untuk ketiga garis linier berkisar antara 0,96 yang berarti bahwa pada proses ini, TMP dapat menjelaskan fluks permeat sebesar 96% sedangkan 4% lainnya dijelaskan oleh faktor lain seperti viskositas permeat dan hambatan hidrolik. Sedangkan pada Gambar 7. memperlihatkan bahwa nilai R2 untuk ketiga garis linier berkisar antara 0,99 yang berarti bahwa pada proses ini, TMP dapat menjelaskan fluks permeat sebesar 99% sedangkan 1% lainnya dijelaskan oleh faktor lain seperti viskositas permeat dan hambatan hidrolik.
Gambar 6 dan 7 menunjukkan bahwa nilai fluks meningkat secara linier dengan meningkatnya nilai TMP. Keadaan ini diduga berhubungan dengan semakin tingginya tekanan maka semakin besar pula daya dorong larutan menuju permukaan membran. Mulder (1996) menyatakan bahwa pada umpan air murni akan terjadi peningkatan fluks permeat seiring dengan semakin meningkatnya tekanan transmembran.
Suhu proses yang semakin meningkat dapat menyebabkan peningkatan pada nilai permeabilitas membran. Pada Gambar 6 permeabilitas membran meningkat dari 0,109 l kPa-1 m-2 h-1 pada suhu umpan 30 °C hingga 0,122 kPa-1 m-2 h-1 pada
suhu 40 °C. Pada Gambar 7 permeabilitas membran meningkat dari 0,171 l kPa-1 m-2 h-1 pada suhu umpan 30 °C hingga 0,188 l kPa-1 m-2 h-1 pada
suhu 40 °C. Nilai permeabilitas yang cenderung meningkat dengan peningkatan suhu umpan disebabkan oleh menurunnya nilai viskositas air. Linsley dan Franzini (1995) melaporkan bahwa nilai viskositas air pada suhu 30 dan 40 °C berturut-turut sebesar 0,798 cP dan 0,653 cP. Hal ini sesuai dengan hukum Darcy diacu dalam Li et al. (2008a) yang menjelaskan bahwa fluks permeat pada membran sebanding dengan nilai TMP dan berbanding terbalik dengan nilai viskositas permeat serta hambatan hidrolik.
4.2.2 Tahanan membran
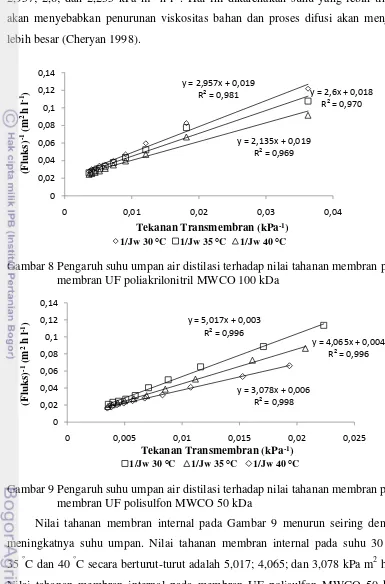
Nilai tahanan membran (Rm) dapat ditentukan dengan menghitung nilai
2,957; 2,6; dan 2,235 kPa m2 h l-1. Hal ini dikarenakan suhu yang lebih tinggi akan menyebabkan penurunan viskositas bahan dan proses difusi akan menjadi lebih besar (Cheryan 1998).
Gambar 8 Pengaruh suhu umpan air distilasi terhadap nilai tahanan membran pada membran UF poliakrilonitril MWCO 100 kDa
Gambar 9 Pengaruh suhu umpan air distilasi terhadap nilai tahanan membran pada membran UF polisulfon MWCO 50 kDa
Nilai tahanan membran internal pada Gambar 9 menurun seiring dengan meningkatnya suhu umpan. Nilai tahanan membran internal pada suhu 30 °C, 35 °C dan 40 °C secara berturut-turut adalah 5,017; 4,065; dan 3,078 kPa m2 h l-1. Nilai tahanan membran internal pada membran UF polisulfon MWCO 50 kDa lebih besar bila dibandingkan dengan membran UF poliakrilonitril MWCO 100 kDa. Hal ini dikarenakan membran dengan ukuran MWCO yang lebih kecil
y = 2,957x + 0,019
R² = 0,981 y = 2,6x + 0,018
R² = 0,970
y = 2,135x + 0,019 R² = 0,969
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14
0 0,01 0,02 0,03 0,04
(F
luk
s)
-1
(m
2 h l -1)
Tekanan Transmembran (kPa-1)
1/Jw 30 °C 1/Jw 35 °C 1/Jw 40 °C
y = 5,017x + 0,003 R² = 0,996
y = 4,065x + 0,004 R² = 0,996
y = 3,078x + 0,006 R² = 0,998
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14
0 0,005 0,01 0,015 0,02 0,025
(F luk s) -1 (m 2h l -1)
Tekanan Transmembran (kPa-1)
[image:37.595.114.486.164.348.2]akan menahan partikel-partikel yang lebih banyak dibandingkan dengan membran dengan ukuran MWCO lebih besar.
4.3Waktu Tunak (Steady State) Fluks
Hubungan antara fluks dengan waktu operasi pada membran UF poliakrilonitril MWCO 100 kDa dan UF polisulfon MWCO 50 kDa menunjukkan bahwa nilai fluks pada proses ultrafiltrasi dengan membran UF poliakrilonitril MWCO 100 kDa pada awal proses filtrasi mengalami penurunan yang tajam namun setelah 5 menit fluks mendekati konstan, sedangkan fluks pada membran UF polisulfon MWCO 50 kDa tidak memperlihatkan terjadinya penurunan yang tajam diawal proses dan cenderung terus konstan sepanjang proses. Penurunan fluks yang tajam pada beberapa menit pertama membran UF poliakrilonitril MWCO 100 kDa diduga disebabkan oleh terjadinya polarisasi konsentrasi pada membran tersebut. Penurunan aliran dengan perlahan-lahan disebabkan oleh adsorpsi protein dan pengendapan partikel pada permukaan membran atau dinding dalam pada pori membran. Beberapa faktor seperti pengendapan partikel, penggabungan fouling material pada membran atau pembentukan lapisan cake menyebabkan aliran yang konstan selama periode yang panjang (Marshal 1993). Membran UF dengan ukuran pori lebih kecil diduga memiliki resiko terjadinya polarisasi konsentrasi yang lebih kecil pula. Hasil selengkapnya hubungan antara fluks dengan waktu pada membran UF polisulfon MWCO 50 kDa dengan UF poliakrilonitril MWCO 100 kDa dapat dilihat pada Gambar 10.
Gambar 10 Hubungan antara fluks dengan waktu pada membran UF poliakrilonitril MWCO 100 dan polisulfon MWCO 50 kDa
0 1 2 3 4 5 6 7 8 9 10
0 5 10 15 20
F luk s (l m -2h -1) Waktu (menit)
4.4Pengaruh Tekanan Transmembran dan Suhu terhadap Fluks
Fluks adalah jumlah volume permeat pada operasi membran per satuan waktu per luas permukaan membran. Berdasarkan hasil pengukuran nilai fluks permeat akibat pengaruh TMP dan suhu memperlihatkan terjadinya peningkatan nilai fluks seiring dengan peningkatan nilai TMP dan suhu. Pola perubahan nilai fluks permeat pada membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa menunjukkan bahwa TMP tidak berpengaruh terhadap nilai fluks pada batas TMP tertentu. Nilai fluks permeat pada membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa pada TMP dan suhu yang berbeda selengkapnya disajikan pada Gambar 11 da 12.
Gambar 11 Pola perubahan nilai fluks permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF poliakrilonitril MWCO 100 kDa
Gambar 12 Pola perubahan nilai fluks permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF polisulfon MWCO 50 kDa
0 2 4 6 8 10
0 50 100 150 200 250 300
F luk s ( l m -2 h -1 )
Tekanan Transmembran (kPa)
30 °C 35 °C 40 °C
0 2 4 6 8 10
0 50 100 150 200 250 300
F luk s (l m -2 h -1)
Tekanan Transmembran (kPa)
[image:39.595.106.500.44.842.2] [image:39.595.107.495.532.707.2]Pada Gambar 11 dan 12 dapat dilihat bahwa TMP dan suhu mempengaruhi fluks permeat. Secara umum terjadi peningkatan nilai fluks seiring dengan peningkatan nilai TMP, hal ini terjadi karena semakin besar tekanan maka semakin besar pula daya dorong larutan menuju permukaan membran. Akan tetapi peningkatan tekanan juga mempercepat terakumulasinya permukaan membran oleh komponen-komponen yang tidak lolos melewati membran (fouling).
Pola perubahan fluks permeat pada membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa menunjukkan bahwa TMP tidak berpengaruh terhadap nilai fluks ketika TMP secara berturut-turut lebih besar dari 110 kPa dan 170 kPa. Li et al. (2006) melaporkan bahwa TMP mempengaruhi aliran permeat ketika TMP lebih rendah dari 350 kPa dan TMP menjadi tidak berpengaruh jika TMP lebih besar dari 350 kPa. Menurut Ghosh dan Cui (2000), hal ini dikarenakan fouling lebih kuat/ besar pada TMP tinggi walaupun TMP mampu meningkatkan aliran permeat. Mulder (1996) mengemukakan bahwa dalam padatan yang terlarut, ketika tekanan dinaikkan sampai batas tertentu akan menaikkan fluks tetapi setelah mencapai tekanan tertentu fluks tidak akan meningkat. Hal ini diduga karena dengan semakin tinggi tekanan yang diberikan fenomena polarisasi lebih berperan, sedangkan fluks menjadi tidak sensitif lagi dengan tekanan yang diberikan.
tinggi akan menyebabkan fluks yang lebih besar baik pada pressure controlled region maupun mass transfer controlled region. Suhu yang lebih tinggi akan menyebabkan penurunan viskositas bahan dan proses difusi akan menjadi lebih besar.
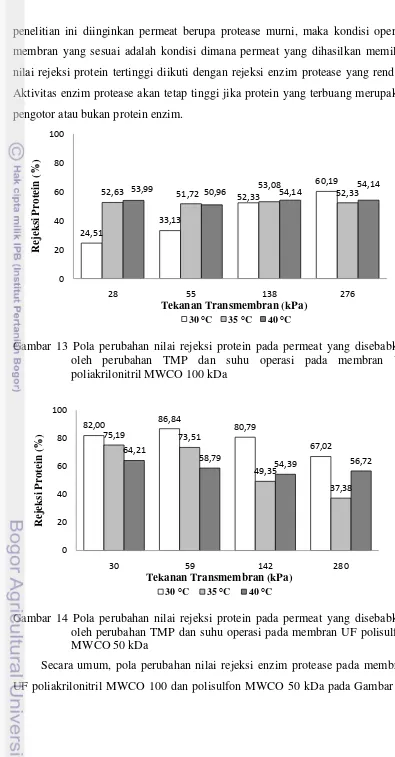
4.5Pengaruh Tekanan Transmembran dan Suhu terhadap Nilai Rejeksi Rejeksi adalah kemampuan suatu membran untuk menahan partikel berukuran tertentu. Pola perubahan nilai rejeksi protein pada membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa terlihat cenderung berfluktuatif. Hal ini menunjukkan bahwa TMP dan suhu tidak berpengaruh terhadap besarnya nilai rejeksi protein. Selain itu, nilai rejeksi protein pada membran UF poliakrilonitril MWCO 100 kDa terlihat juga lebih rendah dibandingkan dengan membran UF polisulfon MWCO 50 kDa. Pola perubahan nilai rejeksi protein pada permeat yang disebabkan oleh perubahan TMP dan suhu pada membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa selengkapnya dapat dilihat pada Gambar 13 dan 14.
Pola perubahan nilai rejeksi protein yang cenderung fluktuatif pada kedua membran menunjukkan bahwa TMP dan suhu tidak mempengaruhi besarnya rejeksi protein dan terdapat faktor-faktor lain yang mempengaruhi nilai rejeksi. Mulder (1996) menyatakan bahwa membran UF merupakan membran porous, sehingga rejeksi zat terlarut sangat dipengaruhi oleh ukuran dan berat zat terlarut relatif terhadap ukuran pori membran.
Nilai rejeksi protein pada membran UF poliakrilonitril MWCO 100 kDa terlihat lebih rendah dibandingkan dengan membran UF polisulfon MWCO 50 kDa. Hal ini diduga jumlah protein yang ada lebih banyak mencemari pori
membran, terutama pada membran berukuran pori lebih besar (Marshall et al. 1993). Menurut Cheryan (1998), material membran yang berbeda
dengan MWCO yang sama akan dapat menghasilkan rejeksi yang berbeda. Hal ini diduga disebabkan adanya pengaruh interaksi antara larutan umpan dan membran.
penelitian ini diinginkan permeat berupa protease murni, maka kondisi operasi membran yang sesuai adalah kondisi dimana permeat yang dihasilkan memiliki nilai rejeksi protein tertinggi diikuti dengan rejeksi enzim protease yang rendah. Aktivitas enzim protease akan tetap tinggi jika protein yang terbuang merupakan pengotor atau bukan protein enzim.
Gambar 13 Pola perubahan nilai rejeksi protein pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF poliakrilonitril MWCO 100 kDa
Gambar 14 Pola perubahan nilai rejeksi protein pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF polisulfon MWCO 50 kDa
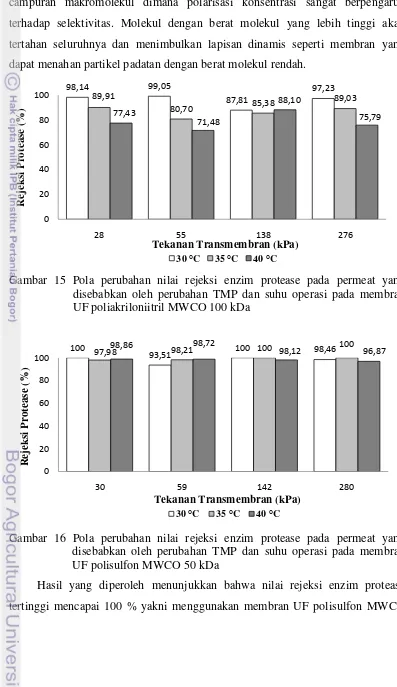
Secara umum, pola perubahan nilai rejeksi enzim protease pada membran UF poliakrilonitril MWCO 100 dan polisulfon MWCO 50 kDa pada Gambar 15
24,51 33,13 52,33 60,19 52,63 51,72 53,08 52,33
53,99 50,96 54,14 54,14
0 20 40 60 80 100
28 55 138 276
R ej eksi P rot ei n (% )
Tekanan Transmembran (kPa)
30 °C 35 °C 40 °C
82,00 86,84 80,79
67,02 75,19 73,51 49,35 37,38 64,21 58,79 54,39 56,72 0 20 40 60 80 100
30 59 142 280
R ej eksi P rot ei n (% )
Tekanan Transmembran (kPa)
[image:42.595.101.496.61.818.2]dan 16 menunjukkan pola yang fluktuatif. Mulder (1996) mengemukakan bahwa rejeksi dapat tinggi pada proses pemisahan dengan menggunakan larutan campuran makromolekul dimana polarisasi konsentrasi sangat berpengaruh terhadap selektivitas. Molekul dengan berat molekul yang lebih tinggi akan tertahan seluruhnya dan menimbulkan lapisan dinamis seperti membran yang dapat menahan partikel padatan dengan berat molekul rendah.
Gambar 15 Pola perubahan nilai rejeksi enzim protease pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF poliakriloniitril MWCO 100 kDa
Gambar 16 Pola perubahan nilai rejeksi enzim protease pada permeat yang disebabkan oleh perubahan TMP dan suhu operasi pada membran UF polisulfon MWCO 50 kDa
Hasil yang diperoleh menunjukkan bahwa nilai rejeksi enzim protease tertinggi mencapai 100 % yakni menggunakan membran UF polisulfon MWCO
98,14 99,05 87,81 97,23 89,91 80,70 85,38 89,03 77,43 71,48 88,10 75,79 0 20 40 60 80 100
28 55 138 276
R ej eksi P rot eas e (% )
Tekanan Transmembran (kPa)
30 °C 35 °C 40 °C
100
93,51 100 98,46
97,9898,86 98,21 100 100
98,72 98,12 96,87 0 20 40 60 80 100
30 59 142 280
R ej eksi P rot eas e (% )
Tekanan Transmembran (kPa)
[image:43.595.105.502.131.818.2]50 kDa, pada suhu 30 °C, TMP 30 kPa, dan 142 kPa, serta suhu 35 °C, TMP 142 kPa, dan 280 kPa, sedangkan nilai rejeksi enzim protease terendah adalah pada proses filtrasi menggunakan membran UF poliakrilonitril MWCO 100 kDa pada suhu 40 °C dan TMP 55 kPa. Marshall et al. (1993) menyatakan bahwa rendahnya nilai rejeksi protein dan enzim protease untuk membran UF poliakrilonitril MWCO 100 kDa dibandingkan dengan membran UF polisulfon MWCO 50 kDa diduga karena jumlah protein maupun enzim protease yang lebih besar mencemari pori membran untuk membran dengan pori berukuran besar.
Selain itu, material membran yang berbeda dengan MWCO yang sama akan menghasilkan rejeksi yang berbeda. Hal ini disebabkan adanya pengaruh interaksi antara larutan umpan dan membran (Cheryan 1998). Membran yang dibuat dari selulosa asetat atau regenerasi selulosa memiliki rejeksi yang lebih tinggi dan sebaran ukuran pori yang lebih luas bila dibandingkan dengan membran polisulfon (Kim et al. 1994 diacu dalam Cheryan 1998) dan memperlihatkan deviasi yang lebih kecil antara pengamatan dan rejeksi sesungguhnya serta pengaruh TMP yang lebih kecil pada rejeksi. Fenomena ini mungkin berhubungan efek fouling yang mana memiliki hubungan dengan hidrofobik, kekasaran permukaan dan sebagainya. Secara umum, fluks yang lebih tinggi dan adsorpsi yang lebih rendah teramati pada material membran yang hidrofilik dibandingkan dengan dengan membran hidrofobik, untuk umpan yang cenderung encer (Cheryan 1998).
Interaksi antara membran dan protein dapat menyebabkan perubahan struktur dari molekul yang terjerap. Cheryan (1998) melaporkan bahwa BSA yang terjerap pada permukaan membran regenerasi selulosa hidrofilik memiliki struktur globular seperti pada larutan bebas. Namun pada permukaan dari membran polisulfon, protein berbentuk panjang dan berfilamen, lebih terbuka dan terdenaturasi. Hal yang sama juga terjadi pada aktivitas enzim karbohidrase
seperti α galaktosidase, β galaktosidase, dan glukosa isomerase.
penelitian ini dilakukan proses filtrasi menggunakan membran UF poliakrilonitril MWCO 100 kDa dan polisulfon MWCO 50 kDa sehingga dapat diasumsikan bahwa pada proses ini permeat yang diperoleh merupakan ekstrak enzim protease. Kondisi operasi membran yang menghasilkan nilai rejeksi enzim protease terendah diikuti dengan nilai rejeksi protein tertinggi merupakan kondisi yang sesuai untuk pemurnian protease dari jeroan ikan tuna. Secara umum kondisi tersebut adalah filtrasi menggunakan membran UF 50 kDa pada suhu 30 °C dan TMP 55 kPa serta filtrasi menggunakan membran UF 100 kDa pada suhu 40 °C dan TMP 55 kPa.
4.6Kadar Protein dan Aktivitas Enzim pada Setiap Tahapan Filtrasi serta Penggunaan RO sebagai Diafiltrasi
Kadar protein dan aktivitas enzim protease setelah ultrafiltrasi mengalami penurunan. Hal ini berarti telah terjadi kerusakan enzim protease selama proses ultrafiltrasi. Hasil pengukuran kadar protein dan aktivitas enzim protease pada setiap tahapan filtrasi selengkapnya disajikan pada Tabel 6.
Tabel 6 Nilai kadar protein dan aktivitas enzim protease pada ekstrak protease jeroan ikan tuna di setiap tahapan filtrasi
Sampel (Kode) Kadar Protein (mg/ ml) Aktivitas Enzim Protease (unit/ ml) Aktivitas Spesifik Enzim Protease (unit/ mg) Ekstrak enzim protease kasar (A) 0,42 0,75 1,77 Ekstrak enzim protease hasil penyaringan
nilon ukuran 225 mesh dan 375 mesh serta penyaringan vakum (B)
0,15 0,22 1,42
Permeat membran UF poliakrilonitril
MWCO 100 kDa (C) 0,14 0,18 1,29
Permeat membran UF polisulfon MWCO
50 kDa (D) 0,30 0,16 0,53
Permeat membran RO dari UF
poliakrilonitril MWCO 100 kDa (E1) 0,03 0,01 0,25 Retentat membran RO dari UF
poliakrilonitril MWCO 100 kDa (E2) 0,13 0,18 1,38 Permeat membran RO dari UF polisulfon
MWCO 50 kDa (F1) 0,02 0,02 0,90
Retentat membran RO dari UF polisulfon
[image:45.595.92.506.420.737.2]Tabel 6 menunjukkan hasil pengukuran kadar protei