PEPTIDA KOLAGEN BIOAKTIF
ACE BAEHAKI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii Dengan ini, saya menyatakan bahwa disertasi yang berjudul Kolagenase Bacillus licheniformisF11 Asal Palembang dan Aplikasinya pada Pembuatan Peptida Kolagen Bioaktif adalah karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan atau tidak diterbitkan dari penulis lain disebutkan dalam teks dan dicatumkan dalam daftar pustaka di bagian akhir disertasi ini
Bogor, Juni 2012
iii THENAWIDJAJA SUHARTONO, SUKARNO, DAHRUL SYAH and SISWA SETYAHADI.
Collagenase is endopeptidase which can cleave helical collagen into small peptide fragments.The objective of the study was to selectBacillus licheniformisF11 which produced the best collagenase, purify collagenase dan characterize the crude and purified collagenase and apply collagenase from Indonesian Bacillus licheniformis in the production of bioactive collagen peptides which act as antioxidant, inhibitor of ACE (angiotensin I-converting enzyme) and anti cancer. The Bacillus licheniformis F11.1 and F11.4 were deleted gen from B. licheniformis F11, respectively. Collagenase from B. licheniformis was selected for application to hydrolyze fish skin collagen to produce collagen peptides. B. licheniformis 11.1 produced higher protease activity as compared toB. licheniformisF11.4 when grown in LB media. The optimum production time was 15 h for B. licheniiformis F11.1 with protease activity of 0.028 U/ml or 0.909 U/mg protein.ForB. licheniformisF11.4 it was between 20-35 hours of fermentation, with enzyme activity of 0.005 U/ml or 0.157 U/mg protein. When collagen was added to the Modified LB media different responses were obtained. The activity of protease fromB. licheniformisF11.1 decreased from 0.028 U/ml or 0.909 U/mg protein to 0.005 U/ml or 0.172 U/mg protein while that of B. licheniformisF11.4 increased from 0.005 U/ml or 0.157 U/mg protein to 0.017 U/ml or 0.546 U/mg protein. Based on result from extracellular collagenase production and spesificities towards substrate and finger print substrate, B. licheniformis F11.4 was selected for further study. Enzyme purification was done with ammonium sulphate 50% (w/v) precipitation, followed by DEAE Sephadex A-50 column chromatography. Precipitation with ammonium sulphate resulted in 5-fold purification with a yield of 10.1%. After purification with DEAE Sephadex A-50 column, the enzyme was purified 26.3-fold with a yield of 2.6%. The relative molecular weight was estimated to be 124 and 26 kDa. The optimum activity of both crude and purified collagenase (without and with Ca2+) were observed at 500C. The crude enzyme had pH optimum at 9.0, while the purified enzyme at 7.0. The crude collagenase activity was inhibited by FeCl2(1mM) and CoCl2(1 mM) while CuCl2increased its activity. The purified collagenase activity was inhibited by CuCl2(1 mM), FeCl2(1 mM), MgCl2(1 mM) and CoCl2(1 mM). However, CaCl2 (10 mM), ZnCl2(5 and 10 mM) and CuCl2 (5 and 10 mM) increased its activity. The radical scavenging activity (as measured by DPPH) of the collagen peptide hydrolysed with purified collagenase was higher (30.28%) than that of these hydrolysed with crude collagenase (23.50%). However, ferric ion reduction activity of the collagen peptide hydrolysed with crude collagenase (2.12) was higher than that of the collagen peptide hydrolysed with purified collagenase (0.78) and these were also higher than the 2.0 mM BHT antioxidant used as control. The ACE (Angiotensin I-Converting Enzyme) inhibitor activity of the collagen peptide hydrolysed with crude was higher (83%) as compared to that hydrolysed with purified collagenase (74%). The antiproliferation activity towards HeLa cervix cancer cells of the collagen peptide hydrolysed with purified collagenase (39.2%) was higher than that of the collagen peptide hydrolysed with crude (23.5%).The antiproliferation activity towards HCT-116 colon cancer cells of the collagen peptide hydrolysed with crude and purified collagenase were similar, with antiproliferation activity at 88.1% at concentration of 1,000 ppm.
iv Aplikasinya pada Pembuatan Peptida Kolagen Bioaktif. Di bawah bimbingan MAGGY THENAWIDJAJA SUHARTONO, SUKARNO, DAHRUL SYAH dan SISWA SETYAHADI.
Kolagenase adalah endopeptidase yang dapat memecah kolagen. Kolagen dapat diperoleh dari berbagai sumber yaitu kulit dan tulang sapi, babi, ayam dan ikan.Bacillus licheniformisF11.1 dan F11.4 merupakan hasil mutasi dariBacillus licheniformis F11 asal Palembang. Tujuan penelitian ini adalah pemilahan Bacillus licheniformis F11 yang menghasilkan kolagenase tertinggi, memurnikan dan mengkarakterisasi kolagenase ekstraselular dari B. licheniformisF11 terpilih dan mengaplikasikan enzimnya dalam pembuatan peptida bioaktif. Kedua Bacillus ditumbuhkan pada media berkolagen untuk produksi kolagenase. Kolagenase dariBacillus licheniformisyang terpilih selanjutnya digunakan untuk menghidrolisis kolagen sehingga dihasilkan peptida kolagen. Peptida kolagen diuji aktivitasnya sebagai antioksidan (DPPH dan pereduksi ion ferric), inhibitor ACE (angiotensin I-converting enzyme) dan anti proliferasi sel kanker serviks (HeLa) dan sel kanker kolon (HCT-116) dengan metode MTT.
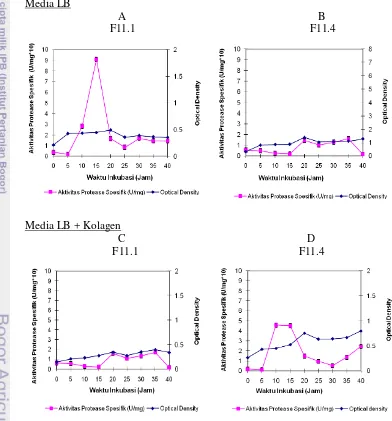
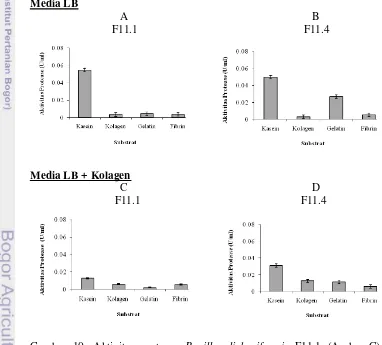
Tahap pertama penelitian bertujuan untuk memilah mutan yang menghasilkan kolagenase yang tertinggi. Hasil penelitian menunjukkan pada media Luria Bertani(LB),B. licheniformisF11.1 menghasilkan aktivitas protease yang lebih tinggi dibandingkan denganB. licheniformisF11.4. Aktivitas tertinggi B.licheniformisF11.1 adalah 0,028 U/ml atau 0,909 U/mg protein pada jam ke 15 dan B.licheniformis F11.4 adalah 0,005 U/ml atau 0,157 U/mg protein pada jam ke 5-40. Produksi pada media LB + kolagen 5% menghasilkan respon yang berbeda, aktivitas protease B. licheniformis F11.1 mengalami penurunan dari 0,028 U/ml atau 0,909 U/mg protein menjadi 0,005 U/ml atau 0,172 U/mg protein pada jam ke 20-35 sedangkan aktivitas proteaseB. licheniformisF11.4 meningkat dari 0,005 U/ml atau 0,157 U/mg protein menjadi 0,017 U/ml atau 0,456 U/mg protein pada jam ke 10-15. Hasil uji spesifitas substrat menunjukkan ketika diproduksi pada media LB, kedua protease lebih aktif pada substrat kasein dibandingkan dengan tiga protein lain (kolagen, gelatin dan fibrin). Penambahan kolagen pada media (LB + kolagen 5%) dapat menginduksi aktivitas fraksi pemecah kolagen menjadi lebih tinggi pada Bacillus licheniformis F11.4, sedangkan Bacillus licheniformis F11.1 aktivitas terhadap substrat kolagen berkurang. Hasil analisis spesifitas substrat didukung dengan hasil finger print substrate menggunakan zimogram menunjukkan pada substrat kolagen menghasilkan pita yang lebih banyak dan intensitas pita yang lebih nyata dibandingkan dengan media LB. Berdasarkan hasil dari produksi protease ekstraselularnya, spesifitas terhadap substrat dan analisis finger print berbagai substrat, B.licheniformis F11.4 dipilih sebagai isolat untuk menghasilkan kolagenase untuk penelitian tahap selanjutnya.
v enzim murni (tanpa dan dengan ion Ca2+) memiliki suhu optimum yang sama yaitu 500C. Pengaruh pH terhadap aktivitas kolagenase dianalisis pada kisaran pH 2,0 sampai pH 12,0 dengan menggunakan bufer universal. Enzimcrude memiliki pH optimum pada pH 9,0 dan enzim murni (tanpa dan dengan Ca2+) memiliki pH optimum pada pH 7,0. Pada pengujian pengaruh ion logam, ditemukan aktivitas kolagenase crude yang dihambat FeCl2 (1mM) and CoCl2 (1 mM) dengan
persentase penurunan masing-masing sebesar 28% dan 39%, sedangkan CuCl2
meningkatkan aktivitas kolagenase crude sebesar 60%. Aktivitas kolagenase murni dihambat oleh CuCl2(1 mM), FeCl2(1 mM), CoCl2(1 mM) dan MgCl2(1 mM) dengan persentase penurunan masing-masing sebesar 44%, 60%, 94% dan 86% sedangkan CaCl2(10 mM) meningkatkan aktivitas sebesar 109%, ZnCl2 (5 mM) meningkatkan aktivitas sebesar 66% dan ZnCl2 (10 mM) meningkatkan aktivitas sebesar 72%. Ion logam CuCl2 (5 mM) dapat meningkatkan aktivitas sebesar 30% dan CuCl2 (10 mM) meningkatkan aktivitas kolagenase murni sebesar 55%.
Tahap ketiga penelitian bertujuan untuk membuat peptida kolagen dengan menggunakan kolagenase. Hidrolisis kolagen dengan menggunakan kolagenase crudemenunjukkan derajat hidrolisis tertinggi 79,41%. Hidrolisis kolagen dengan menggunakan kolagenase murni memiliki derajat hidrolisis tertinggi sebesar 52,94%. Hasil aktivitas scavenging radikal DPPH peptida kolagen yang dihasilkan dari hidrolisis kolagenase murni (30,28%) lebih tinggi dibandingkan dengan peptida kolagen yang dihasilkan dari hidrolisis kolagenase crude(23,5%). Aktivitas pereduksi ionferric oleh peptida kolagen yang dihasilkan dari hidrolisis kolagenasecrude(2,12) memiliki aktivitas yang lebih tinggi dibandingkan dengan peptida yang dihasilkan dari hidrolisis kolagenase murni (0,78). Aktivitas penghambatan ACE peptida kolagen yang dibuat menggunakan kolagenase crude (83%) lebih tinggi dibandingkan dengan peptida yang dibuat menggunakan kolagenase murni (74%). Hasil pengujian dengan metode MTT terhadap kemampuan proliferasi sel VERO menunjukkan peptida kolagen pada konsentrasi 100, 500 dan 1000 ppm tidak bersifat toksik terhadap sel VERO. Aktivitas penghambatan terhadap sel kanker serviks HeLa oleh peptida kolagen yang dihasilkan dari hidrolisis kolagenase murni (39,2%) sedikit lebih tinggi dibandingkan dengan peptida yang dihasikan dari hidrolisis kolagenase crude (33,3%). Penghambatan proliferasi sel kanker kolon HCT-116 oleh peptida yang dihasilkan dari hidrolisis kolagenasecrude dan murni pada konsentrasi 1000 ppm memiliki penghambatan proliferasi tertinggi dengan aktivitas penghambatan yang sama yaitu sebesar 88,1%.
vi 1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencatumkan
atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah b. Pengutipan tidak merugikan kepetingan yang wajar
vii
PEPTIDA KOLAGEN BIOAKTIF
Oleh:
ACE BAEHAKI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
viii Penguji pada ujian terbuka: Dr. Ir. I Made Artika, M.Sc
ix
Nama Mahasiswa : Ace Baehaki
Nomor Pokok : F261080091
Program Mayor : Ilmu Pangan
Menyetujui, Komisi Pembimbing
Prof. Dr. Ir. Maggy Thenawidjaja Suhartono Dr. Ir. Sukarno, M.Sc
Ketua Anggota
Dr. Ir. Dahrul Syah, M.Sc.Agr Anggota
Dr. Ir. Siswa Setyahadi, M.Sc Anggota
Mengetahui, Ketua Program Mayor
Ilmu Pangan
Dr. Ir. Ratih Dewanti Hariyadi, M.Sc.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
x Puji Syukur dipanjatkan ke hadirat Allah SWT, atas rahmat dan karunia-Nya, karya ilmiah ini dapat diselesaikan. Penelitian yang berjudul ”Kolagenase Bacillus licheniformis F11 asal Palembang dan Aplikasinya pada Pembuatan Peptida Kolagen Bioaktif” dilaksanakan dari bulan Pebruari 2010 sampai bulan
Oktober 2011. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor dan di Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa Primata Institut Pertanian Bogor.
Penulis menyampaikan terima kasih dan penghargaan yang tinggi kepada Prof. Dr. Ir. Maggy T. Suhartono sebagai ketua komisi pembimbing yang telah mencurahkan waktu dan perhatian selama proses pembuatan proposal, bimbingan dalam penelitian, penulisan disertasi dan artikel ilmiah. Terima kasih atas fasilitas yang diberikan kepada penulis untuk melakukan penelitian di Laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Dr. Ir. Sukarno, M.Sc atas bimbingan dalam penelitian dan penulisan disertasi. Bapak telah memberikan semangat dalam menyelesaikan penelitian ini.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Dr. Ir. Dahrul Syah, M.Sc Agr atas bimbingan dalam penelitian dan penulisan disertasi. Bapak telah memberikan semangat dalam menyelesaikan penelitian ini.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Dr. Ir. Siswa Setyahadi, M.Sc atas bimbingan dalam penelitian dan penulisan disertasi. Bapak telah berkenan memberikan bakteri Bacillus licehniformis F11.1 dan F11.4 yang merupakan isolat koleksi Laboratorium Teknologi Bioindustri Badan Pengkajian dan Penerapan Teknologi (BPPT).
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Prof. Dr. Friedhelm Meinhardt dan kolageanya di University of Mű ster, Jerman
xi dan Dr. Ir. Feri Kusnandar, M.Sc dan Dr. drh. Diah Iskandriati dalam ujian tertutup, Dr. Ir. I Made Artika, M.AppSc dan Dr. Ir. Ekowati Chasanah, M.Sc dalam ujian terbuka atas segala masukannya dalam menyempurnakan rancangan penelitian dan penulisan disertasi.
Terima kasih kepeda Rektor Universitas Sriwijaya, Dekan Fakultas Pertanian dan ketua Program Studi Teknologi Hasil Perikanan Universitas Sriwijaya yang telah mengijinkan dan mendukung penulis dalam melanjutkan pendidikan S3 di Program Studi Ilmu Pangan. Terima kasih kepada Ketua Program Studi Ilmu Pangan, Kepala Laboratorium Mikrobiologi dan Biokimia Pusat Penelitian Sumberdaya Hayati dan Bioteknologi dan Kepala Laboratorium Mikrobiologi dan Imunologi Pusat Studi Satwa Primata IPB.
Terima kasih kepada DIKTI Depdikbud yang telah memberikan beasiswa BPPS dan dana penelitian Hibah kerjasama luar negeri dan publikasi internasional tahun 2010 dan hibah bersaing tahun 2011-2012. Rekan-rekan dan sahabat seperjuangan di PPSHB-IPB, Program Studi Ilmu Pangan (Mursalin, Rindy Panca T, Nur Wulandari, Mega Safithri, Tuti Suryanti, Nelis Imaningsih, Lula Nadia, Rahmawati, Rijanti Rahayu M, Andi Early Febrinda, Sitti Nurmiah, Emma Rochima dan lain-lain) dan Program Studi lain di lingkungan IPB, terima kasih atas persahabatan, dorongan semangat dan bantuan selama penelitian. Terima kasih kepada Ibu Ika Malikha, S.TP, Ibu Eni Sumartini, mba Mar, mba Pepi, mba Dewi, mba Silmi dan lain-lain yang selalu siap mengulurkan tangan dalam membantu penelitian ini.
Terima kasih kepada isteri None Afriyanti, S.Si dan ketiga anakku Rifqoh Muflihah, M. Syafwan Fikri dan M. Mufid Abdulaziz yang senantiasa memberikan semangat, menyejukan, menguatkan dan sabar mendampingi penulis menjalani studi ini. Terima kasih kepada orang tua (Bapak Solihin dan Ibu Titin) dan Bapak mertua Achtab Said yang senantiasa memberikan dukungan, doa dan dorongan semangat.
Semoga Allah SWT membalas segala kebaikan yang telah diberikan dengan balasan yang lebih sempurna.
Bogor, Juni 2012
xii Penulis dilahirkan di Bogor pada tanggal 9 Juni 1976 sebagai anak pertama dari lima bersaudara dari Bapak Solihin dan Ibu Titin. Tahun 2002 penulis menikah dengan None Afriyanti, S.Si dan dikaruniai tiga orang anak, Rifqoh Mufilhah Baehaki (2003), Muhamad Syafwan Fikri Baehaki (2007) dan Muhamad Mufid Abdul Aziz Baehaki (2010),
Sekolah dasar hingga menengah penulis selesaikan di Bogor. Pada tahun 1998 penulis menyelesaikan pendidikan strata satu di Jurusan Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Tahun 2001 penulis melanjutkan pendidikan S2 pada program studi Ilmu Pangan IPB dan menulis tesis dengan judul karakterisasi protease dari beberapa bakteri patogen di bawah bimbingan Prof. Dr. Ir. Maggy T. Suhartono dan Dr. Ir. Nurheni Sri Palupi, M.Si dan lulus pada tahun 2004. Tahun 2008 penulis diterima sebagai mahasiswa S3 pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB.
Sejak tahun 2001 penulis bekerja sebagai staf pengajar pada Program Studi Teknologi Hasil Perikanan, Fakultas Pertanian Universitas Sriwijaya Palembang.
Daftar Publikasi
1. Ace Baehaki, Maggy T. Suhartono, Sukarno, Dahrul Syah, Azis B. Sitanggang, Siswa Setyahadi, Friedhelm Meinhardt. 2012.“Purification and characterization of collagenase fromBacillus licheniformisF11.4”sudah terbit pada African Journal of Microbiology Research, Vol 6(10): 2373-2379 tanggal 16 Maret 2012. DOI: 10.5897/AJMR11.1379 (ISI Indexed Journal, Impact Factor 0.533)
2. Ace Baehaki, Sukarno, Dahrul Syah, Azis B. Sitanggang, Siswa Setyahadi, Friedhelm Meinhardt, Maggy T. Suhartono. ”Different expression of protease from Bacillus licheniformis F11.1 and F11.4 isolated from Palembang Indonesia”submittedpada Biocatalysis and Agricultural Biotechnology (Elsevier) 3. Ace Baehaki, Sukarno, Dahrul Syah, Siswa Setyahadi, Friedhelm Meinhardt,
xiii Siswa Setyahadi, Friedhelm Meinhardt. “Purification and characterization of collagenase from Bacillus licheniformis F11.4” telah diseminarkan pada seminar internasional The Council of Rector of Indonesia State University (CRISU) and The Council of University President of Thailand (CUPT) di Universitas Sriwijaya Palembang tanggal 20-22 Oktober 2011 (Oral presenter)
2. Ace Baehaki, Maggy T. Suhartono, Sukarno, Dahrul Syah, Siswa Setyahadi, Friedhelm Meinhardt. “Study on the collagenase from Bacillus licheniformis F11.4 and the use for production of collagen peptides with antioxidant activity” telah diseminarkan pada International symposium on Marine Ecosystem, Natural Product and Their Bioactive Metabolites di IPB International Convention Center Bogor, tanggal 25-27 Oktober 2011. (Poster presenter)
xiv
BakteriBacillus licheniformisF11 Penghasil Protease... 11
Peptida sebagai Antioksidan ... 13
Peptida sebagai Inhibitor ACE (Angiotensin I-Converting Enzyme).. 17
Peptida sebagi Anti Kanker ... 21
Bioavailibilitas Peptida ... 23
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 27
Bahan dan Alat ... 27
Metode Penelitian ... 28
Pemilahan Isolat dan Produksi Kolagenase ………. 30
Media Pertumbuhan dan Produksi Kolagenase……… 30
Pengukuran Aktivitas Kolagenase……….. 30
Analisis Protein Enzim ………. 31
Spesifitas danFinger Print Substrate………... 32
Pemurnian Enzim ……….. 32
Pengendapandengan Amonium Sulfat ………. 32
Dialisis ……….. 33
Pemurnian dengan Kromatografi Pertukaran Ion…………. 33
Penentuan Berat Molekul dengan SDS-PAGE dan Zimogram ……….. 34
Karakterisasi Kolagenase ……….. 35
Pengaruh Suhu terhadap Aktivitas Enzim………. 35
Stabilitas terhadap Panas ……… 35
Pengaruh pH terhadap Aktivitas Enzim……….. 36
Stabilitas pada pH Optimum……… 36
Pengaruh Ion Logam ……….. 36
Spesifitas Substrat Kolagenase Murni ……… 36
xv
Pengukuran Peptida Kolagen sebagai Antioksidan ……… 38
Aktivitas Scavenging Radikal DPPH ………. 38
Kekuatan Antioksidan MereduksiFerric(Reducing Power) ……… 39
Pengukuran Peptida Kolagen sebagai Inhibitor ACE ……… 39
Pengukuran Peptida Kolagen sebagai Antiproliferasi Sel Kanker secaraIn Vitro………. 41
Pemeliharaan Kultur Sel ………. 41
Pengujian Aktivitas Antiproliferasi Sel Kanker ………. 41
HASIL DAN PEMBAHASAN Pemilahan Isolat Penghasil Kolagenase Tertinggi……….. 43
Fermentasi ……….. 43
Pemurnian dengan Kromatografi Pertukaran Ion……… 54
Karakterisasi Kolagenase ……….... 57
Pengaruh Suhu terhadap Aktivitas Enzim ……….. 57
Stabilitas terhadap Suhu ……….. 60
Pengaruh pH terhadap Aktivitas Enzim ……….. 64
Stabilitas pada pH Optimum……….. 66
Pengaruh Ion Logam terhadap Aktivitas Enzim ………. 67
Spesifitas Substrat Kolagenase Murni ………. 70
PenentuanVmaxdanKmKolagenase Murni ……….. 71
Pembuatan Peptida Kolagen ……… 72
DerajatHidrolisis ……….… 72
Pola Peptida Hasil Hidrolisis ……… 74
Aktivitas Antioksidan Peptida Kolagen ………... 76
Aktivitas Penghambatan ACE ………. 80
Aktivitas Antiproliferasi Sel Kanker ……… 84
Pengaruh Peptida Kolagen terhadap Proliferasi Sel VERO….. 84
Pengaruh Peptida Kolagen terhadap Proliferasi Sel HeLa…… 86
Pengaruh Peptida Kolagen terhadap Proliferasi Sel HCT-116.. 87
KESIMPULAN DAN SARAN Kesimpulan ……… 93
Saran ……….. 94
DAFTAR PUSTAKA ………... 95
xvi Halaman
1. Karakteristik kolagenase dari beberapa bakteri... 7
2. Beberapa peptida antioksidan ... 16
3. Peptida inhibitor ACE ... 20
4. Rute pada absorbsi peptida……….. 24
5. Prosedur pengukuran aktivitas inhibitor ACE ... 40
6. Ringkasan produksi protease pada media LB dan LB + kolagen .... 45
7. Ringkasan fraksi protease yang diproduksi oleh Bacillus licheniformis F11.1 dan Bacillus licheniformis F11.4 yang terdeteksi pada zimogram……… 52
8. Tahapan pemurnian kolagenase dariB. licheniformisF11.4……….. 56
9. Karakteristik kolagenaseB. lichneniformisF11.4 dibandingkan dengan kolagenase dari bakteri lain………... 58
xvii Halaman 1. Langkah - langkah pemecahan kolagen oleh kolagenase
Kolagenanase mengikat pada kolagen sebelum memecah
triple-helixkolagen Chunget al.2004) ... 8 2. Struktur kolagen dan interaksinya dengan kolagenase
(MMP-1). (A) Peptida triple-helix yang dijelaskan oleh Kramer et al. (2001) dan sisi aktif dari domain katalitik yang dijelaskan oleh Liet al. (2005). (B) Model peptida triple-helixdan MMP-1 yang diputar 900ke arah kiri. Lokasi
katalitik Zn ditunjukkan dengan panah ... 10 3. Prediksi sekuen kitinase A strain F5 dan F11 dengan prediksi
susunan kitinaseB. licheniformisDSM13 dan MD1. (A) N-term-inal yang diduga signal peptida dengan huruf tebalitalics. Kitinase dari B. licheniformis DSM13 dan MD1 memiliki 692 asam amino sedangkan kitinase F5 dan F11 hanya memiliki 160 asam amino (B) mutasiframeshift dengan penghilangan A
(Waldecket al. 2006)………. 12
4. Mekanisme scavenging radikal DPPH oleh antioksidan (Ebada
et al. 2008) ... 15 5. Mekanisme ACE dalam meningkatkan hipertensi (Beevers dan
Greegor 1987) ... 18 6. Perkiraan model sisi pengikatan Captropil dan peptida pada sisi aktif
Enzim ACE. (A) sisi pengikatan Captropil (Illingworth 2002),
(B) sisi pengikatan peptida (Byun & Kim 2002) ……… 21 7. Diagram Alir Penelitian ... 29 8. Aktivitas protease (U/ml)Bacillus licheniformisF11.1 (A dan C)
dan Bacillus licheniformisF11.4 (B dan D) pada media LB
(A dan B) dan LB + kolagen (C dan D)... 43 9. Aktivitas spesifik protease selama fermentasi Bacillus
licheniformisF11.1 (A dan C) danBacillus licheniformisF11.4
xviii berbagai substrat... 47 11. Rasio hidrolisis kolagen dengan substrat lain (kasein, gelatin dan
fibrin). oleh protease Bacillus licheniformisF11.1 (A dan C) dan Bacillus licheniformis F11.4 (B dan D) yang diproduksi dari dua
tipe media: LB (A dan B) dan LB + kolagen (C dan D)... 49 12. (A) Zimogram protease Bacillus licheniformis F11.1 dan F11.4
dengan media LB dan media LB + kolagen. Analisis zimogram dilakukan pada substrat kolagen (lajur 2), kasein (lajur 3), gelatin (lajur 4) dan fibrin (lajur 5). Lajur 1 adalah marker. Jumlah sampel
yang ditambahkan 15 μ l. (B) Ilustrasi Gambar ... 51 13. Aktivitas kolagenase B. licheniformis F11.4 hasil pengendapan
dengan berbagai macam konsentrasi garam amonium sulfat………… 53 14. Profil elusi kolagenase B. licheniformisF11.4 dengan kolom
DEAE Sephadex A-50. Volume tiap fraksi 5 ml/tabung dan elusi
buffer fosfat 0,02 M pH 8………. 55
15. Berat molekul kolagenase B. licheniformisF11.4. (A) SDS-PAGE dan (B) zimogram Lajur 1, marker:phosphorylase b (97 kDa), bovine serum albumin (66 kDa), ovalbumin (45 kDa), carbonic anhydrase (30 kDa), and lysozyme (14 kDa); lajur 2, ekstrak kasar;
dan lajur 3, enzim murni DEAE Sephadex A-50 fraksi 44……… 56 16. Pengaruh suhu terhadap aktivitas kolagenaseBacillus licheniformis
F11.4. (A) kolagenase crude dan (B) kolagenase murni dengan 10 mM Ca2+(
□
) dan tanpa 10 mM Ca2+(Δ
). Aktivitas kolagenasedilakukan pada bufferfosfat 0,05 M pH 7.0………. 57 17. Pengaruh suhu terhadap stabilitas kolagenase B. licheniformis
F11.4. (A) kolagenase crude dan (B) kolagenase murni. Enzim dalam buffer fosfat 0,05 M (pH 7,0) pada 500C dan 700C.
Aktivitas residu enzim diukur pada kondisi standar……….. 61 18. Hubungan ln [aktivasi] kolagenase crude B. licheniformis F11.4
waktu pemanasan………... 62 19. Hubungan ln [aktivasi] kolagenase murni B. licheniformis F11.4
tanpa Ca2+ waktu pemanasan……….... 62 20. Hubungan ln [aktivasi] kolagenase murni B. licheniformis F11.4
xix 0,05 M (pH 7,0). Aktivitas residu kolagenase diukur suhu 500C………. 65 22. Stabilitas pada pH optimum kolagenase B. licheniformis F11.4.
(A) kolagenasecrudedan (B) kolagenase murnidengan 10 mM Ca2+ (
□
) dan tanpa 10 mM Ca2+(Δ
) dalam bufer fosfat 0,05 M (pH 9.0 untuk kolagenase crude dan pH 7,0 untuk kolagenase murni).Kolagenase Aktivitas diukur suhu 500C………... 67 23. Pengaruh ion logam terhadap aktivitas kolagenase Bacillus
licheniformis F11.4. (A) kolagenase crude dan (B) kolagenase
murni. Enzim dalam buffer fosfat 0,05 M (pH 7,0) pada 500C.
Aktivitas residu enzim diukur pada kondisi standar……….. 68 24. Spesifitas substrat kolagenase B. licheniformis F11.4 murni (Insert:
Spesifitas substrat kolagenaseB. licheniformisF11.4 ekstrakkasar)……. 70 25. Rasio hidrolisis kolagen dengan substrat lain (kasein, gelatin dan
fibrin) oleh kolagenase Bacillus licheniformisF11.4 murni (Insert:
rasio substrat kolagenaseB. licheniformisF11.4 ekstrak kasar)... 71 26. Penentuan parameter kinetika enzim koalgenase murni dari
Bacillus licheniformisF11.4 dengan Lineweaver-Burk plot………. 72
27. Derajat hidrolisis kolagenase B.licheniformis F11.4 pada substrat kolagen. (A) kolagenasecrude(0,56 U/mg) dan (B) kolagenase murni
(0,28 U/mg) ……… 73
28. Pola hidrolisis kolagen oleh enzim kolagenase B. licheniformis F11.4. kolagenase crude(A dan B) dan kolagenase murni (C dan D) dengan aktivitas kolagenase A=0,056 U/mg; B=0,028 U/mg; C=0,028
dan D=0,014 U/mg (M=marker, K=kolagen tanpa hidrolisis) ………….. 75 29. Aktivitas scavenging radikal peptida kolagen hasil hidrolisis
kolagenase B. licheniformis F11.4. (A) kolagenase crude dan (B) kolagenase murni. Konsentrasi peptide kolagen adalah 0,54 mg/ml dan konsentrasi BHT 2,0 mM……….... 77 30. Kekuatan pereduksi peptida kolagen hasil hidrolisis kolagenase
xx Unit enzim dengan konsentrasi protein kolagen 0,54 mg/ml. Konsentrasi Captropil yang digunakan adalah 1 mg/ml……….. 81 32. Aktivitas inhibitor ACE pada peptida kolagen dengan perbedaan
konsentrasi kolagen yang dihidrolisis. (A) Peptida hasil hidrolisis kolagenasecrudedan (B) kolagenase murni. Unit enzim kolagenase adalah 0,056 U/ml untuk kolagenase dan 0,028 U/ml pada kolagenase
murni. Konsentrasi Captropil 1 mg/ml………... 83 33. Aktivitas antiproliferasi peptida kolagen terhadap sel VERO,
(A) peptida kolagen hasil hidrolisis kolagenasecrudedan (B) peptida
kolagen hasil hidrolisis kolagenase murni……… 85 34. Aktivitas antiproliferasi peptida kolagen terhadap sel kanker serviks
HeLa, (A) peptida kolagen hasil hidrolisis kolagenase crude dan (B) peptida kolagen hasil hidrolisis kolagenasemurni………... 86 35. Aktivitas antiproliferasi peptide kolagen terhadap sel kanker kolon
HCT-16, (A) peptida kolagen hasil hidrolisis kolagenasecrude dan (B) peptida kolagen hasil hidrolisis kolagenasemurni……... 88 36. SDS-PAGE dan zimogram kolagenase, kolagen dan peptida kolagen
hasil hidrolisisnya yang memilki aktivitas antioksidan, inhibitor ACE
xxi Halaman
1. Pereaksi untuk analisa protease dan kolagenase……… 111
2. Komposisi larutan standar metode Bradford ………. 112
3. Kurva Standar Protein………. 113
4. Pereaksi untuk SDS-PAGE dan zimogram………. 114
5. Komposisi gel penahan dan pemisah SDS-PAGE dan zimogram ... 116
6. Kurva Penentuan berat molekul………... 117
7. Pembuatan Bufer Universal……….. 118
8. Pendugaan waktu paruh (t1/2) enzim (Toledo 2006)………. 119
9. Pereaksi untuk uji pengukuranderajat hidrolisis………. 120
10. Pereaksi untuk uji pengukuran aktivitas antioksidan……….. 121
Latar Belakang
Protein berperan signifikan pada peningkatan kesehatan manusia selain nilai gizinya. Hidrolisis enzimatik secara luas digunakan untuk meningkatkan nilai gizi dan sifat fungsional dari protein pangan. Hidrolisat protein ikan telah dilaporkan memiliki aktivitas antioksidan, antihipertensi, antiproliferasi sel kanker, antimikroba dan imunomodulator. Hidrolisat protein dengan bahan baku ikan yang menunjukkan aktivitas antioksidan yang telah dilaporkan adalah dari daging ikan Yellowfin, Alaska Pollack, Round Scaddan Pasifik Hake. Hidrolisat protein yang memiliki aktivitas sebagai inhibitor ACE (Angiotensin I-Converting Enzyme), diantaranya adalah hidrolisat dari ikan Sardin. Aktivitas antiproliferasi
dari hidrolisat protein juga telah diteliti yaitu hidrolisat protein ikan terhadap sel kanker payudara.
Kolagen merupakan protein struktural yang berlimpah dan seluruhnya berada pada tubuh mahluk hidup. Bentuk utama dari kolagen yang dikenal sebagai kolagen tipe 1 terdapat secara luas pada kulit, otot, tulang dan organ dalam vertebrata tingkat tinggi. Vertebrata tingkat rendah seperti ikan juga memiliki kolagen tipe 1.
Peptida kolagen diperoleh melalui proses enzimatis menggunakan kolagenase dan enzim proteolitik lainnya. Penggunaan kolagenase pada pembuatan peptida kolagen lebih efektif karena kolagenase merupakan endopeptidase yang dapat memecah domaintriple helixdari kolagen. Kolagenase lebih efektif bekerja pada kolagen yang belum terdenaturasi.
Streptomyces parvulus (Sakurai et al. 2009). Beberapa peneliti menggunakan organ dalam ikan sebagai sumber kolagenase yaitu organ dalam ikan makarel (Park et al. 2002), organ dalam ikan filefish (Kim et al. 2002), hepatopancreas udang (Aoki et al. 2003) dan hepatopancreas kepiting raja (Rudenskaya et al. 2004).
Berbagai pertimbangan penggunaan mikroba sebagai sumber enzim antara lain mikroba dapat tumbuh relatif cepat, ramah lingkungan, mudah diisolasi dan terbuka peluang untuk meningkatkan mutu enzim melalui rekayasa genetika. Bakteri yang berpotensi sebagai sumber kolagenase adalahBacillus licheniformis F11.1 danBacillus licheniformisF11.4. Kedua bakteri ini merupakan derivat dari B. licheniformis F11 yang diisolasi dari limbah udang di daerah Palembang Sumatera Selatan. Isolasi B.licheniformis F11 dilakukan atas kerjasama antara Laboratorium Bioindustri, Badan Pengkajian dan Penerapan Teknologi (BPPT) dengan Universitas Hamburg, Jerman dalam skema Indonesia-Germany Biotechnology(IG-Biotech)phase3.
Sumber kolagen yang digunakan adalah kulit ikan bandeng yang merupakan salah satu limbah pengolahan hasil perikanan. Produksi ikan nasional tahun 2009 sekitar 10.065.120 ton (BPS 2010) tentunya menghasilkan limbah yang cukup besar. Salah satu bentuk pemanfaatan limbah kulit ikan adalah dengan dibuat menjadi peptida kolagen menggunakan kolagenase Bacillus licheniformis F11. Peptida kolagen dari kulit ikan selanjutnya diuji bioaktivitasnya yang meliputi aktivitas antioksidan, inhibitor ACE (Angiotensin I-Converting Enzyme) dan antiproliferasi sel kanker.
Perumusan Masalah
bila dihidrolisis sempurna, tetapi hidrolisis secara parsial menghasilkan molekul-molekul peptida dengan sekuen asam amino spesifik yang memiliki bioaktivitas.
Hidrolisis protein menghasilkan peptida dapat dilakukan secara parsial menggunakan asam atau basa. Mengingat proses penambahan asam maupun basa pada proses hidrolisis dapat merusak beberapa gugus asam amino dan menghasilkan senyawa karsinogenik, maka fungsi asam atau basa dapat digantikan oleh enzim yang bekerja secara spesifik. Aplikasi kolagenase perlu dilakukan dalam rangka mencari proses yang lebih efektif dan lebih ramah lingkungan.
kolagen dari kulit salmon yang dapat menurunkan trigliserida pada tikus percobaan (Saito et al. 2009). Peptida kolagen yang dihasilkan oleh aktivitas kolagenase B.licheniformisF11.1 dan B.licheniformisF11.4 diharapkan memiliki aktivitas bioaktif sebagai antioksidan, inhibitor ACE (Angiotensin I-Converting Enzyme) dan antiproliferasi sel kanker.
Tujuan Penelitian
Tujuan penelitian ini adalah 1) memilah isolat yang menghasilkan kolagenase yang efektif dalam menghidrolisis kolagen, 2) memurnikan dan mengkarakterisasi kolagenase ekstraseluler dari B. licheniformisF11 terpilih dan 3) mengaplikasikan enzimnya dalam pembuatan peptida kolagen dari kulit ikan bandeng serta melakukan pengujian sifat bioaktif peptida kolagen yang dihasilkan yaitu aktivitas antioksidan, inhibitor ACE (Angiotensin I-Converting Enzyme) dan antiproliferasi sel kanker (sel kanker serviks HeLa dan sel kanker kolon HCT-116).
Hipotesis
Kolagenase
Kolagenase merupakan endopeptidase yang dapat memecah domaintriple helix dari kolagen. Berdasarkan fungsi fisiologisnya, kolagenase digolongkan menjadi dua tipe, yaitu serin kolagenase dan metallokolagenase. Serin kolagenase seperti semua serin proteinase, memiliki residu serin pada sisi katalitiknya (Daboor et al. 2010). Serin kolagenase memiliki berat molekul pada kisaran 24 - 36 kDa (Roy et al. 1996 dalamDabooret al. 2010), enzim ini berhubungan dengan organ pencernaan (Zefirovaet al. 1996) dan dapat memecah strukturtriple helix kolagen tipe I, II dan III serta terlibat pada produksi hormon dan degradasi protein, pembekuan darah dan fibrinolisis (Neurath 1984). Metallokolagenase merupakan enzim yang mengandung Zn yang membutuhkan kalsium untuk kestabilan (Stricklin et al. 1977). Metallokolagenase merupakan anggota Matrix Metalloproteinase (MMP) dengan berat molekul yang bervariasi dari 30 hingga 150 kDa (Harris & Vatar 1982). Selain itu, metallokolagenase termasuk dalam enzim ekstraseluler yang terlibat dalam pembentukan kembali matriks ekstraseluler, jenis enzim ini telah banyak dipelajari dari berbagai jaringan mamalia, bakteri dan bisa ular (Parket al.2002).
Salah satu sumber enzim kolagenase yang telah diketahui adalah dari bakteri. Penelitian ekstraksi kolagenase dari bakteri sudah banyak dipublikasikan. Beberapa bakteri yang menghasilkan kolagenase adalah Bacillus subtillis FS-2 (Nagano & To 1999), Bacillus subtilis CN2 (Tran & Nagano 2002), Bacillus sp. MO-1 (Okamotoet al.2001),Bacillus subtilisAS1.398 (Riuet al.2009),Bacillus pumilusCoI-J (Wuet al.2010), Streptomycessp. strain 3B (Petrovaet al.2006a) dan Streptomyces parvulus (Sakurai et al. 2009). Beberapa karakterisasi kolagenase dari bakteri hasil penelitian sebelumnya terdapat pada Tabel 1.
Konformasitriple-helixmembuat kolagen resisten terhadap sebagian besar proteinase. Pada vertebrata, enzim yang dapat memecah triple-helix kolagen adalah kolagenase (Visse & Nagase 2003) dan kathepsin K (Garneroet al. 1998). Kathepsin K memecah kolagen pada lingkungan asam, sedangkan enzim kolagenolitik bekerja pada lingkungan pH netral dan termasuk anggota dari matriks metalloproteinase (MMP) (Sternlicht & Werb 2001). Grup yang termasuk kolagenase adalah MMP-1, MMP-8, MMP-13 dan MMP-18 dan yang termasuk gelatinase A adalah MMP-2 (Aimes & Quigley 1995; Pattersonet al. 2001).
Chung et al. (2004) menyelidiki mekanisme kolagenase dalam mendegradasi jaringan kolagen. Pada penelitiannya secara in vitro, digunakan dua substrat, yaitu kolagen utuh tipe I (kolagen fibril dari kulit dan tulang hewan) dan gelatin. Kolagenase yang digunakan adalah prototipe MMP-1 (E200A). Pada perbedaan substrat ini kolagenase mempunyai aktifitas yang tinggi pada kolagen dibandingkan dengan gelatin, sehingga ini membuktikan bahwa kolagenase lebih efektif bekerja pada kolagen yang belum terdenaturasi. Kolagenase dapat memecah tripolipeptida walaupun pada suhu tubuh 37 oC bahkan 100C dan 40C walaupun lebih sedikit kolagen yang terpecah.
peptida dan protein non kolagen tetapi tidak dapat memecah kolagen (Clark & Cawston, 1989).
Tabel 1. Karakteristik kolagenase dari beberapa bakteri
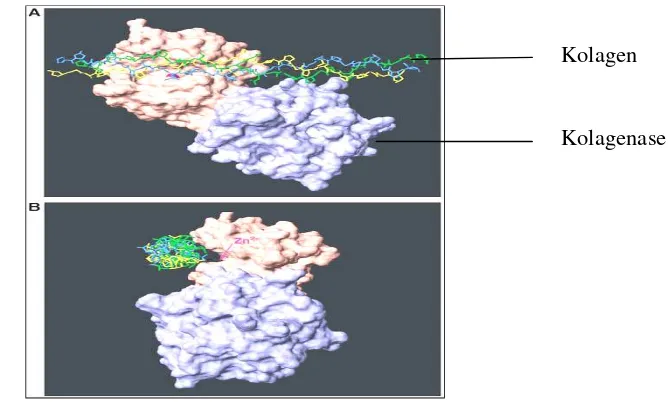
Menurut Chunget al. (2004) domain katalitik yang mengandung Zn pada sisi aktifnya berikatan dengan substrat kolagen. Kemudian kolagenase pada bagian domain ini akan menggerakkan substrat kolagen triple helix yang kaku. Akibatnya ikatan antar residu asam amino Gly775-Ile776 pada α1(I) dan Gly775 -Leu776pada α2(I) terhidrolisa dan terputus, sehingga rantai terpecah manjadi dua fragmen, ¼ dan ¾ fragmen, dimana N terminal berada pada fragmen ¼. Ikatan yang terputus pertama kali adalah pada salah satu rantai α1(I). Gambar langkah-langkah pemecahan kolagen oleh kolagenase tersaji pada Gambar 1.
Gambar 1. Langkah-langkah pemecahan kolagen oleh kolagenase. Kolagenase mengikat pada kolagen sebelum memecah triple-helix kolagen (Chunget al.2004).
(Kanth et al. 2008). Aplikasi kolagenase lainnya adalah pada pembuatan peptida kolagen.
Peranan kolagenase sangat penting dalam bidang biomedis. Rilley & Herman (2005) meneliti kolagenase untuk proses penyembuhan luka secara in vitrodan in vivo. Secarain vitroyaitu dengan menggunakan matriks ekstraseluler yang diberi perlakuan menggunakan kolagenase Clostridial (protease nonspesifik) dan bufer sebagai kontrol. Keratinosit disebar (plated) di atas matriks tersebut dan diamati parameternya yaitu ada dan tidak adanya kolagenase,heparin binding epidermal-like growth factor, proliferasi dan migrasi sel. Keratinosit merupakan
membran dasar yang menyediakanscaffoddan matriks signal makromolekul yang bertanggung jawab terhadap regulasi sel selama masa perkembangan, dewasa, dan penyembuhan luka. Secara in vivo, digunakan luka pada bagian tubuh belakang Yucatan micropigs dengan membandingkan pengaruh kolagenase tersebut dengan Regranex (PDGF-BB) dan Solosite (carboxymethyl cellulose). Hasil dari penelitian Rilley & Herman (2005) menyimpulkan bahwa pada semua parameter yang diteliti yaitu pembentukan jaringan granulasi, inflamasi, re-epitelisasi, dan lama waktu penyembuhan menunjukkan bahwa dengan adanya kolagenase, parameter yang diteliti lebih baik dibandingkan perlakuan yang lain. Sehingga dapat disimpulkan bahwa kolagenase dapat menstimulasi respon seluler keratinosit pada luka secarain vitrodan dapat merupakan pendekatan terapi untuk penyembuhan luka secara in vivo. Penggunaan kolagenase lainnya yang cukup penting dalam bidang biomedis adalah dalam perbaikan radang pada jaringan, transplantasi klinis, fungsi seluler dalam penggumpalan darah, fibrinolisis dan fertilisasi (Simpson 2000).
Kolagen
yang tinggi yaitu asam amino yang jarang ditemukan pada protein selain pada kolagen. Asam amino prolin dan hidroksiprolin mencapai kira-kira 21% dari residu asam amino pada kolagen (Lehninger 1994a). Kolagen terdiri dari dua rantai α1(I) dan rantai α2 (I) yang distabilkan oleh ikatan hidrogen. Struktur kolagen dan interaksinya dengan enzim kolagenase (MMP-1) dapat dilihat pada Gambar 2.
Gambar 2. Struktur kolagen dan interaksinya dengan kolagenase (MMP-1). (A) Peptidatriple-helixyang dijelaskan oleh Krameret al. (2001) dan sisi aktif dari domain katalitik yang dijelaskan oleh Li et al. (1995). (B) Model peptida triple-helixdan MMP-1 yang diputar 900ke arah kiri. Lokasi katalitik Zn ditunjukkan dengan panah.
Kolagen secara luas digunakan pada pangan, farmasi, kosmetik, bahan biomedis dan industri kulit. Sumber utama industri kolagen berasal dari kulit dan tulang sapi dan babi. Tetapi sejak merebaknya penyakit sapi gila menimbulkan kebimbangan para pengguna kolagen sapi, disamping kolagen dari kulit dan tulang babi tidak dapat digunakan di beberapa daerah karena alasan agama. Limbah dari ikan seperti tulang dan sisik seperti halnya kulit banyak mengandung kolagen (Gomez-Guillen et al. 2002). Penelitian memanfaatkan organisme perairan sebagai sumber kolagen sudah banyak dilakukan (Nagai et al. 2001, 2002a, 2002b; Nagai dan Suzuki, 2000, 2002). Kolagen yang terdapat pada kulit ikan mas (Cyprinus carpio) memiliki kandungan yang tinggi yaitu 41,30%
Kolagen
sedangkan pada sisik ikan sebesar 1,35% dan pada tulang ikan sebesar 1,06% (Duanet al. 2006)
Kolagen merupakan kelompok molekul yang terdiri lebih dari 20 jenis. Kolagen digolongkan menjadi dua, yaitu fibril dan non fibril. Kolagen tipe I, II, III dan V merupakan jenis kolagen fibril, sedangkan yang lain merupakan jenis nonfibril. Kolagen tipe I terdapat pada kulit, urat daging, pembuluh darah, organ tubuh dan tulang (komponen utama tulang), kolagen tipe III merupakan komponen utama serat reticular, kolagen tipe IV terdapat padabasementmembran sel. Kolagen tipe V tersebar pada jaringan konektif. Kolagen tipe II dan XI merupakan kolagen spesifik tulang rawan. Sedangkan kolagen yang lain terdapat pada permukaan kolagen fibril dan antara kolagen fibril dan basement membran (Barrow & Shahidi 2008).
BakteriBacillus licheniformisF11 Penghasil Protease
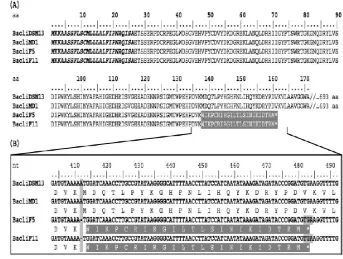
sintesis asam poliglutamat juga dilakukan. Pencarian menggunakan Blastp menunjukkan hasil 99 sampai dengan 100% sama dengan locus B. licheniformis dengan satu kekecualian yaitu chiA (Waldeket al. 2006).
Gambar 3. Prediksi sekuen kitinase A strain F5 dan F11 dengan prediksi sekuen kitinase B.licheniformis DSM13 dan MD1. (A) N-terminal yang diduga signal peptida dengan huruf tebal italics. Kitinase dari B.licheniformis DSM13 dan MD1 memiliki 693 asam amino sedangkan kitinase F5 dan F11 hanya memiliki 160 asam amino (B) mutasiframeshiftdengan penghilangan A (Waldecket al. 2006).
yaitu chiA dan chiB yang menghasilkan enzim kitinase. Adanya enzim kitinase pada proses deproteinasi kitin akan menghasilkan kitin yang memiliki berat molekul rendah sehingga gen penyandi chiA dan chiB harus dihilangkan. B.licheniformis F11.1 secara alamiah telah terjadi mutasi sehingga tidak memiliki chiA ternyata dapat digunakan dalam hidrolisis protein limbah udang, tetapi tidak efisien pada produksi kitin secara besar-besaran, hal ini disebabkan masih ada gen kitinase (chiB) yang berpengaruh negatif pada produksi kitin. B.licheniformis F11.1 dilakukan mutasi lagi dengan menghilangkan gen chiB menghasilkan B.licheniformis F11.4 yaitu bakteri yang operon pembentukan poliglutamat (pga) danchiBAsudah tidak ada (Hoffmannet al.2010).
Peptida sebagai Antioksidan
Antioksidan didefinisikan sebagai substansi yang secara signifikan menghambat proses oksidasi pada konsentrasi rendah. Antioksidan dapat bekerja pada level yang berbeda dalam urutan oksidasi (Jun et al. 2004). Menurut Priyadarsini (2005) antioksidan adalah substansi kimia dalam jumlah rendah dapat mencegah oksidasi seluler organel dengan meminimalkan kerusakan sel akibat adanya ROS/RNS atau stress oksidasi.
Oksidasi lemak merupakan masalah besar bagi industri pangan dan konsumen, karena terbentuknya off-flavor yang tidak diinginkan dan berpotensi menjadi produk yang bereaksi secara toksik (Park et al. 2001). Antioksidan digunakan untuk mengawetkan produk pangan dengan menghambat diskolorasi dan pembusukan sebagai akibat dari oksidasi. Oleh sebab itu, antioksidan penggunaannya meningkat untuk meningkatkan daya simpan dan meningkatkan stabilitas lemak dan pangan yang mengandung lemak.
antioksidan menurut Huang et al. (2005) digolongkan menjadi 2 yaitu hidrogen elektron transfer (HAT) dan elektron transfer (ET). Reaksi HAT umumnya terjadi akibat peroksidasi lemak yaitu antara radikal (X*) dengan antioksidan (AH) (reaksi 1) sedangkan ET akibat reaksi redok (reduksi oksidasi) dan adanya perubahan warna yang memudar yaitu reaksi radikal (X*) dengan antioksidan (AH) menghasilkan ion radikal dan antioksidan radikal (AH*+), kemudian menghasilkan produk yang stabil (XH) dan H2O yang mempengaruhi warna, yang
dapat dilihat pada reaksi 2,3 dan 4.
X* + AH XH + A* (1)
X* + AH X* + AH*+ (2)
AH*+ A* + H3O+ (3)
X* + H3O+ XH + H2O (4)
Reaksi-reaksi di atas mendasari metode-metode penentuan kapasitas atau aktivitas antioksidan seperti DPPH (2,2-diphenyl-1-picrylhidrazil), ABTS (2,2 azinobis 3-ethylbenzothiazoline-6-sulfonic acid), FRAP (Ferric reducing
antioxidant power), TEAC (total equivalent antioxidant capacity), ORAC (oxigen
radical absorbance capacity), TRAP (total radical trapping antioxidant
parameter), TAC (total antioxidant capacity), TOSC (total oxigen scavenging
capacity), FCR (follin calcateau raegent) dan cupprac. Metode-metode analisis
antioksidan yang didasari atas reaksi HAT adalah ORAC, TRAF, TAC, FCR dan TOSC sedangkan yang termasuk ET adalah DPPH, ABTS, FRAP, TEAC dan Cupprac (Prior et al. 2005). Contoh mekanisme scavenging radikal DPPH oleh antioksidan dapat dilihat pada Gambar 4.
bahan pangan adalah 200 ppm (Ketaren 1986). BHT dapat menyebabkan perubahan tiroid tikus, stimulasi sintesis DNA dan induksi enzim (Farago et al. 1989).
Gambar 4. Mekanisme scavenging radikal DPPH oleh antioksidan (Ebadaet al. 2008)
Oleh sebab itu pencarian antioksidan alami sebagai alternatif antioksidan sintetik mendapat perhatian yang besar di kalangan peneliti. Beberapa penelitian aktivitas antioksidan dari protein sudah dilakukan seperti protein kedelai (Pratt 1972), bovine serum albumin (Yukami 1972), protein biji-bijian (Rhee et al. 1979), kasein susu (Yamaguchi et al. 1980), protein kuning telur (Park et al. 2001), hidrolisat gelatin kulit Allaska Pollack (Kim et al. 2001), protein daging babi (Carlsenet al. 2003), dan protein ikan yellowfin (Junet al.2004).
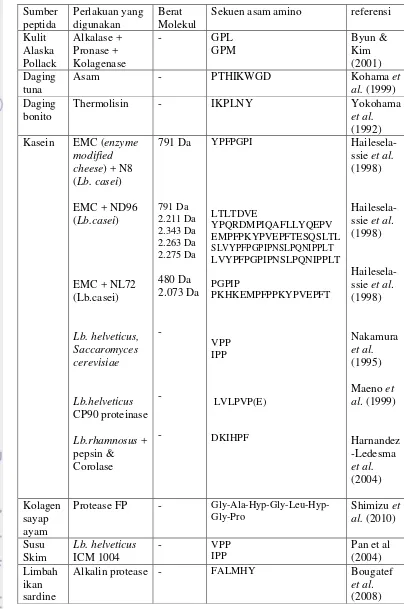
VKAGFAWTANQQLS (1.519 Da) yang memiliki aktivitas menghambat peroksidasi lemak yang lebih tinggi dibandingkan dengan α-tokoferol setelah 7 hari. Raghvan & Kristinsson (2008) melakukan penelitian tingkat kemanjuran antioksidan hidrolisat protein ikan nila, yang menunjukkan semakin tinggi derajat hidrolisis maka semakin tinggi aktivitas scavenging terhadap radikal DPPH. Analisis dengan menggunakan SDS-PAGE terhadap hidrolisat ikan nila menunjukkan semakin tinggi derajat hidrolisis maka berat molekulnya semakin rendah, sehingga semakin banyak peptida yang memiliki berat molekul rendah akan memiliki aktivitas scavenging yang lebih tinggi terhadap radikal DPPH. Khantaphant & Benjakul (2008) melakukan studi komparatif protease yang digunakan pada produksi hidrolisat gelatin yang menunjukkan hidrolisis hampir dipastikan meningkatkan aktivitas antioksidan. Beberapa peptida dari hasil hidrolisis yang bersifat antioksidan terdapat pada Tabel 2.
Tabel 2. Beberapa peptida antioksidan Sumber
Asp-Phe-Asp-Leu-Glu-Pengaruh antioksidan pada scavenging radikal DPPH dikarenakan kemampuan mendonorkan hidrogen (Binsan et al.2008). Suetsuna et al. (2000) menyatakan grup hidroksil fenolik pada asam amino aromatik (fenilalanin, triptopan, tirosin) berpotensi mendonorkan elektron. Asam amino histidin (polar +), prolin, alanin dan leusin (non polar) berkontribusi pada scavenging radikal (Kim et al. 2001). Hernandez-Ledesman et al. (2005) menyatakan triptopan dan tirosin (grup indolik dan fenolik) merupakan donor hidrogen. Secara umum semua hidrolisat yang mengandung peptida atau protein dapat mendonorkan hidrogen dan dapat bereaksi dengan radikal untuk mengubah menjadi produk yang lebih stabil, dengan demikian menghentikan reaksi rantai radikal.
Peptida sebagai Inhibitor ACE (Angiotensin I-Converting Enzyme)
Hipertensi dapat digolongkan dalam dua katagori yaitu hipertensi primer dan hipertensi sekunder. Hipertensi primer artinya hipertensi yang belum diketahui penyebabnya secara jelas. Berbagai faktor diduga turut berperan sebagai penyebab hipertensi seperti bertambahnya umur, stres psikologis dan hereditas (keturunan). Hipertensi sekunder adalah hipertensi yang penyebabnya telah pasti, misalnya ginjal yang tidak berfungsi, pemakaian alat kontrasepsi dan terganggunya keseimbangan hormon yang merupakan faktor pengatur tekanan darah (Purwatiet al.1997).
Peningkatan tekanan darah dapat disebabkan oleh renin (protease asam). Renin disekresi oleh sel juxtaglomerulus yang terdapat pada dinding arteriol aferan dan glomerulus. Renin masuk ke dalam darah bila perfusi ginjal menurun akibat turunnya tekanan darah atau adanya stenosis pada arteri ginjal, bila terjadi deplesi natrium akibat penurunan kadar natrium dalam tubuli ginjal serta bila terdapat stimulasi adrenergik melalui reseptor β1(Ganiswarna 1995).
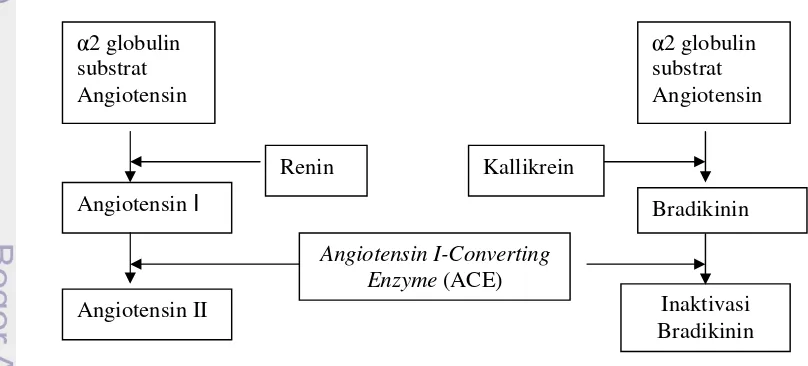
pusat. Angiotensin II berperan juga dalam menimbulkan kontriksi arteriol dan venula, menstimulasi sintesis dan sekresi aldosterol serta menstimulasi jantung dan sistem simpatis. Efeknya pada sistem syaraf pusat menstimulasi konsumsi air dan meningkatkan sekresi ADH (Anti diuretic hormone) atau hormon anti diuretik sehingga terjadi peningkatan resistensi periferal, reabsorbsi natrium dan air. Tekanan darah yang meningkat akan mengaktifkan mekanisme umpan balik sehingga mengurangi sekresi renin. Angiotensin II disebut juga hipertensin atau angiotonin yang menyebabkan arteriolar constriction dan peningkatan tekanan darah sistolik dan distolik. Angiotensin II merupakan salah satu vasocontrictor paling penting yang telah diketahui aktivitasnya yang mencapai 4 sampai 8 kali aktivitas nonepinefrin pada individu normal. Angiotensin II berpengaruh langsung terhadap cortex adrenal dalam peningkatan sekresi aldosteron. Aldosteron adalah hormon yang dapat meningkatkan reabsorbsi natrium dan klorida di tubulus distal. Sistem renin-angiotensin merupakan regulator utama dari sekresi aldosteron (Ganong 1983). Mekanisme ACE dalam meningkatkan hipertensi dapat dilihat pada Gambar 5.
Gambar 5. Mekanisme ACE dalam meningkatkan hipertensi (Beevers & Greegor 1987).
α2 globulin
substrat Angiotensin
AngiotensinI
Angiotensin II
Angiotensin I-Converting Enzyme(ACE)
Bradikinin
Inaktivasi Bradikinin
α2 globulin
substrat Angiotensin
Hipertensi dihubungkan dengan insiden penyakit jantung koroner dan pencegahan hipertensi ini efektif untuk mengurangi resiko penyakit jantung koroner ini (MacMahon et al. 1990). Angiotensin I-converting enzyme (EC 3.4.15.1; ACE) memainkan peranan yang penting secara fisiologis dalam pengaturan tekanan darah (Skeggset al.1956). ACE dapat meningkatkan tekanan darah dengan mengubah dekapeptida angiotensin-I yang inaktif menjadi vasocontrictor angiotensin-II yang kuat (oktapeptida). ACE adalah enzim multifungsional yang dapat mengkatalisis degradasi bradikinin (Erdos 1975). Dengan demikian penghambatan aktivitas ACE dipertimbangkan digunakan pada pendekatan terapi pada pencegahan tekanan darah tinggi, karena dapat mengurangi aktivitas angiotensin-II dan meningkatkan kadar bradikinin. Disamping itu, beberapa inhibitor ACE juga memiliki efek yang bermanfaat pada metabolisme glukosa dan lemak (Pollareet al.1999).
Beberapa inhibitor ACE yang efektif sudah dikembangkan yaitu Captropil, Enalapril dan Lasinopril yang semuanya ini digunakan sebagai obat antihipertensi secara klinis (Kuster & Marshal 2005). Walaupun inihibitor ACE sintetik ini efektif sebagai obat antihipertensi, inhibitor ini memberikan efek yang kurang baik seperti batuk, reaksi alergi, gangguan rasa dan ruam kulit. Oleh karena itu, penelitian dan pengembangan untuk menemukan inhibitor ACE yang aman, inovatif dan ekonomis merupakan kebutuhan dalam pencegahan dan pengobatan hipertensi.
Hasil penelitian Li et al. (2004) menunjukkan peptida yang berpotensi tinggi sebagai inhibitor ACE adalah yang memiliki asam amino triptopan, fenilalanin, tirosin atau prolin pada C-terminal, dan asam amino alifatik bercabang (alanin, valin, isoleusin dan leusin) pada N-terminal. Penelitian lain menunjukkan bahwa prolin pada posisi ketiga dari yang terakhir pada sekuen peptida dapat meningkatkan pengikatan terhadap enzim ACE (Contreras et al. 2009). Sebagian besar peptida inhibitor ACE dari alam mengandung prolin pada C-terminal termasuk kolagen yang memiliki banyak residu asam amino prolin. Inhibitor komersial (Captropil dan Enalapril) juga mengandung residu prolin pada strukturnya (Alemanet al.2011). Perkiraan model sisi pengikatan Captropil dan peptida pada sisi aktif enzim ACE dapat dilihat pada Gambar 6.
A B
Gambar 6. Perkiraan model sisi pengikatan Captropil dan peptida pada sisi aktif enzim ACE. (A) sisi pengikatan Captropil (Illingworth 2002), (B) sisi pengikatan peptida (Byun & Kim 2002)
Peptida Sebagai Anti Kanker
(karsinogenesis) yaitu inisiasi, promosi dan progresi, yang dilanjutkan oleh adanya tahap metastasis tumor.
Mekanisme kerja senyawa aktif dalam penghambatan proliferasi sel kanker dapat melalui berbagai cara, antara lain apoptosis (kematian terprogram), nekrosis, penghambatan siklus sel dan kegagalan ribosom untuk mensintesis protein. Beberapa mekanisme anti kanker peptida telah dilaporkan oleh banyak peneliti. Peptida dari kecap ikan anchovy meningkatkan apoptosis pada sel lymphoma manusia dengan cara meningkatkan caspase 3 dan caspase 8 (Leeet al. 2003). Lunasin, peptida kemopreventif dari kacang kedelai ditemukan sebagai anti kanker (Galvez et al. 2001). Peptida lunasin berkompetisi dengan histon asetil transferase (HAT) untuk berikatan dengan inti histon deasetilasi (HADC). Peptida berikatan dengan inti histon deasetilasi sehingga terjadi apoptosis. Apabila HAT berikatan dan inti histon akan berasetilasi, memberikan sinyal kepada promotor E2F untuk terjadinya transkripsi sehingga tidak terjadi apoptosis (de Lumen 2005). Peptida hidrofobik dari hidrolisat protein kedelai tanpa lemak dengan enzim thermoase menunjukkan terjadinya sitotoksik in vitro pada sel makrofag monosit tikus dan sekuennya adalah X-Met-Leu-Pro-Ser-Tyr-Ser-Pro-Tyr (1157 Da) (Kim et al. 2000). Valorphin, peptida dari hemoglobin menunjukkan aktivitas antiproliferasi yang dihubungkan dengan adanya peptida spesifik yang bersifat toksik terhadap sel kanker (Blishchenko et al. 2005 dalam Picot et al. 2006). Peptida lactoferricin dari susu sapi dapat menghambat metastasis paru-paru dan angiogenesis pada tikus yang ditransplantasi murine melanoma, lymphoma dan karsinoma kolon (Yoo et al. 1997 dalam Hsu et al. 2011).
Apoptosis merupakan mekanisme kematian sel tunggal atau sekelompok sel yang tersebar di antara sel-sel sehat atau sel-sel kanker, kematian sel terjadi karena perubahan metabolisme di dalam sel akibat sel mengalami gangguan sehingga mengalami kondensasi sitoplasma dan inti. Proses ini diikuti dengan pecahnya sel menjadi apoptotik sehingga ditelan oleh sel-sel di sekelilingnya dan diikuti penghancuran total (Govanet al.1995)
3-(4,5-dimethyl-2-thiazol)-2,5 diphenyl-tetrazolium bromide (MTT), dan diamati secara spektrofotometrik. MTT merupakan metode oksidasi reduksi, dengan cara ini sel hidup dapat dihitung dengan mudah, cepat dan akurat. Prinsip dari metode ini adalah perubahan dari garam tetrazolium yang berwarna kuning menjadi kristal formazan yang berwarna biru/ungu akibat adanya akivitas enzim suksinat dehidrogenase pada bagian mitokondria (Doyle dan Griffith 2000).
Metode lainnya adalah pewarnaan biru trifan, pada metode ini sel dihitung dengan haemositometer dan diamati di bawah mikroskop. Pada pewarnaan biru trifan sel hidup terlihat bening tidak berwarna, sedangkan sel mati akan menyerap warna dan pada pengamatan terilhat berwarna biru (Wilson 1992).
Bioavailibilitas Peptida
Bukti yang mengkonfirmasikan aktivitas antioksidan peptida bioaktif secara in vitro sudah banyak, yang penting adalah sulitnya menghubungkan antara sifat antioksidan secarain vitrodengan kapasitas antioksidan secarain vivo karena peptida akan terdegradasi dan termodifikasi di dalam usus, sistem vaskuler dan hati. Ini menyebabkan paptida harus mampu melewati rintangan dan menjangkau target.
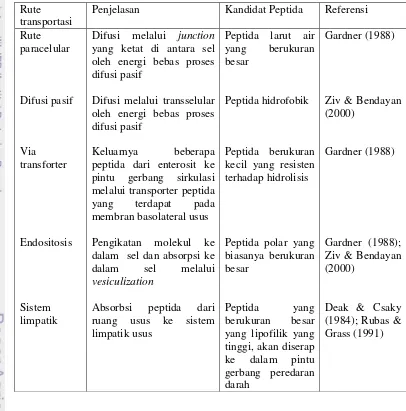
Pada kenyataannya sebagian kecil peptida bioaktif akan melewati rintangan usus dan ini biasanya terlalu kecil untuk menunjukkan efek gizi yang penting secara biologis pada level jaringan (Gardner 1988). Tabel 4 memperlihatkan sejumlah mekanisme absorpsi peptida utuh yaitu rute paraselular, difusi pasif, transpor via pengangkut (transporter), endositosis dan sistem limphatik.
Peptida dan protein dapat lepas dari digesti enzim dan diabsorpsi dalam bentuk utuh melalui usus ke sistem limpatik usus akan tetapi kemampuan untuk masuk ke sistem limpatik usus dipengaruhi oleh permeabilitasnya via sirkulasi portal capillarydan kelarutan terhadap lemak (Deak & Csaky 1984).
menunjukkan bahwa peptida dengan 2 - 6 asam amino lebih siap diabsorpsi dibandingkan dengan protein dan asam amino bebas (Grimble 1994). Robert et al. (1999) melaporkan bahwa peptida kecil (di dan tripeptida) dan peptida besar (10 -51 asam amino) dapat menembus rintangan usus dan memperlihatkan fungsi biologis pada level jaringan, akan tetapi dengan meningkatnya berat molekul akan mengubahnya sehingga untuk menembus rintangan usus semakin menurun.
Tabel 4. Rute pada absorbsi peptida Rute oleh energi bebas proses difusi pasif
Difusi melalui transselular oleh energi bebas proses difusi pasif
Keluarnya beberapa peptida dari enterosit ke pintu gerbang sirkulasi
spesifik prolin. Selanjutnya pada sebuah penelitian menunjukkan sejumlah peptida pada plasma manusia meningkat yang tergantung dosis yang diberikan, yang menunjukkan bahwa kejenuhan dari peptida transforter dapat mempengaruhi sejumlah peptida memasuki darah (Matsuiet al. 2002)
Sehubungan dengan tidak sempurnanya bioavailibilitas peptida dalam mengikuti proses pencernaan secara oral, suatu peptida dengan aktivitas antioksidanin vitromungkin menunjukkan sedikit atau tidak ada aktivitasin vivo. Rute lain yang dapat meningkatkan perubahan absorpsi peptida diperlukan untuk mengurangi masalah ini. Aktivitas antioksidan in vivomungkin dapat lebih tinggi dibandingkan aktivitas in vitro (Erdmann et al. 2008), peptida bioaktif memiliki fungsi biologi dengan mekanisme selain dari yang diterapkan di percobaan. Sebagai tambahan, aktivitas yang tinggi secara in vivo sehubungan dengan peningkatan aktivitas peptida sebagai akibat pemecahan oleh protease gastrointestinal.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Pebruari 2010 sampai Oktober 2011. Tempat penelitian utama dilaksanakan di Laboratorium Mikrobiologi dan Biokimia Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian aktivitas antiproliferasi sel kanker dilaksanakan di Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa Primata Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan pada penelitian adalah kolagen dari kulit ikan bandeng yang dibuat menurut Yuniarti (2010), bahan lain seperti kasein, gelatin, dan fibrin adalah grade p.a (Sigma). Isolat bakteri Bacillus licheniformis F11.1 dan F11.4 yang merupakan hasil mutasi dari B. licheniformis F11 yang diperoleh dari Badan Pengkajian dan Penerapan Teknologi (BPPT). Sel VERO (ATCC CCL-81) dan sel kanker HeLa (Epithel Carsinoma Cervix/ ATCC CCL 2.2) yang digunakan merupakan koleksi dari Pusat Studi Satwa Primata IPB dan HCT-116 (ATCC CCL-247TM/sel kanker kolon) dari Stem Cell Cancer Institute Jakarta.
Bahan-bahan kimia yang digunakan untuk memproduksi dan mengukur aktivitas kolagenase antara lain tryptone, yeast extract, agar, HCl, NaOH, tris (hydroxymethyl) aminomethane, CaCl2, asam trikloro asetat, L-tyrosin, bovine
serum albumin fraction V (merck) dan Coomassie briliant blue G-250. Bahan kimia untuk pemurnian kolagenase adalah amonium sulfat teknis, DEAE (dietilaminoetil) Sephadex A-50 dan EDTA (ethylenedinitrilo tetraacetic acid). Bahan kimia untuk karakterisasi kolagenase adalah CaCl2, BaCl2, MnCl2, FeCl2,
ZnCl2, MgCl2 dan CoCl2. Standar berat molekul yang digunakan dalam gel
(66,0 kDa), ovalbumin (45,0 kDa),carbonic anhydrous (30,0 kDa), cytochrom C (14,4 kDa). Reagen lain seperti Coomassie Brilliant Blue R-250, akrilamid, bisakrilamid, TEMED (N,N,N,N-tetramethylethylendiamin), amonium persulfat (APS), β-mercaptoetanol, SDS (sodium dodecyl sulfate), asam asetat glasial, gliserol,bromphenol blue, tris (hydroxymethyl)-aminomethan, dan glisin
Bahan kimia yang digunakan untuk pengujian peptida kolagen sebagai antioksidan adalah DPPH (2,2-diphenyl-1-picrylhydrazyl), etanol, potasium ferrisianida, asam trikoloroasetat (TCA), dan FeCl3. Bahan kimia untuk untuk
pengujian peptida kolagen sebagai antihipertensi adalah hippuryl-L-histidyl-L-leusine (HHL), ACE (angiotensin I-converting enzyme), etil asetat dan asam borat. Bahan kimia untuk pengujian antiproliferasi sel kanker adalah DMEM (Dulbecco’s modified eagle medium), NaHCO3, FBS (fetal bovine serum),
penisilin, streptomisin, dan garam tetrazolium/3-(4,5-Dimethyl-2-thiazoly)-2,5-diphenyl-2H-tetrazolium bromida (MTT).
Peralatan yang digunakan antara lain sentrifugasi dingin model MRX-152, spektrofotometer Phramacia LKB-Novaspec II dan inkubator model Certomat WR, peralatan elektroforesis SDS-PAGE (Bio-Rad), peralatan kromatografi (kolom dan fraction collector) dan peralatan uji anti proliferasi sel kanker (Microplate readerbenchmark dari Bio-Rad)
Metode Penelitian
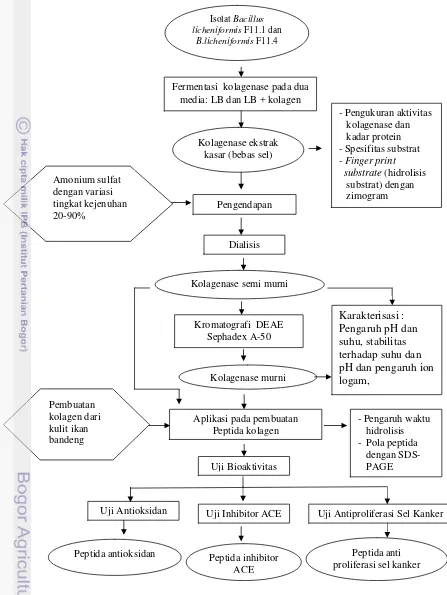
Alur penelitian yang akan dilakukan digambarkan secara seksama dalam diagram alir pada Gambar 7. Penelitian ini terdiri dari 3 bagian utama yaitu: 1. Pemilihan isolat berdasarkan hasil analisis aktivitas, spesifitas substrat dan
finger print substrate
2. Produksi kolagenase, pemurnian dan karakterisasi kolagenase hasil pengendapan amonium sulfat dan kolagenase murni.
Gambar 7. Diagram Alir Penelitian Fermentasi kolagenase pada dua
media: LB dan LB + kolagen
Pemilahan Isolat dan Produksi kolagenase
Produksi Kolagenase
Media pertumbuhan yang digunakan ada dua yaitu media pertama adalah Lauria Bertani broth(LB) dengan komposisi: 1% triptone; 0,5% ekstrak khamir dan 1% NaCl. Media kedua adalah media LB + kolagen dengan komposisi: 0,5% triptone; 0,25% ekstrak khamir; 1% NaCl dan kolagen 5%.
Proses produksi enzim diawali dengan penentuan umur prekultur (dalam media LB) yang tepat untuk keperluan produksi enzim. Pengamatan dilakukan dengan mengukur optical density (OD) sampai nilai OD = 0,8 pada λ = 620 nm.
Media LB yang sudah mempunyai OD = 0,8 diambil 10% kemudian ditambahkan pada media LB dan LB + kolagen yang baru sebagai media untuk memproduksi protease. Pengukuran nilai OD, aktivitas kolagenase dan kadar protein dilakukan setiap 5 jam selama 40 jam. Kondisi produksi adalah pH 7, suhu 370C, agitasi 120 rpm dan lama produksi 40 jam. Untuk memisahkan sel dilakukan sentrifugasi dengan kecepatan 700 x g selama 15 menit pada suhu 40C.
Pemilahan isolat penghasil kolagenase untuk memproduksi peptida kolagen dilakukan berdasarkan aktivitas enzim dan spesifitas substrat yang paling tinggi dan finger print substrate yang mampu menghidrolisis substrat dengan intensitas pita protein yang nyata.
Pengukuran Aktivitas Kolagenase
dalam tabung reaksi yang berisi Na2CO30,4 M kemudian ditambahkan pereaksi
folin Ciocalteau dengan pengenceran (1:2) dan diinkubasi pada suhu 370C selama 20 menit. Hasil inkubasi diukur dengan spektrofotometer pada λ=578 nm. Satu
unit aktivitas kolagenase didefinisikan sebagai jumlah enzim yang dapat
menghasilkan satu μ mol produk tirosin per menit pada kondisi pengukuran.
Tirosin digunakan sebagai standar pengukuran. Aktivitas spesifik adalah jumlah unit enzim per milligram protein. Aktivitas relatif merupakan hasil perbandingan antara aktivitas enzim pada sampel tertentu dengan aktivitas enzim tertinggi pada semua sampel pada suatu pengukuran analisis enzim tertentu.
Analisis Protein Enzim
Analisis konsentrasi protein enzim dilakukan dengan menggunakan metoda Bradford (1976). Analisis protein enzim digunakan untuk menentukan aktivitas spesifik enzim. Larutan Bradford dibuat dengan cara sebagai berikut: sebanyak 100 mg coomassie brilliant blue (CBB) G-250 dilarutkan dalam 50 ml ethanol 95%. Setelah itu 100 ml asam fosfat 85% ditambahkan. Terakhir larutan diencerkan hingga 1 liter. Larutan disaring dengan kertas saring. Larutan tersebut diencerkan 5 kali dengan aquades ketika akan digunakan. Larutan standar segar dibuat menggunakan protein BSA (bovine serum albumin)fractionV. Sebanyak 100 mg BSA ditimbang dan ditambahkan 25 ml aquades. Larutan kemudian dikocok pelan-pelan, setelah larut, diencerkan sampai 50 ml. Konsentrasi akhir larutan stok untuk standar ini adalah 2 mg/ml. Kemudian sederetan larutan standar dengan menggunakan larutan stok di atas dengan cara seperti pada Lampiran 2.
Setelah semua pereaksi siap, langkah selanjutnya adalah memipet masing-masing larutan dalam tiap tabung sebanyak 0,1 ml dan dimasukkan ke dalam tabung reaksi lain yang bersih. Sebanyak 5 ml pereaksi Bradford ditambahkan ke dalam masing-masing tabung reaksi. Blanko dibuat dengan cara mencampurkan 0,1 ml aquades dan direaksikan dengan 5 ml pereaksi Bradford. Setelah sekitar 5 menit, masing-masing campuran reaksi diukur absorbansinya pada λ= 595 nm.
Spesifitas danFinger Print Substrate
Spesifitas substrat dilakukan dengan mengukur aktivitas enzim pada substrat yang berbeda. Enzim direaksikan dengan beberapa jenis substrat yaitu kolagen dari kulit ikan bandeng, gelatin komersil (Sigma), kasein hammerstein (Sigma) dan fibrin komersil (Sigma).
Finger print substrate dilakukan dengan zimogram dengan modifikasi metode Choi et al. (2001). Dengan komposisi gel pemisah 8% dan gel penahan 4%. Gel akrilamid 8% dikopolimerisasi dengan substrat kolagen, kasein, gelatin dan fibrin sebanyak 0,5%. Pereaksi untuk zimogram dapat dilihat pada Lampiran 4, sedangkan komposisi gel pemisah dan gel penahan dapat dilihat pada Lampiran 5. Elektroforesis dilakukan pada tegangan 70 volt dan 50 A selama 2-3 jam. Setelah dilakukan elektroforesis, gel direndam dengan Triton X-100 2,5% selama 1 jam dan dilakukan inkubasi dalam buffer Tris-Cl 10 mM, pH 8 selama 24 jam. Deteksi zimogram dilakukan dengan cara gel dicelup dalam larutan pewarna (metanol 45% + asam asetat 10% + coomassie briliant blue R-250 sebanyak 0,06%) selama 30 menit sambil digoyang konstan. Destainingdengan merendam gel dalam larutan peluntur (metanol 40% + asam asetat 10%) sampai diperoleh pita-pita protein yang berwarna jernih berlatar belakang biru.
Pemurnian Enzim Kolagenase