UJI EFEKTIVITAS ANTIBAKTERI EKSTRAK DAUN KAMBOJA
(Plumiera rubra) PADA KONSENTRASI YANG BERBEDA
TERHADAP PERTUMBUHAN Aeromonas hydrophila
SECARA IN VITRO
SKRIPSI
WAN NITA ULFANI BARUS
090302052
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
2013
UJI EFEKTIVITAS ANTIBAKTERI EKSTRAK DAUN KAMBOJA
(Plumiera rubra) PADA KONSENTRASI YANG BERBEDA
TERHADAP PERTUMBUHAN Aeromonas hydrophila
SECARA IN VITRO
SKRIPSI
WAN NITA ULFANI BARUS
090302052
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
ABSTRACT
The objective of the research are to know the effectivity of Frangipani leaf extract (Plumeira rubra) on the growth of bacteria Aeromonas hydrophila and to determine the minimum dose of Frangipani leaf extract that inhibit the growth of bacteria. The research has been conducted at Laboratory of Fish Quarantine, Quality Control and Fisheries Product Safety Level I, Medan I. The research used completely randomized experiment method with 6 treatment levels and 3 replications. Based on the research, the Frangipani leaf extract doses has highly significant effect on the growth of bacteria A .hydrophila, and the minimum doses that inhibit the bacteria is 2 % with clear zone diameter 6.4 mm.
ABSTRAK
Penelitian ini bertujuan untuk mengetahui efektivitas ekstrak daun kamboja
(Plumiera rubra) terhadap pertumbuhan bakteri Aeromonas hydrophila, dan untuk
mengetahui dosis ekstrak minimal yang menghasilkan zona hambat pada bakteri. Penelitian ini dilaksanakan di laboratorium Balai Karantina Ikan, Pengendalian Mutu dan Hasil Keamanan Perikanan Kelas I, Medan I. Metode penelitian yang digunakan adalah metode percobaan Rancangan Acak Lengkap yang terdiri dari 6 perlakuan dengan 3 ulangan. Hasil analisis variansi menunjukkan bahwa dosis ekstrak daun kamboja berpengaruh sangat nyata terhadap pertumbuhan bakteri A. hydrophila, dan dosis minimal ekstrak daun kamboja yang menghasilkan zona hambat adalah perlakuan 2 % dengan diameter clear zone yang dihasilkan sebesar 6, 4 m
Kata kunci : efektivitas, ekstrak daun Kamboja, A. hydrophila.
\
KATA PENGANTAR
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT, karena atas
berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan Skripsi ini dengan
baik. Adapun skripsi ini berjudul Uji Efek Antibakteri Ekstrak Daun Kamboja
(Plumiera rubra) pada Konsentasi yang Berbeda Terhadap Pertumbuhan
Aeromonas hydrophila Secara In Vitro, merupakan salah satu syarat dalam
menyelesaikan studi di Program Studi Manajemen Sumberdaya Perairan, Fakultas
Pertanian Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Kedua orang tua dan keluarga saya yang menjadi inspirator dan penyemangat
dalam kehidupan penulis.
2. Bapak Prof. Dr. Ir. Hasan Sitorus, MS. selaku Ketua Komisi Pembimbing dan
Bapak Indra Lesmana, S.Pi, M.Si. selaku Anggota Komisi Pembimbing, atas
arahan dan bimbingannya dalam penyusunan Skripsi ini.
3. Bapak Oscar Daniel Butar-butar dan seluruh staf pegawai Balai Karantina Ikan
Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I.
Akhir kata Penulis menyampaikan terimakasih kepada semua pihak yang
telah membantu penulis dalam penulisan Skripsi ini. Semoga Skripsi ini
bermanfaat bagi siapa saja yang membacanya.
DAFTAR TABEL
No. Halaman
1. Zona Hambat Pertumbuhan Bakteri A.hydrophila untuk
setiap perlakuan (dalam mm) ... 23
2. Hasil Pengujian Biokimia Bakteri A. hydrophila Menurut
SNI ... 24
DAFTAR GAMBAR
No. Halaman
1. Bagan Alir Kerangka Pemikiran ... 15
2. Tumbuhan Kamboja (Plumiera rubra) ... 16
3. Zona hambat bakteri A.hydrophila ... 21
4. Aeromonas hydrophila ... 23
5. Diagram Batang Populasi Bakteri Sebelum dan Sesudah Perlakuan Ekstrak Daun Kamboja... 24
DAFTAR LAMPIRAN
No. Halaman
1. Uji Homogenitas Keragaman Data Clear Zone Bakteri
A.hydrophila ... 32
2. Hasil ANAVA Uji Clear Zone pada A.hydrophila ... 34
3. Uji Beda nyata rata-rata pengaruh perlakuan (Uji Lanjutan) ... 36
ABSTRACT
The objective of the research are to know the effectivity of Frangipani leaf extract (Plumeira rubra) on the growth of bacteria Aeromonas hydrophila and to determine the minimum dose of Frangipani leaf extract that inhibit the growth of bacteria. The research has been conducted at Laboratory of Fish Quarantine, Quality Control and Fisheries Product Safety Level I, Medan I. The research used completely randomized experiment method with 6 treatment levels and 3 replications. Based on the research, the Frangipani leaf extract doses has highly significant effect on the growth of bacteria A .hydrophila, and the minimum doses that inhibit the bacteria is 2 % with clear zone diameter 6.4 mm.
ABSTRAK
Penelitian ini bertujuan untuk mengetahui efektivitas ekstrak daun kamboja
(Plumiera rubra) terhadap pertumbuhan bakteri Aeromonas hydrophila, dan untuk
mengetahui dosis ekstrak minimal yang menghasilkan zona hambat pada bakteri. Penelitian ini dilaksanakan di laboratorium Balai Karantina Ikan, Pengendalian Mutu dan Hasil Keamanan Perikanan Kelas I, Medan I. Metode penelitian yang digunakan adalah metode percobaan Rancangan Acak Lengkap yang terdiri dari 6 perlakuan dengan 3 ulangan. Hasil analisis variansi menunjukkan bahwa dosis ekstrak daun kamboja berpengaruh sangat nyata terhadap pertumbuhan bakteri A. hydrophila, dan dosis minimal ekstrak daun kamboja yang menghasilkan zona hambat adalah perlakuan 2 % dengan diameter clear zone yang dihasilkan sebesar 6, 4 m
Kata kunci : efektivitas, ekstrak daun Kamboja, A. hydrophila.
\
PENDAHULUAN
Latar Belakang
Potensi perikanan budidaya di Indonesia cukup besar, baik budidaya air tawar,
air payau maupun budidaya laut. Sampai saat ini produksi perikanan nasional
sebagian besar berasal dari hasil perikanan tangkap, sedangkan produksi perikanan
budidaya masih relatif kecil (KKP, 2010). Dalam dasa warsa terakhir, hasil
tangkapan per satuan upaya (CPU) semakin menurun akibat di beberapa kawasan
perairan Indonesia sudah mengalami tangkap lebih (over fishing). Untuk mengatasi
hal tersebut, Kementerian Kelautan Perikanan sejak tahun 2010 telah
mengembangkan program budidaya perikanan dengan 10 komoditas unggulan ikan
budidaya. Program ini dengan berbagai bantuan dan kemudahan dalam penyediaan
sarana produksi dan pemasarannya, telah mendorong berkembangnya usaha budidaya
di masayarakat mulai dari teknologi tradisional plus hingga teknologi budidaya
intensif.
Dalam proses budidaya ikan oleh masyarakat, salah satu masalah yang dihadapi
adalah terjadinya serangan hama dan penyakit ikan. Menurut Kordi (2010),
berkembangnya penyakit ikan dalam proses budidaya ikan pada dasarnya disebabkan
terjadinya ketidak seimbangan interaksi faktor lingkungan, mikroba air dan ikan.
Ketidak seimbangan ini dapat disebabkan perubahan kualitas air menjadi buruk
sehingga mikroba pathogen berkembang dalam air dan menyerang ikan budidaya.
Penyakit bakterial pada ikan merupakan salah satu penyakit yang dapat
menimbulkan kerugian yang tidak sedikit. Selain dapat mematikan ikan, penyakit ini
patogen pada ikan dapat menyebabkan infeksi primer atau sekunder. Penyakit akibat
infeksi bacteria di Indonesia ternyata dapat mengakibatkan kematian sekitar 50-100%
(Tanjung dkk., 2008).
Serangan bakteri patogen merupakan satu diantara masalah yang dihadapi
dalam bidang perikanan budidaya. Beberapa kasus wabah penyakit akibat infeksi
bakteri telah menyebabkan pembudidaya mengalami kerugian besar. Bakteri yang
sering menginfeksi ikan pada budidaya air tawar adalah bakteri Aeromona hydrophila
(Abdullah, 2008). Infeksi bakteri ini dapat menyebabkan kematian masal pada ikan
budidaya sehingga para petani mengalami kerugian yang signifikan.
Gejala serangan dari bakteri A. hydrophila terhadap ikan budidaya antara lain
: berkurangnya nafsu makan, pembengkakan organ, dan pengelupasan sisik.
Intensitas serangan relatif bervariasi, tergantung pada faktor eskternal (kualitas air,
kepadatan, pakan) dan fa ktor internal ikan (stess, imunitas, genetik). Bakteri A.
hydrophila umumnya menyerang ikan-ikan di perairan tropis seperti ikan-ikan dari
famili Ictaluridae, Siluridae, Clariidae, Cyprinidae, Cichlidae, Salmonidae dan
Centrachidae yang sangat rentan terhadap penyakit ini (Utami, 2009).
Di Indonesia, wabah penyakit bercak merah pada ikan yang disebabkan oleh
bakteri A. hydrophila dilaporkan pertama kali terjadi di suatu areal budidaya ikan di
Cibening, Kecamatan Cibungbulang, Kabupaten Bogor bersamaan dengan datangnya
ikan mas yang baru diimpor dari Taiwan pada bulan September 1980. Banyak upaya
yang telah dilakukan para ahli untuk menanggulanginya, baik upaya-upaya
pencegahan maupun pengobatan mulai dari pemberian berbagai jenis antibiotik
dalam berbagai dosis, pemberian vitamin, maupun pemberian probiotik (Alifuddin,
A. hydrophila merupakan bakteri pathogen yang menyebabkan penyakit
dikenal dengan “Motile Aeromonas Septicemia”. Infeksi penyakit ini dipengaruhi
oleh sejumlah faktor yang saling berkaitan, diantaranya virulemsi bakteri. Kondisi
lingkungan perairan, tingkat resisiten genetik ikan dan tingkat stress ikan dalam
keadaan yang akut penyakit ini dapat menyebabkan kematian yang cepat pada ikan.
Gejala yang timbul satu diantaranya adalah penonjolan sisik dan pembengkakan pada
tubuh ikan (Abdullah, 2008).
Menurut Alifuddin (2002) pemakaian antibiotik untuk jangka panjang yang
tidak terkontrol dan tidak tepat dosis dapat menimbulkan dampak negatif yang
dikhawatirkan memunculkan strain-strain bakteri resisten yang dapat berbahaya bagi
ikan. Selain itu pula harga antibiotik, vitamin, dan probiotik yang cukup mahal dapat
menyebabkan biaya produksi tinggi, sehingga kurang efisien bagi petani-petani lele
skala kecil (tradisional). Alternatif untuk pencegahan dan pengobatan penyakit MAS
yang efektif, murah, aman bagi manusia dan ramah lingkungan sangat perlu dikaji
kembali.
Penggunaan tanaman obat atau fitofarmaka merupakan solusi yang dapat
dilakukan untuk mengatasi permasalahan tersebut. Fitofarmaka atau tanaman obat
adalah obat alamiah yang bahan bakunya disarikan dari tanaman untuk digunakan
dalam pengobatan. Pemanfaatan bahan-bahan alami yang ada di sekitar kita dapat
dijadikan satu diantara alternatif pengobatan untuk mengatasi penyakit MAS.
Tumbuhan obat dapat diartikan sebagai tumbuhan yang mempunyai kemampuan
menyembuhkan penyakit. Di Indonesia dapat dijumpai ± 7500 jenis tanaman yang
berkhasiat obat. Pemakaian tanaman berkhasiat obat sebagai salah satu upaya dalam
modern, tumbuhan obat dapat diartikan sebagai tumbuhan yang mempunyai
kemampuan menyembuhkan penyakit (Mustikasari, 2010).
Beragam jenis tanaman obat telah banyak digunakan untuk pengobatan, tetapi
saat ini ada beberapa tanaman obat yang masih sedikit dukungan data ilmiah
mengenai khasiatnya, tanaman obat masih menjadi obyek penelitian yang sangat
penting dalam pengembangan ilmu farmasi. Secara tradisional berdasarkan
penggunaan tanaman obat tersebut dapat menyembuhkan beberapa penyakit akibat
infeksi oleh jamur maupun bakteri. Hal ini mengindikasikan bahwa dalam tanaman
obat tradisional terkandung suatu senyawa yang mempunyai bioaktivitas sebagai
antibakteri atau antijamur.Tanaman yang digunakan sebagai obat tradisional
diantaranya daun kamboja (Plumeria sp.) yang telah diteliti mengandung senyawa
kimia antara lain flavonoid, alkaloid, terpenoid, steroid dan saponin (Rosidah dan
Afizia, 2012).
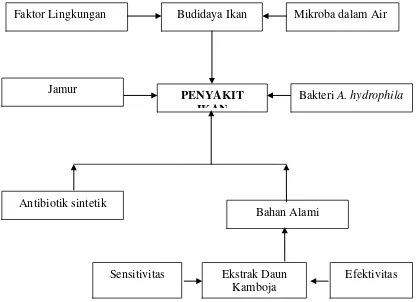
Kerangka Pemikiran
Penggunaan antibiotik sintetik dalam pengendalian penyakit ikan budidaya
menimbulkan dampak negatif terhadap lingkungan dan kemungkinan resistensi
bakteri pathogen bila digunakan dalam jangka panjang. Untuk itu perlu dikaji
penggunaan anti bakteri dari bahan alami sebagai alternatif pengganti antibiotik
sintetik, dan salah satu diantaranya adalah ekstrak daun kamboja.
Daun kamboja mengandung golongan senyawa metabolit sekunder antara lain
flavonoid, alkaloid, terpenoid, steroid dan saponin yang diketahui bersifat antibakteri.
A. hydrophila merupakan bakteri penyebab penyakit MAS sehingga penggunaan
tanaman obat atau fitofarmaka merupakan solusi yang dapat dilakukan untuk
Gambar 1. Bagan Alir Kerangka Pemikiran
Perumusan Masalah
Rumusan masalah dalam penelitian ini adalah sebagai berikut :
1. Bagaimanakah pengaruh ekstrak daun kamboja terhadap pertumbuhan bakteri
Aeromonas hydrophyla secara in vitro?
2. Berapakah dosis minimal ekstrak daun kamboja yang masih menghambat
pertumbuhan bakteri Aeromonas hydrophyla ?
Budidaya Ikan Mikroba dalam Air
Faktor Lingkungan
PENYAKIT IKAN
Bakteri A. hydrophila
Jamur
Bahan Alami Antibiotik sintetik
Efektivitas Ekstrak Daun
Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk mengetahui efektivitas
bakteristatik ekstrak daun kamboja (Plumiera rubra) terhadap pertumbuhan bakteri
Aeromonas hydrophila, dan dosis hambat minimal pertumbuhan bakteri secara in
vitro.
Manfaat Penelitian
Adapun manfaat yang diharapkan dari penelitian ini adalah sebagai
sumbangan infromasi bagi masyarakat pembudidaya ikan tentang bahan alami
alternatif pengganti antibiotik sintetik dalam pengendalian penyakit pada budidaya
ikan.
Hipotesis
Hipotesis dalam penelitian ini adalah ada pengaruh dosis ekstrak daun
Kamboja (Plumiera rubra) terhadap pertumbuhan bakteri Aeromonas hydrophila
TINJAUAN PUSTAKA
Biologi Tumbuhan Kamboja (Plumeria sp.)
Tumbuhan Kamboja atau dikenal dengan Frangipani (Plumeria sp.)
merupakan jenis tumbuhan berbunga yang berasal dari Amerika Tengah danAfrika.
Kamboja merupakan jenis tanaman tropis yang tumbuh subur di dataran rendah
sampai ketinggian tanah 700 m di atas permukaan laut. Ciri khas tanaman ini mudah
tumbuh dan berkembang biak serta tidak memerlukan perawatan khusus (Tanjung
dkk., 2008).
Tumbuhan Kamboja memiliki batang yang begetah dengan tinggi 1,5-6 m
memiliki batang yang berkayu, bulat, bercabang, bekas dudukan daun Nampak jelas,
putih kehijauan dengan jenis daun Tunggal, lanset, ujung runcing, pangkal
meruncing, tepi rata, tebal, panjang 10-25 cm, lebar 5-10 cm, pertulangan menjari,
permukaan atas hijau tua, permukaan bawah hijau muda. Bentuk bunga Majemuk,
malai rata, di ujung batang, kelopak bentuk corong, putih kemerah-merahan, mahkota
bunga empat, putih sedangkan buahnya Bumbung, bentuk lanset, panjang 18-20 cm,
lebar 1-2 cm, masih muda hijau setelah tua hitam dengan biji yang Bulat, bersayap,
putih kotor dan memiliki akar Tunggang, bercabang, coklat muda (Widodo, 2010).
Tumbuhan Kamboja dapat bertahan hidup sampai ratusan tahun karena
merupakan tanaman sekulen yaitu jenis tanaman yang dapat menyimpan air pada
seluruh bagian mulai dari akar, batang, daun, dan bunganya ini terutama di daerah
Bali, kamboja merupakan salah satu tanaman penghias halaman rumah, kantor, dan
Gambar 2. Tumbuhan Kamboja (Plumiera rubra)
Tumbuhan Kamboja memiliki klasifikasi sebagai berikut (Nikijuluw, 2002).
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Apocynales
Famili : Apocynaceae
Genus : Plumiera
Spesies : Plumiera rubra.
Ekstrak Tumbuhan Kamboja Sebagai Bahan Bakteriostatik
Kandungan kimia yang terdapat pada akar, kulit batang dan daun kamboja
seperti saponin, flavonoida, polifenol, dan alkaloida memungkinkan tumbuhan
tersebut berpotensi sebagai bahan bakteriostatik alami. Di beberapa daerah, getah
dan infeksi kulit dengan hasil cukup efektif (Nikijuluw, 2002). Hal ini memberikan
gambaran bahwa kamboja dapat menghambat pertumbuhan bakteri penyebab infeksi.
Selain itu, senyawa Flavonoid pada tumbuhan kamboja juga diindikasikan dapat
menghambat perkembangan kanker, karena Flavonoid dapat menghambat aktivitas
protein kinase sehingga menghambat jalur transduksi sinyal dari membran ke inti sel
kanker (Rolliana, 2010).
Alkaloid adalah senyawa turunan amino dan dibagi berdasarkan kerangka
asam amino yang menyusunnya. Sifat basa dari alkaloid yang cukup moderat
menyebabkan alkaloid mampu menembus barier biologis sehingga sangat mungkin
mencapai reseptor secara maksimal. Berdasarkan sifat ini, senyawa-senyawa alkaloid
dapat dijadikan sebagai antibakterial (Saifudin, 2006).
Aktivitas suatu zat antibakteria dapat dilihat dari efektivitas zat tersebut dalam
menghambat pertumbuhan (bakteristatik) atau membunuh bakteri (bakterisidal).
Kadar minimal yang diperlukan untuk menghambat pertumbuhan atau membunuhnya
dikenal sebagai kadar hambat minimal dan kadar bunuh minimal. Antibakteri tertentu
aktivitasnya dapat meningkatkan dari bakteriostatik menjadi bakteriosidal bila kadar
antibakterinya ditingkatkan (Setiabudy dan Vincent, 2002).
Karakteristik Aeromonas hydrophilla
Bakteri Aeromnas hydrophila pertama kali ditemukan pada tahun 1962 oleh
Hosina T, ketika mengamati penyebab dari penyakit yang menyerang ikan dan belut
yang dinamakan red fin. Bakteri A. hydrophila sering dihubungkan dengan beberapa
penyakit pada ikan anatara lain lesi pada ekor, kerusakan pada insang dan
haemoragic septicemia yanitu menyerang pada pembuluh darah ikan. Kemampuan A.
berbeda seperti protease, membran luar, lipopolisakarida, S-layer, kapsul dan flagella
(Abdullah, 2008).
Bakteri A. hydrophila umumnya hidup di air tawar yang mengandung bahan
organik tinggi, dapat ditemukan pada berbagai sumber air, diantaranya air danau, air
sungai, air pembuangan dan air disekitar laut. Penularan bakteri A. hydrophila dapat
berlangsung melalui air, kontak badan, kontak peralatan yang telah tercemar atau
karena pemindahan ikan yang terserang A. hydrophila dari satu tempat ke tempat lain
(Volk dan Wheller, 1988)
A. hydrophila merupakan bakteri Gram Negatif, berbentuk batang pendek,
anaerobik fakultatif, motil dan tersebar di lingkungan perairan, dapat menginfeksi
ikan dan amphibia. Bakteri ini dapat hidup pada suhu 4 – 37 oC dan tumbuh optimum
pada suhu 28 OC, tidak ada tahap spora dan tidak berkapsul. Bakteri ini mampu
memfermentasi glukosa, berdiameter 0,3-1,0 µm dan panjang 1,0-3,5 µm (Kabata,
1985).
A. hydrophila merupakan mikroorganisme pathogen oportunistik yaitu bakteri
yang dapat menyerang atau ditemukan pada situasi lingkungan yang mendukung.
Beberapa peneliti menyimpulkan bahwa bakteri ini adalah pathogen utama ikan air
tawar. Penyakit yang disebabkan oleh bakteri A. hydrophila sering berkembang pada
perairan yang memiliki kandungan bahan organik yang tinggi dan kondisi
lingkungan perairan yang tidak stabil seperti kadar ammonia, fluktuasi suhu, Ph, dan
parameter kualitas air lainnya. Keadaan ini biasa terjadi saat pergantian musim
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret - April 2013. Kegiatan
ekstraksi daun kamboja dilakukan di Laboratorium Kimia Bahan Alam, Fakultas
Matematika Ilmu Pengetahuan Alam Universitas Sumatera Utara, sedangkan proses
uji biokimia bakteri serta uji antibakteri ekstrak daun kamboja terhadap bakteri
Aeromonas hydrophila dilakukan di Balai Karantina Ikan Pengendalian Mutu dan
Keamanan Hasil Perikanan Kelas I Medan.
Bahan dan Alat
Bahan yang digunakan adalah daun kamboja, Isolat Murni Bakteri yang di
dapat dari Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan
Kelas I Medan I, Media Umum (TSA), akuades, alkohol 70%, Larutan crystal violet,
larutan Iodine lugol, larutan safranin, reagen oksidase, O/F basal medium, kertas
label, RS medium, larutan KOH 3%, cakram disk, kertas cokelat/kertas ubi, kertas
label, plastik, alumunium foil.
Alat yang digunakan adalah : cawan petri, laminarflow, rak tabung reasksi,
pipet tetes, gelas ukur, tabung reaksi. Bunsen, incubator, jarum ose, preparat,
sentripuse, micropore, erlenmeyer, blender, kertas saring, pipet tetes, refrigerator.
Rancangan Penelitian
Penelitian ini dilakukan dengan menguji cobakan secara langsung dosis
ekstrak daun kamboja terhadap pertumbuhan bakteri A. hydrophila. Untuk
mengetahui pengaruh daya hambat ekstrak daun kamboja terhadap pertumbuhan
perlakuan yakni : perlakuan A : .dosis ekstrak daun kamboja 0% (kontrol),
perlakuan B : dosis ekstrak daun kamboja 2,0%, perlakuan C : dosis ekstrak daun
kamboja 4,0%, perlakuan D : dosis ekstrak daun kamboja 6,0%, perlakuan E : dosis
ekstrak daun kamboja 8,0% dan perlakuan F : dosis ekstrak daun kamboja 10,0%
dengan masing-masing perlakuan 3 kali ulangan.
Parameter yang Diukur
Parameter yang diukur dalam penelitian ini adalah : 1) Zona Hambat (clear
zone) yaitu daerah bening yang terbentuk di sekitar cakram setelah diinkubasi selama
18 - 24 jam pada suhu 37oC, dan 2) populasi bakteri sebelum dan sesudah perlakuan.
Pengukuran clear zone dilakukan dengan sistem cakram, dan penghitungan populasi
bakteri dilakukan dengan sistem pengenceran bertingkat.
Prosedur Percobaan
Sterilisasi Alat
Sebelum melakukan pengujian, alat dan bahan disterilisasi yang bertujuan
untuk membersihkan atau membebaskan alat dan bahan dari mikroorganisme
lainnya. Alat-alat yang akan disterilisasi dicuci terlebih dahulu dengan
menggunakan detergen setelah itu dikeringkan. Sebelum dimasukkan kedalam
autoklaf, cawan petri dibungkus dengan kertas sampul dan tabung reaksi ditutup
dengan kapas, kemudian dibungkus dengan kertas dan diikat. Alat dimasukkan
kedalam ranjang autoklaf, kemudian autoklaf dihidupkan dengan suhu 121 °C
selama 20 menit setelah selesai autoklaf dibuka dan semua alat dipindahkan pada
Pembuatan Ekstraksi Tanaman Daun Kamboja
Daun Kamboja segar dicuci dan dibersihkan kotoran lain dengan
menggunakan air bersih, kemudian daun kamboja diblender sehingga diperoleh air
perasannya. Daun Kamboja kemudian disaring dengan menggunakan centrifuse dan
ditampung dalam erlenmeyer.
Pembuatan Media
Media ditimbang 8 gr kemudian dilarutkan dengan 200 ml aquades dalam
Erlenmeyer kemudian dimasukkan kedalam autoclave digital, kemudian Erlenmeyer
ditutup dengan alumunium foil dan disterilisasi menggunakan autoklaf dengan suhu
1210C selama 15 menit. setelah selesai media didinginkan di waterbath, Setelah
selesai media TSA dituang kedalam petridist didalam Laminary Flow agar tidak
terjadi kontaminasi.
Uji Biokimia Bakteri
Menurut Badan Standarisasi Nasional Indonesia (2009), Uji ini dilakukan
untuk mengetahui sifat atau karakteristik bakteri dengan media. Adapun
pelaksanaannya sebagai berikut :
a. Pewarnaan Gram
Pewarnaan Gram merupakan metode double-staining yang merupakan bentuk
dasar untuk pengujian dan identifikasi bakteri. Pewarnaan Gram akan membedakan
bakteri menjai 2 kelompok yaitu bakteri gram (+) dan Gram (-). Teknik pewarnaan
Gram tersebut dapat menghasilkan warna merah dan ungu. Bakteri Gram negatif
ditandai dengan pewarnaan ungu sedangkan yang positif berwarna merah. Hal ini
bertujuan untuk memberikan warna pada bakteri pada akhirnya dapat diidentifikasi
organisme yang dibentuk dalam kondisi yang stres karena kurang nutrisi, yang
memiliki kemungkinan untuk tetap berlanjut di lingkungan sampai kondisi menjadi
baik.Pewarnaan Gram bertujuan untuk menentukan apakah bakteri tersebut termasuk
di dalam kelompok bakteri Gram positif atau kelompok bakteri gram negatif. Cara
kerja dari pewarnaan Gram yaitu suspensikan bakteri dengan ose, kemudian letakkan
pada obyek dan difiksasi, tetesi dengan larutan Gram A yang mengandung kristal
violet, kemudian tetesi dengan larutan Gram B yang mengandung lugol, tetesi dengan
larutan Gram C yang mengandung alkohol, dan yang terakhir tetesi dengan larutan
Gram D yang mengandung safranin.
b. Uji Motilitas
Uji motilitas digunakan untuk membedakan bakteri motil dengan bakteri
non-moti. Motilitas bakteri dapat diamati dari pertumbuhan bakteri pada media. Media
agar yang digunakan utnuk menguji motilitas bakteri adalah media MIO merupakan
media semi solid berwarna ungu dalam tabung reaksi. Dilakukan dengan cara : satu
ose bakteri ditanam secara tegak lurus di tengah Medium SIM dengan cara
ditusukkan, diinkubasi pada suhu 37oC selama 24 jam. Bila timbul kekeruhan seperti
kabut menandakan bakteri bergerak.
c. Uji oksidase
Tujuan uji oksidase adalah untuk mengetahui ada tidaknya enzim oksidase
pada bakteri dengan menggunakan paper oksidase yang dapat dilihat perubahan
warna yang terjadi pada paper oksidase. Fungsi uji ini adalah untuk menentukan
adanya oksidase sitokrom yang ditemukan pada mikroorganisme tertentu. Untuk
menguji oksidase, sebelumnya disediakan kertas filter yang telah ditetesi dengan
pengujian diambil sedikit isolat murni bakteri menggunakan ose steril lalu diletakkan
ke kertas filter tersebut. Selanjutnya diamati perubahan warna yang terjadi, apabila
menjadi ungu maka dikatakan positif menghasilkan enzim oksidase, sebaliknya
apabila tidak berubah warna maka negatif.
d. Uji O/F
Uji O/F medium (Oksidatif/Fermentatif) bertujuan untuk mengetahui
kemampuan bakteri dalam melakukan respirasi (oksidatif) maupun fermentasi
karbohidrat (glukosa). Media O/F merupakan meda semi solid berwarna hijau gelap
dalam tabung reaksi ukuran 16. Cara kerjanya adalah ambil isolat murni bakteri
dengan ose steril kemudian diinokulasikan pada media O/F dengan cara tusukan
kemudian disimpan pada inkubator. Media O/F terdiri dari 2 tabung yang berisikan
cairan parafin (media fermentatif) dan yang tidak berisikan cairan parafin (oksidatif).
Setelah 24 jam penyimpanan, kemudian di amati perubahan warna yang terjadi. Jika
kedua tabung media O/F tersebut berubah menjadi kuning, maka bakteri bersifat
oksidatif. Jika media tanpa parafin berubah menjadi warna kuning dan media
berparafin berubah menjadi biru maka bakteri bersifat oksidatif. Jika media
berparafin berubah menjadi kuning dan media tanpa paraffin tetap berwarna hijau,
maka bakteri bersifat fermentatif. Apabila keduanya tidak mengalami perubahan
maka bakteri dikatakan negatif.
e. Uji Rimmler-Shotts (RS)
Isolat bakteri diambil dengan jarum ose steril dan goreskan pada media RS,
Kemudian inkubasikan pada suhu 37oC selama 18 jam sampai dengan 24 jam
kemudian amati koloni yang tumbuh, apabila bewarna kuning tanpa warna hitam
Identifikasi Bakteri
Identifikasi bakteri dilakukan setelah mendapatkan hasil sifat atau
karakteristik bakteri dari pengujian biokimia pada media uji. Identifikasi dilakukan
untuk menentukan jenis bakteri yang terdapat pada ikan/udang yang diperiksa. Untuk
identifikasi ini dilakukan dengan cara mencocokkan sifat atau karakteristik bakteri
yang telah didapat dengan buku identifikasi bakteri (SNI), sehingga dari pencocokan
tersebut diketahui jenis bakteri.
Tabel 1.Karakteristik Uji Biokimia Bakteri A. hydrophila Menurut SNI.
No. Jenis Uji Hasil Reaksi
1. Pewarnaan Gram Gram negatif, bentuk batang
pendek
2. Uji motilitas Motil
3. Uji oksidase Positif Oksidatif
4. UjI O/F Positif O/F
5. Uji RS Positif RS
Sumber : Badan Standarisasi Nasional Indonesia ( 2009 )
Pembuatan Agar Miring
Kedalam tabung reaksi steril dimasukkan 3 ml media TSA steril, didiamkan
pada temperatur kamar sampai sediaan memadat pada posisi miring kira-kira 45 oC
Peremajaan Biakan Murni
Satu koloni bakteri diambil dengan menggunakan jarum ose steril, lalu
ditanam pada media TSA miring dengan cara menggoreskan jarum ose yang
mengandung bakteri A. hydrophila kemudian diinkubasi selama 18 - 24 jam pada
suhu 36-37oC dalam inkubator (Ditjen POM diacu oleh Mierza, 2011).
Pembuatan Larutan Suspensi
Pembuatan suspensi dilakukan dengan cara mengambil 1 sampai 2 koloni A.
hydrophila yang dimasukkan ke dalam larutan NaCl 0,9%. Kemudian, kekeruhan
suspensi tersebut dibandi ngkan dengan larutan standar 0,5 McFarland secara
berdampingan dengan latar belakang garis-garis bewarna hitam menggunakan mata
tanpa bantuan alat. Bila kekeruhan suspensi tersebut tidak cocok dengan turbiditas
larutan standar maka dapat ditambahkan koloni A. hydrophila pada suspensi atau
mengencerkan suspensi tersebut dengan menambahkan NaCl 0,9%.
Penanaman Bakteri
Penanaman Bakteri menggunakan metode cawan sebar (spread plate) . Pada
metode cawan sebar, 1 ml suspensi bakteri yang telah diencerkan disebar pada media
TSA yang telah disiapkan. Selanjutnya, suspensi dalam cawan petri disebarkan
dengan spreader atau hockey stick pada suhu (37oC) selama 1-2 hari.
Uji Bakteriostatik
Media padat yang telah dipanaskan hingga mencair, didinginkan sampai suhu
± 40OC, dan dituang dalam cawan petri steril. Kemudian ditambahkan 0,1 mL larutan
biakan aktif bakteri dan dihomogenkan kemudian dibiarkan hingga memadat. Kertas
cakram (diameter 5 mm) diresapkan dalam ekstrak . Kertas cakram tersebut
ditekan sedikit. Media bakteri yang sudah dipasangi bahan antibakteri diinkubasi
pada suhu 37 OC selama 18-24 jam. Pembacaan awal dapat dilakukan setelah 6-8
jam. Diameter zona hambatan yang terbentuk diukur menggunakan jangka sorong.
Pengujian bioaktifitas ekstrak terhadap pertumbuhan bakteri dilakukandengan
metode difusi agar Sebagai media tumbuh digunakan TSA. Parameter yang diukur
adalah luas daerah hambat yaitu daerah bening yang terbentuk di sekitar cakram
setelah diinkubasi selama 18 - 24 jam pada temperature 37oC.
Perhitungan jumlah sel Bakteri
Sediakan tabung reaksi yang berisi konsentrasi ekstrak daun kamboja
sebanyak 6 tabung masing- masing 1 ml kemudian tambahkan larutan yang berisi
suspensi bakteri sebanyak 1 ml pada masing- masing tabung di inkubasi 24 jam,
kemudian lakukan pengenceran bertingkat dari 10-1, dst. Kemudian pipet 0,1 ml dari
masing-masing pengenceran dan letakkan pada cawan petri yang berisi media PCA
15 ml dengan teknik cawan tuang, lakukan dengan memutar dari kiri ke kanan,
lakukan secara duplo diinkubasi 24 jam. Cara menentukan jumlah mikroorganisme
per ml suspensi dilakukan dengan jumlah koloni terhitung dengan volume suspensi
yang diinokulasi dan dikali dengan pengenceran yang digunakan.
Analisis Data
Validasi Data
Untuk mengetahui apakah data-data hasil percobaan homogen atau tidak dan
memenuhi asumsi yang telah ditetapkan maka dilakukan analisis homogenitas ragam
galat dengan uji Barlett.
Uji ragam ini menggunakan sebaran Khi Kuadrat ( X2) steel dan Torrie
(2003), jika X2 Murni < X2 Tabel, maka data hasil pengamatan valid dan memenuhi
asumsi, dan dapat dilanjutkan dengan analisis variansi. Bila uji signifikansi
memperlihatkan pengaruh nyata atau sangat nyata maka dilanjutkan dengan Uji LSD
untuk mengetahui dosis ekstrak daun kamboja yang mengasilkan daya hambat
tertinggi terhadap pertumbuhan bakteri A. hydrophila.
Analisi Variansi
Analisi yang digunakan terhadap data yang dikumpulkan adalah analisis
variansi, data yang dianalisis adalah data penghambatan pertumbuhan bakteri A.
hydrophila . Analisis variansi terhadap data penelitian didasarkan pada model linear
HASIL DAN PEMBAHASAN
Hasil
Pengaruh Ekstrak Daun Kamboja Terhadap Bakteri A. hydrophila
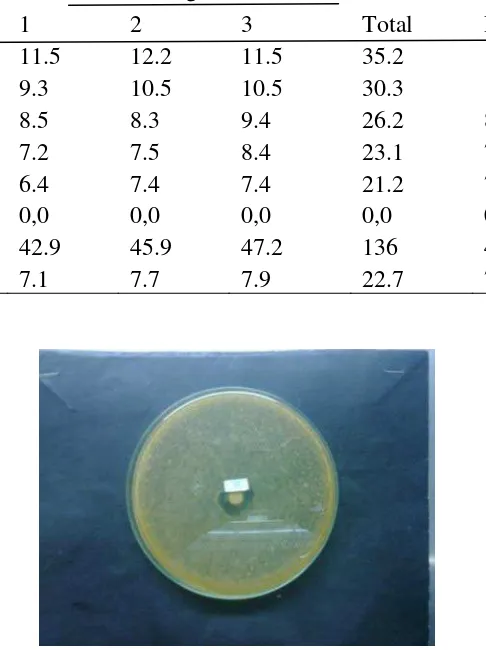
Berdasarkan pengamatan yang telah dilakukan selama penelitian, terdapat
daerah hambatan, yaitu daerah yang benar-benar tidak ditumbuhi bakteri dan zona
yang masih ditumbuhi oleh bakteri yang terlihat buram dan masih terdapat
bintik-bintik). Ukuran kedua zona tersebut ditunjukkan pada Tabel 2.
Tabel 2. Zona Hambat Pertumbuhan Bakteri A.hydrophila untuk Setiap Perlakuan
(dalam mm)
Pengujian Bakteri Uji
Berdasarkan hasil pengujian yang telah dilakukan terhadap bakteri yang
digunakan dalam percobaan berdasarkan standar SNI, maka dapat dinyatakan bahwa
bakteri yang diisolasi dari ikan tersebut adalah bakteri Aeromonas hydrophila
dengan hasil pengujian diperlihatkan pada Tabel 3.
Tabel 3. Hasil Pengujian Bakteri Uji Dalam Percobaan
No. Jenis Uji Hasil Reaksi
1. Pewarnaan Gram Gram negatif, bentuk batang
pendek
2. Uji motilitas Motil
3. Uji oksidase Positif Oksidatif
4. UjI O/F Positif O/F
5. Uji RS Positif RS
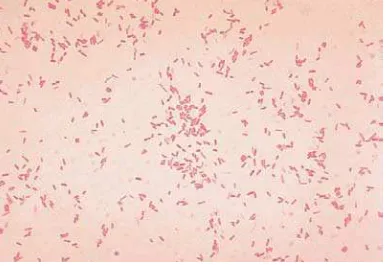
Berdasarkan hasil pengujian bakteri uji dengan pewarnaan gram yang
kemudian di amati di mikroskop, maka di dapat hasil bahwa bakteri A hydrophila
memiliki ciri-ciri gram negatif, berbentuk batang pendek gambar bakteri A.
hdrophila seperti pada Gambar 4.
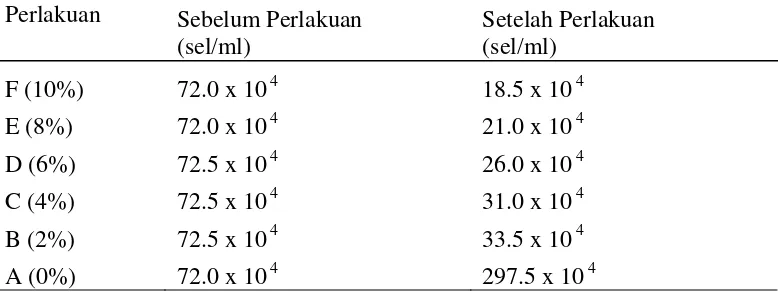
Perhitungan Populasi Bakteri
Berdasarkan pengamatan yang telah dilakukan selama penelitian, didapatkan
hasil perhitungan jumlah bakteri A.hydrophila dengan teknik pengenceran sebelum
dan sesudah perlakuan ekstrak daun kamboja yang diperlihatkan pada Tabel 4.
Tabel 4. Populasi Bakteri A. hydrophila Sebelum dan Setelah Perlakuan
Pembahasan
Dari Tabel 2 dapat dilihat bahwa rata-rata zona hambat pertumbuhan bakteri
dengan pemberian dosis ekstrak daun kamboja mengalami penurunan seiring dengan
menurunnya dosis ekstrak. Berdasarkan analisis variansi terhadap data pengamatan,
perlakuan dosis ekstrak daun kamboja berpengaruh sangat nyata terhadap
pertumbuhan (zona hambat) bakteri A.hydrophila. Artinya, pemberian ekstrak daun
kamboja bersifat menghambat pertumbuhan bakteri A.hydrophila.
Berdasarkan Uji LSD pada taraf nyata 0,01 diperoleh bahwa seluruh
perlakuan berbeda sangat nyata dibandingkan dengan kontrol. Hal ini mengandung
arti, perlakuan dosis ekstrak daun kamboja menyebakan hambatan pertumbuhan
bakteri A.hydrophila yang sangat signifikan dibandingkan tanpa pemberian esktrak
Pemberian ekstrak daun kamboja bersifat menghambat pertumbuhan bakteri
A.hydrophila, seperti pada Gambar 3 diatas dapat dilihat adanya zona hambat dari
ekstrak daun kamboja terhadap bakteri A.hydrophila, hal ini selaras dengan
pernyataan Rolliana (2010) yang mengatakan bahwa adanya senyawa flavonoid yang
terdapat dalam daun kamboja berfungsi sebagai penghambat pembelahan sel bakteri
melalui jalur transduksi dari membran ke inti sel bakteri. Selain flavonoid, beberapa
senyawa yang terkandung dalam daun kamboja yang bersifat bakteristatik adalah
alkaloid, terpenoid, dan glikosid. Menurut Saifudin (2006), senyawa alkaloid
merupakan salah satu senyawa yang bersifat antibakteri karena dapat merusak
dinding sel bakteri, sehingga pembelahan sel terhambat.
Perbedaan dosis esktrak daun kamboja menyebabkan perbedaan kandungan
senyawa antibakteri dalam media uji dan perbedaan tekanan osmosis antara cairan di
dalam dengan di luar sel bakteri yang menyebabkan perbedaan daya hambat terhadap
pertumbuhan bakteri. Daya hambat terbesar dijumpai pada perlakuan dosis ekstrak
10% dengan diameter zona hambatnya 12.2 mm, sedangkan dosis hambat minimal
adalah 2 % dengan zona hambat 6.4 mm. Hal ini mengandung arti, efektivitas bakteri
A. hydrophila dimulai pada dosis ekstrak daun kamboja 2 %. Berdasarkan hasil
percobaan ini dapat dinyatakan, ekstrak daun kamboja memiliki potensi yang besar
untuk digunakan sebagai alternatif pengendalian infeksi bakteri A. hydrophila.
Namun demikian masih perlu dilakukan Uji Efektivitas untuk mengetahui pengaruh
ekstrak daun kamboja terhadap bakteri A.hydrophila di lapangan.
Pada Gambar 4 dapat kita lihat bahwa bakteri A hydrophila memiliki ciri-ciri
Gram negatif, berbentuk batang pendek, ini sesuai dengan pernyataan Kabata (1985)
anaerobik fakultatif, tidak ada tahap spora dan tidak berkapsul. Bakteri ini mampu
memfermentasi glukosa, berdiameter 0,3-1,0 µm dan panjang 1,0-3,5 µm.
Berdasarkan pada Tabel 4 tersebut diketahui semakin tinggi ekstrak daun
kamboja maka akan semakin sedikit jumlah bakteri yang hidup. Hal ini dapat terlihat
pada jumlah bakteri A.hydrophila pada konsentrasi 10%, jumlah bakteri hidup paling
rendah, sementara pada perlakuan yang tidak diberikan ekstrak daun kamboja
(kontrol), pertumbuhan bakteri berlimpat ganda setelah dilakukan inkubasi.
Pada Gambar 5 diatas dapat kita lihat bahwa pertumbuhan bakteri sesudah
perlakuan dalam pemberian ekstrak daun kamboja semakin menurun, ini
dikarenakan adanya kandungan kimia yang ada di dalam daun kamboja tersebut, ini
sesuai dengan pernyataan Nikijuluw (2002) bahwa Kandungan kimia yang terdapat
pada akar, kulit batang dan daun kamboja seperti saponin, flavonoida, polifenol, dan
alkaloida memungkinkan tumbuhan tersebut berpotensi sebagai bahan bakteriostatik
alami dalam pertumbuhan bakteri.
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan maka dapat disimpulkan :
1. Perlakuan dosis ekstrak daun kamboja berpengaruh sangat nyata terhadap
pertumbuhan bakteri A. hydrophila .
2. Daya hambat terbesar dijumpai pada perlakuan dosis ekstrak 10% dengan
diameter zona hambatnya 12.2 mm, sedangkan dosis hambat minimal adalah 2 %
dengan zona hambat 6.4 mm.
3. Rata-rata zona hambat pertumbuhan bakteri dengan pemberian dosis ekstrak daun
kamboja mengalami penurunan seiring dengan menurunnya dosis ekstrak.
4. Dosis hambat minimum adalah 2 % dan populasi jumlah bakteri A.hydrophila
yang paling rendah adalah pada konsentrasi ekstrak daun kamboja 10%.
Saran
Berdasarkan penelitian yang telah dilakukan maka dapat disarankan untuk
melihat efektifitas ekstrak daun kamboja dalam pengendalian serangan bakteri A.
hydrophila pada kegiatan budidaya ikan air tawar, maka perlu dilakukan penelitian
DAFTAR PUSTAKA
Abdullah, Y. 2008. Efektivitas Ekstrak Daun Paci-paci (Leucas lavandulaefolia)
untuk Pencegahan dan Pengobatan Penyakit MAS Motile Aeromonad Septicemia Ditinjau dari Patologi Makro dan Hematologi Ikan Lele Dumbo Clarias sp. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Alifuddin, M. 2002. Imunostimulasi pada Hewan Akuatik. Jurnal Akuakultur
Indonesia.Vol 1 No 2 : 87-92
Kabata Z., 1985. Parasites and Diseases of Fish Cultured in Tropics. Taylor and Francisco Ltd. London.
Kismiyanti, Sri S.S.R. Wahid N. Y. dan Kusdarwati, R. 2009. Isolasi dan Identifikasi Bakteri Gram Negatif Pada Luka Ikan Mas Koki (Carassius auratus ) Akibat Infeksi Ektoparasit Argulus Sp. Jurnal Ilmiah Perikanan dan Kelautan. Vol 1 No 2.
KKP. 2010. Program Pengembangan Perikanan Budidaya Nasional. Direktorat
Jenderal Perikanan Budidaya. Jakarta.
Kordi, M. G.H. 2008. Budidaya Perairan. PT. Citra Aditya Bakti. Bandung
Mierza, V. 2011. Uji Antibakteri Ekstrak Etanol dan Fraksi Umbi Bawang Sabrang
(Eleutherine Palmifolia Merr.). Tesis. Fakultas Farmasi Universitas
Sumatera Utara. Medan.
Mustikasari, K. 2010. Skrining Fitokimia Ekstrak Metanol Biji Kalangkala (Litsea angulata) Sains dan Terapan Kimia. Vol 4 No 2 : 131-136.
Nikijuluw,V.P.H. 2002. Manfaat Kandungan Daun Kamboja. PT. Pustaka
Cidesindo. Jakarta.
Pleczar, M.J.J dan Chan. 1986. Dasar-Dasar Mikrobiologi. Penterjemah : Hadi
Oetomo dan Ratna Siri. Cetakan Pertama.Universitas Indonesia Press. Jakarta.
Rolliana, E.R. 2010. Uji Toksisitas Akut (Plumeria alba L.)Terhadap Larva Artemia salina Leach dengan Metode Brine Shrimp Lethality Test (BST). Skripsi. Fakultas Kedokteran UNDIP. Semarang.
Rosidah, dan Afizia, W.M. 2012. Potensi Ekstrak Daun Jambu biji Sebagai
Antibakterial Untuk Menanggulangi Serangan Bakteri Aeromonas hydrophila
pada Ikan Gurami (Osphronemus Gouramy lacepede). Jurnal Akuatika Vol
Saifudin, A. 2006. Alkaloid : Golongan Paling Prospek Menghasilkan Obat Baru. Departemen Farmakologis. Gorleus Laboratory. University Leiden. Jerman.
Setyabudy, R. Dan Vincent, H.S.G. 2002. Farmakologi dan Terapi . Pengantar Anti Mikroba. Bagia Y Farnakologi Fakultas Kedokteran. Universitas Indonesia. Jakarta.
Samsundari, S. 2006. Pengujian Ekstrak Temulawak dan Kunyit Terhadap Resistensi
Bakteri Aeromonas hydrophila yang Menyerang Ikan Mas (Cyprinus carpio).
Jurnal GAMMA. Vol II No 1 : 71-83.
Tanjung,N.K, Sudarno, dan Laksmi, S. 2008. Efektifitas Ekstrak Kulit Jeruk
Lemon(Citrus limonum) Terhadap Daya Hambat Pertumbuhan Aeromonas
hydrophila Secara In Vitro. Jurnal Berkala Ilmiah Perikanan Vol 3 No 1
April 2008.
Utami, W.P. 2009. Efektivitas Ekstrak Paci-Paci ( Leucas lavandulaefolia) yang diberikan Lewat Pakan untuk Pencegahan dan Pengobatan Penyakit Mas
Motile Aeromonas Septicemia pada Ikan Lele Dumbo Clarias sp. Skripsi.
Fakultas Perikanan Dan Ilmu Kelautan Institut Pertanian Bogor.
Volk W.A. dan Wheller M.F., 1988. Mikrobiologi Dasar. Penterjemah: Markham. Erlangga.Surabaya.
Widodo, G. P. D.Ningsih.M.Aprilia. 2010. Aktivitas Antibakteri dan Penyembuhan
Luka Fraksi-Fraksi Ekstrak Etanol Daun Kamboja (Plumeria acuminata Ait)
pada Kulit Kelinci yang Diinfeksi Staphylococcus aureus. Jurnal Farmasi
Lampiran 1. Uji Homogenitas Keragaman Data Clear Zone (Zona Hambat)
Data hasil pengamatan Clear Zone Bakteri A. hydrophila
Perlakuan
Perhitungan uji Barlet untuk uji homogenitas keragaman clear zone bakteri A.
SI2 =
Kesimpulan : data homogen dan dapat dilanjutkan ke analisis variansi.
Lampiran 2. Hasil ANAVA Data Clear Zone pada A.hydrophila
Sumber
Fhit 174, 02, Ftabel 0.01 = 5, 06 maka Fhit 174, 02 > Ftabel 0.01 (5, 06), berarti
perlakuan dosis ekstrak daun kamboja berpengaruh sangat nyata menghambat
pertumbuhan bakteri A. hydrophila.
Lampiran 3. Uji Beda Nyata Rata-rata Pengaruh Perlakuan (Uji Lanjutan).
LSD = Tα (db E) Sd
LSD 0,05 = T0,05
= 2.179 x 0.435 = 0.947
LSD 0,01 = T0,01
= 3.055 x 0.435
= 1.328
LSD 0,05 = 0.947
LSD 0,01 = 1.328
Perlakuan
Nilai Tengah
Perlakuan Selisih Nilai Tengah Perlakuan
F (10%) 11.7 F E D C B
E (8%) 10.1 1.6 **
D (6%) 8.7 3,0** 1.4**
C (4%) 7.7 4.0** 2.4** 1.0*
B (2%) 7.1 4.7** 3.0** 1.6** 0.6tn 7.1**
A (0%) 0,0 11.7** 10.1** 8.7** 7.7**
Keterangan :
Perlakuan : F – E, F – D, F – C, F – B, dan F – A berbeda sangat nyata
Perlakuan : E – D, E – C, E – B, dan E – A berbeda sangat nyata
Perlakuan : D – C berbeda nyata, D – B dan D – A berbeda sangat nyata
Perlakuan : C – B tidak berbeda nyata, tetapi C – A berbeda sangat nyata
Perlakuan : B – A berbeda sangat nyata.
Lampiran 4. Dokumentasi Kegiatan Penelitian
Proses ekstraksi Sentripuse ekstrak Media TSA 250 ml Dengan micropor
Pembuatan Media Agar Penanaman Cakram Perhitungan Diameter Miring
Perhitungan Jumlah Bakteri Penegenceran Bertingkat Zona Hambat Bakteri