Menentukan Waktu Retensi pada Senyawa Antagonis H
2dengan
variasi Fase Gerak secara Kromatografi Cair Kinerja Tinggi
( KCKT )
SKRIPSI
OLEH :
WULAN NINGRUM S NIM 071524083
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Menentukan Waktu Retensi pada Senyawa Antagonis H
2dengan
variasi Fase Gerak secara Kromatografi Cair Kinerja Tinggi
( KCKT )
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai Gelar Sarjana Farmasi pada Falkutas Farmasi
Universitas Sumatera Utara
OLEH:
WULAN NINGRUM S NIM 071524083
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN SKRIPSI
Menentukan Waktu Retensi pada Senyawa Antagonis H
2dengan
variasi Fase Gerak secara Kromatografi Cair Kinerja Tinggi
( KCKT )
OLEH:
WULAN NINGRUM S NIM 071524083
Dipertahan di hadapan Panitia Penguji Falkutas Farmasi
Universitas Sumatera Utara Pada tanggal : November 2010 Pembimbing I, Panitia Penguji,
(Drs. Ismail, M.Si. Apt.) (Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt.) NIP 195006141980031001 NIP 195306191983031001
Pembimbing II,
(Prof. Dr. Siti Morin Sinaga., M.Sc. Apt.) NIP 195008281976032002
(Prof.Dr.rer.nat.Effendy DeluxPutra,SU,Apt) NIP 195036191983031001
(Drs. Muchlisyam, M.Si., Apt.) NIP 195006221980021001
(Dra. Saleha Salbi, M.Si., Apt) NIP 194909061980032001
Medan, Oktober 2010 Falkutas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGHANTAR
Puji dan syukur kehadirat Allah SWT atas segala rahmat dan ridho – Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Terima kasih dan hormat yang tulus dan sebesar – besarnya kapada Ayahanda dan Ibunda serta kakak dan adikku tersayang yang telah mendukung, memberi dorongan semangat, dan doa yang tak henti – hentinya kepada penulis untuk menyelesaikan studi serta demi kesuksesan penulis.
Semoga Allah SWT selalu melindungi dan melimpahkan rahmatnya kepada kita semua. Penulis berharap semoga skripsi ini dapat menjadi sumbangan yang berarti bagi ilmu pengetahuan khususnya dibidang farmasi.
Medan, November 2010 Penulis
Menentukan Waktu Retensi pada Senyawa Antagonis H
2dengan
variasi Fase Gerak secara Kromatografi Cair Kinerja Tinggi
( KCKT )
ABSTRAK
Telah dilakukan studi penetapan harga koefisien partisi atau pengukuran waktu retensi senyawa – senyawa antihistamin H2 yaitu Simetidin, Ranitidin, Famotidin dengan variasi fase gerak A (Simetidin), fase gerak B (Ranitidin), dan fase gerak C (Famotidin) dengan metode Kromatografi Cair Kinerja Tinggi (KCKT).
Tujuan penelitian ini adalah untuk mengetahui apakah harga koefisien partisi atau pengukuran waktu retensi dapat ditentukan dengan menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT), membandingkannya dengan fase gerak A, B, dan C, membandingkan dengan peneliti sebelumnya (Vonna, 2006) dan program Chem Draw.
(Fase gerak A = 2,044), (Fase gerak B = 1,504), dan Fase gerak C = 1,871). Pratifar ( Fase gerak A = 2,114), (Fase gerak B = 1,503), dan (Fase gerak C = 1,870).
Peneliti sebelumnya (Vonna, 2006) telah melakukan penelitian tentang penentuan nilai log P sediaan bahan baku antihistamin - H2 yaitu : Simetidin (Log P = -0,307), Rantitidin (Log P = -1,328), Famotidin (Log P = -0,946) dengan penggojokan sistem oktanol-air yang dianalisis secara spektrofotometri ultraviolet.
Dari hasil penelitian yang diperoleh adalah Simetidin mempunyai nilai Log P (Koefisien Partisi) yang lebih besar sedangkan dengan Kromatografi Cair Kinerja Tinggi (KCKT) waktu retensi pada fase gerak A (Simetidin) lebih besar dimana harga koefisien partisi senyawa antihistamin H2 yang terbesar adalah Simetidin, yang berarti senyawa tersebut mempunyai kelarutan dalam lemak yang paling besar dibandingkan senyawa antihistamin lain yang diuji.
ABSTRAC
This is a study that to determine the partition coefficients or to measure retensi time of antihistamin H2 compounds, which are simetidin, ranitidine, famotidin with variation mobile fase A ( cimetidine ), B( ranitidine ), and C ( famotidine ) with High Performance Liquid Chromatographi ( HPLC ) methode
The aim of this study is to know wheather the value of partition coefficients or measure retensi time can be determine by method High Performance Liquid Chromatographi (HPLC), to compare with fase gerak a, b, dan c, to compare with the last scientist ( Azizah Vonna, 2006 ) and the program Chem Draw.
The result of research show that retensi time or value partition coefficient of antihistamine H2 the good with use mobile fase A than mobile fase B and C is cimetidin (mobile fase A = 2226), (mobile fase B = 1,647 ), dan (mobile fase C = 1,777). cimetidin generic (mobile fase A = 2,312), (mobile fase B = 1,642), dan (mobile fase C = 1,913). Omekur (mobile fase A = 2,204), (mobile fase B = 1,647), dan (mobile fase C = 1,869). Ranitidin (mobile fase A = 1,829), (mobile fase B = 1,642), dan (mobile fase C = 1,842), Ranitidin generic (mobile fase A = 1,925), (mobile fase B = 1,642), dan (mobile fase C = 1,870). Omeranin (mobile fase A = 1,834), (mobile fase B = 1,646), dan (mobile fase C = 1,870). Famotidin (mobile fase A = 2,150), (mobile fase B = 1,503), dan (mobile fase C = 1,766), Famotidin generic (mobile fase A = 2,044), (mobile fase B = 1,504), dan (mobile fase C = 1,871). Pratifar (mobile fase A = 2,114), (mobile fase B = 1,503), dan (mobile fase gerak C = 1,870).
The last scientist ( Azizah Vonna ) have done this research about to determine the partition coefficient of antihistamin H2 is cimetidin ( Log P = -0,307 ), rantitidin ( Log P = -1,328 ), famotidin ( Log P = -0,946 )with by using octanol-water system mixing methode.
The result of research show cimetidine have value of partition coefficient is more biggest whereas with High Performance Liquid Chromatographi (HPLC) retensi time of mobile fase A (cimetidine ) more biggest where value of partition coefficient antihistamine H2 compound the biggest is cimetidine
DAFTAR ISI
HALAMAN JUDUL
HALAMAN PENGESAHAN……… i
ABSTRAK……….. ii
ABSTRAC……… iv
DAFTAR ISI……… v
DAFTAR TABEL……… vi
DAFTAR GAMBAR……… viii
DAFTAR LAMPIRAN……… x
BAB I PENDAHULUAN……… 1
1.1 Latar Belakang………. 1
1.2 Perumusan Masalah……… 2
1.3 Hipotesis……… 3
1.4 Tujuan……… 3
BAB II METODE PENELITIAN……… 4
2.1 Waktu dan Tempat Pelaksanaan……… 4
2.2 Alat……… 4
2.3 Bahan………. 4
2.4 Pengambilan Sampel………. 4
2.5 Pola Penelitian……….. 5
2.5.1 Pengujian Bahan Baku secara Spektrofotometri Ultraviolet... 5
2.5.1.1 Simetidin……….. 5
2.5.1.2 Ranitidin……… 5
2.5.1.3 Famotidin……… 5
2.5.2 Penetapan Koefisien Partisi……… 6
2.5.2.1 Simetidin……… 6
2.5.2.2 Ranitidin……… 7
2.5.2.3 Famotidin………. 8
2.5.3 Analisa Data Secara Statistik………. 9
BAB III HASIL DAN PEMBAHASAN……… 11
3.1 Penetapan Uji Bahan Baku………. 11
3.2 Pengukuran Waktu Retensi……… 15
BAB IV KESIMPULAN DAN SARAN………. 39
4.1 Kesimpulan………. 39
4.2 Saran……… 40
DAFTAR PUSTAKA……… 41
DAFTAR TABEL
Tabel 1. Data waktu retensi dengan variasi fase gerak………… 15 Tabel 2. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi bahan baku dengan KCKT pada fase gerak A.. 20
Tabel 3. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak A…… 21
Tabel 4. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak A…… 22
Tabel 5. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak B… 23 Tabel 6. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi bahan generik dengan KCKT pada fase gerak B.. 24 Tabel 7. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi merek dagang dengan KCKT pada fase gerak B…25 Tabel 8. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi bahan baku dengan KCKT pada fase gerak C…. 26 Tabel 9. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi bahan generik dengan KCKT pada fase gerak C…27 Tabel 10. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi merek degang dengan KCKT pada fase gerak C.28 Tabel 11. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan
baku secara KCKT pada fase gerak A……… 29
Tabel 12. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak A……….. 29
Tabel 13. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak A……… 30
Tabel 14. Tabel Log P (Koefisien Partisi) secara teori ( Cham Draw ) dan waktu retensi bahan baku secara KCKT pada fase gerak B………. 31
Tabel 15. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak B………..…… 32
Tabel 16. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak B………. 33
Tabel 17. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak C…………..………. 34
Tabel 18. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak C……… 35
Tabel 19. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak C………..… 36
Tabel 20. R2 Penggojokan secara Spektrofotometri dan waktu retensi secara
KCKT..……… 38
DAFTAR GAMBAR
HALAMAN Gambar 1. Kurva serapan Simetidin dengan konsentrasi 6 µg per ml dan panjang gelombang maksimum secara spektrofotometri ultraviolet... 12 Gambar 2. Kurva serapan Rantidin HCI dengan konsentrasi 9 µg per ml dan
panjang gelombang maksimum secara spektrofotometri ultraviolet……….… 13
Gambar 3. Kurva serapan Famotidin dengan konsentrasi 10 µg per ml dan panjang gelombang maksimum secara spektrofotometri ultraviolet………. 14
Gambar 4. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan retensi time bahan baku dengan KCKT pada fase gerak A………. 20
Gambar 5. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak A…. 21
Gambar 6. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak A…….. 22
Gambar 7. Log P (koefisien partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak B……… 23
Gambar 8. Log P ( koefisien partisi ) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak
B………..………… 24
Gambar 9. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak
B………..……… 25
Gambar 10. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak
C………. 26
Gambar 11. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak
C………. 27
Gambar 12. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak
C……….……… 28
Gambar 13. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak A……… 29
Gambar 14. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generi secara KCKT pada fase gerak A……… 30 Gambar 15. Log P (Koefisien Partisi) secara teori dan waktu retensi merek
dagsecara KCKT pada fase gerak A………. 31
Gambar 16. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak B……… 32
Gambar 17. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak B……… 33
Gambar 18. Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak B……….. 34
Gambar 20. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak C……… 36 Gambar 21. Log P (Koefisien Partisi) secara teori dan waktu retensi merek
DAFTAR LAMPIRAN
HALAMAN Lampiran 1. Analisa data statistik waktu retensi ( Log P ) sediaan Simetidin bahan
baku pada fase gerak A……….. 42
Lampiran 2. Analisa data statistik waktu retensi ( Log P ) sediaan Simetidin bahan generik pada fase gerak A……… 44
Lampiran 3. Analisa data statistik waktu retensi ( Log P ) sediaan Omekur pada fase gerak A………. 46
Lampiran 4. Analisa data statistik waktu retensi ( Log P ) sediaan Ranitidin bahan aku pada fase gerak A………. 48
Lampiran 5. Analisa data statistik waktu retensi ( Log P ) sediaan Ranitidin bahan generik pada fase gerak A……….. 50
Lampiran 6. Analisa data statistik waktu retensi ( Log P ) sediaan Omeranin pada fase gerak A………. 52 Lampiran 7. Analisa data statistik waktu retensi ( Log P ) sediaan Famotidin
bahan baku pada fase gerak A……… 54 Lampiran 8. Analisa data statistik waktu retensi ( Log P ) sediaan Famotidin
bahan generik pada fase gerak A……… 56
Lampiran 9. Analisa data statistik waktu retensi ( Log P ) sediaan Pratifar pada fase gerak A……….… 58
Lampiran 10. Analisa data statistik waktu retensi ( Log P ) sediaan Simetidin bahan baku pada fase gerak B………. 60 Lampiran 11. Analisa data statistik waktu retensi ( Log P ) sediaan Simetidin
bahan generik pada fase gerak B………. 62
Lampiran 12. Analisa data statistik waktu retensi ( Log P ) sediaan Omekur pada fase gerak B……….……….. 64
Lampiran 13. Analisa data statistik waktu retensi ( Log P ) sediaan Ranitidin bahan baku pada fase gerak B……… 66 Lampiran 14. Analisa data statistik waktu retensi ( Log P ) sediaan Ranitidin
bahan generik pada fase gerak B……… 68 Lampiran 15. Analisa data statistik waktu retensi ( Log P ) sediaan Omeranin
pada fase gerak B……….. 70 Lampiran 16. Analisa data statistik waktu retensi ( Log P ) sediaan Famotidin
bahan baku pada fase gerak B………... 72 Lampiran 17. Analisa data statistik waktu retensi ( Log P ) sediaan Famotidin
bahan generik pada fase gerak B……… 74
Lampiran 18. Analisa data statistik waktu retensi ( Log P ) sediaan Pratifar pada fase gerak B……….……… 76
Lampiran 19. Analisa data statistik waktu retensi ( Log P ) sediaan Simetidin bahan baku pada fase gerak C……… 78 Lampiran 20. Analisa data statistik waktu retensi ( Log P ) sediaan Simetidin
bahan generik pada fase gerak C……… 80
Lampiran 21. Analisa data statistik waktu retensi ( Log P ) sediaan Omekur pada fase gerak C……….. 82
Lampiran 22. Analisa data statistik waktu retensi ( Log P ) sediaan Ranitidin bahan baku pada fase gerak C……….…… 84 Lampiran 23. Analisa data statistik waktu retensi ( Log P ) sediaan Ranitidin
Lampiran 24. Analisa data statistik waktu retensi ( Log P ) sediaan Omeranin pada fase gerak C……… 88 Lampiran 25. Analisa data statistik waktu retensi ( Log P ) sediaan Famotidin
bahan baku pada fase gerak C………. 90 Lampiran 26. Analisa data statistik waktu retensi ( Log P ) sediaan Famotidin
bahan generik pada fase gerak C……….…… 92
Lampiran 27. Analisa data statistik waktu retensi ( Log P ) sediaan Pratifar pada fase gerak C……….…… 94
Lampiran 28. Kromatogram hasil penyuntikan larutan Simetidin, Ranitidin, Famotidin dengan menggunakan fase gerak A ( Simetidin ) pada konsentrasi 10 mcg / ml, yang dianalisis secara KCKT pada λ 220 nm, kolom VP-ODS (4,6 mm x 25 cm), fase gerak metanol : campuran air-asam fosfat (1 : 4) laju alir 2,0 ml/menit... 96 Lampiran 29. Kromatogram hasil penyuntikan larutan Simetidin, Ranitidin,
Famotidin dengan menggunakan fase gerak B ( Ranitidin ) pada konsentrasi 112 mcg / ml, yang dianalisis secara KCKT pada
λ 322 nm,kolom VP-ODS (4,6 mm x 25 cm), fase gerak Metanol : Amonium asetat 0,1 M (70 : 30) laju alir 2,0 ml/menit... 105 Lampiran 30. Kromatogram hasil penyuntikan larutan Simetidin, Ranitidin,
Menentukan Waktu Retensi pada Senyawa Antagonis H
2dengan
variasi Fase Gerak secara Kromatografi Cair Kinerja Tinggi
( KCKT )
ABSTRAK
Telah dilakukan studi penetapan harga koefisien partisi atau pengukuran waktu retensi senyawa – senyawa antihistamin H2 yaitu Simetidin, Ranitidin, Famotidin dengan variasi fase gerak A (Simetidin), fase gerak B (Ranitidin), dan fase gerak C (Famotidin) dengan metode Kromatografi Cair Kinerja Tinggi (KCKT).
Tujuan penelitian ini adalah untuk mengetahui apakah harga koefisien partisi atau pengukuran waktu retensi dapat ditentukan dengan menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT), membandingkannya dengan fase gerak A, B, dan C, membandingkan dengan peneliti sebelumnya (Vonna, 2006) dan program Chem Draw.
(Fase gerak A = 2,044), (Fase gerak B = 1,504), dan Fase gerak C = 1,871). Pratifar ( Fase gerak A = 2,114), (Fase gerak B = 1,503), dan (Fase gerak C = 1,870).
Peneliti sebelumnya (Vonna, 2006) telah melakukan penelitian tentang penentuan nilai log P sediaan bahan baku antihistamin - H2 yaitu : Simetidin (Log P = -0,307), Rantitidin (Log P = -1,328), Famotidin (Log P = -0,946) dengan penggojokan sistem oktanol-air yang dianalisis secara spektrofotometri ultraviolet.
Dari hasil penelitian yang diperoleh adalah Simetidin mempunyai nilai Log P (Koefisien Partisi) yang lebih besar sedangkan dengan Kromatografi Cair Kinerja Tinggi (KCKT) waktu retensi pada fase gerak A (Simetidin) lebih besar dimana harga koefisien partisi senyawa antihistamin H2 yang terbesar adalah Simetidin, yang berarti senyawa tersebut mempunyai kelarutan dalam lemak yang paling besar dibandingkan senyawa antihistamin lain yang diuji.
ABSTRAC
This is a study that to determine the partition coefficients or to measure retensi time of antihistamin H2 compounds, which are simetidin, ranitidine, famotidin with variation mobile fase A ( cimetidine ), B( ranitidine ), and C ( famotidine ) with High Performance Liquid Chromatographi ( HPLC ) methode
The aim of this study is to know wheather the value of partition coefficients or measure retensi time can be determine by method High Performance Liquid Chromatographi (HPLC), to compare with fase gerak a, b, dan c, to compare with the last scientist ( Azizah Vonna, 2006 ) and the program Chem Draw.
The result of research show that retensi time or value partition coefficient of antihistamine H2 the good with use mobile fase A than mobile fase B and C is cimetidin (mobile fase A = 2226), (mobile fase B = 1,647 ), dan (mobile fase C = 1,777). cimetidin generic (mobile fase A = 2,312), (mobile fase B = 1,642), dan (mobile fase C = 1,913). Omekur (mobile fase A = 2,204), (mobile fase B = 1,647), dan (mobile fase C = 1,869). Ranitidin (mobile fase A = 1,829), (mobile fase B = 1,642), dan (mobile fase C = 1,842), Ranitidin generic (mobile fase A = 1,925), (mobile fase B = 1,642), dan (mobile fase C = 1,870). Omeranin (mobile fase A = 1,834), (mobile fase B = 1,646), dan (mobile fase C = 1,870). Famotidin (mobile fase A = 2,150), (mobile fase B = 1,503), dan (mobile fase C = 1,766), Famotidin generic (mobile fase A = 2,044), (mobile fase B = 1,504), dan (mobile fase C = 1,871). Pratifar (mobile fase A = 2,114), (mobile fase B = 1,503), dan (mobile fase gerak C = 1,870).
The last scientist ( Azizah Vonna ) have done this research about to determine the partition coefficient of antihistamin H2 is cimetidin ( Log P = -0,307 ), rantitidin ( Log P = -1,328 ), famotidin ( Log P = -0,946 )with by using octanol-water system mixing methode.
The result of research show cimetidine have value of partition coefficient is more biggest whereas with High Performance Liquid Chromatographi (HPLC) retensi time of mobile fase A (cimetidine ) more biggest where value of partition coefficient antihistamine H2 compound the biggest is cimetidine
BAB I
PENDAHULUAN
1.1 Latar Belakang
Secara umum histamin diperlukan dalam banyak proses fisiologis akan tetapi dapat juga menghasilkan efek yang tidak diinginkan seperti borok lambung. Oleh karena itu penemuan baru untuk tujuan pengembangan obat yang secara selektif memblok aksi histamin tertentu sangat mendorong keinginan peneliti dunia dalam sintesis dan studi tentang senyawa yang ada hubungannya dengan antihistamin (Sjamsudin dan Dewoto, 1995).
Waktu yang dibutuhkan oleh senyawa untuk bergerak melalui kolom menuju detektor disebut sebagai waktu retensi. Waktu retensi diukur berdasarkan waktu dimana sampel diinjeksikan sampai sampel menunjukkan ketinggian puncak yang maksimum dari senyawa itu. Senyawa-senyawa yang berbeda memiliki waktu retensi yang berbeda. Itu berarti bahwa kondisi harus dikontrol secara hati-hati, jika menggunakan waktu retensi sebagai sarana untuk mengidentifikasi senyawa-senyawa (De Lux Putra, 2007)
Koefisien partisi adalah salah satu faktor yang mempengaruhi distribusi obat dalam tubuh. Setelah obat sampai ke peredaran darah, obat harus menembus sejumlah sel untuk mencapai reseptor. Dimana koefisien partisi juga menentukan jaringan mana yang dapat dicapai oleh suatu senyawa. Senyawa yang sangat mudah larut dalam air (hidrofilik) tidak akan sanggup melewati membran lipid untuk mencapai organ yang kaya akan lipid, misalnya otak (Nogrady, 1992).
dengan cara pengamatan, yaitu dengan melakukan pengukuran di laboratorium. Berdasarkan penelitian sebelumnya (Vonna, 2006) telah diperoleh harga koefisien partisi dengan untuk senyawa antihistamin H2, yaitu Simetidin (Log P = -0,307), Rantitidin (Log P = -1,328), Famotidin (Log P = -0,946). Dari program Chem Draw, diperoleh nilai hitungan untuk Ranitidin sebesar 1,2 Simetidin sebesar 0,79, Famotidin sebesar -0,03.
Dari uraian diatas di ketahui bahwa pengetahuan tentang kelarutan senyawa dalam lemak sangatlah penting untuk menentukan aktivitas terapetiknya. Khususnya untuk senyawa Antihistamin yang digunakan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT). Kelarutan suatu senyawa dalam lemak atau sifat hidrofobik mempunyai beberapa parameter penting yang dapat diukur, salah satunya adalah koefisien partisi (Reksohadiprodjo, 1994).
Atas pertimbangan-pertimbangan tersebut diatas, penulis tertarik untuk melakukan penelitian : menentukan waktu retensi terhadap senyawa antagonis - H2 dengan variasi fase gerak menggunakan Kromatografi Cair Kinerja Tinggi (KCKT).
1.2 Perumusan Masalah
Perumusan masalah dari penelitian ini apakah pengukuran waktu retensi dari senyawa antagonis-H2 (Simetidin, Ranitidin, Famotidin) dapat ditentukan secara Kromatografi Cair Kinerja Tinggi (KCKT).
1.3 Hipotesis
1.4 Tujuan
1. Menentukan waktu retensi dari senyawa antagonis-H2 (Simetidin, Ranitidin, Famotidin) secara Kromatografi Cair Kinerja Tinggi (KCKT). 2. Membandingkan waktu retensi berdasarkan fase gerak dari senyawa
antagonis-H2 (Simetidin, Ranitidin, Famotidin) secara Kromatografi Cair Kinerja Tinggi (KCKT).
3. Membandingan secara regresi nilai Log P (Koefisien Partisi) yang didapat pada penggojokan secara spektrofotometri (Azizah Vona, 2006) dengan waktu retensi secara Kromatografi Cair Kinerja Tinggi (KCKT).
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Umum
2.1.1 Simetidin
2.1.1.1 Sifat Fisikokimia
Sifat fisikokimia menurut Ditjen POM (1995) adalah sebagai berikut : Rumus struktur
N N
H
H3C CH2
S H2
C C H2
H N
C H N
NCN
CH3
Rumus molekul : C10H16N6S. Berat molekul : 252,34.
Nama Kimia : 2-Siano-1-metil-3-{2-{{(5-metilimidazol-4-il) Metil}tio}etil)guanidin.
Kandungan : Tidak kurang dari 98,0% dan tidak lebih dari 102,0% C10H16N6S, dihitung terhadap zat yang telah dikeringkan.
Pemerian : Serbuk hablur, putih sampai hampir putih; praktis. tidak Berbau atau bau merkaptan lemah.
Titik lebur : Antara 139° dan 144°.
Baku pembanding : Simetidin BPFI; lakukan pengeringan pada suhu 110° C selama 2 jam sebelum digunakan.
2.1.1.2 Mekanisme Kerja
Simetidin merupakan antagonis kompetitif histamin pada reseptor H2 dari sel parietal sehingga secara efektif dapat menghambat sekresi asam lambung. Simetidin juga memblok sekresi asam lambung yang disebabkan oleh rangsangan makanan, asetilkolin, kafein, dan insulin. Simetidin digunakan untuk pengobatan tukak lambung atau usus dan keadaan hipersekresi yang patologis, misal sindrom Zolinger – Ellison (Siswondono dan Soekardjo, 1995).
2.1.1.3 Farmakokinetik
Simetidin dapat dicerna secara cepat dalam saluran cerna, kadar plasma tertinggi dicapai dalam 1 jam bila diberikan dalam keadaan lambung kosong dan 2 jam bila diberikan bersama – sama dengan makanan (Siswondono dan Soekardjo, 1995).
2.1.1.4 Efek Samping
Simetidin dapat menimbulkan efek samping seperti diare, pusing, kelelahan dan rash (Siswondono dan Soekardjo, 1995).
2.1.1.5 Kegunaan
Simetidin digunakan untuk pengobatan tukak peptikum duodenum, tukak lambung, esofagitis erosif dan hipersekresi (Katzung, 2001).
2.1.1.6 Dosis
2.1.2 Ranitidin HCl
2.1.2.1. Sifat Fisikokimia
Sifat fisikokimia menurut Ditjen POM (1995) adalah sebagai berikut : Rumus struktur
C H2
H2
C S H2
C
O
H N
H3C
H N
O2N
N H3C
CH3 Cl H
Rumus molekul : C13H22N4O3S.HCl. Berat molekul : 350,87.
Nama Kimia :N-{2-{{{5-{(dimetilamino)metil}-2furanin}metil}-
2-furanin}metil}tio}etil}-N-metil-2-1,1-Etenadiamina, hidroklorida.
Kandungan : Tidak kurang dari 97,5% dan tidak lebih dari 102,0% C13H22N4O3S.HCl, dihitung terhadap zat yang telah dikeringkan.
Pemerian : Serbuk hablur, putih sampai kuning pucat, praktis tidak
berbau, peka terhadap cahaya dan kelembaban. Kelarutan : Sangat mudah larut dalam air, cukup larut dalam
etanol dan sukar larut dalam kloroform. Titik lebur : Melebur pada suhu lebih kurang 140°, disertai
peruraian.
sebelum digunakan. 2.1.2.2 Mekanisme Kerja
Ranitidin HCl merupakan antagonis kompetitif histamin yang khas pada reseptor H2 sehingga secara efektif dapat menghambat sekresi asam lambung, menekan kadar asam dan volume sekresi lambung (Siswondono dan Soekardjo, 1995).
2.1.2.3 Farmakokinetik
Ranitidin HCl diserap 39 – 87 % setelah pemberian oral dan mempunyai masa kerja yang cukup panjang, pemberian dosis 150 mg efektif menekan sekresi asam lambung selama 8–12 jam. Kadar plasma tertinggi dicapai dalam 2–3 jam setelah pemberian oral, dengan waktu paro eliminasi 2–3 jam (Siswondono dan Soekardjo, 1995).
2.1.2.4 Efek Samping
Efek samping Ranitidin HCl antara lain hepatitis, trombositopenia dan leukopenia yang terpulihkan, sakit kepala dan pusing (Siswondono dan Soekardjo, 1995).
2.1.2.5 Kegunaan
Ranitidin HCl digunakan untuk pengobatan tukak lambung atau usus dan
keadaan hipersekresi yang patologis, misal sindrom Zollinger–Ellison (Siswondono dan Soekardjo, 1995).
2.1.2.6 Dosis
2.1.3 Famotidin
2.1.3.1 Sifat Fisikokimia
Sifat fisikokimia menurut Ditjen POM (1995) adalah sebagai berikut : Rumus Struktur
H2N
S
S
N
NH2
NH2
N N
S O
NH2
O
Rumus molekul : C8C15N7O2S3. Berat molekul : 337,04.
Nama Kimia :3-{{{2-{(Aminoiminometil)amino}-4-tiazolil} metil}tio}-N-(aminosulfonil) propanimidamid. Kandungan :Tidak kurang dari 98,5% dan tidak lebih dari
101,0% C8C15N7O2S3, dihitung terhadap zat yang telah di keringkan.
Pemerian : Serbuk hablur, putih sampai kuning pucat.
Kelarutan : Sangat mudah larut dalam dimetil formamida dan asam asetat glacial, kurang larut dalam metanol, sangat kurang larut dalam air, praktis tidak larut dalam aseton, alkohol, eter, kloroform dan etil
asetat
Baku pembanding : Famotidin USP, lakukan pengeringan pada suhu 80°selama 5 jam sebelum digunakan
2.1.3.2 Mekanisme kerja
Famotidin merupakan antagonis kompetitif histamin yang khas pada reseptor H2, sehingga secara efektif dapat menghambat sekresi asam lambung, menekan kadar asam dan volume sekresi lambung. Famotidin merupakan antagonis H2 yang kuat dan sangat selektif dengan masa kerja panjang (Siswondono dan Soekardjo, 1995).
2.1.3.3 Farmakokinetika
Penyerapan Famotidin dalam saluran cerna tidak sempurna 40–45 % dan pengikatan protein plasma relatif rendah 15–22 %. Kadar plasma tertinggi dicapai dalam 1–3 jam setelah pemberian oral, waktu paro eliminasi 2,5–4 jam, dengan masa kerja obat 12 jam (Siswondono dan Soekardjo, 1995).
2.1.2.4 Efek samping
Efek samping obat antara lain adalah trombositopenia, konstipasi, diare, sakit kepala dan pusing (Siswondono dan Soekardjo, 1995).
2.1.2.5 Kegunaan
Famotidin digunakan untuk pengobatan tukak lambung atau usus dan keadaan hipersekresi yang patologis, misal sindrom Zollinger–Ellison (Siswondono dan Soekardjo, 1995).
2.1.2.6 Dosis
Dosis Famotidin adalah 20–40 mg (Siswondono dan Soekardjo, 1995). 2.2 Koefisien partisi
reaksi-reaksi degradasi suatu obat memegang peranan yang penting dalam mendesain metode analisis. Bentuk molekul obat ada yang sederhana dan ada yang sangat kompleks yang mengandung beberapa gugus fungsional. Gabungan beberapa gugus fungsional dalam satu molekul obat akan menentukan keseluruhan sifat-sifat molekul obat tersebut (Gandjar dan Rohman, 2007).
Bila suatu senyawa masuk ke dalam suatu sistem kromatogram, segera terdistribusi diantara fase diam dan fase gerak. Bila aliran fase gerak dihentikan pada waktu tertentu, senyawa diasumsikan sebagai suatu distribusi kesetimbangan diantara dua fase. Konsentrasi dalam tiap-tiap fase ditampilkan dengan koefisien partisi termodinamik (De Lux Putra, 2007)
Koefisien partisi adalah salah satu faktor yang mempengaruhi distribusi obat dalam tubuh. Setelah obat sampai ke peredaran darah, obat harus menembus sejumlah sel untuk mencapai reseptor. Dimana koefisien partisi juga menentukan jaringan mana yang dapat dicapai oleh suatu senyawa. Senyawa yang sangat mudah larut dalam air (hidrofilik) tidak akan sanggup melewati membran lipid untuk mencapai organ yang kaya akan lipid (misalnya otak). Sebaiknya senyawa yang mudah larut dalam lemak akan mudah menembus membran biologis. Tetapi jika terlalu lipofilik senyawa tersebut akan tertahan lama pada jaringan lemak dan sulit meninggalkan tempat itu dengan cepat. Koefisien partisi hanyalah salah satu diantara beberapa parameter fisiko kimia yang mempengaruhi distribusi obat dalam tubuh, di samping faktor lain yaitu parameter elektronik dan parameter sterik (Nogrady, 1992).
fase air. Menurut Nernst koefisien partisi dapat di sederhanakan sesuai dengan persamaan berikut :
P =
Cw Co
Log P = log Co – log Cw
Co adalah kadar dalam fase non air dan Cw kadar molal dalam air, setelah mengalami keseimbangan partisi. Karena P adalah kuantitas tanpa dimensi, setiap unit kadar dapat digunakan, tetapi idealnya untuk hitungan dilakukan dalam keadaan yang sangat encer, pengenceran cukup sampai 10 - 1 molal atau tergantung metode analisis yang digunakan untuk menetapkan kadar, kadang-kadang sampai kadar 10 - 5 molal (Sardjoko, 1993).
Adanya pemahaman tentang koefisien partisi dan pengaruh pH pada koefisien partisi akan bermanfaat dalam hubungannya dengan ekstraksi dan kromatografi obat. Semakin besar nilai P maka semakin banyak senyawa dalam pelarut organik. Nilai P suatu senyawa tergantung pada pelarut organik tertentu yang digunakan untuk melakukan pengukuran.
2.3 Waktu Retensi
Waktu yang dibutuhkan oleh senyawa untuk bergerak melalui kolom menuju detektor disebut sebagai waktu retensi. Waktu retensi diukur berdasarkan waktu dimana sampel diinjeksikan sampai sampel menunjukkan ketinggian puncak yang maksimum dari senyawa itu. Senyawa-senyawa yang berbeda memiliki waktu retensi yang berbeda. Untuk beberapa senyawa, waktu retensi akan sangat bervariasi dan bergantung pada :
• Tekanan yang digunakan (karena itu akan berpengaruh pada laju alir dari
pelarut)
• Kondisi dari fase diam (tidak hanya terbuat dari material apa, tetapi juga pada
ukuran partikel)
• Komposisi yang tepat dari pelarut
• Temperatur pada kolom
Itu berarti bahwa kondisi harus dikontrol secara hati-hati, jika menggunakan waktu retensi sebagai sarana untuk mengidentifikasi senyawa-senyawa ( De Lux Putra, 2007 ).
2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
Diperkenalkannya pompa bertekanan tinggi dan perkembangan detektor yang sangat peka telah membangkitkan perhatian pada kromatografi kolom. Bidang baru dalam kromatografi kolom adalah Kromatografi Cair Kinerja Tinggi (KCKT = HPLC = High Performance Liquid Chromatography), yang pada dasarnya perbaikan dalam laju aliran, karena pada kromatografi kolom klasik laju aliran sangat rendah (Sardjoko, 1993).
kromatografi dengan fase gerak cairan atau padat. Banyak kelebihan metode ini dibandingkan dengan metode lain.
Tiga bentuk kromatografi cair kinerja tinggi yang paling banyak digunakan adalah penukar ion, partisi dan adsorpsi. Kromatografi penukar ion terutama digunakan untuk pemisahan zat-zat larut dalam air yang ionik atau yang dapat terionisasi dengan bobot molekul kurang dari 1500. Fase diam pada kromatografi penukar ion umumnya resin organik sintetik dengan gugus aktif yang berbeda-beda. Pada kromatografi partisi digunakan fase gerak dan fase diam dengan polaritas yang berbeda. Jika fase gerak bersifat polar dan fase diam non polar, dikenal sebagai kromatografi fase balik, maka senyawa yang non polar yang larut dalam hidrokarbon, dengan bobot molekul kurang dari 1000, seperti vitamin larut lemak dan antrakinon, dapat dipisahkan berdasarkan atas afinitasnya terhadap fase diam (Ditjen POM, 199).
Kromatografi Cair Kinerja Tinggi sudah dikembangkan dengan berbagai teknologi mutakhir sehingga peralatan dan perlengkapannya karena mempunyai kinerja atau performance yang memenuhi selera perkembangan teknoogi. Walaupun demikian kita juga harus mempelajari ilmu dasarnya, jangan sampai dalam menggunakan alat canggih tidak mengetahui dasar ilmunya. Semua senyawa akan dapat di analisis dengan alat KCKT baik yang tidak larut dalam air, yamg larut dalam air, yang berbentuk ion maupun non ionik, bermolekul besar maupun molekul biasa telah dapat di analisis dengan KCKT. Tetapi dengan syarat bahwa segala perlengkapan baik kolom dan detektor harus tersedia.
(impur ities), analisa senyawa - senyawa tidak mudah menguap (non-volatile), penentuan molekul-molekul netral, ionik, maupun zwitter ion, isolasi dan pemurnian senyawa, pemisahan senyawa-senyawa yang strukturnya hampir sama, pemisahan senyawa-senyawa dalam jumlah sekelumit (trace elements), dalam jumlah banyak, dan dalam skala proses industri. KCKT merupakan metode yang tidak destruktif dan dapat digunakan baik untuk kualitatif maupun kuantitatif (Gandjar dan Rohman, 2007)
KCKT paling sering digunakan untuk menetapkan kadar senyawa-senyawa tertentu seperti asam amino, asam-asam nukleat, dan protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat, produk hasil samping proses sintetik, atau produk-produk degradasi dalam sedian farmasi, memonitor sample-sampel yang berasal dari lingkungan, memurnikan senyawa dalam suatu campuran, memisahkan polimer dan menentukan distribusi berat molekulnya dalam suatu campuran, kontrol kualitas, dan mengikuti jalannya reaksi sintesis (Gandjar dan Rohman, 2007).
Keterbatasan metode KCKT adalah untuk identifikasi senyawa, kecuali jika KCKT dihubungkan dengan spektrometer massa. Keterbatasan lainnya adalah jika sampelnya sangat kompleks, maka resolusi yang baik sulit diperoleh (Gandjar dan Rohman, 2007).
KomponenKromatografi cair kinerja tinggi (KCKT) pada dasarnya terdiri atas lima komponen pokok yaitu :
1) Wadah fase gerak 2) Pompa
BAB III
METODE PERCOBAAN
3.1. Waktu dan Tempat Pelaksanaan
Penelitian di lakukan di Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Sumatera Utara Medan pada bulan juni tahun 2009.
3.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat KCKT yang terdiri dari vacum desegger, pompa, UV/VIS detektor (dilengkapi dengan komputer dan printer “hp”), kolom Shimpac VP-ODS (4,6 mm x 25 cm), wadah fase gerak, penyuntik mikroliter (100 µ l), neraca analitik (Baeco Germany), membran filter PTFE (Poli Tio Fluro Etilen) 0,5 µm, cellulose nitrat membran filter 0,45 µm dan 0,2 µm dan alat gelas lain.
3.3Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah Akuabides (Ika pharmindo putra mas), Amonium asetat 0,1 M (Merck), Asam asetat glacial (Merck), Natrium asetat tryhidrat (Merck), Asam fosfat (Merck), Bahan baku Simetidin(Mutifa), Bahan baku Ranitidin (Mutifa), Bahan baku Famotidin (PPOM Jakarta), Famotidin tablet, Kalium dihidrogen fosfat (Merck), Kalium hidroksida 0,1 M (Merck), Metanol (Merck), Omekur, Omeranin, Pratifar, Ranitidin tablet, Simetidin tablet, Trietilamin (Merck).
3.4 Pengambilan Sampel
Indo Farma ), tablet Omekur ( PT. Mutifa ), tablet Ranitidin ( PT. Pertiwi Agung), tablet Omeranin ( PT. Mutifa ), tablet Famotidin ( PT. Indo Farma ), tablet Pratifar ( PT. Ifars ).
3.5 Pola Penelitian
3.5.1 Pengujian Bahan Baku secara Spektofotometri Ultraviolet
3.5.1.1 Simetidin
Sebanyak 25 mg Simetidin, dimasukkan kedalam labu tentukur 25 ml kemudian dilarutkan kedalam campuran akuadest dan metanol (4:1) sehingga diperoleh konsentrasinya 1000 µg per ml. Kemudian dipipet 0,3 ml larutan tersebut kedalam labu tentukur 50 ml diencerkan oleh larutan akuadest dan metanol (4:1) sehingga diperoleh konsentrasinya 6 µg per ml. Diukur absorbansinya pada panjang gelombang 200-300 nm.
3.5.1.2 Ranitidin
Sebanyak 50 mg Ranitidin HCI baku, dimasukkan kedalam labu tentukur 100 ml kemudian dilarutkan dengan akuadest sampai garis tanda sehingga diperoleh konsentrasinya 500 µg per ml. Kemudian dipipet 0,9 ml larutan tersebut kedalam labu tentukur 50 ml diencerkan dengan akuadest sampai garis tanda sehingga diperoleh konsentrasinnya 9 µg per ml. Diukur absorbansinya pada panjang gelombang 200-400.
3.5.1.3 Famotidin
diperoleh konsentrasinya 10 µg per ml. Diukur absorbansinya pada panjang gelombang 200 – 300 nm.
3.5.2 Penetapan Koefisien Partisi ( Waktu Retensi )
3.5.2.1 Simetidin
a. Pembuatan fase gerak
Sebanyak 200 ml metanol disaring menggunakan membran filter PTFE ( Poli Tio Fluro Etilen ) 0,45 µm. Kemudian sebanyak 0.3 ml asam fosfat dilarutkan dengan akuadest dimasukkan kedalam labu tentukur 1000 ml, diencerkan dengan akuadest hingga garis tanda lalu disaring dengan selulosa nitrat membran filter 0,45 µm, masing - masing diawaudarakan selama 15 menit. Dengan perbandingan (20 : 80) (USP31, 2008).
b. Pembuatan larutan baku
Timbang masing – masing 40 mg Simetidin, Ranitidin, Famotidin BPFI, kemudian masing – masing dilarutkan kedalam campuran air dan metanol (4 : 1) kedalam labu tentukur 100 ml sehingga diperoleh konsentrasinya 0,4 mg per ml, (LIB I). Dari LIB I dipipet 2,5 ml kedalam labu tentukur 100 ml diencerkan dengan fase gerak sampai tanda sehingga diperoleh konsentrasinya 10 µg per ml (USP31, 2008).
c. Pembuatan larutan uji
d. Sistem kromatografi
KCKT di lengkapi dengan detektor 220 nm dan kolom 4,6 mm x 25 cm berisi bahan pengisi L1. laju aliran lebih kurang 2.0 ml per menit. Lakukan kromatografi terhadap larutan baku, rekam respon puncak seperti yang tertera pada prosedur: faktor kapasitas k’, tidak kurang dari 0.6, efisiensi kolom ditetapkan dari puncak analit tidak kurang dari 1000 lempeng teoritis dan simpangan baku relatif pada penyuntikan ulang tidak lebih dari 2,0 % (USP31, 2008).
3.5.2.2 Ranitidin
a. Pembuatan fase gerak
Sebanyak 700 ml metanol disaring menggunakan membran filter PTFE (Poli Tio Fluro Etilen) 0,45 µ m. Kemudian sebanyak 7,708 mg amonium asetat 0,1 M dilarutkan dengan akuadest dimasukkan kedalam labu tentukur 1000 ml, diencerkan dengan akuadest hingga garis tanda lalu disaring dengan selulosa nitrat membran filter 0,45 µm, masing - masing diawaudarakan selama 15 menit. Dengan perbandingan (70 : 30) (USP31, 2008).
b. Pembuatan larutan baku
Timbang masing masing 11,2 mg Ranitidin hidroklorida, Simetidin, Famotidin BPFI, dilarutkan dalam fase gerak dalam labu tentukur 100 ml, sehingga diperoleh konsentrasinya 112 µg per ml (USP31, 2008).
c. Pembuatan larutan uji
d. Sistem kromatografi
KCKT di lengkapi dengan detektor 322 nm dan kolom 4,6 mm x 20 cm sampai 30 cm berisi bahan pengisi L1. laju aliran lebih kurang 2 ml per menit. Lakukan kromatografi terhadap larutan kesesuaian sistem, rekam respon puncak seperti yang tertera pada prosedur: resolusi, R, tidak kurang dari 1,5. Lakukan penyuntikan ulang larutan baku, rekam respon puncak seperti yang tertera pada prosedur: faktor ikutan puncak ranitidin hidroklorida tidak lebih dari 2,0, jumlah lempeng teoritis ditentukan dari puncak ranitidin hidroklorida tidak kurang dari 700 dan simpangan baku relatif pada penyuntikan ulang tidak lebih 2 % (USP31, 2008).
3.5.2.3Famotidin
a. Larutan bufer
Timbang 13,6 gr natrium asetat trihidrat dilarutkan kedalam 750 ml air. Tambahkan 1 ml trietilamin dan asam asetat glasial hingga diperoleh pH 6,0, larukan dengan akuadest hingga 1 L (USP31, 2008).
b. Pembuatan fase gerak
Sebanyak 70 ml asetonitril disaring menggunakan membran filter PTFE (Poli Tio Fluro Etilen) 0,45 µm. Kemudian sebanyak larutan bufer disaring dengan selulosa nitrat membran filter 0,45 µ m, masing – masing diawaudarakan selama 30 menit. Dengan perbandingan(93 : 7) (USP31, 2008).
c. Pembuatan larutan
d. Pembuatan larutan baku
Timbang masing-masing 10 mg Famotidin BPFI, Simetidin, Ranitidin dimasukkan kedalam labu tentukur 100 ml ditambahkan dengan 20 ml metanol dan dilarutkan dengan pelarut hingga garis tanda sehingga diperoleh konsentrasinya 100 µ m per ml (USP31, 2008).
e. Pembuatan larutan uji
Timbang seksama 10 tablet, setara lebih kurang 100 mg Famotidin, dimasukkan kedalam labu tentukur 1 L. Di larutkan dengan 200 ml pelarut kemudian ditambahkan 20 ml metanol. Sehingga diperoleh konsentrasinya 100 µ m per ml (USP31, 2008).
f. Sistem kromatografi
KCKT di lengkapi dengan detektor 275 nm dan kolom 4,6 mm x 15 cm berisi bahan pengisi L1. Temperatur kolom 40 Oc. Laju aliran lebih kurang 1,4 ml per menit. Lakukan kromatografi terhadap larutan baku, rekam respon puncak seperti yang tertera pada prosedur: faktor kapasitas k’, tidak kurang dari 0.6, efisiensi kolom ditetapkan dari puncak analit tidak kurang dari 1000 lempeng teoritis dan simpangan baku relatif pada penyuntikan ulang tidak lebih dari 2,0 % (USP31, 2008).
3.5.3 Analisa Data Secara Stastistik
Menurut Sudjana (2002) Untuk menghitung Standar Deviasi (SD) digunakan rumus:
SD =
1 )
( 2
− − ∑
n x x
Keterangan :
SD = Standar deviasi X = Kadar sampel
n = Jumlah perlakuan
Untuk menentukan data diterima atau ditolak digunakan rumus:
t hitung =
n SD
X X
/
−
Dengan dasar penolakan data adalah apabila t hitung ≥ t tabel
Untuk mencari kadar sebenarnya dengan α = 0,01; dk = n-1, dapat digunakan rumus :
µ= X
n SD X t(1−1/2α).dk
±
Keterangan :
µ = Kadar sebenarnya X = Kadar sampel n = Jumlah perlakuan
t = Suatu harga yang besarnya tergantung pada derajat kebebasan dan tingkat kepercayaan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penetapan uji bahan baku
Pada penelitian yang dilakukan tidak diperoleh Simetidin BPFI dan Ranitidin HCI BPFI, sehingga digunakan bahan baku yang diperoleh dari pabrik. Untuk Simetidin BPFI dan Ranitidin BPFI digunakan baku dari PT. Mutifa
Karena tidak diperoleh Simetidin BPFI dan Ranitidin BPFI, maka dilakukan uji bahan baku terhadap bahan baku Simetidin dan Ranitidin dari PT. Multifa untuk mengetahui apakah bahan baku tersebut benar yang dimaksud. Pengujian dilakukan dengan cara uji spektrofotometri. Hasil pengukuran dengan spektrofotometri diketahui bahwa bahan baku tersebut adalah benar merupakan bahan baku Simetidin, Ranitidin HCI, dan Famotidin setelah dibandingkan dengan literatur Clark.
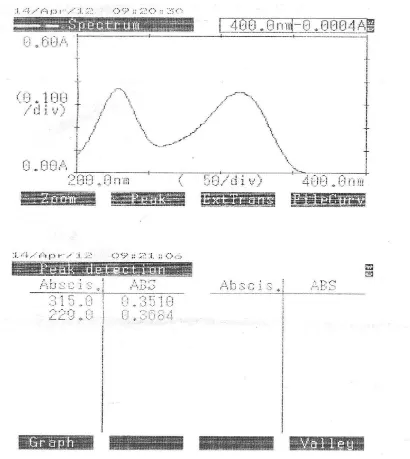
Kurva serapan Ranitidin HCI dapat dibuat dengan mengukur larutan bahan baku Ranitidin HCI secara spektrofotometri ultraviolet mulai panjang gelombang 200-400 nm. Dari hasil pengukuran panjang gelombang maksimum Ranitidin HCI baku dalam pelarut akuadest secara spektrofotometri ultraviolet diperoleh absorbansi maksimum pada panjang gelombang 315 nm dan 229 nm seperti terlihat pada gambar 2.
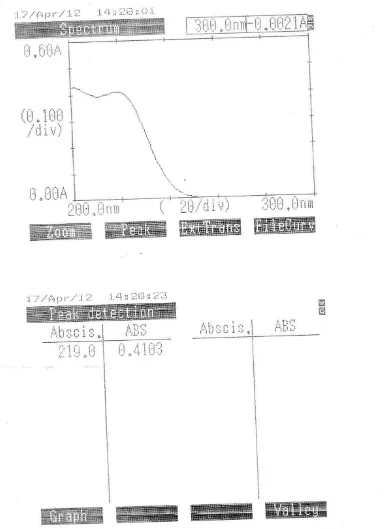
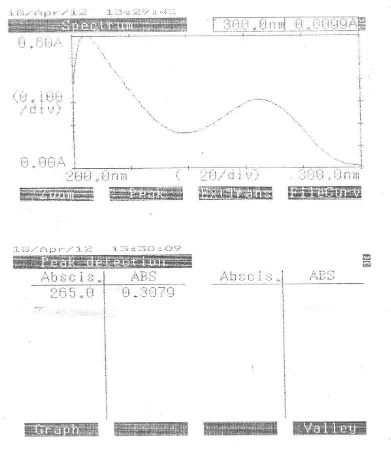
Kurva serapan Famotidin dapat dibuat dengan mengukur larutan bahan baku Famotidin secara spektrofotometri ultraviolet mulai panjang gelombang 200-300 nm. Dari hasil pengukuran panjang gelombang maksimum Famotidin bahan baku dalam pelarut HCI secara spektrofotometri ultraviolet diperoleh absorbansi maksimum pada panjang gelombang 265 nm seperti yang terlihat pada gambar 3.
4.2 Pengukuran waktu retensi (Penetapan Log P)
Pengukuran waktu retensi dan penetapan harga koefisien partisi terhadap Simetidin, Ranitidin HCI, dan Famotidin dilakukan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) menggunakan kolom VP-ODS (Oktadesil silan 4,6 mm x 25 cm), volume penyuntikan 10 µ l, dan laju alir 2,0 ml per menit, 1,4 ml per menit. Senyawa yang akan diperiksa ditimbang seksama dan dilarutkan dalam fase yang mempunyai kekuatan melarutkan terbesar kedalam labu tentukur sehingga dihasilkan larutan standar (Purcell,1979). Dalam hal ini senyawa antihistamin H2 adalah senyawa yang mempunyai struktur yang mengandung cincin imidazol atau biosteriknya yang cenderung bersifat polar, sehingga dapat diambil kesimpulan bahwa fase melarutkan terbesar adalah fase air.
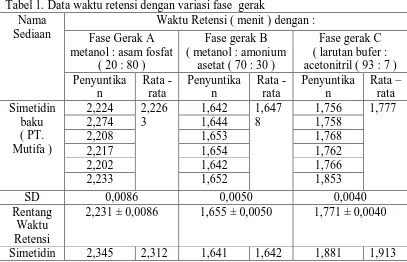
[image:44.595.108.515.493.755.2]Penentuan waktu retensi dengan variasi fase gerak yaitu fase gerak A (Simetidin), fase gerak B (Ranitidin) dan fase gerak C (Famotidin) menunjukkan hasil yang berbeda. Senyawa-senyawa yang berbeda memiliki waktu retensi yang berbeda.
Tabel 1. Data waktu retensi dengan variasi fase gerak Nama
Sediaan
Waktu Retensi ( menit ) dengan : Fase Gerak A
metanol : asam fosfat ( 20 : 80 )
Fase gerak B ( metanol : amonium
asetat ( 70 : 30 )
Fase gerak C ( larutan bufer : acetonitril ( 93 : 7 ) Penyuntika n Rata - rata Penyuntika n Rata - rata Penyuntika n Rata – rata Simetidin baku ( PT. Mutifa )
2,224 2,226 3
1,642 1,647 8
1,756 1,777
2,274 1,644 1,758
2,208 1,653 1,768
2,217 1,654 1,762
2,202 1,642 1,766
2,233 1,652 1,853
SD 0,0086 0,0050 0,0040
Rentang Waktu Retensi
generik ( PT. Indofarma
)
2,313 8 1,636 6 1,927
2,344 1,644 1,924
2,262 1,647 1,911
2,301 1,648 1,924
2,312 1,640 1,911
SD 0,0187 0,0018 0,0074
Rentang Waktu Retensi
2,361 ± 0,0187 1,648 ± 0,0018 1,934 ± 0,0074
Omekur ( PT. Mutifa )
2,243 2,204 6
1,644 1,647 3
1,867 1,869 6
2,241 1,654 1,865
2,210 1,653 1,874
2,185 1,644 1,873
2,165 1,648 1,872
2,184 1,641 1,867
SD 0,0316 0,0040 0,0022
Rentang Waktu Retensi
2,255 ± 0,0316 1,655 ± 0,0040 1,88 ± 0,0022
Ranitidin Baku ( PT. Mutifa )
1,813 1,829 3
1,637 1,642 1
1,864 1,872
1,814 1,637 1,876
1,801 1,649 1,874
1,811 1,645 1,877
1,852 1,639 1,866
1,885 1,646 1,877
SD 0,0180 0,0035 0,0038
Rentang Waktu Retensi
1,855 ± 0,0180 1,647 ± 0,0035 1,881 ± 0,0038
Ranitidin generik
( PT. Pertiwi Agung )
1,898 1,925 8
1,638 1,642 5
1,866 1,870 5
1,929 1,636 1,877
1,922 1,649 1,876
1,926 1,638 1,864
1,949 1,648 1,874
1,931 1,646 1,866
SD 0,0031 0,0040 0,005
Rentang Waktu Retensi
1,827 ± 0,0031 1,649 ± 0,0040 1,878 ± 0,005
Omeranin ( PT. Mutifa )
1,842 1,834 1,633 1,646 1,871 1,870 3
1,856 1,649 1,866
1,831 1,643 1,872
1,832 1,647 1,870
1,843 1,655 1,871
1,800 1,649 1,872
Rentang Waktu Retensi
1,854 ± 0,0070 1,655 ± 0,0038 1,872 ± 0,0008
Famotidin BPFI
2,170 2,150 8
1,499 1,503 3
1,765 1,766
2,166 1,503 1,767
2,119 1,511 1,768
2,128 1,499 1,764
2,155 1,504 1,765
2,167 1,504 1,767
SD 0,0158 0,0018 0,0015
Rentang Waktu Retensi
2,189 ± 0,0158 1,504 ± 0,0018 1,768 ± 0,0015
Famotidin generik
( PT. Indofarma
)
2,072 2,044 1,504 1,504 3
1,876 1,871
2,041 1,504 1,865
2,054 1,499 1,870
2,042 1,511 1,875
2,058 1,503 1,876
1,997 1,499 1,865
SD 0,0111 0,0207 0,0046
Rentang Waktu Retensi
2,075 ± 0,0111 1,506 ± 0,0207 1,878 ± 0,0046
Pratifar ( PT. Ifars)
2,146 2,114 5
1,504 1,503 1,882 1,870 6
2,121 1,499 1,870
2,097 1,504 1,865
2,116 1,499 1,872
2,103 1,511 1,870
2,104 1,503 1,865
SD 0,0070 0,0027 0,0032
Rentang Waktu Retensi
2,122 ± 0,0070 1,506 ± 0,0027 1,874 ± 0,0032
1,869). Ranitidin baku (Fase gerak A = 1,829), (Fase gerak B = 1,642), dan (Fase gerak C = 1,842), Ranitidin generik (Fase gerak A = 1,925), (Fase gerak B = 1,642), dan (Fase gerak C = 1,870). Omeranin (Fase gerak A = 1,834), (Fase gerak B = 1,646), dan (Fase gerak C = 1,870). Famotidin baku (Fase gerak A = 2,150), Fase gerak B = 1,503), dan (Fase gerak C = 1,766), Famotidin generik (Fase gerak A = 2,044), (Fase gerak B = 1,504), dan (Fase gerak C = 1,871). Pratifar ( Fase gerak A = 2,114), (Fase gerak B = 1,503), dan (Fase gerak C = 1,870).
Ini berarti fase gerak A tersebut memiliki kelarutan dalam lemak yang paling besar dibandingkan fase gerak lain yang diuji. Fase gerak yang mempunyai waktu retensi atau harga koefisien partisi yang paling rendah dari hasil penelitian yang dilakukan adalah fase gerak B. Waktu retensi atau harga koefisien partisi fase gerak C berada diantara fase gerak A dan fase gerak B. Semakin besar waktu retensi atau pengukuran koefisien partisi maka absorpsinya kedalam tubuh semakin baik karena tubuh tersusun oleh lapisan lemak.
Ranitidin HCI yang secara teoritis dinyatakan sebagai senyawa antihistamin H2 yang paling non polar, ternyata apabila dilakukan penetapan harga dalam bentuk garamnya, maka diperoleh harga koefisien partisi yang paling kecil dibandingkan dengan senyawa antihistamin-H2 lainnya. Hal ini disebabkan oleh bentuk garam yang lebih mudah larut dalam fase polar.
Tetapi berdasarkan program (Chem Draw) penentuan nilai log P sediaan bahan baku antihistamin-H2 yaitu : Simetidin (Log P = 0,79), Ranitidin (Log P = 1,2), Famotidin (Log P = -0,03) dimana harga koefisien partisi senyawa antihistamin H2 yang terbesar adalah Ranitidin disebabkan karena dalam bentuk base yang larut dalam fase non polar, bukan dalam bentuk garamnya yaitu Ranitidin HCI yang lebih mudah larut dalam fase polar.
Peneliti sebelumnya (Vonna, 2006) ) telah melakukan penelitian tentang penentuan nilai log P sediaan bahan baku antihistamin - H2 yaitu : Simetidin (Log P = -0,307), Rantitidin (Log P = -1,328), Famotidin (Log P = -0,946) dengan penggojokan sistem oktanol-air yang dianalisis secara spektrofotometri ultraviolet.
Berikut adalah hubungan hasil waktu retensi secara KCKT dan harga Log P (Koefisien Partisi) penggojokan secara spektrofotometri (Vonna, 2006) yang menunjukkan adanya perbedaan pada grafik dibawah ini :.
Perbandingan antara Log P (Koefisien Partisi) dengan penggojokan dan waktu retensi dengan KCKT.
1. Fase Gerak A
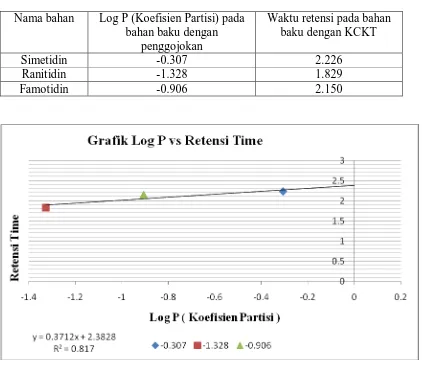
[image:49.595.113.535.336.701.2]Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada Simetidin, Ranitidin, dan Famotidin. Tabel 2. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan
waktu retensi bahan baku dengan KCKT pada fase gerak A
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada bahan baku dengan KCKT
Simetidin -0.307 2.226
Ranitidin -1.328 1.829
Famotidin -0.906 2.150
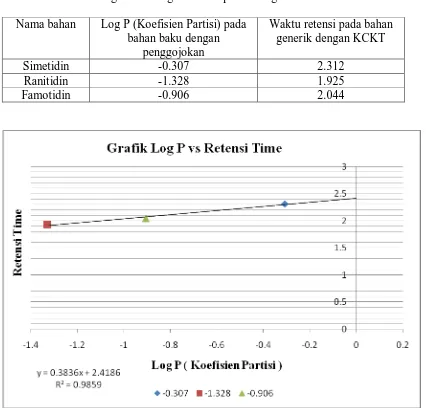
Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 3. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak A.
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada bahan generik dengan KCKT
Simetidin -0.307 2.312
Ranitidin -1.328 1.925
Famotidin -0.906 2.044
Gambar 5. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak A.
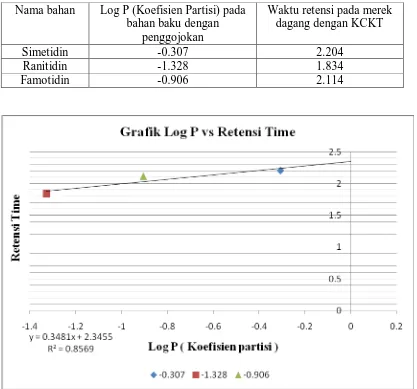
Tabel 4. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak A
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada merek dagang dengan KCKT
Simetidin -0.307 2.204
Ranitidin -1.328 1.834
Famotidin -0.906 2.114
Gambar 6. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak A.
2. Fase Gerak B
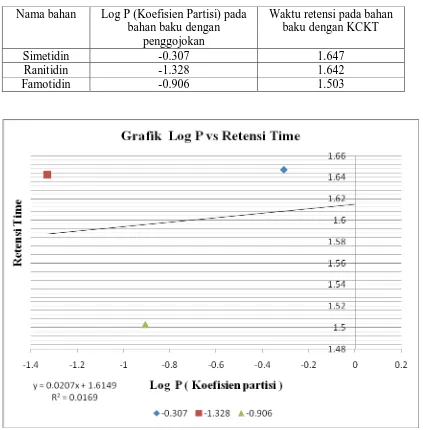
[image:51.595.112.529.124.513.2]Tabel 5. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak B
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada bahan baku dengan KCKT
Simetidin -0.307 1.647
Ranitidin -1.328 1.642
Famotidin -0.906 1.503
Gambar 7. Log P (koefisien partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak B
Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada Simetidin, Ranitidin, dan Famotidin.
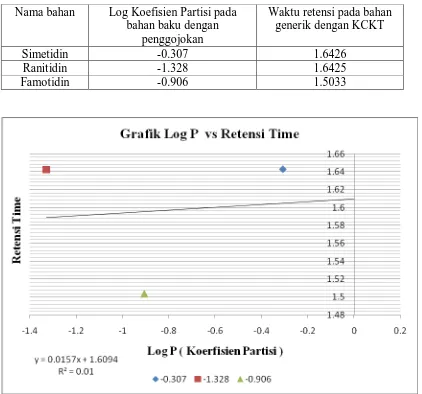
[image:52.595.111.534.120.550.2]Tabel 6. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak B
Nama bahan Log Koefisien Partisi pada bahan baku dengan
penggojokan
Waktu retensi pada bahan generik dengan KCKT
Simetidin -0.307 1.6426
Ranitidin -1.328 1.6425
Famotidin -0.906 1.5033
Gambar 8. Log P ( koefisien partisi ) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak B
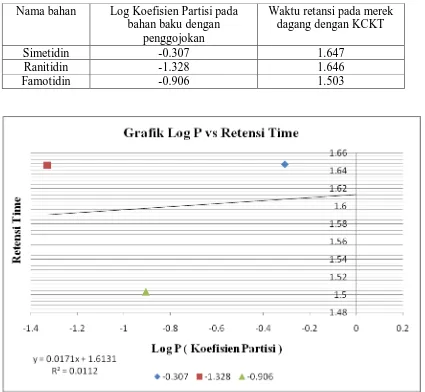
Tabel 7. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak B
Nama bahan Log Koefisien Partisi pada bahan baku dengan
penggojokan
Waktu retansi pada merek dagang dengan KCKT
Simetidin -0.307 1.647
Ranitidin -1.328 1.646
Famotidin -0.906 1.503
Gambar 9. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak B
3. Fase Gerak C
Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 8. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak C
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada bahan baku dengan KCKT
Simetidin -0.307 1.777
Ranitidin -1.328 1.872
Famotidin -0.906 1.766
Gambar 10. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan baku dengan KCKT pada fase gerak C
Tabel 9. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak C
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada bahan generik dengan KCKT
Simetidin -0.307 1.913
Ranitidin -1.328 1.870
Famotidin -0.906 1.871
Gambar 11. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi bahan generik dengan KCKT pada fase gerak C
Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 10. Tabel Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek degang dengan KCKT pada fase gerak C
Nama bahan Log P (Koefisien Partisi) pada bahan baku dengan
penggojokan
Waktu retensi pada merek dagang dengan KCKT
Simetidin -0.307 1.8696
Ranitidin -1.328 1.8703
[image:57.595.115.534.260.514.2]Famotidin -0.906 1.8706
Gambar 12. Log P (Koefisien Partisi) bahan baku dengan penggojokan dan waktu retensi merek dagang dengan KCKT pada fase gerak C
Perbandingan antara Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi secara KCKT.
1. Fase Gerak A
Tabel 11. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak A.
Nama bahan Koefisien Partisi (Log P) secara teori
Waktu retensi pada bahan baku dengan KCKT
Simetidin 0.79 2.226
Ranitidin 1.2 1.829
Famotidin -0.03 2.150
Gambar 13. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak A
[image:58.595.114.519.677.750.2]Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi bahan generik secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 12. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak A
Nama bahan Log Koefisien Partisi ( Log P ) secara teori
Waktu retensi pada bahan generik dengan KCKT
Simetidin 0.79 2.112
Ranitidin 1.2 1.925
Gambar 14. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak A
Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi merek dagang secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 13. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak A
Nama bahan Log Koefisien Partisi (Log P) secara teori
Waktu retensi pada merek dagang dengan KCKT
Simetidin 0.79 2.204
Ranitidin 1.2 1.834
[image:59.595.111.517.567.638.2]Gambar 15. Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak A
2. Fase Gerak B
[image:60.595.113.516.568.640.2]Tabel log koefisien partisi secara teori (Chem Draw) dan waktu retensi bahan baku secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 14. Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi bahan baku secara KCKT pada fase gerak B
Nama bahan Log Koefisien Partisi ( Log P ) secara teori
Waktu retensi pada bahan baku dengan KCKT
Simetidin 0.79 1.647
Ranitidin 1.2 1.642
Gambar 16. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak B
[image:61.595.114.518.533.607.2]Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 15. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak B
Nama bahan Log Koefisien Partisi (Log P) secara teori
Waktu retensi pada bahan generik dengan KCKT
Simetidin 0.79 1.6426
Ranitidin 1.2 1.6425
Gambar 17. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak B
Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi merek dagang secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 16. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak B
Nama bahan Log Koefisien Partisi (Log P) secara teori
Waktu retensi pada merek dagang dengan KCKT
Simetidin 0.79 1.647
Ranitidin 1.2 1.646
Gambar 18. Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak B
3. Fase Gerak C
[image:63.595.113.515.549.622.2]Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi bahan baku secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 17. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak C
Nama bahan Log Koefisien Partisi (Log P) secara teori
Waktu retensi pada bahan baku dengan KCKT
Simetidin 0.79 1.777
Ranitidin 1.2 1.872
Gambar 19. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan baku secara KCKT pada fase gerak C
[image:64.595.112.517.534.607.2]Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi bahan generik secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 18. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak C
Nama bahan Log Koefisien Partisi (Log P) secara teori
Waktu retensi pada bahan generik dengan KCKT
Simetidin 0.79 1.870
Ranitidin 1.2 1.913
Gambar 20. Log P (Koefisien Partisi) secara teori dan waktu retensi bahan generik secara KCKT pada fase gerak C
Tabel Log P (Koefisien Partisi) secara teori (Chem Draw) dan waktu retensi merek dagang secara KCKT pada Simetidin, Ranitidin, dan Famotidin.
Tabel 19. Tabel Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak C
Nama bahan Log Koefisien Partisi (Log P) secara teori
Waktu retensi pada merek dagang dengan KCKT
Simetidin 0.79 1.8703
Ranitidin 1.2 1.8696
Gambar 21. Log P (Koefisien Partisi) secara teori dan waktu retensi merek dagang secara KCKT pada fase gerak C
Dari grafik diatas terlihat bahwa hubungan antara nilai log P (Koefisien Partisi) dengan penggojokan secara spektrofotometri (Vonna, 2006) dan program (Chem Draw) dengan waktu retensi secara Kromatografi Cair Kinerja Tinggi (KCKT) dari senyawa antagonis H2 merupakan hubungan yang tidak linear, disebabkan Ranitidin yang digunakan pada penggojokan dan program Chem Draw bukan Ranitidn dalam bentuk garamnya atau Ranitidin HCI tetapi Ranitidin dalam bentuk basenya yang digunakan pada Kromatografi Cair Kinerja Tinggi (KCKT) Tabel 20. R2 Penggojokan secara Spektrofotometri dan waktu retensi secara
KCKT
Nama Sediaan R2
Penggojokan secara Spektrofotometri dan Retensi Time secara KCKT
Simetidin Baku 0.817
Simetidin Generik 0.985
Ranitidin Baku 0.016
Ranitidin Generik 0.01
Omeranin 0.011
Famotidin Baku 0.5673
Famotidin Generik 0.8459
[image:67.595.109.536.86.171.2]Pratifar 0.5647
Tabel 21. R2Cham Draw ( Teori ) dan waktu retensi secara KCKT
Nama Sediaan R2
Cham Draw ( Teori ) dan Retensi Time secara KCKT
Simetidin Baku 0.8912
Simetidin Generik 0.7212
Omekur 0.8392
Ranitidin Baku 0.8732
Ranitidin Generik 0.8925
Omeranin 0.8891
Famotidin Baku 0.6631
Famotidin Generik 0.5512
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan, diketahui bahwa harga waktu retensi atau harga koefisien partisi dari senyawa antihistamin H2 dapat ditetapkan dengan metode Kromatografi Cair Kinerja Tinggi ( KCKT ).
Dari hasil penelitian diperoleh waktu retensi atau harga koefisien partisi senyawa antihistamin H2 yang terbesar dengan menggunakan fase gerak A dibandingkan fase gerak B dan fase gerak C.
Perbandingan secara regresi linear yang dapat dilihat pada grafik nilai Log P (Koefisien partisi) yang didapat pada penggojokan secara spektrofotometri Simetidin (Log P = 0,307), Rantitidin (Log P = 1,328), Famotidin (Log P = -0,946) (Vonna, 2006) dengan waktu retensi secara Kromatografi Cair Kinerja Tinggi (KCKT) bahwa nilai Log P Simetidin dan waktu retensi fase gerak Simetidin lebih besar dibandingkan dengan senyawa antihistamin – H2 .yaitu Ranitidin dan Famotidin.
5.2 Saran
DAFTAR PUSTAKA
De Lux Putra, E (2007). Dasar-dasar Kromatografi Gas Dan Kromatografi Cair Kinerja Tinggi. Medan. Universitas Sumatera Utara.
Ditjen POM. (1995). Farmakope Indonesia. Edisi ke IV. Departemen Kesehatan RI. Jakarta. Hal : 233-234, 733-734, 1009.
Gandjar, I.G. dan Rohman, A (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal : 378-388.
Katzung, Bertram G. (2001). Farmokologi Dasar dan Klinik. Penerjemah: Dr. Dripa Sjabana, dkk. Jakarta. Penerbit Salemba Medika.
Nogrady, T. (1985). Kimia Medisinal, Pendekatan Secara Biokimia. Edisi kedua. Bandung. Penerbit ITB. Hal : 8-9.
Purcell, William P., Bass, Goerge E., dan Clyton John M. (1973). Strategy of Drug Design: A Guide to Biological Activity. New York. John Wiley & Sons. P. 126-131.
Reksohadiprodjo, M.S. (1994). Pusat Penelitian Obat Masa Kini. Cetakan Pertama. Jogyakarta. Gadjah Mada University Press. Hal : 66-69.
Sardjoko,. Apt, Drs. Prof. (1993). Rancangan Obat. Cetakan pertama. Yogyakarta. Penerbit Gadjah mada University Press. Hal : 158.
Siswandono dan Soekardjo, B. (1995). Kimia Medisinal. Surabaya. Airlangga University Press.
Sjamsudin, U., dan dewoto, H.R. (1995). Histamin dan Antialergi. Dalam Ian Tanu. Farmakologi Dan Terapi. Edisi keempat. Jakarta: UI Press. Hal: 256-258.
Sudjana. (2002). Metode Statistik. Edisi keenam. Bandung. Torsito. Hal. 168, 371. USP Pharmacopeia, (2008). The National Formulary. 31th Edition . The United
States Pharmacopeial Convention. Page.1765-1766, 3476-3477, 2137-2138.