AKTIVITAS DAN STABILITAS SUPEROKSIDA DISMUTASE
DARI EKSTRAK
Deinococcus radiodurans
YANG
DIIMOBILISASI PADA ZEOLIT ALAM SEBAGAI
BIOSENSOR ANTIOKSIDAN
WASKITHO AJI ATMADI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas dan Stabilitas Superoksida Dismutase dari ekstrak Deinococcus radiodurans yang Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Waskitho Aji Atmadi
ABSTRAK
WASKITHO AJI ATMADI. Aktivitas dan Stabilitas Superoksida Dismutase dari Ekstrak
Deinococcus radiodurans yang Diimobilisasi pada Zeolit Alam sebagai Biosensor
Antioksidan. Dibimbing oleh DYAH ISWANTINI PRADONO, NOVIK
NURHIDAYAT, dan DEDEN SAPRUDIN.
Imobilisasi superoksida dismutase (SOD) dari ekstrak Deinococcus radiodurans
telah dipelajari. D. radiodurans merupakan bakteri yang memiliki enzim Mn-SOD. Kondisi optimum aktivitas antioksidan SOD dari ekstraknya adalah suhu 31 °C, pH 9, dan zeolit 157 mg. Penentuan konstanta Michaelis-Menten berdasarkan metode Lineweaver-Burk, Eadie-Hoofstee, dan Hanes. Nilai KMapp SOD dari ekstrak D.
radiodurans yang diimobilisasi pada zeolit lebih rendah dibandingkan tanpa
diimobilisasi. Elektrode yang dibuat stabil hingga 22 jam. Aktivitas antioksidan yang menggunakan zeolit sebagai matriks imobilisasi lebih tinggi dibandingkan tanpa imobilisasi. Aktivitas antioksidan pada elektrode dengan penggunaan zeolit pada jam ke-22 sebesar 64.0%, sedangkan stabilitas elektrode tanpa zeolit pada waktu yang sama hanya 49.3%. SOD dari D. radiodurans memiliki potensi sebagai biosensor antioksidan karena menunjukkan aktivitas antioksidan yang tinggi, tetapi masih memiliki stabilitas rendah.
Kata kunci: biosensor antioksidan, Deinococcus radiodurans, superoksida dismutase, zeolit alam
ABSTRACT
WASKITHO AJI ATMADI. Superoxide Dismutase Activity and Stability of
Deinococcus radiodurans Extract Immobilized on Natural Zeolites as Antioxidant
Biosensor. Supervised by DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, and DEDEN SAPRUDIN.
Immobilization of superoxide dismutase (SOD) from extract of Deinococcus
radiodurans have been studied. D. radiodurans is a bacteria having an enzyme Mn-SOD.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
AKTIVITAS DAN STABILITAS SUPEROKSIDA DISMUTASE
DARI EKSTRAK
Deinococcus radiodurans
YANG
DIIMOBILISASI PADA ZEOLIT ALAM SEBAGAI
BIOSENSOR ANTIOKSIDAN
WASKITHO AJI ATMADI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas dan Stabilitas Superoksida Dismutase dari Ekstrak
Deinococcus radiodurans yang Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan
Nama : Waskitho Aji Atmadi NIM : G44090033
Disetujui oleh
Novik Nurhidayat, PhD Pembimbing II
Dr Deden Saprudin, MSi Pembimbing III
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 ini ialah biosensor, dengan judul Aktivitas dan Stabilitas Superoksida Dismutase dari ekstrak
Deinococcus radiodurans yang Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan.
Terima kasih penulis ucapkan kepada Prof Dr Dyah Iswantini Pradono, MAgr, Dr Novik Nurhidayat, dan Bapak Deden Saprudin, MSi selaku pembimbing yang telah memberi bimbingan dan saran. Penulis juga mengucapkan terima kasih kepada Mbak Ratih dan Pak Acun atas bimbingan dan diskusinya selama penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Tak lupa disampaikan ucapan terima kasih kepada teman-teman seperjuangan, Fahrul Kamal, Lilla Budiman, Mbak Imas, Kak Dinie dan Kak Royhan atas segala dorongan dan semangat bagi penulis untuk menyelesaikan karya ilmiah ini. Semoga Allah SWT dapat membalas kebaikan semua. Amin.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode Penelitian 3
HASIL DAN PEMBAHASAN 5
Sel dan Ekstrak Protein Sitoplasma D. radiodurans 5
Karakterisasi Elektrode Pasta Karbon 6
Optimasi Aktivitas Ekstrak Protein D. radiodurans 6 Linearitas dan Aktivitas Antioksidan Ekstrak D.radiodurans 9 Kinetika enzimatis SOD dari ekstrak D. radiourans 10 Stabilitas Biosensor Antioksidan Berbasis SOD dari Ekstrak D. radiodurans 12
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Nilai parameter kinetika enzim ekstrak D. radiodurans 12
DAFTAR GAMBAR
1 Voltamogram siklik K3Fe(CN)6 dengan menggunakan elektroda pasta
karbon 6
2 Voltamogram Siklik pada suhu 36 °C. bufer fosfat pH 7.8, dan zeolit
204 mg 8
3 Plot kontur SOD dari ekstrak D. radiourans dengan penambahan
zeolit 9
4 Hubungan antara konsentrasi xantina dan aktivitas ekstrak
D. radiodurans 10 5 Linieritas antara konsentrasi xantina dan aktivitas ekstrak
D. radiodurans 10
6 Plot Lineweaver-Burk ekstrak D. Radiodurans 11
7 Plot Eadie-Hofstee ekstrak D. radiodurans 11 8 Plot Hanes ekstrak D. radiodurans 11 9 Kurva stabilitas biosensor antioksidan berbasis SOD dari ekstrak D.
radiodurans 13
DAFTAR LAMPIRAN
1 Bagan alir penelitian 17
2 Optimasi zeolit, suhu, pH dan arus yang dihasilkan 18 3 Analisis kinetika SOD dalam ekstrak D. radiodurans yang
diimobilisasi pada zeolit 19
4 Analisis kinetika SOD dalam ekstrak D. radiodurans tanpa zeolit 20 5 Stabilitas biosensor antioksidan berbasis SOD dari ekstrak D.
PENDAHULUAN
Perkembangan teknologi yang maju meningkatkan laju pembentukan radikal bebas. Radikal bebas dihasilkan dari polusi air dan udara, makanan yang mengandung pengawet, asap rokok, dan bahan kimia berbahaya. Radikal bebas memiliki elektron yang tidak berpasangan, sehingga akan mencari elektron dari sel-sel di dalam tubuh yang sehat. Hal ini akan merusak sel-sel dan menimbulkan penyakit seperti kanker, tekanan darah tinggi, jantung koroner, katarak, penuaan dini, dan kerusakan protein dan DNA (Rahmat et al. 2003; Shivashankara et al.
2004; Ozyurt et al. 2006). Untuk mengatasi radikal bebas dapat digunakan antioksidan.
Penggunaan antioksidan tidak hanya di bidang kesehatan, tetapi juga di bidang pangan. Beberapa metode yang dapat digunakan untuk mengukur kapasitas antioksidan seperti spektrofotometri, fluoresens, Oxygen Radical Absorbance Capacity (ORAC), dan OXY-adsorben (Bonanni et al. 2007). Metode-metode pengukuran tersebut memerlukan preparasi sampel yang rumit dan peralatan yang mahal. Biosensor antioksidan dapat menjadi metode alternatif pengukuran dalam menentukan kapasitas antioksidan.
Pengukuran antioksidan menggunakan metode elektrokimia tidak memerlukan preparasi yang rumit seperti metode spektrofotometri dan juga tidak dipengaruhi oleh cahaya. Biosensor juga bersifat sensitif dan dapat digunakan untuk mengukur kapasitas antioksidan yang konsentrasinya rendah. Biosensor juga dapat mengukur dengan cepat dan biayanya rendah, tidak seperti metode fluorometri yang biayanya sangat mahal. Eduardo et al. (2011) telah mengukur okratoksin dari kacang tanah menggunakan biosensor PHBR (peroxidases obtained from Brassica napus hairy roots) dan menghasilkan kestabilan, kinerja, kelinearan, keterulangan, serta limit deteksi yang baik. Pengukuran kapasitas antioksidan pada sampel yang kompleks menggunakan biosensor tidak memerlukan pemisahan komponen terlebih dahulu (Mello dan Kubota 2007).
Biosensor telah terbukti dapat mengukur kapasitas antioksidan pada minyak zaitun (Coban 2008), anggur merah dan anggur putih (Campanella et al. 2004), dan teh (Gil 2011). Pengukuran kapasitas antioksidan anggur merah dan anggur putih yang dilakukan oleh Campanella et al. (2004) menunjukkan metode biosensor superoksida dismutase (SOD) lebih sensitif dibandingkan dengan metode fluorometri dan spektrofotometri. Penelitian yang dilakukan oleh Safrizal (2011) membuat biosensor berbasis SOD dan menunjukkan linearitas yang baik dengan nilai r = 0.9761 dan R² = 95.28%.
2
Metode yang dapat digunakan untuk menjaga kestabilan enzim dan menghasilkan kerja yang maksimum adalah dengan melakukan imobilisasi pada suatu matriks. Esumi et al. (2003) membuat biosensor antioksidan yang terimobilisasi pada nanopartikel emas dengan kitosan dan menunjukkan stablitas yang baik. Shumyantseva et al. (2005) juga menggunakan nanopartikel emas dan terbukti meningkatkan sensitivitas biosensor kolesterol. Mello et al. (2005) mengukur antioksidan dengan menggunakan biosensor DNA- peroksidase yang diimobilisasi pada permukaan silika-titanium. Penelitian Akyilmaz et al. (2006) menunjukkan stabilitas yang baik hingga 14 hari pada biosensor lisin oksidase yang diimobilisasi ke gelatin.
Bahan lain yang berpotensi sebagai matriks imobilisasi adalah zeolit (Prodromidis dan Karayannis 2002). Zeolit memiliki pori-pori dan tahan pada suhu tinggi serta pelarut organik sehingga enzim akan lebih stabil di dalamnya. Dai et al. (2004) mengimobilisasi sitokrom c pada zeolit NaY, dan spektrum yang dihasilkan memperlihatkan bahwa partikel zeolit NaY tidak merusak struktur dan lingkungan enzim. Mukhopadhyay et al. (2003) menggunakan nanopartikel emas pada amina yang terfungsionalisasi pada zeolit Na-Y untuk mengimobilisasi pepsin dan menghasilkan aktivitas katalitik yang baik, di atas 7 kali penggunaan kembali. Balal et al. (2009) menggunakan nanopartikel berupa zeolit termodifikasi FeCl3 pada elektrode pasta karbon (EPC) sebagai biosensor untuk mengukur dopamina dan triptopan. Arus yang dihasilkan lebih tinggi EPC dengan mediator FeCl3 dibandingkan tanpa penambahan zeolit. Gia (2012) melakukan imobilisasi enzim pada zeolit dan aktivitas glukosa dehidrogenase (GDH) pada biosensor glukosa meningkat berdasarkan nilai Imaks-nya. Liyonawati (2012) juga telah menggunakan zeolit sebagai matriks untuk mengimobilisasi ekstrak protein
Esecherichia coli dan menghasilkan hasil yang lebih baik pada biosensor antioksidan. Weniarti (2011) juga melaporkan bahwa penggunaan zeolit sebagai matriks imobilisasi ekstrak D. radiodurans meningkatkan aktivitasnya dalam biosensor antioksidan. Namun, aktivitas dan stabilitas dari biosensor masih perlu ditingkatkan agar penggunaan biosensor dapat digunakan dalam jangka waktu yang lama. Oleh karena itu, pada penelitian ini akan dibuat biosensor antioksidan berbasis SOD dari bakteri D. radiodurans yang diimobilisasi pada zeolit dan mengoptimasi campuran zeolit dengan enzim, pH, dan suhu dalam pembuatan elektroda untuk lebih meningkatkan aktivitas dan stabilitasnya.
METODE
Bahan dan Alat
3 zeolit alam Bayah, xantin oksidase (XO), xantina, dimetil sulfoksida (DMSO), bufer fosfat, HCl 3 M, AgNO3, membran dialisis, jaring nilon, dan parafilm.
Metode Penelitian
Penelitian ini terdiri atas beberapa tahap percobaan, yaitu pembuatan elektrode, penumbuhan sel Deinococus radiodurans dan ekstraksi SOD, imobilisasi enzim, optimasi aktivitas antioksidan ekstrak Deinococcus radiodurans, linearitas biosensor, dan stabilitas biosensor. Bagan alir penelitian secara umum dilampirkan pada Lampiran 1.
Penumbuhan sel Deinococcus radiodurans dan ekstraksi protein sitoplasma D. radiodurans
Bakteri ditumbuhkan pada media LB miring selama 24 jam dalam inkubator bersuhu 37 °C. Bakteri yang telah tumbuh dipindahkan ke media LB cair 50 mL sebagai starter dan diinkubasi selama 2 x 24 jam. Bakteri kemudian diinokulasi ke dalam 250 mL media LB cair dan diinkubasi kembali selama 2 x 24 jam. Sel bakteri dipanen dengan cara disentrifugasi dengan kecepatan 7000 rpm selama 10 menit. Setelah itu, sel bakteri disuspensikan kembali dalam larutan bufer fosfat pH 7.5.
Untuk mendapatkan ekstrak kasar bakteri, suspensi biomassa sel bakteri disonikasi dengan penghomogen ultrasonik dengan pulse 50% dan output 5, dengan interval 2 x 10 menit. Sel bakteri yang telah disonikasi kemudian disentrifugasi kembali dengan kecepatan 10.000 rpm selama 30 menit. Ekstrak kasar bakteri diukur konsentrasinya dengan menggunakan spektrofotometer pada panjang gelombang 260 nm dan 280 nm.
Pembuatan Elektrode Pasta Karbon Termodifikasi Ferosena
Sebanyak 3 mg ferosena dilarutkan dalam 1 mL DMSO dan ke dalam larutan tersebut ditambahkan 100 mg grafit. Campuran didiamkan selama 2 jam kemudian pelarut diuapkan menggunakan pengering vakum sehingga diperoleh grafit termodifikasi mediator ferosena. Grafit kemudian dicampur dengan 35 μL parafin cair hingga membentuk pasta. Pasta karbon kemudian dimasukkan ke dalam badan elektrode hingga padat sampai permukaan. Permukaan elektroda dihaluskan dan dibersihkan dengan amplas dan kertas minyak (Trivadila 2011).
Aktivasi Zeolit
4
Setelah pH netral dan bebas klorin, zeolit dikeringkan pada suhu 300 °C selama 3 jam. Zeolit kemudian dihaluskan dan diayak dengan ayakan 100 mesh (Arif 2011).
Optimasi Aktivitas SOD dari Bakteri D. Radiodurans Terimobilisasi
Parameter yang dioptimasi meliputi suhu (20-40 0C), pH (7-11), dan konsentrasi zeolit (25-250 mg). Metode permukaan respon (RSM) dengan mode
central composite digunakan untuk pengoptimuman aktivitas SOD, dengan cara memasukkan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistika Minitab 15. Selanjutnya percobaan dilakukan sesuai dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas optimumnya.
Imobilisasi Ekstrak D. radiodurans
Sebanyak 30 mg zeolit Bayah dicampur dengan 10 mL akuades dengan alat vorteks sehingga membentuk suspensi 3 mg/mL. Sebanyak 20 µL ekstrak
Deinococcus radiodurans dalam bufer fosfat pH 7.5 dicampur dengan 10 µL suspensi zeolit tersebut dan didiamkan selama 10 menit. Sebanyak 10 µL campuran diteteskan pada permukaan elektrode, didiamkan hingga pelarutnya menguap, dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektroea dapat langsung digunakan untuk pengukuran aktivitas antioksidan ekstrak D. radiodurans dengan metode voltammetri siklik. Elektrode direndam dalam bufer fosfat pH 7.5 pada suhu 4 °C ketika tidak digunakan untuk memberikan keadaan yang sama dengan lingkungan sebenarnya (Dai et al. 2004).
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan metode voltametri siklik dengan menggunakan eDAQ potensiostat–Galvanostat yang dilengkapi perangkat lunak Echem v2.1.0. Elektrode Ag/AgCl digunakan sebagai elektrode rujukan, platina sebagai counter, dan EPC dan zeolit sebagai elektrode kerja. Parameter pengukuran dibuat sebagai berikut:
Mode : Cyclic
5 diamati sebagai blangko. Selanjutnya ditambahkan 1 mL larutan xantina 2.1 mM dan perubahan atau kenaikan puncak arus anode yang terjadi diukur.
Pengukuran Aktivitas dan Linearitas SOD
Uji aktivitas dilakukan dengan metode voltametri siklik dengan menggunakan konsentrasi substrat xantina 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, dan 1.0 mM sehingga dihasilkan hubungan linear antara arus dengan konsentrasi. Linearitas ditentukan sebagai koefisien relasi r pada persamaan regresi linier y = a
+ bx.
Penentuan Stabilitas Elektrode
Penentuan stabilitas elektrode ditentukan dari pengukuran aktivitas ekstrak sel D. radiodurans terimobilisasi pada konsentrasi xantina 2.1 mM. Nilai aktivitas yang diperoleh pada pengukuran awal dianggap 100%. Aktivitas diukur ulang setiap selang waktutertentu untuk menentukan aktivitas yang tersisa.
Aktivitas D. radiodurans (%) =
x 100%
HASIL DAN PEMBAHASAN
Sel dan Ekstrak Protein Sitoplasma D. radiodurans
D. radiodurans merupakan bakteri gram positif dan termasuk dalam keluarga Deinococcales. Bakteri ini bersifat nonmotil, berespirasi secara aerob, metabolism kemoorganotropik, dan memproduksi katalase. Bakteri ini juga
resistan terhadap radiasi ultraviolet, ionisasi, desikasi, dan spesi oksigen reaktif (ROS) karena memiliki enzim Mn-SOD dan katalase yang merupakan sistem antioksidan.
Proses diawali dengan menempatkan D. radiodurans dalam media LB, yaitu
campuran tripton, NaCl, dan ekstrak khamir (2:1:1). Media ini berfungsi sebagai vitamin, mineral, dan nutrisi bagi pertumbuhan D. radiodurans. Setelah 2 x 24 jam inkubasi, isolat dipindahkan ke dalam media LB yang lebih besar untuk peremajaan. Selanjutnya, bakteri dipisahkan dengan cara disentrifugasi pada kecepatan 7000 rpm. Bakteri lalu disuspensikan kembali menggunakan bufer fosfat dengan pH 9.
6
Karakterisasi Elektrode Pasta Karbon
Voltammetri siklik merupakan salah satu teknik elektrokimia dengan prinsip mengukur perubahan arus akibat reaksi redoks. Dalam voltammetri, potensial yang diberikan dapat diatur sesuai dengan kebutuhan. Kelebihan teknik ini adalah sensitivitasnya yang tinggi, limit deteksi yang rendah, dan daerah linier yang lebar (Mulyani 2012). Sinyal berupa potensial diaplikasikan pada elektrode kerja, mengubah potensialnya relatif terhadap potensial tetap dari elektrode rujukan. Arus yang dihasilkan antara elektrode kerja dan pembantu diukur (Harvey 2000).
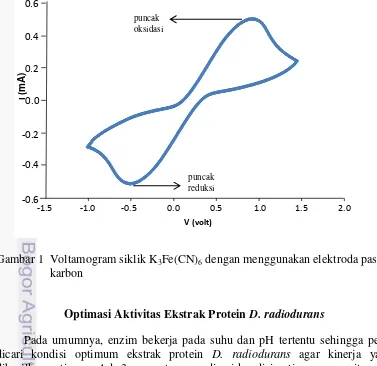
Voltammetri siklik bekerja dengan cara memberikan range potensial pada analat yang menyebabkan terjadinya arus akibat adanya elektron dari reaksi redoks analat. EPC yang telah dibuat dikarakterisasi menggunakan larutan K3Fe(CN)6. Pada Gambar 1, terlihat puncak oksidasi akibat oksidasi larutan [Fe(CN)6]4- menjadi [Fe(CN)6]3- dengan arus oksidasi sebesar 0.3667 mA. Pada voltamogram juga muncul puncak reduksi akibat larutan [Fe(CN)6]3- tereduksi menjadi [Fe(CN)6]4-. EPC yang menghasilkan puncak oksidasi dan reduksi selanjutnya digunakan untuk pengukuran sebagai biosensor.
Gambar 1 Voltamogram siklik K3Fe(CN)6 dengan menggunakan elektroda pasta karbon
Optimasi Aktivitas Ekstrak Protein D. radiodurans
Pada umumnya, enzim bekerja pada suhu dan pH tertentu sehingga perlu dicari kondisi optimum ekstrak protein D. radiodurans agar kinerja yang dihasilkan optimum. Ada 3 parameter yang dicari kondisi optimumnya, yaitu suhu (20-40 °C), pH (7-9), dan zeolit (25-250 mg). Ketiga parameter dianalisis menggunakan RSM pada perangkat lunak Minitab dan dihasilkan 20 kombinasi (Lampiran 2).
I (
mA
)
V (volt)
-1.5 0.6
0.4
0.2
0.0
-0.2
-0.4
-0.6
-1.0 -0.5 0.0 0.5 1.0 1.5 2.0
puncak oksidasi
7 Aktivitas SOD D. radiodurans ditentukan dengan menggunakan metode voltammetri siklik. Pengukuran dilakukan dengan mengukur bufer fosfat dengan berbagai variasi pH, lalu ditambahkan ferosena (hasil pengukuran sebagai blangko), XO, dan xantina. Pada Gambar 2, voltamogram dari bufer fosfat menunjukkan adanya puncak oksidasi dengan arus 0.57 µA. Hal ini terjadi karena diduga adanya oksigen terlarut pada bufer fosfat yang dapat mengalami reaksi redoks sehingga mengahasilkan puncak-puncak oksigen (Mulyani 2012). Penambahan ferosena menyebabkan puncak oksidasi dan reduksi meningkat menjadi 0.99 µA. Ini terjadi karena ferosena menghasilkan puncak oksidasi dan reduksi (Trivadila 2011). Penambahan XO dan xantina akan menimbulkan reaksi enzimatis XO dengan xantina yang menghasilkan radikal bebas superoksida dengan reaksi:
xantina + H
2O + O2 XO
asam urat + 2H+ + 2O2•−
(Antiochia et al. 2012)
Radikal superoksida yang dihasilkan akan bereaksi dengan enzim SOD yang diimobilisasi pada zeolit di permukaan elektrode. Reaksi yang terjadi adalah dismutasi, dimana radikal bebas akan bereaksi dengan radikal bebas yang lain. Satu radikal superoksida akan teroksidasi menjadi oksigen, dan radikal lain tereduksi menjadi hidrogen peroksida (Kohen and Nyska 2002). Reaksi yang terjadi melibatkan pertukaran elektron sehingga menghasilkan arus oksidasi dan reduksi. Elektron ini akan dideteksi oleh elektrode pada transduser kimia yang selanjutnya diubah menjadi arus. Arus yang dihasilkan sebanding dengan konsentrasi SOD. Arus oksidasi yang dihasilkan sebesar 2.91 µA. Arus ini dikurangi dengan arus blanko dan menghasilkan arus sebesar 1.92 µA yang merupakan hasil reaksi enzimatis radikal superoksida dengan SOD.
2O2
•−
+ 2H+SOD O2 + H2O2
(Wang et al. 2012) Arus yang dihasilkan dari 20 kombinasi merupakan respon dari ketiga parameter yang selanjutnya akan dicari kondisi optimumnya menggunakan
Response Optimizer pada Minitab. Kondisi optimum aktivitas SOD dari D. radiodurans adalah suhu 30 °C, pH 9, dan zeolit 157 mg. Hasil ini tidak jauh berbeda dari Weniarti (2011) yang mengimobilisasi SOD dari D. radiodurans
8
Gambar 2 Voltamogram Siklik pada suhu 36 °C. bufer fosfat pH 7.8, dan zeolit 204 mg
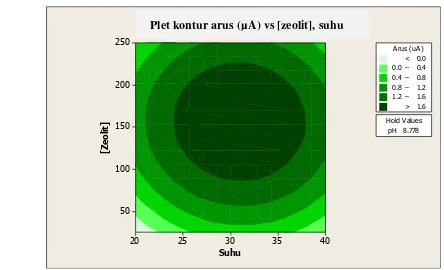
Gambar 3 menunjukkan plot kontur ketiga parameter dengan respon berupa arus. Dari kontur dapat dilihat bahwa peningkatan suhu, pH, dan zeolit pada awalnya meningkatkan arus, namun arus turun pada kondisi tertentu. Ini disebabkan karena enzim bekerja optimum pada suhu dan pH tertentu. Suhu yang terlalu tinggi dapat menyebabkan enzim terdenaturasi sehingga rusak, sedangkan suhu yang rendah dapat menyebabkan enzim tidak dapat bekerja dengan optimum. Begitu juga dengan pH yang terlalu tinggi atau terlalu rendah dapat menyebabkan penurunan kinerja enzim yang berakibat pada penurunan arus. Penggunaan zeolit yang terlalu banyak dapat menyebabkan sulitnya interaksi antara substrat dengan enzim karena terhalangi oleh partikel-partikel zeolit sehingga arus menjadi turun. Penggunaan zeolit yang terlalu sedikit juga akan memberikan respon arus yang kecil.
Contour Plot of Arus (uA) vs Suhu, pH
pH
Contour Plot of Arus (uA) vs [Zeolit], pH
I (
9
Contour Plot of Arus (uA) vs [Zeolit], Suhu
Gambar 3 Plot kontur SOD dari ekstrak D. radiourans dengan penambahan zeolit
Linearitas dan Aktivitas Antioksidan Ekstrak D.radiodurans
Linearitas dan aktivitas ekstrak D. radiodurans dilakukan pada konsentrasi xantina 0.1-1.0 mM (rentang 0.1 mM) pada kondisi optimum (suhu 30 °C, pH 9, dan zeolit 157 mg). Ada 2 elektroda yang digunakan, yaitu SOD ekstrak D. radiourans yang terimobilisasi pada zeolit dan diteteskan pada elektrode dan SOD ekstrak D. radiourans yang diteteskan langsung pada elektrode tanpa diimobilisasi terlebih dahulu pada zeolit. Gambar 4 menunjukkan hubungan antara konsentrasi substrat dengan aktivitas ekstrak D. radiodurans. Arus meningkat dengan bertambahnya konsentrasi substrat. Namun, pada konsentrasi 0.9 dan 1.0 arus menurun untuk kedua elektroda. Hal ini terjadi karena pada konsentrasi rendah, tapak aktif pada enzim masih belum terikat semua sehingga peningkatan konsentrasi substrat hingga konsentrasi 0.8 mM akan mengikat semua tapak aktif enzim yang menyebabkan peningkatan pembentukan hidrogen peroksida dan oksigen dan arus terdeteksi semakin besar.
Gambar 5 menunjukkan linieritas dari kedua elektroda pada rentang konsentrasi 0.1-0.8 mM. Rentang linier yang dihasilkan lebih pendek dibandingkan biosensor superoksida yang dibuat oleh Campanella et al. (2004) dengan nilai 0.02-2 mM. Regresi linier yang dihasilkan oleh ekstrak D. radiodurans yang diimobilisasi pada zeolit adalah R²= 0.9914 dan lebih besar dibandingkan ekstrak D. radiodurans tanpa penambahan zeolit dengan R²= 0.9546. Selain itu, aktivitas ekstrak D. radiodurans dengan penambahan zeolit lebih besar dibandingkan tanpa penambahan zeolit. Hal ini menunjukkan bahwa zeolit sebagai matriks imobilisasi dapat meningkatkan arus puncak oksidasi.
Pada penelitian Varvari et al. (2010), arus yang dihasilkan dari biosensor G/Os-HRP (graphite electrode with Ospolymer wired horseradish peroxidase) dengan mendeteksi H2O2 adalah 0.9 µA pada konsentrasi xantina 0.41 mM. Arus yang dihasilkan lebih kecil dibandingkan arus yang dihasilkan pada percobaan dengan menggunakan zeolit dan tanpa menggunakan zeolit berturut-turut yaitu 1.68 µA (Lampiran 3) dan 1.46 µA (Lampiran 4). Hal ini menunjukkan bahwa penggunaan ekstrak D. radiodurans sebagai biosensor menghasilkan aktivitas yang lebih baik dibandingkan biosensor G/Os-HRP pada penelitian Varvari.
10
Gambar 4 Hubungan antara konsentrasi xantina dan aktivitas ekstrak D. radiodurans
Gambar 5 Linearitas antara konsentrasi xantina dan aktivitas ekstrak D. radiodurans
Kinetika enzimatis SOD dari ekstrak D. radiourans
Untuk melihat kespesifikan dari ekstrak D. radiodurans maka perlu ditentukan parameternya, yaitu konstanta Michaelis-Menten nyata (KM app) dan laju
reaksi maksimum nyata (Vmaks app) yang dianalogikan sebagai arus maksimum nyata
(Imaks app). Parameter ini ditentukan dengan 3 metode, yaitu Lineweaver-Burk,
Eadie-Hoofstee, dan Hanes (Lampiran 3 dan Lampiran 4). Kinetika Lineweaver-Burk merupakan hubungan 1/[xantina] dengan 1/arus (Gambar 6), kinetika Eadie-Hofstee merupakan hubungan arus/[xantina] dengan arus (Gambar 7), dan kinetika Hanes merupakan hubungan [xantina] dengan [xantina]/arus (Gambar 8).
11
Gambar 6 Plot Lineweaver-Burk ekstrak D. radiodurans
Gambar 7 Plot Eadie-Hofstee ekstrak D. radiodurans
Gambar 8 Plot Hanes ekstrak D. Radiodurans
0.0000 2.0000 4.0000 6.0000 8.0000 10.0000 12.0000
1/I (
-1.0000 1.0000 3.0000 5.0000 7.0000 9.0000
12
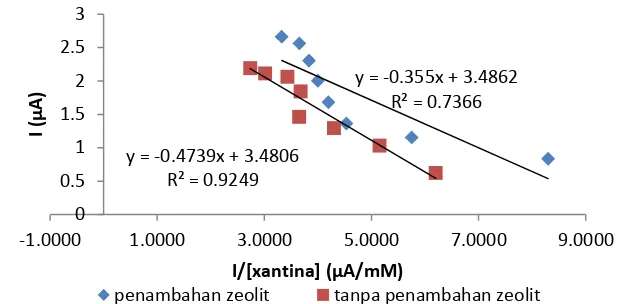
Berdasarkan Tabel 1, nilai KMapp ekstrak D. radiodurans dengan penambahan zeolit sebagai matriks imobilisasi lebih kecil dibandingkan KMapp ekstrak D. radiodurans tanpa penambahan zeolit. Ini menunjukkan bahwa afinitas SOD pada ekstrak D. radiodurans yangdiimobilisasi pada zeolit terhadap radikal superoksida lebih besar dibandingkan SOD pada ekstrak D. radiodurans tanpa penambahan zeolit. Hal ini menunjukkan enzim yang diimobilisasi pada zeolit mengikat substrat dengan kuat. Nilai Imaks app menunjukkan aktivitas dari enzim. Semakin besar nilai Imaks app, semakin besar aktivitas yang dihasilkan.
Nilai KMapp SOD D. radiodurans pada percobaan berdasarkan metode Lineweaver-Burk adalah 0.3011 dan tidak jauh berbeda dengan nilai KMapp SOD murni yang dilakukan oleh Trivadila (2011), yaitu 0.3694. Selain itu, nilai R2 pada Plot Lineweaver-Burk lebih besar dibandingkan Eadie-Hoofstee dan Hanes sehingga kinetika enzimatis mengikuti persamaan Lineweaver-Burk. Nilai KMapp yang dihasilkan oleh biosensor G/Os-HRP pada penelitian Varvari et al. (2010) dalam mendeteksi H2O2 adalah 0.24. Nilai ini lebih kecil dibandingkan KMapp yang dihasilkan pada penelitian. Perbedaan nilai terjadi karena perbedaan enzim dan analat yang digunakan.
Tabel 1 Nilai parameter kinetika enzim ekstrak D. radiodurans
Stabilitas Biosensor Antioksidan Berbasis SOD dari Ekstrak D. radiodurans
Kestabilan dan ketahanan enzim merupakan kriteria yang penting dalam biosensor. Enzim yang diekstrak dari mikrob mempunyai kestabilan yang rendah sehingga diperlukan metode untuk mengikat enzim ke permukaan sensor atau matriks (Roy et al. 2005). Imobilisasi enzim pada suatu matriks akan membuat stabilitas meningkat (Prodromidis dan Karayannis 2002) dan enzim dapat digunakan kembali (Weniarti 2011). Nadifiyine et al. (2013) melakukan imobilisasi enzim tirosinase pada albumin-glutaraldehida dan menghasilkan aktivitas hingga 70 % setelah 53 hari. Junior dan Rebelo (2008) juga mengimobilisasi enzim laccase pada matriks membran polietersulfon dan menghasilkan aktivitas 71.4 % setelah 24 hari penyimpanan. Hal yang sama juga dilakukan oleh Akyilmaz et al. (2006) untuk meningkatkan kestabilan biosensor dengan mengimobilisasi lisin oksidase pada gelatin. Aktivitas yang ditunjukkan masih sebesar 60 % setelah 14 hari.
Biosensor SOD yang dibuat menggunakan zeolit sebagai matriks imobilisasi. Enzim diimobilisasi ke dalam zeolit dengan metode adsorbsi, yaitu enzim terikat hanya secara fisik sehingga tidak merubah struktur dan fungsidari enzim. Gambar 9 menunjukkan bahwa penggunaan zeolit sebagai matriks imobilisasi meningkatkan kestabilan dari biosensor. Ini karena enzim terlindungi dari pengaruh luar oleh zeolit, seperti suhu dan pH sehingga dapat meminimalisir Metode Penambahan zeolit Tanpa penambahan zeolit
Imaks app KMapp Imaks app KMapp
Lineweaver-Burk 3.1696 0.3011 3.3456 0.4446
Eadie-Hofstee 3.4862 0.3550 3.4806 0.4739
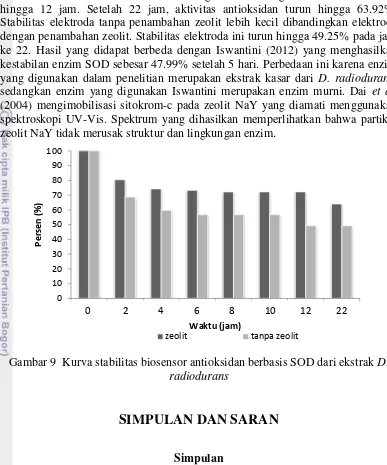
13 kerusakan enzim. Stabilitas elektroda dengan zeolit sebagai matriks relatif stabil hingga 12 jam. Setelah 22 jam, aktivitas antioksidan turun hingga 63.92%. Stabilitas elektroda tanpa penambahan zeolit lebih kecil dibandingkan elektroda dengan penambahan zeolit. Stabilitas elektroda ini turun hingga 49.25% pada jam ke 22. Hasil yang didapat berbeda dengan Iswantini (2012) yang menghasilkan kestabilan enzim SOD sebesar 47.99% setelah 5 hari. Perbedaan ini karena enzim yang digunakan dalam penelitian merupakan ekstrak kasar dari D. radiodurans, sedangkan enzim yang digunakan Iswantini merupakan enzim murni. Dai et al.
(2004) mengimobilisasi sitokrom-c pada zeolit NaY yang diamati menggunakan spektroskopi UV-Vis. Spektrum yang dihasilkan memperlihatkan bahwa partikel zeolit NaY tidak merusak struktur dan lingkungan enzim.
Gambar 9 Kurva stabilitas biosensor antioksidan berbasis SOD dari ekstrak D. radiodurans
SIMPULAN DAN SARAN
Simpulan
Superoksida dismutase dari ekstrak D. radiodurans yang diimobilisasi pada zeolit alam Bayah memiliki aktivitas yang lebih tinggi dibandingkan tanpa diimobilisasi pada zeolit. Nilai KM app SOD dari ekstrak D. radiodurans yang diimobilisasi pada zeolit Bayah lebih kecil dibandingkan tanpa imobilisasi. Hal ini menunjukkan SOD dari ekstrak D. radiodurans mengikat substrat lebih kuat dibandingkan tanpa imobilisasi. Penggunaan zeolit sebagai matriks imobilisasi meningkatkan aktivitas dan stabilitas dari biosensor.
Saran
Perlu dilakukan penelitian lanjutan untuk melihat sifat-sifat analitik seperti sensitivitas, limit deteksi, perolehan kembali (recovery), keterulangan
14
(repeatibility), reproducibility dan ketelitian (Precission). Selain itu, perlu dilakukan pengujian penggunaan matriks imobilisasi lain selain zeolit untuk meningkatkan stabilitas biosensor.
DAFTAR PUSTAKA
Akyilmaz E, Erdogan A, Ozturk R, Yasa I. 2006. Sensitive determination of L-lysine with a new amperometric biosensor based on saccharomyces cerevisiae yeast cells. J Biosen Bioelect.
Antiochia R, Movassaghi K, Lipone P, Campanella L. 2012. Determination of the antioxidant capacity of different types of bread and flour using a superoxide dismutase biosensor. J Chem. 6: 199-208.
Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bahan media pendeteksi. [tesis]. Bogor: FMIPA, IPB.
Balal K, Mohammad H, Bahareh , Ali B.M.H, Mozhgan Z. 2009. Zeolite nanoparticle modified carbon paste electrode as a biosensor for simultaneous determination of dopamine and tryptophan. J Chin Chem. 56: 789-796.
Bonanni A, Campanella L, Gatta T, Gregori E, Tomassetti M. 2007. Evaluation of the antioxidant and prooxidant properties of several commercial dry spices by different analytical methods. Food Chem. 102: 751-758.
Campanella L, Bonnani A, Tommaseti M. 2004. Biosensors for determination of total and natural antioxidant capacity of red and white wines: comparison with
other spectrophotometric and fluorimetric methods. J Biosen Bioelect. 19: 641–
651.
Coban S. 2008. Development of biosensors for determination of the total antioxidant capacity. [thesis]. Izmir: Department of Chemical Engineering, Izmir Institute of Technology.
Dai Z, Liu S, Ju H. 2004. Direct electron transfer of cytochrome c immobilized on a NaY zeolite matrix and its application in biosensing. Electro Acta. 49: 2139– 2144.
Eduardo A. Ramírez, Adrián M. Granero, María A. Zón and Héctor Fernández. 2011. Development of an amperometric biosensor based on peroxidases from Brassica. J Biosens Bioelectron. S3:001.
Esumi K, Takei N & Yoshimura T. 2003. Antioxidant-potentiality of gold– chitosan nanocomposites. Colloids and Surfaces B: Biointerfaces. 32(2): 117– 125.
Gia LL. 2012. Aktivitas dan stabilitas biosensor glukosa berbasis Escherichia coli
yang diimobilisasi pada zeolit-glutaraldehida..[skripsi]. Bogor: Program Sarjana, Institut Pertanian Bogor.
Gil DM de Albuquerque. 2011. Biosensor evaluation of the antioxidant activity of wines and teas, interference studies and comparison with other methods. [thesis]. Lisbon: Chemical/Biochemical Department, Lisbon University. Harvey D. 2000. Modern Analytical Chemistry. Singapore: Mc-Graw Hill.
15 dan stabilitas. Di dalam: Dahlan K, Mulijani S, Nugrahani EH, Suryani, Kurnia A, June T, Miftahudin,Charlena, Sianturi P, Wijaya SH, Sumaryada TI, Nurcholis W, Indahwati, Kusnanto A, editor. Sains sebagai Landasan Inovasi dalam Bidang Energi, Lingkungan dan Pertanian Berkelanjutan. Seminar Nasional Sains V; 10 November 2012; Bogor, Indonesia. Bogor (ID). Hlm 562-570.
Kohen Ron, Nyska Abraham. 2002. Oxidation of biological system: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification. Toxicologic Pathology. 30(6): 620–650.
Liyonawati. 2012. Aktivitas dan stabilitas superoksida dismutase dari ekstrak
Escherichia coli diimobilisasi pada zeolit alam sebagai biosensor antioksidan. [skripsi].Bogor: Program Sarjana, Institut Pertanian Bogor.
Mateo C, Palomo J M, Fernandez-Lorente G. 2007. Improvement of enzyme activity, stability, and selectivity via immobilization techniques. Enzyme and Microbial Technology. 40: 1451-1463.
Mello LD, Alves AA, Macedo DV, Kubota LT. 2005. Peroxidase-based biosensor as a tool for fast evaluation of antioxidant capacity of tea. Food Chem. 92: 515-519.
Mello LD, Kubota LT. 2007. Review biosensors as a tool for the antioxidant status evaluation. Talanta. 72: 335–348.
Mulyani R, Buchari, Noviandri Indra, Ciptati. 2012. Studi voltametri siklikk sodium dedocyl benzen sulfonat dalam berbagai elektroda dan elektrolit pendukung. Journal of Waste Management Technology. 15(1).
Mukhopadhyay K, Phadtare S, Vinod VP, Kumar A, Rao M, Chaudhari RV, and Sastry M. 2003. Gold nanoparticles assembled on amine-functionalized Na−Y zeolite: a biocompatible surface for enzyme immobilization. Langmuir. 19 (9): 3858-3863.
Nadifiyine S, Calas-Blanchard C, Amine A, Marty JL. 202. Tyrosinase biosensor used for the determination of catechin derivatives in tea: correlation with HPLC/DAD method. Food and Nutrition Science. 4: 108-118.
Ningrum LG. 2011. Aktivitas ekstrak protein Mn-superoksida dismutase
Deinococcus radiodurans yang diimobilisasi pada permukaan pasta karbon sebagai biosensor antioksidan. [skripsi]. Bogor: Departemen Kimia, Institut Pertanian Bogor.
Ozyurt D, Demirata B, Apak R. 2006. Determination of total antioxidant capacity by a new spectrophotometric method based on Ce(IV) reducing capacity measurement. Talanta. 24: 273-282.
Prodromidis MI, Karayannis MI. (2002). Enzyme based amperometric biosensor for food analysis. Electroanalysis. 14(4).
Rahmat, A, Kumar, V., Fong, L. M., Endrini, S. dan Sani, H. A. 2003. Determination of total antioxidant activity in three types of local vegetables shoots and the cytotoxic effect of their ethanolic extracts against different cancer cell lines. Asia Pasific J Clin Nutr. 12(3): 292-295.
16
Safrizal BT. 2011. Penentuan konsentrasi optimum superoksida dismutase, linearitas, dan stabilitas biosensor antioksidan menggunakan elektrode pasta karbon. [skripsi]. Bogor: Departemen Kimia, Institut Pertanian Bogor.
Seatovic S, Gligic L, Radulovic Z, Jacikov RM. 2004. Purification and partial characterization of SOD from thermophilic bacteria Thermotherix sp. J Serb Chem Soc. 96: 9-16.
Shivashankara, K. S., Isobe, Seiichiro., Al-Haq, M. I., Takenaka, Makiko dan Shina, Takeo. 2004. Fruit Antioxidant Activity, Ascorbic Acid, Total Phenol, Quercetin, and Carotene of Irwin Mango Fruits Stored at Low Temperature after High Electric Field Pretreatment. J Agric Food Chem 52: 1281-1286. Shumyantseva, V.V; Carrara, S; Bavastrello, V; Riley, D.J; Bulko, T.V; Skryabin,
K.G; Archakov, A.I. & Nicolini, C. 2005. Direct electron transfer between cytochrome P450scc and gold nanoparticles on screen-printed rhodium– graphite electrodes. Biosensors and Bioelectronics. 21: 217–22.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococus radiodurans diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Varvari L, Lates V, Popescu Ionel C. 2011. Determination of antioxidant capacity using xanthine-xanthine oxidase system coupled with H2O2 amperometric biosensor. Rev Roum Chim. 56(7). 735-742.
Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase
17 Lampiran 1 Bagan alir penelitian
Penumbuhan dan reremajaan
Deinococcus radiodurans
Ekstraksi Protein Deinococcus radiodurans
Imobilisasi ekstrak Deinococcus radiodurans pada zeolit
Aktivasi zeolit
Zeolit teraktivasi
Zeolit terimobilisasi ekstrak Deinococcus radiodurans diteteskan pada elektroda
Pengukuran dengan metode voltametri siklik
Optimasi elektrode yang terimobilisasi SOD ekstrak Deinococcus radiodurans
dan zeolit alam Bayah
Penentuan linearitas dan stabilitas elektroda
e
18
Lampiran 2 Optimasi zeolit, suhu, pH dan arus yang dihasilkan No Zeolit (mg) Suhu (°C) pH I (µA)
1 25.0 30 9 0.69
2 70.6 24 7.8 0.72
3 70.6 24 10.1 0.53
4 70.6 36 7.8 0.92
5 70.6 36 10.1 0.96
6 137.5 20 9.0 0.87
7 137.5 30 7.0 0.4
8 137.5 30 9.0 2.7
9 137.5 30 9.0 1.73
10 137.5 30 9.0 1.52
11 137.5 30 9.0 2.14
12 137.5 30 9.0 1.52
13 137.5 30 9.0 2.13
14 137.5 30 11.0 0.65
15 137.5 40 9.0 0.96
16 204.0 24 7.8 1.55
17 204.0 24 10.1 0.84
18 204.0 36 7.8 1.92
19 204.0 36 10.1 0.99
19 Lampiran 3 Analisis kinetika SOD dalam ekstrak D. radiodurans yang
20
21 Lampiran 5 Stabilitas biosensor antioksidan berbasis SOD dari ekstrak D.
radiodurans pada suhu 30°C
Waktu (jam) Zeolit Tanpa zeolit
Arus Persen (%) Arus Persen (%)
0 0.97 100 0.67 100.0
2 0.78 80.4 0.46 68.6
4 0.72 74.2 0.40 59.7
6 0.71 73.2 0.38 56.7
8 0.70 72.2 0.38 56.7
10 0.70 72.2 0.38 56.7
12 0.70 72.2 0.33 49.3
22
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 11 Juni 1991 dari pasangan Ipiet Bientoro dan Dyah Palupi. Penulis merupakan anak ketiga dari empat bersaudara. Tahun 2009, penulis lulus dari SMA Negeri 89 Jakarta dan pada tahun yang sama
diterima di Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum pada mata kuliah Kimia Tingkat Persiapan Bersama (TPB) pada tahun 2011-2013 dan Kimia Fisik pada tahun 2012-2013. Penulis juga aktif sebagai pengajar Kimia Dasar di bimbingan belajar Katalis pada tahun 2011-2012. Penulis pernah melaksanakan praktik lapangan dari Juli-Agustus 2012 di PT. Pertamina dengan
judul “Pengujian Surfaktan dalam Pemanfaatan sebagai Bahan Enhanced Oil