1
DETEKSI TRANSMISI VAKSIN DNA ANTI-KHV PADA
BAKTERI DI MEDIA BUDIDAYA IKAN MAS
DINDA JANUARI CIPTA
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
i
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Deteksi Transmisi
Vaksin DNA Anti-KHV pada Bakteri di Media Budidaya Ikan Mas” adalah benar
karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dan karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Dinda Januari Cipta
ABSTRAK
DINDA JANUARI CIPTA. Deteksi Transmisi Vaksin DNA Anti-KHV pada
Bakteri di Media Budidaya Ikan Mas. Dibimbing oleh SRI NURYATI dan ALIMUDDIN.
KHV merupakan penyakit menular yang menyerang ikan mas dalam berbagai stadia, dapat mengakibatkan kematian 80-100%. Salah satu cara penanggulangan serangan KHV adalah dengan penggunaan vaksin DNA. Vaksin DNA merupakan produk rekayasa genetika yang dikhawatirkan dapat melakukan transmisi pada bakteri di perairan dan mempengaruhi keragaman hayati. Penelitian ini bertujuan untuk mendeteksi transmisi vaksin DNA anti-KHV ke bakteri di air pemeliharaan ikan mas. Vaksinasi dilakukan menggunakan metode perendaman, dan pemberian melalui pakan. Bakteri dari air vaksinasi melalui perendaman dan akuarium pemeliharaan ikan mas diisolasi pada 6 jam, hari ke-4, dan hari ke-7 pascavaksinasi, sedangkan bakteri dari kolam diisolasi setelah 6 jam, hari ke-4 dan hari ke-7 ikan dipelihara di kolam. Bakteri tersebut disebar sebanyak 50 µL pada media kultur mengandung ampisilin (50 µg/µL). Bakteri yang tumbuh pada media TSA yang mengandung ampisilin sebanyak 103 bakteri dan yang teridentifikasi hingga tingkat spesies dengan menggunakank kit API ada 11 bakteri, yakni 2 Aeromonas hydrophila, 4 Bacillus cereus, 2 B. subtilis, 2
Staphylococcus auricularis dan 1 Enterobacter sakazakii. Keberadaan vaksin DNA dalam bakteri diuji menggunakan metode cracking, dan PCR. Hasil
cracking menunjukkan tidak adanya bakteri yang mengandung vaksin DNA anti-KHV. Analisis bakteri dengan metode PCR menunjukkan bahwa bakteri tidak dapat meng-uptake atau mengambil vaksin DNA anti-KHV dari lingkungan, sehingga dapat disimpulkan bahwa vaksin DNA anti-KHV tidak ditransmisikan ke bakteri media pemeliharaan ikan mas.
i
ABSTRACT
DINDA JANUARI CIPTA. Detection of Anti-KHV DNA Vaccine Transmission toward Bacteria in Common Carp Cultivation Media. Supervised by SRI NURYATI and ALIMUDDIN.
KHV is an infectious disease that attacks common carp in various stadia and causing 80-100% of death. One of ways to prevent KHV infection is by using DNA vaccine. DNA vaccine is a genetically modified product that was feared to be transmitted to bacteria and affects genetic diversity. This research was performed to detect of anti-KHV DNA vaccine transmission into bacteria of common carp rearing water. Vaccination was conducted by dipping and oral vaccination methods. Bacteria from dipping vaccination and aquaria were isolated on 6 hours, 4th day, and 7th day post vaccination while bacteria from pond were isolated on 6 hours, 4th day and 7th day after fish were reared in pond. Bacteria as many as 50 µL were spread in triptic soy agar containing ampicilline (50 µg/µL). Bacteria that grow in the TSA contain ampisilin were 103 bacteria and the amount of bacteria that identified to species level by using API kit were 11 bacteria; 2 colonies were identified as Aeromonas hydrophila, 4 colonies were identified as Bacillus cereus, 2 colonies were identified as Bacillus subtilis, 2 colonies were identified as Staphylococcus auricularis dan 1 colony was identified as Enterobacter sakazakii. The existence of DNA vaccine in the bacteria was tested by using cracking and PCR methods. The results of cracking
indicated the absence of bacteria containing anti-KHV DNA vaccine. Analysis of bacteria by PCR method showed that the bacteria could not uptake anti-KHV DNA vaccine from the environment, so the conclusion was anti-KHV DNA vaccine did not transmitted to bacteria in common carp rearing water.
DETEKSI TRANSMISI VAKSIN DNA ANTI-KHV PADA
BAKTERI DI MEDIA BUDIDAYA IKAN MAS
DINDA JANUARI CIPTA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Budidaya Perairan
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat serta hidayah-Nya sehingga penyusunan skripsi yang
berjudul “Deteksi Transmisi Vaksin DNA Anti-KHV pada Bakteri Media Budidaya Ikan Mas” ini dapat diselesaikan. Skripsi disusun dalam rangka memenuhi salah satu syarat untuk menyelesaikan studi di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian dilaksanakan pada bulan September 2014 hingga Mei 2015 di Laboratorium Kesehatan Ikan, dan Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan dan penyusunan skripsi ini, terutama kepada:
1. Dr. Sri Nuryati SPi MSi selaku dosen Pembimbing Skripsi I dan Pembimbing Akademik
2. Dr. Alimuddin SPi MSc selaku dosen Pembimbing Skripsi II 3. Ir. Iis Diatin MM selaku Penguji Sidang Skripsi.
4. Dr. Ir. Mia Setyawati MSi selaku wakil Ketua Program Studi.
5. Bapak H. Harinto dan Ibu Hj. Siti Subaria, SAp selaku orang tua penulis atas segala bentuk dukungan yang diberikan pada penulis baik dukungan moril maupun finansial. Putri Harisstyaningtias, SKm selaku kakak penulis dan Anugerah Syarif Maulana selaku adik penulis atas dukungan dalam proses penelitian hingga penyelesaian skripsi.
6. Bapak Ranta selaku laboran pada Laboratorium Kesehatan Ikan, Rangga Garnama, SPi dan Hasan Nasrullah SPi dari Laboratorium Reproduksi dan Genetika Organisme Akuatik, dan Abe selaku laboran Laboratorium Lingkungan Akuakultur atas nasihat dan segala bantuan dalam penyelesaian skripsi ini.
7. Dosen dan staf BDP yang tidak dapat disebutkan satu per satu, yang telah banyak memberikan bantuan dalam menyelesaikan kuliah di IPB.
8. Dendi Skom atas dukungan, doa, dan waktunya.
9. Teman-teman Program Alih Jenis BDP yang memberikan motivasi dan semangat terutama selama penelitian terutama Dian Novita Sari Amd, Ratih Fauziatin Hazana AMd, Rosi Sulistiani AMd dan Tetty Innesia Hutapea AMd. 10. Rekan-rekan „LKI Warriors‟ atas kebersamaannya terutama Asep Akmal
Aonullah, SPi, Yanti Inneke Nababan SPi, dan Dendi Hidayatullah SPi yang telah banyak membantu selama penelitian di Laboratorium Kesehatan Ikan. 11. Orang-orang terdekat penulis yang namanya tidak dapat disebutkan satu per
satu atas dukungan dan doa yang diberikan sehingga penulis dapat menyelesaikan skripsi ini tepat pada waktunya.
Demikian skripsi ini disusun, semoga bermanfaat.
Bogor, September 2015
DAFTAR ISI
Wadah Vaksinasi dengan Metode Perendaman (PM) ... 2
Akuarium Pemeliharaan (PP) ... 2
Wadah Vaksinasi dengan Metode Oral (O) ... 2
Kolam Pemeliharaan (H) ... 2
Isolasi Bakteri... 2
Rancangan Penelitian ... 3
Parameter Pengamatan ... 3
Identifikasi Bakteri ... 3
Pewarnaan Gram ... 4
Uji Sitokrom Oksidase ... 4
Uji Katalase... 4
Uji Oksidatif/Fermentatif ... 4
Uji Motilitas ... 4
Uji Kit API ... 5
Analisis Vaksin DNA pada Isolat Bakteri ... 5
Isolasi DNA Bakteri dengan Metode Cracking ... 5
Analisis DNA Vaksin dengan Metode Polymerase Chain Reaction (PCR) .... 5
Analisis data ... 6
HASIL ... 6
Identifikasi bakteri ... 6
Uji transmisi vaksin DNA anti-KHV ... 8
Pembahasan ... 9
KESIMPULAN ... 11
DAFTAR PUSTAKA ... 11
LAMPIRAN ... 14
DAFTAR TABEL
1. Rancangan penelitian dengan isolasi bakteri ... 3 2. Jumlah bakteri dari sumber berbeda yang tumbuh dalam media TSA
mengandung ampisilin ... 6 3. Karakteristik isolat bakteri dari air pascavaksinasi melalui perendaman
dan oral, serta pemeliharaan benih ikan mas di akuarium dan kolam. ... 7 4. Bakteri isolat dari air pascavaksinasi melalui perendaman dan oral, serta
pemeliharaan benih ikan mas diidentifikasi menggunakan kit API dan
API web ... 8
DAFTAR GAMBAR
1. Rentang waktu dilakukannya vaksinasi ... 3 2. Elektroforegram hasil uji cracking bakteri isolat dari air pascavaksinasi
melalui perendaman dan oral, serta pemeliharaan benih ikan mas. ... 9 3. Elektroforegram (a) produk PCR dengan DNA template GP 25 dari isolat
bakteri yang diambil dari air pascavaksinasi melalui perendaman, oral, dan pemeliharaan benih ikan mas, (b) produk PCR dengan primer 16s rRNA. ... 9
DAFTAR LAMPIRAN
1. Skema proses isolasi bakteri pada penelitian deteksi vaksin DNA anti-KHV pada bakteri media budidaya ikan mas ... 14 2. Metode identifikasi bakteri dalam penelitian deteksi vaksin DNA anti-KHV
pada bakteri media budidaya ikan mas ... 14 3. Gambar koloni dan hasil pewarnaan Gram air isolat pascavaksinasi media
pemeliharaan ikan mas melalui perendaman, oral, dan air kolam
pemeliharaan pada media TSA mengandung ampisilin ... 15 4. Hasil uji biokimia ... 17 5. Hasil identifikasi bakteri secara biokimia di air media pemeliharaan ikan mas
yang telah diberi vaksin DNA anti-KHV menggunakan metode perendaman pada media TSA mengandung ampisilin ... 18 6. Hasil identifikasi bakteri secara biokimia di air media pemeliharaan ikan mas
7. Hasil identifikasi bakteri secara biokimia di air kolam pemeliharaan ikan mas yang telah diberi vaksin DNA anti-KHV menggunakan metode perendaman
dan oral pada media TSA mengandung ampisilin ... 22
8. Hasil cracking ... 23
9. Hasil PCR ... 24
1
PENDAHULUAN
Latar Belakang
Koi herpesvirus (KHV) merupakan penyakit sangat menular pada ikan mas yang mulai merebak pada akhir tahun 1990-an (Omori & Adams 2011). KHV pertama kali dilaporkan di Indonesia pada tahun 2002 di Blitar, Jawa Timur (Sunarto et al. 2005; Nuryati et al. 2010a). KHV menyerang pada berbagai stadia ikan mas dan dapat mengakibatkan kematian 80%-100% pada kisaran suhu air 16-25 C (Haenen et al. 2004).
Alternatif penggunaan bahan kimia dan antibiotik untuk mencegah infeksi penyakit KHV dalam budidaya ikan mas adalah vaksin DNA. Selain mudah disimpan dan dibawa serta lebih murah dibandingkan dengan vaksin konvensional, vaksin DNA sangat stabil bahkan pada suhu ruang (Kumalagurubaran & Kaliaperumal 2013). Vaksin DNA juga memiliki capaian yang relatif tinggi dalam merangsang kekebalan spesifik dan kekebalan yang timbul relatif tinggi (Nuryati et al. 2010a). Vaksin DNA anti-KHV telah dikembangkan oleh Nuryati et al. (2010a) menggunakan gen glikoprotein KHV ORF 25 (GP 25) yang disisipkan ke dalam plasmid dan ditransformasikan ke dalam Escherichia coli. GP25 bersifat imunogenik dan ekspresinya dapat meningkatkan kekebalan ikan mas terhadap infeksi KHV (Nuryati et al. 2010b). Kelangsungan hidup ikan mas yang diberi vaksin DNA GP25 dengan dosis 12,5 µg/100 µL melalui injeksi, dan ditantang selama 30 hari dapat mencapai 96,67% (Nuryati et al. 2010b).
Vaksin DNA anti-KHV merupakan produk rekayasa genetik yang dikhawatirkan dapat melakukan transmisi dengan bakteri di perairan dan mempengaruhi keragaman hayati, terutama jika bertransmisi ke bakteri dalam media budidaya. Informasi mengenai potensi transmisi vaksin DNA anti-KHV GP25 terhadap bakteri masih terbatas, sehingga diperlukan adanya penelitian untuk menguji potensi transmisi vaksin DNA pada bakteri dalam air perendaman dan pemeliharaan ikan mas yang divaksin melalui pakan.
Tujuan
2
METODE
Pengambilan Sampel
Wadah Vaksinasi dengan Metode Perendaman (PM)
Vaksinasi dilakukan pada ikan mas varietas Majalaya berumur 30 hari pascatetas yang diperoleh dari Balai Besar Perikanan Budidaya Air Tawar Sukabumi. Ikan mas direndam dalam 500 mL air mengandung 5 mL bakteri
Escherichia coli pembawa vaksin DNA anti-KHV (kepadatan 108 CFU/mL). Perendaman dilakukan selama 30 menit dalam kantong plastik diberi oksigen (volume oksigen dan air 3:1). Setelah itu, air vaksinasi perendaman dalam kantong plastik tersebut diambil dan dijadikan sebagai sumber isolat bakteri PM. Pengambilan sampel juga dilakukan pada hari ke-4 dan hari ke-7.
Akuarium Pemeliharaan (PP)
Langkah selanjutnya, ikan yang telah divaksinasi dikembalikan ke akuarium. Akuarium yang digunakan berukuran 100x45x45 cm3 dengan tinggi air saat pemeliharaan 35 cm yang telah disterilisasi dengan klorin dosis 3 ppm dan didiamkan selama 1 hari, kemudian dibilas. Ikan yang telah berada dalam akuarium tersebut didiamkan selama 6 jam. Kemudian air diambil dari akuarium sebagai sumber isolat PP. Ikan dipelihara selama 30 hari, dan diberi pakan cacing sutera at satiation. Pengambilan sampel juga dilakukan pada hari ke-4 dan hari ke-7.
Wadah Vaksinasi dengan Metode Oral (O)
Benih umur 60 hari pascatetas, divaksinasi dengan metode oral melalui pakan (komersial Fengli F1000, kadar protein 39– 41%). Cara pencampuran bakteri ke pakan mengikuti metode Nuryati et al. (2013). Pada vaksinasi oral, air diambil setelah 6 jam, hari ke-4 dan hari ke-7 pascavaksinasi sebagai sumber dipindahkan dari akuarium ke kolam sebagai sumber isolat H.
Isolasi Bakteri
3
dilihat pada Gambar 1 dan skema proses isolasi bakteri dapat dilihat pada Lampiran 1.
Gambar 1 Rentang waktu dilakukannya vaksinasi
Rancangan Penelitian
Penelitian dilakukan dengan menganalisis dan mengidentifikasi bakteri (Lampiran 2) yang ada dalam air pascavaksinasi menggunakan vaksin DNA anti-KHV pada benih ikan mas. Vaksin DNA yang digunakan adalah vaksin DNA yang mengandung sisipan gen GP25. Penelitian ini menggunakan metode eksperimental dengan mengisolasi bakteri dari 4 sumber isolat yang berbeda (Tabel 1).
Tabel 1 Rancangan penelitian dengan isolasi bakteri
No. Kode Perlakuan
1 PM Air pascavaksinasi melalui perendaman di kantong plastik
2 PP Air pemeliharaan ikan mas yang telah divaksinasi melalui
perendaman
4
Pewarnaan Gram
Pewarnaan Gram dilakukan berdasarkan SNI (7303:2009). Isolat bakteri diambil menggunakan jarum Ose, kemudian digoreskan pada gelas preparat yang telah ditambahkan akuades. Goresan bakteri tersebut dipanaskan di atas api bunsen untuk melekatkan isolat bakteri pada gelas preparat. Setelah itu diteteskan pewarna Kristal violet dan didiamkan selama 1 menit. Kemudian gelas preparat dibilas dengan akuades dan dikeringanginkan. Langkah selanjutnya pewarna kalium iodida (iodin) diteteskan di atas gelas preparat, dibiarkan selama 1 menit, kemudian dibilas dan dikeringanginkan. Gelas preparat ditetesi dengan alkohol dan ditunggu selama 30 detik, kemudian dibilas dengan akuades dan dikeringanginkan. Kemudian gelas preparat diberi pewarna tandingan Safranin, dibiarkan selama 1 menit, dibilas, setelah kering preparat diamati di bawah mikroskop. Bakteri berwarna ungu merupakan bakteri Gram positif, sedangkan bakteri berwarna merah merupakan bakteri Gram negatif.
Uji Sitokrom Oksidase
Uji sitokrom oksidase dilakukan mengacu pada SNI (7303:2009) yang diawali dengan kertas cakram dibasahi dengan p-amino dimetil oxalate sebagai pereaksi oksidasi. Kemudian diambil sebanyak satu Ose isolat bakteri digoreskan di atas kertas cakram yang telah diberi pereaksi oksidasi. Perubahan warna kertas cakram diamati. Reaksi oksidase positif ditandai dengan munculnya warna biru keunguan pada goresan, sedangkan reaksi negatif bila tidak berubah warna.
Uji Katalase
Uji diawali dengan 3% hydrogen peroxide diteteskan pada slide, kemudian sebanyak 1 Ose bakteri dicampur pada larutan tersebut. Jika terbentuk gelembung karena terlepasnya oksigen berarti hasil tes adalah positif, sedangkan jika tidak terdapat gelembung maka hasilnya dinyatakan negatif.
Uji Oksidatif/Fermentatif (O/F)
Uji O/F dilakukan untuk mengetahui kemampuan bakteri untuk
memanfaatkan glukosa dalam keadaan aerob atau anaerob. Uji
oksidatif/fermentatif dilakukan mengacu pada SNI (7303:2009). Sebanyak 2 tabung berisi media O/F disiapkan. Isolat bakteri diambil sebanyak 1 Ose dan diinokulasi pada media OF dengan cara ditusukkan. Satu tabung diisi dengan parafin cair steril hingga ketinggian 1 cm di atas permukaan media O/F, sedangkan tabung lainnya tanpa parafin cair. Selanjutnya diinkubasi selama 24 jam untuk kemudian diamati perubahan warnanya. Reaksi fermentatif ditandai perubahan warna media pada tabung yang diisi parafin cair dari hijau menjadi kuning.
Uji Motilitas
5
Uji Kit API
Kit API digunakan setelah dilakukan uji biokimia. Penggunaan kit API diawali dengan mengambil seluruh koloni bakteri dengan menggunakan Ose lalu dimasukkan ke dalam 5 mL API Medium (dapat digunakan PBS atau NaCl). Api Medium tersebut kemudian dihomogenasi dengan vorteks. Langkah selanjutnya, bakteri yang sudah tercampur dengan PBS tersebut diambil dengan menggunakan mikropipet lalu dimasukkan ke dalam tiap-tiap tabung kit API hingga mencapai setengahnya, diisi penuh hanya pada tabung yang terdapat tanda siku. Pada tabung yang digarisbawahi maka ditambahkan dengan mineral oil. Kemudian diinkubasi selama 24-48 jam. Setelah diinkubasi, kit API ditambahkan dengan reagen. Setelah itu, bandingkan dengan gambar pada buku panduan, apabila sesuai maka diberi tanda( +) dan apabila tidak sesuai di beri tanda (-). Data berupa kode (+) dan (-) dimasukkan ke dalam API web (https://apiweb.biomerieux.com) untuk mengetahui hasil uji.
Analisis Vaksin DNA pada Isolat Bakteri
Isolasi DNA Bakteri dengan Metode Cracking
Metode cracking mengikuti prosedur Alimuddin et al. (2008). Cracking
atau pemecahan sel bakteri dilakukan untuk menguji apakah isolat bakteri yang
tumbuh mengandung vaksin DNA anti-KHV. Sample DNA hasil cracking
sebanyak 3 μL dicampurkan dengan 0,5 μL loading buffer, lalu dimasukkan ke dalam sumur yang terdapat dalam gel dengan menggunakan pipet mikro. Setelah
itu 3 μL marker DNA dimasukkan ke dalam sumur di dekat sumur sampel.
Marker yang digunakan adalah KAPA DNA ladder dengan kontrol positif berupa DNA anti-KHV. Bak elektroforesis ditutup dan listrik dialirkan dengan tegangan 200 Volt dan kuat arus 70 mA. Fragmen DNA akan bermigrasi dari kutub negatif ke positif. Setelah bromophenol blue bermigrasi sampai 3/4 bagian dari panjang
gel, aliran listrik dihentikan. Hasilnya difoto dengan kamera pada transiluminator yang dihubungkan langsung dengan komputer.
Analisis DNA Vaksin dengan Metode Polymerase Chain Reaction (PCR)
Amplifikasi DNA hasil isolasi dilakukan menggunakan mesin PCR. Tahap PCR diawali dengan pembuatan premix, yaitu campuran bahan pereaksi yang akan digunakan dalam proses PCR. Primer yang digunakan adalah primer spesifik
glikoprotein KHV yaitu FGP 5‟
-TTGTCGACATGACGGGTTGTGGGGTTTG-„3 dan RGP 5‟-TCAGCAAGGCGGCCTTCACGG-„3. Amplifikasi PCR dengan situs pengenalan KHV : pre-denaturasi pada suhu 95 °C selama tujuh menit; 45 siklus pada suhu 95 °C selama 30 detik, 64 °C selama 30 detik dan 72 °C selama 30 detik; serta satu siklus pada suhu 72 °C selama tujuh menit (Nuryati et al. 2013). Selain itu amplifikasi 16s rRNA ikan mas dilakukan sebagai kontrol
internal loading DNA. Primer yang digunakan adalah primer universal untuk
domain bakteri berupa forward primer63f (5‟-CAG GCC TAA CAC ATG CAA
6
Analisis data
Parameter yang diamati adalah ada atau tidaknya transmisi plasmid vaksin DNA anti-KHV (GP 25) terhadap bakteri dengan melihat pita DNA yang tervisualisasi melalui proses elektroforesis. Bakteri yang tumbuh pada media TSA yang ditambahkan dengan ampisilin diidentifikasi hingga tingkat genusnya. Data yang diperoleh dianalisis secara deskriptif dan ditampilkan menggunakan tabel dan gambar.
HASIL
Identifikasi bakteri
Pewarnaan Gram berfungsi sebagai pengelompokan awal dalam identifikasi bakteri. Melalui uji Gram juga dapat diketahui bentuk dari bakteri sumber, berkisar 12-16 isolat. Hasil identifikasi bakteri (103 isolat) disajikan pada Lampiran 5 – Lampiran 7.
Tabel 2 Jumlah bakteri dari sumber berbeda yang tumbuh dalam media TSA mengandung ampisilin 1. Air pascavaksinasi melalui perendaman (PM) 8 15 2. Air pemeliharaan ikan mas setelah vaksinasi melalui
Sampling koloni dilakukan untuk identifikasi berdasarkan kesamaan warna, bentuk dan elevasi koloni, uji oksidase, uji katalase, motilitas, dan O/F. Karakteristik bakteri isolat disajikan pada Tabel 3, dan hasil identifikasi dengan
7
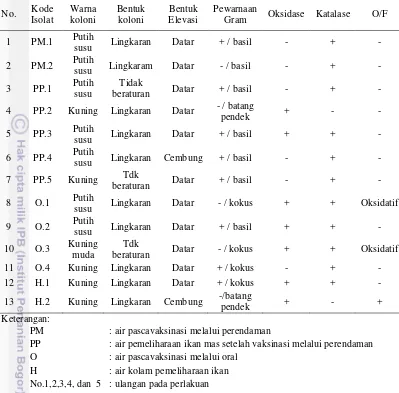
Tabel 3 Karakteristik isolat bakteri dari air pascavaksinasi melalui perendaman dan oral, serta pemeliharaan benih ikan mas di akuarium dan kolam.
No. Kode
PM : air pascavaksinasi melalui perendaman
PP : air pemeliharaan ikan mas setelah vaksinasi melalui perendaman
O : air pascavaksinasi melalui oral
H : air kolam pemeliharaan ikan
No.1,2,3,4, dan 5 : ulangan pada perlakuan
8
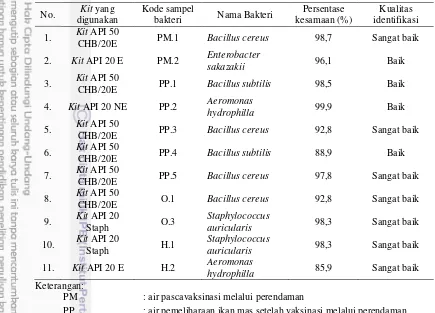
Tabel 4 Bakteri isolat dari air pascavaksinasi melalui perendaman dan oral, serta pemeliharaan benih ikan mas diidentifikasi menggunakan kit API dan API web
CHB/20E PM.1 Bacillus cereus 98,7 Sangat baik
2. Kit API 20 E PM.2 Enterobacter
sakazakii 96,1 Baik
3. Kit API 50
CHB/20E PP.1 Bacillus subtilis 98,5 Baik
4. Kit API 20 NE PP.2 Aeromonas
hydrophilla 99,9 Baik
5. Kit API 50
CHB/20E PP.3 Bacillus cereus 92,8 Sangat baik
6. Kit API 50
CHB/20E PP.4 Bacillus subtilis 88,9 Baik
7. Kit API 50
CHB/20E PP.5 Bacillus cereus 97,8 Sangat baik
8. Kit API 50
CHB/20E O.1 Bacillus cereus 92,8 Sangat baik
9. Kit API 20
Staph O.3
Staphylococcus
auricularis 98,3 Sangat baik
10. Kit API 20
Staph H.1
Staphylococcus
auricularis 98,3 Sangat baik
11. Kit API 20 E H.2 Aeromonas
hydrophilla 85,9 Sangat baik
Keterangan:
PM : air pascavaksinasi melalui perendaman
PP : air pemeliharaan ikan mas setelah vaksinasi melalui perendaman
O : air pascavaksinasi melalui oral
H : air kolam pemeliharaan ikan
No.1,2,3,4, dan 5 : ulangan pada perlakuan
Berdasarkan Tabel 4, ada 10 bakteri yang berhasil diidentifikasi dengan menggunakan kit API, yaitu 4 bakteri Bacillus cereus, 2 Bacillus subtilis, 2 bakteri Staphylococcus auricularis, 1 Enterobacter sakazakii dan 2 Aeromonas hydrophilla. Dua isolat bakteri, yaitu isolat O.2 dan O.4 merupakan golongan bakteri berbentuk kokus Gram negatif yang tidak ada produk kit API untuk mengujinya, sehingga digunakan uji biokimia saja.
Uji transmisi vaksin DNA anti-KHV
9
dengan menggunakan primer 16s rRNA sebagai kontrol internal. PCR bakteri dengan menggunakan primer 16s rRNA menunjukkan bahwa bakteri memang ada karena semua isolat memiliki produk PCR (Gambar 3b).
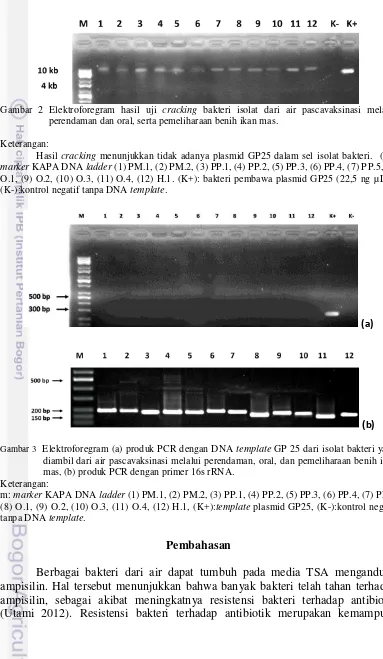
Gambar 2 Elektroforegram hasil uji cracking bakteri isolat dari air pascavaksinasi melalui perendaman dan oral, serta pemeliharaan benih ikan mas.
Keterangan:
Hasil cracking menunjukkan tidak adanya plasmid GP25 dalam sel isolat bakteri. (m):
marker KAPA DNA ladder (1) PM.1, (2) PM.2, (3) PP.1, (4) PP.2, (5) PP.3, (6) PP.4, (7) PP.5, (8) O.1, (9) O.2, (10) O.3, (11) O.4, (12) H.1. (K+): bakteri pembawa plasmid GP25 (22,5 ng µL-1), (K-):kontrol negatif tanpa DNA template.
(a)
(b)
Gambar 3 Elektroforegram (a) produk PCR dengan DNA template GP 25 dari isolat bakteri yang
diambil dari air pascavaksinasi melalui perendaman, oral, dan pemeliharaan benih ikan mas, (b) produk PCR dengan primer 16s rRNA.
Keterangan:
m: marker KAPA DNA ladder (1) PM.1, (2) PM.2, (3) PP.1, (4) PP.2, (5) PP.3, (6) PP.4, (7) PP.5, (8) O.1, (9) O.2, (10) O.3, (11) O.4, (12) H.1, (K+):template plasmid GP25, (K-):kontrol negatif tanpa DNA template.
Pembahasan
10
alami bakteri untuk mempertahankan diri terhadap antibiotik untuk melanjutkan hidup dalam media yang terdapat antibiotik. Salah satu penyebab terjadinya resistensi adalah evolusi vertikal atau mutasi dan seleksi. Evolusi vertikal didorong oleh prinsip seleksi alam. Mutasi spontan pada kromosom bakteri dapat menimbulkan resistensi pada suatu populasi bakteri. Bakteri yang bermutasi akan resisten, kemudian tumbuh dan berkembang biak (Kusuma 2010).
Resistensi bakteri terhadap ampisilin tersebut belum tentu menandakan bahwa bakteri tersebut pasti membawa plasmid penanda resisten ampisilin. Plasmid ini dapat mengarah ke vaksin DNA anti-KHV yang memang mengandung penanda resiten ampisilin. Bakteri yang diperoleh tersebut perlu dipecah (di-cracking) untuk membuktikan apakah bakteri tersebut membawa vaksin DNA anti-KHV yang berbentuk plasmid atau tidak. Berdasarkan hasil penelitian (Gambar 2) menunjukkan bahwa bakteri tersebut tidak mengandung plasmid yang seukuran dengan vaksin DNA anti-KHV. Namun, hal ini belum meyakinkan apakah genom DNA yang terlihat benar-benar tidak dapat meng-uptake vaksin. Sehingga perlu dibuktikan dengan PCR dengan primer GP 25. PCR juga dilakukan dengan primer 16s rRNA sebagai kontrol internal. Setelah dibuktikan dengan amplifikasi terhadap gen GP25 terbukti bahwa tidak terjadi amplifikasi gen GP25 (Gambar 3). Hal ini menunjukkan bahwa tidak terdapat template vaksin DNA anti-KHV pada semua isolat bakteri yang berhasil diisolasi.
Hasil uji cracking dan analisis PCR menunjukkan bahwa tidak ada bakteri
yang mengambil atau uptake vaksin DNA GP25 yang diberikan melalui
perendaman dan oral. Penelitian Nuryati et al. (2013) menyatakan gen GP25 tidak terdeteksi pada semua organ target karena diduga semua atau hampir semua plasmid DNA telah terpotong-potong oleh enzim restriksi endogenus. Hal ini diperkuat oleh pendapat Gillund et al. (2008) yang menjelaskan bahwa vaksin DNA yang diberikan ke ikan akan mengalami beberapa kemungkinan antara lain: DNA akan masuk (uptake) ke dalam sel yang ada di lokasi injeksi, DNA akan tertinggal di bagian luar sel (ekstraseluler), DNA akan didegradasi oleh enzim endonuklease di jaringan tempat injeksi, dan DNA terdistribusi melalui darah ke jaringan lain. Pada vaksinasi dengan metode lain, yaitu pemberian bersamaan dengan pakan dan perendaman, plasmid DNA yang masuk ke tubuh ikan akan masuk ke dalam sel, dan selebihnya akan didegradasi oleh enzim endonuklease (Tonheim et al. 2008).
Sisa vaksin yang tidak terserap tubuh ikan misalnya pada kasus vaksinasi melalui oral terjadi leaching dari pakan buatan (pelet) dapat tersebar ke dalam perairan ataupun bakteri yang terdapat di dalam air. Hal ini dikhawatirkan memungkinkan adanya transmisi pada bakteri yang ada di lingkungan budidaya. Johnson et al. (2014) menjelaskan bahwa transformasi bakteri secara alami pernah ditemukan pada bakteri Gram positif Streptococcus pneumoniae yang dianggap terjadi dengan proses paraseksual melibatkan 2 partner yaitu DNA eksogenus dan sel penerima. Internalisasi dari DNA eksogenus dan integrasi ke dalam sel penerima memungkinkan bakteri untuk memiliki sifat genetik baru dan beradaptasi dengan lingkungan, contohnya resisten terhadap antibiotik dan penggunaan vaksin. Namun, dibutuhkan waktu 10 tahun untuk mengubah dari transformasi buatan menjadi transformasi alami.
11
vaksin GP25 dengan dosis 12,5 μg/100 μl di media LB-Tripton yang telah ditambahkan ampisilin dan hasilnya tidak terjadi uptake.
Berkaitan dengan isolat bakteri yang diperoleh, berdasarkan uji fisiologi dan biokimia, diperoleh 4 golongan bakteri, yaitu bakteri batang pendek Gram negatif katalase negatif, bakteri basil Gram positif katalase positif, bakteri basil Gram negatif katalase positif, dan bakteri kokus Gram negatif katalase positif. Meskipun menurut SNI (2009) bakteri dinyatakan sebagai Aeromonas hydrophila
apabila memenuhi kriteria sebagai berikut: test pewarnaan Gram, hasil reaksi Gram negative, bentuk batang pendek; pada uji motilitas, hasil reaksinya motil; uji oksidasi dengan hasil reaksi positif oksidatif, namun hal ini belum dapat menetukan spesies dua bakteri lainnya, sehingga ketiga bakteri ini yang selanjutnya diuji menggunakan kit API dan API web untuk menentukan spesiesnya (Lampiran 10). Hasil menunjukkan bahwa bakteri basil Gram negatif katalase negatif yang diuji dengan kit API 20 NE merupakan Enterobacter sakazakii, bakteri batang pendek Gram negatif oksidase positif yang diuji dengan
kit API 20 NE merupakan Aeromonas hydrophilla, dan bakteri basil Gram negatif katalase positif yang diuji dengan kit API 50 CHB/E merupakan Bacillus cereus. Dua dari bakteri yang ditemukan tersebut telah dilaporkan sebagai bakteri resisten terhadap ampisilin yaitu Aeromonas hydrophilla (Dias et al. 2012) dan Bacillus cereus (Murray et al. 2007), sedangkan Enterobacter sakazakii dilaporkan sebagai bakteri rentan ampisilin (Njage et al. 2012; Dennison&Morris 2002; Hunter et al.
2008).
KESIMPULAN
Vaksin DNA anti-KHV yang diberikan melalui perendaman dan secara oral pada benih ikan mas tidak terdeteksi setelah dianalisis dengan PCR, tidak terjadi transmisi ke bakteri dalam media akuakultur. Hal ini membuktikan vaksin DNA aman terhadap lingkungan.
DAFTAR PUSTAKA
Allameh SK, Daud H, Yusoff M, Saad CS, Ideris A. 2012. Isolation, identification and characterization of Leuconostoc mesenteroides as a new probiotic from intestine of snakehead fish Channa striatus. African Journal of Biotechnology 11(16): 3810–3816.
Alimuddin, Octavera A, Arifin OZ, Sumantadinata K. 2008. Karakterisasi promoter β-actin from nile tilapia (Oreochromis niloticus). Jurnal Akuakultur Indonesia 7(2): 115 – 127
Aris M, Sukenda, Harris E, Sukadi MF, Yuhana M. 2013. Identifikasi molekular bakteri patogen dan desain primer PCR. Budidaya Perairan September
1(3): 43 – 50.
12
Dias C, Mota V , Murcia AM, Saavedra MJ. 2012. Antimicrobial Resistance Patterns of Aeromonas spp. Isolated from ornamental fish. Journal Aquaculture Research and Development 3(3): 1–4.
Gillund F, KjølbergKA, Krauss MKV, MyhrAI. 2008. Do uncertainty analyses reveal uncertainties? Using the introduction of DNA vaccines to aquaculture as a case. Science of The Total Environment407(1): 185–196. Haenen OLM, Way K, Bergmann SM, Ariel E. 2004. The emergence of koi
herpesvirus and its significance to European aquaculture. Bulletin of the European Association of Fish Pathologists 24: 293–307.
Hunter CJ, Petrosyan M, Ford HR, Prasadarao NV. Enterobacter sakazakii: an emerging pathogen in infants and neonates. Surgical Infections 9(5). Heppel J, Davis HL. 2000. Application of DNA vaccine technology to
aquaculture. Advanced Drug Delivery Reviews. 43(1): 29–43.
Johnston C. Martin B. Fichant G, Polard P, Claverys JP. 2014. Bacterial transformation: distribution, shared mechanisms and divergent control.
Nature Review: Microbiology. 12: 181 – 195.
Juliadiningtyas AD. 2013. Uji Potensi Transmisi Vaksin GP25 Pada Bakteri Flora Nermal Media Budidaya Ikan Mas Cyprinus carpio Secara In Vitro
[Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kumaragurubaran K, Kaliaperumal K. 2013. DNA vaccine: the miniature miracle.
Veterinary World 6(4): 228–232.
Kusuma S. 2010. Escherichia coli. [Makalah]. Bandung (ID): Universitas Padjadjaran.
Manik VT. 2013. Identifikasi dan Filogenetika Bakteri Aeromonas Spp. Isolat Air Kolam Beberapa Kota Berdasarkan Pada Sekuen Gen 16S rRNA. [Skripsi]. Bandung (ID): Universitas Pendidikan Indonesia.
Marchesi JR, Sato T, Andrew, Weightman, Tracey, Martin, Fry JC, Hiom SJ, Wade WG. 1998. Design and evaluation of useful bacterium-spesific PCR primers that amplify gene coding for bacterial 16S rRNA. Applied and Environmental Microbiology. 64(2): 795 – 799.
Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA. 2007. Manual of Clinical Microbiology (9th ed.) American Society of Microbiology Press. Njage PMK, Dolci S, Jans C, Wangoh J , Lacroix C and Meile L. 2012.
Ampicillin resistance and extended spectrum β- lactamases in Enterobacteriaceae isolated from raw and spontaneously fermented camel milk. African Journal of Microbiology Research 6(7): 1446-1452.
Nuryati S, Maswan NA, Alimuddin, Sukenda, Sumantadinata K, Pasaribu FH, Soejoedono RD, Santika, A. 2010a. Gambaran darah ikan mas setelah divaksinasi dengan vaksin DNA dan diuji tantang dengan koi herpesvirus.
Jurnal Akuakultur Indonesia 9 : 9-15.
Nuryati S, Alimuddin, Sukenda, Soejoedono RD, Santika A, Pasaribu FH, and Sumantadinata K. 2010b. Construction of a DNA vaccine using glycoprotein gene and its expression towards increasing survival rate of KHV-infected common carp Cyprinus carpio. Jurnal Natur Indonesia
13(1):47-52.
Nuryati S, Yuliyanti, Alimuddin. 2013. Frekuensi dan persistensi vaksin DNA penyandi GP25 yang diberikan melalui pakan buatan pada ikan mas
13
Omori R., Adams B. 2011. Disrupting seasonality to control disease outbreaks: The case of koi herpes virus. Journal of Theoretical Biology 271 : 159-165.
[SNI] Standar Nasional Indonesia. 2009. Metode identifikasi bakteri Aeromonas hydrophila secara biokimia. SNI 7303:2009.
Sunarto A, Rukyani A, Itami I. 2005. Indonesian experience on the outbreak of koi herpesvirus in koi and carp (Cyprinus carpio). Bulletin of Fisheries Research Agency, Yokohama, Japan. 86: 15-21.
Tonheim TC, BØgwald J, Dalmo RA. 2008. What happens to the DNA vaccine in fish? A review of current knowledge. Fish & Shellfish Immunology 25: 1-18.
14
LAMPIRAN
Lampiran 1 Skema proses isolasi bakteri pada penelitian deteksi vaksin DNA anti-KHV pada bakteri media budidaya ikan mas
15
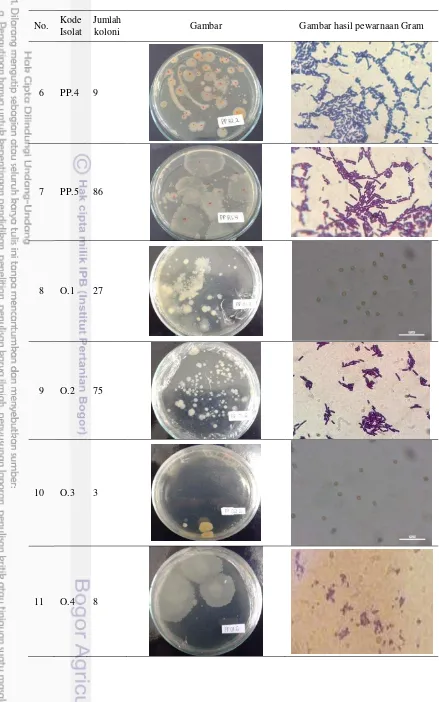
Lampiran 3 Gambar koloni dan hasil pewarnaan Gram air isolat pascavaksinasi media pemeliharaan ikan mas melalui perendaman, oral, dan air kolam pemeliharaan pada media TSA mengandung ampisilin
No. Kode Isolat
Jumlah
koloni Gambar Gambar hasil pewarnaan Gram
1 PM.
1 TBUD
2 PM.
2 TBUD
3 PP.1 TBUD
4 PP.2 25
16
No. Kode Isolat
Jumlah
koloni Gambar Gambar hasil pewarnaan Gram
6 PP.4 9
7 PP.5 86
8 O.1 27
9 O.2 75
10 O.3 3
17
No. Kode Isolat
Jumlah
koloni Gambar Gambar hasil pewarnaan Gram
12 H.1 2
13 H.2 19
Keterangan:
TBUD = Terlalu Banyak Untuk Dihitung
Lampiran 4 Hasil uji biokimia
Uji sitokrom oksidase, (a) hasil positif (b) negatif Uji katalase (a) hasil positif (b) negatif
Uji motilitas, hasil positif ditandai dengan tumbuhnya bakteri pada permukaan media
18
Lampiran 5 Hasil identifikasi bakteri secara biokimia di air media pemeliharaan ikan mas yang telah diberi vaksin DNA anti-KHV menggunakan metode perendaman pada media TSA mengandung ampisilin
No Kode Isolat Nomor Isolat Jumlah
Koloni
H1
Warna Koloni Bentuk Koloni Bentuk Elevasi
19
20
Lampiran 6 Hasil identifikasi bakteri secara biokimia di air media pemeliharaan ikan mas yang telah diberi vaksin DNA anti-KHV menggunakan metode oral pada media TSA mengandung ampisilin
No Kode Isolat Nomor
Isolat
Jumlah Koloni
H1
Warna Koloni Bentuk Koloni Bentuk Elevasi
21
22
Lampiran 7 Hasil identifikasi bakteri secara biokimia di air kolam pemeliharaan ikan mas yang telah diberi vaksin DNA anti-KHV menggunakan metode perendaman dan oral pada media TSA mengandung ampisilin
No Kode
Elevasi Pewarnaan Gram Uji C.Oxydase Katalase
1 T 6 Putih susu Lingkaran Datar - Cocus -
Pewarnaan Gram Uji C.Oxydase Katalase
23
Lampiran 8 Hasil cracking
Hasil cracking 13 – 27
Hasil cracking 28 – 42
Hasil cracking 43 – 57
Hasil cracking 58 – 72
24
Hasil cracking 88 – 99
Hasil cracking 100 – 103
Lampiran 9 Hasil PCR
Hasil PCR 13 – 22
Hasil PCR 23 – 37
Hasil PCR 38 – 52
25
Hasil PCR 68 – 79
Hasil PCR 80 – 94
Hasil PCR 95 - 103
Lampiran 10 Data hasil uji kit API pada API web Kode Sampel Hasil uji dengan API web
PM.1.62
26
Kode Sampel Hasil uji dengan API web
PP.4.41
PP.4.61
PP.7.21
27
PP.7.41
O.4.6
O.7.61
H.7.KN2
28
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 28 Januari 1992 dengan nama lengkap Dinda Januari Cipta. Penulis merupakan anak kedua dari pasangan Bapak H.Harinto dan Ibu Hj.Siti Subaria, S,Ap. Pendidikan formal yang telah ditempuh penulis adalah SMAN 99 Jakarta Timur dan lulus pada tahun 2010, selanjutnya pada tahun yang sama penulis diterima menjadi mahasiswa Program Diploma Institut Pertanian Bogor pada Program Keahlian Teknologi Produksi dan Manajemen Perikanan Budidaya, dan lulus pada tahun 2013. Penulis melanjutkan pendidikan Sarjana melalui Program Alih Jenis pada Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama masa studi, penulis pernah menjadi asisten praktikum mata kuliah Penyakit Organisme Akuatik di Laboratorium Kesehatan Ikan periode 2014/2015, dan mata kuliah Mikrobiologi Akuatik serta mata kuliah Teknik Pencegahan dan Pengobatan Penyakit Ikan di Program Diploma Institut Pertanian Bogor. Selain itu, penulis juga pernah mendapatkan penghargaan “The Best Presenter in Fish
Genetic International Journal Review” pada mata kuliah Dasar-dasar Genetika Ikan Departemen Budidaya Perairan IPB tahun ajaran 2013/2014. Pada tahun ajaran yang sama penulis mendapatkan juara 2 dalam lomba Tari Tradisional Pekan Olahraga dan Kesenian Fakultas Perikanan dan Ilmu Kelautan (PORIKAN) IPB. Penulis sempat menjadi panitia dalam kegiatan yang diselenggarakan oleh Himpunan Mahasiswa Akuakultur (HIMAKUA) yaitu pada acara Aquaculture Festival 2013 menjadi seksi publikasi, dan Aquacultute Festival 2014 di mana penulis menjadi seksi Humas sekaligus pembawa acaranya. Penulis juga menjadi pembawa acara dalam Olimpiade Mahasiswa IPB (OMI) tahun 2015.
Penulis telah beberapa kali melaksanakan magang mandiri, antara lain Teknik Pembenihan Ikan Hias di Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi pada tanggal 27 Juni – 8 Juli 2011, Produksi Pakan Alami di Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara pada tanggal 16 – 22 Januari 2012, Pembenihan Kakap Putih Lates calcarifer di Balai Besar Pengembangan Budidaya Laut Lampung pada tanggal 20 – 31 Januari 2014. Sebagai syarat untuk menyelesaikan studinya di Program Diploma Institut Pertanian Bogor, penulis melaksanakan Praktek Kerja Lapang pada tanggal 1 Februari – April 2013 yang berjudul “Pembenihan dan Pembesaran Ikan Gurami Osphronemus gouramy di Pusat Pelatihan Mandiri Kelautan dan Perikanan (P2MKP) Tunas Mina Terpadu Kecamatan Kemang Kabupaten Bogor, Jawa
Barat”
Tugas akhir dalam pendidikan tinggi sarjana diselesaikan oleh penulis
dengan menyusun skripsi yang berjudul “Deteksi Transmisi Vaksin DNA