i
KENDALI MUTU EKSTRAK TEMU IRENG BERKHASIAT
SEBAGAI ANTIOKSIDAN
SAIMA MEGA PUTRI MANURUNG
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Kendali Mutu Ekstrak Temuireng
Berkhasiat sebagai Antioksidan adalah karya saya dengan arahan dari pembimbing
dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2013
Saima Mega Putri Manurung
NIM
G44090028
i
ABSTRAK
SAIMA MEGA PUTRI MANURUNG. Kendali Mutu Ekstrak Temuireng Berkhasiat sebagai Antioksidan. Dibimbing oleh IRMANIDA BATUBARA dan LATIFAH K DARUSMAN.
Mutu tanaman obat perlu dikendalikan sebagai upaya menjamin khasiatnya. Teknik kromatografi lapis tipis digunakan pada penelitian ini. Temuireng diekstraksi menggunakan pelarut etanol, metanol, kloroform, dan n-heksana. Kandungan total fenol, flavonoid, dan kurkuminoid dari setiap ekstrak ditentukan dan dihubungkan dengan aktivitas antioksidan. Didapatkan korelasi yang kuat antara total fenol dan aktivitas antioksidan. Persamaan y= -0.744x + 3.522 dengan y=akar total fenol dan x=log IC50 dapat digunakan untuk menduga
aktivitas antioksidan sampel berdasarkan kandungan total fenol. Kromatogram yang memiliki aktivitas antioksidan yang baik terdiri dari setidaknya 12 spot pada panjang gelombang ultraviolet (UV) 254 nm dan 3 spot cerah pada lampu UV 366 yang merupakan kurkuminoid.
Kata kunci: antioksidan, kromatogram, temuireng, total fenol.
ABSTRACT
SAIMA MEGA PUTRI MANURUNG. Quality Control of Temuireng Extract as Antioxidant. Supervised by IRMANIDA BATUBARA and LATIFAH K DARUSMAN.
Control on herbal medicine is needed to guarantee its efficacy. Thin layer chromatography technique was used in this study. Temuireng was extracted using ethanol, methanol, chloroform, and n-hexane. Total phenolic, flavonoid, and curcuminoid contents from each extract were determined and correlated with antioxidant activity. There was a strong correlation between total phenolic content with their antioxidant activity. The equation y= -0.744x + 3.522 (y=root of total phenolic content, x=log IC50) can be used to estimate antioxidant activity of
extract based total phenol content. Chromatogram profile of a good antioxidant activity contained at least 12 spots that can be identified under ultraviolet (UV) light 254 nm and 3 bright spot under UV light 366 nm from curcuminoids.
i
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
KENDALI MUTU EKSTRAK TEMU IRENG BERKHASIAT
SEBAGAI ANTIOKSIDAN
SAIMA MEGA PUTRI MANURUNG
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul : Kendali Mutu Ekstrak Temuireng Berkhasiat sebagai Antioksidan Nama : Saima Mega Putri Manurung
NIM : G44090028
Disetujui oleh
Dr Irmanida Batubara, MSi Prof Dr Ir Latifah K Darusman, MS Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 sampai Juni 2013 ini ialah kendali mutu, dengan judul Kendali Mutu Ekstrak Temuireng Berkhasiat sebagai Antioksidan. Penelitian ini merupakan bagian dari Kegiatan Penelitian Unggulan Strategis Nasional tetang pengembangan pakan unggas berbahan fitofarmaka terstandar Indonesia yang berkhasiat dalam menanggulangi wabah avian influenza.
Terima kasih penulis ucapkan kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) atas bantuan dana yang diberikan sehingga penelitian ini dapat berjalan dengan baik. Penulis juga mengucapkan terimakasih kepada Pusat Studi Biofarmaka atas ijin yang diberikan kepads penulis untuk melakukan penelitian di laboratorium. Kepada Dr. Irmanida Batubara MS dan Prof. Dr. Latifah K. Darusman, MS selaku pembimbing, penulis mengucapkan terimakasih atas bimbingan selama penelitian hingga penulisan karya tulis ini. Di samping itu, penghargaan penulis sampaikan kepada Ade, Iren, Rahmi, dan Fiqa atas masukan yang diberikan saat pengerjaan setiap tahapan dalam penelitian ini. Ungkapan terima kasih juga disampaikan kepada kedua orang tua, serta seluruh keluarga, atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
ii
DAFTAR ISI
DAFTAR TABEL iii
DAFTAR GAMBAR iii
DAFTAR LAMPIRAN iii
PENDAHULUAN 1
BAHAN DAN METODE 2
Waktu dan Tempat 2
Alat dan Bahan 2
Metode 2
HASIL DAN PEMBAHASAN 5
Kadar Air dan Kadar Abu 5
Ekstraksi 5
Kandungan alkaloid, saponin, dan tanin 6
Kadar Total Fenol 6
Kandungan Total Flavonoid 7
Kandungan total kurkuminoid 7
Aktivitas Antioksidan 8
Kromatografi lapis tipis 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
1 Rendemen ekstraksi dengan berbagai pelarut 6
2 Keberadaan alkaloid, saponin, dan tanin 7
3 Total fenol, total flavonoid, total kurkuminoid dan aktivitas antioksidan
ekstrak rimpang temu ireng 8
DAFTAR GAMBAR
1 Hubungan aktivitas antioksidan rimpang temu ireng dengan total
fenol 9
2 Hubungan aktivitas antioksidan rimpang temu ireng dengan total
flavonoid 9
3 Hubungan aktivitas antioksidan rimpang temu ireng dengan total
kurkuminoid 10
4 Kromatogram ekstrak etanol, n-heksana, metanol, dan kloroform rimpang temu ireng serta standar kurkuminoid dengan eluen
diklorometana:etil asetat 9:1 pada λ 366nm 11 5 Kromatogram ekstrak etanol, n-heksana, metanol, dan kloroform
rimpang temu ireng serta standar kurkuminoid dengan eluen
diklorometana:etil asetat 9:1 pada λ 254nm 11
DAFTAR LAMPIRAN
1 Bagan Alir Kerja 15
2 Kadar air sampel 16
3 Kadar abu sampel 17
4 Perhitungan rendemen 17
5 Perhitungan total fenol 18
6 Perhitungan total flavonoid 19
7 Perhitungan total kurkuminoid 20
8 Perhitungan aktivitas antioksidan 20
9 Korelasi antioksidan dengan 2 dan 3 variabel 21 10 Nilai Rf standar kurkuminoid dengan eluen diklorometana:etil
asetat 9:1 pada λ 366nm dan 254nm 21
11 Nilai Rf ekstrak kloroform, n-heksana, metanol, dan etanol rimpang temu ireng dengan eluen diklorometana:etilasetat 9:1
pada λ 254 nm 22
12 Nilai Rf ekstrak kloroform, n-heksana, metanol, dan etanol rimpang temu ireng dengan eluen diklorometana:etil asetat 9:1
PENDAHULUAN
Ramuan obat dari bahan herbal telah banyak digunakan oleh masyarakat untuk beberapa macam penyakit manusia. Ramuan tanaman herbal juga telah mengalami perkembangan yang pesat baik secara tradisional maupun modern. Namun, selama ini pemanfaatan ramuan obat tersebut sebagian besar untuk manusia dan belum banyak digunakan untuk mengobati penyakit hewan. Penggunaan bahan herbal untuk hewan menuntut adanya upaya yang dapat menjamin mutu dan khasiatnya.
Kendali mutu pada bahan herbal didefinisikan sebagai status obat yang ditentukan oleh identitas, kemurnian, kandungan, dan sifat kimia, fisik dan biologis atau proses produksi (Bandaranayake 2006). Kendali mutu diperlukan untuk menghasilkan produk yang bermutu mulai dari bahan awal sampai pada produk jadi. Sistem pengendalian mutu dirancang untuk menjamin bahwa tiap produk mengandung bahan dengan mutu yang benar dan dibuat pada kondisi standar sehingga produk tersebut senantiasa memenuhi persyaratan produk yang berlaku (BPOM 2011).
Kendali mutu tanaman dapat dilakukan secara manual, seperti yang dilakukan para pembuat jamu tradisional, namun cara ini tidak efektif karena keterbatasan dan keragaman respon indera manusia. Cara lain yang dapat digunakan adalah berdasarkan kandungan senyawa penciri tunggal yang terdapat pada bahan. Cara ini tidak memberikan gambaran lengkap tentang bahan karena ada kemungkinan senyawa penciri tersebut bekerja secara sinergis dengan komponen lain. Untuk mendapatkan gambaran yang lebih jelas tentang bahan, dapat digunakan metode analisis sidik jari. Kromatografi lapis tipis, HPLC, GC, dan elektroforesis kapiler adalah instrumen yang dapat digunakan untuk kontrol kualitas tanaman obat menggunakan metode sidikjari (Liang et al. 2004). Kendali mutu tanaman obat pada penelitian ini menggunakan metode kromatografi lapis tipis (KLT). Kromatografi lapis tipis telah banyak digunakan dalam identifikasi obat herbal. Sidikjari KLT dapat memberikan data fundamental yang berguna untuk menunjukkan kosistensi dan stabilitas produk herbal (Mohammad et al. 2010).
2
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan selama bulan Maret sampai Juni 2013 di Laboratorium Kimia Bagian Analitik Departemen Kimia IPB dan Laboratorium Pusat Studi Biofarmaka, IPB, Bogor.
Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah alat kaca, oven, tanur, spektrofotometer ultraviolet-tampak (UV-Vis), 96-well plate, microplate reader, dan CAMAG Linomat IV. Bahan yang digunakan pada penelitian ini adalah rimpang temu ireng dari kebun Pusat Studi Biofarmaka (PSB) berumur 1 tahun, kebun Balai Penelitian Tanaman Obat dan Aromatik (Balittro) berumur 1 tahun, dan pasar Bogor, pelat KLT silika gel 60 F254, metanol, kloroform, n-heksana,
etanol, asam asetat, etil asetat, aseton, dietil eter, diklorometana, toluena, butanol, tetrahidrofuran (THF), AlCl3, dan radikal 2,2-difenil-1-pikrilhidrazil (DPPH).
Metode
Secara umum, alur penelitian dapat dilihat pada Lampiran 1. Rimpang temu ireng diambil dari 3 tempat yaitu kebun PSB, kebun Balittro, dan pasar Bogor. Rimpang dicuci, diiris tipis-tipis, dan dikeringkan di oven. Setelah itu, rimpang kering digiling hingga menjadi serbuk dengan ukuran 40 mesh. Serbuk rimpang yang didapatkan ditentukan kadar air dan kadar abunya serta diekstraksi menggunakan pelarut etanol, metanol, kloroform, dan n-heksana. Ekstrak yang didapat diuji keberadaan alkaloid, saponin, dan tanin di dalamnya. Kadar flavonoid, kurkuminoid, dan total fenol serta aktivitas antioksidan dari setiap ekstrak ditentukan. Kadar yang diperoleh dikorelasikan dengan aktivitas antioksidan yang didapat untuk menentukan senyawa yang berperan dalam aktivitas antioksidan. Ekstrak yang memiliki aktivitas antioksidan terbaik dielusi dengan berbagai eluen untuk mendapatkan eluen terbaik. Eluen terbaik yang didapat digunakan untuk mengelusi ekstrak yang lain sehingga diperoleh kromatogram sidikjari dari rimpang temu ireng.
Penentuan Kadar Air (AOAC 2007)
Penentuan Kadar Abu (AOAC 2007)
Cawan porselen dikeringkan di dalam oven selama 30 menit pada suhu 100– 105 ˚C, kemudian dimasukkan ke tanur selama 30 menit dan didinginkan di dalam desikator. Cawan ditimbang hingga diperoleh bobot konstan (A). Sebanyak 2 g sampel diletakkan ke dalam cawan tersebut dan ditimbang (B), lalu cawan berisi sampel dibakar menggunakan pembakar bunsen hingga tidak berasap selama ±20
menit dan dilanjutkan dengan pengabuan di dalam tanur pada suhu 600˚C sampai
pengabuan sempurna. Sampel yang telah diabukan didinginkan di dalam desikator dan ditimbang (C). Kadar abu dihitung menggunakan rumus sebagai berikut:
Ekstraksi (Depkes RI 2008)
Sampel yang sudah kering dan berbentuk serbuk 40 mesh dimasukkan ke dalam erlenmeyer sebanyak 15 gram dan ditambahkan pelarut sebanyak 75 mL. Pelarut yang digunakan adalah etanol dan metanol. Ekstrak metanol yang telah diperoleh kemudian diekstraksi lagi menggunakan n-heksana. Setelah didapat ekstrak n-heksana, ekstak metanol diekstraksi lagi dengan kloroform. Ekstrak yang telah didapat dipekatkan hingga didapat ekstrak pekat.
Uji Fitokimia (Harborne 1987)
Uji Alkaloid
Sebanyak 1 g ekstrak ditambahkan 10 mL CHCl3 dan beberapa tetes NaOH.
Larutan tersebut disaring dan filtratnya ditambahkan 10 tetes H2SO4 2 M serta
dikocok. Lapisan asam dipisahkan dan masing-masing ditambahkan dengan pereaksi Mayer (positif jika terbentuk endapan putih), pereaksi Wagner (positif jika terbentuk endapan coklat), dan pereaksi Dragendorf (positif jika terbentuk endapan merah jingga).
Uji Saponin
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas kemudian disaring. Sebanyak 10 mL filtrat dikocok selama 10 menit dengan keadaan tertutup. Jika terbentuk buih yang stabil berarti ekstrak mengandung saponin.
Uji Tanin
Sebanyak 10 mL ekstrak dipanaskan selama 10 menit. Larutan tersebut kemudian disaring dan filtratnya ditambahkan dengan FeCl3 1%. Jika terbentuk
warna biru tua atau hijau berarti ekstrak mengandung tanin. Analisis Kandungan Fenol Total (Atanassova et al. 2011)
4
Sebanyak 1 mL reagen fenol Folin-Ciocalteu ditambahkan ke labu ukur lalu diaduk. Setelah 5 menit, ditambahkan 10 mL larutan Na2CO3 7% dan ditera
dengan akuades bebas ion. Setelah inkubasi pada suhu ruang selama 90 menit, diukur absorbans larutan pada panjang gelombang 750 nm. Data total fenol ditunjukkan sebagai jumlah asam galat (mg) dalam 100 gram bobot kering.
Analisis Kandungan Flavonoid (Chang et al. 2002)
Total flavonoid diukur dengan uji kolometrik aluminium klorida. Sebanyak 1 mL ekstrak atau standar kuersetin dengan konsentrasi 20, 40, 60, 80, dan 100 mg/L ditambahkan ke dalam labu takar 10 mL yang telah berisi 3 mL etanol. Lalu ditambahkan 0,2 mL AlCl3 10% dan 0,2 mL kalium asetat. Campuran ditera
dengan akuades yang dideionisasi sampai 10 mL. Larutan diaduk dan diinkubasi selama 30 menit pada suhu ruang. Absorbansi larutan diukur pada panjang gelombang 415 nm. Data total flavonoid ditunjukkan sebagai jumlah katekin ekivalen dalam 100 gram berat kering (mg kuersetin/ 100g bobot kering).
Analisis Kandungan Kurkuminoid (Batubara et al. 2005)
Sebanyak 10 mg ekstrak dilarutkan dalam 1 mL THF. Sebanyak 100 µL dari larutan ini dilarutkan dalam 10 mL etanol. Serapan larutan diukur pada sperktrofotometer UV-Vis pada panjang gelombang 420 nm.
Uji Aktivitas Antioksidan (Salazar-Aranda et. al. 2009)
Uji aktivitas antioksidan yang digunakan adalah uji penangkapan radikal bebas 2,2-difenil-1-pikrilhidrazil (DPPH). Sampel dilarutkan di dalam etanol hingga diperoleh variasi konsentrasi. Sebanyak 500 µL ekstrak dan 500 µL larutan DPPH (125µM dalam etanol) ditambahkan ke dalam masing-masing sumur (96-well plate). Setelah 30 menit, diukur absorbansnya pada panjang gelombang 517 nm. Kontrol positif yang digunakan adalah asam askorbat dan etanol sebagai kontrol negatif. Pengukuran absorbans masing-masing sampel dengan berbagai konsentrasi dan kontrol positif dilakukan tiga kali ulangan (triplo). Aktivitas dihitung dengan persamaan:
Inhibisi (%)= [1-(Asampel-Akontrol)/(Ablanko-Akontrol)] x 100%
Aktivitas antioksidan setiap ekstrak dihubungkan dengan keberadaan senyawa kurkuminoid dan flavonoid dengan regresi linear. Hal ini bertujuan untuk mengetahui senyawa yang bertanggung jawab pada aktivitas antioksidan ekstrak.
Analisis Kromatografi Lapis Tipis (Depkes RI 2008)
Semua ekstrak diaplikasikan pada pelat kromatografi lapis tipis untuk diamati pola pemisahannya, pelat KLT alumunium yang digunakan adalah jenis silika gel G60F254 dari Merck. Masing masing ekstrak dilarutkan dalam larutan
terbaik pertama dilakukan menggunakan eluen tunggal dengan membandingkan noda terbanyak dan pemisahannya di bawah paparan UV pada panjang gelombang 254 dan 366 nm. Eluen yang menghasilkan noda terbanyak dan terpisah baik dipilih sebagai eluen terbaik. Jika terdapat 2 eluen yang memenuhi kriteria, maka eluen-eluen tersebut dicampurkan dengan perbandingan dari 1:9 sampai 9:1.
Setelah diketahui eluen terbaik, dilakukan pembuatan kromatogram temu ireng dari berbagai daerah. Serbuk rimpang temu ireng dari beberapa daerah diekstraksi kemudian ekstraknya ditotolkan pada plat KLT. Plat kemudian dielusi dengan eluen terbaik yang sudah diketahui, kemudian diamati profil kromatogramnya. Berdasarkan kromatogram yang didapat, dilihat hubungan antara spot yang terbentuk dengan aktivitas antioksidan dan kandungan bahan di dalamnya.
HASIL DAN PEMBAHASAN
Sampel yang digunakan pada penelitian ini berasal dari daerah Bogor, Jawa Barat. Ada tiga sampel yang dianalisis yaitu dari kebun PSB (sampel A), kebun Balittro (sampel B), dan Pasar Bogor (sampel C).
Kadar Air dan Kadar Abu
Kadar air pada ketiga sampel temu ireng bernilai kurang dari 15% (Lampiran 2). Kadar air tertinggi dimiliki sampel B, yaitu 13.60%. Sampel A memiliki kadar air 8.90 % dan sampel C 12.74%. Kadar air ini akan menjadi faktor koreksi bobot pada saat penentuan rendemen. Nilai kadar abu menunjukkan mineral yang terkandung di dalam bahan. Sampel B juga memiliki kandungan mineral yang lebih banyak (8.01%) dibandingkan dengan sampel lainnya (Lampiran 3). Berdasarkan Materia Medika jilid II (1978), kadar abu rimpang tanaman temu ireng tidak lebih dari 6.10%. Kadar abu yang lebih tinggi pada sampel dari kebun Balittro dan Pasar Bogor dapat disebabkan oleh perbedaan kondisi pertumbuhan, pemupukan, waktu panen, teknik panen, dan perlakuan setelah pemanenan (Bakker dan Elbersen 2005).
Ekstraksi
Ekstraksi dilakukan dengan metode maserasi dan partisi. Secara umum, sampel B memiliki rendemen terendah dan ekstrak etanol dari setiap sampel memiliki rendemen tertinggi. Ekstrak etanol merupakan ekstrak kasar yang tidak dipartisi. Partisi ekstrak metanol dengan kloroform dan n-heksana menyebabkan rendemen ekstrak metanol lebih rendah daripada ekstrak etanol. Rendemen setiap ekstrak dapat dilihat pada Tabel 1 dan cara perhitungan diberikan di Lampiran 4.
6
cenderung polar, sedangkan komponen polar lebih larut dalam metanol dan etanol.
Tabel 1 Rendemen ekstraksi dengan berbagai pelarut Sampel Ekstrak Rendemen (%)
A CHCl3
Kandungan alkaloid, saponin, dan tanin
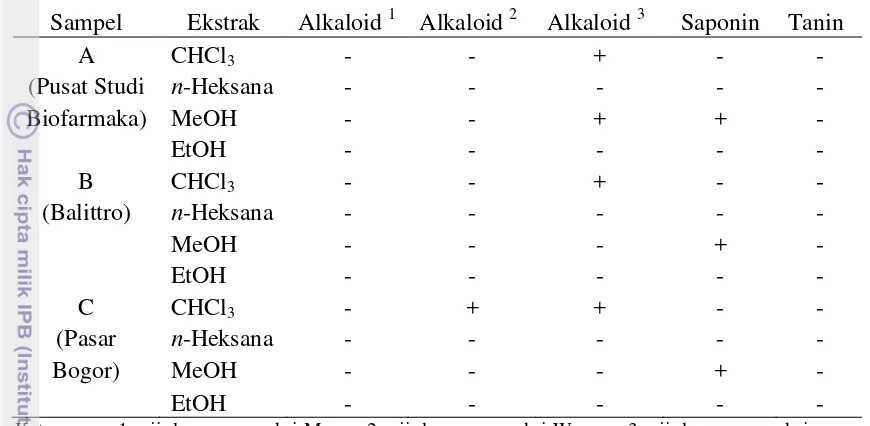
Alkaloid terkandung dalam ekstrak kloroform dari semua sampel dan ekstrak metanol dari sampel A. Keberadaan alkaloid terdeteksi dari terbentuknya endapan saat direaksikan dengan pereaksi Dragendorf.Ekstrak metanol dari setiap sampel mengandung saponin yang ditunjukkan dengan terbentuknya busa yang stabil selama 10 menit, sedangkan tanin tidak terdeteksi pada semua ekstrak sampel. Hasil uji kualitatif kandungan alkaloid, saponin dan tanin ditunjukkan pada Tabel 2.
Penelitian sebelumnya menyatakan terdapat saponin pada ekstrak etanol rimpang temu ireng (Erickkatulistiawan 2012). Berbeda dengan penelitian ini, saponin hanya terdapat dalam ekstrak metanol. Hal ini dimungkinkan karena keberadaan senyawaan lain lebih dominan, sehingga keberadaan saponin yang ditandai dengan terbentuknya busa stabil tidak terdeteksi. Keberadaan alkaloid dalam ekstrak kloroform juga hanya terdeteksi dari pereaksi Dragendorf. Hal ini diduga karena keberadaan alkaloid yang sangat sedikit sehingga hanya dapat terdeteksi oleh pereaksi yang paling sensitif.
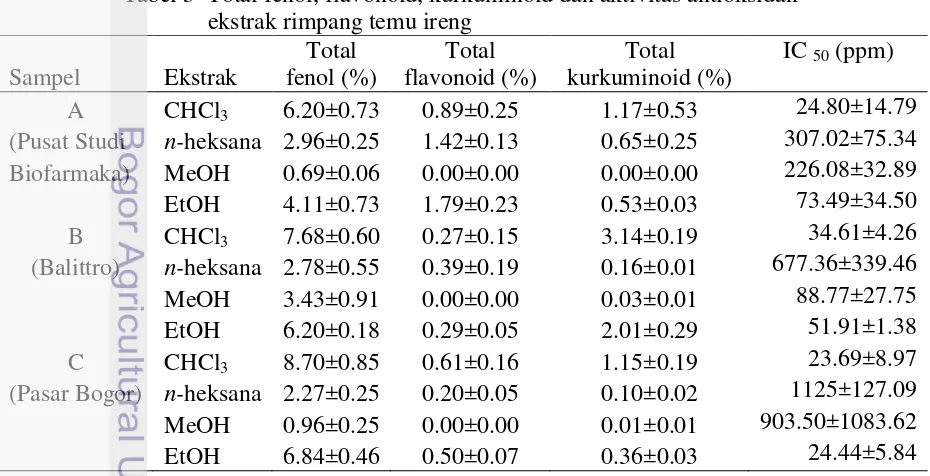
Kadar Total Fenol
(Tabel 3). Ekstrak dengan kandungan total fenol tertinggi ialah ekstrak kloroform. Ekstraksi menggunakan etanol juga memiliki total fenol yang cukup tinggi berkisar antara 4.11–6.84 %. Total fenol terendah dimiliki oleh ekstrak metanol
Tabel 2 Keberadaan alkaloid, saponin, dan tanin
Sampel Ekstrak Alkaloid 1 Alkaloid 2 Alkaloid 3 Saponin Tanin
Keterangan: 1: uji dengan pereaksi Mayer, 2: uji dengan pereaksi Wagner, 3: uji dengan pereaksi Dragendorf
Kandungan Total Flavonoid
Total flavonoid dari tiap sampel diukur menggunakan pereaksi AlCl3 dan
kalium asetat. Prinsip metode ini adalah AlCl3 akan membentuk kompleks stabil
tahan-asamdengan gugus keto C-4 dan gugus hidroksil C-3 atau C-5 dari flavon dan flavonol. AlCl3 juga akan membentuk kompleks yang labil dalam asam
dengan gugus orto-dihidroksil pada cincin-A atau B dari flavonoid (Chang et al. 2002). Total flavonoid dihitung berdasarkan kurva standar kuersetin (Lampiran 6). Kandungan flavonoid ekstrak tidak terlalu tinggi, berkisar antara 0.00 dan 1.79% b/b. Kandungan flavonoid tertinggi dimiliki oleh ekstrak etanol sampel dari kebun Pusat Studi Biofarmaka (Tabel 3). Ekstrak kloroform dan n-heksana dari sampel yang sama juga memiliki kandungan total flavonoid yang lebih tinggi dibandingkan sampel dari tempat lain dengan pengekstraksi yang sama. Sementara itu, sampel dari Balittro memiliki kandungan flavonoid cenderung lebih rendah daripada sampel dari pasar Bogor, kecuali untuk ekstrak n-heksana. Hal ini menunjukkan sampel dari Balittro memiliki kandungan flavonoid nonpolar yang lebih tinggi. Ekstrak metanol dari semua tempat tidak memiliki total flavonoid sama sekali.
Kandungan total kurkuminoid
8
menunjukkan bahwa kandungan kurkuminoid tertinggi dimiliki oleh ekstrak kloroform sampel dari Balittro. Sampel dari Balittro yang diekstraksi dengan pelarut lain juga memiliki kandungan total kurkuminoid yang cenderung lebih tinggi dibandingkan dari tempat lain. Semua ekstrak kloroform memiliki kandungan total kurkuminoid paling tinggi. Hal ini menunjukkan senyawaan kurkuminoid lebih bersifat semipolar.
Aktivitas Antioksidan
Aktivitas antioksidan dengan metode DPPH dinyatakan dalam nilai IC50
yang menunjukkan konsentrasi ekstrak yang dapat menghambat aktivitas DPPH sebesar 50%. Hasil uji dan perhitungan (Tabel 3, Lampiran 8) menunjukkan bahwa ekstrak kloroform dari setiap tempat memiliki IC50 lebih rendah daripada
ekstrak lainnya. Ekstrak lain yang memiliki aktivitas antioksidan yang cukup baik adalah ekstrak etanol. Setiap sampel yang diekstraksi dengan n-heksana memiliki nilai IC50 lebih besar dari 200 ppm, berdasarkan hal tersebut, dapat dikatakan
bahwa ekstrak n-heksana tidak memiliki aktivitas antioksidan. Ekstrak lain yang memiliki IC50 lebih besar dari 200 ppm adalah ekstrak metanol sampel dari kebun
Pusat Studi Biofarmaka dan pasar Bogor. Kemampuan ekstrak kloroform yang lebih baik dalam menghambat aktivitas DPPH dapat disebabkan oleh tingginya kandungan senyawa fenolik di dalamnya.
Penentuan koefisien korelasi antara total senyawa fenolik terhadap aktivitas antioksidan menunjukkan adanya hubungan antara keduanya. Koefisien korelasi sebesar 0.814 menunjukkan korelasi yang kuat. Penelitian Choudhury et al. (2013) juga menunjukkan adanya korelasi total fenol dengan aktivitas antioksidan ekstrak temu ireng sebesar 0.863. Berdasarkan nilai kandungan total senyawa fenolik pada temu ireng, dapat diduga aktivitas antioksidannya dengan persamaan linear sebagai berikut y= -0.744x + 3.522 dengan y= log IC50, x= akar total fenol,
dan R2 =0.6628 (Gambar 1).
Tabel 3 Total fenol, flavonoid, kurkuminoid dan aktivitas antioksidan ekstrak rimpang temu ireng
(Pusat Studi n-heksana 2.96±0.25 1.42±0.13 0.65±0.25 307.02±75.34 Biofarmaka) MeOH 0.69±0.06 0.00±0.00 0.00±0.00 226.08±32.89 EtOH 4.11±0.73 1.79±0.23 0.53±0.03 73.49±34.50
B CHCl3 7.68±0.60 0.27±0.15 3.14±0.19 34.61±4.26
(Balittro) n-heksana 2.78±0.55 0.39±0.19 0.16±0.01 677.36±339.46 MeOH 3.43±0.91 0.00±0.00 0.03±0.01 88.77±27.75
EtOH 6.20±0.18 0.29±0.05 2.01±0.29 51.91±1.38
C CHCl3 8.70±0.85 0.61±0.16 1.15±0.19 23.69±8.97
(Pasar Bogor) n-heksana 2.27±0.25 0.20±0.05 0.10±0.02 1125±127.09 MeOH 0.96±0.25 0.00±0.00 0.01±0.01 903.50±1083.62
Hal ini menunjukkan bahwa 66% kapasitas antioksidan dari ekstrak temu ireng berasal dari kontribusi senyawa fenolik (Javanmardi 2003). Senyawa fenolik merupakan kandungan tanaman yang sangat penting karena kemampuannya menghambat radikal bebas. Kemampuan ini berasal dari gugus hidroksil yang dimiliki (Stankovic 2011). Aktivitas antioksidan senyawa fenolik umumnya disebabkan oleh sifat redoks senyawa tersebut yang memiliki peran penting dalam menjerap dan menetralkan radikal bebas atau mendekomposisi peroksida. Hal ini juga berarti bahwa aktivitas antioksidan ekstrak temu ireng bukan hanya disebabkan oleh keberadaan senyawa fenolik (Javanmardi 2003).
Hubungan antara total flavonoid dengan aktivitas antioksidan memiliki koefisien korelasi sebesar 0.324. Hal ini berarti terdapat korelasi antara total flavonoid dan aktivitas antioksidan, tetapi korelasinya kecil. Choudhury et al. (2013) menemukan korelasi antara aktivitas antioksidan dengan total flavonoid sebesar 0.682. Flavonoid merupakan jenis metabolit sekunder dengan aktivitas antioksidan dan sifat pengelat yang signifikan (Stankovic 2011).
Gambar 1 Hubungan aktivitas antioksidan rimpang temu ireng dengan total fenol Dari nilai total flavonoid, dapat pula diduga nilai aktivitas antioksidan dari ekstrak temu ireng yaitu dengan persamaan y=9309x + 1.3656 dengan y= log IC50, x=
1/(total flavonoid+1), dan R2= 0.1051(Gambar 2).
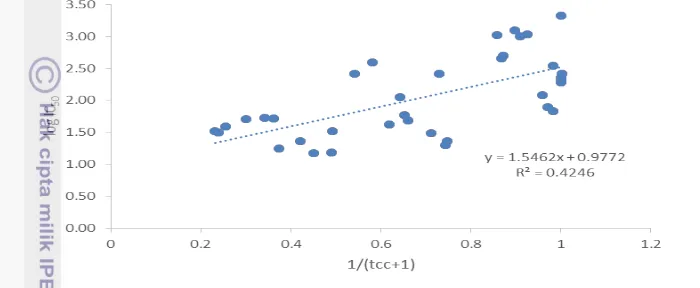
Serupa dengan total fenol dan total flavonoid, keberadaan kurkuminoid juga berhubungan dengan aktivitas antioksidan dengan koefisien korelasi sebesar 0.652. Penelitian sebelumnya menunjukkan korelasi antara total kurkuminoid dengan aktivitas antioksidan pada ekstrak temu ireng sebesar 0.601 (Choudhury 2013).
10
Aktivitas antioksidan rimpang temu ireng dapat diduga dari jumlah kurkuminoid menggunakan persamaan y=1.5462x + 0.9772 dengan y= log IC50, x= 1/(total
kurkuminoid +1),dan R2= 0.425 (Gambar 3).
Gambar 3 Hubungan aktivitas antioksidan rimpang temu ireng dengan total kurkuminoid
Hubungan aktivitas antioksidan dan semua komponen yang diuji dapat dinyatakan melalui persamaan y=3.658-0.760X1- 0.173X2+ 0.030X3 dengan X1=
akar total fenol, X2= 1/(total flavonoid+1), X3= 1/(total kurkuminoid+1), dan y=
log IC50. Nilai korelasi hubungan ini adalah 0.816 dengan R2= 0.666. Nilai
korelasi dan linearitas yang hampir menyerupai hubungan antioksidan dengan total fenol semakin menjelaskan bahwa aktivitas antioksidan dari temuireng sebagian besar dipengaruhi oleh keberadaan senyawa fenolik. Korelasi antioksidan dengan 2 variabel yang diuji (Lampiran 9) juga menunjukkan besarnya pengaruh total fenol terhadap aktivitas antioksidan.
Aktivitas antioksidan yang dimiliki oleh rimpang temu ireng diduga dapat meningkatkan ketahanan tubuh unggas terhadap virus flu burung. Antioksidan dapat memberikan kekebalan pada jaringan saluran pernapasan terhadap kerusakan yang ditimbulkan oleh penyakit infeksi dan kanker (Young et al. 1999). Salah satu gejala klinis penyakit virus pada unggas adalah gangguan pernapasan. Berdasarkan hal tersebut, pemberian antioksidan diharapkan dapat memberikan perlindungan pada saluran pernapasan ternak dari serangan virus (Prawirodigdo 2010).
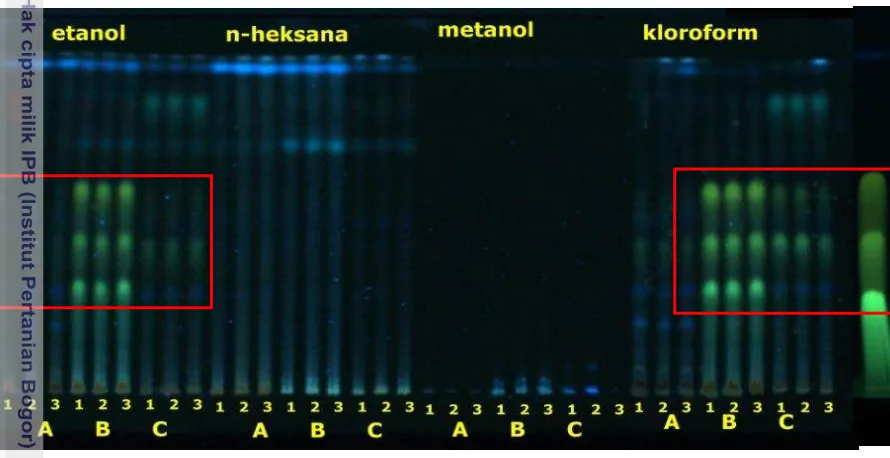
Kromatografi lapis tipis
Pelat yang telah ditotol oleh sampel dielusi menggunakan eluen berupa diklorometana:etil asetat 9:1. Hasil elusi divisualisasi pada panjang gelombang 366 nm dan 254 nm (Gambar 4 dan Gambar 5). Ekstrak kloroform pada lampu 366 nm menghasilkan 3 spot dengan Rf seragam (0.6; 0.4;0.3) yang dimiliki oleh sampel dari ketiga asal. Nilai Rf ketiga spot tersebut serupa dengan nilai Rf ketiga spot pada standar kurkuminoid yang dielusi pada eluen yang sama (lampiran 10).
Gambar 4. Kromatogram ekstrak etanol, n-heksana, metanol, dan kloroform rimpang temu ireng serta standar kurkuminoid dengan eluen diklorometana:etil asetat 9:1 pada λ 366nm
12
Diduga kuat bahwa ketiga spot tersebut menupakan senyawa kurkuminoid, yaitu kurkumin, desmetoksikurkumin, dan bisdesmetoksikurkumin. Spot ini juga terdapat pada ekstrak etanol. Ekstrak etanol dari sampel A memiliki kandungan kurkuminoid lebih tinggi daripada sampel C, namun sampel A hanya memiliki 1 spot kurkuminoid, yaitu spot paling bawah, hal ini diduga karena sampel A hanya memproduksi 1 jenis kurkuminoid.
Jumlah spot yang terdeteksi pada lampu 245 nm berhubungan dengan aktivitas antioksidan ekstrak etanol dan kloroform. Spot terbanyak terdapat pada sampel C. Ekstrak etanol sampel C menunjukkan 13 spot dengan nilai Rf bervariasi dari 0.06-0.95. Ekstrak kloroform memiliki 12 spot dengan nilai Rf dari 0.08- 0.95. Hal ini berarti setidaknya ada 13 senyawa berbeda yang terdapat pada ekstrak etanol dan kloroform rimpang temu ireng (Lampiran 11).
Kromatogram yang telah didapatkan bersifat spesifik untuk eluen diklorometana: etil asetat 9:1. Karakteristik kromatogram sidik jari dari ekstrak tanaman rimpang temu ireng ini dapat membantu upaya identifikasi bahan dan kendali mutu dalam penggunaan temu ireng kedepannya. Kromatogram ini juga menyediakan informasi dasar yang berfungsi untuk isolasi, purifikasi, karakterisasi dan identifikasi senyawa yang diinginkan (Gunalan et. al. 2012)
SIMPULAN DAN SARAN
Simpulan
Keberadaaaan senyawa fenol, flavonoid dan kurkuminoid pada rimpang temu ireng memiliki korelasi dengan aktivitas antioksidan rimpang. Korelasi yang cenderung bersifat linear dimiliki oleh total fenol dengan nlai R2 sebesar 0.6628. Aktivitas antioksidan rimpang dapat diduga dari jumlah senyawaan fenol, menggunakan persamaan yang telah diberikan. Pada kromatogram, sampel yang memiliki aktivitas antioksidan yang baik akan menunjukkan setidaknya 12 spot pada UV-tampak 254 nm dan keberadaan spot cerah pada UV-Vis 366 yang diduga sebagai kurkuminoid.
Saran
Perlu dilakukan visualisasi menggunakan pewarna senyawa pada plat KLT agar didapatkan kromatogram yang lebih menjelaskan keberadaan senyawa yang berpengaruh terhadap aktivitas antioksidan. Perlu diuji kandungan flavonoid dari ekstrak dengan metode lain yang dapat mendeteksi semua jenis flavonoid.
DAFTAR PUSTAKA
Anonim. 1978. Materia Medika Jilid II . Departemen Kesehatan republik Indonesia, Jakarta (ID).
Atanassova M, Georgieva S, Ivancheva K. 2011. Total phenolic and total flavonoid contents, antioxidant capacity and biological contaminants in medical herbs. J of Univ of Chem Techno and Metallurgy 46 (1): 81-88. [BPOM] Badan Pengawas Obat dan Makanan. 2011. Peraturan kepala badan
pengawas obat dan makanan Republik Indonesia Nomor hk.03.1.23.06.11.5629 tahun 2011 tentang persyaratan teknis cara pembuatan obat tradisional yang baik. Jakarta: BPOM (ID).
Bakker RR, Elbersen HW. 2005. Managing ash content and quality in herbaceous biomass: an analysis from plant to product.14th European Biomass Conference and Exhibition; 2005 Oct 17; Paris, France (FR).
Bandaranayake W. 2006. Quality control, screening, toxicity, and regulation of herbal drug in Modern Phytomedicine Turning Meicinal Plants into Drugs. Weinheim: WILEY-VCH Verlag GmbH&Co.KgaA (DE).
Batubara I, Rafi M, Darusman L. 2005. Estimasi kandungan kurkumin pada sediaan herbal komersial secara spektrofotometri derivatif. J Sains Kimia 9 (1) : 28-34.
Bhullar K, Jha A, Youssef D, Rupasinghe H. Curcumin and its carbocyclic analogs: structure-activity in relation to antioxidant and selected biological properties. Molecules18. hlm:5389-5404. doi:10.3390/molecules18055389. Chang C, Yang M, Wen H, Chern J. 2002. Estimation of total flavonoid content in
propolis by two complementary colorimetric methods. J of Food and Drug Analysis. 10 (3). Hlo: 178-182.
Choudhury D, Ghosal M, Das A, Mandal P. 2013. Development of single node cutting propagation techniques and evaluation of antioxidant activity of curcuma aeruginosa roxburgh rhizome. Int J of Phar and Pharma Sci. 5 (2) : 227-234.
Ciesla L. M, Hajnos W. 2010. Application of thin-layer chromatography for the quality control and screening the free radical scavenging activity of selected pharmacuetical preparations containing Salvia oficinalis L. Extract. Acta Poloniae Pharmaceutica n Drug Research. 67 (5): 481-485.
[Depkes RI] Departemen Kesehatan Republik Indonesia. Farmakope Herbal Indonesia Edisi Ke-1. Jakarta: Departemen kesehatan Republik Indonesia. Erickatulistiawan, Gallusena. 2012. The Effects Test of Antihelmintic Pink and
Blue Gingers Extract Ethanol (Curcuma aeruginosa) on Ascaris suum, in vitro. [skripsi], Malang (ID) : Universitas Brawijaya.
Gunalan G, Saraswathy A, Vijaylakshmi K. 2012. HPTLC fingerprint profile of Bauhinia variegata Linn. Leaves. Asian Pasific J of Trop Disease.
Harborne JB. 1987. Metode Fitokimia Ed ke-2. Padmawinata K, Soedira L, penerjemah; Bandung (ID): Penerbit ITB. Terjemahan dari: Phytochemical Method.
Itokawa H, Qian S, Akiyama T, Morris-Natschke S, Lee K. 2008. Recent advances in investigation of curcuminoids. Chinese Medicine 3(11). doi:10.1186/1749-8546-3-11.
14
Jing Z, Jiang-shen Z, Bin Y, Guang P, Shao L. 2010. Free radical scavenging activity and characterization of sesquiterpenoids in four species of Curcuma using a TLC bioautography assay ang GC-MS analysis. Molecules 15: 7547-7557. doi: 10.3390/molecules15117547.
Kritchevskey, D. and S.B. Kritchevskey. 1999. Antioxidant and Their Role in Coronary Heart Disease. In Antioxidants in Human Health and Disease, pp. 151-164 (T.K. BASU, & M.L. GARG, Editors). CABI Publishing: Oxon, (UK).
Liang YZ, Xie P, Chan K. 2004. Quality control of herbal medicines. J of Chrom 812:53-70.
Mohammad A, Bhawani S, Sharma S. 2010. Analysis of herbal products by thin-layer chromatography : a review. Int J of Phar and Bio Sci 1(2): 1-50. Nurbara F.D. 2009. Kajian potensi ekstrak etanol Adas (Foeniculum vulgare Mill)
dan temu ireng (Curcuma Aeruginosa Roxb) sebagai bahan obat alternatif flu burung [Thesis]. Bogor (ID) : Institut Pertanian Bogor.
Nurcholis W, Priosoeryanto B.P, Purwakusumah E.D, Katayama T, Suzuki T. 2012. Antioxidant, cytotoxic activities and total phenolic content of four Indonesian medicinal plants. Valensi (2) 4: 501-510.
Prawirodigdo S. 2010. Pemberian pakan mengandung asam amino seimbang dan antioksidan nabati sebagai strategi proteksi terhadap serangan penyakit pada ternak ayam. Lokakarya Nasional Inovasi Teknologi Dalam Mendukung Usahaternak Unggas Berdayasaing.
Salazar-Aranda R, Perez-Lopez L, Lopez-Arroyo J, Alanis-Garza B, Torres N. 2009. Antimicrobial and antioxidant activities of plants from Northeast of Mexico. Evidence-Based Complementary and Alternative Medicine.2011 : 1-6. doi:10.1093/ecam/nep127.
Schopield P, Mbugua D, Pell A. 2001. Analysis of condensed tannins :a review. Animal Feed Science and Technology. 91 : 21-40.
Sumardi. 2006. Sumardi dan Jamu Tahan Flu Burung. Dilaporkan C. Wahyu Haryo. Dalam Harian Kompas, tanggal 17 Juli, hal. 16. Jakarta (ID).
Stankovic M. 2011. Total phenolic content, flavonoid concentration and antioxidant activity of Marrubium peregrinum L. extracts. Kragujevac J. Sci. 33 (2011) 63-72.
Uji kadar total fenol,
flavonoid, dan kurkuminoid
LAMPIRAN
Lampiran 1 Bagan Alir Kerja
Hubungkan Total fenol, flavonoid dan kurkuminoid dengan aktivitas antioksidan
Dielusi untuk mengetahui eluen terbaik
Digunakan untuk analisis KLT sampel lain
Ekstrak kasar metanol Ekstrak
Ekstrak
Senyawa yang bertanggung jawab atas aktivitas antioksidan
Eluen terbaik Kandungan
fitokimia
Total fenol, flavonoid dan kurkuminoid
16
Lampiran 2 Kadar air sampel
Sampel ulangan
bobot (g)
cawan
kosong sampel
cawan+sampel bebas air
sampel bebas air
kadar air (%)
A 1 4.3306 2.0003 6.1548 1.8242 8.8
( Biofarmaka) 2 4.6458 2.0006 6.4737 1.8279 8.63 3 4.4118 2.0004 6.2268 1.815 9.27
rata rata 8.9
B 1 4.4245 2.0000 6.1464 1.7219 13.91
(Balittro) 2 4.2857 2.0005 6.0136 1.7279 13.63 3 4.4974 2.0005 6.2324 1.735 13.27
rata rata 13.6
C 1 1.9638 2.0002 3.7008 1.737 13.16
(Pasar Bogor) 2 1.9892 2.0009 3.743 1.7538 12.35 3 1.9762 2.0001 3.7223 1.7461 12.7
rata rata 12.74
Contoh perhitungan
bobot sampel bebas air = bobot cawan+sampel bebas air - bobot cawan kosong = 6.1548 g - 4.3306 g
= 1.8242 g
Kadar air (%) =
=
=
Lampiran 3 Kadar abu sampel
Bobot sampel kering = bobot sampel awal ×kadar air = 2.0006 g × 8.90 %
Bobot ekstrak = (bobot vial+ekstrak) – (bobot vial) = 37.3002 g - 36.6314 g
= 0.6688 g
Bobot sampel kering = bobot sampel awal ×kadar air = 15.0369 × 8.90 %
= 13.6986 g % Rendemen =
=
18
Lampiran 5 Perhitungan total fenol
Kurva standar asam galat
Contoh perhitungan
Absorbans terkoreksi = absorbans sampel – absorbans blanko = 0.334 – 0.08
= 0.254
[fenol] =
=
= 68.647 ppm %b/b =
=
= 6.86 %
y = 0.0034x - 0.0206 R² = 0.9958
0.000 0.050 0.100 0.150 0.200 0.250 0.300 0.350
0 20 40 60 80 100 120
ab
so
rb
an
Lampiran 6 Perhitungan total flavonoid
Kurva standar kuersetin Contoh perhitungan
Absorbans terkoreksi = absorbans reaksi – absorbans sampel = 0.362 – 0.196
= 0.166 [flavonoid] =
=
= 20.5350 ppm
%b/b = =
= 1.03 %
y = 0.0071x + 0.0202 R² = 0.9945
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
0 20 40 60 80 100 120
ab
sor
b
an
s
20
Lampiran 7 Perhitungan total kurkuminoid
Kurva standar kurkuminoid
Lampiran 8 Perhitungan aktivitas antioksidan Contoh perhitungan
Persamaan garis y = 65.997ln(x) + 54.445 Dengan y= %inhibisi dan x= log [sampel] IC50 adalah ketika % inhibisi= 50 atau y=50
Lampiran 9 Korelasi antioksidan dengan 2 dan 3 variabel
TPC,TFC TPC,TCC TFC,TCC TPC,TFC, TCC
R=0.816 R=0.814 R=0.651 R=0.816
R2=0.666 R2=0.663 R2=0.424 R2=0.666
y=3.692-0.768X1
-0.167X2
y=3.549-0.750X1
-0.020X3
y=0.970+0.017X2+
1.538X3
y=3.658-0.760X1-
0.173X2+0.030X3
Ket:TPC= Total Fenol, TFC= Total Flavonoid, TCC= Total Kurkuminoid, X1= akar total fenol,
X2= 1/(total flavonoid+1), X3= 1/(total kurkuminoid+1), dan y= log IC50.
Lampiran 10 Nilai Rf standar kurkuminoid dengan eluen diklorometana:etil asetat 9:1 pada λ 366nm dan 254nm
Nomor spot
Rf
366 254
1 0.63 0.62
2 0.44 0.43
22
Lampiran 11 Nilai Rf ekstrak kloroform, n-heksana, metanol, dan etanol rimpang temu ireng dengan eluen diklorometana:etil asetat 9:1 pada λ 254 nm
Lampiran 12 Nilai Rf ekstrak kloroform, n-heksana, metanol, dan etanol rimpang temu ireng dengan eluen diklorometana:etil asetat 9:1 pada λ 366nm
Sampel
Ekstrak A B C
Nomor spot Rf
Nomor spot Rf
Nomor spot Rf
CH3Cl 1 0.98 1 0.60 1 1.00
2 0.95 2 0.46 2 0.86 3 0.60 3 0.32 3 0.60
4 0.52 4 0.46
5 0.44 5 0.32 6 0.33
7 0.22 8 0.09
n-heksana 1 1.00 1 1.00 1 1.00 2 0.95 2 0.95 2 0.95 3 0.74 3 0.74
MeOH - - - -
EtOH 1 1.00 1 1.00 1 1.00
24
RIWAYAT HIDUP
Penulis dilahirkan di Curup pada tanggal 13 Maret 1991 dari ayah Saibun Manurung dan ibu Tionim Sitanggang. Penulis adalah putr1 ketiga dari lima bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 1 Curup dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.