i
PENGARUH
STUNTING
TERHADAP KONDISI FISIOLOGIS
BENIH IKAN SIDAT (
Anguilla bicolor bicolor
McClelland, 1844)
LATIFA FEKRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengaruh Lama Stunting terhadap Kondisi Fisiologis Benih Ikan Sidat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
RINGKASAN
LATIFA FEKRI. Pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat (Anguilla bicolor bicolor McClelland, 1844). Dibimbing oleh RIDWAN AFFANDI dan TATAG BUDIARDI.
Stunting adalah tehnik yang digunakan pada proses penahanan pertumbuhan ukuran bobot atau panjang ikan. Salah satu tujuan stunting adalah menyediakan stok ikan pada ukuran yang dibutuhkan. Stunting diterapkan hanya pada ikan-ikan yang memiliki pertumbuhan somatik (umur hidup) yang panjang, misalnya bandeng, kerapu dan sidat.
Sidat merupakan jenis ikan yang bernilai ekonomis tinggi, dan mengandung EPA dan DHA yang tinggi. Permintaan sidat terus meningkat dan sebagian besar (92 %) sidat ukuran konsumsi dihasilkan dari kegiatan budidaya. Budidaya sidat menggunakan benih yang masih diperoleh dari alam, karena benih sidat belum dapat dihasilkan dari kegiatan pembenihan. Keberadaan benih sidat di alam hanya terdapat pada musim penghujan, sehingga benih untuk kebutuhan budidaya tidak tersedia sepanjang tahun. Dengan demikian, teknik stunting perlu dilakukan pada benih sidat agar kebutuhan stok benih dapat terpenuhi sepanjang tahun.
Penelitian ini bertujuan untuk menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat ukuran 1-2 g. Penelitian dilakukan dari bulan September 2013 hingga Februari 2014 di Laboratorium Fisiologi Hewan Air FPIK IPB.
Penelitian melalui dua tahap penelitian, penelitian tahap pertama untuk menentukan kebutuhan pakan (maintenance, optimum dan maksimum) dan penelitian tahap kedua untuk menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat. Pakan yang digunakan pada penelitian ini adalah pakan komersial ukuran 1.5 mm berbentuk pelet dengan kadar protein 46 %. Ikan sidat yang digunakan berbobot awal 1-2 g/ekor dan panjang tubuh awal 10-12 cm/ekor. Penelitian tahap pertama diberi 4 perlakuan persentase pakan (0 %, 5 %, 10 % dan 15 %) dari biomass benih ikan sidat yang dipelihara pada akuarium berukuran 40x30x30 cm3 dengan kepadatan 8 ekor/akuarium. Ikan diberi pakan 2 kali sehari secara kontinu selama 30 hari dan penimbangan bobot tubuh ikan dilakukan setiap dua minggu sekali. Pemeliharaan tahap kedua, benih ikan diberi pakan pada level maintenance yaitu 3.3 % (hasil dari percobaan tahap satu) selama satu, dua, dan tiga bulan yang dipelihara pada akuarium berukuran 60x40x30 cm3 dengan kepadatan 30 ekor/akuarium. Ikan diberi pakan 2 kali sehari secara kontinu selama 30, 60 dan 90 hari. Setiap 30 hari sekali dilakukan penimbangan bobot tubuh ikan, analisis proksimat dan analisis darah.
Hasil pemeliharaan menunjukkan bahwa stunting selama satu bulan merupakan yang terbaik dengan laju pertumbuhan spesifiknya paling rendah (0.1 %), nilai koefisien keragaman bobot <20 % (19.90 %) dan kondisi fisiologis mendekati normal (tidak jauh berbeda dengan kontrol), serta kelangsungan hidup sebesar 96 %. Sedangkan stunting benih sidat selama dua dan tiga bulan menunjukkan laju pertumbuhan spesifiknya 0.2 %, nilai koefisien keragaman bobot >25 % (27.96 % dan 30.37 %) dan kondisi fisiologisnya jauh berbeda dengan batas normal benih sidat, serta kelangsungan hidup sebesar 89 %.
iii
SUMMARY
LATIFA FEKRI. The Effect of Stunting to Physiological Condition of Freshwater Eel Seed (Anguilla bicolor bicolor McClelland, 1844). Supervised by RIDWAN cultivation still used the seed which is derived from native, becouse the seed eel can not be produced from breeding yet. The presence of eel seed at nature is only found in rainy season, so the needs for cultivation throghout year is unavailabile. Becouse of that, stunting technique is needed for eel seed until the need is fulfilled for the year.
This research aims to examine the effect of stunting to physiological condition of 1-2 g eel seed. The research was conducted from September 2013 to February 2014 at Aquatic Animal Fhysiologi Laboratory FPIK IPB.
The research consist of two phases experiment, the first was carried out to determine the level of feed requirements for stunting. The second was econducted to examine the effect of stunting to physiological condition of freshwater eel seed. Feed which was used in this research was KRA feed with 46% protein content. Initial weight and length of eel were 1-2 g /ind and 10-12 cm/ind concecutively. First stage experiment was conducted at 4 treatment (0 %, 5 %, 10 % and 15 % of feed percentage freshwater eel seed biomass) which were kept in an aquarium measuring 40x30x30 cm3 with 8 fish / aquarium for density. Fishes were fed 2 days. Every 30 days the body weight of the fish body weight, proximate and blood analysis.
The results of this research showed that the stunting for one month was the best, which the lowest specific growth rate and growth approaching 0 % (0.1 %), diversity coefficient weights <20 % (19.90 %) and physiological conditions was normal (no defferent with control). Survival rate in experiment was above 96 %. Whereas stunting for two and three month showed that specific growth rate 0.2 %, similirity koefisien value >25 % (27.96 % and 30.37 %), and physiological conditions was up normal, Survival rate in experiment was above 96 % 89 %, respectively.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Pengelolaan Sumberdaya Perairan
PENGARUH
STUNTING
TERHADAP KONDISI FISIOLOGIS
BENIH IKAN SIDAT (
Anguilla bicolor bicolor
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
iii
Judul Tesis : Pengaruh Stunting terhadap Kondisi Fisiologis Benih Ikan Sidat (Anguilla bicolor bicolor McClelland, 1844)
Nama : Latifa Fekri NIM : C251120021
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Ridwan Affandi, DEA Ketua
Dr Ir Tatag Budiardi, MSi Anggota
Diketahui oleh
Ketua Program Studi
Pengelolaan Sumberdaya Perairan
Dr Ir Sigid Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Alhmadulillah puji dan syukur penulis panjatkan kepada Allah subhanahu
wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013 sampai dengan bulan Februari 2014 ini ialah pertumbuhan benih sidat, dengan judul “Pengaruh Lama Stunting terhadap Kondisi Fisiologis Benih Ikan Sidat (Anguilla bicolor bicolor McClelland, 1844)”.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Ridwan Affandi, DEA dan Bapak Dr Ir Tatag Budiardi, MSi selaku pembimbing, atas curahan waktu, perhatian, motivasi dan pikiran yang mengantarkan penelitian penulis hingga
selesai. Terimakasih juga penulis ucapkan kepada seluruh dosen Pengelolaan
Sumber Daya Perairan dan staf pegawai Pengelolaan Sumber Daya Perairan, atas arahan dan ilmu yang diberikan selama ini. Penghargaan yang sebesar-besarnya penulis ucapkan kepada ayahanda Asis, SE dan ibunda Timo Lisueja, BSc serta saudaraku tercinta (Fitria Azhari, SPd., Badar Matsal, ST., Nadia Adum Farhaini, Sakina Ilya Asis, dan Azuhri Qadrawi) atas segala doa, kasih sayang serta dukungan baik dana, tenaga maupun pikiran yang diberikan selama ini. Hasan Eldin Adimu, SPi MSi atas dukungan dan motivasinya selama penulis
menyelesaikan studi. Beasiswa Unggulan Dikti 2012 atas bantuan dana pendidikan
yang diberikan kepada penulis. Teman-teman Pengelolaan Sumber Daya Perairan dan teman-teman Forum Wacana Sulawesi Tenggara yang telah menemani selama ini, penulis ucapkan banyak terima kasih, semoga pertemanan silaturahmi dan kebersamaan ini tetap terjaga hingga akhir hayat kita.
Penulis berharap semoga karya ilmiah ini dapat berguna bagi kemajuan ilmu pengetahuan dan bermanfaat bagi semua pihak, khususnya kepada penulis kiranya
dapat menjadi bekal setelah menyelesaikan studi nantinya.
Bogor, September 2014
v
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 METODE
Waktu dan Tempat 3
Penelitian Tahap Pertama 4
Rancangan Percobaan 4
Prosedur Percobaan 4
Penelitian Tahap Kedua 6
Rancangan Percobaan 6
Prosedur Percobaan 6
3 HASIL DAN PEMBAHASAN
Hasil 8
Pembahasan 12
4 SIMPULAN DAN SARAN
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 21
DAFTAR TABEL
1 Nilai kelangsungan hidup dan laju pertumbuhan spesifik benih ikan sidat selama
pemeliharaan 9
2 Kisaran nilai rata-rata parameter fisika–kimia air selama pemeliharaan 10 3 Nilai kelangsungan hidup, laju pertumbuhan spesifik dan koefisien
keragaman bobot benih ikan sidat selama pemeliharaan 11 4 Gambaran darah benih ikan sidat selama pemeliharaan. 11 5 Hasil pengukuran proksimat tubuh benih ikan sidat selama pemeliharaan. 11 6 Kisaran rata-rata parameter fisika–kimia air selama pemeliharaan 12
DAFTAR GAMBAR
1 Skema perumusan masalah 3
2 Bobot rata-rata benih ikan sidat pada masing-masing perlakuan selama 30 hari pemeliharaan. 9 3 Kurva hubungan antara tingkat pemberian pakan dengan SGR pada benih ikan
sidat selama 30 hari pemeliharaan. 10
DAFTAR LAMPIRAN
1 Dokumentasi penelitian 21
2 Prosedur kerja penentuan kadar amonia 26
3 Prosedur kerja penentuan kadar nitrit 29
4 Prosedur kerja uji gambaran darah ikan 30
5 Prosedur kerja analisis proksimat tubuh ikan 32
1
PENDAHULUAN
Latar Belakang
Stunting adalah proses penahanan pertumbuhan ukuran bobot atau panjang ikan. Stunting pertama kali dikembangkan di Filipina oleh Bombeo-Tuburan (1988) yang melakukan stunting pada ikan bandeng untuk dapat menyediakan pasokan benih sepanjang tahun. Pada saat itu, bandeng sebagai penyedia sumber protein yang murah untuk negara Asia Tenggara, namun budidaya dan produksi ikan bandeng tersebut terhalang terutama oleh pasokan benih yang tidak kontinu dan musiman, serta kurang tersedianya pakan praktis. Stunting hanya dapat dilakukan pada ikan yang memiliki umur hidup yang panjang, misalnya bandeng, kerapu dan sidat.
Sidat (Anguilla bicolor bicolor) merupakan jenis ikan yang bernilai ekonomis tinggi, dan mengandung EPA dan DHA yang tinggi.. Kandungan asam lemak omega 3 sebesar 10.9 g/100 g, kandungan vitamin A mencapai 4700 IU/100 g, dan di hati lebih tinggi lagi, yaitu 15000 IU/100 g, lebih tinggi dari kandungan vitamin A mentega yang hanya mencapai 1900 IU/100 g. Kandungan DHA ikan sidat 1337 mg/100 g melebihi ikan salmon mengandung 820 mg/100 g dan ikan tenggiri yang mengandung 748 mg/100 g. Kandungan EPA ikan sidat mencapai 742 mg/100 g, melebihi ikan salmon (492 mg/100 g) dan ikan tenggiri (409 mg/100 g) (Pratiwi dalam Haryono 2008).
Ikan sidat laku di pasar internasional terutama di Jepang, Hongkong, Jerman, Italia, Taiwan, dan Korea, sehingga ikan ini memiliki potensi sebagai komoditas ekspor (Affandi 2005; Haryono 2008). Indonesia dianggap sebagai daerah pusat keanekaragaman ikan sidat (Aoyama 2009) sehingga Indonesia memiliki potensi yang besar untuk mengembangkan budidaya ikan sidat.
2
Musim migrasi glass eel di alam dari laut ke muara adalah pada musim hujan, dengan demikian maka benih sidat yang ditangkap pada musim hujan harus dibesarkan dahulu hingga ukuran 1-2 g yang membutuhkan waktu 2-3 bulan masa pemeliharaan (Affandi 2010). Apabila benih berukuran 1-2 g tersebut langsung ditebar kelokasi restocking maka ada kemungkinan waktu tebar tidak tepat karena berada pada musim kemarau/awal musim kemarau. Untuk menunggu waktu penebaran yang tepat, benih yang berukuran 1-2 g tersebut perlu ditahan pertumbuhannya (stunting) melalui pembatasan pakan pada level maintenance agar dalam pemeliharaannya tidak banyak menggunakan tempat dan biaya yang tinggi. Selain itu, adanya musim benih yang terbatas, sedangkan kebutuhan benih ukuran 1-2 g harus kontinu sepanjang tahun pada kegiatan budidaya, maka stunting benih sidat untuk keperluan budidaya juga perlu dilakukan. Pada kegiatan stunting perlu dipertanyakan bagaimana pengaruh stunting terhadap kondisi kesehatan benih pasca dilakukan stunting dalam kaitannya dengan kesiapan benih untuk ditebar di perairan umum (restocking ) atau dipelihara pada wadah budidaya. Sehubungan dengan perlunya stunting tersebut, baik untuk keperluan restocking di perairan umum maupun untuk kegiatan budidaya serta perlunya informasi kondisi benih pasca-stunting maka penelitian ini penting untuk dilakukan.
Perumusan Masalah
Ikan sidat mempunyai sifat katadromus yakni melakukan ruaya mijah ke laut dan anak-anak sidat melakukan ruaya kembali untuk tumbuh dewasa di perairan tawar. Ruaya merupakan bagian terpenting dalam siklus hidup ikan sidat untuk kelangsungan proses regenerasi. Pemutusan salah satu mata rantai siklus ini dapat mengakibatkan punahnya sumberdaya sidat di alam karena pemijahan hanya terjadi sekali dalam hidupnya (Herianti 2005). Ikan sidat merupakan sumberdaya dapat pulih namun rentan kepunahan. Eksploitasi ikan sidat di alam cukup tinggi, baik penangkapan pada ukuran benih maupun ukuran konsumsi. Upaya untuk mengurangi tekanan terhadap populasi sidat agar kelestariannya terjaga dapat dilakukan dengan mengembangkan kegiatan budidayanya.
Kegiatan budidaya membutuhkan benih dengan ukuran tertentu (1-2 g) dan saat ini benih yang digunakan masih dari alam yang ketersediaannya dipengaruhi oleh musim (musim hujan). Dengan demikian untuk menyediakan benih sepanjang tahun dapat dilakukan dengan memelihara dan menahan pertumbuhan (stunting) benih agar berada pada ukuran yang dibutuhkan pada setiap fase penebaran benih sepanjang tahun. Untuk dapat merealisasikan terjaminnya benih sepanjang tahun, maka penelitian ini dilakukan dalam dua tahap yaitu:
1) Penentuan tingkat kebutuhan pakan yang dapat menahan pertumbuhan (maintenance), optimum dan maksimum.
2) Menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat.
3
Gambar 1. Skema perumusan masalah
Tujuan Penelitian
Tujuan penelitian terdiri atas dua tahap: menentukan level pakan benih sidat (maintenance, optimum dan maksimum) dan menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi dasar dalam manajemen penyediaan benih ikan pada kegiatan budidaya dan restocking ikan sidat di perairan umum.
Ruang Lingkup Penelitian
Penelitian tahap awal dilakukan dengan mengaplikasikan empat perlakuan pemberian pakan dengan tujuan untuk menentukan level pakan maintenance, optimum dan maksimum pada pemeliharaan benih ikan sidat. Penelitian tahap kedua dilakukan dengan mengaplikasikan tiga perlakuan waktu stunting (satu, dua dan tiga bulan) dengan pemberian pakan pada level maintenace dengan tujuan, untuk menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat.
2 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan September 2013 hingga Februari 2014 di Laboratorium Fisiologi Hewan Air, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis fisika-kimia air berupa nitrit dan amonia dilaksanakan di Laboratorium Lingkungan Akuakultur FPIK IPB. Analisis darah
4
berupa glukosa darah, hemoglobin, eritrosit, leukosit dan hematokrit dilaksanakan di Laboratorium Fisiologi FKH IPB. Analisis proksimat berupa kadar air, protein, lemak, karbohidrat dan abu dilaksanakan di Laboratorium Sumberdaya Hayati dan Bioteknologi LPPM IPB.
Pelaksanaan Penelitian
Penelitian dilaksanakan dalam dua tahap, yaitu:
1) Tahap pertama, penelitian untuk menentukan kebutuhan pakan pada tingkat maintenance, optimum dan maksimum.
2) Tahap kedua, penelitian untuk menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat.
Penelitian Tahap I
Penelitian ini bertujuan untuk menentukan kebutuhan pakan pada tingkat maintenance, optimum dan maksimum benih ikan sidat berukuran 1-2 g.
Rancangan Percobaan
Penelitian ini dilaksanakan selama 30 hari menggunakan rancangan acak lengkap (RAL) dengan perlakuan jumlah pemberian pakan dengan level yang berbeda dan masing-masing perlakuan diulang 3 kali. Tingkat pemberian pakan pada masing-masing perlakuan adalah:
Perlakuan 1 : pemberian pakan sebanyak 0 % dari biomassa ikan Perlakuan 2 : pemberian pakan sebanyak 5 % dari biomassa ikan Perlakuan 3 : pemberian pakan sebanyak 10 % dari biomassa ikan Perlakuan 4 : pemberian pakan sebanyak 15 % dari biomassa ikan
Prosedur Percobaan
5 46 %, penentuan pemilihan ukuran pakan yang digunakan berdasarkan lebar bukaan mulut benih ikan sidat yang diukur menggunakan DinoCapture 2.0 dengan cara kerja pada Lampiran 1. Penyifonan air dilakukan setiap hari sebelum pemberian pakan pada pagi hari. Penyifonan dilakukan untuk menjaga kualitas air dalam media pemeliharaan. Sebanyak ¼ volume air dari akuarium dikeluarkan bersama kotoran yang ada pada air di akuarium, kemudian air tandon ditambahkan kembali ke dalam akuarium hingga volume semula.
Pengamatan dan Pengukuran
Pengamatan kematian benih ikan sidat dilakukan setiap hari, pengukuran bobot tubuh dan pengukuran fisika-kimia air (DO, pH, amonia dan nitrit) dilakukan tiap dua minggu sekali, sedangkan suhu diamati dua kali sehari yaitu sebelum pemberian pakan (08.00 dan 16.00). Pengukuran bobot ikan dilakukan dengan cara mengambil ikan dalam media pemeliharaan dari setiap akuarium menggunakan serok, selanjutnya ikan ditimbang satu persatu menggunakan timbangan digital dengan ketelitian seperseratus gram. Setelah ditimbang, ikan dikembalikan kedalam akuarium. Pengukuran parameter fisika-kimia air pada penelitian ini meliputi suhu yang diukur menggunakan termometer, oksigen terlarut air diukur menggunakan DO-meter, dan pH air diukur menggunakan pH-meter. Amonia dan nitrit air pemeliharaan dianalisis di Laboratorium Lingkungan Akuakultur FPIK IPB dengan penentuan kadar (amonia dan nitrit) pada Lampiran 2 dan 3.
Pengelolaan dan analisis data
Data kematian ikan dan bobot ikan diolah untuk menghitung tingkat kelangsungan hidup (survival rate, SR) dan laju pertumbuhan spesifik (spesifik growth rate, SGR).
A.Tingkat kelangsungan hidup
Tingkat kelangsungan hidup ikan dihitung dengan rumus Effendie (1997):
Keterangan :
SR = tingkat kelangsungan hidup (%)
No = jumlah ikan uji pada awal penelitian (ekor) Nt = jumlah ikan uji pada akhir penelitian (ekor) B.Laju pertumbuhan spesifik (specific growth rate)
Laju pertumbuhan spesifik dihitung dengan rumus Ricker (1979):
6 (ANOVA) pada tingkat kepercayaan 95 %. Apabila hasil analisis memperlihatkan adanya perbedaan nyata, maka dilakukan uji lanjut Tukey pada taraf nyata 5 % (Steel dan Torrie 1981). Pakan maintenance, optimum dan maksimum ditentukan dengan membuat kurva hubungan antara feeding rate (FR) dan SGR. Perpotongan antara SGR dengan FR dinyatakan sebagai pakan maintenance. Titik persinggungan kurva pertumbuhan dengan garis linear dianggap sebagai pakan optimum dan kebutuhan pakan maksimum ditentukan dari titik tertinggi kurva pertumbuhan. Parameter fisika-kimia air dianalisis secara deskriptif. Analisis data dilakukan dengan program MS Excel 2013 dan SPSS 16.0.
Penelitian Tahap II
Penelitian tahap kedua bertujuan untuk menganalisis pengaruh lama stunting terhadap kondisi fisiologis benih ikan sidat.
Rancangan Percobaan
Rancangan yang digunakan adalah rancangan acak lengkap (RAL) dengan 3 perlakuan waktu dan masing-masing perlakuan diulang 3 kali, yaitu:
Perlakuan 1: benih ikan sidat diberi pakan dengan tingkat pemberian pakan
Akuarium disiapkan sebanyak sembilan unit berukuran 60x40x303 cm lengkap dengan sistem aerasi dan filteri internal. Air diendapkan di dalam sebuah bak penampungan air selama 2-3 hari diaerasi. Air dimasukkan kedalam akuarium percobaan sebanyak 54 liter, didiamkan dan diberi aerasi selama 2-3 jam. Benih ikan sidat disiapkan sebanyak 270 ekor, yang ditebar 30 ekor/akuarium percobaan. Hari pertama pemeliharaan benih ikan dipuasakan selama 24 jam, setelah itu pakan diberikan dua kali dalam sehari, yakni pada pukul 08.00 (¼ bagian) dan pada pukul 16.00 (¾ bagian) dari jumlah pakan yang diberikan per harinya. Persentase yang banyak diberikan pada pukul 16.00 dikarenakan sifat nokturnal ikan sidat yang aktif makan pada malam hari. Jumlah pakan yang
_
7 diberikan per harinya sebesar 3.3 % (persentase pakan yang diberikan berdasarkan hasil percobaan tahap 1). Pakan diberikan setiap hari secara kontinu tanpa jeda, kecuali di hari pergantian air 100 %. Pakan yang digunakan adalah pakan komersial berbentuk pelet ukuran 1.5 mm dengan kadar protein 46 %, penentuan pemilihan ukuran pakan yang digunakan berdasarkan lebar bukaan mulut benih ikan sidat. Penyifonan air dilakukan setiap hari sebelum pemberian pakan pada pagi hari, proses penyifonan dilakukan untuk menjaga kualitas air dalam media pemeliharaan. Sebanyak ¼ volume air dari akuarium dikeluarkan bersama kotoran yang ada pada air di akuarium, kemudian air tandon ditambahkan kembali ke dalam akuarium hingga volume semula.
Pengamatan dan Pengukuran
Pengamatan yang dilakukan pada penelitian ini adalah pengamatan kematian yang diamati setiap hari pada saat pemberian pakan, sedangkan pengukuran bobot tubuh dilakukan pada hari ke-0, 30, 60 dan ke-90. Ikan sebanyak 30 ekor diambil dari setiap akuarium menggunakan serok. Selanjutnya, ikan ditimbang satu persatu menggunakan timbangan dengan ketelitian seperseratus gram. Setelah ditimbang, ikan dikembalikan kedalam akuarium. Pengukuran glukosa darah dan gambaran darah ikan dilakukan sebagai indikator stres. Pengukuran glukosa darah, gambaran darah dan analisis proksimat dilakukan sebanyak empat kali yaitu pada hari ke-0, 30, 60 dan hari ke-90. Pengukuran glukosa darah dan gambaran darah ikan dilakukan menggunakan metode pull yaitu dalam satu sampel darah untuk dianalisis berasal dari pengumpulan darah lima ekor ikan yang dikumpulkan dalam satu tabung penyimpanan darah. Masing-masing tabung tersebut sebelumnya telah diisi larutan heparin yang berfungsi untuk menjaga keenceran darah agar darah tersebut tidak mudah membeku, prosedur kerja dapat dilihat pada Lampiran 4. Pengukuran proksimat total tubuh benih sidat juga menggunakan metode pull karena syarat satu sampel untuk analisis proksimat adalah 15 gram bobot basah, sehingga dalam satu sampel untuk analisis proksimat benih sidat berasal dari pengumpulan 8-10 benih sidat yang dimasukkan kedalam satu plastik sampel, prosedur kerja dapat dilihat pada Lampiran 5.
Pengukuran parameter fisika-kimia air pada penelitian ini meliputi suhu yang diukur menggunakan termometer, oksigen terlarut air diukur menggunakan DO-meter, dan pH air diukur menggunakan pH-meter. Nitrit dan amonia air pemeliharaan dianalisis di Laboratorium Lingkungan Akuakultur FPIK IPB menggunakan sampel air media pemeliharaan.
Pengolahan dan analisis data
8
A.Tingkat kelangsungan hidup
Tingkat kelangsungan hidup ikan dihitung dengan rumus (Effendie 1997):
Keterangan :
SR = tingkat kelangsungan hidup (%)
No = jumlah ikan uji pada awal penelitian (ekor) Nt = jumlah ikan uji pada akhir penelitian (ekor) B.Laju pertumbuhan spesifik (specific growth rate)
Laju pertumbuhan spesifik dihitung dengan rumus Ricker (1979):
Keterangan :
Koefisien keragaman bobot dihitung dengan rumus Steel dan Torrie (1981): KK = (s/y) x 100 memperlihatkan adanya perbedaan nyata, maka dilakukan uji lanjut Tukey pada taraf nyata 5 % (Steel dan Torrie 1981) untuk mengetahui tingkat perbedaan antar perlakuan. Glukosa darah, gambaran darah, proksimat dan fisika-kimia air dianalisis secara deskriptif. Analisis data dilakukan dengan program MS Excel 2013 dan SPSS 16.0.
3 HASIL DAN PEMBAHASAN
HASIL
Tahap I
Tingkat Kelangsungan Hidup dan Laju Pertumbuhan Spesifik
Hasil pengukuran dan pengamatan selama penelitian didapatkan nilai SR dan SGR yang disajikan pada Tabel 1 dan Lampiran 6. Nilai SR benih ikan sidat
_ _
_
9 selama pemeliharaan memperlihatkan nilai yang baik (>90 %) dan hasil uji statistik menunjukkan bahwa tidak ada perbedaan nyata antar perlakuan (p>0.05). Laju pertumbuhan spesifik merupakan persentase pertumbuhan harian yang dihitung berdasarkan bobot ikan uji selama 30 hari penelitian. Hasil uji statistik SGR memperlihatkan bahwa ada perbedaan nyata (p<0.05) pada semua perlakuan (0 %, 5 %, 10 % dan 15 %).
Tabel 1 Nilai kelangsungan hidup dan laju pertumbuhan spesifik benih ikan sidat selama pemeliharaan
a
Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5 % ( uji selang berganda Tukey).
Perubahan Bobot Rata–Rata Selama Pemeliharaan
Perubahan bobot rata-rata benih ikan sidat dengan pemberian persentase pakan yang berbeda (0 %, 5 %, 10 % dan 15 %) selama pemeliharaan disajikan pada Gambar 2. Bobot rata-rata benih ikan sidat pada awal pemeliharaan adalah 1.14–1.32 g. Bobot ikan yang tidak diberi pakan selama pemeliharaan mengalami penurunan, dengan nilai bobot rata-rata menjadi 1.06 g, sedangkan bobot rata-rata pada perlakuan pakan 5 %, 10 %, dan 15 % selama pemeliharaaan mengalami kenaikan (Gambar 1) bobot nilai tertinggi dicapai pada perlakuan 10 %.
Gambar 2 Bobot rata-rata benih ikan sidat pada masing-masing perlakuan selama 30 hari pemeliharaan
10
Gambar 3 Kurva hubungan antara tingkat pemberian pakan (%) dengan SGR pada benih ikan sidat selama 30 hari pemeliharaan (MC = pertumbuhan nol, OP = pertumbuhan optimum, MK = pertumbuhan maksimum)
Fisika–Kimia Air
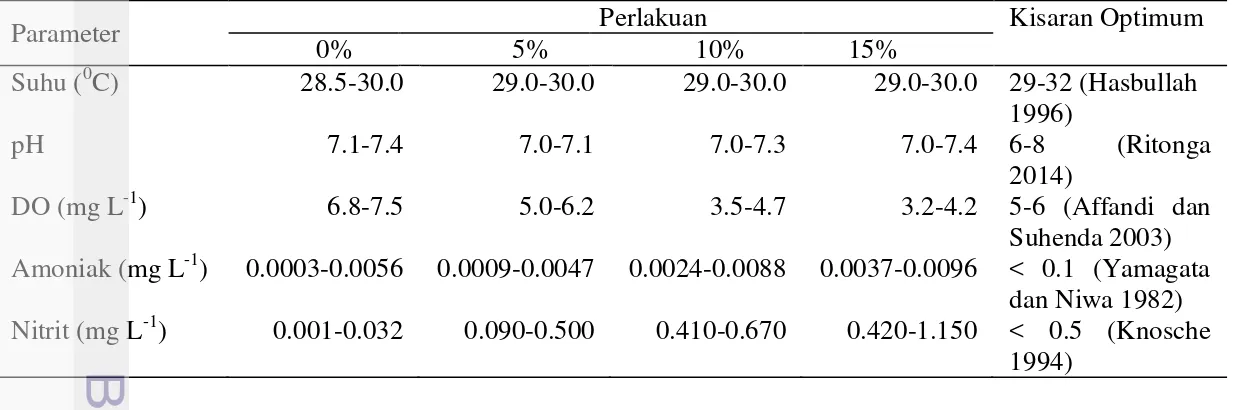
Nilai kisaran parameter fisika–kimia air pada media pemeliharaan benih ikan sidat (Anguilla bicolor bicolor) dengan pemberian persentase pakan yang berbeda (0 %, 5 %, 10 % dan 15 %) selama pemeliharaan disajikan pada Tabel 2. Parameter fisika-kimia perairan selama pemeliharaan. Masing-masing perlakuan menghasilkan nilai parameter fisika–kimia air yang optimum untuk pertumbuhan benih ikan sidat, namun DO dan nitrit pada perlakuan pemberian pakan 10 % dan 15 %, memiliki nilai yang berada diluar kondisi optimum bagi pertumbuhan ikan sidat.
Tabel 2 Kisaran nilai rata-rata parameter fisika–kimia air selama pemeliharaan
Parameter Perlakuan Kisaran Optimum
0% 5% 10% 15%
Amoniak (mg L-1) 0.0003-0.0056 0.0009-0.0047 0.0024-0.0088 0.0037-0.0096 < 0.1 (Yamagata
dan Niwa 1982)
Nitrit (mg L-1) 0.001-0.032 0.090-0.500 0.410-0.670 0.420-1.150 < 0.5 (Knosche
1994)
Tahap II
Tingkat Kelangsungan Hidup (SR), Laju Pertumbuhan Spesifik (SGR) dan Koefisien Keragaman Bobot(KK)
11 Tabel 3 Nilai kelangsungan hidup, laju pertumbuhan spesifik dan koefisien
keragaman bobot benih ikan sidat selama pemeliharaan
a
Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5 % ( uji selang berganda Tukey).
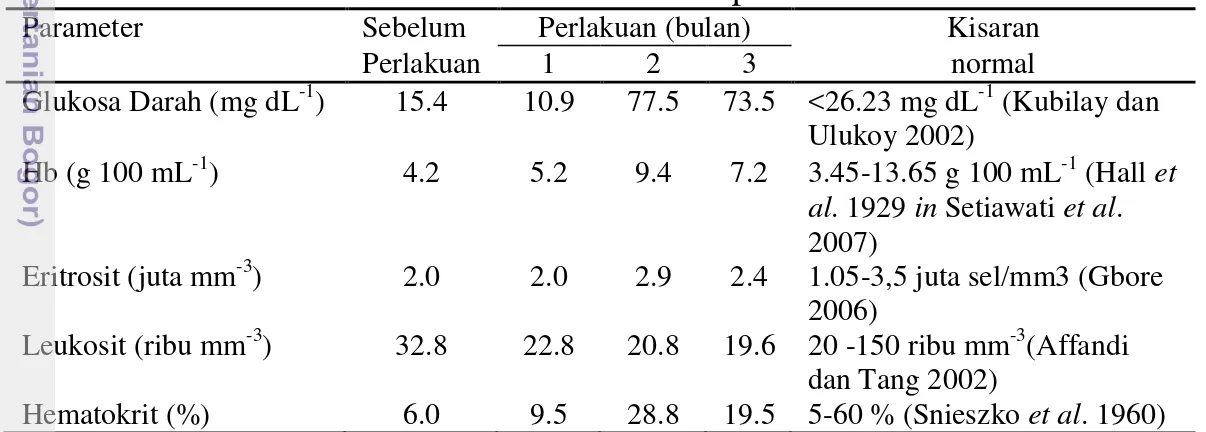
Gambaran Darah
Gambaran darah benih ikan sidat (Anguilla bicolor bicolor) dengan pemberian pakan pada tingkat maintenance (3.3 %) dengan waktu berbeda (satu, dua dan tiga bulan) disajikan pada Tabel 4. Glukosa darah mengalami fluktuasi. Nilai glukosa darah sebelum diberikan perlakuan sebesar 15.4 mg dL-1. Pada perlakuan stunting selama 1 bulan, nilai glukosa darah turun menjadi 10.9 mg dL
-1
,namun meningkat pada perlakuan 2 dan 3 bulan stunting yaitu sebesar 77.5 dan 73.5 mg dL-1. Nilai glukosa pada stunting 1 bulan masih berada pada kisaran normal. Gambaran darah (hemoglobin, eritrosit, leukosit dan hematokrit) pada semua perlakuan (satu, dua dan tiga bulan) berada pada kisaran normal.
Tabel 4 Gambaran darah benih ikan sidat selama pemeliharaan
Parameter Sebelum Perlakuan (bulan) Kisaran
Perlakuan 1 2 3 normal berbeda antar perlakuan sebelum dan setelah perlakuan stunting 1, 2 dan 3 bulan. Tabel 5 Hasil proksimat (%) tubuh benih ikan sidat selama pemeliharaan
Kandungan kimiawi tubuh
Sebelum Perlakuan (bulan)
perlakuan 1 2 3
Air 81.70±2.12a 75.98±1.34b 75.40±0.63b 79.83±1.08ab Protein 71.43±0.07a 50.27±0.38a 64.40±0.46b 63.09±0.92a Lemak 15.30±0.80a 12.75±0.69a 15.52±0.33a 12.39±0.48a Karbohidrat 6.85±1.33a 27.67±0.48ab 10.18±1.13ab 17.30±1.76b
Abu 6.43±0.06a 9.32±0.34b 9.90±0.32b 8.11±0.27a
a
Angka-angka pada baris yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% ( uji selang berganda Tukey).
12
Fisika–Kimia Air
Hasil pengukuran parameter fisika–kimia air selama pemeliharaan benih ikan sidat (Anguilla bicolor-bicolor) dengan pemberian pakan dengan tingkat maintenance (3.3 %) dengan lama pemeliharaan waktu berbeda (satu, dua dan tiga bulan) disajikan pada Tabel 6. Nilai rata–rata parameter fisika-kimia air selama pemeliharaan. Perlakuan stunting dengan waktu yang berbeda menghasilkan data nilai fisika-kimia air berada pada kisaran yang optimal bagi kelangsungan hidup dan pertumbuhan benih ikan sidat.
Tabel 6 Kisaran rata-rata parameter fisika–kimia air selama pemeliharaa
Parameter Perlakuan Kisaran Optimum
1 Bulan 2 Bulan 3 Bulan
Masing-masing perlakuan menghasilkan tingkat kelangsungan hidup rata-rata 100 % kecuali pada perlakuan pemberian pakan 15 % pada ulangan ke-2 (88 %). Hal ini membuktikan bahwa perlakuan pakan yang diberikan berupa pelet komersil dengan kandungan protein tinggi (45.95 %) tidak banyak mengubah kualitas air media kerena pada proses pemeliharaan benih tersebut dilakukan penyifonan dan penggantian air 100 % setiap dua minggu sekali.
Penurunan pertumbuhan pada perlakuan 0 % dikarenakan tidak adanya asupan makanan, padahal pertumbuhan hanya dapat terjadi bila adanya kelebihan energi dan protein yang berasal dari makanan yang dikonsumsi (Effendie 2007). Peningkatan pertumbuhan benih sidat di akuarium yang diberi pakan 5 %, 10 % dan 15 % sudah cukup baik. Namun demikian tampaknya pertumbuhan benih belum optimal apabila dikaitkan dengan kondisi kualitas air ideal seperti yang dikemukakan Affandi dan Suhenda (2003). Hal tersebut dapat dilihat dari nilai DO yang cenderung lebih rendah dan nitrit yang cenderung lebih tinggi dari nilai optimalnya.
13 metabolisme, bergerak, bernafas, mencerna makanan serta untuk mempertahankan kehidupan, sehingga tidak ada energi dari pakan yang dialokasikan untuk pertumbuhan (Effendie 2007). Pertumbuhan optimum terjadi pada saat pemberian pakan sebesar 7 % dari biomassa. Pertumbuhan optimum sangat diperlukan dalam usaha budidaya, dengan pertumbuhan optimum, biaya yang dikeluarkan untuk pakan dapat ditekan sehingga keuntungan dapat dimaksimalkan. Pertumbuhan maksimum pada benih sidat terjadi pada saat pemberian pakan sebesar 9.5 % dari biomassa (0.78 %). Hasil yang diperoleh dengan pemeliharaan 30 hari dengan bobot benih rata-rata 1.14-1.32 g tidak berbeda jauh dengan hasil penelitian Suhenda et al. (2003) pada pemeliharaan benih ikan sidat dengan bobot rata-rata 1.6 g selama 42 hari diperoleh penambahan bobot individu 1.15 g.
Kualitas air yang baik dalam media pemeliharaan merupakan faktor yang sangat penting untuk mendukung kelangsungan hidup dan pertumbuhan ikan sidat. Suhu pada media pemeliharaan sidat tergolong baik berkisar antara 28.5-30 0C. Hal ini sesuai hasil penelitian Hasbullah (1996) yang menyatakan bahwa suhu air optimal untuk pertumbuhan ikan Sidat adalah 29-32 0C. Nilai pH berkisar antara 7.0-7.4 nilai ini telah sesuai dengan pH yang dibutuhkan untuk memacu pertumbuhan sidat. Menurut Ritonga (2014), pH media pemeliharaan sidat sebaiknya dipertahankan pada nilai netral pada kisaran 6.0-8.0. Oksigen terlarut (DO) selama pemeliharaan berkisar 3.2-7.5 mg L-1 nilai ini terkadang mencapai batas minimum yang dibutuhkan untuk memacu pertumbuhan sidat, penurunan oksigen itu terjadi karena oksigen terlarut dalam air digunakan oleh bakteri untuk merombak amonia menjadi nitrit sehingga dapat menjadi penghambat pertumbuhan benih sidat, menurut Affandi dan Suhenda (2003) untuk meningkatkan produktivitas, maka kandungan oksigen terlarut dalam air sebaiknya dijaga pada level diatas 5 mg L-1. Nilai amonia dan nitrit meningkat seiring dengan peningkatan persentase pakan yang diberikan. Nilai amonia masih berada pada batas toleransi < 0.1 mg L-1 (Yamagata dan Niwa 1982), sedangkan kandungan nitrit pada perlakuan 10 %-15 % berada diluar batas toleransi benih ikan sidat yaitu berada pada kisaran 0.1-0.6 mg L-1. Tingginya nitrit dan rendahnya amonia pada media pemeliharaan karena amonia diubah menjadi nitrit (media diaerasi). Kandungan nitrit yang tinggi akan menyebabkan berkurangnya laju transportasi oksigen oleh darah (Hb) ikan, sehingga ikan akan bergerak lamban sehingga mempengaruhi aktivitas makan sidat (Degani et al. 1985). Komarawidjaja (2006) juga menyatakan bahwa nitrit beracun karena lebih mudah diikat oleh haemoglobin sehingga mengganggu pengangkutan oksigen oleh darah. Mekanisme efek toksik nitrit adalah ketika asam nitrous berdifusi ke dalam darah melalui insang lalu bereaksi dengan besi II (Fe2+) menghasilkan besi III (Fe3+). Hal ini akan mengurangi kemampuan sel darah merah untuk mengikat oksigen, yang mengakibatkan penyakit darah coklat (methemoglobin) yang dapat mematikan ikan karena kekurangan oksigen (hypoxia) (Wiesman et al. 2007). Knosche (1994) menyatakan bahwa kandungan nitrit yang aman untuk mendukung pertumbuhan benih ikan sidat adalah kurang dari 0.5 mg L-1.
Tahap II
14
jumlah pakan harian sebesar 3.3 % dari bobot biomassa, mampu memberikan energi yang dapat dimanfaatkan oleh ikan sidat untuk aktivitas tubuh sehingga ikan dapat melangsungkan kehidupannya. Demikin pula padat tebar yang di gunakan pada penelitian ini yaitu 1.4 g L-1 masih memadai, nilai SR yang sama juga didapatkan oleh Sasongko et al. (2007) yang menggunakan ukuran benih ikan sidat yang relatif sama dengan padat tebar 1.5-1.75 g L-1. Pemeliharaan benih dengan stunting yang baik berada pada pemeliharaan dengan lama stunting 1 bulan dengan pertumbuhan paling mendekati 0 (nilai SGR 0.1 %). Hasil analisis statistik menunjukkan bahwa tidak ada perbedaan nyata antar perlakuan (p>0.05). Laju pertumbuhan meningkat dengan meningkatnya lama stunting, namun dengan laju pertumbuhan yang lambat (≤0.2 %) selama pemeliharaan. Hal ini diakibatkan oleh perlakuan stunting dengan pembatasan pemberian pakan sehingga memperlambat pertumbuhan benih. Effendie (2007) juga menyatakan bahwa pertumbuhan ikan dipengaruhi oleh beberapa faktor yaitu faktor internal dan eksternal. Faktor internal umumnya adalah faktor yang sulit dikontrol, di antaranya adalah keturunan, jenis kelamin, umur, keberadaan parasit dan penyakit. Sedangkan faktor eksternal meliputi makanan dan suhu perairan.
Hasil penelitian memperlihatkan bahwa nilai koefisien keragaman bobot tubuh benih ikan sidat yang linear dengan lama stunting, semakin lama masa stunting maka nilai koefisien keragaman bobot tubuh benih ikan sidat semakin besar. Hal ini terjadi karena adanya persaingan dalam mendapatkan pakan oleh benih sidat. Benih ikan sidat yang memiliki bobot tubuh yang relatif lebih besar cenderung lebih mampu dalam mendapatkan pakan lebih banyak sehingga benih ukuran ini akan tumbuh lebih cepat, sedangkan benih ikan sidat yang memiliki bobot yang lebih kecil cenderung lebih lambat dalam memanfaatkan makanan yang diberikan sehingga pertumbuhannya lebih lambat. Nilai koefisien keragaman bobot yang baik adalah pada perlakuan stunting satu bulan dengan nilai KK <20 % (19.90 %). Mattjik and Sumertajaya (2000) menyatakan bahwa nilai KK yang dianggap wajar dalam suatu populasi adalah 20 %-25 %. Koefisien keragaman bobot pada perlakuan stunting dua dan tiga bulan memiliki nilai KK >25 % (27.96 % dan 30.37 %), nilai ini berada di atas nilai yang disarankan sehingga pada budidaya praktis sebaiknya setelah satu bulan masa pemeliharaan, dilakukan pemilahan ukuran benih (grading).
15 jambal siam terlihat mengalami stres yang ditandai dengan tingginya kadar glukosa dalam plasma darahnya.
Walaupun ada indikasi stres yang dialami benih ikan sidat pada perlakuan dua dan tiga bulan, namun benih masih mampu mempertahankan kelangsungan hidupnya dengan baik (SR>80 %). Hal ini juga diperlihatkan oleh adanya adaptasi benih, yaitu adanya peningkatan kadar glukosa darah pada masa stunting dua bulan, namun pada masa stunting tiga bulan mulai memperlihatkan penurunan. Apabila level stres sangat tinggi, dan terjadi peningkatan yang cepat dari glukosa darah dan nilainya bertahan pada level tinggi maka biasanya akan diikuti dengan kematian (Brown 1993).
Hemoglobin adalah protein dalam eritrosit yang tersusun atas protein globin yang tidak berwarna dan pigmen heme dalam eritrosit. Anderson dan Siwicki (1993) menyatakan bahwa peningkatan hemoglobin menunjukkan ikan berada dalam keadaan stres. Siakpere (1985) menyatakan bahwa secara fisiologis, hemoglobin menentukan tingkat ketahanan tubuh ikan dikarenakan hubungannya yang sangat erat dengan daya ikat oksigen oleh darah. Kemampuan darah untuk mengangkut oksigen bergantung pada Hb dalam darah (Lagler et al. 1977). Well et al. (2005) menyatakan bahwa 1 gram hemoglobin dapat mengikat kira-kira 1.34 ml oksigen. Hasil analisis hemoglobin ikan sidat selama pemeliharaan menunjukkan bahwa hemoglobin mengalami peningkatan dan tertinggi pada perlakuan stunting selama dua bulan, namun peningkatan hemoglobin pasca perlakuan stunting satu, dua dan tiga bulan masih berada pada batas normal (5.2, 9.4, dan 7.2 g 100 mL-1). Hall et al. (1929) dalam Setiawati et al. (2007) menyatakan, bahwa Hb benih ikan berkisar 3.45-13.65 g 100 mL-1. Hal ini menunjukkan bahwa perlakuan pembatasan persentase pakan pada waktu satu, dua dan tiga bulan tidak berpengaruh nyata terhadap kadar hemoglobin dalam darah ikan. Hasil penelitian serupa juga memperlihatkan tidak adanya pengaruh perlakuan cekaman panas dan pakan yang disuplementasikan tepung daun jaloh (Salix tetrasperma Roxb) pada kadar hemoglobin ikan nila (Oreochromis niloticus) (Safitri et al. 2013).
Pemeriksaan total eritrosit bertujuan untuk mengetahui status kesehatan ikan. Gbore et al. (2006) menyatakan bahwa tingginya jumlah eritrosit menandakan ikan dalam keadaan stres. Rendahnya jumlah eritrosit menandakan ikan menderita anemia dan kerusakan organ ginjal, sedangkan tingginya jumlah eritrosit menandakan ikan dalam keadaan stres (Wedemeyer dan Yasutake 1977; Nabib dan Pasaribu 1989). Sel darah merah terbentuk di jaringan hematopoetik ginjal dan pada ikan merupakan sel yang terbanyak. Hasil pengukuran kadar eritrosit pada ketiga perlakuan, menunjukkan bahwa nilai eritrosit pasca-stunting cenderung meningkat namun peningkatan nilai eritrosit pasca-stunting masih berada pada batas normal eritrosit ikan (2, 2.9, dan 2.4 %). Menurut Lagler et al. (1977), nilai normal eritrosit pada ikan adalah 1.05-3.00 x 106 sel/mm3.
16
bulan masih berapada pada kisaran normal jumlah leukosit ikan (19.6 – 22.8 ribu mm-3).
Jumlah leukosit setelah perlakuan mengalami penurunan dari jumlah sel darah putih sebelum perlakuan, menurunnya jumlah sel darah putih dapat mengakibatkan tubuh tidak terlindungi terhadap infeksi kuman penyakit. Hal ini dikarenakan fungsi leukosit adalah membunuh kuman penyakit dalam tubuh dan membentuk antibodi tubuh (Kwon 2012).
Meningkatnya kadar hematokrit dan eritrosit menunjukkan bahwa ikan dalam keadaan stres (Klontz in Johni et al. 2004). Hasil pengukuran kadar hematokrit dari ketiga perlakuan, terlihat bahwa nilai hematokrit pasca-stunting cenderung meningkat namun peningkatan nilai hematokrit pasca-stunting masih berada pada batas normal hematokrit ikan (9.5, 28.8, dan 19.5 %). Menurut Snieszko et al. (1960), nilai normal hematokrit pada benih ikan adalah 5-60 %.
Pakan yang digunakan adalah pelet kering berukuran 1.5 mm yang bersifat tenggelam dengan kandungan protein yang tinggi sebesar 45.95 %. Pakan yang diberikan berdasarkan kebutuhan protein sidat adalah 40-50 % dari asupan pakan yang diberikan (Rovara 2007). Pemberian pakan dengan kandungan protein yang tinggi memberikan pertumbuhan yang baik bagi kelangsungan hidup benih ikan sidat bila diberikan dengan takaran optimal yang dibutuhkan bagi kelangsungan hidup benih sidat, namun dengan adanya perlakuan stunting dengan pemberian pakan maintenance mengakibatkan pertumbuhan yang lambat (mendekati nol).
Hasil analisis proksimat tubuh benih ikan sidat pasca-stunting memperlihatkan adanya penurunan kadar protein dan lemak, hal ini disebabkan adanya pemanfaatan protein dan lemak tubuh untuk menutupi kebutuhan energi akibat adanya pembatasan pakan yang diberikan selama pemeliharaan. Sebaliknya, kadar abu dan karbohidrat tubuh pasca-stunting mengalami kenaikan, peningkatan kadar abu dan karbohidrat tubuh ini adalah akibat adanya penurunan komponen protein dan lemak pada saat kandungan kadar air tubuh benih ikan sidat pasca-stunting relatif tetap selama pemeliharaan.
17 KESIMPULAN
1. Tingkat kebutuhan pakan maintenance, optimum dan maksimum benih ikan sidat ukuran 1-2 g masing-masing adalah 3.3 %, 7.0 % dan 9.5 %.
2. Stunting benih ikan sidat selama satu bulan pemeliharaan tidak menunjukkan kondisi stres, sedangkan masa stunting dua dan tiga bulan menunjukkan kondisi stres namun tampak adanya proses adaptasi, sehingga tingkat kematian benih akibat perlakuan tidak signifikan.
SARAN
1. Perlu dilakukan grading setiap sebulan sekali dalam proses stunting benih ikan sidat agar SGR benih yang di-stunting dan nilai KK bobot individu benih sidat memiliki nilai yang rendah.
2. Selain pembatasan persentase pakan untuk stunting benih ikan sidat, juga perlu dilakukan penurunan suhu media pemeliharaan agar benih memiliki nafsu makan yang rendah sehingga tidak terjadi persaingan makanan.
DAFTAR PUSTAKA
Affandi R, Suhenda N. 2003. Teknik budidaya ikan sidat (Anguilla bicolor). Prosiding Sumberdaya Perikanan Sidat Tropik. UPT Baruna Jaya. BPPT-DKP. Jakarta. Hal 47-54.
Affandi R, Tang UM. 2002. Fisiologi Hewan Air. Riau (ID): Unri Press Pekanbaru.
Affandi R. 2005. Strategi pemanfaatan sumberdaya ikan sidat, Anguilla spp. di Indonesia. Jurnal lktiologi Indonesia. 5(2): 77-81.
Affandi R. 2010. Strategi Pemanfaatan Sumberdaya Ikan Sidat, Anguilla spp. di Indonesia. Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Prosiding Seminar Riptek Kelautan Nasional. FPIK IPB.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health programs. Paper presented in second symposium on diseases in Asian
Aquaculture “Aquatic Animal Health and the Evironment”.
Phuket,Thailand.25-29 th October 1993. 17 hlm.
Anggorodi HR. 1990. Ilmu Makanan Ternak Umum. Jakarta (ID): Gramedia Pustaka Utama.
Aoyama J. 2009. Life history and evolution of migration in catadromous eels (Anguilla sp.). Aqua-Bio Science Monograph (AMSM). 2(1): 1-42.
Barham D, Trinder P. 1972. An Improved colour reagent for the determination of blood glucose by the oxidase system. Analyst . 97:142-5
Bombeo-Tuburan I. 1988. The effect of stunting on growth, survival and production of milkfish (Chanos chanos Forsskal). Aquaculture 75: 97-104. Boyd CE. 1988. Water Quality in Warm Water Fish Ponds. Alabama (US):
Fourth Printing. Auburn University Agriculture Experiment Station.
18
Darsudi. 2011. Analisis Kandungan Proksimat Bahan Baku Dan Pakan Buatan/ Pelet Untuk Kepiting Bakau. Balai Besar Riset Perikanan Budidaya Laut. Degani GA, Horowitz, Levanon D. 1985. Effect of protein level in purified diet
and density ammonia and O2on growth of juvenil europan eels Anguilla
Anguilla L. Aquaculture (46):193-200.
Djajasewaka H. 1985. Pakan Ikan. Jakarta (ID): PT. Yasaguna.
Effendi MI. 1997. Metode Biologi Perikanan. Bogor (ID): Yayasan Dewi Sri. Effendi MI. 2007. Biologi Perikanan. Yogyakarta (ID). Yayasan Pustaka
Nusatama.
Evans DH, Claiborne JB. 2006. The Physiology of Fishes. Third Edition. Taylor and Francis.
Floyd RFC, Watson DP, Deborah BP. 2005. Ammonia in Aquatic System. University of Florida.
Gbore FA, Oginni AM, Adewole, Aladetan JO. 2006. The effect of transportation and handling stress on hematology and plasma biochemistry in fingerlings of Clarias gariepinus and Tilapia zilli. World Journal of Agricultural Science 2(2): 208-212.
Haryono. 2008. Sidat, belut bertelinga: potensi dan aspek budidayanya. Fauna Indonesia, 8(1): 22-26
Hasbullah. 1996. Pengaruh tingkat salinitas (0, 3, 6 dan 9‰) dan suhu (23, 26, 29
dan 320C) terhadap kelangsungan hidup dan pertumbuhan benih ikan sidat (Anguilla bicolor McClelland) pada masa pemeliharaan 0-2 minggu setelah penangkapan dari alam [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hastuti S, Supriyono E, Mokoginta I, Subandiyono. 2003. Blood Glukose Response of Giant Gouramy (Osphronemus gaouramy, Lac.) to the Stress of Environmental Temperature Changes. JurnaI Akuakultur Indonesia, 2(2): 73 -77
Herianti I. 2005. Rekayasa lingkungan untuk memacu perkembangan ovarium ikan sidat(Anguilla bicolor). Oseanologi dan Limnologi. 37: 25-41.
Johnny F, Zafran, Rosa D, Mahardika K. 2003. Hematologis beberapa pesies ikan laut budidaya. Jurnal Penelitian Perikanan Indonesia. 9 (4): 34–38.
Knosche R. 1994. An Effective Biofilter Type For Eel Culture In Resirculation System. Aquaculture engineering. Elsevier applied science. 13.
Komarawidjaja W. 2006. Pengaruh perbedaan dosis oksigen terlarut (DO) pada degradasi amonium kolam kajian budidaya udang. Jurnal Teknologi Lingkungan. BPPT. 1(1): 32–37.
Kubilay A, Ulukoy G. 2002. The effects of acute stress on rainbow trout (Oncorhynchus mykiss). Turk J Zool. 26 (2002) 249 – 254.
Kwon, Jeremiah. 2012. Sel Darah Merah (Eritrosit), Sel Darah Putih (Leukosit) dan Keping Darah (Trombosit). http://asiabussinescenter.blogspot.com. [15 Januari 2014].
Lagler KF, Bardach JE, Miller RR, Passino DRM. 1977. Ichthyology. John Wiley and Sonc Inc. New York-London.
19 Mattjik AA, Sumertajaya M. 2000. Perancangan Percobaan dengan Aplikasi SAS
dan MINITAB. Edisi Kesatu. Bogor (ID): IPB Press.
Mazeaud MM, Mazeaud F. 1981. Andrenergic Responses to Stress in Fish. In A.D. Pickering. (Ed.): Shess and Fish. London (GB): Academic Press. Nabib R, Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan
dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. Bogor (ID): UPT Produksi Media Informasi LSI-IPB.
Noercholis A, Aziz M, Muslim, Maftuch. 2013. Ekstraksi fitur roundness untuk menghitung jumlah leukosit dalam citra sel darah ikan. Jurnal EECCIS. 7(1): 35-40.
Paulo CFC, Pedro HSK, Elaine A, Correia S, Bernardo B. 2009. Transport of jundia (Rhamdia quelen) juveniles at different loading densities: water quality and blood parameters. JournalNeotropical Ichthyology, 7(2): 283-288.
Porchas MM, Córdova LRM, Enriquez RR. 2009. Cortisol and glucose: reliable indicators of fish stress?. Pan-American Journal of Aquatic Sciences. 4(2): 158-178
Ricker WE. 1979. Growth Rates and Models. In: W.S. Hoar, D.J. Randall and J.R. Brett (Editors). Fish Physiology. Vol. VIII. Bioenergetics and Growth. New York (US): Academic Press.
Ritonga T. 2014. Respon benih ikan sidat (Anguilla bicolor bicolor) terhadap derajat keasaman (pH) [skripsi]. Bogor (ID): Institut Pertanian Bogor. Rovara O. 2007. Karakteristik reproduksi, upaya maskulinisasi dan pematangan
gonad ikan sidat betina (Anguilla bicolor bicolor) melalui penyuntikan ekstrak hepofisis [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Rudiyanti S, Ekasari AD. 2009. Growth and survival rate of cyprinus carpio linn juvenile on different concentration of regent 0.3 g pesticide. Jurnal Saintek Perikanan. 5(1): 39 – 47.
Sacks DB. 1999. Carbohydrates, In : Burtis CA, Ashwood ER, editors. Tietz Textbook of clinical Chemistry, 3rd ed Philadelpihia (US): W,B Saunders Company.
Safitri D, Sugito, Suryaningsih S. 2013. Hemoglobin levels of Tilapia fish (Oreochromis niloticus) treated by heat stress and supplemented with willow (Salix tetrasperma Roxb) leaves powder supplementation. Jurnal Medika Veterinaria. 7(1): 39-41.
Sasongko A, Purwanto J, Mu’minah S, Arie U. 2007. Sidat Panduan Agribisnis Penangkapan, Pendederan dan Pembesaran. Jakarta (ID). Penebar Swadaya.
Setiawati M, Mokoginta I, Suprayudi MA, Manulu W. 2007. Pengaruh penambahan mineral fe pada pakan ikan terhadap status kesehatan ikan kerapu bebek. Jurnal Perikanan dan Ilmu Kelautan. 121:55-63.
Siakpere OK. 1985. Haematological characteristics of clarias fisheriensis. S.J. Fish Biology. 27 (3): 259-264.
Sniezko SF. 1960. Microhematocrite as a tool in fishery research and management. US. Wildi. Serv. Sci.Ref. Fish, 341:15.
20
Subiakto S. 2012. Budidaya Sidat Janjikan Omzet Menggiurkan. http://indonesia.go.id/in/kementerian/kementerian/kementerian-kelautan-dan-perikanan/823-perikanan/10997-budidaya-sidat-janjikan-omzet- menggiurkan.html. [15 Januari 2014].
Sugita H, Nakamura H, Shimada T. 2005. Microbial communities associated with filter materials in recirculating aquaculture systems of freshwater fish. Aquaculture. 243:403-409.
Suhenda N, Affandi R, Ulum B. 2003. Pengaruh Tingkat Penambahan Campuran Vitamin Pada Pakan Buatan Terhadap Pertumbuhan Banih Ikan Sidat, Anguilla bicolor dalam Aplikasi Teknologi Pakan dan Peranannya Bagi Perkembangan Usaha Perikanan Budidaya. Prosiding Semiloka Pusat Riset Perikanan Budidaya. Hal 73-79.
Sutrisno. 2008. Penentuan salinitas air dan jenis pakan alami yang tepat dalam pemeliharaan benih ikan sidat (Anguilla bicolor). Jurnal Akuakultur Indonesia, 7(1): 71–77.
Syawal H, Ikhwan YS. 2011. Respon fisiologis ikan jambal siam (Pangasius hypopthalamus) pada suhu pemeliharaan yang berbeda. Berkala Perikanan Terubuk. 39(1): 51-57.
Thomas L. 1998. Clinical Laboratory Diagnostics, 1st ed. Frankfurt (DE): TH-Books Verlagsgesellschaft.
Tillman AD, Hartadi H, Reksohadiprodjo S, Prawiro KS, Lebdosoekoekojo S. 1998. Ilmu Makanan Ternak Dasar. Yogyakarta (ID): Gadjah Mada University Press.
Wedemeyer GA, Yasutake WT. 1977. Clinical Methods for Assesment of the Effect of Environmental Stress on Fish Health. Thechnical papers of the U.S Fish and Wildlife Service, Fish and Wildlife Service 89:1-17.
Well RMG, Baldwin J, Seymour RS, Christian K, Britain T. 2005. Blood cell function and haematology in two tropical freshwater fishes from Australia. Comparative Biochemistry and Physiology. 141(1):87-93.
Wiesman U, Choi IS, Dombrowski M. 2007. Fundamental of Biological Wastewater Treatment. Germany (DE): WILEY-VCH Verlag GmbH & Co. KgaA, Weinheim.
21 Lampiran 1. Dokumentasi penelitian
Pakan benih ikan sidat (pelet komorsil merek KRA, kandungan protein 46%)
22
Pengukuran lebar bukaan mulut benih ikan sidat
23 Media pemeliharaan benih ikan sidat
24
Keragaman bobot benih ikan sidat selama stunting 1 bulan
Keragaman bobot benih ikan sidat selama stunting 2 bulan
26
Lampiran 2. Prosedur kerja penentuan kadar amonia
Menurut Floyd dan Watson (2005) bahwa amonia adalah produk sisa metabolisme yang utama dari ikan, dikeluarkan melalui insang dan urine. Sumber utama amonia sebenarnya berasal dari protein pada pakan ikan yang dimakan oleh ikan untuk kebutuhan energi dan nutrien, deaminasi asam amino menjadi energi menghasilkan amonia yang dikeluarkan sebagai sisa metabolisme.
Analisa NH3-N (Amonia)
Metode fenat digunakan untuk menentukan kadar amonia pada sample air dan air limbah. Amonia bereaksi dengan hipoklorit dan fenol yang dikatalisis oleh natrium nitroprusida membentuk senyawa biru indofenol. Absorbansi indofenol ini sebanding dengan konsentrasi ammonia yang diukur dengan spektrofotometer pada panjang gelombang 640 nm dengan menggunakan kuvet 1 cm.
Peralatan dan Bahan
Peralatan
Spectrofotometer dengan panjang gelombang 640 nm. Pipet ukur 10 mL, 25 mL
Campurkan 11,1 mL fenol cair ( ≥ 89%) dengan etil alkohol 95% sampai
volume 100 mL(Catatan : larutan ini harus disiapkan setiap minggu) 2. Latutan Natrium Nitroprusida (C5FeN6Na2O) 0,5%
3. Larutkan 0,5 gram natrium nitroprusida dengan akuades dan encerkan sampai volume 100 mL. Simpan pada botol amber dan dapat disimpan selama 1 bulan.
4. Larutan Natrium Hipoklorit (NaClO) 5% 5. Larutan Alkalin Sitrat (C6H5Na3O7)
6. Larutkan 200 gram trinatrium sitrat dan 10 gram NaOH dengan akuades, kemudian encerkan sampai volume 1000 mL.
7 Larutan Pengoksidasi
8. Larutkan 100 ml larutan alkalin sitrat dengan 25 ml natrium hipoklorit. 9. Larutan Standar Induk Amonia (1000 mg N/L)
10. Larutkan 3,819 gram amonium klorida (NH4Cl) (yang telah dikeringkan
pada suhu 100oC) dengan akuades, kemudian encerkan sampai dengan volume 1000 mL
11. Larutan Standar Baku Amonia (10 mg N/L)
27 Prosedur Kalibrasi
Buat larutan standar kerja amonia masing-masing dari larutan standar baku 10 mg N/L menjadi volume 100 ml dengan konsentrasi sbb. :
No Konsentrasi Larutan Standar Kerja(mg/L)
Volume Penambahan Larutan Standar Induk (ml)
1 Blanko 0,0
2 0,1 1,0
3 0,2 2,0
4 0,3 3,0
5 0,5 5,0
Lakukan analisa absorbansi sesuai dengan prosedur. Buat kurva kalibrasi antara konsentrasi larutan standar dengan hasil pembacaan absorbansinya.
Yakinkan bahwa koefesien korelasi (R2) dari kurva kalibrasi adalah ≥ 0,995 Catat nilai R2, slope dan intersep dalam kertas kerja.
Prosedur Analisa
1. Pipet 25 mL sample, kemudian masukkan ke dalam erlenmeyer 50 mL 2. Tambahkan 1 mL larutan fenol, kemudian homogenkan.
3. Tambahkan 1 mL larutan natrium nitroprusida, kemudian homogenkan 4. Tambahkan 2,5 mL larutan pengoksidasi, kemudian homogenkan 5. Tutup Erlenmeyer dengan paraffin film.
6. Diamkan selama t 1 jam, untuk pembentukan warna.
7. Kemudian masukkan sample ke dalam kuvet, dan ukur absorbansi pada panjang gelombang 640 nm.
Semua alat uji amonia (spektrometer) hanya mengukur TAN , fraksi NH3
28
Hasil laboratorium analisis TAN yang di hitung berdasarkan Boyd (1988) dengan memperhatikan nilai pH dan temperatur yang berbeda, disajikan pada tabel berikut:
pH TEMPERATUR (' C)
29 Lampiran 3. Prosedur kerja penentuan kadar nitrit
Analisis kadar nitrit pada sampel air bersih dengan tahapan sebagai berikut:
1. Sebanyak 50 mL sampel air dengan salah satu sampel dibuat secara duplo dipipet
dan dimasukkan ke dalam labu erlenmeyer 100 mL.
2. Sebanyak 1 mL larutan asam sulfanilat ditambahkan dan dibiarkan larutan
tersebut bereaksi selama 2-8 menit.
3. Sebanyak 1 mL larutan NED dihidroklorida ditambahkan,diaduk dan dibiarkan
paling sedikit 10 menit, tetapi tidak lebih dari 2 jam.
4. Larutan sampel dimasukkan ke dalam kuvet pada alat spektrofotometer, dibaca
dan dicatat serapannya pada panjang gelombang 543 nm.
5. Apabila perbedaan hasil pengukuran secara duplo lebih besar dari 2 %, periksa
keadaan alat dan diulangi tahapan 1 sampai dengan 4, apabila perbedaanya lebih kecil atau sama dengan 2 %, rata-ratakan hasilnya (SNI-06-2484-1991).
Rumus Perhitungan:
mg/L NO2-sebagai N = C × fp
Dimana:
30
Lampiran 4. Prosedur kerja uji gambaran darah
1) Prosedur Kerja Pengambilan Darah
Pengambilan darah ikan yaitu terlebih dahulu syringe dengan antikoagulan agar tidak terjadi pembekuan darah dalam penyaringan. Darah di ambil pada bagian belakang sirip anal, syringe ditusukkan hingga mengenai tulang belakang, kemudian darah disedot perlahan. Kemudian darah dimasukkan ke dalam ependorf yang telah dibilas antikoagulan, sentrifus sampai homogen. Amati kadar glukosa darahhemoglobin, kadar hematokrit, sel darah merah, sel darah putih. 2) Pengukuran Kadar Glukosa Darah
Uji glukosa darah dengan cara, ambil reagent glukosa sebanyak 1000 μl
tabung reaksi kedalam mikrotube 2 ml (2000 μl ), tambahkan plasma darah yang akan diuji sebanyak 10 μl harus menggunakan mikropipet, biarkan selama 15
menit amati sampai terjadi perubahan warna merah muda atau jingga, kemudian pindahkan kedalam cuvet kapasitas 1,5 ml dan dilakukan pengukuran dengan spektropotometer, dilakukan dengan panjang gelombang 546 nm, yang secara otomatis dapat langsung terbaca, sebagai perhitungan perlu dibuatkan larutan standar dari reagent glukosa 1000 μl ditambahkan 10 μl larutan standar, bandingkan larutan warna sampel dan larutan standar yang telah ditentukan, kemudian larutan standar masukkan kedalam spektrofotometer, untuk mengetahui kadar larutan standar gunakan panjang gelombang yang sama, kemudian sudah
dapat dihitung kadar glukosa darah dengan rumus berdasarkan metode ”GOD – PAP ” Enzymatic photometric test (Thomas L, 1998; Sacks DB, 1999; Barham D, Trinder P., 1972). Dibaca dengan panjang gelombang 546 nm.
3) Pengukuran Kadar Hemoglobin
Dalam penghitungan kadar hemoblobin, darah dihisap menggunakan pipet Sahli sampai 20 m3/0.2 ml. Kemudian pipet dimasukkan ke dalam tabung Hb-meter yang telah diisi dengan HCl 0.1 N sampai mencapai skala 10. Diaduk selama 3-5 menit secara perlahan. Ditambahkan akuades sedikit demi sedikit sampai warna larutan sama dengan warna larutan standar. Kadar hemoglobin yang diperoleh merupakan skala yang ditunjukkan.
4) Penentuan Nilai Hematokrit
Perhitungan hematokrit dilakukan dengan cara salah satu ujung tabung hematokrit dicelupkan kedalam tabung yang berisi darah sehingga darah naik ke tabung hematokrit sampai bagian. Setelah itu, ujung tabung ditutup dengan crystoseal dengan cara ujung tabung ditancapkan kedalam crystoseal sampai 1 mm. Selanjutnya, disentrifus dengan kecepatan 3000 rpm selama 5 menit, kemudian bagian yang mengendap dan total endapan dengan cairan diukur dalam 100% sebagai berikut:
31 5) Penghitungan Jumlah Sel Darah Merah
Perhitungan sel darah merah dilakukan dengan cara darah dihisap dengan menggunakan pipet yang berisi bulir sampai skala 1, kemudian ditambahkan larutan hayems sampai skala 101, serta diaduk selama 3-5 menit. Setelah itu, darah diteteskan pada hemasitometer (2 tetesan yang pertama dibuang) dan ditutup dengan cover glass untuk diamati dan dihitung jumlah sel darah merahnya di bawah mikroskop. Cara perhitungannya adalah 5 kotak besar pada hemasitometer, jumlah sel darah merahnya dihitung menggunakan rumus:
SDM = Rataan sel terhitung x (1)/(volume kotak besar) x pengenceran 6) Penghitungan Jumlah Sel Darah Putih
Perhitungan sel darah putih dilakukan dengan cara darah dihisap dengan menggunakan pipet yang berisi bulir sampai skala 0.5, kemudian ditambahkan larutan turks sampai skala 11, serta diaduk selama 3-5 menit. Setelah itu, darah diteteskan pada hemasitometer (2 tetesan yang pertama dibuang) dan ditutup dengan cover glass untuk diamati dan dihitung jumlah sel darah putihnya di bawah mikroskop. Cara perhitungannya adalah hanya 25 kotak kecil yang terdapat pada kotak besar dihemasitometer, jumlah sel darah putihnya dihitung menggunakan rumus :
32
Lampiran 5. Prosedur kerja analisis proksimat tubuh ikan
Analisis proksimat atau analisis Weende dikembangkan dari Weende Experiment Station di Jerman oleh Henneberg dan Stokman pada tahun 1865, yaitu suatu metode analisis dan menggolongkan komponen yang ada pada makanan. Cara ini dipakai hampir di seluruh dunia dan disebut “analisis
proksimat” (proximate analysis). Analisis ini didasarkan atas komposisi susunan kimia dan kegunaannya (Tillman et al., 1998).
1) Penentuan kadar air
Air yang terkandung di dalam tepung ikan akan menguap seluruhnya apabila bahan tersebut dipanaskan selama beberapa waktu pada suhu 105 sampai 110 0C dengan tekanan udara bebas. Alat yang digunakan adalah silica disk yang berfungsi sebagai tempat sampel yang tidak mudah rusak karena memiliki titik leleh lebih dari 1000oC sehingga dapat digunakan dalam menentukan analisis proksimat dan merusak sampel pada suhu yang tinggi, desikator yang berfungsi sebagai penstabil suhu, silica gel berfungsi menyerap air. Alat lain yang digunakan adalah oven (105 sampai 110 0C), yang berfungsi untuk menguapkan seluruh air yang terdapat dalam sampel, tang penjepit untuk mengeluarkan silica disk dari dalam oven, dan timbangan analitik yang digunakan untuk menimbang sampel baik yang belum atau sudah di oven ataupun untuk menimbang silica disk. Berdasarkan data-data yang diperoleh, maka kadar air dapat dihitung dengan mejumlah bobot gelas timbang dan bobot cuplikan kemudian dikurangi bobot gelas timbang dan cuplikan setelah dioven 105 sampai 110oC, kemudian dikali 100% dan dibagi bobot cuplikan pakan.
Sampel makanan ditimbang dan diletakan dalam cawan khusus dan dipanaskan dalam oven pada temperatur 105 0C. Pemanasan berjalan hingga sampel sudah tidak lagi turun beratnya. Setelah pemanasan tersebut sampel
makanan disebut “sampel bahan kering” dan pengurangannya dengan sampel
makanan tadi disebut persen air atau kadar airnya (Tillman et al., 1998) 2) Penentuan kadar abu.
Menurut Anggorodi (1990), abu merupakan zat-zat mineral sebagai suatu golongan dalam bahan makanan atau jaringan hewan ditentukan dengan membakar zat-zat organik dan kemudian menimbang sisanya. Suatu bahan pakan bila dibakar pada suhu 550 sampai 600OC selama beberapa waktu maka semua zat organiknya akan terbakar sempura menghasilkan oksida yang menguap yaitu berupa CO2, H2O dan gas-gas lain, sedangkan yang tertinggal tidak menguap
adalah oksida mineral atau yang disebut abu. Berdasarkan data-data yang diperoleh, maka kadar abu dapat dihitung dengan menghitung bobot sampel dan silica disk setelah ditanur 550 sampai 600oC, kemudian dikurangi bobot silica disk kosong sebelum ditenur dan dikali 100% dan dibagi bobot sampel sebelum ditanur.
33 pengeringan pada pembuatan tepung ikan yaitu pengeringan matahari, pengeringan vacuum, pengeringan dengan uap panas dan pengeringan dengan api pijar sesaat. Pengeringan dan lama pengeringan mempengaruhi kualitas tepung ikan. Seluruh senyawa organiknya akan terbakar menjadi CO2 dan H2O dan gas
lain yang menguap, sedang sisanya adalah abu atau campuran dari berbagai oksida mineral sesuai dengan macam mineral yang terkandung di dalamnya. Abu hasil pembakaran dapat digunakan sebagai titik tolak untuk determinasi persentase zat-zat tertentu yang terdapat dalam bahan pakan (Anggorodi, 1990).
3) Penentuan kadar protein kasar.
Penentuan protein kasar dengan alat Kjeldahl. Analisis ini menggunakan asam sulfat dengan suatu katalisator dan pemanasan (Tillman et al., 1998). Alat yang digunakan dalam praktikum ini adalah timbangan analitik, labu kjeldahl 650 ml yang berfungsi sebagai tempat sampel pada saat destruksi dan destilasi, labu erlenmeyer sebagai tempat penampung sampel pada saat titrasi, gelas ukur 100 ml untuk mengukur reagensia yang digunakan, buret yang berfungsi sebagai tempat HCl pada saat titrasi, pipet volume 25 atau 50 ml untuk mengambil larutan reagensia yang digunakan, corong yang berfungsi untuk mempermudah dalam memasukkan larutan HCl ke dalam buret, alat destruksi yang berfungsi untuk melepaskan N-organik sampel, dan alat destilasi yang berfungsi untuk mendestilasi sampel. berfungsi untuk mencegah terjadinya superheating ataupun pemercikan cairan atau timbulnya gelembung gas yang besar. Protein kasar asal ikan herring yang tertinggi dan yang terendah dari ikan tuna. Kandungan protein kasar yang menengah berasal dari ikan menhaden dan sarden.
4) Penentuan kadar lemak kasar.
Lemak kasar merupakan campuran dari berbagai senyawa yang larut dalam pelarut lemak. Menurut Tillman et al., (1998), sampel bahan kering diekstrasi dengan etil eter selama beberapa jam, maka bahan yang didapatkan adalah lemak, eter akan menguap. Alat yang digunakan dalam praktikum ini adalah timbangan analitik, tang penjepit, oven pengering, desikator, seperangkat alat ekstraksi dan selongsong dari soxhlet yang berfungsi untuk ekstraksi lemak, labu penampung yang berfungsi menampung sisa petroleum benzene yang jatuh dari soxhlet , alat pendingin yang berfungsi untuk mengkondensari uap hasil penguapan petroleum benzen agar tidak mencemari lingkungan, dan kertas saring bebas lemak yang berfungsi untuk menyaring ekstrak.