PENGARUH APLIKASI BAKTERI PERAKARAN PEMACU
PERTUMBUHAN TANAMAN PADA TIGA GENOTIPE CABAI
(
Capsicum annum
L.) TERHADAP PERTUMBUHAN TANAMAN
SERTA KEJADIAN PENYAKIT PENTING CABAI
SRI MARIA
A34051919
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
annum L.) TERHADAP PERTUMBUHAN TANAMAN SERTA KEJADIAN PENYAKIT PENTING CABAI
Sri Maria
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman Fakultas Pertanian Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
HALAMAN PENGESAHAN
Judul : Pengaruh Aplikasi Bakteri Perakaran Pemacu Pertumbuhan Tanaman Pada Tiga Genotipe Cabai (Capsicum annum L.) Terhadap Pertumbuhan Tanaman Serta Kejadian Penyakit Penting Cabai
Nama Mahasiswa : Sri Maria
NIM : A34051919
Menyetujui
Pembimbing I Pembimbing II
(Dr.Ir. Sri Hendrastuti Hidayat, MSc) (Dr.Ir. Widodo, MS)
NIP : 19610708 198603 2 001 NIP
Mengetahui, Ketua Departemen,
( Dr. Ir. Dadang, M.Sc) NIP 19640204 199002 1 002
SRI MARIA. The effect of Plant Growth Promoting Rhizobacteria Application on Three genotypes of Chilli (Capsicum annum L.) against Plant Growth and Chilli Important Disease Incidence. Supervised by SRI HENDRASTUTI HIDAYAT and WIDODO.
In Indonesia, chilli was an important vegetable commodity refer to production area as well as it’s value, but production of chilli in Indonesia still very low. The low production was caused by a lack of proper cultivation techniques, seed quality, and pest and plant disease. Important disease that can decrease the production of chilli includes antrachnose disease, bacterial wilt, mosaic and mottle virus in chilli. The disease controlling effort that were recently developed and relatively safe for the environment, using Plant Growth-promoting Rhizobacteria (PGPR). The objective of this study was to determine the effect of PGPR usage, that were P. fluorescens PG01 isolates, B. polymixa BG25 and a mixture of both isolates (PG01 + BG25) against agronomic characters and incidence of important diseases in the three genotypes of chilli (IPB C5, C10 IPB, and Kopay) on the experimental units. Each experimental unit consisted of 20 plants, with a total 720 plants were tested. PGPR treatments significantly influenced the plant height and number of branches, but gave no significant effect on leaves number. The highest growth improvement on vegetative phase was occurred by the mixed bacterial treatment (PG01 + BG25). IPB C10, C5 genotypes and varieties of IPB Kopay have different agronomic characteristics measured on plant height, number of branches and number of leaves. PGPR treatment did not affect significantly to crop production and disease incidence (antraknosa, bacterial wilt, TMV, CMV, and ChiVMV). Antrachnose infections most commonly found in Kopay varieties, while the bacterial wilt infection occurs more frequently in genotypes IPB C5.
RIWAYAT HIDUP
Penulis merupakan anak terakhir dari delapan bersaudara, lahir pada tanggal 31 Maret 1987 di Sukabumi, Jawa Barat. Orang tua bernama Endang Suhendi dan Nani Sutiana.
Penulis menyelesaikan pendidikan menengah atas di SMA YPI 45 Bekasi, pada tahun 2005. Pada tahun yang sama penulis diterima sebagai mahasiswa di Institut Pertanian Bogor (IPB) melalui jalur undangan seleksi mahasiswa IPB (USMI) dan pada tahun berikutnya penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Segala puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala rahmat dan karuniaNya dan shalawat beriring salam semoga tetap tercurah bagi Nabi Muhammad Sallallahu Alaihi Wassallam sehingga penulis dapat menyelesaikan skripsi ini yang merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor.
Ucapan terima kasih yang sebesar-besarnya kepada Ayah dan Ibunda tercinta atas do’a, perhatian dan dukungan yang dicurahkan semata-mata demi keberhasilan anak-anaknya. Pada kesempatan ini, penulis menyampaikan rasa terima kasih yang sebesar-besarnya kepada:
1. Dr.Ir. Sri Hendrastuti Hidayat, MSi selaku dosen pembimbing I dan Dr. Ir. Widodo, MS selaku dosen pembimbing II yang telah membimbing, memberikan ilmu dan perhatian penuh kepada penulis selama penelitian dan proses penulisan skripsi ini.
2. Dr. Ir. Idham S Harahap, M.Si, selaku dosen pembimbing akademik yang telah memberikan bimbingan, bantuan, motivasi dan dorongan kepada penulis. 3. Dr. Rully Anwar selaku dosen penguji tamu yang memberikan masukan dan
menambah wawasan kepada penulis.
4. Ayah, Mamah, Kakak dan keponakanku yang telah memberikan kasih sayang, dukungan, perhatian, bantuan dan doa kepada penulis.
5. Pak Edi, Pak Dadang, Pak Sodik, Pak Yusuf, Pak Wawan, dan semua laboran di Departemen Proteksi Tanaman yang telah membantu penulis dalam penelitian.
6. Pak Kusnadi dan keluarga yang telah membantu penulis selama di lapangan. 7. Mbak Ita, Mbak Tuti, Mbak Cici, Mbak Devi, Bunda Ifa, Bu Rika, Wiwin dan
teman-teman di Laboratorium Virologi dan Mikologi atas segala bantuannya. 8. Teman-teman seperjuangan Proteksi Tanaman 42 atas kebersamaannya selama
ini yang telah memberikan banyak kenangan.
9. Adil, Dewi, serta teman-teman seperjuangan 42 wisma Novia II Lina, Komalasari, Wina, Juning, Triani, dini, Fitri dan Lili atas dukungan dan bantuannya selama ini.
Serta semua pihak yang telah membantu dalam mengerjakan penelitian ini yang tidak dapat penulis sebutkan satu-persatu. Semoga apa yang telah diberikan kepada penulis menjadi amal kebaikan.
Penulis menyadari bahwa masih banyak kekurangan dan kelemahan dalam penulisan skripsi ini. Penulis berharap semoga hasil penelitian ini dapat memberikan manfaat yang sebesar-besarnya bagi yang memerlukan.
Bogor, Maret 2010
DAFTAR ISI
Pemanfaatan Plant Growth-Promoting Rhizobacteria untuk Pengendalian Penyakit ... 9
Pseudomonas fluorescens dan Bacillus sp. sebagai Agens Biokontrol .. 10
BAHAN DAN METODE ... 12
Waktu dan Tempat Penelitian... 12
Bahan... 12
Deteksi dan Isolasi Cendawan dan Bakteri ... 15
HASIL DAN PEMBAHASAN ... 17
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Tinggi Tanaman ... 17
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Jumlah Cabang ... 19
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Jumlah Daun ... 21
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap jumlah dan Bobot Buah Cabai ... 23
Pengaruh Perlakuan PGPR terhadap Kejadian Penyakit Antraknosa... 25
Pengaruh Perlakuan PGPR terhadap Kejadian Penyakit Layu Bakteri ... 27
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Kejadian Infeksi Virus pada Tanaman Cabai ... 29
KESIMPULAN DAN SARAN ... 34
Kesimpulan ... 34
Saran ... 34
DAFTAR PUSTAKA ... 35
DAFTAR TABEL
Halaman
1. Pengaruh perlakuan PGPR terhadap tinggi tanaman cabai……….. 18 2. Pengaruh genotipe cabai terhadap tinggi tanaman cabai …………. 18 3. Pengaruh perlakuan PGPR terhadap jumlah cabang tanaman
cabai………. 20
4. Pengaruh genotipe cabai terhadap jumlah cabang tanaman cabai…. 20 5. Pengaruh perlakuan PGPR terhadap jumlah daun cabai…………... 22 6. Pengaruh genotipe cabai terhadap jumlah daun cabai……….. 22 7. Pengaruh perlakuan PGPR terhadap jumlah
dan bobot buah cabai……… 24
8. Pengaruh genotipe cabai terhadap bobot dan jumlah buah……….. 25 9. Pengaruh perlakuan PGPR terhadap persentase jumlah
buah cabai terinfeksi Colletotrichum spp………. 26
10. Pengaruh genotipe cabai terhadap persentase jumlah
buah cabai terinfeksi Colletotrichum spp………. 27 11. Pengaruh perlakuan PGPR terhadap jumlah tanaman
terinfeksi layu bakteri……….. 28 12. Pengaruh genotipe cabai terhadap jumlah tanaman
terinfeksi layu bakteri……….. 29
13. Pengaruh perlakuan PGPR terhadap infeksi virus
di lapangan berdasarkan pengamatan gejala……… 30 14. Pengaruh perlakuan PGPR pada masing-masing
genotipe cabai terhadap infeksi CMV,ChiVMV dan TMV
berdasarkan ELISA……….. 31
15. Pengaruh PGPR terhadap nilai absorban ELISA
pada tanaman cabai……….. 32
16. Pengaruh genotipe terhadap nilai absorbansi ELISA
1. Pengaruh perlakuan PGPR terhadap laju pertambahan
tinggi tanaman cabai ... 19
2. Pengaruh perlakuan PGPR terhadap laju pertambahan jumlah cabang tanaman cabai ... 21
3. Pengaruh perlakuan PGPR terhadap laju pertambahan jumlah daun tanaman cabai ... 23
4. Gejala buah terinfeksi Colletotrichum spp ... 25
5. Gejala tanaman terinfeksi layu bakteri ... 27
DAFTAR LAMPIRAN
... Halaman 1. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 1 MST ... 39 2. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 2 MST ... 39 3. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 3 MST ... 39 4. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 4 MST ... 39 5. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 5 MST ... 40 6. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 6 MST ... 40 7. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 7 MST ... 40 8. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe
cabai terhadap tinggi tanaman saat 8 MST ... 40 9. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah cabang saat 1 MST... 41 10. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah cabang saat 2 MST... 41 11. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah cabang saat 3 MST... 41 12. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah cabang saat 4 MST... 41 13. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah cabang saat 5 MST... 42 14. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah cabang saat 6 MST... 42 15. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah daun saat 1 MST ... 42 16. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah daun saat 3 MST ... 43 18. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah daun saat 4 MST ... 43 19. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah daun saat 5 MST ... 43 20. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah daun saat 6 MST ... 44 21. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap jumlah buah ... 44 22. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap bobot buah... 44 23. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap infeksi antraknosa ... 45 24. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap infeksi layu bakteri ... 45 25. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap infeksi virus berdasarkan gejala di lapangan ... 45 26. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap infeksi ChiVMV berdasarkan nilai absorban ELISA ... 45 27. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
terhadap infeksi CMV berdasarkan nilai asorban ELISA ... 45 28. Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai
PENDAHULUAN
Latar Belakang
Cabai (Capsicum annum L.) merupakan salah satu jenis sayuran yang cukup penting di Indonesia, baik untuk konsumsi di dalam negeri maupun untuk ekspor. Komoditas cabai dapat tumbuh dan berproduksi di dataran rendah sampai dataran tinggi, pada lahan sawah ataupun tegalan. Selain memiliki kandungan gizi yang tinggi, cabai juga sangat potensial secara ekonomis. Thompson dan Kelly (1957) menyatakan bahwa C. annum merupakan tanaman hortikultura yang mempunyai nilai ekonomi yang tinggi, selain dimanfaatkan sebagai bumbu masak cabai juga digunakan sebagai bahan baku berbagai industri makanan, minuman dan obat-obatan; dapat dipasarkan dalam bentuk segar dan olahan sehingga menambah pentingnya komoditas tersebut.
Secara nasional rata-rata hasil panen cabai di Indonesia baru mencapai 6,392 ton/ha pada tahun 2005 (Deptan 2006). Hasil tersebut masih jauh dari potensi hasilnya yang berkisar antara 12 hingga 20 ton/ha (Duriat 2003). Hal tersebut antara lain disebabkan karena berkurangnya luas panen, cara bertani yang masih tradisional dan adanya gangguan hama dan penyakit (Ditlintan 2005). Kebutuhan akan cabai terus meningkat setiap tahunnya sejalan dengan bertambahnya jumlah penduduk dan berkembangnya industri yang membutuhkan bahan baku cabai, sehingga mengakibatkan konsumsi cabai per kapita terus mengalami peningkatan.
oleh Ralstonia solanacearum dan penyakit yang disebabkan oleh infeksi virus. Tobacco mosaic virus (TMV), Cucumber mosaic virus (CMV), dan Chilli veinal mottle virus (ChiVMV) merupakan virus utama yang menyerang tanaman cabai di Indonesia (Sastrosumarjo 2003). Infeksi CMV dapat menyebabkan kerugian hasil panen pada tujuh kultivar cabai mulai 32 sampai 75% (Sulyo et al. 1984), sedangkan infeksi oleh TMV dapat menyebabkan kehilangan hasil mulai 20,5 % sampai 100% (Sutic et al. 1999). Kehilangan hasil panen yang disebabkan oleh infeksi ChiVMV berkisar antara 9 sampai 57% (Santika 2001). Infeksi yang ditimbulkan oleh TMV menunjukkan gejala mosaik sistemik baik ringan maupun berat pada daun tanaman. Serangan TMV yang sangat berat dapat menyebabkan mosaik parah disertai dengan deformasi daun hingga tanaman kerdil. Infeksi CMV pada daun cabai dapat menimbulkan gejala berupa mosaik hijau tua dan hijau muda, sedangkan pada buah menyebabkan buah tidak normal (CPC global Modul 2nd 1996-2000). Infeksi yang ditimbulkan oleh ChiVMV menunjukkan adanya gejala bercak hijau, penebalan tulang daun, daun menjadi lebih kecil dan kadang diikuti dengan malformasi daun (Siriwong et al. 1995).
Antraknosa adalah penyakit terpenting yang menyerang di semua daerah pertanaman cabai diseluruh dunia termasuk Indonesia. Di Indonesia, penyakit ini banyak dilaporkan di Sumatera Barat, Irian Jaya, dan Lampung serta di daerah Jawa, sedangkan di Asia dilaporkan terjadi di Singapura, Malaysia, Thailand, Filipina (Semangun 2000). Antraknosa dapat menyerang biji, batang, daun, dan buah cabai. Serangan penyakit ini ditandai dengan adanya bercak dipermukaan kulit buah atau pada bagian daun yang membentuk lingkaran konsentris berwarna hitam. Menurut Than (2008) antraknosa adalah salah satu penyakit yang paling penting dalam produksi cabai di dunia. Hal ini dikarenakan antraknosa dapat menyebabkan kerusakan sejak dari penyemaian sampai tanaman berbuah, dan merupakan masalah utama pada buah masak sehingga dapat menyebabkan penurunan mutu dan hasil produksi.
3
Agrios (2005) layu bakteri pada tanaman Solanaceae terjadi sebagai layu yang tiba-tiba. Jika menginfeksi tanaman muda, bakteri akan menyebabkan kematian. Pada tanaman yang lebih tua, pertama akan menunjukkan layu pada daun yang paling muda, atau pada satu sisi layu dan pertumbuhan terhambat, dan akhirnya tanaman akan layu secara permanen kemudian mati. Jaringan vaskuler pada batang, akar dan umbi berubah menjadi coklat dan akan mengeluarkan ooze yang merupakan eksudat bakteri.
Beberapa cara pengendalian terhadap penyakit yang disebabkan oleh virus, cendawan dan bakteri diantaranya dengan melakukan eradikasi gulma, proteksi silang, penanaman bibit sehat, pembongkaran tanaman sakit, pengendalian vektor, dan penggunaan kultivar tahan (Walkey 1991). Penggunaan kultivar tahan dapat mengurangi kejadian penyakit di lapangan secara efektif, tetapi pengembangan varietas tanaman ini relatif lama dan dinilai tidak ekonomis (Hadidi et al. 1998).
Kajian dan evaluasi untuk mengetahui efektivitas PGPR dalam meningkatkan pertumbuhan tanaman dan menekan infeksi penyakit di lapangan perlu dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh penggunaan P. fluorescens isolat PG01, B. polymixa isolat BG25 dan campuran keduanya (PG01+BG25) terhadap karakter agronomis dan kejadian penyakit-penyakit penting pada 3 genotipe cabai (IPB C5, IPB C10, dan Kopay) di lapangan.
Manfaat
Penelitian ini bermanfaat untuk memperoleh informasi tentang potensi bakteri pemacu pertumbuhan yang dapat digunakan sebagai alternatif pengendalian penyakit antraknosa, layu bakteri, mosaik dan belang virus pada cabai.
TINJAUAN PUSTAKA
Ekologi dan Syarat Tumbuh Cabai
Cabai (Capsicum annum L.) merupakan tanaman herba tegak dari famili terung-terungan (Solanaceae). Cabai dapat tumbuh pada daerah yang memiliki ketinggian antara 10-200 m di atas permukaan laut (dpl), sehingga cabai termasuk tanaman yang dapat ditanam di dataran tinggi maupun dataran rendah. Cabai dapat ditanam pada tanah yang gembur dan banyak mengandung unsur hara. Cabai tumbuh optimal di tanah regosol dan andosol. Namun, untuk pertumbuhan dan produksi terbaik, dianjurkan menanam cabai pada tanah berstruktur remah atau gembur dan kaya bahan organik, dengan pH tanah yang dikehendaki antara 5,0-6,0. Curah hujan yang ideal untuk bertanam cabai adalah 1.000 mm/tahun, sebab curah hujan yang rendah menyebabkan tanaman mengalami kekeringan dan
membutuhkan air untuk penyiraman. Sebaliknya, curah hujan yang tinggi dapat
merusak tanaman cabai serta membuat lahan penanaman tergenang air dan
kelembabannya tinggi. Oleh sebab itu, cabai biasanya ditanam pada lahan yang
agak miring untuk menghindari genangan air, namun tingkat kemiringan lahan
tidak lebih dari 25%. Lahan yang terlalu miring menyebabkan erosi dan hilangnya
pupuk karena tercuci oleh air hujan. Tanah yang terlalu datar harus dibuatkan
saluran pembuangan air (Topan 2008). Suhu optimum untuk pertumbuhan cabai adalah 21 °C-29.5 °C dengan suhu minimum 18°C dan maksimum 35 °C (Setiadi 2005). Pemeliharaan tanaman cabai meliputi penyiraman, penyiangan gulma dan pengendalian hama penyakit.
Hama dan Penyakit pada Tanaman Cabai
serangga hama, telah dikenali sebagai kendala utama untuk produksi cabai (Berke 2002).
Antraknosa pada Cabai
Antraknosa atau sering disebut sebagai penyakit patek pada cabai adalah penyakit yang disebabkan oleh cendawan Colletotrichum sp. Penyakit antraknosa ini menyebabkan kerugian yang sangat besar baik di daerah tropis maupun subtropis (Agrios 1997). Patogen antraknosa dapat menyerang cabai muda, cabai matang, atau cabai yang sudah dipasarkan sehingga menyebabkan buah membusuk, dan kering (Martoredjo 1984). Penyakit ini bisa menyerang biji, batang, daun, dan buah cabai. Serangan penyakit ini ditandai dengan adanya gejala seperti biji gagal berkecambah, batang kecambah rapuh, sehingga mudah rebah, pucuk mati dan infeksinya menjalar ke bagian bawah. Bercak dipermukaan kulit buah melesak kedalam daging buah dan membentuk lingkaran seperti terkena sengatan terik matahari. Serangan penyakit ini terjadi menjelang buah masak (Roberts et al. 2009).
Keberadaan penyakit busuk buah terutama dipicu oleh iklim mikro di pertanaman yang lembab, dan berembun, suhu tinggi, cuaca berkabut. Patogen mampu bertahan dalam biji, sehingga penyebaran melalui biji sangat mudah terjadi (seed borne diseases). Antraknosa adalah penyakit yang sangat berbahaya dan memiliki daya merusak berat terhadap produksi. Selain itu, penyakit ini bersifat laten, yakni mampu bertahan lama dalam jaringan tanaman dalam bentuk aservulus yang kemudian dapat ditumbuhi miselium. Spora Colletotrichum memiliki zat perekat, sehingga dengan mudah dapat melekat dan berpindah melalui peralatan pertanian, udara, dan angin. Selain kemampuan menyebar yang cepat, patogen mampu bertahan dalam tanah. Spora pada tanaman inang akan cepat berkecambah dan melakukan infeksi dalam waktu yang singkat, yakni sekitar lima hari (Mulyaman 2009).
Penyakit Layu Bakteri
7
tanaman dan kegagalan panen (Semangun 1994). Penyakit layu bakteri sulit dikendalikan karena R.solanacearum memiliki kisaran inang yang luas, termasuk patogen soil-borne, dan dapat menimbulkan infeksi laten (Abdullah dan Rahman 1998). Pada tanaman muda, serangan ditandai dengan layunya daun dari atas kanopi tanaman. Sementara itu, pada tanaman tua serangan ditunjukan dengan layunya daun tanaman dari bawah ke atas secara berangsur-angsur. Jika batang dibelah, terlihat jaringan pembuluh, pangkal batang, dan akar berwarna kecoklatan. Bila dipotong melintang dan dicelupkan ke air bersih, akan terlihat cairan keruh yang keluar dari potongan batang atau akar tersebut. Infeksi yang disebabkan oleh layu bakteri ini terjadi melalui luka-luka yang berada dibatang atau akar, lalu masuk ke jaringan pembuluh.
Upaya pengendalian penyakit layu bakteri dengan rotasi tanaman dan tumpangsari hanya mengurangi keparahan penyakit (Hartman dan Elphinstone 1994). Pengendalian dengan bakterisida secara terus menerus akan menimbulkan dampak yang tidak diinginkan seperti matinya musuh-musuh alami dan timbulnya resistensi pada patogen. Penggunaan varietas cabai tahan penyakit merupakan upaya pengendalian yang efektif dan ekonomis serta ramah lingkungan.
Virus Mosaik Tembakau (Tobacco Mosaic Virus/ TMV)
TMV merupakan virus yang termasuk ke dalam genus Tobamovirus. Kisaran inang virus ini sangat luas, beberapa tanaman inang yang penting termasuk dalam famili Solanaceae, Scrophulariaceae, Labiatae, Leguminoceae, Chenopodiaceae, Cucurbitaceae, dan Alliaceae. Namun tidak semua spesies yang terinfeksi TMV menunjukan gejala sistemik. Beberapa diantaranya hanya menunjukkan lesio nekrotik lokal pada titik infeksi (reaksi hipersensitif). Beberapa varietas yang menunjukkan reaksi hipersensitif yaitu tembakau, tomat, dan cabai (Sutic et al. 1999, CABI 2003).
Virus Mosaik Ketimun (Cucumber Mosaic Virus /CMV)
CMV mempunyai kisaran inang yang sangat luas, dapat ditularkan secara mekanik, beberapa spesies inang dapat ditularkan melalui benih (Matthews 2002), serta vektor serangga (Francki et al. 1979). Virus ini menyebabkan infeksi sistemik pada kebanyakan tanaman yang diinfeksinya. Bagian jaringan dan organ tanaman yang terbentuk pada awal infeksi biasanya tidak terpengaruh oleh infeksi CMV. Pengaruh infeksi CMV terutama terjadi pada sel-sel dan jaringan tanaman yang terbentuk setelah infeksi tersebut terjadi. Konsentrasi virus meningkat setelah terjadi inokulasi, kemudian menurun pada tingkat tertentu atau tanaman menjadi mati (Agrios 1998).
Virus Belang Cabai (Chilli Veinal Mottle Virus /ChiVMV)
ChiVMV merupakan virus yang termasuk ke dalam genus Potyvirus. Partikel virus ini berbentuk batang lentur dengan panjang 720-740 nm. Titik panas inaktivasi dari virus ini berkisar antara suhu 55-60 C, sedangkan titik batas pengencerannya berkisar antara 10-3- 10-4. Virus ini dapat bertahan secara in-vitro selama 7 hari pada suhu 20°C (Murayama 1998).
9
sebelum pembentukan buah. Daun dan buah tanaman yang terinfeksi ChiVMV akan mengalami distorsi dan berukuran lebih kecil (Cerkauskas 2004).
ChiVMV dapat ditularkan melalui inokulasi mekanis, penyambungan, dan serangga vektor secara non persisten, tetapi tidak terjadi melalui benih. Beberapa spesies serangga yang dilaporkan menjadi vektor ChiVMV adalah Aphis craccivora, A. gossypii, A. spiraecola, dan M. persicae. Diantara serangga vektor tersebut yang paling penting dan sering dijumpai menjadi vektor ChiVMV pada pertanaman cabai adalah M. persicae (CABI 2000). Virus ini hanya bertahan pada kutu daun selama tidak lebih dari 1 jam. ChiVMV dapat menginfeksi berbagai jenis cabai, diantaranya cabai merah, cabai keriting dan cabai rawit (Murayama 1998).
Pemanfaatan Plant Growth-Promoting Rhizobacteria (PGPR) untuk Pengendalian Penyakit
PGPR adalah agens (mikroba) yang bersifat menguntungkan bagi tanaman, dan termasuk sebagai agens penginduksi ketahanan. PGPR, yaitu kelompok bakteri yang dapat mengkoloni perakaran tanaman dan memiliki kemampuan untuk memacu pertumbuhan tanaman (Nelson 2004).
osmoprotektan pada kondisi cekaman kekeringan dan penghasil osmolit tertentu yang dapat membunuh patogen tanaman di tanah (Hasannudin 2003).
Penggunaan PGPR juga terbukti dapat mengendalikan serangan antraknosa pada cabai yang disebabkan oleh cendawan C. capsici sehingga mampu menekan kejadian penyakit pada buah cabai (Amalia 2007). Hal ini dikarenakan PGPR sebagai biokontrol berperan dengan mekanisme induced systemic resistance (ISR). Mekanisme ISR terjadi sebagai akibat perubahan fisiologi tanaman yang kemudian menstimulasi terbentuknya senyawa kimia yang berguna dalam pertahanan terhadap serangan patogen (Ramamoorthy et al. 2001). Perubahan fisiologi tersebut dapat berupa modifikasi struktural dinding sel atau perubahan reaksi biokimia pada tanaman inang. Beberapa faktor yang dapat menyebabkan adanya induksi ketahanan sistemik oleh bakteri yaitu: 1) adanya sumbangan lipopolisakarida oleh bakteri; 2) produksi siderofor oleh bakteri; dan 3) produksi asam salisilat yang dapat terjadi secara langsung ataupun secara tidak langsung (van Loon et al. 1998)
Perlakuan benih dengan menggunakan suspensi PGPR juga terbukti meningkatkan daya berkecambah dan indeks vigor. Penelitian Listiani (2006) menyatakan bahwa tanaman yang diberi perlakuan rizobakteri berpengaruh baik terhadap tinggi tanaman, panjang daun dan lebar daun bila dibandingkan dengan perlakuan kontrol. Selain itu keberadaan PGPR ini dalam tanaman juga dapat menekan kejadian penyakit seperti bercak daun bakteri pada ketimun (bacterial angular leaf spot) (Liu et al. 1995), penyakit nekrosis tembakau (Maurhofer et al. 1994), dan penyakit akar gada Plasmodiophora brassicae (Widodo 1993).
P. fluorescens dan Bacillus sp. Sebagai Agens Biokontrol
Bacillus dan Pseudomonas sebagai kelompok PGPR merupakan genus yang paling banyak diteliti dan berpotensi tinggi sebagai agens pengendali penyakit tanaman (Compant et al. 2005). Keduanya dilaporkan mampu menekan patogen secara langsung dengan mengeluarkan senyawa antibiotik dan induksi ketahanan sistemik pada tanaman.
11
pertumbuhan bakteri lain sehingga mudah diisolasi. Bakteri ini mampu mendominasi daerah rizosfer dan berkembang sangat cepat, bersifat gram negatif, motil, aerob/fakultatif anaerob (Pelczar dan Chan 1986). Pseudomonas sp. banyak dilaporkan sebagai penghasil fitohormon dalam jumlah besar khususnya Indole Acetic Acid (IAA). IAA merupakan hormon pertumbuhan kelompok auksin yang berguna untuk merangsang pertumbuhan tanaman. Auksin berfungsi untuk meningkatkan pertumbuhan sel batang, menghambat proses pengguguran daun, merangsang pembentukan buah, serta merangsang pertumbuhan kambium dan menghambat pertumbuhan tunas ketiak (Tjondronegoro et al. 1989). Pseudomonas sp. juga diketahui dapat memproduksi asam salisilat yang mampu mengendalikan virus nekrotik tembakau (Tobacco Necrotic Virus/TNV) pada tembakau (Maurhofer et al. 1994).
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Februari hingga November 2009 di lahan petani yang terletak di Desa Cibatok I, Kecamatan Cibungbulang, Kabupaten Bogor. Deteksi dan diagnosis penyakit dilakukan di Laboratorium Mikologi Tumbuhan dan Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah isolat bakteri P.
fluorescens PG01 dan B. polymixa BG25 yang merupakan koleksi Klinik Tanaman
Departemen Proteksi Tanaman. Bahan tanaman uji yang digunakan adalah cabai besar IPB C5, cabai rawit IPB C10 yang berasal dari Laboratorium Pemuliaan
Tanaman Departemen Agronomi dan Hortikulturadan cabai keriting varietas Kopay
yang didapat dari petani Payakumbuh, Sumatera Barat.
Metode
Pembuatan Suspensi Bakteri
Biakan murni bakteri diambil sebanyak 1 sampai 3 loop dari stok awal dan
digoreskan pada media untuk diremajakan. Bakteri kelompok Pseudomonas sp.
dibiakkan pada media King’s B dan bakteri kelompok Bacillus sp. dibiakkan pada
media Tryptic Soy Agar (TSA). Bakteri yang telah diremajakan diinkubasi pada suhu
ruangan selama 48 jam. Sebanyak 15 loop biakan murni yang didapat diencerkan dalam 100 ml NaCl 0,85% sehingga didapat suspensi bakteri (stok) dengan kepadatan
rata-rata masing-masing 1012 cfu/ml untuk Bacillus dan 1013 cfu/ml untuk
Pseudomonas (Jamaliah 2005). Setelah diperoleh suspensi stok bakteri, dilakukan pengenceran secara bertingkat sehingga didapat suspensi bakteri dengan kepadatan
13
didapat suspensi kombinasi kedua bakteri tersebut (PG01 dan BG25) dengan kepadatan yang sama.
Persiapan Lahan
Percobaan dilakukan pada lahan seluas 500 m2 di lahan petani Desa Cibatok I. Lahan tersebut dibagi ke dalam tiga kelompok. Dari setiap kelompok dibagi lagi menjadi empat petak utama, sesuai dengan perlakuan bakteri yang digunakan yaitu bakteri P. fluorescens (PG01), B. polymixa (BG25), campuran PGPR (PG01+BG25), dan tanpa perlakuan PGPR. Pengacakan taraf pertama dilakukan untuk menempatkan taraf pemberian suspensi bakteri ke dalam petak utama. Setiap dua belas petak utama (empat petak utama dari tiga kelompok) dibagi kedalam tiga anak petak, sesuai dengan taraf genotipe yang digunakan yaitu IPB C10, IPB C5, dan Kopay. Penempatan taraf faktor genotipe ke dalam setiap petak utama dilakukan secara acak. Tanaman uji yang ditanam pada tiap anak petak terdiri dari 20 tanaman, sehingga terdapat total 720 tanaman uji.
Tahapan yang dilakukan dalam persiapan lahan ini dimulai dengan pengolahan tanah secara konvensional. Pengolahan tanah ini bertujuan untuk mendapatkan tanah yang gembur yang sesuai untuk perkembangan akar tanaman, serta menstabilkan peredaran air, udara, dan suhu di dalam tanah (Prajanta 2002).
bambu yang dilengkungkan (membentuk huruf U). Setelah pemasangan mulsa selesai maka dilanjutkan dengan pelubangan mulsa. Proses pelubangan dilakukan tiga hari menjelang bibit dipindah tanam. Cara untuk membuat lubang tanam yaitu dengan menggunakan kaleng bekas susu yang salah satu ujungnya telah digunting, kemudian diisi arang yang sudah membara ke dalam kaleng tersebut. Kaleng ditempelkan kepermukaan mulsa plastik yang sudah ditandai untuk lubang tanam.
Perlakuan PGPR
Benih cabai yang sebelumnya telah dicuci kemudian dimasukkan ke dalam suspensi bakteri dengan kepadatan 106cfu/ml dan dibiarkan selama 10 jam pada suhu ruang. Sebagai perlakuan kontrol, benih cabai direndam dalam 10 ml NaCl 0,85% selama 10 jam.
Benih yang telah direndam disebar pada baki semai yang berisi media tanam berupa campuran tanah dan pupuk kandang dengan perbandingan 1:2 (v/v). Empat minggu setelah sebar bibit dipindah tanam ke lahan.
Satu minggu setelah tanam (MST), dilakukan penyiraman suspensi bakteri dengan kepadatan 109cfu sebanyak 100 ml per tanaman. Penyiraman dilakukan kembali pada 1,3, dan 6 minggu setelah tanam (MST). Pemupukan dilakukan pada saat tanaman berumur lima minggu dengan pupuk majemuk NPK (15-15-15) dengan dosis 5 g/tanaman.
Pengamatan Pertumbuhan, Produksi Tanaman, dan Kejadian Penyakit
Peubah pengamatan terkait pertumbuhan vegetatif, yaitu: tinggi tanaman, jumlah cabang, dan jumlah daun, diukur mulai 1 hingga 8 MST. Peubah pengamatan terkait produksi tanaman, yaitu bobot buah/tanaman dan jumlah buah/tanaman diukur pada 13 MST.
15
Laju pertambahan jumlah daun, jumlah cabang, dan tinggi tanaman dihitung dengan rumus :
Laju pertambahan = P(n+1)-P(n)
Keterangan :
P = jumlah daun, jumlah cabang, tinggi tanaman
N = waktu pengamatan minggu ke-1,2,…
Pengamatan penyakit penting (layu bakteri, antraknosa, mosaik dan belang) dilakukan dengan menghitung kejadian penyakit. Kejadian penyakit dihitung berdasarkan proporsi tanaman yang terinfeksi patogen dalam suatu populasi tanaman, tanpa memperhitungkan berat atau ringannya tingkat serangan dengan rumus:
KP = n/N x 100% Keterangan :
KP = Kejadian penyakit (%)
n = jumlah tanaman yang terinfeksi penyakit N = jumlah seluruh tanaman atau buah
Deteksi dan Isolasi Cendawan dan Bakteri
Isolasi penyebab penyakit yang disebabkan oleh bakteri dan cendawan masing-masing menggunakan media yang berbeda. Isolasi cendawan menggunakan media potato dextrose agar (PDA) sedangkan isolasi bakteri menggunakan media TSA. Isolasi cendawan dari buah yang menunjukkan gejala dilakukan untuk memastikan adanya infeksi Colletotrichum. Buah cabai yang menunjukkan gejala antraknosa di bersihkan dengan alkohol 70% hingga merata, kemudian dipotong jaringannya. Potongan tersebut dicelupkan kedalam larutan sodium hipoklorit 75%, lalu dikeringkan diatas tissue atau kertas serap steril, selanjutnya potongan tersebut diletakkan ke dalam cawan petri yang telah berisi media PDA. Setelah kurang lebih 2 hari, diamati pertumbuhan miselia, selanjutnya miselia yang terdapat dalam media diambil koloninya untuk diamati dibawah mikroskop.
layu. Bagian yang diisolasi yaitu batang yang dekat dengan bagian akar tanaman. Setelah dibersihkan dengan alkohol 70% bagian jaringan tersebut dipotong kecil-kecil. Selanjutnya potongan tersebut diletakkan kedalam cawan petri yang telah berisi media TSA. Setelah 28 jam media TSA yang telah ditumbuhui oleh koloni bakteri diamati bentuk dan warna koloninya.
Deteksi Virus dengan Metode Double Antibody Sandwich - Enzyme Linked Immunosorbent Assay (DAS-ELISA)
Deteksi virus pada tanaman cabai uji dilakukan dengan metode DAS- ELISA (Clark dan Adams 1997). Tahapan deteksi diawali dengan mengambil secara individual daun kedua, ketiga dan keenam dari tiap-tiap tanaman uji sebanyak 0,1 g. Selanjutnya, daun dimasukkan ke dalam plastik gerus dan disimpan dalam lemari pendingin (-80oC) sampai siap untuk pengujian.
Antiserum dipersiapkan dan dicampur dengan coating buffer (pH 9,6). Antiserum yang digunakan adalah ChiVMV (1:1000), CMV (1:1000), dan TMV (1:100). Tiap sumuran diisi dengan antiserum 100 µl. Plat ELISA yang telah terisi diinkubasi selama satu malam pada suhu 4oC. Setelah itu plat dicuci dengan menggunakan phosphate buffer saline tween (PBST) sebanyak 5 kali. Selanjutnya sumuran diisi dengan 100 µl sap tanaman terinfeksi dicampur dengan general extract buffer (pH 7,4) dengan perbandingan 1:5 (b/v). Plat ELISA diinkubasi selama satu malam, kemudian dicuci kembali dengan PBST sampai 5 kali.
Setiap sumuran kemudian diisi dengan enzim konjugat (alkaline phosphate conjugate, sigma) sebanyak 100 µl dengan perbandingan 1:1000 (v/v) dan diinkubasi selama 2-4 jam pada suhu 37oC. Plat ELISA kembali dicuci seperti sebelumnya.
17
reaksi positif dan negatif. Jika nilai absorbansi sampel yang diperoleh lebih besar atau sama dengan 2 kali kontrol negatif maka hasil uji tersebut dinyatakan positif.
Rancangan Percobaan
Percobaan disusun dalam rancangan petak terbagi (split plot design) secara acak kelompok dengan perlakuan bakteri sebagai petak utama dan genotipe sebagai anak petak. Empat taraf petak utama yaitu perlakuan PGPR isolat PG01, BG25, PG01+BG25, dan perlakuan tanpa PGPR sebagai pembanding. Tiga taraf anak petak yaitu IPB C10, IPB C5, dan Kopay. Pada percobaan terdapat 12 kombinasi perlakuan, masing-masing perlakuan terdiri dari tiga ulangan, sehingga terdapat 36 satuan percobaaan. Masing-masing satuan percobaan terdiri dari 20 tanaman, dengan jumlah keseluruhan adalah 720 tanaman uji.
Analisis Data
Data yang diperoleh dari pengamatan dianalisis dengan menggunakan program SAS for Windows v 9.1melalui Analisys of Variance (ANOVA). Apabila data menunjukkan pengaruh nyata maka dilanjutkan dengan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf 5% (ά = 0,05).
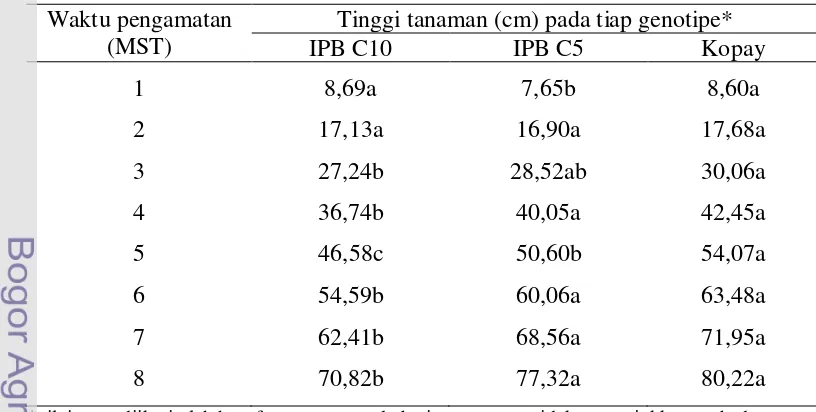
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Tinggi Tanaman
Bakteri perakaran pemacu pertumbuhan (PGPR) yang diaplikasikan pada tanaman umumnya dapat memberikan pengaruh dalam menginduksi pertumbuhan dan ketahanan tanaman terhadap infeksi patogen. Pengaruh induksi ketahanan ini terlihat pada pengamatan persentase kejadian penyakit pada masing-masing perlakuan dan genotipe cabai. Karakter pertumbuhan tanaman yang mendapat perlakuan PGPR pun secara umum pertumbuhannya lebih baik bila dibandingkan dengan tanaman tanpa perlakuan PGPR. Hal ini dikarenakan PGPR mampu meningkatkan pertumbuhan tanaman secara langsung melalui hormon-hormon pertumbuhan yang dihasilkan seperti Giberelin (GAs) dan indole 3-acetic acid (IAA). Disamping itu PGPR juga mampu mensintesis sitokonin dan beberapa fitohormon lain (Nelson 2004).
19
Tabel 1 Pengaruh perlakuan PGPR terhadap tinggi tanaman cabai Waktu pengamatan
(MST)
Tinggi tanaman (cm) pada tiap perlakuan PGPR PG 01 BG 25 PG01+BG25 Tanpa PGPR
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Masing-masing genotipe (IPB C5, IPB C10, dan Kopay) memiliki potensi yang berbeda untuk sifat tinggi tanaman. Pengaruh genotipe cabai terhadap tinggi tanaman terlihat berbeda nyata mulai 4 MST (Lampiran 1). Di akhir pengamatan genotipe Kopay dan IPB C5 cenderung lebih tinggi dibandingkan dengan dua genotipe lainnya ,IPB C5 dan IPB C10 (Tabel 2).
Tabel 2 Pengaruh genotipe cabai terhadap tinggi tanaman cabai Waktu pengamatan
(MST)
Tinggi tanaman (cm) pada tiap genotipe*
IPB C10 IPB C5 Kopay
Gambar 1 Pengaruh perlakuan PGPR terhadap laju pertambahan tinggi tanaman cabai
Laju pertambahan tinggi tanaman menunjukkan pola yang sama untuk perlakuan PGPR. Laju pertambahan tinggi tanaman meningkat hingga minggu terakhir pengamatan (8 MST). Berbeda dengan perlakuan PGPR, laju pertambahan tinggi tanaman tanpa PGPR meningkat hingga minggu ke 5 kemudian menurun pada minggu ke 6 dan meningkat lagi pada minggu ke 7. Perlakuan PGPR menyebabkan laju pertambahan tinggi tanaman lebih tinggi dibandingkan perlakuan tanpa PGPR (Gambar 1).
21
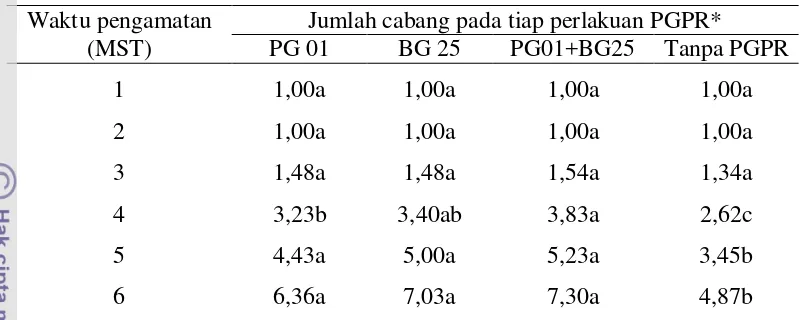
Tabel 3 Pengaruh perlakuan PGPR terhadap jumlah cabang tanaman cabai Waktu pengamatan
(MST)
Jumlah cabang pada tiap perlakuan PGPR* PG 01 BG 25 PG01+BG25 Tanpa PGPR
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Pengaruh genotipe cabai terhadap jumlah cabang terlihat berbeda nyata mulai 4 MST (Lampiran 9). Jumlah cabang yang dimiliki genotipe IPB C5 dan Kopay tidak berbeda nyata selama 6 minggu pengamatan, tetapi berbeda nyata dengan genotipe IPB C10 (Tabel 4). Diantara ketiga genotipe, IPB C10 memiliki jumlah cabang paling rendah yaitu sebesar 6,09.
Tabel 4 Pengaruh genotipe cabai terhadap jumlah cabang tanaman cabai Waktu pengamatan
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
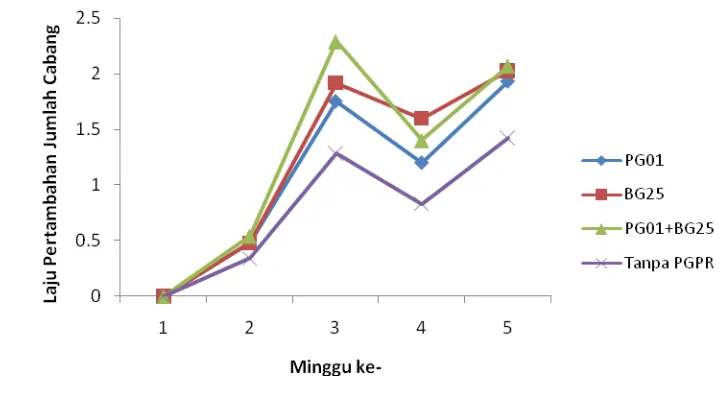
Gambar 2 Pengaruh perlakuan PGPR terhadap laju pertambahan jumlah cabang tanaman cabai
Penurunan laju pertambahan jumlah cabang pada minggu ke empat disebabkan oleh adanya gangguan lingkungan saat di lapangan yang menyebabkan cabang tanaman menjadi patah. Perlakuan campuran PGPR lebih berpengaruh terhadap laju pertambahan jumlah cabang karena adanya kombinasi kedua PGPR. Pseudomonas sp. merupakan penghasil fitohormon dalam jumlah yang besar khususnya IAA untuk merangsang pertumbuhan (Asghar et al. 2004), sedangkan B. polymixa menghasilkan hormon sitokinin (Timmusk et al. 1999), jika bersama IAA, sitokinin dapat merangsang pembelahan sel secara cepat.
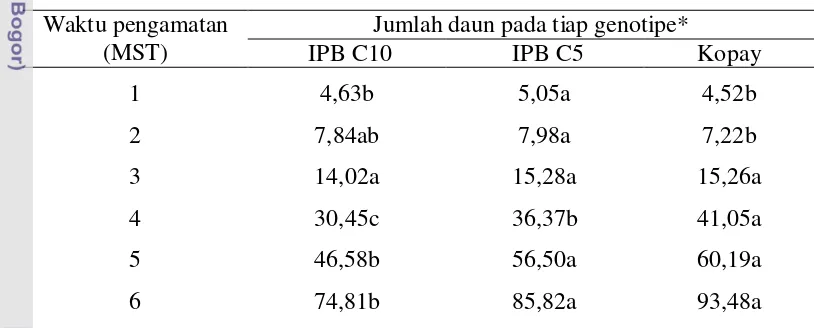
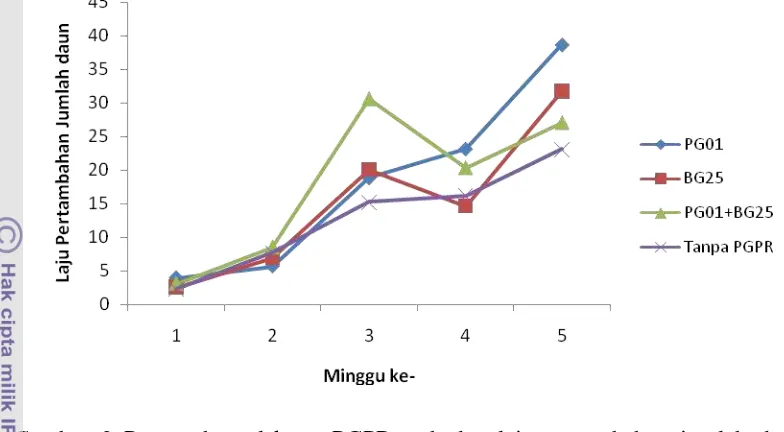
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Jumlah Daun
23
Tabel 5 Pengaruh perlakuan PGPR terhadap jumlah daun cabai Waktu pengamatan
(MST)
Jumlah Daun pada tiap perlakuan PGPR*
PG 01 BG 25 PG01+BG25 Tanpa PGPR
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Masing-masing genotipe cabai memiliki potensi genetik yang bervariasi untuk sifat jumlah daun. Perbedaan jumlah daun yang nyata antar genotipe terjadi pada 4 MST (Tabel 6). Pada akhir pengamatan (6 MST) genotipe Kopay memiliki jumlah daun tertinggi (93 helai daun) diikuti berturut-turut oleh IPB C5 (85 helai daun) dan IPB C10 (74,81 helai daun).
Tabel 6 Pengaruh genotipe cabai terhadap jumlah daun cabai Waktu pengamatan
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Gambar 3 Pengaruh perlakuan PGPR terhadap laju pertambahan jumlah daun tanaman cabai
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Jumlah dan Bobot Buah Cabai
Umur 13 MST adalah pada saat dilakukan pemanenan. Dari hasil pemanenan dapat dilakukan pengukuran bobot buah dan penghitungan jumlah buah. Pengukuran bobot buah bertujuan untuk mengetahui pengaruh perlakuan pemberian bakteri terhadap buah cabai. Dengan adanya pemberian bakteri diharapkan dapat meningkatkan mutu buah cabai baik dari segi kuantitas maupun kualitas. Penghitungan jumlah buah dilakukan untuk mengetahui jumlah buah dalam bobot buah per tanaman sehingga bisa diketahui kualitas buah cabai.
25
dikarenakan P. fluorescens dapat menghasilkan hormon auksin yang dapat merangsang pembentukan buah (Timmusk et al. 1999). Demikian pula dengan perlakuan PGPR campuran (PG01 + BG25), mampu menghasilkan buah dengan bobot dan jumlah yang lebih tinggi dibanding dengan tanpa PGPR. Dapat disimpulkan bahwa perlakuan PGPR mampu mempengaruhi produksi buah.
Tabel 7 Pengaruh perlakuan PGPR terhadap jumlah dan bobot buah cabai
Perlakuan Bobot Buah yang nyata menurut uji DMRT pada taraf 5%
Tabel 8 Pengaruh genotipe cabai terhadap bobot dan jumlah buah
Genotipe Bobot Buah
(g/tanaman)*
Jumlah Buah (buah/tanaman)*
IPB C10 39,00c 25,90a
IPB C5 186,88a 24,03b
Kopay 109,92b 25,76a
*nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Rendahnya produksi cabai selain disebabkan oleh adanya infeksi patogen, juga disebakan oleh kurang baiknya cara budidaya tanaman yaitu dalam proses pemupukan. Kurang baiknya pemupukan tersebut mengakibatkan tanaman uji tumbuh tidak optimal bahkan cenderung mati. Selain itu, hasil panen yang didapat dihitung berdasarkan pada buah yang layak untuk dipasarkan (tidak terkena infeksi patogen).
Pengaruh Perlakuan PGPR terhadap Kejadian Penyakit Antraknosa
Gejala infeksi antraknosa pada tanaman cabai muncul pada saat tanaman mulai berbuah. Infeksi ini menyerang saat buah masih berwarna hijau hingga buah siap dipanen. Gejala yang muncul yaitu berupa bercak kecil berwarna hitam dan berlekuk, bercak tersebut lama kelamaan melebar dan dibagian tepi bercak berwarna kuning (Gambar 5).
27
Perlakuan PGPR tidak mampu menekan terjadinya infeksi Colletotrichum spp pada buah secara nyata dibanding tanpa perlakuan PGPR (Tabel 9). Buah terinfeksi Colletotrichum spp. pada tanaman tanpa perlakuan PGPR memilki nilai yang terendah yaitu 32.05%. Hal ini berbeda dengan pernyataan Sutariati (2005) yang menyatakan bahwa perendaman benih dengan PGPR dapat menekan kejadian penyakit antraknosa. Tingginya persentase jumlah buah terinfeksi pada perlakuan PGPR diakibatkan oleh keadaan lingkungan yang kurang mendukung. Lingkungan pertanaman yang kurang bersih dan banyaknya genangan air akibat hujan, serta kondisi kelembaban yang relatif tinggi menyebabkan proses penyebaran konidia menjadi cepat. Selain itu Colletotrichum spp. juga dapat bertahan dalam sisa-sisa tanaman sakit yang jatuh di tanah dan selanjutnya akan menjadi sumber infeksi (Mulyaman 2009).
Tabel 9 Pengaruh perlakuan PGPR terhadap persentase jumlah buah cabai terinfeksi Colletotrichum spp.
Perlakuan PGPR Jumlah buah (%)*
PG01 36,05a
BG25 37,06a
PG01+BG25 40,58a
Tanpa perlakuan PGPR 32,05a
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Tabel 10 Pengaruh genotipe cabai terhadap persentase jumlah buah cabai terinfeksi Colletotrichum spp.
Perlakuan Genotipe Jumlah buah (%)*
IPB C10 31,38b
IPB C5 37,80ab
Kopay 40,12ab
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Pengaruh Perlakuan PGPR terhadap Kejadian Penyakit Layu Bakteri
Gejala layu bakteri ditandai dengan adanya gejala layu yang terjadi secara tiba-tiba. Jika menginfeksi tanaman muda akan segera mati, dan jika menginfeksi tanaman yang lebih tua akan menunjukkan layu pada daun yang paling muda, atau layu pada satu bagian tanaman dan pertumbuhan terhambat dan akhirnya tanaman akan layu secara permanen kemudian mati (Schaad 2001) (Gambar 6).
Gambar 6 Gejala tanaman cabai yang terinfeksi layu bakteri
Perlakuan PGPR pada masing-masing genotipe menunjukkan pengaruh yang tidak berbeda nyata terhadap persentase jumlah tanaman yang terinfeksi layu bakteri(Lampiran 24). Persentase jumlah tanaman terinfeksi paling tinggi terjadi pada perlakuan PG01 dan BG25, sedangkan perlakuan campuran PGPR (PG01+BG25) menyebabkan persentase jumlah tanaman yang terinfeksi layu menjadi rendah (Tabel 11).
29
dalam mengkolonisasi akar tanaman, sehingga kombinasi PGPR tersebut mampu berkompetisi dalam ruang dan nutrisi dengan patogen.
Tabel 11 Pengaruh perlakuan PGPR terhadap jumlah tanaman terinfeksi layu bakteri
Perlakuan PGPR Jumlah tanaman (%)*
PG01 15a
BG25 18a
PG01+BG25 10a
Tanpa perlakuan PGPR 18a
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Tabel 12 Pengaruh genotipe cabai terhadap jumlah tanaman terinfeksi layu bakteri
Perlakuan Genotipe Jumlah tanaman (%)*
IPB C10 13a
IPB C5 19a
Kopay 12a
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Pengaruh Perlakuan PGPR dan Genotipe Cabai terhadap Kejadian Infeksi Virus pada Tanaman Cabai
Gejala infeksi yang disebabkan oleh virus mulai terlihat pada saat tanaman berumur 8 MST (Lampiran 30). Secara umum gejala yang ditunjukkan adalah gejala mosaik, vein banding dan adanya penebalan daun. Infeksi tidak hanya menyebabkan pengurangan dalam hasil panen, tetapi juga mengakibatkan kerusakan tanaman. Infeksi CMV dapat menyebabkan kerugian hasil panen pada tujuh kultivar cabai berkisar 32 sampai 75% (Sulyo et al. 1984), sedangkan infeksi oleh TMV dapat menyebabkan kehilangan hasil berkisar 20,5 % sampai 100% (Sutic et al. 1999). Kehilangan hasil panen yang disebabkan oleh infeksi ChiVMV berkisar antara 9 sampai 57% (Santika 2001).
31
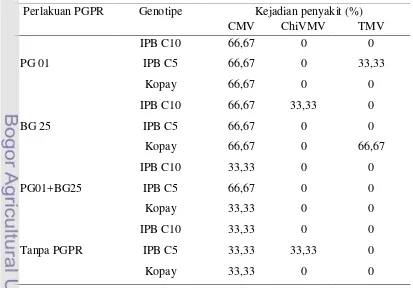
Tabel 13 Pengaruh perlakuan PGPR terhadap infeksi virus di lapangan berdasarkan pengamatan gejala
Perlakuan PGPR Genotipe Kejadian penyakit (%)
PG 01
Tabel 14 Pengaruh perlakuan PGPR pada masing-masing genotipe cabai terhadap infeksi virus CMV,ChiVMV dan TMV berdasarkan ELISA
Perlakuan PGPR Genotipe Kejadian penyakit (%)
Berdasarkan hasil ELISA dapat disimpulkan bahwa gejala yang diamati pada tanaman di lapangan berasosiasi dengan infeksi CMV, ChiVMV dan TMV. Umumnya semua perlakuan PGPR mampu menekan terjadinya infeksi ChiVMV dan TMV, tetapi tidak dengan infeksi CMV (Tabel 14). Infeksi ChiVMV hanya terjadi pada genotipe IPB C10 dan IPB C5 sedangkan infeksi TMV hanya terjadi pada genotipe IPB C5 dan Kopay.
Gambar 7 Gejala infeksi virus pada daun cabai: TMV (A); CMV; ChiVMV (C).
Perlakuan PGPR pada masing-masing genotipe cabai tidak memberikan pengaruh yang berbeda nyata terhadap persentase jumlah tanaman yang terinfeksi CMV, ChiVMV dan TMV (Lampiran 25-27). Perlakuan PGPR tidak memberikan pengaruh terhadap nilai absorbansi ELISA. Berdasarkan hasil analisis statistik perlakuan BG25 menghasilkan nilai absorbansi yang lebih tinggi dibandingkan dengan perlakuan tanpa PGPR (Tabel 15)
Tabel 15 Pengaruh PGPR terhadap nilai absorban ELISA pada tanaman cabai
Jenis Virus Perlakuan PGPR*
PG 01 BG 25 PG01+BG25 Tanpa PGPR
CMV 0,52a 0,59a 0,46a 0,38a
ChiVMV 0,16a 0,21a 0,14a 0,20a
TMV 0,36a 0,26a 0,23a 0,25a
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
33
Diantara ketiga jenis virus yang berasosiasi dengan tanaman di lapangan, akumulasi CMV lebih tinggi dibandingkan akumulasi ChiVMV dan TMV. Tingginya akumulasi tersebut dapat dilihat melalui nilai absorban dari masing-masing perlakuan. Infeksi virus dilapangan di pengaruhi oleh kondisi curah hujan yang lebih rendah dari biasanya, walaupun penanaman dilakukan pada musim penghujan yaitu bulan Februari. Curah hujan yang rendah tersebut menyebabkan kelembaban yang relatif rendah dan suhu menjadi lebih tinggi sehingga memungkinkan terjadinya transpirasi tanaman yang lebih tinggi sehingga translokasi virus lebih cepat. Hal ini sejalan dengan pendapat Matthews (1991) yang menyatakan bahwa dengan meningkatnya suhu, masa inkubasi virus mosaik lebih singkat, translokasi virus lebih cepat dan konsentrasi virus lebih tinggi. Hasil ELISA pada tanaman dengan perlakuan PGPR campuran (PG01+BG25) menunjukkan nilai absorban yang paling rendah, yaitu 0.14 dan 0.23 berturut-turut untuk infeksi ChiVMV dan TMV. Rendahnya nilai absorban ini menunjukkan bahwa perlakuan PGPR dapat mempengaruhi induksi pertumbuhan dan ketahanan terhadap infeksi patogen.
Tabel 16 Pengaruh genotipe terhadap nilai absorbansi ELISA pada tanaman cabai
Jenis Virus Genotipe*
IPB C10 IPB C5 Kopay
CMV 0,47a 0,49a 0,51a
ChiVMV 0,18a 0,18a 0,17a
TMV 0,30a 0,27a 0,26a
*nilai yang diikuti oleh huruf yang sama pada baris yang sama tidak menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf 5%
Kesimpulan
Perlakuan PGPR (P. fluorescens, B. polymixa, dan campuran keduanya) dapat meningkatkan pertumbuhan vegetatif tanaman cabai genotipe IPB C10, IPB C5, dan Kopay. Walaupun demikian, perlakuan PGPR tidak memberikan pengaruh yang nyata terhadap produksi tanaman maupun kejadian penyakit (antraknosa, layu bakteri, TMV, CMV, dan ChiVMV).
Genotipe cabai yang digunakan dalam penelitian ini memiliki karakter agronomis yang berbeda dan memiliki respons yang berbeda terhadap infeksi patogen. Infeksi antraknosa lebih banyak ditemukan pada varietas Kopay; sedangkan infeksi layu bakteri lebih banyak terjadi pada genotipe IPB C5.
Saran
DAFTAR PUSTAKA
Abdullah H, Rahman MA. 1998. Multiplication of Ralstonia solanacearum in Capsicum annuum. p.309–315. In Bacterial Wilt Disease Molecular and Ecological Aspects. Edited by P.H. Prior, C. Allen, J. Elphinstone. Reports of The Second International Bacterial Wilt Symposium Held In Gosier, Guadeloupe, France 22-27 June 1997. Berlin Heidelberg New York: Springer-Verlag.
Agrios GN. 1997. Plant Pathology. Edisi ke-4. New York: Academic Press.
. 1998. Plant Pathology. New York: Academy Press. research and development center pepper project. Proceedings of the 16th International Pepper Cenference; Mexico, 10-12 November 2002. Mexico.
Cerkauskas R. 2004. Chilli Veinal Mottle Virus. AVRDC. www.avrdc.org
Clark MF, Adams AN. 1997. Characteristics of the microplate method of enzyme- linked immunosorbent assay for detection of plant viruses. Journal of General Virology.34: 475-483.
Compant S, Duffy B, Nowak J, Clément C, Barka AE. 2005. Use of plant growth-promoting bacteria for bioncontrol of plant diseases: principles, mechanisms of action, and future prospects. Appl. Env. Microbiol. 71 (9):4951-4959
Francki RIB, Mossop DW, Hatta T. 1979. Cucumber Mosaic Virus. CMI/AAB. Descriptions of Plant Viruses. No.213.
[CABI] CAB International. 2003. Crop Protection Compendium [serial online]. CAB International.
[DEPTAN] Departemen Pertanian .2006. Luas Panen, Rata-Rata Hasil Produksi Tanaman Hortikultura Di Indonesia. Jakarta: Departemen Pertanian RI.
Gray EJ, Smith DL. 2005. Intracellular and extracellular PGPR: communalities and distinctions in the plant-bacterium signaling processes. Soil. Biol. Biochem. 37:395-412.
Hadidi A, Khetarpal RK, Koganezawa H. 1998. Plant Virus Disease Control. USA: APS Press.
Hartman GL, Elphinstone JG. 1994. Advances in the Control of Pseudomonas solanacearum race 1 in Major Food Crops. pp157–177. In Bacterial Wilt: The Disease and its Causative Agent, Pseudomonas solanacearum. Edited by A.C. Haywad and G.L. Hartman. Wallingford: CAB International.
Jamaliah W. 2005. Ketahanan hidup dan kemampuan antagonisme Bacillus subtilis ERB21, dan Pseudomonas fluorescens ES32 dalam berbagai formulasi. [skripsi] Bogor: IPB. Fakultas Pertanian
Kloepper JW, Ryu CM, Zang S. 2004. Induced Systemic Resistance and Promoting Plant Growth by Bacillus spp. Phytopathology 94: 1259-1266.
Kokalis B, Vavarina NCS, Rosskopf EN, Shelby RA. 2002. Field evaluation of plant growth promoting rhizobacteria amended transplant mixes and soil solarization for tomato and pepper production in Florida. Plant and Soil. 238: 257-166.
Liu L, Kloepper JW, Tuzun S. 1995. Induction of systemic resistance in cucumber against bacterial angular leaf spot by plant growth promoting rhizobacteria. Phytopathology 85: 843-847.
Matthews REF. 1991.Plant Virology.3rd Ed. NewYork. Academic Press.
Maurhofer M, Hase C, Mewly P, Metraux JP, Defago G. 1994. Induction of systemic resistance of tobacco to Tobacco necrosis virus by the root-colonizing Pseudomonas fluorescens strain CHA0: influence of the gacAgene and pyoverdine production. Phytopathology 84: 139-146.
Mulyaman S. 2009. Bagaimana Menanggulangi Penyakit Patek ,Antraknose pada Komoditas Sayuran dan Buah-buahan. Sinar Tani.Ed 15-21 Juli. 3312: 12-13.
Murayama D, editor. 1998. Plant viruses in Asia. Yogyakarta : Gajah Mada University Press.
Nelson LM. 2004. Plant growth promoting rhizobacteria (PGPR): prospects for new inoculants. Crop Manag 10:1094 [jurnal on-line]. http://www.cropmanagement.org/10.1094 [21 Des 2009].
37
Pelczar MJ Jr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Jakarta: UI Press.
Ramamoorthy V, Viswanathan R, Raguchander T, Prakasam V, Samiyappan R. 2001. Induction of systemic resistance by plant growth promoting rhizobacteria crop plants against pests and diseases. Crop Prot. 20: 1-11.
Roberts PD, Pernezny KL, Kucharek TA. 2009. Anthracnose Caused by Colletotrichum sp. on Pepper. Florida: University of Florida.
Sastrosumarjo S. 2003. Pembentukan Varietas Cabai Tahan Penyakit Antraknosa dengan Pendekatan Metode Konvensional dan Bioteknologi. Laporan Akhir Riset Unggulan Terpadu VIII Bidang Teknologi Hasil Pertanian. Kementrian Riset dan Teknologi RI: Lembaga Ilmu pengetahuan Indonesia.
Schaad NW, Jones JB, Chun W, editor. 2001. Plant Pathogenic Bacteria. Ed ke-3. Amerika: APS Press.
Semangun H. 1994. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Yogyakarta. Gadjah Mada University Press.
Semangun H. 2000. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Yogyakarta: Gajah Mada University Press.
Setiadi. 2005. Bertanam Cabai. Jakarta: Penebar Swadaya
Siriwong P, Kittipakorn K, Ikegami M. 1995. Characterization of chilli vein-banding mottle virus isolated from pepper in Thailand. Plant Pathology 44:718-727
Santika A. 2001. Agribisnis cabai. Jakarta : Penebar Swadaya.
Sugiura M, Bandaranayake CM, Hemachandra GH. 1975. Chilli Virus Diseases in Sri Lanka. Technic Bull.8. TARC.62P
Sulyo Y, Hartono D, Sujanto D. 1984. Yield Losses of Some Pepper Cultivars Due to CMV Infection in Green house. Lembang: Balai Penelitian Hortikultura.
Sutariati GAK. 2006. Perlakuan benih dengan agens biokontrol untuk pengendalian penyakit antraknosa dan peningkatan hasil serta mutu benih cabai [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Sutic DD, Ford RE, Tosic MT. 1999. Handbook of Plant Virus Disease. New York: CRC Press.
Thompson HC, Kelly WC. 1957. Vegetable crops. 5th ed. McGraw-Hill. NY.
Timmusk S, Tillberg E, Nicander B, Granhall U. 1999. Cytokinin Production by Paenibacillus polymixa. Soil Biol. & Biochem. 31: 1847-1852.
van Lonn LC, Bakker PAHM, Pieterse CMJ. 1998. Systemic resistance induced by rhizobacteria. Ann Rev. Phytopathology 36 : 453-483
Walkey D. 1991. Applied Plant Virology. Edisi ke-2. London: Longman.
Widodo. 1993. Penggunaan Pseudomonas spp. kelompok fluorescens untuk pengendalian penyakit akar gada (Pseudomonas brassicae Wor) pada Caisin (Brassica campestris L.) var Chinensis (Rupr) Olson [tesis]. Bogor: IPB. Program Pasca Sarjana.
Yabuuchi E, Y Kosaka, I Yano, H Hotta, and Y Nishiuchi. 1995. Transfer of Two Burkholderia and an Alcaligenes Spesies to Ralstonia gen : Proposal of Ralstonia pickettii (Ralston, Palleroni, and Doudoroff. 1973) Comb.Nov. Ralstonia solanacearum (Smith, 1986). Com Nov. and Ralstonia eutropha (Davis.1996) Comb Nov. J. of Microbiol. Immunol. 39(11): 897-904.
Lampiran 1 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap
Bakteri*Genotipe 6 4.28991561 0.71498594 1.03 0.4393
Kelompok 2 0.80295139 0.40147569 0.58 0.5708
Galat 16 11.06022067 0.69126379
Total 35 28.48408189
Lampiran 2 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 2 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 8.39066733 2.79688911 2.15 0.1334
Galat (bakteri) 6 1.61469483 0.26911581 0.21 0.9693
Genotipe 2 3.84752772 1.92376386 1.48 0.2568
Bakteri*Genotipe 6 20.42892317 3.40482053 2.62 0.0577
Kelompok 2 10.74929339 5.37464669 4.14 0.0356
Galat 16 20.76954578 1.29809661
Total 35 65.80065222
Lampiran 3 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 3 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 136.4275831 45.475861 11.99 0.0002
Galat (bakteri) 6 56.5586661 9.4264443 2.49 0.0681
Genotipe 2 47.7995973 23.8997986 6.3 0.0096
Bakteri*Genotipe 6 41.1795175 6.8632529 1.81 0.1604
Kelompok 2 49.8136832 24.9068416 6.57 0.0083
Galat 16 60.6646102 3.7915381
Total 35 392.4436572
Lampiran 4 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 4 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 304.3587931 101.452931 11.36 0.0003
Galat (bakteri) 6 79.1128271 13.1854712 1.48 0.2482
Genotipe 2 197.3925572 98.6962786 11.05 0.001
Bakteri*Genotipe 6 23.9092984 3.9848831 0.45 0.8373 Kelompok 2 391.0652672 195.5326336 21.89 <.0001
Galat 16 142.923659 8.932729
41
Lampiran 5 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 5 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 488.548999 162.8496663 12.79 0.0002
Galat (bakteri) 6 183.7024549 30.6170758 2.41 0.0753 Genotipe 2 337.2600352 168.6300176 13.25 0.0004 Bakteri*Genotipe 6 65.2396453 10.8732742 0.85 0.5479 Kelompok 2 532.4810962 266.2405481 20.92 <.0001
Galat 16 203.668942 12.729309
Total 35 1810.901173
Lampirean 6 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 6 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 761.6863845 253.8954615 14.31 <.0001 Galat (bakteri) 6 162.5058481 27.084308 1.53 0.2324 Genotipe 2 482.8958682 241.4479341 13.6 0.0004 Bakteri*Genotipe 6 62.1028689 10.3504781 0.58 0.7388 Kelompok 2 706.8264044 353.4132022 19.91 <.0001
Galat 16 283.95327 17.747079
Total 35 2459.970644
Lampiran 7 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 7 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 1138.399311 379.466437 14.33 <.0001 Galat (bakteri) 6 114.046969 19.007828 0.72 0.6411
Genotipe 2 560.940243 280.470122 10.59 0.0012
Bakteri*Genotipe 6 110.009864 18.334977 0.69 0.6593 Kelompok 2 936.320037 468.160019 17.68 <.0001
Galat 16 423.722238 26.48264
Total 35 3283.438663
Lampiran 8 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap tinggi tanaman saat 8 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 1566.193156 522.064385 20.64 <.0001 Galat (bakteri) 6 201.37886 33.563143 1.33 0.3016
Genotipe 2 556.609566 278.304783 11 0.001
Bakteri*Genotipe 6 148.489287 24.748214 0.98 0.471
Kelompok 2 870.209231 435.104615 17.2 0.0001
Galat 16 404.688439 25.293027
Lampira 9 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap
Lampiran 10 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap jumlah cabang saat 2 MST
Lampiran 11 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap jumlah cabang saat 3 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 1.06915495 0.35638498 1.9 0.1289
Galat (bakteri) 6 2.26822579 0.37803763 2.02 0.0629
Genotipe 2 1.11737986 0.55868993 2.99 0.052
Bakteri*Genotipe 6 1.04900288 0.17483381 0.93 0.4705 Kelompok 2 25.74303021 12.87151511 68.8 <.0001
Galat 16 54.63118949 0.18709311
Total 35 85.53846154
Lampiran 12 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap jumlah cabang saat 4 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 39.32601660 13.10867220 18.21 <.0001 Galat (bakteri) 6 9.62153477 1.60358913 2.23 0.0411
Genotipe 2 9.87993983 4.93996991 6.86 0.0013
Bakteri*Genotipe 6 4.15429946 0.69238324 0.96 0.4517
Kelompok 2 8.68142041 4.34071021 6.03 0.0028
Galat 16 182.1502334 0.7199614
43
Lampiran 13 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap jumlah cabang saat 5 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 102.3380038 34.1126679 51.35 <.0001 Galat (bakteri) 6 24.6294125 4.1049021 6.18 <.0001
Genotipe 2 8.8413747 4.4206873 6.65 0.0015
Bakteri*Genotipe 6 22.0959776 3.6826629 5.54 <.0001
Kelompok 2 7.1895907 3.5947953 5.41 0.005
Galat 16 164.752847 0.664326
Total 35 354.9850746
Lampiran 14 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap jumlah cabang saat 6 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 185.6763909 61.8921303 48.92 <.0001 Galat (bakteri) 6 37.8402788 6.3067131 4.98 <.0001
Genotipe 2 9.9785342 4.9892671 3.94 0.0206
Bakteri*Genotipe 6 12.048121 2.0080202 1.59 0.1514
Kelompok 2 16.2650791 8.1325396 6.43 0.0019
Galat 16 313.78767 1.2652729
Total 35 627.6119403
Lampiran 15 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe terhadap jumlah daun saat 1 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 349.6422239 116.547408 61.06 <.0001 Galat (bakteri) 6 118.6123403 19.7687234 10.36 <.0001
Genotipe 2 19.0837835 9.5418918 5 0.0073
Bakteri*Genotipe 6 63.018227 10.5030378 5.5 <.0001
Kelompok 2 12.6903714 6.3451857 3.32 0.0372
Galat 16 639.475192 1.908881
Total 35 1204.63662
Lampiran 16 Hasil analisis ragam pengaruh perlakuan PGPR dan genotipe cabai terhadap jumlah daun saat 2 MST
Sumber keragaman DB JK KT F value pr>F
Bakteri 3 67.0848104 22.3616035 3.22 0.0228
Galat (bakteri) 6 400.2375232 66.7062539 9.62 <.0001
Genotipe 2 39.6196762 19.8098381 2.86 0.0589
Bakteri*Genotipe 6 242.9320904 40.4886817 5.84 <.0001 Kelompok 2 577.905213 288.9526065 41.67 <.0001
Galat 16 2322.993966 6.93431