DETEKSI ANTIBODI
HUMAN IMMUNODEFICIENCY VIRUS TYPE-1
(HIV-1)
PADA
M
ACACA NEMESTRINA
YANG DIIMUNISASI DENGAN VAKSIN DNA HIV-1
MENGGUNAKAN TEKNIK
ENZYME-LINKED IMMUNOSORBENT ASSAY
(ELISA)
FITRIYA NUR ANNISA DEWI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dedicated to my beloved grandpa,
Prof.D r.M r.Prajudi Atmosudirdjo
Prof.D r.M r.Prajudi Atmosudirdjo(Alm.)
(Alm.)
DETEKSI ANTIBODI
HUMAN IMMUNODEFICIENCY VIRUS TYPE-1
(HIV-1)
PADA
M
ACACA NEMESTRINA
YANG DIIMUNISASI DENGAN VAKSIN DNA HIV-1
MENGGUNAKAN TEKNIK
ENZYME-LINKED IMMUNOSORBENT ASSAY
(ELISA)
FITRIYA NUR ANNISA DEWI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRAK
Fitriya Nur Annisa Dewi / B01400034. Deteksi Antibodi Human Immunodeficiency Virus Type-1 (HIV-1) pada Macaca nemestrina yang Diimunisasi dengan Vaksin DNA HIV-1 Menggunakan Teknik Enzyme -linked Immunosorbent Assay (ELISA). Dibimbing oleh Dr.drh.Joko Pamungkas MSc. dan Dr.drh.Diah Iskandriati.
Human immunodeficiency virus type 1 (HIV-1) diidentifikasi sebagai patogen penyebab penyakit acquired immunodeficiency syndrome (AIDS). Sampai saat ini antiviral belum dapat mengendalikan penyebaran HIV karena HIV memiliki
daya mutasi yang tinggi. Untuk menekan penyebaran HIV dikembangkan
berbagai jenis vaksin, salah satunya adalah vaksin DNA. Penelitian ini bertujuan
melihat respon kebal humoral pada beruk (Macaca nemestrina) setelah diimunisasi dengan vaksin DNA HIV-1, dengan mendeteksi antibodinya.
Sampel dalam penelitian ini berasal dari plasma dua kelompok beruk, yaitu
kelompok yang divaksinasi dan kelompok hewan kontrol. Masing-masing
kelompok terdiri dari tujuh ekor. Vaksin yang digunakan adalah vaksin DNA
HIV-1 subtipe B. Sampel diambil pada prevaksinasi, saat boosting pertama, dua minggu setelah boosting pertama, saat boosting kedua, dua minggu dan empat minggu setelah boosting kedua kemudian dideteksi terhadap antibodi menggunakan teknik enzyme -linked immunosorbent assay (ELISA) tidak langsung.
Hasil penelitian menunjukkan pada kelompok beruk yang diimunisasi dengan
vaksin DNA HIV-1, dideteksi adanya antibodi terhadap protein p24 HIV-1 ditandai
dengan kenaikan nilai optical density pada dua minggu setelah booster kedua. Disimpulkan imunisasi menggunakan vaksin DNA HIV-1 dapat menginduksi
respon kebal humoral, tubuh membentuk antibodi terhadap p24 HIV-1 dan
terdeteksi pada dua minggu setelah booster dengan rFPV-HIV-1 yang kedua meskipun respon tidak selalu seragam pada setiap individu hewan model.
Fitriya Nur Annisa Dewi / B01400034.Detection of Human Immunodeficiency Virus Type-1 (HIV-1) Antibody by Enzyme-linked Immunosorbent Assay (ELISA)
Method in Macaca nemestrina Immunized with HIV-1 DNA Vaccine
Human immunodeficiency virus type-1 (HIV-1) is the ethiological cause of acquired immunodeficiency syndrome (AIDS). Developing a cure for AIDS
remains difficult because HIV has the ability to mutate rapidly which can easily
cause resistancy. One of the vaccines being developed currently against HIV-1 is
HIV-1 DNA Vaccine.
This study was conducted to understand the humoral immune response
of Macaca nemestrina (pig-tailed macaques) after immunization with HIV-1 DNA
vaccine, by observing the antibody detected. The samples used were plasmas
from two groups of M. nemestrina; the vaccinated group and the control group.
Each group consisted of seven animals. The vaccine used in this study was B
clade HIV-1 DNA vaccine. The samples were taken on prevactination, day of first
boosting, two weeks post-boosting, day of second boosting, two and four weeks
post second boosting. Samples were detected for antibody to HIV-1 p24 protein
using an indirect enzyme -linked immunosorbent assay (ELISA) method.
The results revealed that the animal vaccinated group showed detected
antibodies to HIV-1 p24 protein in which the optical density values increased two
weeks after the second boost. These results concluded that immunization with
HIV-1 DNA vaccine induced the humoral immune response, showed by the
detected HIV -1 p24 antibody two weeks after the second boost with HIV-1 rFPV.
DETEKSI ANTIBODI HUMAN IMMUNODEFICIENCY VIRUS TYPE-1 (HIV-1) PADA M ACACA NEMESTRINA
MENGGUNAKAN TEKNIK ENZYME-LINKED IMMUNOSORBENT
ASSAY (ELISA)
FITRIYA NUR ANNISA DEWI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
2006
Judul Skripsi : Deteksi Antibodi Human Immunodeficiency Virus Type-1 (HIV-1) Pada Macaca nemestrina Yang Diimunisasi Dengan Vaksin DNA HIV-1 Menggunakan Teknik Enzyme-Linked Immunosorbent Assay
(ELISA)
Nama : Fitriya Nur Annisa Dewi
NRP : B01400034
Disetujui,
Dr. drh. Joko Pamungkas, MSc. Dr. drh. Diah Iskandriati
Dosen Pembimbing I Dosen Pembimbing II
Diketahui,
Wakil Dekan FKH-IPB
Dr. drh. I Wayan Teguh Wibawan, MS.
NIP. 131.129.090
Tanggal Lulus : 3 Februari 2006
Penulis dilahirkan di Jakarta pada 25 Juni 1982 dari ayah dr. Bagja
Waluya Hardiwinangun dan ibu drh. Wiwiek Bagja. Penulis merupakan anak
ketiga dari tiga bersaudara.
Penulis menamatkan pendidikan di SD Perguruan Cikini Jakarta tahun
1993 dan SMP Perguruan Cikini Jakarta tahun 1997. Pada tahun 2000 penulis
lulus dari SMU Negeri 8 Jakarta kemudian diterima di Fakultas Kedokteran
Hewan Insititut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB
(USMI).
Selama masa perkuliahan, penulis pernah menjadi asisten mata kuliah
Anatomi Veteriner periode 2001/2002 dan aktif sebagai ketua organisasi
Himpunan Minat Profesi Satwa Liar. Pada tahun 2003 penulis meraih peringkat
pertama pada seleksi mahasiswa berprestasi (Mawapres) Fakultas Kedokteran
Hewan IPB, serta peringkat kelima pada seleksi Mawapres tingkat IPB. Selain itu
penulis berkesempatan mengikuti program pertukaran mahasiswa ke University
of Miyazaki, Jepang selama satu tahun pada Januari-Desember 2004.
Puji syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT yang
senantiasa melimpahkan rahmat dan karunia-Nya sehingga penulis dapat
menyelesaikan skripsi ini sebagai syarat memperoleh gelar sarjana kedokteran
hewan.
Proses penyusunan skripsi ini merupakan sebuah perjalanan panjang
yang tidak lepas dari dukungan berbagai pihak. Perkenankanlah penulis
mengucapkan terima kasih yang sebesar-sebesarnya pada:
1. Dr. drh. Joko Pamungkas MSc. dan Dr. drh. Diah Iskandriati sebagai dosen
pembimbing, atas segala ilmu, keterampilan, inspirasi, nasehat, saran, kritik
dan kesabarannya dalam membimbing penulis.
2. Kepala Pusat Studi Satwa Primata LPPM-IPB dan Kepala Laboratorium
Mikrobiologi dan Imunologi PSSP LPPM-IPB serta Prof. drh. Dondin Sajuthi
PhD., yang telah memberikan kesempatan pada penulis untuk menjadi
bagian dalam penelitian ini.
3. drh. Ekowati Handharyani MS, PhD sebagai ketua tim penguji ujian akhir
karya ilmiah atas saran dan masukan yang diberikan
4. Rachmitasari Noviana SKH, Silmi Mariya SSi, Uus Saepuloh SSi, Susanti
Dyah SKH dan Dra.Maryati Surya MS., atas segala bimbingan keterampilan
laboratorium yang diberikan, serta berbagai saran dan dukungannya selama
penelitian dan penyusunan skripsi. Juga kepada Kak Dede, Kak Esther,
Estero, Mba Isti, Mba Tya dan Teh Dewi yang turut mendukung sampai
5. Drh. Yasmina Paramastri SP1. beserta staf Laboratorium Fasilitas Hewan
Penelitian PSSP LPPM-IPB atas segala ilmu dan saran yang diberikan.
6. Orang tua, keluarga dan orang-orang terdekat penulis, yang senantiasa
memberikan perhatian, kasih sayang, semangat, motivasi dan doa tanpa
henti, kapanpun dan dimanapun penulis berada.
7. Sahabat-sahabat (Dewi, Novie, Diah, Winie, Tyas, Ledi, Santoso, Kamto dan
Agung), Astrini, Anggie dan Sadat serta keluarga besar Apidae 37 atas
segala bentuk bantuan, dukungan, hiburan dan semangat, sejak penulis
menjalani penelitian hingga skripsi ini dapat selesai.
8. Riana, Pipit Pane, Hellen, Nia, Lia, Kaka, Elies, Fita dan Suindra atas
kekompakannya menjadi tim suksesi skripsi satu sama lain.
9. Keluarga besar Himpro Satwa Liar dan tim basket putri FKH IPB atas
semangat, kebersamaan dan hiburan yang diberikan selama ini.
Penulis menyadari bahwa skripsi ini masih sangat jauh dari sempurna
dan terdapat banyak kekurangan di dalamnya, namun penulis tetap berharap
semoga skripsi ini dapat memberikan manfaat.
Bogor, Januari 2006
DAFTAR ISI
Halaman
PRAKATA……… i
DAFTAR ISI ……… iii
DAFTAR TABEL ……… v
DAFTAR GAMBAR ……… vi
DAFTAR LAMPIRAN ……… viii
I. PENDAHULUAN ………. 1
1.1. Latar Belakang ………. 1
1.2. Tujuan ……… 3
1.3. Manfaat ……… 3
1.4. Hipotesis ……… 3
II. TINJAUAN PUSTAKA ………... 4
2.1. Kekebalan Humoral ……… 4
2.2. Human Immunodeficiency Virus ……… 5
2.3. Vaksin DNA HIV-1 ……… 12
2.4. Macaca nemestrina………. 15
2.5. Teknik Enzyme-Linked Immunosorbent Assay ………... 17
III. BAHAN DAN METODE ……… 20
3.1. Tempat dan Waktu Penelitian ……… 20
3.3. Vaksin ……… 20
3.4. Reagensia dan Bahan Habis Pakai ………. 21
3.5. Alat ……….. 21
3.6. Metode Penelitian ………. 21
3.6.1.Program Vaksinasi ………. 22
3.6.2. Koleksi Sampel ……… 23
3.6.3. Enzyme-Linked Immunosorbent Assay (ELISA)………..…….. 25
3.6.4. Analisis Hasil ELISA ………. 26
IV. HASIL PENELITIAN ……… 27
4.1. Kontrol Positif dan Negatif ……… 27
4.2. Kelompok A ……… 27
4.3. Kelompok B ……… 29
V. PEMBAHASAN ………. 32
VI. SIMPULAN DAN SARAN ……….. 36
6.1. Simpulan ……… 36
6.2. Saran ……….. 36
DAFTAR PUSTAKA ……….. 38
DAFTAR TABEL
Tabel Halaman
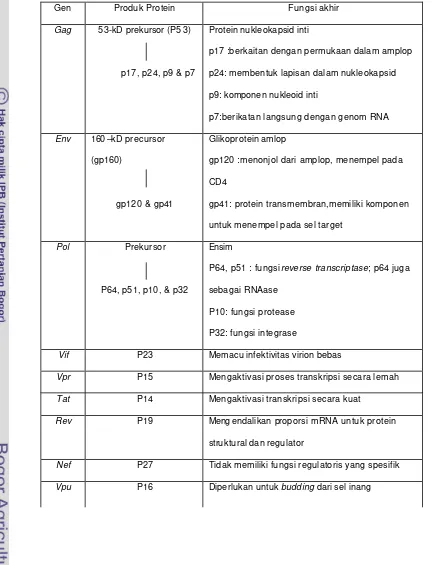
1 Protein yang disandi oleh gen HIV-1 dan fungsinya (sumber:
Kuby, 1992) ……….. 11
2 Daftar Identitas Macaca nemestrina (nomor tato) kelompok A (kelompok yang divaksinasi) dan kelompok B (kelompok kontrol)……… 23
3 Jadwal vaksinasi priming dan boosting pada hewan kelompok A dan B ………... 23
4 Jadwal pengambilan darah yang digunakan untuk uji ELISA... 24
5 Rumus perhitungan nilai Optical Density (OD) ……… 26
6 Nilai Optical Density Kelompok A ………... 28
DAFTAR GAMBAR
Gambar Halaman
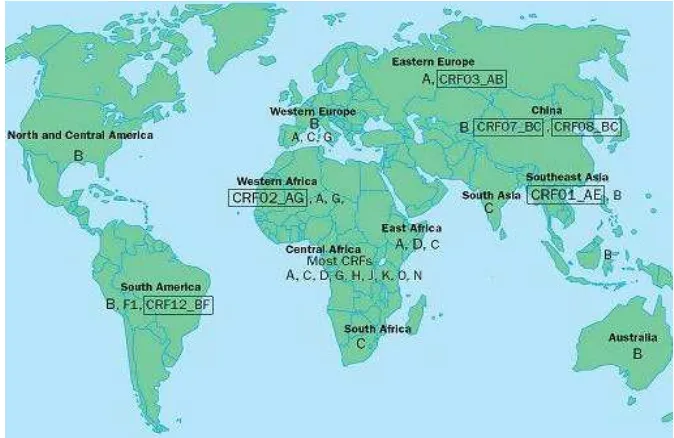
1 Pola distribusi geografik subtipe HIV-1 di seluruh dunia
sampai tahun 2003 (sumber: Perrin 2003)……… 7
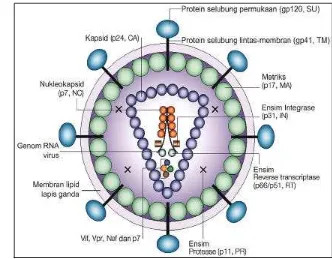
2 Struktur virion HIV-1. Partikel lengkap HIV-1 memiliki komponen
amplop, matriks dan inti (sumber: Robinson 2002) ……….. 10
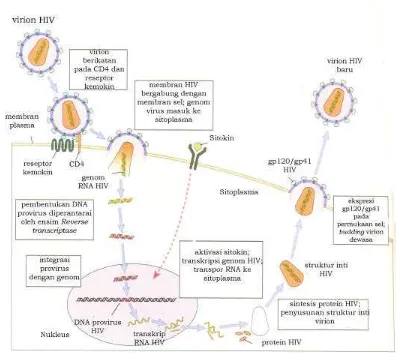
3 Siklus hidup HIV dalam tubuh (sumber: Abbas dan Lichtman 2000) 12
4 Satwa primata Macaca nemestrina usia pradewasa (sumber:
Pusat Studi Satwa Primata 2003) ……….. 17
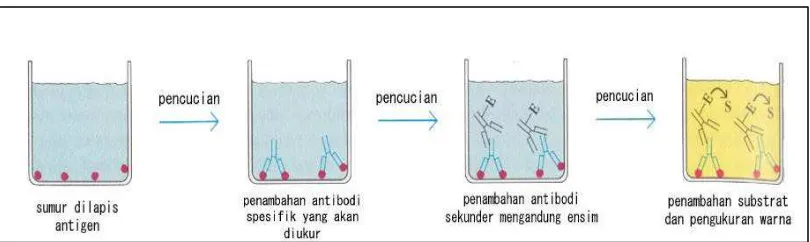
5 Skema uji ELISA tipe tidak-langsung (sumber:Goldsby et al.2000) 19
6 Skema desain penelitian disajikan secara ringkas dalam gambar.. 22
7 Jadwal vaksinasi dan pengambilan darah disajikan secara
sekuensial……… 24
8 Sumur lempeng ELISA. Warna kuning yang semakin tua menandakan
nilai OD yang semakin besar ……….. 27
9 Pola induksi respon kebal humoral berupa pembentukan antibodi
p24 HIV-1 pada kelompok A yang divaksinasi DNA HIV-1 serta
diboosting dengan rFPV-HIV. Terjadi kenaikan nilai OD pada dua minggu pasca booster kedua ... 28
10 Respon antibodi p24 HIV-1 pada kelompok B (kelompok kontrol)
yang diberi placebo berupa vektor plasmid DNA dan FPV tanpa introduksi gen HIV. Nilai OD cenderung rendah sebelum maupun
11 Grafik rataan nilai OD kelompok A dan B yang menggambarkan
kadar antibodi p24 HIV-1 yang dideteksi dengan ELISA. Pada
kelompok A yang divaksinasi, terjadi induksi respon kebal
humoral terhadap HIV-1 terlihat dari kenaikan kadar antibodi pada
DAFTAR LAMPIRAN
Lampiran Halaman
1 Persetujuan pelaksanaan penelitian oleh Komisi Pengawasan
Kesejahteraan dan Penggunaan Hewan Percobaan Pusat Studi
Satwa Primata, Lembaga Penelitiandan Pemberdayaan
Masyarakat- IPB (PSSP LPPM- IPB)... 42
2 Data penelitian Pamungkas (2005) menunjukkan respon kebal
seluler pada vaksinasi DNA HIV-1 dengan vektor rFPV
muncul satu minggu setelah booster pertama... 43
I. PENDAHULUAN
1.1. Latar Belakang
Human Immunodeficiency Virus (HIV) merupakan salah satu retrovirus
yang menyerang sistem kekebalan tubuh manusia dan menyebabkan
serangkaian sindroma yang dikenal dengan AIDS (acquired immunodeficiency
syndrome). AIDS ditandai dengan berbagai gejala klinis akibat imunodefisiensi
berat yang memungkinkan terjadinya infeksi oportunistik (Kuby 1992; Goldsby et
al. 2000). Kejadian AIDS ditemukan di seluruh dunia dengan angka kematian
tertinggi di Afrika (Kent 2001). Sampai saat ini penderita AIDS telah berjumlah
lebih dari 42 juta jiwa dan terus bertambah dengan kecepatan 15.000 pasien per
hari. Total lebih dari 20 juta jiwa telah meninggal karena AIDS dan diperkirakan
akan ada sekitar 5,3 juta individu yang terinfeksi HIV setiap tahunnya (Utama
2003; Iskandriati 2004). Jika tidak ada penyelesaian terhadap epidemi ini, HIV
akan terus membahayakan kehidupan individu, komunitas dan negara bahkan
dapat mengakibatkan kerugian besar bagi ekonomi dunia.
Tubuh manusia secara alami memiliki sistem pertahanan terhadap
kehadiran benda asing. Kehadiran virus dalam berbagai kejadian penyakit viral
dapat diatasi oleh sistem kekebalan sehingga infeksi tidak berkepanjangan. Pada
individu terinfeksi HIV -1, respon kebal yang terjadi tidak mampu mengatasi
infeksi. Hal ini karena HIV memiliki daya mutasi yang luar biasa, infeksinya
bersifat laten dan virus ini mampu menghancurkan sel Limfosit T-helper (Girard
1993; Shen dan Siliciano 2001).
Kejadian AIDS masih sangat sulit diatasi karena sampai saat ini belum
ditemukan metode yang tepat untuk mencegah dan mengobati infeksi HIV.
berbagai metode pengobatan. Namun selain harganya yang masih cenderung
mahal, obat-obatan ini beresiko menyebabkan toksi ksitas jangka panjang. Selain
itu, virus HIV mudah menjadi resisten terhadap obat (Kent 2001; Montefori 2001).
Sebagai alternatif dari pengembangan obat, saat ini berbagai penelitian vaksin
dilakukan agar dapat ditemukan suatu vaksin yang aman dan efektif untuk
mencegah infeksi HIV dan penyebaran penyakit AIDS (Goldsby et al. 2000).
Berbagai jenis vaksin HIV telah diteliti sejak pertengahan 1980-an. Untuk
menghasilkan respon kebal yang efektif, selama ini vaksin dikembangkan untuk
mampu menghasilkan antibodi yang dapat menetralisir virus (induksi kekebalan
humoral). Namun kemampuan mutasi HIV-1 terutama pada komponen
amplopnya menyebabkan antibodi yang dihasilkan tubuh sulit melakukan
netralisasi. Sehubungan dengan hal tersebut, pengembangan vaksin terhadap
HIV-1 kemudian lebih difokuskan untuk menginduksi kekebalan berperantara sel
(kekebalan seluler) berupa aktivasi Cytotoxic T-Lymphocyte (CTL) yang lebih
baik.
Robinson (2002) menekankan perlunya pendekatan yang unik dan
khusus dalam pengembangan pembuatan vaksin HIV-1. Salah satu vaksin yang
sedang dikembangkan dan dianggap sangat menjanjikan untuk pencegahan HIV
saat ini adalah vaksin DNA (Goldsby et al. 2000; Baltimore 2002). Vaksin DNA
memilik rute dan metode vaksinasi yang berbeda dengan vaksin jenis lain. Hal ini
dapat mempengaruhi pemaparan antigen pada sistem kekebalan (Simmonds et
al.1996) sehingga diharapkan dapat menghasilkan respon kebal yang berbeda
pula. Meskipun vaksinasi menggunakan vaksin DNA HIV-1 diutamakan untuk
menginduksi kekebalan seluler, namun diharapkan respon kebal humoral berupa
1.2. Tujuan Penelitian
Tujuan dari penelitian ini adalah melihat respon kebal humoral yang
dihasilkan setelah imunisasi dengan vaksin DNA HIV -1 pada hewan model
Macaca nemestrina melalui teknik enzyme -linked immunosorbent assay (ELISA).
1.3. Manfaat Penelitian
Hasil penelitian diharapkan dapat menjadi tambahan bukti mengenai
induksi respon kebal hasil imunisasi vaksin DNA untuk mengembangkan vaksin
DNA HIV-1 selanjutnya.
1.4. Hipotesis
Pada Macaca nemestrina yang divaksinasi dengan vaksin DNA HIV-1
dan dibooster dengan vaksin rekombinan FowlpoxVirus (rFPV-HIV) akan
II. TINJAUAN PUSTAKA
2.1. Kekebalan Humoral
Lingkun gan di sekitar manusia mengandung berbagai jenis unsur patogen
yaitu bakteri, virus, jamur, protozoa dan parasit yang dapat menyebabkan infeksi
pada manusia. Infeksi yang terjadi pada manusia normal umumnya berlangsung
singkat dan jarang meninggalkan kerusakan permanen. Hal ini disebabkan tubuh
manusia memiliki suatu sistem yang disebut sistem kekebalan yang memberikan
respon dan melindungi tubuh terhadap unsur-unsur patogen tersebut (Kresno
2001). Pada dasarnya respon kebal bekerja atas dua akitivitas, yaitu pengenalan
(recognition) yang bersifat spesifik dan respon efektor yaitu penghancuran atau
netralisasi organisme setelah dikenali (Kuby 1992; Goldsby et al. 2000).
Respon kebal dapat dibagi menjadi dua macam yaitu kekebalan humoral
dan kekebalan berperantara sel (seluler). Kekebalan humoral melibatkan
interaksi sel B dengan antigen beserta proses proliferasi dan diferensiasi sel
limfosit B menjadi sel-sel plasma yang memproduksi antibodi. Antibodi
merupakan molekul imunoglobulin yang dihasilkan oleh sel limfosit B sebagai
respon terhadap adanya protein atau karbohidrat asing (antigen) di dalam inang
vertebrata (Mahy 1997). Antibodi berfungsi sebagai molekul efektor dalam
respon kebal humoral dengan berikatan dengan antigen kemudian menetralisasi
atau memfasilitasi eliminasinya (Kuby 1992; Goldsby et al. 2000).
Sel B (Limfosit B) dihasilkan oleh sumsum tulang dan bersirkulasi di aliran
darah, cairan limfe ataupun tersimpan di berbagai organ limfoid. Interaksi antara
sel B dengan antigen akan menyebabka n aktivasi, proliferasi dan diferensiasi sel
B tersebut. Proses dimulai saat antigen berikatan dengan molekul membran
endositosis. Setelah antigen diproses, sel B akan memaparkan peptida-peptida
antigen yang berikatan dengan Major Histocompatibility Complex (MHC) kelas II
pada membran sel. Sel T-helper yang spesifik terhadap kompleks antigen-MHC
kemudian berikatan dan mensekresikan sitokin. Sitokin akan menstimulasi
proses pembelahan dan diferensiasi sel B. Sel B yang teraktivasi mengalami
pembelahan terus menerus selama lebih kurang lima hari lalu berd iferensiasi
menjadi sel memori dan sel plasma yang mensekresikan antibodi (Goldsby et al.
2000).
Antibodi yang spesifik terhadap permukaan virus sangat diperlukan untuk
mencegah penyebaran virus saat infeksi akut dan melindungi tubuh terhadap
reinfeksi. Sebagian besar virus menggunakan molekul reseptor di permukaannya
untuk menempel pada membran sel inang. Jika terbentuk antibodi terhadap
molekul reseptor tersebut, maka binding antara virus dengan inang akan
terhambat sehingga infeksi tidak terjadi (Kuby 1992; Goldsby et al. 2000).
2. 2. Human Immunodeficiency Virus (HIV)
Retrovirus merupakan virus golongan Ribonucleic Acid (RNA) beramplop
dan terbagi menjadi dua bagian utama berupa amplop dan komponen inti
(Constantine et al. 1992). Klasifikasi virus lama dalam Mann (1996) membagi
famili Retroviridae menjadi tiga sub-famili yaitu Lentivirinae, Oncovirinae dan
Spumavirinae. Human Immunodeficiency Virus (HIV) bersama dengan Simian
Immunodeficiency Virus (SIV), Feline Immunodeficiency Virus (FIV), Bovine
Immunodeficiency Virus (BIV), virus Visna-Maedi, infectious equine anemia virus
dan caprine arthritis-encephalitis virus termasuk dalam sub-famili Lentivirinae.
Berdasarkan International Committee on Taxonomy of Viruses (ICT V)
tahun 2000, klasifikasi famili Retroviridae disempurnakan menjadi tujuh genus
Epsilonretrovirus, Lentivirus dan Spumavirus. HIV dan virus-virus yang
sebelumnya termasuk subfamili Lentivirinae kini tergabung dalam genus
Lentivirus.
Klasifikasi HIV dalam ICTV (2000) adalah sebagai berikut:
Famili: Retroviridae
Genus: Lentivirus
Subgrup: Primate lentivirus
Spesies: Human Immunodeficiency Virus type 1
Human Immunodeficiency Virus type 2
HIV terdiri dari dua tipe yaitu HIV-1 dan HIV-2. Kedua virus ini
menyebabkan gejala yang serupa yaitu imunodefisiensi, namun antigenitas
HIV-2 tidak seganas HIV-1. Selain genomnya yang berbeda, penyebaran HIV-1
adalah di seluruh dunia sedangkan HIV-2 endemik di Afrika Barat (Constantine et
al, 1992). HIV-1 terbagi menjadi beberapa subtipe berdasarkan sekuen basa
yang menyandi pembentukan komponen proteinnya (gp 120) (Levinson dan
Jawetz 2000). Subtipe HIV atau dikenal juga dengan istilah clade, diklasifikasi kan
menjadi tiga kelompok yaitu M (Major), O (Outlier) dan N (bukan M ataupun O).
Sembilan puluh lima persen dari virus HIV di dunia termasuk dalam kelompok M,
yaitu subtipe A, B, C, D, F, G, H, J dan K (Freed dan Martin 2001; Pamungkas
Gambar 1. Pola distribusi geografik subtipe HIV-1 di seluruh dunia sampai tahun 2003 (sumber: Perrin 2003)
HIV-1 adalah virus RNA berbentuk ikosahedral dan beramplop yang
hidup dengan menginfeksi dan membunuh sel limfosit T-helper. HIV
menyebabkan timbulnya gangguan pada kekebalan seluler tubuh dan
memudahkan terjadinya infeksi oportunistik. Rangkaian sindroma yang
disebabkan oleh infeksi HIV-1 dikenal dengan istilah AIDS. Transmisi virus ini
melalui cairan tubuh (darah dan semen) serta menular secara transplasental dan
perinatal (Constantine et al. 1992; Levinson dan Jawetz 2000).
Genom HIV terdiri dari dua tipe gen yaitu gen struktural dan gen
regulator. Gen struktural berfungsi dalam pengaturan dan sintesis protein yang
akan membentuk karakteristik fisik dan morfologi virus, sedangkan gen regulator
akan mengatur aktivitas virus seperti produksi ensim, replikasi dan lain-lain.
Pembentukan struktur antigen dalam sel inang disandi oleh tiga gen utama yaitu
gag, env dan pol (Kuby 1992; Goldsby et al. 2000).
Secara struktural, HIV terdiri dari dua bagian utama yaitu amplop dan inti.
dari membran lipid ganda, berperan dalam perlekatan virus pada sel inang saat
infeksi. Amplop mengandung protein berupa glikoprotein permukaan gp120 dan
glikoprotein transmembran gp41. Gen env menyandi pembentukan molekul
prekusor gp160 menjadi gp120 dan gp41 (Constantine et al. 1992; Kuby 1992;
Levinson dan Jawetz 2000).
Komponen inti terdapat dibawah lapisan membran, terikat oleh protein
serta melapisi dua rantai RNA yang identik. Gen gag menyandi pembentukan
protein gag yang merupakan protein komponen inti. Protein gag yang paling
penting adalah p55, p24, p17 dan p15. Protein p55 merupakan molekul prekursor
yang muncul di awal infeksi dan akan membangun protein inti lainnya. Protein
p17 merupakan protein yang berlokasi di matriks antara amplop dan inti. Protein
yang menyusun kapsid inti dan menyelimuti asam nukleat adalah p15 dan p24.
Selain itu terdapat pula protein lain yang turut menyusun inti HIV-1 yaitu p9 dan
p7 (Constantine et al. 1992; Levinson dan Jawetz 2000; Goldsby et al. 2000).
Selain melapisi rantai RNA, inti memiliki ensim reverse transcriptase,
integrase dan protease. Reverse transcriptase berfungsi merubah RNA virus
menjadi DNA, integrase berfungsi mengintegrasikan DNA virus dengan DNA sel
inang dan protease berfungsi dalam menggertak protein prekursor membentuk
protein lain. Pembentukan protein penyusun ensim-ensim ini disandi oleh gen pol .
Ensim reverse transcriptase tersusun dari protein p64 dan p5, protease dari p10
dan integrase dari p32 (Constantine et al. 1992; Levinson dan Jawetz 2000).
Selain ketiga gen struktural yang penting tadi, terdapat pula gen-gen
regulator. Gen tat berfungsi menyandi p14 yang akan menggertak transkripsi
genom virus (mungkin juga genom sel inang). Gen rev berfungsi dalam
mengendalikan mRNA melalui produksi p19, gen vif menyandi p23 yang
mempengaruhi infektivitas virus, gen vpr menyandi p15 yang merupakan faktor
partikel atau komponen virus(Constantine et al. 1992; Kuby 1992; Goldsby et al.
2000). Terdapat pula gen nef yang menurut Levinson dan Jawetz (2000)
berperan bersama gen tat dalam menekan sintesis MHC kelas I sehingga
menurunkan kemampuan CTL membunuh sel terinfeksi HIV. Selain itu menurut
Constantine et al. (1992) nef merupakan regulator negatif yang akan membatasi
replikasi virus melalui pembentukan p27. Genom HIV-1, protein komponen virus
dan fungsinya disajikan secara ringkas pada tabel 1.
HIV-1 menempel pada sel limfosit T inang melalui mekanisme kompleks
yang melibatkan komponen amplop bagian luar dan reseptor CCR5 atau CXCR4
pada protein CD4 sel inang. Selain pada limfosit T, HIV juga dapat menginfeksi
makrofag, antara lain sel glia pada otak. Amplop virus akan melakukan fusi atau
penggabungan dengan membran sel, kemudian virus masuk kedalam sel inang.
Pada stadium ini, individu dinyatakan terinfeksi HIV-1 (Constantine et al. 1992;
Goldsby et al. 2000). Di dalam sel inang, RNA ditranskripsi balik menjadi DNA
dan berintegrasi dengan DNA sel inang membentuk provirus. Ensim yang
berperan dalam proses ini adalah reverse transcriptase HIV dan ensim
ribonuklease dari inang. Provirus dapat berada dalam periode laten yang lama
bahkan bisa mencapai 10 tahun dan individu tidak menunjukan gejala sakit.
Dalam periode laten, repl ikasi dan maturasi virus tetap berlangsung dalam
jumlah yang sangat rendah atau tidak berlangsung sama sekali. Provirus dalam
sel inang ikut menyebar ke sel anaknya seiring dengan replikasi genom sel inang
saat mitosis. Ketika fase laten berubah menjadi fase litik, replikasi dan maturasi
virus akan meningkat drastis dan menekan jumlah sel T CD4+ (Kuby 1992).
Faktor-faktor penyebab berkembangnya fase laten menjadi fase litik ini masih
diselidiki. Beberapa peneliti menduga bahwa aktivasi HIV tersebut disebabkan
oleh sinyal-sinyal yang berperan dalam aktivasi sel T (Kuby 1992). Menurut
dialami sel (misalnya karena logam berat, sinar UV, serangan panas atau radikal
bebas), serta virus seperti cytomegalovirus, Herpes simplex, Hepatitis B, Human
T cell Leukemia Virus turut mengaktivasi HIV dari fase latennya. Setelah provirus
teraktivasi, terjadi transkripsi DNA menjadi mRNA kemudian mRNA
ditranslasikan menjadi protein-protein komponen penyusun virus dan membentuk
virus baru (Kuby 1992; Abbas dan Lichtman 2000).
Komponen yang penting pada HIV-1 adalah gp120, gp 41 dan p24.
Antigenitas HIV-1 sangat ditentukan oleh gp120 dan gp41 karena kedua
glikoprotein tersebut berperan dalam interaksi dengan reseptor CD4 pada
permukaan sel inang. Protein gp41 merupakan mediator dalam penyatuan
amplop virus dengan membran sel inang saat terjadi infeksi. Protein p24
berlokasi di inti virus. Antibodi spesifik p24 tidak mampu menetralisasi virus,
tetapi jika muncul merupakan suatu parameter terjadinya infeksi oleh HIV
(Levinson dan Jawetz 2000).
Tabel 1. Protein yang disandi oleh gen HIV-1 dan fungsinya (sumber: Kuby 1992)
Gen Produk Protein Fungsi akhir
Gag 53-kD prekursor (P5 3)
p17, p24, p9 & p7
Protein nukleokapsid inti
p17 :berkaitan dengan permukaan dalam amplop
p24: membentuk lapisan dalam nukleokapsid
p9: komponen nukleoid inti
p7:berikatan langsung dengan genom RNA
Env 160 –kD precursor
(gp160)
gp120 & gp41
Glikoprotein amlop
gp120 :menonjol dari amplop, menempel pada
CD4
gp41: protein transmembran,memiliki komponen
untuk menempel pada sel target
Pol Prekursor
P64, p51, p10, & p32
Ensim
P64, p51 : fungsi reverse transcriptase; p64 juga
sebagai RNAase
P10: fungsi protease
P32: fungsi integrase
Vif P23 Memacu infektivitas virion bebas
Vpr P15 Mengaktivasi proses transkripsi secara lemah
Tat P14 Mengaktivasi transkripsi secara kuat
Rev P19 Meng endalikan proporsi mRNA untuk protein
struktural dan regulat or
Nef P27 Tidak memiliki fungsi regulatoris yang spesifik
Gambar 3. Siklus hidup HIV dalam tubuh (sumber: Abbas dan Lichtman 2000)
2. 3. Vaksin DNA HIV-1
Vaksinasi merupakan metode introduksi suatu zat ke dalam tubuh
manusia atau hewan dan substansi yang dikandungnya tidak lagi mampu
menyebabkan penyakit tetapi masih mampu menstimulasi sistem kekebalan
tubuh layaknya infeksi alami suatu patogen (Tortora et al. 2001). Meskipun
banyak kendala yang dihadapi dalam pengembangannya, vaksin HIV sangat
dibutuhkan untuk mencegah terjadinya infeksi (Dale et al. 2000; Kent et al. 2001;
Vaksin untuk HIV sulit dikembangkan karena HIV memiliki keunikan yang
menyebabkan virus mampu berkembang dan me ngelabui daya kerja antibodi
(Baltimore 2002). Subtipe HIV-1 yang bervariasi menyulitkan antibodi untuk
melakukan netralisasi virus (Girard 1993; Ramshaw et al. 2002; Gaschen et al.
2002).
Teknologi vaksin untuk pencegahan AIDS telah berkembang dari tahun
ke tahun dengan menghadapi berbagai kesulitan. Beberapa hal mendasar yang
masih menjadi pertanyaan adalah mengenai keamanan vaksin serta variasi virus
yang sangat beragam (Girard 1993; Joy et al.1999).
Seperti halnya vaksin virus lain, usaha pengembangan vaksin HIV selama
ini mengacu pada stimulasi antibodi. Vaksin HIV selal u diusahakan untuk “aman”
dengan tidak menginfeksi sel, namun ternyata tidak diperoleh hasil yang
memuaskan. Meskipun transfer pasif antibodi dosis tinggi dari individu terinfeksi
kepada hewan model terbukti dapat mencegah transmisi HIV, kenyata annya
antibodi yang mampu menetralisir HIV tetap sulit diinduksi melalui vaksinasi (Joy
et al. 1999; Kent 2001). Suatu fakta yang menarik adalah vaksin yang
menginduksi respon kebal seluler terutama sel limfosit T spesifik HIV (bukan
antibodi) ternyata mampu menghambat replikasi HIV pada hewan model. Vaksin
yang menginduksi respon ini mengharuskan adanya infeksi HIV pada sel inang
guna menstimulir respon kebal tersebut (Kent et al. 1998; Kent 2001). Untuk
menginduksi respon kebal seluler yang aman dan efisien terhadap HIV, dicoba
jenis vaksin baru berupa vaksin DNA dan vaksin yang memanfaatkan live-virus
sebagai vektornya (Joy et al. 1999; Kent 2001; Baltimore 2002).
Vaksin DNA merupakan jenis vaksin berupa plasmid DNA suatu virus
yang dimasukkan ke dalam tubuh menggunakan virus vektor (pembawa) atau
secara langsung menggunakan gene gun (Simmonds et al. 199 6). Cara
(ID), intravena dan intraperitoneal serta skarifikasi epidermis, per oral, intranasal
dan vaginal. Metode imunisasi DNA yang paling umum dipelajari dalam berbagai
studi selama ini adalah IM dan ID. Vaksinasi DNA dengan kedua metode ini telah
terbukti mampu menginduksi respon kebal terhadap antigen yang dibawanya
(Gurunathan et al. 2000).
Keuntungan dari penggunaan vaksin DNA adalah vaksin mampu
menginduksi respon kebal yang sama seperti respon terhadap kehadiran
patogen asli, hal ini karena antigen dari vaksin dipaparkan pada sel inang dalam
bentuk sebenarnya. Selain itu antigen yang terpapar lebih lama memungkinkan
bagi terjadinya pembentukan memori (Goldsby et al . 2000). Dari berbagai studi
yang dilakukan, vaksin DNA telah terbukti mampu menstimulir respon kebal
humoral maupun seluler terhadap berbagai antigen, namun belum cukup optimal
untuk memproteksi terhadap HIV (Goldsby et al. 2000; Gurunathan et al. 2000),
Maka kemudian dikembangkan berbagai regimen alternatif untuk menggertak
respon kebal terhadap HIV. Regimen yang umum digunakan antara lain adalah
protein rekombinan ataupun virus Pox (Gurunathan et al. 2000).
Pendekatan penggunaan vaksin DNA yang cukup menjanjikan untuk
meningk atkan kekebalan seluler terhadap HIV adalah melalui metode imunisasi
prime -boost, yaitu priming dengan DNA HIV dan digertak (boosting)
menggunakan vaksin rekombinan virus Fowl pox (Kent et al. 1998; Robinson et al.
2000; Amara et al. 2001). Pada penggunaan rekombinan virus Pox sebagai
booster, kompetisi antara antigen vaksin HIV dan antigen vektor dalam
menginduksi kekebalan akan minimal karena memori terhadap antigen vaksin
lebih dominan daripada memori terhadap vektor (Robinson et al . 2000). Dari
beberapa studi yang membandingkan proto kol vaksinasi HIV, hewan coba yang
divaksinasi DNA dan dibooster dengan rFPV menunjukkan hasil uji-tantang yang
2. 4. Macaca nemestrina
Dalam ordo primata dikenal tiga klasifikasi besar yaitu sub-ordo
prosimians, tarsioidea, dan anthropoidea. Hewan yang tergolong prosimians
adalah lemur dan loris. Hewan yang termasuk dalam sub-ordo Tarsioidea adalah
tarsius. Sub-ordo Antrhopoidea terbagi menjadi dua infra-ordo; platyrrhini yaitu
monyet-monyet dunia baru serta catarrhini yang terdiri dari monyet dunia lama,
kera dan manusia. Pembagian monyet dunia baru dan dunia lama didasarkan
kepada beberapa perbedaan morfologis dan fungsi alat tubuh. Salah satu famili
yang termasuk dalam catarrhini adalah cercopithecidae yang beranggotakan
hewan-hewan dari genus Macaca (Napier dan Napier 1985).
Selain manusia, Macaca merupakan primata yang penyebarannya paling
luas. Berbagai spesies Macaca dapat dijumpai di Moroko, Algeria, Gibraltar,
Afganistan, India, Cina, Jepang dan sepanjang Asia Tenggara (Filipina,
Sumatera, Jawa dan Sulawesi). Genus ini sering digunakan sebagai hewan
laboratorium di sebagian daerah barat. Tubuh Macaca berukuran sedang.
Ukuran jantan lebih besar daripada betina. Hewan anggota genus ini merupakan
hewan arboreal dan terestrial. Makanannya adalah buah-buahan, dedaunan dan
invertebrata kecil (Napier dan Napier 1985; Swindler 1998).
Macaca khususnya Macaca nemestrina dan Macaca fascicularis
merupakan spesies yang tersebar di Indonesia, yakni Pulau Sumatera, Jawa,
Kalimantan, Nusa Tenggara, Bali dan negara di Asia Tenggara seperti Malaysia
dan Thailand (Darusman 2001). Macaca nemestrina yang biasa dikenal dengan
beruk, adalah hewan dengan ciri khas rambut coklat di tubuh bagian atas dan
putih di bagian bawahnya. Bagian ujung kepalanya berwarna coklat tua. Ekornya
Taksonomi Macaca nemestrina dalam Swindler (1998) adalah sebagai
Jenis primata non-manusia, disebut satwa primata, memiliki kedekatan
kekerabatan dengan manusia. Keduanya memiliki kondisi fisiologis, biologis dan
patologis yang mirip satu sama lain. Satwa primata seringkali merupakan hewan
coba yang paling sesuai untuk penelitian dalam kaitannya dengan ilmu
pengetahuan tentang manusia. Kekerabatan yang amat dekat menyebabkan
satwa primata suseptibel atau peka terhadap berbagai penyakit manusia (Sidik
2001).
Pada primata terdapat penyakit serupa AIDS yang disebut Simian
Adequate Immunodeficiency Syndrome (SAIDS). Penyakit ini disebabkan oleh
virus Simian Retrovirus (SRV) dan SIV, menyerang kekebalan tubuh primata.
Gejala klinisnya serupa dengan AIDS pada manusia dan memungkinkan
terjadinya infeksi oportunistik (Kuby 1992). SIV pada Macaca dapat dijadikan
model penelitian untuk menemukan vaksin terhadap HIV (Girard 1993; Lu et al.
1996).
Beberapa primata termasuk beruk ternyata dapat terinfeksi pula oleh HIV,
meskipun virus ini tidak akan menyebabkan AIDS (Kuby 1992). Kerentanan
beruk terhadap infeksi HIV -1 tidak akan berkembang menjadi imunodefisiensi
RNA ataupun virus HIV-1 yang dapat dikultur (Dale et al. 2000). Karena bersifat
peka terhadap HIV, beruk dapat menjadi hewan model yang tepat untuk
kepentingan penelitian biomedis manusia sehubungan dengan AIDS (Kuby
1992). Oleh sebab itu, saat ini Macaca nemestrina banyak diminta oleh
laboratorium medis untuk digunakan dalam penelitian HIV (Rowe 1996).
Gambar 4. Satwa primata Macaca nemestrina usia pradewasa (Sumber: Pusat Studi Satwa Primata 2003)
2. 5. Teknik Enzyme-Linked Immunosorbent Assay (ELISA)
Uji serologis Enzyme-Linked Immunosorbent Assay yang biasa disingkat
ELISA adalah uji kuantitatif yang digunakan untuk pengukuran antigen atau
antibodi pada spesimen pasien. ELISA merupakan salah satu teknik
immunoassay yang prinsipnya adalah reaksi antigen-antibodi, dapat dideteksi
dengan penambahan konjugat dilabel ensim aktif yang bereaksi dengan substrat
menghasilkan warna spesifik (Levinson dan Jawetz 2000)
ELISA terdiri dari beberapa tipe yaitu ELISA tipe tidak langsung,
Sandwich ELISA dan ELISA kompetitif. Masing-masing tipe digunakan
tergantung dari tujuan uji yang dilakukan. Untuk deteksi antibodi, tipe yang biasa
memeriksa keberadaan antibodi terhadap HIV (Kuby 1992; Constantine et al.
1992, Levinson dan Jawetz 2000; Goldsby, et al. 2000).
Protokol ELISA tidak langsung dalam Constantine et al. (1992) adalah
sebagai berikut. Antigen (biasanya berupa protein suatu virus yang telah
diketahui) dilekat kan dalam sumur pada lempeng polistiren. Selanjutnya sampel
ditambahkan ke dalam sumur dan jika sampel mengandung antibodi maka terjadi
ikatan antigen-antibodi.
Setelah proses pencucian, konjugat ditambahkan dan di lakukan inkubasi.
Konjugat akan berikatan dengan antibodi dan kelebihannya akan terbuang pada
pencucian berikutnya. Konjugat biasanya merupakan antibodi yang dilabel
dengan ensim, florokrom atau reagen lainnya yang jika bereaksi akan
menghasilkan wa rna. Antibodi pada konjugat umunya berupa anti-human
immunoglobulin dan ensim yang biasa digunakan adalah Alkaline phosphatase
atau Horseradish peroxidase. Substrat yang ditambahkan selanjutnya tergantung
pada jenis konjugatnya. Karena substrat bersifat peka terhadap cahaya maka
inkubasi dilakukan dalam ruang gelap dan pada suhu ruangan. Jika konjugat
bereaksi dengan ikatan antibodi-antigen, ensim dalam konjugat mampu membuat
kromogen pada substrat menghasilkan warna. Warna yang dihasilkan dapat
dideteksi secara visual maupun diu kur dengan alat seperti spektrofotometer.
Hasil uji ELISA diukur dari optical density (OD) pada panjang gelombang
tertentu. Penentuan hasil uji dilakukan berdasarkan nilai OD kontrol positif,
kontrol negatif dan sampel-sampel yang diuji. Titer antibodi sebanding dengan
aktivitas ensim (Levinson dan Jawetz2000), semakin kuat warna yang dihasilkan
berarti titer antibodi sampel semakin tinggi. Jika antibodi pada sampel sedikit
atau tidak ada sama sekali, maka semakin sedikit pula konjugat yang berikatan
lemah dan nilai OD semakin kecil. Pada ELISA tidak langsung, nilai OD akan
sebanding dengan konsentrasi antibodi (Constantine et al. 1992).
Saat ini ELISA biasa digunakan sebagai uji penapisan terhadap HIV
dengan Western Blot sebagai uji konfirmatorinya (Constantine et al. 1992;
Goldsby et al. 2000; Kresno 2000).
III. BAHAN DAN METODE
3.1. Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan April sampai dengan Oktober 2003
bertempat di Fasilitas Hewan Penelitian dan Laboratorium Mikrobiologi dan
Imunologi Pusat Studi Satwa Primata, Lembaga Penelitian dan Pemberdayaan
Masyarakat Insititut Pertanian Bogor (PSSP LPPM-IPB). Penelitian ini
merupakan bagian dari penelitian kerjasama PSSP LPPM-IPB dengan tim
peneliti dari University of Melbourne, Australia.
3.2. Sampel
Hewan coba yang digunakan adalah beruk (M. nemestrina) jantan umur
pradewasa (2-3 tahun) yang berasal dari penangkaran PSSP LPPM-IPB
Darmaga. Hewan telah melalui proses seleksi dan karantina sehingga dipastikan
termasuk kategori hewan bebas patogen tertentu (specific pathogen free, SPF)
dalam hal ini bebas tuberkulosis dan simian retrovirus (SRV).
Sampel yang digunakan adalah plasma beruk dari kelompok hewan
divaksinasi (A) dan kelompok hewan kontrol (B). Sebagai kontrol untuk acuan
dalam uji ELISA digunakan serum yang telah diketahui positif dan negatif
terhadap HIV-1.
3.3. Vaksin
Kelompok A diberi vaksin DNA HIV-1 berupa plasmid DNA pHIS yang
diinsersi gen-gen HIV-1 subtipe B (gag dan pol yang dimodifikasi, rev, tat, vpu,
serta nef dan env yang dipotong) dan booster vaksin rekombinan virus Fowlpox
berupa plasmid DNA pHIS tanpa gen HIV-1 serta booster berupa virus Fowlpox
(FPV) tanpa sisipan gen HIV -1. Vaksin diaplikasikan melalui rute intramuskular.
Seluruh regimen vaksin yang digunakan dalam penelitian ini diperoleh dari
tim peneliti Laboratorium Vaksin HIV, Departemen Mikrobiologi dan Imunologi,
University of Melbourne, Australia yang dipimpin oleh Dr. Stephen J. Kent, MD,
MBBS, FRACP.
3.4. Reagensia dan Bahan Habis Pakai
Larutan penyangga borat, larutan penyangga PBS (phosphate buffer
saline), Tween-20, susu tanpa lemak, air tanpa ion, protein p24 HIV-1, kontrol
protein, goat anti-monkey IgG yang dikonjugasikan dengan peroksidase, substrat
TMB (3-3-5-5-tetramethylbenzidine), larutan penyangga phosphate citrate buffer,
H2SO4, jarum suntik, tabung hampa udara berheparin, 96 well ELISA plate.
3.5. Alat
Alat yang digunakan adalah sentrifuse, penangas air 56°C, lemari
pendingin suhu 4°C dan suhu -70°C, ELISA microplate reader, microplate
washer, micropipettor, biosafety cabinet, pipette tips, vortex, inkubator 37°C.
3.6. Metode Penelitian
Seluruh pelaksanaan kegiatan penelitian secara etika dan moral telah
memperoleh persetujuan etik dari Komisi Pengawasan Kesejahteraan dan
Penggunaan Hewan Penelitian PSSP-LPPM IPB (Animal Care and Use
Committee, Primate Research Center-Bogor Agricultural University) dengan
nomor persetujuan 03-003-OR tahun 2003 (Lampiran 1).
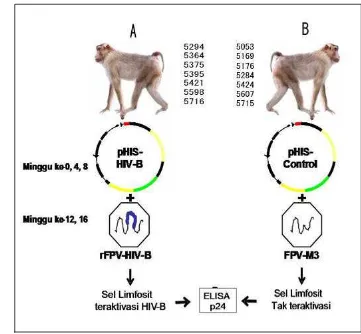
Gambar 6. Skema desain penelitian disajikan secara ringkas dalam gambar
3.6.1. Program Vaksinasi
Empat belas ekor beruk dibagi menjadi dua kelompok yaitu kelompok A
(kelompok hewan yang divaksinasi) dan kelompok B (kelompok kontrol).
Masing-masing kelompok terdiri dari tujuh ekor dengan nomor identifikasi tato tertera
Tabel 2. Daftar Identitas Macaca nemestrina (nomor tato) kelompok A (kelompok yang divaksinasi) dan kelompok B (kelompok kontrol)
Kelompok A Kelompok B
5294
Kelompok A diimunisasi dengan vaksin DNA HIV-1 melalui metode
priming DNA HIV-1 dan boosting dengan rFPV-HIV, sedangkan kelompok B
merupakan kelompok kontrol yang diberi placebo. Jadwal vaksinasi pada kedua
kelompok dituliskan pada Tabel 3 dibawah ini.
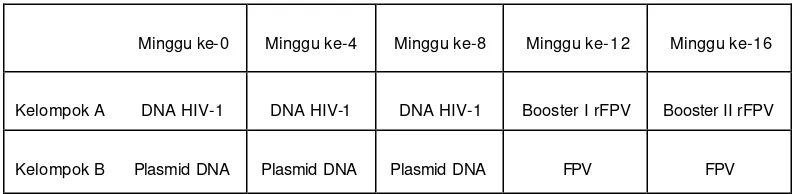
Tabel 3. Jadwal vaksinasi priming dan boosting pada hewan kelompok A dan B
Minggu ke- 0 Minggu ke-4 Minggu ke-8 Minggu ke- 12 Minggu ke-16
Kelompok A DNA HIV-1 DNA HIV-1 DNA HIV-1 Booster I rFPV Booster II rFPV
Kelompok B Plasmid DNA Plasmid DNA Plasmid DNA FPV FPV
3.6.2. Koleksi Sampel
Dilakukan pengambilan darah dengan venesectio pada vena femoralis.
Jadwal koleksi sampel disajikan pada Tabel 4. Hewan terlebih dahulu dianastesi
dengan injeksi Ketamin (10-20 mg/kg BB) secara intramuskular. Setelah hewan
teranastesi, darah diambil dan dimasukkan ke tabung hampa udara dengan anti
koagulan heparin.
Selanjutnya darah di sentrifugasi dengan kecepatan 400 x g (gravitasi).
sehingga terbentuk endapan dan supernatan. Supernatan merupakan plasma
yang akan digunakan untuk uji. Sebelum diuji, plasma diinaktivasi dengan
pemanasan pada suhu 56°C selama tiga puluh menit. Jika sampel tidak
langsung digunakan dapat disimpan pada suhu -70°C untuk selanjutnya
digunakan dalam uji ELISA.
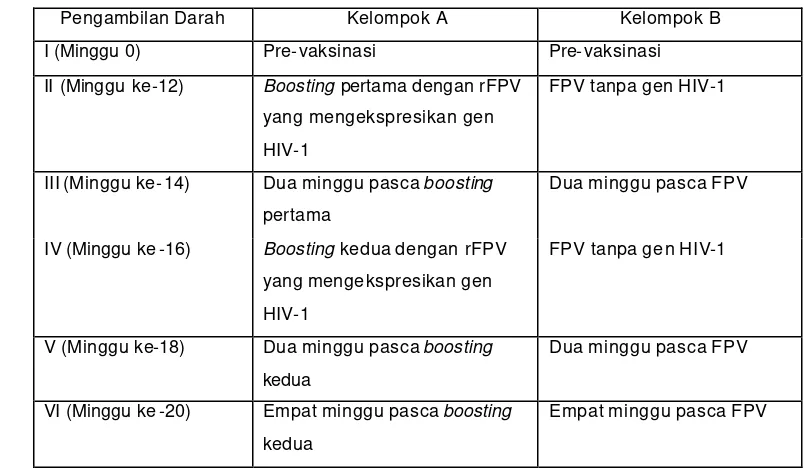
Tabel 4. Jadwal pengambilan darah yang digunakan untuk uji ELISA
Pengambilan Darah Kelompok A Kelompok B I (Minggu 0) Pre-vaksinasi Pre-vaksinasi II (Minggu ke-12) Boosting pertama dengan rFPV
yang mengekspresikan gen HIV-1
FPV tanpa gen HIV-1
III (Minggu ke-14) Dua minggu pasca boosting pertama
V (Minggu ke-18) Dua minggu pasca boosting kedua
Dua minggu pasca FPV
VI (Minggu ke -20) Empat minggu pasca boosting kedua
Empat minggu pasca FPV
Secara sekuensial jadwal vaksinasi dan pengambilan darah disajikan pada
Gambar 7. Jadwal vaksinasi dan pengambilan darah disajikan secara sekuensial
3.6.3. Enzyme-linked Immunosorbent Assay (ELISA)
Uji ELISA yang dilakukan pada penelitian ini adalah ELISA tipe tidak
langsung untuk mendeteksi ada tidaknya antibodi terhadap HIV-1 protein p24
yang merupakan protein komponen inti (capsid) HIV-1.
Sebanyak 2µg/ml protein p24 HIV-1 dalam larutan penyangga Borat
digunakan untuk melapisi tiap sumur dari lempeng ELISA 96-well. Sebagai
kontrol background digunakan protein yang berasal dari sel tidak terinfeksi
tempat ditumbuhkannya p24 HIV dengan konsentrasi yang sama. Setiap sumur
pada lempeng dilapis dengan antigen p24 dan kontrol p24 sebanyak 50µl.
Selanjutnya dilakukan inkubasi 18 jam pada suhu 4°C. Kemudian dilakukan
pencucian dengan PBS-Tween 0.05% menggunakan ELISA microplate washer
yang dilanjutkan dengan blocking selama dua jam pada suhu 37°C
menggunakan larutan penghambat berupa susu tanpa lemak 5% dalam
PBS-Tween 0.05% dan setelah itu dicuci kembali. Tujuan blocking adalah mencegah
terjadinya ikatan antara lempeng dengan protein asing yang dapat mengganggu
hasil uji.
Sebanyak 50µl (perbandingan 1:400 dalam larutan penghambat) plasma
M.nemestrina, kontrol positif antibodi p24 HIV, kontrol negatif p24 HIV
dimasukkan ke dalam setiap sumur dan diinkubasi selama 90 menit pada suhu
37°C. Sebanyak empat sumur tidak diberi penambahan sampel oleh karena
optical density (OD) yang dihasilkan aka n digunakan sebagai kontrol konjugat
dalam analisis hasil.
Setelah pencucian, dimasukkan ke dalam masing-masing sumur sebanyak
dalam larutan penghambat. Inkubasi dilakukan pada suhu 37°C selama 60 menit
dan diikuti dengan pencucian menggunakan PBS-Tween 0,05%.
Tahap akhir uji adalah penambahan substrat berupa TMB yang dilarutkan
dalam Phosphate Citrate Buffer sebanyak 50 µl pada setiap sumur dalam kondisi
gelap selama 20 menit. Penghentian reaksi dilakukan dengan penambahan
larutan H2SO4. Substrat akan bereaksi dengan ensim peroksidase sehingga
chromogen yang dikandung substrat tersebut teroksidasi menghasilkan warna
yang akan dibaca dengan alat ELISA microplate reader pada panjang gelombang
450nm. Hasil pembacaan berupa nilai kepadatan optik (OD) sebagai data
numerik yang mempresentasikan kadar antibodi dalam sampel.
3.6.4. Analisis Hasil ELISA
Untuk mendapatkan nilai kepadatan optik atau Optical Density (OD) yang
sesungguhnya digunakan formulasi yang merupakan standar penghitungan
empirik di Laboratorium Mikrobiologi dan Imunologi, PSSP LPPM-IPB, disajikan
dalam tabel 5 dibawah ini.
Tabel 5. Rumus perhitungan ni lai Optical Density (OD)
OD konjugat kontrol = (OD p24 – OD kontrol p24) pada sumur tanpa sampel
OD sampel = (OD sampel pada p24 – OD s ampel pada kontrol p 24) –
OD konjugat control
Analisis hasil diamati secara metode deskriptif dengan menggunakan
tabel dan grafik yang menyajikan nilai OD sesungguhnya dari setiap sampel asal
IV. HASIL PENELITIAN
Dari uji ELISA yang dilakukan, diperoleh hasil berupa nilai OD setiap
individu yang menggambarkan kadar antibodi p24 HIV-1 yang terbentuk dalam
tubuh sebelum vaksinasi (minggu ke-0) dan setelah vaksinasi DNA HIV-1.
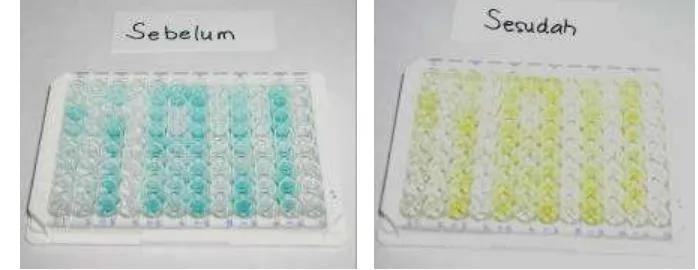
Gambar 8. Sumur lempeng ELISA. Warna kuning yang semakin tua menandakan
nilai OD yang semakin besar
4.1. Kontrol Positif dan Negatif
Nilai OD kontrol positif HIV dan negatif HIV masing-masing menunjukkan
nilai rata-rata 0.430 dan 0.015
4.2. Kelompok A
Kadar antibodi p24 HIV-1 yang terbentuk diukur secara tidak langsung
dengan membaca nilai OD dari setiap hewan. Kelompok A terdiri dari
hewan-hewan yang divaksinasi DNA HIV-1 dan dibooster rFPV. Nilai OD dari setiap
Gambar 9. Pola induksi respon kebal humoral berupa p embentukan antibodi p24 HIV-1 pada kelompok A yang divaksinasi DNA HIV-1 serta diboosting dengan rFPV-HIV. Terjadi kenaikan nilai OD pada dua minggu pasca booster kedua.
Nilai OD pravaksinasi sampai dengan minggu ke-16 cenderung tidak
berubah, kecuali pada hewan nomor 5716 di minggu ke-14. Pada minggu ke-18
yaitu dua minggu setelah booster rFPV yang kedua, lima dari tujuh sampel
menunjukkan kenaikan nilai OD. Pada grafik dalam gambar 9, terlihat bahwa dari
lima sampel tersebut, empat hewan yaitu; 5294, 5421, 5598 dan 5716
mengalami kenaikan nilai OD yang tajam. OD hewan-hewan tersebut mencapai
nilai yang lebih tinggi daripada OD kontrol positif. Nilai OD kemudian
menunjukkan penurunan kembali pada minggu ke-20.
Respon antar individu ternyata berbeda walaupun mengalami perlakuan
vaksinasi yang sama. Hewan 5716 menunjukkan respon antibodi yang berbeda
dengan keenam hewan lainnya. Pada dua minggu setelah booster rFPV pertama,
hewan ini telah menunjuk kan adanya kenaikan nilai OD sedangkan pada hewan
lain tidak demikian. Hewan 5421 memiliki respon yang berbeda pula. Setelah OD
hewan menunjukkan nilai 0.617 pada dua minggu pasca booster kedua, pada
minggu ke-20 nilainya hampir tidak berubah yaitu 0.603. Sebaliknya, nilai OD
hewan 5364 dan 5375 tidak menunjukkan fluktuasi perubahan setelah vaksinasi
maupun booster. Nilai OD sebelum dan sesudah perlakuan tetap rendah yakni
0.1
Walaupun terdapat perbedaan respon antara tiap individu hewan, namun
secara umum terlihat adanya suatu keseragaman pola respon antibodi yaitu
antibodi p24 HIV terbentuk dan terdeteksi pada dua minggu pasca booster yang
kedua.
4. 3. Kelompok B
Kelompok B merupakan kelompok kontrol. Hewan dalam kelompok ini
diberi plasmid DNA dan FPV, keduanya tanpa ekspresi gen HIV. Nilai OD
seluruh hewan kelompok B pada tiap waktu perlakuan disajikan dalam tabel 7
dan gambar 10 berikut ini.
Tabel 7. Nilai Optical Density Kelompok B
Gambar 10. Respon antibodi p24 HIV-1 pada kelompok B (kelompok kontrol) yang diberi placebo berupa vektor plasmid DNA dan FPV tanpa introduksi gen HIV. Nilai OD cenderung rendah sebelum maupun sesudah divaks inasi.
Secara umum ketujuh hewan tidak memperlihatkan perubahan nilai OD
antara satu waktu perlakuan ke perlakuan berikutnya. Kadar antibodi
pravaks inasi DNA sampai dengan pasca injeksi FPV konstan dengan nilai OD
yang rendah dibawah 0.200.
Gambar 11 menyajikan grafik nilai OD rataan kelompok A dan B. Dapat
terlihat bahwa kelompok A menunjukkan kenaikan kadar nilai OD pada dua
minggu pasca booster kedua, sementara pada kelompok B sebagai kontrol tidak
menunjukkan adanya pola perubahan kadar antibodi dari pravaksinasi sampai
- 0.1
Gambar 11. Grafik rataan nilai OD kelompok A dan B yang menggambarkan kadar antibodi p24 HIV-1 yang dideteksi dengan ELISA. Pada kelompok A yang divaksinasi, terjadi induksi respon kebal humoral terhadap HIV-1 terlihat dari kenaikan kadar antibodi pada dua minggu pasca booster kedua
V. PEMBAHASAN
Saat terpapar suatu protein asing, tubuh hewan akan melakukan respon
kebal humoral dengan menghasilkan antibodi yang bereaksi spesifik terhadap
protein tersebut. Pada uji ELISA yang dilakukan dalam penelitian ini diperoleh
nilai yang menggambarkan respon pembentukan antibodi yang diinduksi oleh
vaksinasi. Nilai antibodi yang diperoleh merupakan nilai kuantitas dan tidak
menunjukkan nilai titernya.
Protein p24 merupakan protein capsid HIV-1 dan disandi dari gen gag
infeksi oleh HIV-1 (Levinson dan Jawetz 2001). Terdeteksinya antibodi protein
p24 pada penelitian ini menunjukkan bahwa gen gag HIV-1 dalam vaksin DNA
telah ditranskripsi dan ditranslasikan membentuk protein p24 yang selanjutnya
dipresentasikan pada sel inang. Pemaparan protein p24 menginduksi respon
kebal humoral berupa pembentukan antibodi terhadap protein tersebut.
Nilai OD pada minggu ke-12 (pra-boosting) mendekati nilai OD pravaksinasi
(minggu ke-0), menunjukkan bahwa sampai titik waktu tersebut, hewan coba
yang diimunisasi priming tidak menginduksi respon kebal humoral. Pada minggu
ke-12 dilakukan boosting dengan rFPV-HIV yang membawa gen gag dan pol
HIV-1. Setelah boosting pertama tidak terlihat kenaikan nilai OD kecuali pada
satu hewan (5716). Antibodi p24 HIV-1 terdeteksi pada minggu ke-18, dua
minggu pasca boosting yang kedua. Grafik pada gambar 9 memperlihatkan
kenaikan nilai OD sampel asal lima dari tujuh hewan coba kelompok A. Hasil
serupa juga dilaporkan oleh Letvin et al. (1997) yang menggunakan vaksin
protein HIV-1 sebagai booster setelah imunisasi priming dengan vaksin DNA.
Respon antar individu tidak sepenuhnya seragam walaupun mendapat
perlakuan vaksinasi yang sama. Variasi individu mempengaruhi respon kebal
yang terbentuk. Satu individu mungkin mampu berespon kuat terhadap p24,
sementara mungkin pada hewan lainnya tidak (Constantine et al . 1992). Hewan
nomor 5716 menunjukkan respon pembentukan antibodi p24 terdeteksi sejak
dua minggu pasca booster pertama, terlihat dari kenaikan nilai OD pada minggu
ke-14 dan meningkat pada minggu ke-18. Pada hewan 5421, nilai OD melonjak
dua minggu setelah booster kedua mencapai 0.617 dan tetap bertahan tinggi
pada nilai 0.603 pada minggu ke-20. Dua hewan pada kelompok A yaitu 5364
dan 5375 tidak menunjukkan pola pembentukan antibodi seperti hewan lain pada
kelompok ini, nilai OD pada tiap waktu perlakuan tetap rendah seperti pada
kurang baik. Studi oleh Smith et al. (2005) menduga adanya kaitan keragaman
tipe molekul Major Histocompatibility Complex (MHC) pada hewan coba dengan
variasi respon yang terjadi setelah vaksinasi.
Kelompok hewan kontrol tidak menunjukkan adanya respon spesifik
antibodi p24 HIV dari satu waktu ke waktu lainnya, terlihat dari nilai OD pra dan
pasca vaksinasi berkisar pada nilai yang rendah dan cenderung konstan. Hal ini
membuktikan tanpa introduksi protein asing tidak akan terjadi pembentukan
antibodi dalam tubuh.
Antibodi p24 yang terdeteksi pada seorang pasien bukan berarti antibodi
yang mampu menetralisasi virus (Levinson dan Jawetz 2001). Hasil ELISA hanya
dapat menyatakan kadar antibodi yang muncul tanpa melihat kemampuannya
melakukan fungsi kekebalan. Penelitian ini tidak melihat kemampuan antibodi
menetralisasi virus HIV-1. Untuk menghasilkan respon kebal humoral berupa
antibodi yang mampu menetralisasi (anti-gp120) sangatlah sulit. Antibodi akan
bersifat spesifik pada antigen dari strain virus yang digunakan untuk vaksin
sedangkan virus ini memiliki kemampuan mutasi yang luar biasa (Montefiori
2001).
Vaksin DNA HIV-1 dikembangkan dengan fokus untuk menghasilkan
respon kebal seluler yang diharapkan akan lebih efektif memberikan proteksi
terhadap infeksi HIV. Penelitian ini merupakan bagian dari penelitian oleh
Pamungkas (2005) dan dalam studinya ditemukan bahwa vaksinasi DNA HIV-1
dan booster rFPV-HIV menghasilkan respon kebal seluler spesifik terhadap
protein gag HIV-1, yang meningkat pada satu minggu pasca booster pertama
dengan rFPV. Pada penelitian Kent et al. (1998) menggunakan hewan coba tikus,
vaksinasi priming dengan DNA HIV-1 dan boosting dengan rFPV-HIV merupakan
usaha imunisasi yang menginduksi respon kebal seluler (Cytotoxic
Maka menjadi suatu hal yang menarik bahwa ternyata pada vaksinasi DNA HIV-1
metode prime/boost menggunakan hewan coba Macaca, respo n kebal humoral
juga terjadi dengan kadar antibodi yang meningkat pasca booster kedua.
Proses vaksin DNA menginduksi respon kebal di dalam tubuh dijelaskan
dalam Gurunathan et al. (2000) dan Simmonds et al. (1996) sebagai berikut.
Plasmid DNA yang diinsersi DNA virus masuk ke dalam tubuh dan melakukan
transfeksi pada sel inang. Di dalam sel, protein asing yang terbentuk akan
dipecah menjadi peptida-peptida yang kemudian dipaparkan bersama MHC. Jika
suatu protein asing muncul dari dalam sel inang, maka protein tersebut akan
masuk ke jalur MHC kelas I. Jalur ini menginduksi respon kebal seluler berupa
aktivasi CTL yang spesifik terhadap protein antigen. Sebaliknya, respon kebal
humoral berupa pembentukan antibodi muncul jika protein asing yang eksogen
masuk ke dalam sel inang melalui proses endositosis atau fagositosis, kemudian
masuk jalur MHC kelas II sel inang. Respon kebal yang muncul tergantung dari
pemaparan antigen di dalam tubuh inang. Transfeksi DNA virus pada sel somatis
akan mengaktifkan kekebalan dengan mediasi MHC kelas I. Jika protein virus
yang terbentuk keluar dari sel somatis dan ditangkap oleh Antigen Presenting
Cells (APC) maka akan dipaparkan bersama MHC kelas I maupun II. Demikian
pula jika transfeksi langsung terjadi pada APC maka akan mengaktifkan jalur
respon kebal yang melibatkan MHC kelas I dan kelas II.
Vaksinasi dengan DNA HIV-1 dan booster menggunakan rFPV-HIV dalam
rangkaian studi ini terbukti mampu menginduksi respon kebal humoral dan juga
seluler dengan terdeteksi adanya respon antibodi serta peningkatan jumlah
limfosit setelah vaksinasi. Namun, belum dapat dipastikan vaksin akan mampu
memproteksi hewan bila dilakukan uji tantang. Data yang diperoleh dari
penelitian ini dapat menjadi tambahan bukti mengenai kemampuan vaksin DNA
VI. SIMPULAN DAN SARAN
6.1. Simpulan
Berdasarkan hasil penelitian, imunisasipada Macaca nemestrina dengan
vaksin DNA HIV-1 menginduksi respon kebal humoral. Dengan teknik ELISA
dideteksi adanya antibodi terhadap protein p24 HIV -1 yang muncul pada dua
minggu setelah boosting rFPV-HIV-1 yang kedua.
Pengembangan vaksin DNA sebagai vaksin untuk HIV-1 membutuhkan
studi lebih lanjut. Berbagai penelitian masih harus dilakukan sehubungan dengan
optimalisasi vaksin, baik pengembangan regimen vaksin DNA maupun regimen
vektornya agar dapat menghasilkan respon kebal yang lebih baik.
Untuk mengetahui pola respon antibodi hasil imunisasi vaksin DNA HIV-1
ini secara lebih lengkap, penulis menyarankan agar dapat dilakukan penelitian
menggunakan sampel plasma dari seluruh waktu perlakuan. Selain itu, dapat
dilakukan uji konfirmatori Western Blot untuk mengetahui profil antibodi yang
lebih lengkap. Jika fasilitas laboratorium memungkinkan, dapat pula dilakukan uji
tantang.
DAFTAR PUSTAKA
Abbas AK dan Lichtman AH. 2003. Cellular and Molecular Immunology. Fifth Edition. Saunders-Elsevier Science. Philadelphia, Amerika Serikat. Halaman : 464-475
Amara RR, Villinger F, Altman JD, Lydy SL, O’Neil SP, Satprans SI, Montefiori DC, Xu Y, Herndon JG, Wyatt LS, Candido MA, Kozyr NL, Earl PL, Smith JM, Ma H, Grimm BD, Hulsey ML, Miller J, McClure HM, McNicholl JM, Moss B, Robinson HL. 2001. Control of a Mucosal Challenge and
Prevention of AIDS by a Multiprotein DNA/MVA Vaccine. Science (292):69-74
Constantine NT, Callahan JD dan Watts DM. 1992. Retroviral Testing: Essentials for Quality Control and Laboratory Diagnosis. CRC Press. Boca Raton, Florida Amerika Serikat. Halaman: 5-58
Dale CJ, Zhao A, Jones SL, Boyle DB, Ramshaw IA da n Kent SJ. 2000. Induction of HIV-1 specific T-helper responses and type 1 secretion following therapeutic vaccination of macaques with a recombinant fowlpoxvirus co-expressing interferon gamma. J.Med Primatol 29(3-4):240-7
Darusman HS. 2001. Pengembangan Uji Penapisan Antibodi Terhadap Simian Retrovirus Tipe-D Serotipe-2 (SRV-2) dengan Teknik Dot Blot Immunoassay (DBIA) [skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Kedokteran Hewan. Halaman:12-15
Freed EO dan Martin MA. 2001. HIVs and Their Replication. Di dalam: Knipe DM, Howley PM, Griffin DE, Lamb A, Martin MA, Roizman B, Straus SE (Ed.). Fields Virology Vol.2. Fourth Edition. Lippincott Williams&Wilkins. Philadelphia, Amerika Serikat. Halaman:1971-2026
Gaschen B, Taylor J, Yusim K, Foley B, Gao F, Lang D, Novitsky V, Haynes B, Hahn BH, Bhattacharya T dan Korber B. 2002. Diversity Considerations in HIV-1 Vaccine Selection. Science (296):2354-2360
Girard M. 1993. The Needs and Hopes for an AIDS Vaccine.Biochimie7 :583-589
Goldsby RA, Kindt TJ dan Osborne BA. 2000. Kuby Immunology. WH Freeman and Company. New York, Amerika Serikat. Halaman: 161, 478-492
Gurunathan SD, Klinman M dan Seder RA. 2000. DNA Vaccines: Immunology, Application dand Optimization. Annual Review Immunology. (18): 927-974 International Committee for Taxonomy on Viruses. 2000. Index of Viruses:ICTV
Index to Virus Classification and Nomenclature, Taxonomic Lists and Catalogue of Viruses. http://www.ncbi.nlm.nih.gov/IVTVdb/Ictv/fr-indv0.htm
Iskandriati, D. 2004. Identifikasi dan Karakterisasi Simian Retrovirus Tipe-D Pada Macaca fascicularis, M. nemestrina dan Presbytis spp di Indonesia [disertasi]. Bogor:Insititut Pertanian Bogor, Sekolah Pascasarjana. Halaman : 1-19
Joy AK, Dale J dan Kent SJ. 1999. Can HIV Infection be Prevented with a Vaccine. Journal Drugs R&D (6): 431-440
Kent SJ, Zhao A, Best SJ, Chandler JD, Boyle DB dan Ramshaw IA. 1998. Enhanced T-Cell Immunogenicity and Protective Efficacy of a Human Immunodefficiency Virus Type 1 Vaccine Regimen Consisting of Consecutive Priming with DNA and Boosting with Recombinant Fowlpox Virus. Journal of Virology. Vol 72. (12): 10180-10188
(171): 124-125
---. 2001. Vaccines to Pre vent HIV and AIDS. Microbiology Australia (22):1215
Kresno SB. 2001. Imunologi: Diagnosis dan Prosedur Laboratorium Edisi Keempat. Fakultas Kedokteran Universitas Indonesia. Jakarta, Indonesia. Halaman:1-95
Kuby J. 1992. Immunology. W.H. Freeman and Company. Amerika Serikat. Halaman :1-20, 271-294, 457-486
Letvin NL, Montefiori DC, Yasutomi Y, Perry HC, Davies ME, Lekutis C, Alroy M, Freed DC, Lord CI, Hand LK, Liu MA dan Shiver JW. 1997. Potent, protective anti-HIV Immune Responses Generated by Bimodal HIV Envelope DNA Plus Protein Vaccination. Proc. Natl. Acad. Sci. USA (94): 9378-9383
Levinson W dan Jawetz E. 2000. Medical Microbiology and Immunology : Examination and Board Review, Sixth Edition. The McGraw-Hill Co. Amerika Serikat. Halaman : 271-277, 388
Lu S, Arthos J, Montefiori DC, Yasutami Y, Manson K, Mustafa F, Johnson E, Santoro JC, Wissink J, Mullins JI, Haynes JR, Lervin NL, Luyand M dan. Robinson HL. 1996. SIV DNA Vaccine Trial in Macaques. Journal of Virology. Vol.7 (6): 3978-3991
Mahy BWJ. 1997. A Dictionary of Virology. Second Edition. Academic Press. California, Amerika Serikat.
Mann DA. 1996. Molecular Biology of the Human Immunodeficiency Viruses. Di dalam: Lever AM (Ed.). The Molecular Biology of HIV/AIDS. John Wiley&Sons. Halaman :1-24
Napier JR dan Napier PH. 1985. The Natural History of the Primates. MIT Press. Great Britain. Halaman : 7-19, 128-130
Montefiori DC. 2001. HIV-Specific Neutralizing Antibodies. Di dalam :Pantaleo G dan
Walker BD. Retroviral Immunology, Immune Response and Restoration. Humana Press. New Jersey, Amerika Serikat. (8): 191-211