ABSTRACT
AMINAH. Application of Recombinant Giant Grouper Growth Hormone on Glass eelWith Different Immersion Dose. Supervised by Dr. Alimuddin and Dr. Odang Carman.
This research was conducted to determine the optimum dose of recombinant giant grouper growth hormone (rElGH) that generates highest growth of eel at glass eel stage via immersion. This research consisted of six treatments with three replications. The dose of rElGH used was 0 mg/L, 3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L, and control without rElGH. The rElGH was dissolved in 200 mL water containing NaCl 0,6% and bovine serum albumin 0,01%. A total of 50 fish were salinity shocked (NaCl 3%) for 2 minutes, and then immersed into 200 mL of rElGH solution for 2 hours. Fish were reared for 8 weeks, and fed on blood worm ad libitum. The results showed that 3 mg/L immersion treatment allowed the highest average of body weight, biomass, and survival rate. Biomass and survival rate of 3 mg/L rElGH- treated fish were respectively 28,0% and 15,2% higher than that of control. The average total body length of fish among treatments was similar. Thus, 3 mg/L of rElGH was an optimum immersion dose to improve growth in weight and survival of eel juvenile.
ABSTRAK
AMINAH. Aplikasi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Glass eel dengan Dosis Perendaman Berbeda. Dibimbing oleh Dr. Alimuddin dan Dr. Odang Carman.
Penelitian dilakukan untuk menentukan dosis optimum hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) yang menghasilkan pertumbuhan tertinggi pada ikan sidat stadia glass eel melalui metode perendaman. Penelitian ini menggunakan 6 perlakuan dengan 3 ulangan. Dosis rElHP yang diberikan, yaitu 0 mg/L, 3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L dan kontrol tanpa rElHP. rElHP dilarutkan dalam 200 mL air yang mengandung NaCl 0,6% dan serum albumin sapi 0,01%. Ikan sebanyak 50 ekor diberi kejutan salinitas (NaCl 3%) selama 2 menit, kemudian direndam dalam larutan rElHP selama 2 jam. Benih dipelihara selama 8 minggu dan diberi pakan berupa cacing sutera secara ad libitum. Hasil penelitian menunjukkan bahwa perlakuan perendaman 3 mg/L memberikan pertumbuhan bobot, biomassa, dan kelangsungan hidup tertinggi. Ikan perlakuan 3 mg/L memiliki biomassa sekitar 28,0% lebih tinggi, dan kelangsungan hidup sekitar 15,2% lebih tinggi dibandingkan dengan kontrol. Rerata panjang total tubuh ikan sidat antar perlakuan adalah tidak berbeda. Dengan demikian, perendaman rElHP dosis 3 mg/L adalah optimum dalam meningkatkan pertumbuhan bobot dan kelangsungan hidup benih ikan sidat.
I. PENDAHULUAN
1.1 Latar Belakang
Ikan sidat (Anguilla spp.) memiliki 19 spesies yang menyebar di seluruh dunia, dan tujuh di antaranya terdapat di perairan Indonesia (Ege, 1939 dalam Budimawan, 2007). Ikan sidat memiliki potensi yang sangat besar untuk dikembangkan karena banyak diminati oleh negara-negara maju seperti Jepang, Hongkong, Jerman, dan Italia. Selain itu, ikan ini memiliki harga jual yang cukup tinggi. Harga ikan sidat ukuran konsumsi >500 gram/ekor untuk jenis Anguilla bicolor pada pasar lokal rata-rata Rp.75.000,- s.d. 100.000/kg; jenis Anguilla marmorataRp. 125.000,- s.d. Rp. 175.000/kg (Suitha, 2008). Selain itu, ikan sidat memiliki rasa yang enak dan nilai nutrisi yang sangat baik untuk kesehatan manusia.
Permintaan terhadap ikan sidat terus meningkat. Di dunia, ikan sidat dikonsumsi sekitar 60.000 ton/tahun (Haryono, 2004). Hal ini mendorong berkembangnya kegiatan budidaya ikan sidat secara intensif. Namun demikian usaha tersebut masih bergantung pada ketersediaan benih (elver) dari alam (Wouthuyen et al., 2002). Selain itu, kendala yang dihadapi dalam kegiatan budidaya ikan sidat adalah pertumbuhan benih (glass eel) yang lambat dan rentan terhadap penyakit pada dua bulan awal pemeliharaan (Handoyo, 2012). Penyakit yang terjadi pada ikan sidat biasanya disebabkan oleh infeksi bakteri seperti Aeromonas hydrophila, Pseudomonas anguilliaseptica, dan Edwardsiella tarda atau disebabkan oleh jamur seperti Saprolegnia sp. (Tomiyama dan Hibiya, 1977). Menurut Suhenda et al. (2003), dalam budidaya ikan sidat ada tiga tahap yang perlu dilakukan, yaitu pemeliharaanelverselama 1,5 bulan (diperoleh benih ukuran 1-2 g), pemeliharaan pendederan (benih ukuran 1-2 g) selama 2-3 bulan untuk mencapai benih ukuran 10-20 g, dan pembesaran selama 7-9 bulan untuk mencapai ukuran konsumsi (150-200 g).
terhadap ikan sidat adalah teknologi rHP. Aplikasi metode seleksi membutuhkan waktu relatif lama untuk mencapai efek signifikan khususnya pada ikan yang mencapai matang kelamin pertama kali cukup lama (Bolivar et al., 2002). Aplikasi teknologi transgenesis dapat menghasilkan ikan dengan tingkat perbaikan kualitas tinggi dalam waktu relatif cepat, tetapi teknologi ini masih menimbulkan kontroversi terhadap keamanan pangan. Sementara itu, penggunaan rHP pada ikan dianggap aman untuk dikonsumsi karena rHP tidak ditransmisikan ke keturunan selanjutnya sehingga tidak termasuk ikan transgenik (Acostaet al., 2007). Penerapan teknologi hibridisasi, dan triploidisasi dapat dilakukan untuk ikan yang sudah dikuasai teknik pemijahan buatannya, sedangkan pemijahan buatan ikan sidat masih perlu diteliti. Teknologi rHP juga aplikatif untuk diterapkan oleh pembudidaya dengan perbaikan pertumbuhan yang relatif tinggi sebesar 17-75% dan mudah dilakukan untuk kegiatan produksi massal. Dengan demikian, pada penelitian ini digunakan teknologi rHP untuk meningkatkan pertumbuhan benih ikan sidat.
Efektivitas rHP bergantung pada spesies ikan uji, dosis, dan metode pemberian rHP. Pemberian rHP pada ikan dapat dilakukan dengan beberapa metode, yaitu penyuntikan/injeksi, perendaman, dan secara oral melalui pakan. Pemberian rHP pada ikan sidat dengan metode perendaman lebih mudah, lebih efektif, dan lebih aplikatif dibandingkan dengan metode injeksi dan pemberian melalui pakan. Pemberian rHP melalui teknik penyuntikan/injeksi kurang aplikatif jika diterapkan pada kegiatan produksi secara massal. Selain itu respon yang dihasilkan lambat, diduga karena reseptor memerlukan faktor intermediet atau waktu untuk mengenali rHP yang diinjeksikan (Promdonkoy et al., 2004). Perbandingan efektivitas metode pemberian rHP melalui pakan dan perendaman dapat dilihat dari hasil penelitian yang dilakukan oleh Rahmawaty (2011) dan Putra (2010). Pemberian rHP melalui pakan telah diuji oleh Rahmawaty (2011) pada ikan gurame menggunakan rHP ikan mas. Hasil yang diperoleh menunjukkan peningkatan bobot sebesar 13% dari perlakuan kontrol. Uji ikan yang sama dilakukan oleh Putra (2010) dengan teknik perendaman menggunakan rHP ikan gurame, hasilnya menunjukkan peningkatan 75,04 % dengan dosis 30 mg/L dibandingkan dengan kontrol.
Hasil penelitian pendahuluan yang dilakukan oleh Handoyo (2012), diketahui bahwa kisaran dosis rElHP pada benih ikan sidat yang menghasilkan pertumbuhan lebih tinggi daripada kontrol adalah antara 1,2 s.d 12,0 mg/L. Kisaran dosis tersebut masih relatif besar, dan diduga di antara kisaran dosis tersebut dapat menghasilkan pertumbuhan lebih baik. Oleh karena itu, pada penelitian ini dilakukan perendamanglass eeldalam larutan rElHP dosis 0, 3, 6, 9 dan 12 mg/L.
1.2 Tujuan
II. BAHAN DAN METODE
2.1 Rancangan Perlakuan
Penelitian ini terdiri dari enam perlakuan yang masing-masing diberi 3 kali ulangan. Perlakuan yang diberikan berupa perendaman dengan dosis rElHP berbeda yaitu 0, 3, 6, 9, dan 12 mg/L dalam larutan NaCl 0,6% yang ditambah serum albumin sapi (BSA) 0,01%, dan kontrol yang direndam dalam larutan NaCl 0,6% tanpa BSA dan rElHP. Penelitian menggunakan rancangan acak lengkap (Tabel 1). Benih ikan sidat yang digunakan yaitu stadia glass eelyang diperoleh dari pengumpul di Pelabuhan Ratu, Jawa Barat.
Tabel 1. Rancangan perlakuan
phosphate saline (BFS) sebanyak 1 kali, kemudian disimpan di deep-freezer (-80oC) hingga akan digunakan.
Pelet bakteri hasil sentrifugasi dicuci menggunakan bufer tris-EDTA(TE) sebanyak 1 mL per 200 mg bakteri, diinkubasi pada suhu 37oC selama 20 menit dan kemudian disentrifugasi pada suhu 4oC dengan kecepatan 12.000 rpm selama 2 menit. Supernatan dibuang, dan ke dalam tabung berisi pelet bakteri dimasukkan 500 µL larutan lisozim (10 mg dalam 1 mL bufer TE) untuk melisis dinding bakteri. Proses dilakukan selama 20 menit pada 37oC, lalu disentrifugasi pada 12.000 rpm selama 15 menit. Supernatan dibuang, dan endapan yang terbentuk merupakan pelet protein rHP dalam bentuk badan inklusi (inclusion body). Pelet protein rHP dicuci dengan BFS sebanyak 1 mL, pencucian dilakukan sebanyak 2 kali. Setelah selesai, protein di simpan dalamdeep-freezerhingga akan digunakan.
2.3 Perendaman Ikan dalam Larutan rHP
Bobot dan panjang totalglass eelikan sidat sebanyak 50 ekor diukur untuk masing-masing ulangan perlakuan sebagai data awal. Benih ikan direndam dalam media larutan NaCl 3% selama 2 menit (shock salinitas), setelah itu dipindahkan ke larutan NaCl 0,6% yang telah diberi campuran rHP dan BSA sesuai dosis perlakuan (Tabel 1). Ikan direndam dalam larutan rHP volume 200 mL selama 2 jam (Handoyo, 2012). Ikan yang sudah selesai direndam kemudian dipindahkan ke akuarium yang berukuran 20 x 30 x 20 cm3 dengan volume air sebanyak 7 liter. Pemeliharaan dilakukan selama 8 minggu. Pengukuran biomassa ikan tiap perlakuan dilakukan setiap 2 minggu sekali.
2.4 Analisis Proksimat
Analisis proksimat dilakukan di Laboratorium Nutrisi, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat (kadar protein, kadar lemak, kadar abu, kadar air, serat kasar, dan BETN) dilakukan pada kontrol dan perlakuan terbaik. Pengujian parameter ini ditujukan untuk menguji pengaruh penggunaan rHP terhadap kandungan gizi (kadar protein, kadar lemak, kadar air, kadar abu, serat kasar, dan BETN) pada ikan sidat. Rumus perhitungan kandungan proksimat daging dilampirkan pada Lampiran 1.
2.4.1 Kadar Air
Prinsip kerja analisis kadar air adalah menguapkan air yang terdapat dalam bahan menggunakan oven 100o-105oC dalam jangka waktu tertentu hingga penyusutan berat badan tidak berubah lagi. Pertama, botol dikeringkan dalam oven selama 1 jam pada suhu 105oC. Lalu didinginkan dalam eksikator dan ditimbang bobotnya (x). Sampel sebanyak 5 g (y) dimasukkan ke dalam oven 1050C selama 4-6 jam, lalu didinginkan lagi dalam eksikator dan ditimbang. Langkah ini dilakukan 3 kali hingga berat kering bahan konstan (z).
2.4.2 Kadar Abu
2.4.3 Kadar Protein
Prinsip pengukuran kadar protein adalah pengukuran kadar nitrogen bahan dengan metode Kjeldahl melalui 3 tahap yaitu destruksi, destilasi, dan titrasi. Pada tahap destruksi, 0,3 g bahan dimasukkan ke dalam labu destruksi dan ditambahkan sekitar 3 sendok katalis campuran dan 20 mL H2SO4 pekat teknis secara homogen. Kemudian campuran tersebut dipanaskan pada alat destruksi dengan posisi low selama 10 menit, medium 5 menit dan high sampai larutan menjadi jernih dan berwarna kehijauan. Tahap kedua yaitu destilasi, labu destruksi didinginkan dan dimasukkan ke dalam labu penyuling dan diencerkan dengan 300 mL akuades. Ke dalam larutan ditambahkan batu didih dan larutan NaOH 22% 100 mL, kemudian labu penyuling dipasang dengan cepat di atas alat penyuling. Proses penyulingan berlangsung sampai 2/3 cairan dalam labu penyuling telah menguap. Tahap ke tiga yaitu titrasi, hasil penyulingan dalam labu erlemeyer dititrasi dengan larutan NaOH 1,3 N sampai larutan tersebut berwarna biru kehijauan. Volume NaOH dicatat (z mL) dan dibandingkan dengan blanko (y mL).
2.4.4 Kadar Lemak
2.4.5 Serat Kasar
Sampel bahan sebanyak 1 gram (x) dimasukkan ke dalam gelas piala 500 mL dan ditambahkan 50 mL H2SO4 0,3 N, lalu dipanaskan selama 30 menit hingga mendidih. Setelah itu, ditambahkan 25 ml NaOH 1,5 N, dan terus dididihkan kembali selama 30 menit kedua. Kemudian cairan tersebut disaring dengan kertas saring yang sudah ditimbang (a) menggunakan corong Bucher. Proses penyaringan berturut-turut dilakukan dengan menggunakan 50 mL air panas, 50 mL H2SO4 0,3 N, 50 mL air panas, 25 mL Aceton. Kertas saring dan isinya dipindahkan ke cawan porselen dan dikeringkan dalam oven pada suhu 105oC kemudian didinginkan dalam eksikator selama 1 jam dan ditimbang (y). Setelah itu kertas saring dan isinya dipijarkan dalam tanur sampai putih dan ditimbang (z).
2.5 Analisis Statistik
III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Pertumbuhan Bobot, Panjang, dan Biomassa
Peningkatan bobot rerata dan biomassa ikan sidat yang diberi perlakuan perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) lebih tinggi dibandingkan dengan perlakuan kontrol. Nilai bobot rerata dan biomassa ikan sidat ditampilkan pada Tabel 2.
Tabel 2. Bobot rerata, laju pertumbuhan spesifik (SGR), pertumbuhan panjang (PP), dan biomassa, ikan sidat kontrol dan ikan sidat yang diberi perlakuan dan 12 = 12 mg/L direndam dalam larutan 0,6% yang ditambah BSA 0,01%
Berdasarkan Tabel 2, ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis 3 mg/L menunjukkan nilai bobot rerata tertinggi (0,682 g) dibandingkan dengan perlakuan lainnya (0 mg/L: 0,577 g, 6 mg/L: 0,612 g, 9 mg/L: 0,531 g, 12 mg/L: 0,553 g) dan kontrol (0,614 g,). Sama halnya dengan nilai pertumbuhan bobot, nilai biomassa tertinggi ditunjukkan oleh ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis 3 mg/L (biomassa: 20,707 g) dan yang terkecil ditunjukkan oleh ikan perlakuan 0 mg/L dengan nilai biomassa 7,810 g. Peningkatan biomassa ikan sidat perlakuan rElHP 3 mg/L adalah sekitar 28% dibandingkan dengan kontrol. Hal ini menunjukkan bahwa penggunaan rHP dengan metode perendaman mampu meningkatkan pertumbuhan ikan sidat.
(3,043%), 6 mg/L (2,781%), 9 mg/L (2,652%) menunjukkan nilai yang lebih tinggi dibandingkan dengan perlakuan 0 mg/L (2,587%), sedangkan rElHP dengan dosis 12 mg/L (2,558%) menunjukkan nilai SGR yang lebih kecil dibandingkan dengan dosis 0 mg/L.
Pertumbuhan panjang ikan menunjukkan nilai yang tidak berbanding lurus dengan bobot rerata ikan. Berdasarkan Tabel 2, bobot rerata terbesar ditunjukkan oleh ikan sidat dengan perlakuan 3 mg/L (bobot rerata: 0,682 g, PP: 7,517 cm), namun untuk pertumbuhan panjang tertinggi (Tabel 2) ditunjukkan oleh ikan sidat dengan perlakuan 0 mg/L (PP: 7,550 cm, bobot rerata: 0,577 g).
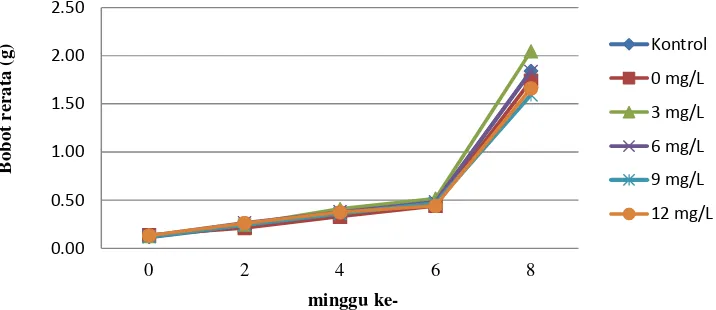
Gambar 1. Pertumbuhan bobot rerata ikan sidat kontrol dan yang telah direndam dalam larutan rHP ikan kerapu kertang, yang dipelihara selama 8 minggu.
Pada Gambar 1 terlihat bahwa bobot rerata ikan sidat untuk semua perlakuan terus meningkat setiap dua minggu sampai akhir pemeliharaan. Namun demikian, pertumbuhan yang signifikan terjadi pada minggu keenam sampai minggu kedelapan dengan bobot rerata 0,50 g meningkat menjadi 1,50-2,00 g, sedangkan pada minggu-minggu sebelumnya penambahan bobot rerata ikan kurang dari 0,50 g.
0 2 4 6 8
B
o
bo
t
re
ra
ta
(
g
)
ke-3.1.2 Kelangsungan Hidup Ikan (SR)
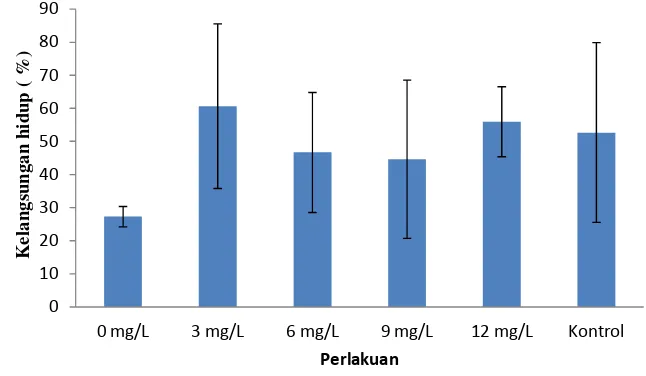
Perbandingan kelangsungan hidup ikan sidat kontrol dengan ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis berbeda (0, 3, 6, 9, 12 mg/L) ditampilkan pada Gambar 2.
Tingkat kelangsungan hidup ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis berbeda ( 3, 6, 9, dan 12 mg/L) menunjukkan tingkat kelangsungan hidup (SR) yang lebih tinggi (rerata >40%) dibandingkan dengan dosis 0 mg/L (27,33%). Nilai SR ikan pada perlakuan perendaman rElHP dengan dosis 3 mg/L (60,67%) dan 12 mg/L (56%) lebih tinggi dibandingkan dengan kontrol (52,67%). Nilai SR tertinggi ditunjukkan oleh ikan sidat dengan perlakuan perendaman rElHP dengan dosis 3 mg/L.
Gambar 2. Tingkat kelangsungan hidup ikan sidat kontrol dan yang direndam dalam larutan rHP ikan kerapu kertang, yang dipelihara selama 8 minggu
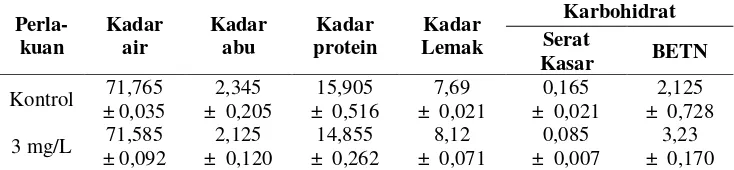
3.1.3 Proksimat Ikan Sidat
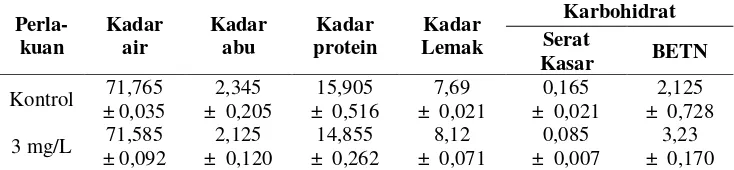
Kandungan gizi (kadar protein, kadar lemak, karbohidrat, kadar abu, serat kasar, dan BETN) ikan sidat ditampilkan pada Tabel 3. Penggunaan rHP pada ikan sidat dapat menurunkan kadar air, kadar abu, protein, dan serat kasar ikan, sedangkan kadar lemak dan nilai BETN meningkat. Penggunaan rHP pada ikan sidat menunjukkan penurunan kandungan serat kasar sebesar 50% dibandingkan
dengan ikan kontrol (K: 0,17%, 3 mg/L: 0,085%), dan peningkatan BETN sebesar 52% dari ikan kontrol (K: 2,13%, 3 mg/L: 3,23%).
Tabel 3. Kandungan proksimat ikan perlakuan rElHP terbaik (3 mg/L) dan kontrol
Perla-Keterangan : Analisis proksimat dilakukan di laboratorium Nutrisi departemen BDP,FPIK,IPB. Sampel yang digunakan 10 g untuk masing-masing analisis.
3.2 Pembahasan
akibat infeksi bakteri ini bervariasi, tetapi umumnya ditandai oleh adanya
hemoragik pada kulit, insang, rongga mulut, dan borok pada kulit. Infeksi oleh
bakteri A. hydrophila terjadi melalui permukaan badan yang luka, saluran
pencernaan makanan atau melalui insang. Kemudian bakteri masuk dalam
pembuluh darah dan menyebar pada organ dalam lain yang menyebabkan
pendarahan yang disertai haemorrhagic septicaemia (Kabata, 1985 dalam
Gardeniaet al., 2010).
Gambar 3. Benih ikan sidat yang terkena Aeromonas hydrophila dengan gejala hemoragik pada sirip ekor.
langsung terhadap kelangsungan hidup, pertumbuhan, tingkah laku, kesehatan, dan kualitas air. Jika hasil penelitian ini dibandingkan dengan penelitian pendahuluan Handoyo, diketahui bahwa penggunaan dosis rElHP 3 mg/L menunjukkan peningkatan pertumbuhan yang tidak berbeda jauh dengan dosis 12 mg/L yang dilakukan oleh Handoyo. Dengan demikian, diantara 1,2 sampai 12 mg/L dosis rElHP yang diujicobakan oleh Handoyo terdapat dosis yang lebih efektif untuk digunakan yaitu dosis rElHP 3 mg/L.
Peningkatan pertumbuhan pada penelitian ini (28%) dapat dicapai dalam 3 generasi dengan metode seleksi. Hasil tersebut menunjukkan bahwa pemberian rHP dengan metode perendaman dapat meningkatkan pertumbuhan lebih cepat dibandingkan dengan metode seleksi yang meningkatkan pertumbuhan hanya 10% per generasi. Aplikasi metode seleksi membutuhkan waktu 10 tahun untuk menghasilkan 12 generasi dengan kecepatan tumbuh 12,4% per generasi pada ikan nila (Bolivaret al., 2002).
Kontrol rElHP dosis 3 mg/L
Gambar 4. Perbandingan ukuran ikan sidat kontrol dengan perlakuan terbaik (dosis perendaman: 3mg/L) pada akhir pemeliharaan selama 8 minggu.
gurame dengan dosis 20 mg/L dan 30 mg/L berhasil meningkatkan pertumbuhan masing-masing 63,95% dan 75,04% lebih tinggi dibandingkan dengan kontrol. Perbedaan hasil tersebut diduga karena perbedaan jenis rHP dan ikan uji yang digunakan. Pada penelitian Putra (2010) rHP yang digunakan yaitu rHP ikan gurame yang diujicobakan kepada ikan gurame, sedangkan pada penelitian ini digunakan rHP ikan kerapu kertang yang diujicobakan kepada ikan sidat. Penggunaan jenis rHP yang merupakan hasil transformasi gen GH dari ikan uji itu sendiri diduga akan menghasilkan pertumbuhan yang lebih besar dibandingkan dengan penggunaan rHP yang berbeda dengan ikan uji. Organ atau jaringan dalam tubuh ikan memiliki reseptor hormon pertumbuhan yang akan mengenali rHP yang diberikan dan kemudian disampaikan ke sel-sel tubuh sehingga terjadi proses pertumbuhan. Kecocokan antara reseptor dan jenis rHP yang digunakan akan mempengaruhi proses pertumbuhan yang akan terjadi. Hal yang sama disampaikan oleh Birzniece et al. (2009) yang menyatakan bahwa perbedaan pengaruh pertumbuhan dikarenakan tidak cocoknya jenis rHP yang diberikan terhadap reseptor hormon pertumbuhan yang terdapat di dalam tubuh ikan target.
Acosta et al. (2009) menyatakan bahwa pemberian rHP pada larva dapat meningkatkan kelangsungan hidup dan meningkatkan daya tahan terhadap stress dan infeksi penyakit. Penggunaan rHP melalui teknik perendaman menunjukkan tingkat kelangsungan hidup yang lebih tinggi dibandingkan dengan perlakuan dosis 0 mg/L. SR benih ikan sidat yang diberi perlakuan rHP dengan dosis 3 mg/L lebih tinggi 15,2% dibandingkan dengan kontrol dan 121,99% lebih tinggi dibandingkan dengan dosis 0 mg/L. Benih ikan sidat yang diberi dosis 1,2 s.d 12 mg/L pada penelitian pendahuluan Handoyo menunjukkan SR yang tinggi, lebih dari 90%. Pada penelitian ini, dosis yang digunakan berada pada kisaran dosis yang diujicobakan oleh Handoyo. Namun SR yang diperoleh lebih rendah, perlakuan terbaik (3 mg/L) menunjukkan nilai SR yang tidak begitu tinggi yaitu hanya 60,67%. Perbedaan nilai SR yang diperoleh disebabkan padat penebaran dan ukuran wadah/ akuarium yang digunakan berbeda sehingga daya dukung air untuk benih juga berbeda.
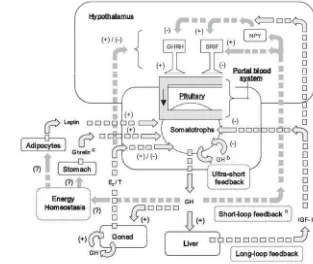
berlebih diduga dapat memberikan feedback negatif bagi pertumbuhan ikan. Wong et al. (2006) menyatakan tentang pengaturan feedback hormon pertumbuhan pada mamalia. Dalam pituitari mamalia, pelepasan hormon pertumbuhan/ Growth Hormon (GH) di somatotrop dikontrol oleh GHRH dan SRIF di mana kedua regulator tersebut dirilis oleh hipotalamus dan akan disampaikan ke pituitari anterior melalui sistem peredaran darah. GH yang dirilis dari pituitari dapat memberikan feedback negatif pada somatotrop melalui tiga jalur. Pertama, long-loop feedback yang merupakan akibat tidak langsung dari aktifitas IGF-I yang diproduksi oleh hati. Kedua, short-loop feedback yang merupakan akibat langsung dari aktifitas GH di hipotalamus. Ketiga, ultra-short feedbackyang merupakan akibat langsung dari aktivitas GH yang berada di dalam pituitari (Gambar 5). Jumlah GH atau IGF-I yang berlebih dalam pembuluh darah akan menimbulkanFeedback negatif atau umpan balik negatif tersebut dan akan memberikan impuls pada kelenjar pituitari untuk tidak mensekresikan GH.
Gambar 5. Pengaturanfeedbackhormon pertumbuhan pada mamalia
rendah dibandingkan dengan kontrol yang tidak diberi rHP dan BSA (0,614 g). Pemberian BSA tanpa diiringi pemberian rHP diduga akan berakibat tidak baik bagi pertumbuhan ikan. Hasil yang sama juga diperoleh pada penelitian Ratnawati (2012). Ikan gurame diberi perlakuan perendaman (tanpa NaCl 0,9%) dalam larutan BSA+rHP (24 mg/200 ml) dengan waktu perendaman 3 (A), 2 (B), 1 (C), dan 0,5 (D) jam serta perlakuan perendaman dalam lartutan BSA+ NaCl 0,9% tanpa rHP sebagai kontrol (E) dan perendaman dalam larutan BSA+rHP+NaCl 0,9% (F). Benih ikan gurame perlakuan kontrol dengan lama perendaman 1 jam (E) menghasilkan bobot rerata yang lebih kecil (1,93 g ) dibandingkan dengan perlakuan lainnya (A: 2,30 g, B: 2,22 g, C: 2,30 g, D: 2,54 g, dan E: 2,25 g).
menunjukkan pertumbuhan yang signifikan setelah minggu ke-14 dan 16. Pada uji yang ketiga, benih disuntik rbGH dengan dosis 100 atau 1000 µg. Pertumbuhan bobot yang signifikan terjadi setelah minggu ke-2 dan respon ini akan terus meningkat setelah itu. Pertumbuhan yang signifikan dihasilkan pada waktu yang berbeda-beda. Menurut Promdonkoy et al. (2004), respons yang lambat terjadi dikarenakan reseptor membutuhkan waktu atau faktor intermediet untuk mengenali rHP yang diinjeksikan/diberikan.
Pada penelitian ini selain parameter pertumbuhan, diamati juga kandungan proksimat daging ikan untuk mengetahui ada atau tidaknya pengaruh pemberian rHP pada kandungan proksimat daging benih ikan sidat. Hasil analisis proksimat menunjukkan bahwa ikan yang diberi perlakuan perendaman rHP dengan dosis 3 mg/L menunjukkan nilai kadar protein yang menurun sebesar 6,6% dari kontrol (15,91% menjadi 14,86%) dan peningkatan kadar lemak sebesar 5,6% dari kontrol (7,69% menjadi 8,12%). Penurunan kadar protein ikan yang diberi perlakuan diduga karena banyaknya protein yang dikonversi menjadi energi akibat perilaku ikan yang lebih agresif dan nafsu makan yang meningkat, sehingga sedikit protein yang digunakan untuk pertumbuhan. Ikan yang lebih agresif melakukan lebih banyak gerakan. Dengan demikian ikan lebih banyak mengeluarkan energi dibandingkan dengan ikan kontrol. Protein merupakan sumber energi utama bagi ikan, protein dalam pakan diharapkan dapat digunakan secara optimum untuk pertumbuhan (Hariyadi et al., 2005). Namun hasil yang berbeda dilaporkan oleh Chatakondiet al. (1995) yang melakukan perbandingan kandungan nutrisi tubuh pada ikan mas transgenik yang mengekspresikan gen hormon pertumbuhan ikan rainbow trout dengan yang bukan transgenik. Kandungan protein ikan transgenik meningkat 7,5% dan kandungan lemaknya menurun 13%. Penyebab perbedaan hasil dan mekanisme regulasi hormon pada ikan sidat yang diberi perlakuan rHP perlu dikaji lebih lanjut.
lemaknya lebih banyak. Oleh karena itu kadar lemak dosis 3 mg/L lebih tinggi dibandingkan dengan kontrol.
Ikan sidat yang diberi perlakuan perendaman menggunakan rHP menunjukkan adanya peningkatan nafsu makan. Pada saat pemberian pakan, ikan yang diberi perlakuan perendaman rHP menunjukkan perilaku yang lebih agresif dibandingkan dengan ikan kontrol. Pengamatan terhadap perilaku dan pola makan ikan dilakukan secara visual (kuantitatif) setiap hari. Hal yang sama juga disampaikan oleh Promkondoy et al. (2004), ikan mas koki yang diberi gcGH menunjukkan peningkatan nafsu makan dan tingkah laku makan yang lebih agresif dan lebih enerjik terhadap pakan yang diberikan. Peningkatan nafsu makan juga ditunjukkan oleh ikan gurame yang diberi perlakuan perendaman rOgHP pada penelitian Putra (2010).
Mekanisme penyerapan/masuknya rHP ke dalam tubuh ikan belum diketahui secara pasti. Smith (1982) dalam Moriyama & Kawauchi (1990), mendemonsrasikanradiolabeled-BSA dapat masuk ke insang dan epidermis ikan rainbow trout setelah perendaman dalam larutan dan diduga bahwa sel insang memungkinkan digunakan sebagai jalur masuk. Berdasarkan uraian tersebut, mekanisme masuknya rHP dengan metode perendaman juga diduga melalui insang secara osmoregulasi. Menurut Smith (1982) dalam Setyo (2006), untuk menjaga keseimbangan konsentrasi osmotik antara cairan intrasel dan ektrasel maka ikan atau udang melakukan proses osmoregulasi. Beberapa organ yang berperan dalam proses osmoregulasi ikan antara lain: insang, ginjal, dan usus.
dalam larutan NaCl 3% maka kondisinya menjadi terbalik, sel pada tubuh ikan sidat bersifat hipotonik (tekanan osmotik dalam tubuh ikan lebih rendah dibandingkan dengan di luar tubuh). Perubahan kadar salinitas akan mempengaruhi tekanan osmotik cairan tubuh ikan, sehingga ikan akan melakukan penyesuaian dengan melakukan pengaturan kerja osmotik agar proses fisiologis dalam tubuhnya dapat bekerja secara normal kembali. Maka pada kondisi tersebut akan terjadi proses osmoregulasi dimana cairan dari luar tubuh akan masuk ke dalam tubuh ikan, diduga rHP masuk ke dalam tubuh ikan pada proses osmoregulasi tersebut.
IV. KESIMPULAN
APLIKASI HORMON PERTUMBUHAN REKOMBINAN IKAN
KERAPU KERTANG PADA
GLASS EEL
DENGAN DOSIS
PERENDAMAN BERBEDA
AMINAH
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
APLIKASI HORMON PERTUMBUHAN REKOMBINAN IKAN
KERAPU KERTANG PADA
GLASS EEL
DENGAN DOSIS
PERENDAMAN BERBEDA
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Mei 2012
ABSTRAK
AMINAH. Aplikasi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang pada Glass eel dengan Dosis Perendaman Berbeda. Dibimbing oleh Dr. Alimuddin dan Dr. Odang Carman.
Penelitian dilakukan untuk menentukan dosis optimum hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) yang menghasilkan pertumbuhan tertinggi pada ikan sidat stadia glass eel melalui metode perendaman. Penelitian ini menggunakan 6 perlakuan dengan 3 ulangan. Dosis rElHP yang diberikan, yaitu 0 mg/L, 3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L dan kontrol tanpa rElHP. rElHP dilarutkan dalam 200 mL air yang mengandung NaCl 0,6% dan serum albumin sapi 0,01%. Ikan sebanyak 50 ekor diberi kejutan salinitas (NaCl 3%) selama 2 menit, kemudian direndam dalam larutan rElHP selama 2 jam. Benih dipelihara selama 8 minggu dan diberi pakan berupa cacing sutera secara ad libitum. Hasil penelitian menunjukkan bahwa perlakuan perendaman 3 mg/L memberikan pertumbuhan bobot, biomassa, dan kelangsungan hidup tertinggi. Ikan perlakuan 3 mg/L memiliki biomassa sekitar 28,0% lebih tinggi, dan kelangsungan hidup sekitar 15,2% lebih tinggi dibandingkan dengan kontrol. Rerata panjang total tubuh ikan sidat antar perlakuan adalah tidak berbeda. Dengan demikian, perendaman rElHP dosis 3 mg/L adalah optimum dalam meningkatkan pertumbuhan bobot dan kelangsungan hidup benih ikan sidat.
ABSTRACT
AMINAH. Application of Recombinant Giant Grouper Growth Hormone on Glass eelWith Different Immersion Dose. Supervised by Dr. Alimuddin and Dr. Odang Carman.
This research was conducted to determine the optimum dose of recombinant giant grouper growth hormone (rElGH) that generates highest growth of eel at glass eel stage via immersion. This research consisted of six treatments with three replications. The dose of rElGH used was 0 mg/L, 3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L, and control without rElGH. The rElGH was dissolved in 200 mL water containing NaCl 0,6% and bovine serum albumin 0,01%. A total of 50 fish were salinity shocked (NaCl 3%) for 2 minutes, and then immersed into 200 mL of rElGH solution for 2 hours. Fish were reared for 8 weeks, and fed on blood worm ad libitum. The results showed that 3 mg/L immersion treatment allowed the highest average of body weight, biomass, and survival rate. Biomass and survival rate of 3 mg/L rElGH- treated fish were respectively 28,0% and 15,2% higher than that of control. The average total body length of fish among treatments was similar. Thus, 3 mg/L of rElGH was an optimum immersion dose to improve growth in weight and survival of eel juvenile.
APLIKASI HORMON PERTUMBUHAN REKOMBINAN IKAN
KERAPU KERTANG PADA
GLASS EEL
DENGAN DOSIS
PERENDAMAN BERBEDA
AMINAH
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi & Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul : Aplikasi Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang (rElHP) padaGlass eeldengan Dosis Perendaman Berbeda
Nama : Aminah
Nrp : C14080050
Menyetujui,
Pembimbing I Pembimbing II
Dr. Alimuddin Dr. Odang Carman
NIP. 19700103 199512 1 001 NIP. 19591222 198601 1 001
Mengetahui,
Ketua Departemen Budidaya Perairan
Dr. Odang Carman NIP. 19591222 198601 1 001
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya tulis ini. Penelitian ini dilaksanakan pada bulan Desember 2011- Februari 2012 di Laboratorium Reproduksi dan Genetika Organisme Akuatik. Ungkapan kebahagiaan dan terima kasih yang tulus penulis utarakan kepada:
1. Orang tua tercinta, Muhammad Nuh Lubis dan Hasna Rangkuti yang selalu mencurahkan kasih sayangnya, do’a dan dukungan yang tiada henti. Serta adik-adikku tersayang yang senantiasa memberikan semangatnya
2. Dr. Alimuddin selaku Pembimbing I dan Dr. Odang Carman selaku Pembimbing II, atas segala masukan dan dukungannya selama pelaksanaan penelitian dan penyusunan tugas akhir ini
3. Dr. Nur Bambang PU, selaku Dosen Penguji pada pelaksanaan Ujian Akhir Skripsi
4. Dr. Tatag Budiardi, selaku dosen Pembimbing Akademik
5. Anna Octavera, S.Pi. M.Si., Pustika Ratnawati, S.Pi., dan Ika Rahmawaty S.Pi yang telah banyak membantu dan membimbing dalam penelitian dan penyusunan serta penulisan skripsi ini
6. Mas Boyun Handoyo, Ibu Eni, Ibu Yulintine, Ibu Irma, Bang Safir, dan mahasiswa S2/S3 Ilmu Akuakultur lainnya yang telah banyak memberikan informasi
7. Teman-teman seperjuangan: Ipha, Sri, Rima, Hikma, Dita, Iday, Daus, Fajar yang telah banyak membantu dan memberi semangat
8. Sahabat-sahabat terdekat: Melati, Widayati P, Nidya M, Annisa M, Amalia GP, dan Erriza A. atas do’a, motivasi, dukungan dan persahabatan selama ini 9. Seandy Firmansyah, S.Ik. yang tiada lelah memberikan dorongan dan
semangatnya dalam penyelesaian skripsi ini
10. Seluruh sahabat seperjuangan BDP’45, beribu kenangan yang takkan terlupakan bersama kalian
Semoga skripsi ini bermanfaat bagi ilmu pengetahuan dan masyarakat. Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 22 November 1990. Penulis adalah anak pertama dari lima bersaudara, dari pasangan Muhammad Nuh Lubis dan Hasna Rangkuti. Penulis mengawali pendidikan di SDN 17 Pagi Jakarta Selatan pada tahun 1996-1998, kemudian pindah ke SDN Kedung Halang III pada tahun 1998-2002. Melanjutkan pendidikan di SMP Negeri 8 Bogor pada tahun 2002-2005 dan SMA Negeri 2 Bogor pada tahun 2005-2008.
Pada tahun 2008, penulis diterima di Institut Pertanian Bogor (IPB) sebagai mahasiswa Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama mengikuti perkuliahan, penulis merupakan mahasiswi yang aktif. Penulis aktif sebagai pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) periode 2010-2011. Selain itu penulis juga aktif sebagai asisten praktikum Mata Kuliah Dasar-dasar Akuakultur pada periode 2010 dan periode 2011, dan asisten praktikum Mata Kuliah Dasar-dasar Genetika Ikan pada periode 2010-2011 dan 2011-2012. Penulis juga menerima beasiswa program “SKSS” dari BAZNAS pada tahun 2009-2012.
DAFTAR ISI
Halaman DAFTAR TABEL... ii DAFTAR GAMBAR... iii DAFTAR LAMPIRAN... iv
I. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Tujuan... 3 II. BAHAN DAN METODE... 4 2.1. Rancangan Perlakuan ... 4 2.2. Produksi Hormon Pertumbuhan Rekombinan ... 4 2.3. Perendaman Ikan dalam Larutan rHP ... 5 2.4. Analisis Proksimat ... 6 2.4.1. Kadar Air... 6 2.4.2. Kadar Abu ... 6 2.4.3. Kadar Protein ... 7 2.4.4. Kadar Lemak ... 7 2.4.5. Serat Kasar ... 8 2.5. Analisis Statistik ... 8 III. HASIL DAN PEMBAHASAN... 9
3.1. Hasil
DAFTAR TABEL
Halaman
1. Rancangan Perlakuan ... 4 2. Bobot rata-rata, laju pertumbuhan spesifik (SGR), pertumbuhan panjang
DAFTAR GAMBAR
Halaman
1. Pertumbuhan bobot rerata ikan sidat kontrol, dan yang telah direndam dalam larutan rHP ikan kerapu kertang, dan dipelihara selama 8 minggu.. ... 10 2. Tingkat kelangsungan hidup ikan sidat kontrol dan yang direndam
dalam larutan rHP ikan kerapu kertang, dan ikan dipelihara selama 8 minggu ... 11 3. Benih ikan sidat yang terkena Aeromonas hydrophila dengan gejala
hemoragik pada sirip ekor. ... 13 4. Perbandingan ukuran ikan sidat kontrol dengan perlakuan terbaik (dosis
perendaman: 3 mg/L) pada akhir pemeliharaan selama 8 minggu ... 14 5. Pengaturanfeedbackhormon pertumbuhan pada mamalia ... 16
DAFTAR LAMPIRAN
Halaman
1 Perhitungan Analisis Proksimat ... 27 1.1 Perhitungan Kadar Air ... 27 1.2 Perhitungan Kadar Abu... 27 1.3 Perhitungan Kadar Protein ... 27 1.4 Perhitungan Kadar Lemak... 27 1.5 Perhitungan Serat Kasar... 27 1.6 Perhitungan BETN (Berat Ekstrak Tanpa Nitrogen) ... 28 2. Parameter Uji ... 29 2.1 Laju Pertumbuhan Spesifik...29 2.2 Pertumbuhan Panjang ...29 2.3 Tingkat Kelangsungan Hidup ...29 2.4 Biomassa ...29 3.Data Pertumbuhan dan Kelangsungan Hidup Benih Ikan Sidat yang Diberi
I. PENDAHULUAN
1.1 Latar Belakang
Ikan sidat (Anguilla spp.) memiliki 19 spesies yang menyebar di seluruh dunia, dan tujuh di antaranya terdapat di perairan Indonesia (Ege, 1939 dalam Budimawan, 2007). Ikan sidat memiliki potensi yang sangat besar untuk dikembangkan karena banyak diminati oleh negara-negara maju seperti Jepang, Hongkong, Jerman, dan Italia. Selain itu, ikan ini memiliki harga jual yang cukup tinggi. Harga ikan sidat ukuran konsumsi >500 gram/ekor untuk jenis Anguilla bicolor pada pasar lokal rata-rata Rp.75.000,- s.d. 100.000/kg; jenis Anguilla marmorataRp. 125.000,- s.d. Rp. 175.000/kg (Suitha, 2008). Selain itu, ikan sidat memiliki rasa yang enak dan nilai nutrisi yang sangat baik untuk kesehatan manusia.
Permintaan terhadap ikan sidat terus meningkat. Di dunia, ikan sidat dikonsumsi sekitar 60.000 ton/tahun (Haryono, 2004). Hal ini mendorong berkembangnya kegiatan budidaya ikan sidat secara intensif. Namun demikian usaha tersebut masih bergantung pada ketersediaan benih (elver) dari alam (Wouthuyen et al., 2002). Selain itu, kendala yang dihadapi dalam kegiatan budidaya ikan sidat adalah pertumbuhan benih (glass eel) yang lambat dan rentan terhadap penyakit pada dua bulan awal pemeliharaan (Handoyo, 2012). Penyakit yang terjadi pada ikan sidat biasanya disebabkan oleh infeksi bakteri seperti Aeromonas hydrophila, Pseudomonas anguilliaseptica, dan Edwardsiella tarda atau disebabkan oleh jamur seperti Saprolegnia sp. (Tomiyama dan Hibiya, 1977). Menurut Suhenda et al. (2003), dalam budidaya ikan sidat ada tiga tahap yang perlu dilakukan, yaitu pemeliharaanelverselama 1,5 bulan (diperoleh benih ukuran 1-2 g), pemeliharaan pendederan (benih ukuran 1-2 g) selama 2-3 bulan untuk mencapai benih ukuran 10-20 g, dan pembesaran selama 7-9 bulan untuk mencapai ukuran konsumsi (150-200 g).
terhadap ikan sidat adalah teknologi rHP. Aplikasi metode seleksi membutuhkan waktu relatif lama untuk mencapai efek signifikan khususnya pada ikan yang mencapai matang kelamin pertama kali cukup lama (Bolivar et al., 2002). Aplikasi teknologi transgenesis dapat menghasilkan ikan dengan tingkat perbaikan kualitas tinggi dalam waktu relatif cepat, tetapi teknologi ini masih menimbulkan kontroversi terhadap keamanan pangan. Sementara itu, penggunaan rHP pada ikan dianggap aman untuk dikonsumsi karena rHP tidak ditransmisikan ke keturunan selanjutnya sehingga tidak termasuk ikan transgenik (Acostaet al., 2007). Penerapan teknologi hibridisasi, dan triploidisasi dapat dilakukan untuk ikan yang sudah dikuasai teknik pemijahan buatannya, sedangkan pemijahan buatan ikan sidat masih perlu diteliti. Teknologi rHP juga aplikatif untuk diterapkan oleh pembudidaya dengan perbaikan pertumbuhan yang relatif tinggi sebesar 17-75% dan mudah dilakukan untuk kegiatan produksi massal. Dengan demikian, pada penelitian ini digunakan teknologi rHP untuk meningkatkan pertumbuhan benih ikan sidat.
Efektivitas rHP bergantung pada spesies ikan uji, dosis, dan metode pemberian rHP. Pemberian rHP pada ikan dapat dilakukan dengan beberapa metode, yaitu penyuntikan/injeksi, perendaman, dan secara oral melalui pakan. Pemberian rHP pada ikan sidat dengan metode perendaman lebih mudah, lebih efektif, dan lebih aplikatif dibandingkan dengan metode injeksi dan pemberian melalui pakan. Pemberian rHP melalui teknik penyuntikan/injeksi kurang aplikatif jika diterapkan pada kegiatan produksi secara massal. Selain itu respon yang dihasilkan lambat, diduga karena reseptor memerlukan faktor intermediet atau waktu untuk mengenali rHP yang diinjeksikan (Promdonkoy et al., 2004). Perbandingan efektivitas metode pemberian rHP melalui pakan dan perendaman dapat dilihat dari hasil penelitian yang dilakukan oleh Rahmawaty (2011) dan Putra (2010). Pemberian rHP melalui pakan telah diuji oleh Rahmawaty (2011) pada ikan gurame menggunakan rHP ikan mas. Hasil yang diperoleh menunjukkan peningkatan bobot sebesar 13% dari perlakuan kontrol. Uji ikan yang sama dilakukan oleh Putra (2010) dengan teknik perendaman menggunakan rHP ikan gurame, hasilnya menunjukkan peningkatan 75,04 % dengan dosis 30 mg/L dibandingkan dengan kontrol.
Hasil penelitian pendahuluan yang dilakukan oleh Handoyo (2012), diketahui bahwa kisaran dosis rElHP pada benih ikan sidat yang menghasilkan pertumbuhan lebih tinggi daripada kontrol adalah antara 1,2 s.d 12,0 mg/L. Kisaran dosis tersebut masih relatif besar, dan diduga di antara kisaran dosis tersebut dapat menghasilkan pertumbuhan lebih baik. Oleh karena itu, pada penelitian ini dilakukan perendamanglass eeldalam larutan rElHP dosis 0, 3, 6, 9 dan 12 mg/L.
1.2 Tujuan
II. BAHAN DAN METODE
2.1 Rancangan Perlakuan
Penelitian ini terdiri dari enam perlakuan yang masing-masing diberi 3 kali ulangan. Perlakuan yang diberikan berupa perendaman dengan dosis rElHP berbeda yaitu 0, 3, 6, 9, dan 12 mg/L dalam larutan NaCl 0,6% yang ditambah serum albumin sapi (BSA) 0,01%, dan kontrol yang direndam dalam larutan NaCl 0,6% tanpa BSA dan rElHP. Penelitian menggunakan rancangan acak lengkap (Tabel 1). Benih ikan sidat yang digunakan yaitu stadia glass eelyang diperoleh dari pengumpul di Pelabuhan Ratu, Jawa Barat.
Tabel 1. Rancangan perlakuan
phosphate saline (BFS) sebanyak 1 kali, kemudian disimpan di deep-freezer (-80oC) hingga akan digunakan.
Pelet bakteri hasil sentrifugasi dicuci menggunakan bufer tris-EDTA(TE) sebanyak 1 mL per 200 mg bakteri, diinkubasi pada suhu 37oC selama 20 menit dan kemudian disentrifugasi pada suhu 4oC dengan kecepatan 12.000 rpm selama 2 menit. Supernatan dibuang, dan ke dalam tabung berisi pelet bakteri dimasukkan 500 µL larutan lisozim (10 mg dalam 1 mL bufer TE) untuk melisis dinding bakteri. Proses dilakukan selama 20 menit pada 37oC, lalu disentrifugasi pada 12.000 rpm selama 15 menit. Supernatan dibuang, dan endapan yang terbentuk merupakan pelet protein rHP dalam bentuk badan inklusi (inclusion body). Pelet protein rHP dicuci dengan BFS sebanyak 1 mL, pencucian dilakukan sebanyak 2 kali. Setelah selesai, protein di simpan dalamdeep-freezerhingga akan digunakan.
2.3 Perendaman Ikan dalam Larutan rHP
Bobot dan panjang totalglass eelikan sidat sebanyak 50 ekor diukur untuk masing-masing ulangan perlakuan sebagai data awal. Benih ikan direndam dalam media larutan NaCl 3% selama 2 menit (shock salinitas), setelah itu dipindahkan ke larutan NaCl 0,6% yang telah diberi campuran rHP dan BSA sesuai dosis perlakuan (Tabel 1). Ikan direndam dalam larutan rHP volume 200 mL selama 2 jam (Handoyo, 2012). Ikan yang sudah selesai direndam kemudian dipindahkan ke akuarium yang berukuran 20 x 30 x 20 cm3 dengan volume air sebanyak 7 liter. Pemeliharaan dilakukan selama 8 minggu. Pengukuran biomassa ikan tiap perlakuan dilakukan setiap 2 minggu sekali.
2.4 Analisis Proksimat
Analisis proksimat dilakukan di Laboratorium Nutrisi, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat (kadar protein, kadar lemak, kadar abu, kadar air, serat kasar, dan BETN) dilakukan pada kontrol dan perlakuan terbaik. Pengujian parameter ini ditujukan untuk menguji pengaruh penggunaan rHP terhadap kandungan gizi (kadar protein, kadar lemak, kadar air, kadar abu, serat kasar, dan BETN) pada ikan sidat. Rumus perhitungan kandungan proksimat daging dilampirkan pada Lampiran 1.
2.4.1 Kadar Air
Prinsip kerja analisis kadar air adalah menguapkan air yang terdapat dalam bahan menggunakan oven 100o-105oC dalam jangka waktu tertentu hingga penyusutan berat badan tidak berubah lagi. Pertama, botol dikeringkan dalam oven selama 1 jam pada suhu 105oC. Lalu didinginkan dalam eksikator dan ditimbang bobotnya (x). Sampel sebanyak 5 g (y) dimasukkan ke dalam oven 1050C selama 4-6 jam, lalu didinginkan lagi dalam eksikator dan ditimbang. Langkah ini dilakukan 3 kali hingga berat kering bahan konstan (z).
2.4.2 Kadar Abu
2.4.3 Kadar Protein
Prinsip pengukuran kadar protein adalah pengukuran kadar nitrogen bahan dengan metode Kjeldahl melalui 3 tahap yaitu destruksi, destilasi, dan titrasi. Pada tahap destruksi, 0,3 g bahan dimasukkan ke dalam labu destruksi dan ditambahkan sekitar 3 sendok katalis campuran dan 20 mL H2SO4 pekat teknis secara homogen. Kemudian campuran tersebut dipanaskan pada alat destruksi dengan posisi low selama 10 menit, medium 5 menit dan high sampai larutan menjadi jernih dan berwarna kehijauan. Tahap kedua yaitu destilasi, labu destruksi didinginkan dan dimasukkan ke dalam labu penyuling dan diencerkan dengan 300 mL akuades. Ke dalam larutan ditambahkan batu didih dan larutan NaOH 22% 100 mL, kemudian labu penyuling dipasang dengan cepat di atas alat penyuling. Proses penyulingan berlangsung sampai 2/3 cairan dalam labu penyuling telah menguap. Tahap ke tiga yaitu titrasi, hasil penyulingan dalam labu erlemeyer dititrasi dengan larutan NaOH 1,3 N sampai larutan tersebut berwarna biru kehijauan. Volume NaOH dicatat (z mL) dan dibandingkan dengan blanko (y mL).
2.4.4 Kadar Lemak
2.4.5 Serat Kasar
Sampel bahan sebanyak 1 gram (x) dimasukkan ke dalam gelas piala 500 mL dan ditambahkan 50 mL H2SO4 0,3 N, lalu dipanaskan selama 30 menit hingga mendidih. Setelah itu, ditambahkan 25 ml NaOH 1,5 N, dan terus dididihkan kembali selama 30 menit kedua. Kemudian cairan tersebut disaring dengan kertas saring yang sudah ditimbang (a) menggunakan corong Bucher. Proses penyaringan berturut-turut dilakukan dengan menggunakan 50 mL air panas, 50 mL H2SO4 0,3 N, 50 mL air panas, 25 mL Aceton. Kertas saring dan isinya dipindahkan ke cawan porselen dan dikeringkan dalam oven pada suhu 105oC kemudian didinginkan dalam eksikator selama 1 jam dan ditimbang (y). Setelah itu kertas saring dan isinya dipijarkan dalam tanur sampai putih dan ditimbang (z).
2.5 Analisis Statistik
III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Pertumbuhan Bobot, Panjang, dan Biomassa
Peningkatan bobot rerata dan biomassa ikan sidat yang diberi perlakuan perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) lebih tinggi dibandingkan dengan perlakuan kontrol. Nilai bobot rerata dan biomassa ikan sidat ditampilkan pada Tabel 2.
Tabel 2. Bobot rerata, laju pertumbuhan spesifik (SGR), pertumbuhan panjang (PP), dan biomassa, ikan sidat kontrol dan ikan sidat yang diberi perlakuan dan 12 = 12 mg/L direndam dalam larutan 0,6% yang ditambah BSA 0,01%
Berdasarkan Tabel 2, ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis 3 mg/L menunjukkan nilai bobot rerata tertinggi (0,682 g) dibandingkan dengan perlakuan lainnya (0 mg/L: 0,577 g, 6 mg/L: 0,612 g, 9 mg/L: 0,531 g, 12 mg/L: 0,553 g) dan kontrol (0,614 g,). Sama halnya dengan nilai pertumbuhan bobot, nilai biomassa tertinggi ditunjukkan oleh ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis 3 mg/L (biomassa: 20,707 g) dan yang terkecil ditunjukkan oleh ikan perlakuan 0 mg/L dengan nilai biomassa 7,810 g. Peningkatan biomassa ikan sidat perlakuan rElHP 3 mg/L adalah sekitar 28% dibandingkan dengan kontrol. Hal ini menunjukkan bahwa penggunaan rHP dengan metode perendaman mampu meningkatkan pertumbuhan ikan sidat.
(3,043%), 6 mg/L (2,781%), 9 mg/L (2,652%) menunjukkan nilai yang lebih tinggi dibandingkan dengan perlakuan 0 mg/L (2,587%), sedangkan rElHP dengan dosis 12 mg/L (2,558%) menunjukkan nilai SGR yang lebih kecil dibandingkan dengan dosis 0 mg/L.
Pertumbuhan panjang ikan menunjukkan nilai yang tidak berbanding lurus dengan bobot rerata ikan. Berdasarkan Tabel 2, bobot rerata terbesar ditunjukkan oleh ikan sidat dengan perlakuan 3 mg/L (bobot rerata: 0,682 g, PP: 7,517 cm), namun untuk pertumbuhan panjang tertinggi (Tabel 2) ditunjukkan oleh ikan sidat dengan perlakuan 0 mg/L (PP: 7,550 cm, bobot rerata: 0,577 g).
Gambar 1. Pertumbuhan bobot rerata ikan sidat kontrol dan yang telah direndam dalam larutan rHP ikan kerapu kertang, yang dipelihara selama 8 minggu.
Pada Gambar 1 terlihat bahwa bobot rerata ikan sidat untuk semua perlakuan terus meningkat setiap dua minggu sampai akhir pemeliharaan. Namun demikian, pertumbuhan yang signifikan terjadi pada minggu keenam sampai minggu kedelapan dengan bobot rerata 0,50 g meningkat menjadi 1,50-2,00 g, sedangkan pada minggu-minggu sebelumnya penambahan bobot rerata ikan kurang dari 0,50 g.
0 2 4 6 8
B
o
bo
t
re
ra
ta
(
g
)
ke-3.1.2 Kelangsungan Hidup Ikan (SR)
Perbandingan kelangsungan hidup ikan sidat kontrol dengan ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis berbeda (0, 3, 6, 9, 12 mg/L) ditampilkan pada Gambar 2.
Tingkat kelangsungan hidup ikan sidat yang diberi perlakuan perendaman rElHP dengan dosis berbeda ( 3, 6, 9, dan 12 mg/L) menunjukkan tingkat kelangsungan hidup (SR) yang lebih tinggi (rerata >40%) dibandingkan dengan dosis 0 mg/L (27,33%). Nilai SR ikan pada perlakuan perendaman rElHP dengan dosis 3 mg/L (60,67%) dan 12 mg/L (56%) lebih tinggi dibandingkan dengan kontrol (52,67%). Nilai SR tertinggi ditunjukkan oleh ikan sidat dengan perlakuan perendaman rElHP dengan dosis 3 mg/L.
Gambar 2. Tingkat kelangsungan hidup ikan sidat kontrol dan yang direndam dalam larutan rHP ikan kerapu kertang, yang dipelihara selama 8 minggu
3.1.3 Proksimat Ikan Sidat
Kandungan gizi (kadar protein, kadar lemak, karbohidrat, kadar abu, serat kasar, dan BETN) ikan sidat ditampilkan pada Tabel 3. Penggunaan rHP pada ikan sidat dapat menurunkan kadar air, kadar abu, protein, dan serat kasar ikan, sedangkan kadar lemak dan nilai BETN meningkat. Penggunaan rHP pada ikan sidat menunjukkan penurunan kandungan serat kasar sebesar 50% dibandingkan
dengan ikan kontrol (K: 0,17%, 3 mg/L: 0,085%), dan peningkatan BETN sebesar 52% dari ikan kontrol (K: 2,13%, 3 mg/L: 3,23%).
Tabel 3. Kandungan proksimat ikan perlakuan rElHP terbaik (3 mg/L) dan kontrol
Perla-Keterangan : Analisis proksimat dilakukan di laboratorium Nutrisi departemen BDP,FPIK,IPB. Sampel yang digunakan 10 g untuk masing-masing analisis.
3.2 Pembahasan
akibat infeksi bakteri ini bervariasi, tetapi umumnya ditandai oleh adanya
hemoragik pada kulit, insang, rongga mulut, dan borok pada kulit. Infeksi oleh
bakteri A. hydrophila terjadi melalui permukaan badan yang luka, saluran
pencernaan makanan atau melalui insang. Kemudian bakteri masuk dalam
pembuluh darah dan menyebar pada organ dalam lain yang menyebabkan
pendarahan yang disertai haemorrhagic septicaemia (Kabata, 1985 dalam
Gardeniaet al., 2010).
Gambar 3. Benih ikan sidat yang terkena Aeromonas hydrophila dengan gejala hemoragik pada sirip ekor.
langsung terhadap kelangsungan hidup, pertumbuhan, tingkah laku, kesehatan, dan kualitas air. Jika hasil penelitian ini dibandingkan dengan penelitian pendahuluan Handoyo, diketahui bahwa penggunaan dosis rElHP 3 mg/L menunjukkan peningkatan pertumbuhan yang tidak berbeda jauh dengan dosis 12 mg/L yang dilakukan oleh Handoyo. Dengan demikian, diantara 1,2 sampai 12 mg/L dosis rElHP yang diujicobakan oleh Handoyo terdapat dosis yang lebih efektif untuk digunakan yaitu dosis rElHP 3 mg/L.
Peningkatan pertumbuhan pada penelitian ini (28%) dapat dicapai dalam 3 generasi dengan metode seleksi. Hasil tersebut menunjukkan bahwa pemberian rHP dengan metode perendaman dapat meningkatkan pertumbuhan lebih cepat dibandingkan dengan metode seleksi yang meningkatkan pertumbuhan hanya 10% per generasi. Aplikasi metode seleksi membutuhkan waktu 10 tahun untuk menghasilkan 12 generasi dengan kecepatan tumbuh 12,4% per generasi pada ikan nila (Bolivaret al., 2002).
Kontrol rElHP dosis 3 mg/L
Gambar 4. Perbandingan ukuran ikan sidat kontrol dengan perlakuan terbaik (dosis perendaman: 3mg/L) pada akhir pemeliharaan selama 8 minggu.
gurame dengan dosis 20 mg/L dan 30 mg/L berhasil meningkatkan pertumbuhan masing-masing 63,95% dan 75,04% lebih tinggi dibandingkan dengan kontrol. Perbedaan hasil tersebut diduga karena perbedaan jenis rHP dan ikan uji yang digunakan. Pada penelitian Putra (2010) rHP yang digunakan yaitu rHP ikan gurame yang diujicobakan kepada ikan gurame, sedangkan pada penelitian ini digunakan rHP ikan kerapu kertang yang diujicobakan kepada ikan sidat. Penggunaan jenis rHP yang merupakan hasil transformasi gen GH dari ikan uji itu sendiri diduga akan menghasilkan pertumbuhan yang lebih besar dibandingkan dengan penggunaan rHP yang berbeda dengan ikan uji. Organ atau jaringan dalam tubuh ikan memiliki reseptor hormon pertumbuhan yang akan mengenali rHP yang diberikan dan kemudian disampaikan ke sel-sel tubuh sehingga terjadi proses pertumbuhan. Kecocokan antara reseptor dan jenis rHP yang digunakan akan mempengaruhi proses pertumbuhan yang akan terjadi. Hal yang sama disampaikan oleh Birzniece et al. (2009) yang menyatakan bahwa perbedaan pengaruh pertumbuhan dikarenakan tidak cocoknya jenis rHP yang diberikan terhadap reseptor hormon pertumbuhan yang terdapat di dalam tubuh ikan target.
Acosta et al. (2009) menyatakan bahwa pemberian rHP pada larva dapat meningkatkan kelangsungan hidup dan meningkatkan daya tahan terhadap stress dan infeksi penyakit. Penggunaan rHP melalui teknik perendaman menunjukkan tingkat kelangsungan hidup yang lebih tinggi dibandingkan dengan perlakuan dosis 0 mg/L. SR benih ikan sidat yang diberi perlakuan rHP dengan dosis 3 mg/L lebih tinggi 15,2% dibandingkan dengan kontrol dan 121,99% lebih tinggi dibandingkan dengan dosis 0 mg/L. Benih ikan sidat yang diberi dosis 1,2 s.d 12 mg/L pada penelitian pendahuluan Handoyo menunjukkan SR yang tinggi, lebih dari 90%. Pada penelitian ini, dosis yang digunakan berada pada kisaran dosis yang diujicobakan oleh Handoyo. Namun SR yang diperoleh lebih rendah, perlakuan terbaik (3 mg/L) menunjukkan nilai SR yang tidak begitu tinggi yaitu hanya 60,67%. Perbedaan nilai SR yang diperoleh disebabkan padat penebaran dan ukuran wadah/ akuarium yang digunakan berbeda sehingga daya dukung air untuk benih juga berbeda.
berlebih diduga dapat memberikan feedback negatif bagi pertumbuhan ikan. Wong et al. (2006) menyatakan tentang pengaturan feedback hormon pertumbuhan pada mamalia. Dalam pituitari mamalia, pelepasan hormon pertumbuhan/ Growth Hormon (GH) di somatotrop dikontrol oleh GHRH dan SRIF di mana kedua regulator tersebut dirilis oleh hipotalamus dan akan disampaikan ke pituitari anterior melalui sistem peredaran darah. GH yang dirilis dari pituitari dapat memberikan feedback negatif pada somatotrop melalui tiga jalur. Pertama, long-loop feedback yang merupakan akibat tidak langsung dari aktifitas IGF-I yang diproduksi oleh hati. Kedua, short-loop feedback yang merupakan akibat langsung dari aktifitas GH di hipotalamus. Ketiga, ultra-short feedbackyang merupakan akibat langsung dari aktivitas GH yang berada di dalam pituitari (Gambar 5). Jumlah GH atau IGF-I yang berlebih dalam pembuluh darah akan menimbulkanFeedback negatif atau umpan balik negatif tersebut dan akan memberikan impuls pada kelenjar pituitari untuk tidak mensekresikan GH.
Gambar 5. Pengaturanfeedbackhormon pertumbuhan pada mamalia
rendah dibandingkan dengan kontrol yang tidak diberi rHP dan BSA (0,614 g). Pemberian BSA tanpa diiringi pemberian rHP diduga akan berakibat tidak baik bagi pertumbuhan ikan. Hasil yang sama juga diperoleh pada penelitian Ratnawati (2012). Ikan gurame diberi perlakuan perendaman (tanpa NaCl 0,9%) dalam larutan BSA+rHP (24 mg/200 ml) dengan waktu perendaman 3 (A), 2 (B), 1 (C), dan 0,5 (D) jam serta perlakuan perendaman dalam lartutan BSA+ NaCl 0,9% tanpa rHP sebagai kontrol (E) dan perendaman dalam larutan BSA+rHP+NaCl 0,9% (F). Benih ikan gurame perlakuan kontrol dengan lama perendaman 1 jam (E) menghasilkan bobot rerata yang lebih kecil (1,93 g ) dibandingkan dengan perlakuan lainnya (A: 2,30 g, B: 2,22 g, C: 2,30 g, D: 2,54 g, dan E: 2,25 g).
menunjukkan pertumbuhan yang signifikan setelah minggu ke-14 dan 16. Pada uji yang ketiga, benih disuntik rbGH dengan dosis 100 atau 1000 µg. Pertumbuhan bobot yang signifikan terjadi setelah minggu ke-2 dan respon ini akan terus meningkat setelah itu. Pertumbuhan yang signifikan dihasilkan pada waktu yang berbeda-beda. Menurut Promdonkoy et al. (2004), respons yang lambat terjadi dikarenakan reseptor membutuhkan waktu atau faktor intermediet untuk mengenali rHP yang diinjeksikan/diberikan.
Pada penelitian ini selain parameter pertumbuhan, diamati juga kandungan proksimat daging ikan untuk mengetahui ada atau tidaknya pengaruh pemberian rHP pada kandungan proksimat daging benih ikan sidat. Hasil analisis proksimat menunjukkan bahwa ikan yang diberi perlakuan perendaman rHP dengan dosis 3 mg/L menunjukkan nilai kadar protein yang menurun sebesar 6,6% dari kontrol (15,91% menjadi 14,86%) dan peningkatan kadar lemak sebesar 5,6% dari kontrol (7,69% menjadi 8,12%). Penurunan kadar protein ikan yang diberi perlakuan diduga karena banyaknya protein yang dikonversi menjadi energi akibat perilaku ikan yang lebih agresif dan nafsu makan yang meningkat, sehingga sedikit protein yang digunakan untuk pertumbuhan. Ikan yang lebih agresif melakukan lebih banyak gerakan. Dengan demikian ikan lebih banyak mengeluarkan energi dibandingkan dengan ikan kontrol. Protein merupakan sumber energi utama bagi ikan, protein dalam pakan diharapkan dapat digunakan secara optimum untuk pertumbuhan (Hariyadi et al., 2005). Namun hasil yang berbeda dilaporkan oleh Chatakondiet al. (1995) yang melakukan perbandingan kandungan nutrisi tubuh pada ikan mas transgenik yang mengekspresikan gen hormon pertumbuhan ikan rainbow trout dengan yang bukan transgenik. Kandungan protein ikan transgenik meningkat 7,5% dan kandungan lemaknya menurun 13%. Penyebab perbedaan hasil dan mekanisme regulasi hormon pada ikan sidat yang diberi perlakuan rHP perlu dikaji lebih lanjut.
lemaknya lebih banyak. Oleh karena itu kadar lemak dosis 3 mg/L lebih tinggi dibandingkan dengan kontrol.
Ikan sidat yang diberi perlakuan perendaman menggunakan rHP menunjukkan adanya peningkatan nafsu makan. Pada saat pemberian pakan, ikan yang diberi perlakuan perendaman rHP menunjukkan perilaku yang lebih agresif dibandingkan dengan ikan kontrol. Pengamatan terhadap perilaku dan pola makan ikan dilakukan secara visual (kuantitatif) setiap hari. Hal yang sama juga disampaikan oleh Promkondoy et al. (2004), ikan mas koki yang diberi gcGH menunjukkan peningkatan nafsu makan dan tingkah laku makan yang lebih agresif dan lebih enerjik terhadap pakan yang diberikan. Peningkatan nafsu makan juga ditunjukkan oleh ikan gurame yang diberi perlakuan perendaman rOgHP pada penelitian Putra (2010).
Mekanisme penyerapan/masuknya rHP ke dalam tubuh ikan belum diketahui secara pasti. Smith (1982) dalam Moriyama & Kawauchi (1990), mendemonsrasikanradiolabeled-BSA dapat masuk ke insang dan epidermis ikan rainbow trout setelah perendaman dalam larutan dan diduga bahwa sel insang memungkinkan digunakan sebagai jalur masuk. Berdasarkan uraian tersebut, mekanisme masuknya rHP dengan metode perendaman juga diduga melalui insang secara osmoregulasi. Menurut Smith (1982) dalam Setyo (2006), untuk menjaga keseimbangan konsentrasi osmotik antara cairan intrasel dan ektrasel maka ikan atau udang melakukan proses osmoregulasi. Beberapa organ yang berperan dalam proses osmoregulasi ikan antara lain: insang, ginjal, dan usus.
dalam larutan NaCl 3% maka kondisinya menjadi terbalik, sel pada tubuh ikan sidat bersifat hipotonik (tekanan osmotik dalam tubuh ikan lebih rendah dibandingkan dengan di luar tubuh). Perubahan kadar salinitas akan mempengaruhi tekanan osmotik cairan tubuh ikan, sehingga ikan akan melakukan penyesuaian dengan melakukan pengaturan kerja osmotik agar proses fisiologis dalam tubuhnya dapat bekerja secara normal kembali. Maka pada kondisi tersebut akan terjadi proses osmoregulasi dimana cairan dari luar tubuh akan masuk ke dalam tubuh ikan, diduga rHP masuk ke dalam tubuh ikan pada proses osmoregulasi tersebut.
IV. KESIMPULAN
DAFTAR PUSTAKA
Acosta JR, Morales R, Morales M, Alonso M, Estrada MP. 2007.Pichia pastoris Expressing Recombinant Tilapia Growth Hormone Accelerates The Growth of Tilapia.Biotechnol Lett29: 1671-1676.
Acosta J, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, Borroto C, Besada V, Sanchez A, Herrera F. 2009. Tilapia Somatotropin Polypeptides: Potent Enhancers of Fish Growth and Innate Immunity. Biotecnologia Aplicada26: 267-272.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faizal I. 2010. Production and Bioactivity Potential of Three Recombinant Growth Hormones of Farmed Fish.Indonesian Aquaculture Journal5:11-16.
Bolivar RB, Gary F, Newkirk. 2002. Response to Within Family Selection for Body Weight in Nile Tilapia Oreochromis niloticus Using A Single-Trait Animal Model.Aquaculture204: 371-381.
Birzniece V, Sata A, Ho K. 2009. Growth Hormone Reseptor Modulators. Clin Endocrinol(Oxf) 71 (5): 715. PMID 19170715
Budimawan. 2007. Identifikasi Spesies Glass-Eeldan Elver Ikan Sidat (Anguilla spp.) Berdasarkan Jumlah Vertebrata.Torani, 17 (3), 203-207.
Chatakondi, Lovell RT, Duncan PL, Hayat M, Chen TT, Powers DA, Weete JD.\, Cummins K, Dunham RA. 1995. Body Composition of Transgenic Common Carp, Cyprinus carpio, Containing Rainbow Trout Growth Hormone Gene.Aquaculture138: 99-109.
Funkenstein B, Dyman A, Lapidot Z, de Jesus-Ayson EG, Gertler A, Ayson FG. 2005. Expression And Purification of A Biologically Active Recombinant Rabbit Fish (Siganus guttatus) Growth Hormone. Aquaculture 250: 504-515.
Gardenia L, Koesharyani I, Supriyadi H, Mufidah T. 2010. Aplikasi Deteksi Aeromonas hydrophila Penghasil Aerolysin dengan Menggunakan Polymerase Chain Reaction (PCR). [prosiding]. Forum Inovasi Teknologi Akuakultur, hlm. 877-883.
Handoyo B. 2012. Metode Pemberian dan Respons Ikan Sidat terhadap Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang. Makalah yang Disampaikan dalam Seminar Hasil Penelitian Program Pasca Sarjana pada Tanggal 31 Mei 2012 di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Haryadi B, Haryono A, Susilo U. 2005. Evaluasi Efisiensi Pakan dan Efisiensi Protein Pada Ikan Karper Rumput (Ctenopharyngodon idella Val.) yang Diberi Pakan dengan kadar Karbohidrat dan Energi yang Berbeda.Ichthyos 4: 87-92.
Haryono A. 2004. Pengukuran Nilai Target Strenght Larva Ikan dengan Split Beam Acoustic System di Perairan Teluk Tomini, Sulawesi.[skripsi]. Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Heinsbroek L, Paul, Hoof V, Swinkels W, Tanck M, Schrama J, Verreth J. 2007. Effect of Feed Composition on Life History Development in Feed Intake, Metabolism, Growth and Body Composition of European Eel, Anguilla anguilla.Aquaculture267: 175-187.
Jeh HS, Kim CH, Lee HK, Han K. 1998. Recombinant Flounder Growth Hormone from Escherichia coli: Overexpression, Efficient Recovery, and Growth-Promoting Effect On Juvenile Flounder By Oral Administration. J Biotechnol60: 183-193.
Lesmana I. 2010. Produksi dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan dari Tiga Jenis Ikan Budidaya. [tesis]. Depertemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Leedom T, Uchida K, Yada T, Richman N, Byatt J, Collier R, Hirano T, Grau E.
2002. Recombinant Bovine Growth Hormone Treatment of Tilapia: Growth Response, Metabolic Clearance, Receptor Binding and Immunoglobin Production.Aquaculture207: 359-380.
Li Y, Bai J, Jian Q, Ye X, Lao H, Li X, Luo J, Liang X. 2003. Expression of Common Carp Growth Hormone in The YeastPichia Pastorisand Growth Stimulation of Juvenile Tilapia (Oreochromis niloticus). Aquaculture 216: 329-341.
Moriyama S, Kawauchi H. 1990. Growth Stimulation of Juvenile Salmonids By Immersion in Recombinant Salmon Growth Hormone. Nippon Suisan Gakkaishi56: 31-34.
Promdonkoy B, Warit S, Panyim S. 2004. Production of A Biologically Active Growth Hormone from Giant Catfish (Pangasianodon gigas) inEscherichia coli.Biotechnology Lett26: 649-653.
Putra HGP. 2010. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Protein Rekombinan GH Melalui Perendaman dengan Dosis Berbeda [skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rahmawaty I. 2011. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Pakan Alami yang Disuplementasi Hormon Pertumbuhan Rekombinan. [skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ratnawati P. 2012. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Gurame yang Diberi Hormon Pertumbuhan Rekombinan dengan Lama Perendaman yang Berbeda. [skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rowland, S.J, Mifsuda, C., Nixon., M., dan Boyd, P. 2006. Effect of Stocking Density Performance of The Australian Freshwater Silver Perch (Bidyanus bidyanus) in Cages.Aquaculture253: 301-308.
Said dan Mayasari. 2010. Pertumbuhan dan Pola Reproduksi Ikan BadaRasbora argyrotaeniaPada Rasio Kelamin yang Berbeda. LIMNOTEK, 17 (2): 201-209.
Satyani D, Meilisza N, Solichah L. 2010. Gambaran Pertumbuhan Panjang Benih Ikan Botia (Chromobotia macracanthus) Hasil Budidaya Pada Pemeliharaan dalam Sistem Hapa dengan Padat Penebaran 5 Ekor per Liter. [prosiding]. Forum Inovasi Teknologi Akuakultur, hlm. 395-402.
Sekine S, Mizukami T, Nishi T, Kuwana Y, Saito A, Sato M, Itoh S, Kawauchi H. 1985. Cloning and Expression of cDNA for Salmon Growth Hormone in Escherichia coli.Proc Natl Acad Sci USA82: 4306-4310.
Setyo BP. 2006. Efek Konsentrasi Kromium (Cr3+) dan Salinitas Berbeda Terhadap Efisiensi Pemanfaatan Pakan Untuk Pertumbuhan Ikan Nila (Oreochromis niloticus). [tesis]. Program Studi Megister Manajemen Sumber Daya Pantai, Universitas Diponegoro. Semarang.