ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI DAUNPINUS
(Pinus merkusii Jungh.et deVries)DARI
KABUPATEN SAMOSIR
SKRIPSI
MAWAR SIRINGO-RINGO
120822027
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI DAUNPINUS
(Pinus merkusii Jungh. et deVries)DARI
KABUPATEN SAMOSIR
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar
Sarjana Sains
MAWAR SIRINGO-RINGO
120822027
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAUN PINUS (Pinus merkusii Jungh.et deVries) DARI KABUPATEN SAMOSIR
Kategori : SKRIPSI
Nama : MAWAR SIRINGO-RINGO Nomor Induk Mahasiswa : 120822027
Program : SARJANA (S1) EKSTENSI KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Juni 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Mimpin Ginting, M.S Dr. Juliati br Tarigan, S.Si, M.Si NIP : 195510131986011001 NIP: 197205031999032001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAUN PINUS (Pinus merkusii Jungh.
etdeVries)DARI KABUPATEN SAMOSIR
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2014
PENGHARGAAN
Segala puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini sesuai rencana dan kehendakNya. Banyak hal sebagai pembelajaran dan pembentukan diri dalam setiap waktu penulis rasakan sehingga semakin melihat dan merasakan kebaikan dan kebesaranNya. Dalam pelaksanaan penelitian ini hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, dukungan maupun motivasi dari berbagai pihak. Untuk itu pada kesempatan ini penulis mengucapkan terimakasih kepada :
1. Bapak Dr.Sutarman, MSc selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
2. Ibu Dr.Rumondang Bulan Nst., MS dan Bapak Drs.Albert Pasaribu, M.Sc sebagai Ketua dan Sekretaris Departemen Kimia FMIPA USU
3. Bapak Dr.Darwin Yunus Nst., MS sebagai Ketua Bidang Kimia Ekstensi FMIPA USU.
4. Ibu Dr.Juliati TariganS.Si, M.Si sebagai pembimbing I dan Bapak Dr. Mimpin Ginting, MS sebagai pembimbing II dengan sabar telah memberikan dorongan, bimbingan dan saran sehingga skripsi ini dapat selesai.
5. Bapak Prof.Dr.Jamaran Kaban,M.Sc selaku Ketua Bidang Kimia Organik FMIPA USU.
6. Kepala Laboratorium Kimia Organik FMIPA USU Medan Bapak Dr.Mimpin Ginting,MS beserta Dosen dan Staff Laboratorium Kimia Organik FMIPA USU. 7. Seluruh Dosen Departemen Kimia FMIPA USU yang telah memberikan waktunya
untuk memberi bimbingan selama penulis mengikuti kuliah di Departemen Kimia FMIPA USU
8. Pihak-pihak yang tidak disebutkan namun dengan tulus membantu penulis dalam penyelesaian skripsi ini.
ABSTRAK
Minyak atsiri daun pinus (Pinus merkusii Jungh. et deVries) telah diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Daun pinus dihidrodestilasi selama 5 jam menghasilkan minyak atsiri sebesar 0,1531 % (b/b). Hasil analisis menggunakan GC-MS menunjukkan 23 puncak yang dapat diidentifikasi sebanyak 20 senyawa memilki 5 komponen utama yaitu senyawa Limonen (22,72%), α-Pinen (17,53%), β -Kariofilen (16,76%), β-Ocimene (14,68%), dan Germakren-d (11,24%). Aktivitas antibakteri di uji dengan metode diffuse agar pada konsentrasi 0,1%, 0,25%, 0,5%, 0,75% dan 1% dalam pelarut dimetil sulfoksida. Minyak atsiri pinus (Pinus merkusii
CHEMICAL ANALYSIS OF ESSENTIAL OIL COMPONENTS AND ANTIBACTERIAlACTIVITY TEST OF PINUS LEAVES (Pinus
merkusiJungh.etdeVries) FROM KABUPATEN SAMOSIR
ABSTRACT
Essential oil of pinus leaves (Pinus merkusii Jungh.et deVries) have been isolated by hydrodestilation method using Stahl. Pinus leaves have destilated for five hours roduced essential oil 0.1531% (w/w). The results of the analyse use GC-MS showed 23 peaks and can be identified 20 compounds and have five major compounds are
Limonene (22.72%), α-Pinene (17.53%), β-Caryophyllene (16.76%), β-Ocimene (14.68%), and Germacren-d (11.24%). Antibacterial activity of the test have been done using agar diffuse method the concentrations 0,1%, 0,25%, 0,5%, 0,75%, and 1% in the solvent dimethyl sufoxside. Essential oil of pinus leaves (Pinus merkusii
DAFTAR ISI 1.3. Tujuan Penelitian 1.4. Pembatasan Masalah 1.5.Manfaat Penelitian 1.6.Lokasi Penelitian 1.7.Metodologi Penelitian
BAB 2. TINJAUAN PUSTAKA
2.1.Tanaman Pinus (Pinus merkusiiJungh.et deVries) 2.1.1. Manfaat Pinus
2.1.2. Minyak Atsiri Pinus 2.2. Sumber-sumber Minyak Atsiri 2.3. Komposisi Minyak Atsiri
2.3.1. BiosintesaMinyakAtsiri
2.3.2. Cara Isolasi Minyak Atisiri Pinus 2.3.3. Penggunaan Minyak Atsiri Pinus 2.4. Senyawa Terpen
2.5. Kromatografi Gas-Spektrometri Massa (GC-MS) 2.5.1. Kromatografi Gas
2.5.1.1. Cara KerjaKromatografi Gas 2.5.1.2. Instrumentasi Kromatografi Gas
2.5.2. Spektrometri Massa
2.5.2.1. Instrumentasi Spektrometer Massa 2.5.2.2. Penentuan Rumus Molekul
2.5.2.3. Pengenalan Puncak Ion Molekul
2.5.2.4. Kaidah Umum untuk Mengenali Puncak-Puncak dalamSpektra
2.6. Bakteri
2.6.1. Bakteri Gram Negatif
2.6.1.1. Pseudomonas aeruginosa
2.6.1. Staphylococcus aureus
2.7. Antibakteri
BAB 3. METODE PENELITIAN
3.1. Alat 3.2. Bahan
3.3. Prosedur Penelitian
3.3.1. Isolasi Minyak Atsiri Daun Pinus denganMetode Hidrodestilasi
3.3.2. UjiSifatAntibakteriMinyakAtsiriPinus
3.3.2.1. PembuatanMedia Nutrient Agar (NA) dan SubkulturBakteri
3.3.2.2. Pembuatan Media Mueller Hinton Agar ( MHA)
3.3.2.3. PembuatanMedia Natrium Broth (NB) dan SubkulturBakteri
3.3.2.4. PembuatanSuspensiBakteri
3.3.3. UjiSifatAntibakteriMinyakAtsiriDaunPinus
3.4. PengenceranMinyakAtsiri 3.5. BaganPenelitian
3.5.1. IsolasiMinyakAtsiriDaunPinusDenganAlat Stahl 3.5.2.UjiAktivitasAntibakteri
3.5.2.1.Pembuatan Media Nutrient Agar (NA) Miring dan StokKulturBakteri
3.5.2.2. Pembuatan Mueller Hinton Agat (MHA) 3.5.2.3. Penyiapan InokulumBakteri
3.5.2.4. UjiAktivitasAntibakteri
BAB 4. HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Hasil Isolasi MinyakAtsiri dari Daun Pinus (Pinusmerkusii)
4.1.2. Hasil Analisis Komponen Kimia Minyak Atsiri Daun Pinus denganGC-MS
4.1.3. Hasil Uji Aktivitas Antibakteri 4.2. Pembahasan
4.2.1. Isolasi MinyakAtsiri Pinus ( Pinusmerkusii )
4.2.2. AnalisisMinyakAtsiriDaunPinus dengan Metode GC-MS
4.2.3. AktivitasAntibakteri
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 5.2. Saran
DAFTAR GAMBAR
Nomor Gambar Judul Halaman
Gambar 2.1. Tanaman Pinusmerkusii Gambar 2.2.BiosintesaTerpenoid
Gambar 2.3. Perubahan Senyawa monoterpen
Gambar 2.4. Reaksi Biogenetik Beberapa Seskuiterpena Gambar 2.5.StrukturKomposisiMinyak Terpentin Pinus Gambar 2.6. Skematis KromatograsiKromatografi Gas Gambar 2.7. Skematis Spektrometer Massa
Gambar 2.8. Bakteri Pseudomonas aeruginosa
Gambar 2.9.BakteriStaphylococcus aureus
Gambar 4.1.KromatogramMinyakAtsiri Daun Pinus
Gambar 4.2. Spektrum MS Senyawa Limonen dari Minyak Atsiri Daun Pinus
Gambar 4.3.PolaFragmentasiSenyawaLimonen
Gambar 4.4. Spektrum MS Senyawa α-Pinen dariMinyakAtsiri DaunPinus
Gambar 4.5. Pola Fragmentasi Senyawa α-Pinen
Gambar 4.6. Spektrum MS Senyawa β-Kariofilen dari Minyak Atsiri Daun Pinus
Gambar 4.7. Pola Fragmentasi Senyawa β-Kariofilen
Gambar 4.8.Spektrum MS Senyawa β-Ocimene dari Minyak Atsiri Daun Pinus
Gambar 4.9. Pola Fragmentasi β-Ocimene
Gambar 4.10. Spektrum MS Senyawa Germakren-d dari Minyak Atsiri Daun Pinus
DAFTAR TABEL
Nomor Tabel Judul Halaman
Tabel 2.1.Sumber-SumberMinyakAtsiri Tabel 2.2.KlasifikasiTerpen
Tabel 3.1. Kondisi AlatGC-MS Yang Digunakan untuk Analisis Minyak Atsiri Pinus
Tabel4.1. HasilIsolasiMinyakAtsiriDaunPinus Melalui Hidrodestilasi Tabel4.2.HasilAnalisisGC-MS MinyakAtsiriDaun Pinus
DAFTAR LAMPIRAN
Nomor Lampiran Judul Halaman
Lampiran 1: Gambar Spektrum MS Limonen dari Minyak Daun Pinus yang diperoleh Menggunakan Alat Stahl
Lampiran 2: Gambar Spektrum MS α-Pinen dari Minyak Daun Pinus yang diperoleh Menggunakan Alat Stahl
Lampiran 3: Gambar Spektrum MS dari β-Kariofilen Minyak Daun Pinus yang diperoleh MenggunakanAlat Stahl
Lampiran 4: Gambar Spektrum MS β-Ocimene dariMinyakDaun Pinus yangdiperolehMenggunakanAlat Stahl Lampiran 5: Gambar Spektrum MS Kalaren dariMinyakDaun
Pinus yang diperolehMenggunakanAlat Stahl Lampiran 6: Hasil Identifikasi Pinus
Lampiran 7: Gambar Pohon Pinus
ABSTRAK
Minyak atsiri daun pinus (Pinus merkusii Jungh. et deVries) telah diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Daun pinus dihidrodestilasi selama 5 jam menghasilkan minyak atsiri sebesar 0,1531 % (b/b). Hasil analisis menggunakan GC-MS menunjukkan 23 puncak yang dapat diidentifikasi sebanyak 20 senyawa memilki 5 komponen utama yaitu senyawa Limonen (22,72%), α-Pinen (17,53%), β -Kariofilen (16,76%), β-Ocimene (14,68%), dan Germakren-d (11,24%). Aktivitas antibakteri di uji dengan metode diffuse agar pada konsentrasi 0,1%, 0,25%, 0,5%, 0,75% dan 1% dalam pelarut dimetil sulfoksida. Minyak atsiri pinus (Pinus merkusii
CHEMICAL ANALYSIS OF ESSENTIAL OIL COMPONENTS AND ANTIBACTERIAlACTIVITY TEST OF PINUS LEAVES (Pinus
merkusiJungh.etdeVries) FROM KABUPATEN SAMOSIR
ABSTRACT
Essential oil of pinus leaves (Pinus merkusii Jungh.et deVries) have been isolated by hydrodestilation method using Stahl. Pinus leaves have destilated for five hours roduced essential oil 0.1531% (w/w). The results of the analyse use GC-MS showed 23 peaks and can be identified 20 compounds and have five major compounds are
Limonene (22.72%), α-Pinene (17.53%), β-Caryophyllene (16.76%), β-Ocimene (14.68%), and Germacren-d (11.24%). Antibacterial activity of the test have been done using agar diffuse method the concentrations 0,1%, 0,25%, 0,5%, 0,75%, and 1% in the solvent dimethyl sufoxside. Essential oil of pinus leaves (Pinus merkusii
BAB I
PENDAHULUAN
1.1. Latar Belakang
Hutan pinus merupakan hutan yang luas di Indonesia. Pohon pinus, famili Pinaciae
yang dibudidayakan di Indonesia sebagian besar adalah jenis Pinus merkusii Jungh. et
deVries yang tumbuh asli di Indonesia dan tumbuh di daerah Aceh, Sumatera Utara,
dan pulau Jawa (Sastrohamidjojo, 2004). Manfaat pinus antara lain bagian batangnya
dapat disadap untuk mengambil getahnya, kayunya dapat digunakan untuk bahan
konstruksi, korek api, pulp, dan kertas serat panjang (Dahlian dan Hartoyo, 1997).
Adapun deskripsi pinus adalah daunya dalam berkas dua dan berbentuk jarum, kulit
berwarna abu-abu, tinggi kisaran 20-40 m dan diameter 30-60 cm (Steenis dan Van
2003). Pada umumnya pohon pinus bila disadap batang pohonya akan mengandung
minyak terpentin merupakan golongan minyak atsiri hidrokarbon yang dapat
menghasilkan 70-80%, komponen utama α- pinen dan sisanya β-pinen, Δ-karen, δ
-longifolen (Sastrohamidjojo, 2004).
Minyak atsiri merupakan senyawa yang dapat memberikan aroma yang
karakteristik pada tumbuhan. Minyak atsiri dapat dimanfaatkan sebagai antiseptik/anti
bakteri, anti jamur, perangsang selera makan, karminatif, deodoran, ekspektoran,
insektisida dan antiseptik/ antibakteri(Yuliani, 2012). Dalam keadaan segar dan murni
tanpa pencemar, minyak atsiri umumnya tidak berwarna, namun dalam penyimpanan
yang lama minyak atsiri dapat teroksidasi dan membentuk resin serta warnanya
berubah menjadi lebih tua / gelap (Gunawan dan Muyani, 2004).
Penelitian sebelumnya, yakni Senjaya dan Surakusumah, 1999 telah meneliti
tentang potensi ekstrak daun pinus (Pinus merkusii Jungh. et deVries) yang
mengandung senyawa pinen dan tanin mampu sebagai bioherbisida penghambat
perkecambahan Echinochloa colonum dan Amaranthus viridis. Sutya, 2006 meneliti
tentang lama penyimpanan terhadap rendemen minyak atsiri daun pinus (Pinus
merkusii Jungh. et deVries) dari Banjarbaru menghasilkan rendemen 0,5564 % yakni
analisis GC-MS daun pinus diperoleh monoterpen 34,49 %, seskuiterpen 62,48 %, dan
lain-lain 3,03 % dan menunjukkan kemampuan daya hambat minimum pertumbuhan
S.aureus pada konsentrasi 0,25%, tetapi sampai dengan kadar 12,5% minyak atsiri
pinus tidak menunjukkan daya antibakteri terhadap E.coli (Erindyah, 2003).
Produksi daun pinus menghasilkan sekitar 12,56-16,65 ton/hektar (Komarayati
et all., 2002) salah satunya adalah daerah Kabupaten Samosir yang merupakan
penghasil pohon pinus. Selama ini daun pinus yang diperoleh pada saat penebangan
pohon pinus hanya dianggap sebagai limbah yang belum dimanfaatkan secara
maksimal oleh masyarakat. Oleh karena itu peneliti tertarik menggunakan sampel
daun pinus segar sebagai sumber minyak atsiri. Sampel yang digunakan merupakan
daun pinus yang tumbuh kira-kira 2 tahun dengan tinggi kisaran 4 meter. Daun pinus
yang digunakan dalam keadaan segar untuk menghindari terjadinya penguapan
minyak atsiri dari daun pinus tersebut. Metode yang digunakan untuk mengisolasi
minyak atsiri adalah dengan Hidrodestilasi dan untuk menentukan komponen minyak
atsiri dianalisis dengan GC-MS selanjutnya diuji sifat antibakteri dengan metode
difusi agar terhadap bakteri gram positif dan gram negatif yaitu Staphylococcus
aureus sebagai gram positifbiasanya terdapat pada jerawat dan Pseudomonas
aeruginosa sebagaigram negatifterdapat pada luka dibagian kulit.
1.2. Permasalahan
1. Komponen kimia minyak atsiri apa sajakah yang terkandung pada daun pinus
(Pinus merkussi Jungh. Et deVries) dari Desa Sijambur Kecamatan Ronggurnihuta
Kabupaten Samosir yang dianalisis secara GC-MS ?
2. Bagaimanakah aktifitas antibakteri minyak atsiri daun Pinus terhadap
Staphylococcus aureus dan Pseudomonas aeruginosa yang diuji dengan metode
1.3. Tujuan Penelitian
1. Untuk menentukan komponen minyak atsiri yang terkandung di dalam daun pinus
segarsecara GC-MS
2. Untuk menguji aktivitas antibakteri minyak atsiri daun pinusterhadap
Staphylococus aureus dan Pseudomonas aeruginosa menggunakan metode difusi
agar
1.4.Pembatasan Masalah
1. Penentuan komponen minyak atsiri daun pinus segar dari desa Sijambur Kecamatan
Ronggurnihuta Kabupaten Samosir yang tumbuh selama 2 tahun
yang telah diisolasi dengan alat Stahl dan dianalisis dengan GC-MS
2. Minyak atsiri daun pinus diuji sifat antibakteri terhadap bakteri Staphylococcus
aureus dan Pseudomonas aeruginosa dengan metode difusi agar
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai aktivitas antibakteri
minyak atsiri daun pinus terhadap Staphylococus aureus dan Pseudomonas
aeruginosa. Dengan demikian daun pinus dapat dimanfaatkan sebagai penghasil
minyak atsiri yang dapat digunakan sebagai antibakteri sehingga lebih bermanfaat dan
tidak lagi sebagai limbah.
1.6. Lokasi penelitian
Penelitian ini dilakukan di Laboratorium Kimia Organik FMIPA -USU Medan. Uji
antibakteri dilakukan di laboratorium Mikrobiologi Fakultas Farmasi USU, analisis
1.7. Metodologi Penelitian
Penelitian ini dilakukan melalui eksperimen laboratorium. Dimana minyak atsiri daun
pinus diperoleh dengan metode Hidrodestilasi menggunakan alat Sthal. Minyak atsiri
yang diperoleh dipisahkan dari lapisan airnya kemudian ditambahkan Na2SO4
anhidrous bertujuan untuk menyerap kandungan airnya, yang masih terikat kemudian
didekantasi. Minyak atsiri yang diperoleh dianalisis dengan metode GC-MS untuk
mengetahui komponen kimianya, serta dilakukan pengujian aktivitas antibakteri
terhadap Staphylococcus aureus dan Pseudomonas aeruginosa menggunakan metode
BAB 2
TINJAUAN PUSTAKA
2.1.Tanaman Pinus (Pinus merkusii Jungh. et deVries)
Pinus merkusii Jungh. et deVries merupakan satu-satunya jenis pinus yang tumbuh di
Indonesia salah satunya tumbuh di Sumatera Utara dan sebaran alaminya sampai di
Asia Tenggara antara lain Laos, Kamboja, Thailand, Vietnam, dan diFlipina.Pinus
merkusii Jungh.et deVries termasuk suku Pinacea nama daerah Pinus (Jawa), tusam
(Sumatera) (Siregar, 2005). Pohon pinus tersebut pertama kali ditemukan di daerah
Sipirok, Tapanuli Selatan Sumatera Utara seorang ahli botani dari Jerman oleh
Dr.F.R.Junghuhn pada tahun 1841.Tumbuhan ini tergolong jenis cepat tumbuh dan
tidak membutuhkan persyaratan yang khusus (Harahap, 2000).
Deskripsi botani pinus pada umumya batang berkayu, bulat, keras, bercabang
horizontal, kulit retak-retak seperti saluran dan berwarna cokelat, daunya majemuk
dan bentuk jarum (Agusta,2000) memiliki buah dengan perisai ujung berbentuk
jajaran genjang, akhirnya merenggang, (Steenis and Van, 2003) tinggi kisaran 20-40
m dan diameter 30-60 cm (Hidayat dan Hansen, 2001).
Sistematika klasifikasi tanaman pinus adalah sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta
Class : Pinopsida
Pinus merkusii dapat tumbuh di tanah kurang subur, tanah berpasir, dan tanah berbatu,
dengan curah hujan tipe A-C pada ketinggian 200-1.700 m diatas permukaan laut.Di
hutan alam masih banyak ditemukan pohon besar berukuran tinggi 70 m dengan
diameter 170 cm (Harahap dan Izudin, 2002).
2.1.1. Manfaat Pinus
Pinus merkusii Jungh.et deVries atau sering disebut dengan tusam salah satunya jenis
pohon industri yang mempunyai produk tinggi dan merupakan prioritas jenis tanaman
untuk reboisasi dapat menghasilkan daun 12,56-16,65 ton/hektar (Komarayati et
all2002). Pinus termasuk dalam jenis pohon serba guna yang terus-menerus
dikembangkan dan diperluas masa penanamanya masa mendatang untuk penghasil
kayu produksi, getah dan konservasi lahan (Dahlian dan Hartoyo,1997). Kayunya
dapat dimanfaatkan menjadi bahan konstruksi, korek api, pulp, kertas serat panjang.
Bagian batangnya dapat disadap untuk mengambil getahnya dan diproses lebih
lanjut dengan penyulingan menghasilkan gondorukem sebagai komponen utama dan
terpentin sebagai hasil samping. Gondorukem telah banyak diperdagangkan untuk
keperluan dalam negeri dan ekspor (Sastrohamidjojo, 2004) yang dapat digunakan
sebagai bahan membuat sabun, resin dan cat ( Dahlian dan Hartoyo, 1997) sementara
terpentin yang dihasilkan berupa bagian minyak atsiri yang dapat digunakan dalam
bidang farmasi ataupun industri, bidang farmasi minyak terpentin dari pinus memiliki
Berdasarkan penelitian Erindyah, 2003, daun pinus juga sudah terbukti mempunyai
efek antibakteri terhadap Staphylococcus aureus dan Escherichia coli.
2.1.2. Minyak Atsiri Pinus
Minyak terpentin yang diperoleh dari tanaman-tanaman bermarga pinus famili
Pinaceae yang terbagi dalam 80-90 jenis (spesies) (Gunawan dkk,2004) yang sering
disebut dengan spirits of turpentine berupa cairan yang mudah menguap, berasal dari
penyulingan getah pinus.Minyak terpentin secara garis besar dibagi menjadi dua
jenis, yaitu yang dihasilkan dari getah pinus dan yang dihasilkan dari kayu pohon
pinus. Secara umum minyak terpentin dapat diperoleh dengan 4 cara yaitu:
1. Destilasi getah pinus yang diperoleh dengan menyadap pohon pinus yang masih
hidup (terpentin dari getah).
2. Ekstraksi dari potong-potongan/irisan ujung batang pohon pinus yang tua,
dilanjutkan dengan destilasi (terpentin kayu hasil destilasi uap dan ekstraksi)
3. Destilasi destruksi, yaitu destilasi terhadap potongan kayu pinus yang berumur
tua (terpentin hasil destilasi destruksi)
4. Proses sulfat, yaitu permasalahan bubur kayu pinus yang masih berumur muda
(terpentin kayu hasil proses sulfat) (Sastrohamidjojo,2004).
Berdasarkan data lembaga Penelitian Hasil Hutan (LPHH) Bogor melalui
proses penyulingan, minyak terpentin Pinus merkusii Jungh.et deVries dapat
menghasilkan 70-85% terpentin komponen utama menghasilkan α-pinen, dan sisanya
terdiri dari β-pinen, Δ-karen dan δ-longifolen (Silitonga, 1976). Terpentin ini berupa
cairan tidak berwarna dengan bau khas dan rasa menggigit, dapat larut dalam alkohol,
eter, kloroform dan asam asetat glasial.Terpentin bersifat opstis aktif dengan
pemutaran bidang polarisasi bervariasi, tergantung dari spesies pohon yang
menghasilkanya jika di udara terbuka terpentin cenderung teroksidasi membentuk
komplek resin yang berwarna lebih gelap (Gunawan dkk, 2004).
2.2. Sumber-sumber Minyak Atsiri
Minyak atsiri merupakan salah satu hasil akhir proses metabolisme sekunder dalam
tumbuhan. Tumbuhan penghasil minyak atsiri antara lain Pinaceae, Labiatae,
Umbelliferae, Gramineae. Minyak atsiri terdapat pada setiap bagian tumbuhan yaitu
di daun, bunga, buah, biji, batang, kulit, akar, dan rhizome (Ketaren, 1985). Minyak
atsiri yang banyak digunakan dalam industri tertera dalam Tabel 2.1.
Tabel 2.1. Sumber-sumber Minyak Atsiri (Agusta, 2000) Tumbuhan Bagian Kandungan Nama
Minyak (%komposisi) Senyawa
Acorus calamus rimpang β-Asaron
Kalamenena
cardamomun Linalool, Sineol
Zingiber rimpang kering 1,5-3 Zingiberena
officinale β- Seskuifelandrena
β- Felandrena
β- Bisabolone
Myristica fragrans biji 5-16 Sabinena, α-Pinena
β-pinena, Terpinena, Miristisin, Elemisin
Eugenia aromatic bunga 15-20 Eugenol, Eugenial
β-Kariofilena, Asetat
2.3. Komposisi Kimia Minyak Atsiri
Pada umumnya komponen kimia dalam minyak atsiri dibagi menjadi dua golongan
yaitu:
1. Golongan Hidrokarbon
Persenyawaan yang termasuk golongan hidrokarbon terbentuk dari unsur
Hidrogen (H) dan Karbon (C). Jenis hidrokarbon yang terdapat dalam alam dan
minyak atsiri sebagian besar terdiri dari monoterpen (2 unit isoprene), sesquiterpen (3
unit isoprene), dan diterpen (4 unit isoprene) dan politerpen, serta paraffin, olefin dan
hidrokarbon aromatik. Komponen kimia golongan hidrokarbon yang dominan
menentukan bau dan sifat khas setiap jenis minyak.Sebagai contoh minyak terpentin
yang mengandung monoterpen disebut pinene dan minyak jeruk mengandung 90%
limonene.
2. Oxygenated hydrocarbon
Komponen kimia dari golongan persenyawaan ini terbentuk dari unsur Karbon
(C), Hidrokarbon (H), dan Oksigen (O).Persenyawaan yang termasuk dalam golongan
ini adalah senyawa alkohol, aldehid, keton, oksida, ester, dan eter.Ikatan atom karbon
yang terdapat dalam molekulnya dapat terdiri dari ikatan jenuh dan ikatan tidak jenuh.
Persenyawaan yang mengandung ikatan tidak jenuh umumnya tersusun dari terpen.
Komponen lainya terdiri dari persenyawaan fenol, asam organik yang terikat dalam
bentuk ester misalnya lakton, coumarin dan turunan furan misalnya quinonen.
Golongan persenyawaan oxygenated hydrocarbon merupakan persenyawaan
menyebabkan bau wangi dalam minyak atsiri, sedangkan golongan hidrokarbon
berpengaruh kecil terhadap nilai wangi minyak atsiri. Persenyawaan oxygenated
hydrocarbon mempunyai nilai larutan yang tinggi dalam alkohol encer (kecuali
beberapa senyawa golongan aldehid), serta lebih tahan dan stabil terhadap proses
oksidasi dan resinifikasi. Sebaliknya golongan persenyawaan hidrokorban lebih
mudah mengalami proses oksidasi dan resinifikasi di bawah pengaruh cahaya dan
udara atau pada kondisi penyimpanan yang kurang baik, sehingga dapat merusak bau
2.3.1. Biosintesa Minyak Atsiri
Berdasarkan proses biosintesisnya atau pembentukan komponen minyak atsiri di
dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan. Golongan
pertama adalah turunan terpena yang terbentuk dari asam asetat melalui jalur
biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang terbentuk
dari biosintesis asam sikimat melalui jalur fenil propanoid (Agusta, 2000). Mekanisme
dari tahap-tahap reaksi biosintesis terpenoid yaitu asam asetat yang telah diaktifkan
oleh koenzim A melalui kondensasi jenis Claisen menghasilkan asam asetoasetat.
Senyawa yang dihasilkan ini dengan koenzim A melakukan kondensasi sejenis aldol
menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat.
Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi asam fosfat dan dekarboksilasi
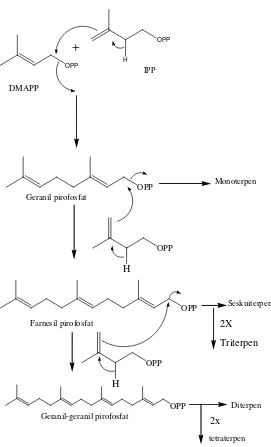
menghasilkan IPP (Isopentenil Pirofosfat) yang selanjutnya berisomerisasi menjadi
DMAPP (Dimetilalil Pirofosfat) oleh enzim isomerase. IPP sebagai unit isoprene aktif
bergabung secara kepala ke ekor dengan DMAPP dan penggabungan ini merupakan
langkah pertama dari polimerisasi isopren untuk menghasilkan terpenoid.
Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap IPP terhadap
atom karbon dari DMAPP yang kekurangan elektron diikuti oleh penyingkiran ion
pirofosfat. Serangan ini menghasilkan geranil pirofosfat (GPP) yakni senyawa antara
bagi semua senyawa monoterpen.
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi
organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi
selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan
senyawa-senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi sekunder
pula. Reaksi –reaksi sekunder ini lazimnya adalah hidrolisa, siklisasi, oksidasi,
reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam
suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarboksilasi, dan
sebagainya.Berikut ini adalah gambar biosintesa terpenoid dapat dilihat pada gambar
CH3 C
Asetil Koenzim A Asetosetil koenzim A
OPP H
Gambar 2.2. Biosintesisa Terpenoid (Achmad, 1986)
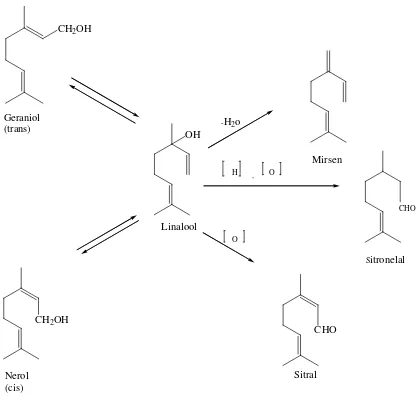
Untuk menjelaskan hal diatas dapat diambil beberapa contoh monoterpen. Dari
segi biogenetik, perubahan geraniol, nerol, dan linalool dari satu menjadi yang lain
berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari
hidrolisa geranil pirofosfat (GPP) dapat menjalani reaksi-reaksi sekunder berikut,
misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi
menghasilkan sitronelal. Berikut ini contoh perubahan senyawa monoterpen dapat
CH2OH
Geraniol (trans)
OH
-H2o
Mirsen
CHO
Sitronelal
H , O
Linalool
CH2OH
Nerol (cis)
O
CHO
Sitral
Gambar 2.3. Perubahan Senyawa Monoterpen (Achmad, 1986).
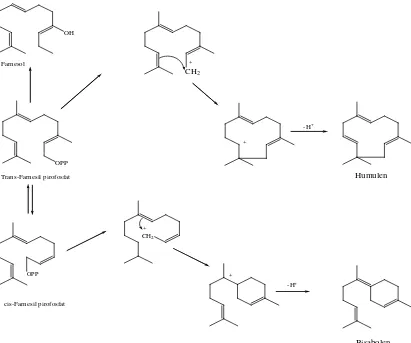
Senyawa-senyawa seskuiterpen diturunkan dari cis-farsenil pirofosfat dan
trans-farsenil pirofosfat melalui reaksi siklisasi dan reaksi sekunder lainnya. Kedua
isomer farsenil pirofosfat ini dihasilkan in vivo melalui mekanisme yang sama seperti
isomerisasi antara geraniol dan nerol.Perubahan farsenil pirofosfat menjadi
OH
Gambar 2.4. Reaksi Biogenetik Beberapa Seskuiterpena (Achmad, 1987)
2.3.2. Cara isolasi Minyak Atsiri
Pada umumnya cara isolasi minyak atsiri adalah uap menembus jaringan tanaman
dan menguapkan semua senyawa yang mudah menguap yang disebut destilasi
uap.Bahan yang mengandung minyak atsiri dapat diperoleh dengan metode
penyulingan (Guenther, 1987). Ada tiga metode penyulingan yang digunakan dalam
industri minyak atsiri, yaitu:
1. Penyulingan dengan air (hydrodistillation)
Pada sistim penyulingan dengan air, bahan yang akan disuling langsung
kontak dengan air mendidih. Keuntungan dari penggunaan sistim ini adalah digunakan
untuk menyuling bahan yang berbentuk tepung dan bunga-bungan yang mudah
membetuk gumpalan jika kena panas.Prosesnya cukup sederhana, sistim penyulingan
bubur.Kelemahanya adalah penyulingan minyak ini tidak sempurna (Sastrohamidjojo,
2004).
2. Penyulingan dengan air dan uap (hydro and steam distillation)
Pada sistim penyulingan ini, bahan yang diletakkan di atas piring yang berupa
ayakan yang terletak beberapa sentimeter di atas permukaan air dalam ketel
penyulingan.Keuntungan sistim penyulingan ini adalah karena uap berenetrasi secara
merata ke dalam jaringan bahan dan suhu dapat dipertahankan sampai 100 0C.
3. Penyulingan dengan uap langsung (steam distillation)
Sistem yang menggunakan uap panas yang terdapat dalam boiler yang letaknya
terpisah dari ketel penyulingan.Uap yang dihasilkan mempunyai tekanan lebih tinggi
dari tekanan udara luar. Sistim penyulingan ini baik digunakan untuk mengekstraksi
minyak dari biji-bijian, akar dan kayu- kayuan yang umumnya mengandung
komponen minyak yang bertitik didih tinggi dan baik digunakan terhadap bahan yang
mengandung minyak atsiri yang mudah rusak oleh pemanasan air (Ketaren, 1985).
2.3.3. Penggunaan Minyak Atsiri
Penggunaan minyak atsiri dan bahan kimia volatil untuk pengobatan, kosmetik serta
wewangi-wangian telah dikenal dalam masyarakat sejak jaman purba. Dan kini ada
kecenderungan untuk kembali ke penggunaan bahan- bahan alam, antara lain karena
minyak atsiri dapat larut dalam lemak yang terdapatpada kulit, dapat diabsorpsi ke
dalam aliran darah, dan mempunyai kompabilitas dengan lingkungan (dapat
mengalami bidegradasi dan merupakan bagian dari kesetimbangan ekosistem selama
ribuan tahun) (Rojat, dkk, 1996).
Minyak atsiri merupakan sumber dari aroma kimia alami yang dapat
digunakan sebagai komponen flavor dan fragrance alami dan sebagai sumber yang
penting dari struktur stereospesifik enansiomer murni yang biosintesisnya lebih murah
dibandingkan dengan proses sintesis (Lawrence dan Reynold, 1992). Minyak atsiri
digunakan sebagai bahan baku dalam industri, misalnya industri parfum, kosmetik,
“essence”, industri farmasi dan “flavoring agent”. Dalam pembuatan parfum dan
wangi-wangian, minyak atsiri tersebut berfungsi sebagai pengikat bau (fixative) dalam
atsiri yang berasal dari rempah rempah, misalnya minyak lada, minyak kayu manis,
minyak jahe, minyak cengkeh, minyak ketumbar, umumnya digunakan sebagai bahan
penyedap (flavoring agent) dalam bahan pangan dan minuman (Ketaren, 1985).
Minyak atsiri ini selain memberikan aroma wangi yang menyenangkan juga
dapat membantu pencernaan denga merangsang sistem saraf sekresi, sehingga akan
meningkatkan sekresi getah labung yang mengandung enzim hanya oleh stimulus
aroma dan rasa bahan pangan dan lambung menjadi basah. Beberapa jenis minyak
atsiri digunakan sebagai bahan antiseptik internal atau eksternal, bahan analgesik,
haelitik atau sebagai antizimatik sebagai sedatif dan simultan untuk obat sakit
perut.Minyak atsiri mempunyai sifat membius, merangsang atau memuakkan
(Guenther, 1987).
2.4. Senyawa Terpen
Senyawa terpen merupakan suatu golongan hidrokarbon yang banyak dihasilkan oleh
tumbuhan dan terutama terkandung pada getah dan vakuola selnya.Pada tumbuhan,
senyawa-senyawa golongan terpen dan modifikasinya, terpenoid, merupakan
metabolit sekunder.Terpen dan terpenoid dihasilkan pula oleh sejumlah hewan,
terutama serangga beberapa hewan laut.Di samping sebagai metabolit sekunder,terpen
merupakan kerangka penyusun sejumlah senyawa penting bagi mahluk hidup.Sebagai
contoh, senyawa- senyawa terpenoid adalah skualena, suatu triterpen, juga karoten
dan retinol. Nama “ terpen” (terpene) diambil dari produk getah tusam, terpentin
(turpentine).
Terpen dan terpenoid menyusun banyak minyak atsiri yang dihasilkan oleh
tumbuhan.Kandungan minyak atsiri mempengaruhi penggunaan produk
rempah-rempah, baik sebagai bumbu, sebagai wewangian, serta sebagai bahan pengobatan,
kesehatan, dan penyerta upacara-upacara ritual. Nama-nama umum senyawa golongan
ini sering kali diambil dari nama minyak atsiri yang mengandungnya. Lebih jauh lagi,
nama minyak itu sendiri diambil dari nama (nama latin) tumbuhan yang menjadi
sumbernya ketika pertama kali diidentifikasi. Sebagai missal adalah citral, diambil
dari minyak yang diambil dari jeruk (citrus). Contoh lain adalah eugenol, diambil dari
terpenoid, berarti serupa dengan terpena adalah senyawa dengan struktur serupa tetapi
tidak dapat dinyatakan dengan rumus dasar.Kedua golongan ini menyusun banyak
minyak atsiri.Klasifikasi biasanya tergantung pada nilai n.
Tabel 2.2. Klasifikasi Terpen (Koensoemardiyah, 2010)
Nama Rumus Sumber
Monoterpen C10H16 Minyak atsiri
Seskuiterpen C15H24 Minyak atsiri
Diterpen C20H32 Resin pinus
Triterpen C30H48 Saponin, Damar
Tetraterpen C40H64 Pigmen, Karoten
Politerpen (C5H8)n Karet alam
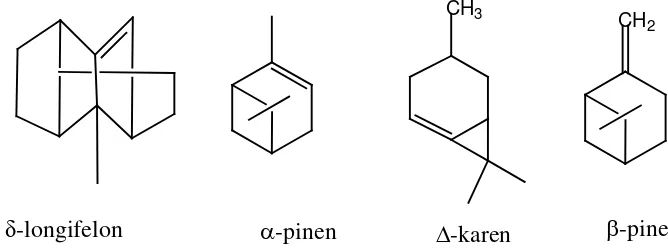
Beberapa contoh struktur monoterpen bisiklik yang dikandung oleh minyak terpentin
dari Pinus merkusii(gambar 2.5) ( Sastrohamidjojo, 2004).
α-pinen
CH3
∆-karen
CH2
β-pinen
Gambar 2.5.Struktur Komposisi Minyak Terpentin Pinus
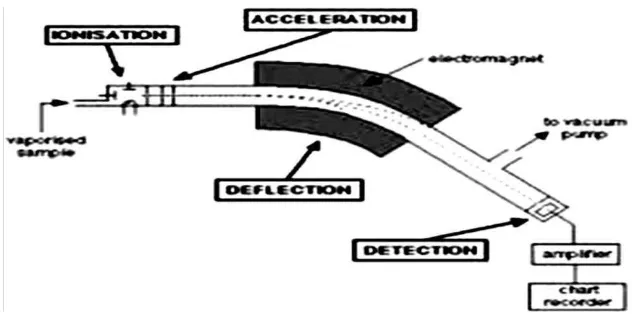
2.5. Kromatografi Gas-Spektrometri Massa (GC-MS)
Kromatografi Gas-Spektrometri Massa (GC-MS) merupakan alat yang gabungan
antara Kromatografi Gas dan Spektrometri Massa. Instrumen alat ini adalah gabungan
dari GC dan MS merupakan kombinasi kekuatan simultan untuk memisahkan dan
mengidentifikasi komponen-komponen campuran.
2.5.1. Kromatografi Gas
Kromatografi gas berfungsi sebagai alat pemisah berbagai komponen campuran dalam
sampel yang mudah menguap, sedangkan spektrometer massa berfungsi untuk
mendeteksi masing-masing molekul komponen telah dipisahkan pada sistem
kromatografi gas (Agusta,2000). Tekanan uap atsiri memungkinkan komponen
menguap dan bergerak bersama-sama dengan fase gerak yang berupa gas (Sinambela,
2012). Waktu yang diperlukan untuk memisahkan campuran sangat beragam,
tergantung banyaknya komponen dalam suatu campuran, semakin banyak komponen
yang terdapat dalam suatu campuran maka waktu yang diperlukan semakin
lama.Komponen campuran dapat diidentifikasi berdasarkan waktu tambat (waktu
resistensi) yang khas pada kondisi yang tepat.Waktu tambat adalah waktu yang
menunjukkan berapa lama suatu senyawa tertahan dalam kolom (Gritter, 1985).
Gambar 2.6. Skemaδtis Kromatografi Gas
2.5.1.1. Cara Kerja Kromatografi Gas
Sampel diinjeksikan melalui suatu sampel injection port yang temperaturnya dapat
diatur, senyawa-senyawa dalam sampel akan menguap dan akan dibawa oleh gas-gas
pengemban menuju kolom. Zat terlarut akan teradsorpsi pada bagian atas kolom oleh
fase diam, kemudian akan merambat dengan laju rambatan masing-masing komponen
tersebut. Komponen-komponen tersebut terelusi sesuai dengan urut-urutan makin
membesarnya nilai koefisien partisi menuju ke detektor.Detektor sederetan sinyal
sinyal ini akan tampak sebagai kurva antara waktu terhadap komposisi aliran gas
pembawa.
Ada beberapa kelebihan kromatografi gas diantaranya kita dapat menggunakan
kolom lebih panjang untuk menghasilkan efesiensi pemisahan yang tinggi.Gas dan
uap mempunyai viskositas yang rendah, demikian juga kesetimbangan partisi antara
gas dan cairan berlangsung cepat, sehingga analisis relatif cepat dan sensitivitasnya
tinggi.Fase gas dibandingkan fase cair tidak bersifat reaktif terhadap fase diam dan
zat-zat terlarut.Kelemahannya adalah teknik ini terbatas untuk zat yang mudah
menguap (Khopkar, 2003).
2.5.1.2. Instrumentasi Kromatografi Gas
1. Regulator tekanan: Tekanan diatur pada 1-4 atmosfer, sedangkan aliran diatur 1000
liter gas per menit. Katub pengatur aliran diatur oleh pengatup berbentuk jarum
terletak bagian bawah penunjuk aliran.Sebelum kolom, gas pengemban dialirkan
dulu pada suatu silinder berisi molekular CEV untuk menyaring adanya
kontaminasi pengotor.Gas pembawa He, N2, Ar, umumnya digunakan, tetapi untuk
detektor konduktivitas termal, He lebih disukai karena konduktivitas termalnya
yang tinggi.
2. Sistem injeksi sampel: Sampel diinjeksikan dengan suatu makro sirinye melalui
suatu septum karte silikon ke dalam kotak logam yang panas. Kotak logam tersebut
dipanaskan dengan pemanas listrik. Banyaknya sampel berkisar antara 0,5-10 µm.
3. Kolom kromatografi: Terbuat dari tabung yang dibuat berbentuk spiral terbuka.
Baja tahan karat digunakan untuk tabung kolom kromatografi bila bekerja pada
temperatur tinggi.Diameter kolom bervariasi dari 1/16-3/16.Panjang umumnya
adalah dua meter.
4. Penunjang stasioner: Struktur dan sifat permukaan memegang peranan penting.
Struktur berperan pada efesiensi kolom, sedangkan sifat permukaan menentukan
tingkat pemisahan. Permukaan penunjang akan terselimuti oleh fase cair stasioner
berupa lapisan film tipis. Penunjang yang sering digunakan adalah
5. Fase stasioner: Salah satu keunggulan kromatografi gas cair terletak pada variasi
fase cair untuk partisi yang dapat tersedia dalam jumlah tidak terbatas. Temperatur
maksimum yang dapat diperlakukan terhadap suatu kolom ditentukan oleh suatu
penguapan stasioner.Banyaknya fase stasioner suatu kolom dinyatakan dengan
persen berat.
6. Detektor: Peka terhadap komponen-komponen yang terpisahkan di dalam kolom
serta mengubah kepekaanya menjadi sinyal listrik. Kuat lemahnya sinyal
tergantung pada laju aliran masa sampel dan bukan pada konsentrasi sampel gas
penunjang.
7. Pencatat sinyal: Akurasi suatu kromatogram pada suatu daerah pembacaan
ditentukan oleh pemilihan pencatat sinyal (Kopkhar,2003).
2.5.2. Spektrometri Massa
Spektrometri massa berdasarkan asas-asas yang berlainan. Dalam sebuah
spektrometer, suatu sampel dalam keadaan gas dibom elektron yang berenergi cukup
untuk mengalahkan potensi ionisasi pertama senyawa ini.Tabrakan antara sebuah
molekul organik dan salah satu elektron berenergi tinggi menyebabkan lepasnya
sebuah elektron dari molekul itu dan terbentuknya suatu ion organik. Ion organik yang
dihasilkan oleh pemboman elektron berenergi tinggi ini tidak stabil dan pecah menjadi
fragmen kecil, baik berbentuk radikal bebas maupun ion-ion lain. Dalam sebuah
spektrometer massa yang khas, fragmen bermuatan positif ini akan dideteksi.
Spektrum massa ialah alur kelimpahan (abdundance, jumlah relatif fragmen
bermuatan positif yang berlainan) versus angka banding massa/muatan (m/e) dari
fragmen-fragmen itu (Fessenden, 1982).Spektrometer massa pada umumnya
digunakan untuk:
1. Menentukan massa suatu molekul
2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresolusi
Tinggi (High Resolution Mass Spectra)
3. Mengetahui informasi dari struktur dengan melihat pola fragmentasinya
Gambar 2.7. Skematis Spektrometer Massa
2.5.2.1. Instrumentasi Spektrometer Massa
Bagian-bagian utama suatu jenis spektrometer massa adalah tempat menginjeksikan
sampel, ruang pengion, pengumpul ion, penguat sinyal dan pencatat. Sampel diuapkan
dan didorong ke dalam ruang pengion.Kemudian molekul-molekul sampel terionisasi
baik secara langsung ataupun tidak langsung oleh arus elektron sehingga ion-ion
positif, dan molekul-molekul dipisahkan dalam bentuk-bentuk ion-ionya. Ion positif
masuk ke dalam daerah penganalisis massa. Kemudian partikel yang bergerak cepat
diberi medan magnit yang kuat, sehingga lintasanya menjadi lengkung. Jari-jari
lengkung lintasan tergantung dari kecepatan dan kekuatan medan magnit. Ion-ion
yang melewati celah akan diterima oleh elektron pengumpul. Arus ion yang
dihasilkan diperkuat dan dicatat sebagai fungsi kuat medan atau potensial akselerasi
(Khopkar, 2003).
1. Sistem penanganan sampel
Bagian ini terdiri dari suatu alat untuk memasukkan sampel, sebuah
makrometer untuk mengetahui jumlah sampel yang dimasukkan.Sebuah alat
pembocor molekul untuk mengatur sampel ke dalam kamar pengion dan sebuah
sistem pompa.Apabila sampel berupa gas dapat dimasukkan dengan memindahkan
dari bola gas ke dalam ukuran volume, kemudian ke kamar pengion.Sampel yang
berupa cairan dimasukkan berbagai alat misalnya dengan minginjeksikan melalui
kemudian dipanaskan untuk menguapkan sampel ke dalam sistem
masukan.Pemanasan sistem ini dilakukan terhadap cairan yang kurang mudah
menguap atau terhadap padatan yang dilarutkan dalam suatu pelarut. Cara pemasukan
sampel ke kamar pengion dilakukan terhadap senyawa yang sukar menguap dan tidak
stabil terhadap panas ( Sudjadi, 1985).
2. Sumber ion
Disini molekul akan diubah menjadi ion dalam bentuk gas. Cara yang umum
untuk menghasilkan ion-ion meliputi penembakan sampel dengan berkas elektron
berenergi tinggi yang berasal dari suatu ion gun. Pada cara elektron inpact, tumbukan
dengan elektron menyebabkab fragmentasi molekul-molekul yang membentuk
sejumlah ion-ion positif dari berbagai massa. Pada carachemical ionization
memberikan fragmentasi lebih sederhana. Pada cara nyala, pembentukan ion dari
sampel anorganik yang tidak mudah menguap dilakukan dengan cara nyala. Pada cara
ionisasi medan dipakai anoda dan katoda untuk mendapat fragmentasinya (Khopkar,
2003).
3. Penganalisis massa
Ini adalah susunan alat-alat yang berguna untuk memisahkan ion-ion dengan
perbandingan massa terhadap muatan yang berbeda-beda. Penganalisis massa harus
dapat membedakan selisih massa yang kecil serta dapat menghasilkan arus ion yang
tinggi (Khopkar, 2003).
4. Pengumpul ion
Terdiri dari suatu celah atau lebih dari silinder Faraday. Berkas ion
membentuk tegak lurus pada plat pengumpul dan isyarat yang timbul diperkuat
dengan pelipat ganda elektron (Sudjadi, 1985).
5. Pencatat
Spektrum massa biasanya dibuat dari massa rendah ke massa tinggi. Pencatat
yang banyak digunakan mempunyai 3-6 galvanometer yang mencatat secara
bersama-sama pada kertas fotografi.Galvanometer menyimpang jika ada ion menabrak
lempeng pengumpul, bertukar sinar ultraviolet dapat menimbulkan berbagai puncak
2.5.2.2. Penentuan Rumus Molekul
Penentuan rumus molekul yang mungkin dari kekuatan isotop dapat dilakukan jika
puncak ion molekul termasuk cukup kuat hingga puncak tersebut dapat diukur dengan
cermat sekali.Misalnya suatu senyawa mengandung 1 atom karbon. Maka untuk tiap
100 molekul yang mengandung satu atom 12C, sekitar 1,08% molekul mengandung
satu atom 13C. Karenanya molekul-molekul ini akan menghasilkan sebuah puncak
M+1 yang besarnya 1,08% kuat puncak molekul ion molekulnya; sedangkan
atom-atom 2H yang akan memberikan sumbangan tambahan yang amat lemah pada puncak
M+1 itu. Jika suatu senyawa mengandung sebuah atom sulfur, puncak M+2 akan
menjadi 4,4% puncak induk.
2.5.2.3. Pengenalan Puncak Ion Molekul
Ada dua hal yang menyulitkan pengidentifikasian puncak molekul yaitu:
1. Ion molekul tidak nampak atau amat lemah. Cara penanggulangannya ialah
mengambil spektrum pada kepekaan maksimum, jika belum diketahui
dengan jelas dapat juga dilihat berdasarkan pola pecahnya.
2. Ion molekul nampak tetapi cukup membingungkan karena terdapatnya
beberapa puncak yang sama atau lebih menonjol. Dalam keadaan
demikian, pertama-tama soal kemurnian harus dipertanyakan. Jika
senyawa memang sudah murni, masalah yang lazim ialah membedakan
puncak ion molekul dari puncak M-1 yang lebih menonjol. Satu cara yang
bagus adalah dengan mengurangi energi bebas elektron penembak
mendekati puncak penampilan.
Kuat puncak ion molekul tergantung pada kemantapan ion molekul.Ion-ion
molekul paling mantap adalah dari sistem aromatik murni. Secara umum golongan
senyawa-senyawa berikut ini akan memberikan puncak-puncak ion menonjol:
senyawa aromatik (alkena terkonjugasi), senyawa sinyal sulfida organik (alkana
normal, pendek), merkaptan. Ion molekul biasanya tidak nampak pada alkohol
alifatik, nitrit, nitrat, senyawa nitro, nitril, dan pada senyawa-senyawa bercabang.
Puncak-puncak dalam arah M-3 sampai M-14 menunjukkan kemungkinan adanya
2.5.2.4.Kaidah Umum untuk Mengenali Puncak-Puncak dalam Spektra
Sejumlah kaidah umum untuk mengenali puncak-puncak menonjol dalam dampak
elektron dapat ditulis dan dipahami dengan konsep-konsep buku kimia fisik:
1.Tinggi nisbi puncak ion molekul terbesar bagi senyawa rantai lurus dan akan
menurun jika derajat percabangan bertambah.
2. Tinggi nisbi puncak ion molekul biasanya makin kecil dengan bertambahnya bobot
molekul deret homolog; kecuali ester lemak.
3. Pemecahan/pemutusan cenderung terjadi pada karbon terganti gugus alkil; makin
terganti gugus, makin mudah terputus. Hal ini merupakan akibat lebih mantabnya
karbokasasi tersier dari pada sekunder yang lebih mantap dari pada primer.
4. Adanya ikatan rangkap, struktur lingkar dan terlebih-lebih cincin aromatik
(heteroatom) memantapkan ion molekul hingga meningkatkan pembentukanya.
5. Ikatan rangkap mendukung pemecahan alil dan menghasilkan karbonium alil.
6. Cincin jenuh cenderung melepas rantai samping pada ikatan-α. Hal ini tidak lain
dari pada kejadian khusus percabangan. Muatan positif cenderung menyertai sibir
cincin.Cincin tak jenuh dapat mengalami reaksi Retro-Diels-Alder.
7. Dalam senyawa aromatik terganti gugus alkil, pemecahan paling mungkin terjadi
pada ikatan berlokasi –β terhadap cincin mengahsilkan ion benzil talunan
termantapkan atau ion tropilium.
8. Ikatan C-C yang bersebelahan dengan heteroatom cenderung terpecah meninggalkan
muatan pada sibiran yang mengandung heteroatom yang elektron tak-ikatanya
menciptakan kemantapanya talunan.
9. Pemecahan sering berkaitan dengan penyingkiran molekul netral matap yang kecil,
misalnya karbon monoksida, olefin, ammonia, hidrogen sulfida, hidrogen sianida,
merkaptan, ketena atau alkohol (Silverstein, 1981).
2.6. Bakteri
Bakteri (tunggal=bakterium) adalah organisme bersel tunggal terkecil, beberapa
diantaranya hanya memiliki diameter 0,4 µm (mikrometer).Bakteri diklasifikasikan
1. Coccus (jamak cocci) bulat, contoh streptokokus, staphylococus,
diplokokus
2. Bacillus (jamak bacilli) bentuk batang contoh Streptobacillus
3. Vibrio-pendek, batang lengkung, contoh vibrio
4. Spirilium (jamak spirilli) panjang berbentuk koil (benang melingkar),
contoh spirili (Sherrington, 1992).
Dalam pertumbuhan bakteri dapat dipengaruhi oleh faktor lingkungan yaitu:
a) Mineral
Selain karbon dan nitrogen, sel- sel hidup memerlukan sejumlah
mineral-mineral lainya untuk pertumbuhanya:
- Belerang (sulfur): seperti halnya dengan nitrogen, sulfur juga merupakan
substansi sel. Sebagian besar sulfur sebagai H2S, tetapi kebanyakan dijumpai
dalam SO4 (sulfat).
- Fosfor-fosfat (PO4): diperlukan sebagai komponen-komponen asam nukleat dan
berupa ko-enzim.
- Aktivator enzim: sejumlah mineral diperlukan sebagai aktivator enzim seperti
Mg, Fe, juga K dan Ca.
Bakteri yang memerlukan C dalam bentuk senyawa organik, karbohidrat, untuk
pertumbuhanya disebut bakteri heterotroph (organotrof).Dalam golongan ini
termasuk semua jenis bakteri yang phatogen bagi manusia. Dalam laboratorium
biasanya dipakai glukosa sebagai sumber C, energi yang diperlukan diperoleh dari
cahaya matahari atau oksidasi senyawa organik. Bakteri heterotroph fotosintetik
memperoleh energi dari cahaya.Bakteri heterotrof kemosintek memperoleh energi
dari oksidasi (Nasution, 2014).
b) Suhu
Mikroorganisme yang mempunyai suhu optimum diantara 0-20 0C disebut
psikrofil, mikroorganisme yang tumbuh cepat pada suhu 20-50 0C disebut mesofil,
sedangkan mikroorganisme yang tumbuh pada kisaran suhu 50-100 0C disebut
termofil (Lay, 1996).
c) Oksigen
Berdasarkan kebutuhan oksigen bakteri dapat digolongkan menjadi bakteri
oksigen, bakteri anaerob fakultatif yang dapat tumbuh dalam keadaan anaerob
maupun aerob dan mikroaerofilik, bakteri yang dapat tumbuh dalam keadaan oksigen
yang sedikit (Muslimin, 1996).
d) pH
Kebanyakan bakteri tumbuh pada pH mendekati netral (6,57-7,5). Bakteri
terutama patogen, toleransinya terhadap asam lebih kecil bila dibandingkan dengan
jamur dan khamir.
e) Tekanan osmosis
Mikroba memerlukan air untuk pertumbuhan (80-90%). Sewaktu sel mikroba
membran sitoplasma yang disebut plasmolysis (Suryanto, 2006).Beberapa mikroba
perusak pangan dan patogen digolongkan dalam, bakteri gram positif contoh
Staphylococcus aureus dan bakteri gram negatif contoh Pseudomonas aeruginosa.
Berdasarkan perbedaan respons terhadap prosedur pewarnaan gram (klasifikasi
ini dilakukan oleh ahli histology Hans Christian Gram) dan struktur dinding sel,
bakteri dapat diklasifikasikan menjadi gram positif dan bakteri gram negatif.
2.6.1. Bakteri gram Negatif
- Mengandung “sedikit sekali” ikatan petidoglikan, kandungan lipid tinggi (11-22 %)
dan tidak terdapat ikatan benang-benang teichoic acid dan teichoronic acid
- Pada umumnya berbentuk batang (basil), kecuali Bacillusanthrasis dan
Bacillussereus
- Pada pewarnaan Gram, bakteri jenis ini tidak mampu berikatan dengan zat warna
utama yaitu Gentian Violet dan luntur bila dicelupkan ke dalam larutan alkohol
- Dibawah mikroskop tampak berwarna merah, apabila diberi zat warna
safranin/fusin .
Komponen-komponen dinding sel bakteri gram negatif (yang terletak di luar lapisan
peptidoglikan)
1. Lipoprotein
Berfungsi untuk menstabilkan membran luar dan merekatkanya ke lapisan
peptidoglikan.
Adalah struktur berlapis ganda, lapisan sebelah dalamnya memiliki komposisi yang
serupa dengan membran sitoplasma, sedangkan pada lapisan sebelah luar digantikan
oleh fosfolipid.
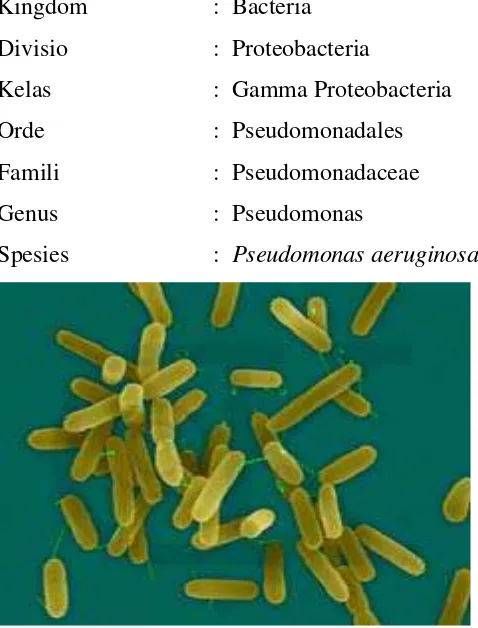
2.6.1.1. Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan famili Pseudomonacea sp memiliki sel berupa
batang lurus, kadang-kadang serupa dengan bola, bergerak dengan flagel yang
terdapat pada ujung.Pseudomonas aeruginosa kadang-kadang kedapatan di dalam
luka pada hewan atau manusia.Bakteri ini menyebabkan timbulnya nanah yang
kebiruan. Beberapa spesies yang lain dapat menyebabkan penyakit pada tanaman
(Irianto, 2007). Adapun klasifikasi Pseudomonas aeruginosasebagai berikut:
Kingdom : Bacteria
Divisio : Proteobacteria
Kelas : Gamma Proteobacteria
Orde : Pseudomonadales
Famili : Pseudomonadaceae
Genus : Pseudomonas
Spesies : Pseudomonas aeruginosa
Gambar 2.8. Bakteri Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri yang patogen dan merupakan
penyebab utama infeksi nosokomial di Rumah sakit Amerika yang sangat berbahaya.
yangditemukan di dalam perut 5 persen pada manusia sehat. Di rumah sakit, angka ini
meningkat menjadi 40 persen (Mckane and Kandel, 1996).
2.6.2. Bakteri Gram Positif
- Dinding sel mengandung peptidoglikan yang tebal, kandungan lipid rendah 1-4 %
serta diikuti pula dengan adanya ikatan benang-benang teichoic acid dan
teichoronic acid, yang merupakan 50% dari berat kering dinding sel dan 10% dari
berat kering keseluruhan sel.
- Pada umumnya berbentuk bulat (coccus)
- Pada pewarnaan Gram, bakteri jenis ini berikatan dengan warna utama (primary
Strain) yaitu Gentian Violet dan tidak luntur (decolorized) bila dicelupkan ke dalam
larutan alkohol.
- Dibawah mikroskop tampak berwarna ungu (Nasution, 2014)
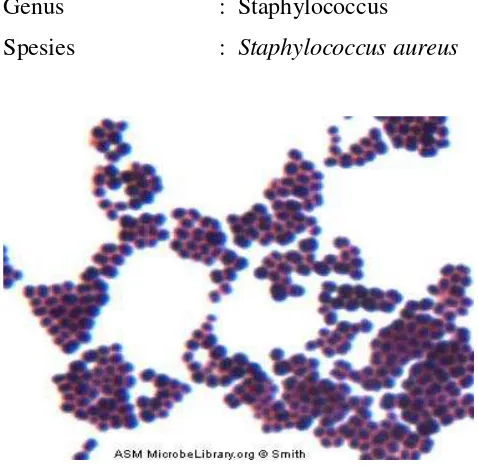
2.6.2.1.Staphylococcus aureus
Bakteri gram positif yang mengasilkan pigmen kuning, bersifat aerob dan anaerob
fakultatif hal ini membedakannya dari spesies lain. Staphylococcus aureus patogen
terutama bagi manusia, hampir semua orang akan mengalami beberapa tipe infeksi S.
aureus sepanjang hidupnya, beratnya mulai kerancunan makanan atau infeksi kulit
ringan, sampai infeksi berat yang mengancam jiwa. Suhu optimum pertumbuhan
Staphylococcus aureus adalah 35 0C- 37 0C suhu minimum 6,7 0C dan suhu
maksimum 45,4 0C. Bakteri ini dapat tumbuh pada pH 4,0- 9,8 pH optimum 7,0-7,5.
Staphylococcus aureus sering juga terdapat pada pori-pori dari permukaan kulit,
kelenjer keringat, dan saluran usus.Bakteri ini dapat menyebabkan bermacam-macam
infeksi seperti jerawat, bisul, meningitis, oteomielitis, pneumonia, dan mastitis, pada
manusia dan hewan (Nasution, 2014). Adapun klasifikasi Staphylococcus
aureussebagai berikut:
Kingdom : Monera
Divisio : Firmicuter
Kelas : Bacilli
Orde : Bacillales
Genus : Staphylococcus
Spesies : Staphylococcus aureus
Gambar 2.9.Bakteri Staphylococcus aureus
Staphylococcus aureus juga merupakan bakteri tidak bergerak, dan mampu
membentuk kapsul, berbentuk kokus dan tersusun seperti buah anggur.Ukuran
Staphylococcus berbeda-beda tergantung pada media pertumbuhanya. Apabila
ditumbuhkan dengan media agar, Staphylococcus memiliki diameter 0,5-1,0 mm
dengan koloni berwarna kuning. Dinding selnya mengandung asam teikoat, yaitu
sekitar 40% dari berat kering dinding selnya.Asam tekioat adalah beberapa kelompok
antigen dari Staphylococcus. Asam teikoat mengandung aglutinogen dan
N-asetilglukosamin (Rya and Ray, 2004).Staphylococcus mengandung polisakarida dan
protein, bersifat antigen yang merupakan substansi penting di dalam struktur dinding
2.7. Antibakteri
Senyawa antibakteri merupakan senyawa yang mempunyai kemampuan menghambat
pertumbuhan mikroorganisme, senyawa ini dapat berasal dari bagian tanaman
tumbuhan seperti daun, bunga, biji, buah, rimpang, batang dan umbi.Sebagian besar
senyawa antibakteri yang berasal dari tanaman diketahui merupakan metabolit
sekunder terutama dari golongan fenolik dan terpena dalam minyak atsiri.Beberapa
senyawa yang bersifat antibakteri dari tanaman diantaranya adalah fitoeleksin, asam
organik, minyak atsiri, fenolitik dan beberapa kelompok pigmen tanaman (Naufalin,
2005). Besar zona hambat antibakteri :
1. Diameter zona hambat < 8 mm = kurang sensitif
2. Diameter zona hambat 9-14 mm = sensitif
3. Diameter zona hambat 15-19 mm = sangat sensitif
4. Diameter zona hambat > 20 mm = luar biasa sensitif ( Ponce, at all,
BAB 3
METODE PENELITIAN
3.1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah :
Neraca analitis Mettler
Gelas ukur 50 mL Pyrex
Inkubator Fision
Kain kasa
Bahan-bahan yang digunakan dalam penelitian ini antara lain :
Daun pinus segar ( Pinus merkusii)
Etanol p.a. (E. Merck)
n-Heksana p.a. (E. Merck)
Dimetil sulfoksida p.a. (E. Merck)
Potassium Hydroxide (KOH) p.a. (E. Merck)
Na2SO4 Anhidrous p.a. (E. Merck)
Alkohol 70 %
Air suling
Nutrient Agar (NA)
Mueller Hinton Agar (MHA)
Nutrient Broth (NB)
Staphylococcus aureus
Minyak
Larutan Mc Farland
3.3. Prosedur Penelitian
3.3.1. Isolasi Minyak Atsiri Daun Pinus dengan Metode Hidrodestilasi
Sebanyak 200 g daun pinus segar yang telah dipotong-potong kecil dimasukkan ke
dalam labu destilasi 1000 mL, ditambahkan air suling 120 mL kemudian dirangkai
alat stahl dan dipanaskan selama 5 jam pada suhu ± 110-120 0C. Minyak atsiri yang
diperoleh dipisahkan kemudian ditambahkan dengan Na2SO4 anhidrous, didekantasi
dan diukur volume minyak atsiri yang diperoleh, dihitung persentasenya (dilakukan
secara triplo). Minyak atsiri yang diperoleh disimpan di lemari pendingin pada suhu
40C untuk digunakan selanjutnya. Minyak atsiri yang diperoleh dianalisis kandungan
kimianya dengan GC-MS dapat dilihat pada tabel 3.1 dan sifat antibakteri diuji
dengan metode difusi agar pada bakteri Staphylococcus aureus dan Pseudomonas
aeruginosa dengan konsentrasi 0,1%, 0,25%, 0,5%, 0,75%, 1% dalam pelarut dimetil
sulfoksida.
Tabel 3.1. Kondisi Alat GC-MS yang Digunakan untuk Analisis MinyakAtsiri Pinus
Nama alat Keterangan
Injection Temp. : 310.00 0C
Injection Mode : Split
Flow Control Mode : Pressure
Pressure : 13.7 kPa
3.3.2. Uji Sifat Antibakteri Minyak Atsiri Daun Pinus
3.3.2.1. Pembuatan Media Nutrien Agar (NA) dan Subkultur Bakteri
Sebanyak 5,6 gram media NA dimasukkan ke dalam gelas Erlenmeyer, dilarutkan
dengan 200 ml air suling yang diikuti dengan pemanasan dan pengadukan, lalu
disterilkan dalam autoclave pada suhu 1210 C selama 15 menit. Hasil yang diperoleh
sebanyak 3 mL dimasukkan ke dalam masing-masing tabung reaksi dan dibiarkan
memadat dalam posisi miring dengan sudut ± 30-450. Digoreskan bakteri
Staphylococcus aureus dan Pseudomonas aeruginosa yang berasal dari isolate secara
aseptik ke dalam masing-masing tabung reaksi. Diinkubasi selama 24 jam pada suhu
3.3.2.2. Pembuatan Media Mueller Hinton Agar ( MHA)
Sebanyak 7,6 gram media MHA dimasukkan kedalam gelas Erlenmeyer kemudian
dilarutkan dengan 200 mL air suling yang diikuti dengan pemanasan dan pengadukan,
lalu disterilkan di dalam autoclave pada suhu 1210 C selama 15 menit.
3.3.2.3. Pembuatan Media Natrium Broth (NB) dan Subkultur Bakteri
Sebanyak 1,3 gram media NB dimasukkan kedalam Erlenmeyer kemudian dilarutkan
dengan 100 mL air suling yang diikuti dengan pemanasan dan pengadukan, lalu
disterilkan di dalam autoclave pada 1210C selama 15 menit.
3.3.2.4. Pembuatan Suspensi Bakteri
Sebanyak 3 mL NB dimasukkan ke dalam masing-masing tabung reaksi kemudian
ditambahkan bakteri Staphylococcus aureus dan Pseudomonas aeruginosa yang sudah
di subkultur dengan jarum ose steril ke masing-masing tabung reaksi, hingga
kekeruhan NB sama dengan kekeruhan standar Mc Farland 108 .
3.3.3. Uji Sifat Antibakteri Minyak Atsiri Daun Pinus
Kedalam cawan petri berdiameter 9 cm dituangkan 10 mL MHA dan sebanyak 0,1
mL suspensi Staphylococcus aureus kemudian dihomogenkan dengan membentuk
angka delapan dibiarkan hingga memadat. Diletakkan kertas cakram yang terlebih
dahulu dibasahi oleh minyak atsiri daun Pinus merkusii 0,1%, 0,25%, 0,5%, 0,75%,
1% ke dalam cawan petri diatas media dan diinkubasi selama 24 jam pada suhu 30 0C.
Dilakukan perlakuan yang sama terhadap bakteri Pseudomonas aeruginosa.
Kemudian diukur zona bening yang ada disekitar kertas cakram dengan menggunakan
3.4. Pengenceran Minyak Atsiri Persentase minyak atsiri 1%
Minyak atsiri sebanyak 0,05 mLdipipet dari botol vial kemudian dimasukkan ke
dalam labu takar 5 mLdan ditambahkan dimetil sulfoksida hingga garis tanda
kemudian dihomogenkan
Persentase minyak atsiri 0,75 %
Sebanyak 3,75 mL larutan minyak atsiri 1% dimasukkan kedalam labu takar 5
mLkemudian ditambahkandimetil sulfoksida hingga garis tanda dan
dihomogenkan
Persentase minyak atsiri 0,5%
Sebanyak 3,3 mL larutan minyak atsiri 0,75 % dimasukkan ke dalam labu takar 5
mLkemudian ditambahkan dimetil sulfoksida hingga garis tanda dan
dihomogenkan
Persentase minyak atsiri 0,25 %
Sebanyak 2,5 mL larutan minyak atsiri 0,5% dimasukkan ke dalam labu takar 5
mLkemudian ditambahkan dimetil sulfoksida dan dihomogenkan
Persentase minyak atsiri 0,1%
Sebanyak 2 mL larutan minyak atsiri 0,25% dimasukkan ke dalam labu takar 5 mL
3.5. Bagan Penelitian
3.5.1. Isolasi Minyak Atsiri Daun Pinus dengan Alat Stahl
Dimasukkan ke dalam labu Stahl 1liter
Ditambahkan air suling 120 mL
Dirangkai alat Stahl
Dipanaskan hingga keluar uap air bersama minyak
Lapisan minyak Lapisan air
Dimasukkan ke dalam botol vial
Ditambahkan Na2SO4 anhidrous
Didekantasi
Minyak atsiri residu
Analisa GC-MS
3.5.2. Uji aktivitas antibakteri
3.5.2.1. Pembuatan Media Nutrien Agar (NA) Miring dan Stok Kultur Bakteri
3.5.2.2. Pembuatan Mueller Hinton Agar (MHA)
5,6 media NA
Dilarutkan dengan 200 mL air suling dalam erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121 0C selama 15
Media NA steril
Dituang kedalam tabung reaksi sebanyak 3 m
Dibiarkan pada temperatur kamar sampai memadat
pada posisi miring membentuk sudut 30°-45°
Diambil biakan bakteri Staphylococcus aureus dari
strain utama dengan jarum ose steril lalu digoreskan
Stok kultur bakteri Staphylococcus aureus
7,6 g Mueller Hinton Agar
Dilarutkan dengan 200 mL aquadest dalam erlenmeyer
Dipanasakan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15
menit
3.5.2.3. Penyiapan Inokulum Bakteri
3.4.2.4. Uji Aktivitas Antibakteri
1,3 g media Nutrient Broth (NB)
Dilarutkan dengan 100 mL aquadest dalam Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121° selama 15 menit
Media NB steril
Dimasukkan sebanyak 10 mL kedalam tabung reaksi
Diambil koloni bakteri Staphylococcus aureus dari stok kultur bakteri dengan jarum ose steril
Disuspensikan kedalam media Nutrient Broth (NB)
Diinokulasi pada suhu 35°C selama 3 jam
Dibandingkan kekeruhannya dengan standar Mc farland
Inokulum bakteri Staphylococcus aureus
0,1 ml inokulum bakteri
Dimasukkan kedalam cawan petri
Ditambahkan 15 mL MHA dengan suhu 45-50°C
Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan minyak atsiri daun pinus kedalam cawan petri yang telah berisi bakteri
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Hasil Isolasi Minyak Atsiri dari Daun Pinus (Pinus merkusii)
Isolasi minyak atsiri dari daun pinus dilakukan dengan metode hidrodestilasi
menggunakan alat Stahl dari sampel segar seberat 200 gram, jumlah rata-rata minyak
atsiri diperoleh sebanyak 0,36 mL dan kadar minyak atsiri daun pinus yang diperoleh
adalah 0,1531 % (b/b) ditentukan secara triplo seperti ditunjukkan pada tabel 4.1.
Tabel 4.1. Hasil Isolasi Minyak Atsiri Daun Pinus Melalui Hidrodestilasi No Berat Sampel (gram) Minyak Atsiri (mL) Persentase % (b/b)
1 200 0,37 0,155
2 200 0,36 0,151
3 200 0,35 0,147
Rata-rata 200 0,36 0,1531
4.1.2. Hasil Analisis Komponen Kimia Minyak Atsiri Daun Pinus dengan GC-MS
Minyak atsiri yang dihasilkan dari daun pinus segar secara hidrodestilasi
menggunakan alat Stahl dianalisis dengan Gas Chromatography-Massa Spectroscopy
(GC-MS). Hasil kromatogram analisis, dapat menunjukkan terdapatnya 23 puncak
yang menunjukkan adanya 23 senyawa yang terkandung di dalam minyak atsiri
tersebut (gambar 4.1). Jumlah senyawa yang teridentifikasi bila disesuaikan dengan
Gambar 4.1 Kromatogram Minyak Atsiri Daun Pinus
Tabel 4.2. Hasil Analisis GC-MS Minyak Atsiri Daun Pinus
4.1.3. Hasil Uji Aktivitas Antibakteri
Minyak atsiri daun pinus diencerkan dengan dimetil sulfoksida (DMSO) dengan
variasi konsentrasi 0,1 %; 0,25%; 0,5%; 0,75% dan 1% (v/v). Sifat antibakteri
minyak atsiri daun pinus menunjukkan zona hambat pada pertumbuhan bakteri gram
positif yaitu Staphylococcus aureus dan bakteri gram negatif yaitu Pseudomonas
aureginosa . Hasil pengujian sifat antibakteri minyak atsiri daun pinus terhadap
pertumbuhan bakteri Staphylococcus aureus dan Pseudomonas aeruginosa dengan
metode difusi agar ditunjukkan pada tabel 4.3.
Tabel 4.3. Hasil Uji Antibakteri oleh Minyak Atsiri Daun Pinus dengan Metode Difusi Agar
4.2. Pembahasan
4.2.1.Isolasi Minyak Atsiri Daun Pinus (Pinus merkusii)
Volume rata-rata minyak atsiri yang diperoleh dari daun pinus sebanyak 0,36 mL dari
berat sampel 200 gram daun pinus segar. Berat jenis rata-rata minyak atsiri secara
kuantitatif dari puncak masing-masing berat jenis komponen senyawa yang dominan
yakni: Limonen, α-Pinen, β-Kariofilen, β-Ocimene dan Germakren-d diperoleh sebesar 0,8507 g/cm3. Dengan demikian persentase minyak atsiri yang diperoleh
adalah 0,1531 %(b/b) secara triplo dengan perhitungan perhitungan berikut:
% kadar minyak atsiri = berat minyak atsiri
berat daun pinus × 100%
% kadar minyak atsiri = 0.3062 g
200 g × 100%
= 0,1531 %
Bakteri
Diameter Zona hambat yang terbentuk (mm)
Blanko
(DMSO)
0,1% 0,25% 0,5% 0,75% 1%
Staphylococcus aureus - - 7,65 7,90 8,50 9,50