commit to user
ISOLASI, IDENTIFIKASI DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAUN LEGUNDI
(Vitex trifolia Linn.)
Disusun oleh :
OKTAVIA YULIANTI
M 0306048
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
Desember, 2011
ISOLASI, IDENTIFIKASI DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAUN LEGUNDI (Vitex trifolia Linn.)
OKTAVIA YULIANTI
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret
ABSTRAK
Isolasi, identifikasi dan uji aktivitas antibakteri minyak atsiri daun legundi (Vitex trfolia
Linn) telah dilakukan. Minyak atsiri diisolasi dengan metode destilasi Stahl dan dianalisis
dengan GC-MS. Kadar minyak atsiri yang dihasilkan 0,2% (v/b). Komponen yang teridentifikasi
sebanyak 22 senyawa dari 34 senyawa yang terdeteksi. Minyak atsiri daun Vitex trifolia Linn.
Didominasi oleh senyawa golongan monoterpen (51,09%) Komponen utama penyusunnya adalah senyawa 1,8 sineol (18,94%), caryophyllen (15,81%), α-pinen (10,18%), sabinen (9,20%), α-terpineol asetat (7,98%), dan 3-sikloheksan-1-ol (5,33%). Aktivitas antibakteri dari
minyak atsiri diujikan pada 4 bakteri patogen (Staphylococcus epidermidis, Streptococcus
pyogenes, Proteus mirabilis dan Shigella flexneri). Minyak atsiri daun Vitex trifolia Linn. menunjukkan adanya aktivitas antibakteri terhadap 4 bakteri yang digunakan.
commit to user
ISOLATION, IDENTIFICATION AND ANTIBACTERIAL ACTIVITY OF ESSENTIAL OIL FROM Vitex trifolia Linn LEAVES
OKTAVIA YULIANTI
Department of Chemistry, Faculty of Mathematics and Science Sebelas Maret University
ABSTRACT
Isolation, identification and antibacterial activity of essential oil from Vitex trifolia Linn
leafes have been done. The essential oil was isolated by Stahl distillation method and analyzed
by gas chromatography and mass spectrometry (GC-MS). The yield of the essential oil was 0,2%
(v/w). Twenty-two components out of thirty-four were identified in the oil. The oil were predominantly composed of monoterpene hydrocarbons (51,09%). Major component in essential oil was 1,8-cineol (18,94%), caryophyllene (15,81%), pinene (10,18%), sabinene (9,20%), α-terpineol acetate (7,98%), and 3-sikloheksan-1-ol (5,33%). The antimicrobial activity of essential
oils was evaluated against four bacteria (Staphylococcus epidermidis, Streptococcus pyogenes,
Proteus mirabilis and Shigella flexneri). Results showed that oils moderate antibacterial activities.
commit to user
A. Latar Belakang Masalah
Indonesia adalah salah satu negara yang memiliki keanekaragaman hayati yang terdapat di dalam hutan tropika Indonesia (Hariana, 2008). Salah satu tanaman yang berpotensi sebagai obat adalah legundi. Tanaman legundi berpotensi untuk dikembangkan sebagai salah satu sumber fitofarmaka Indonesia (Agusta, 2000). Legundi (Vitex trifolia Linn.) merupakan tanaman yang sering digunakan sebagai obat tradisional oleh masyarakat Jawa, Sumatera dan Sulawesi. Daun tanaman ini sering digunakan untuk obat analgesik, antipiretik, obat luka, obat cacing, obat tipus, peluruh kencing, peluruh kentut, pereda kejang, menormalkan siklus haid dan pembunuh kuman (Sudarsono dkk, 2002).
Khasiat obat pada suatu tanaman umumnya ditentukan oleh kandungan metabolit sekundernya. Senyawa-senyawa golongan metabolit sekunder diantara lain flavonoid, terpenoid, alkaloid, dan steroid. Daun dan akar legundi mengandung alkaloida, saponin, flavonoida dan polifenol, di samping itu daunnya juga mengandung minyak atsiri (Hariana, 2008). Salah satu komponen kimia yang berkhasiat obat yang terdapat pada tumbuhan adalah minyak atsiri. Komponen utama dalam minyak atsiri merupakan golongan terpenoid jenis monoterpen dan sesquiterpen. Komponen tersebut mempunyai bioaktivitas sebagai antibakteri yang mempunyai kemampuan untuk menghambat atau membunuh pertumbuhan bakteri pathogen. Beberapa jenis bakteri yang akhir-akhir ini banyak menimbulkan penyakit yang mewabah antara lain : Shigella sp (Shigella flexneri), Proteus sp( Proteus mirabilis), Staphylococcus sp (Staphylococcus epidermidis), Streptococcus sp (Streptococcus pyogenes)
(Sadewo, 2005).
Pemilihan bakteri Staphylococcus epidermidis merupakan bakteri patogen pada kulit, daerah saluran pernapasan bagian atas dan bisa menyebabkan penyakit seperti sariawan, koreng, jerawat serta ekspektoran. Streptococcus pyogenes penyebab infeksi kulit permukaan yang bermula di tenggorokan atau kulit. Shigella flexneri menyebabkan disentri dan respon inflamasi pada kolon. Sedangkan Proteus mirabilis dapat menginfeksi saluran kencing, luka terbuka dan paru-paru yang sangat bersifat pathogen (Funke BR, 2004).
bakteri-commit to user
efektif dan relatif aman. Salah satu alternatifnya adalah dengan menggali dan mengembangkan obat terutama yang berasal dari bahan alam khususnya tumbuhan (Cowan, 1999).
Beberapa penelitian uji aktivitas antibakteri ekstrak dari tumbuhan Legundi telah banyak dilakukan. Daun legundi yang diekstrak dengan petroleum eter memberikan skrining positif untuk steroid dan terpenoid sedangkan ekstrak etanol dari daun legundi menunjukkan skrining positif untuk steroid, terpenoid, flavonoid, karbohidrat, senyawa fenol, tanin, saponin dan phytosterol (Hossain, 2001, S. Thenmozhi et. al., 2011). Geetha, A. et al., 2010 melakukan penelitian uji antibakteri terhadap ekstrak kloroform daun legundi dan memberikan hasil yang cukup baik untuk bakteri patogen seperti Pseudomonas aeruginosa, Klebsiella pneumonia dan Stapylococcus aureus. Pengujian antibakteri dari ekstrak
diklorometan daun legundi memberikan hasil yang efektif pada bakteri Staphylococcus aureus dan Streptococcus faecalis (Hernandez, 1999). B
Selama ini penelitian antibakteri daun legundi sebagian besar terfokus dalam bentuk ekstrak, sedangkan dalam bentuk minyak atsirinya belum banyak diteliti. Oleh karena itu, penelitian ini ditekankan pada isolasi, identifikasi komponen senyawa kimia dan uji aktivitas antibakteri minyak atsiri daun Legundi terhadap Staphylococcus epidermidis, Shigella flexneri, Streptococcus pyogenes dan Proteus mirabilis.
B. Perumusan Masalah
1. Identifikasi Masalah
Kadar dan komponen minyak atsiri dari suatu tumbuhan dipengaruhi oleh daerah tempat tumbuh serta pengambilan bagian tertentu dari tumbuhan. Pada umumnya legundi dapat tumbuh di daerah terbuka dan pegunungan, sedangkan dalam pengambilan bagian tertentu dari tumbuhan harus spesifik hal ini dikarenakan setiap bagian tumbuhan legundi terdiri atas akar, batang, daun, bunga, buah dan biji.
senyawa kimia tersebut. Identifikasi komponen senyawa kimia dalam minyak atsiri dapat dilakukan dengan analisis data dari Kromatografi Lapis Tipis (KLT), Kromatografi Gas (GC), dan Kromatografi Gas – Spektrofotometer Massa (GC-MS). Pemilihan instrumen yang tepat untuk analisis sangat penting dalam penentuan struktur senyawa kimia.
Identifikasi komponen kimia dan uji aktivitas antibakteri minyak atsiri, akan diperoleh informasi tentang senyawa aktif yang bersifat antibakteri berdasarkan penelitian-penelitian sebelumnya.
Jenis bakteri yang sesuai dengan khasiat daun legundi adalah termasuk golongan bakteri yang dapat menginfeksi kulit maupun saluran pencernaan. Bakteri yang berkaitan dengan penyakit infeksi kulit diantaranya Streptococcus pyogenes, Staphylococcus aereus, Pseudomonas aeruginosa dan Staphylococcus epidermidis. Sedangkan yang berkaitan infeksi
saluran pencernaan adalah Bacillus cereus, Shigella flexneri Proteus mirabilis dan Eschericia coli. Patogenitas dari setiap bakteri adalah berbeda sesuai dengan karakteristik
masing-masing bakteri.
Uji aktivitas antibakteri minyak atsiri dapat dilakukan dengan metode difusi, dilusi, dan turbidimetri. Pada metode difusi dapat dilakukan dengan difusi agar yaitu dengan menggunakan lubang (perforasi) dan gores silang. Uji banding potensi minyak atsiri dan antibiotik sintetis dapat dilakukan dengan membuat kurva antara log konsentrasi kloramfenikol dan amoksisilin vs Diameter Daerah Hambat (DDH) atau dengan cara membuat kurva konsentrasi amoksisilin dan kloramfenikol vs Diameter Daerah Hambat (DDH). Kemudian dari persamaan garis linier kurva dapat ditentukan nilai bandingnya.
2. Batasan Masalah
Isolasi, identifikasi dan uji antibakteri minyak atsiri daun legundi (Vitex trifolia Linn) masalah dibatasi sebagai berikut:
a. Bagian tanaman legundi yang digunakan adalah daunnya, yang diperoleh dari daerah Magelang, Jawa Tengah
b. Isolasi minyak atsiri dilakukan dengan metode destilasi stahl
commit to user
e. Metode uji banding potensi minyak atsiri terhadap antibiotik amoksisilin dan kloramfenikol dilakukan dengan membuat kurva log konsentrasi vs Diameter Daerah Hambat (DDH) dari kedua antibiotik tersebut.
3. Rumusan Masalah
1. Berapakah kadar minyak atsiri daun legundi yang diisolasi dengan metode destilasi stahl?
2. Apakah minyak atsiri daun legundi mempunyai aktivitas terhadap bakteri Staphylococcus epidermidis, Streptococcus pyogenes, Proteus mirabilis, Shigella
flexneri ?
3. Komponen senyawa kimia apa saja yang dapat teridentifikasi dan bersifat aktif antibakteri dalam minyak atsiri daun legundi?
4. Bagaimana potensi antibakteri minyak atsiri daun legundi terhadap antibiotik amoksisilin dan kloramfenikol?
C. Tujuan Penelitian
1. Mengetahui kadar minyak atsiri daun legundi dengan metode stahl
2. Mengetahui aktivitas antibakteri minyak atsiri daun legundi terhadap bakteri Staphylococcus epidermidis, Streptococcus pyogenese, Proteus mirabilis dan Shigella
flexneri
3. Mengetahui komponen kimia dari minyak atsiri daun legundi dengan analisa data GC – MS dan menentukan komponen yang aktif antibakteri
commit to user BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Legundi ( Vitex trifoia Linn)
Tanaman suku Vitex (Verbenaceae) diperkirakan ada 270 species dari
tanaman dan semak belukar yang diketahui yang tersebar di daerah tropis dan
sub-tropis, meskipun hanya sedikit spesies yang ditemukan di daerah berhawa sedang.
Vitex trifolia Linn adalah tanaman semak belukar atau perdu pohon kecil, tumbuh
menjadi liar di Jawa hingga kurang lebih 1000 m di atas permukaan laut. Daunnya
yang berbau aromatis sering digunakan untuk tanaman obat maupun tanaman
pagar (Haryanto, 2009). Tanaman legundi ditunjukkan pada gambar 1.
a. Klasifikasi tanaman
Tanaman legundi (Gambar 1) ini merupakan famili Verbenaceae.
Kedudukan tanaman legundi dalam taksonomi tumbuhan adalah sebagai berikut:
1. Divisi : Spermatophyta
2. Sub divisi : Angiospermae
3. Kelas : Dicotyledonae
4. Bangsa : Solanales
5. Suku : Verbenaceae
6. Marga : Vitex
7. Jenis : Vitex trifolia Linn.
b. Deskripsi tanaman
Tanaman legundi ditunjukkan pada gambar 1.
Legundi merupakan pohon jarang sebagai semak merayap. Waktu
berbunga Januari – Desember, daerah distribusi, habitat dan budidaya di Jawa
tumbuh di daerah dengan ketinggian 11100 m dpl, pada umumnya tumbuh liar
pada daerah hutan jati, hutan sekunder, di tepi jalan dan pematang sawah.
Perbanyakan dapat dilakukan dengan biji atau stek batang, jika menggunakan stek
batang sebaiknya diambil dari batang yang tidak terlalu muda. Tumbuhan ini
mudah tumbuh di segala jenis tanah, namun lebih menyukai tempat yang agak
kering dan pada daerah yang terbuka. Tumbuh dengan baik pada media tumbuh
yang terdiri dari campuran pasir, pupuk kandang dan lempung (Thomas, 1996).
c. Kandungan kimia
Daun legundi (Vitex trifolia Linn) mengandung alkaloida, saponin,
flavonoida dan polifenol, di samping itu daunnya juga mengandung minyak atsiri
(Hariana, 2008). Menurut penelitian Ono, Maseteru et al. (2001) dari ekstrak buah
legundi ditemukan kandungan diterpen-haliman baru yang diberi nama
vitetrifolins D-G. Beberapa kandungan kimia lain dalam legundi diantaranya
kamphen, L-α-pinen, silexicarpin, casticin, terpenil asetat, luteolin-7-glukosida,
flavopurposida, vitrisin, dihidroksi asam benzoat dan vitamin A (Haryanto, 2009).
Daun legundi berkhasiat sebagai analgesik, antipiretik, obat luka, peluruh
kencing, peluruh kentut, pereda kejang, menormalkan siklus haid, germicide
(pembunuh kuman), batuk kering, batuk rejan beri-beri, sakit tenggorokan,
muntah darah, obat cacing, demam nifas, sakit kepala, TBC, turun peranakan,
tipus, dan peluruh keringat. Pada pemakaian luar, digunakan untuk mengatasi
eksim dan kurap (Sudarsono dkk, 2002).
2. Minyak Atsiri
Minyak atsiri merupakan salah satu hasil metabolit sekunder yang
dihasilkan oleh tanaman, bersifat mudah menguap pada suhu kamar, mempunyai
rasa getir, serta berbau wangi sesuai dengan bau tanaman penghasilnya
(Sudaryanti dan Sugiharti, 1990).
commit to user
dapat digunakan sebagai bahan pewangi, bahkan beberapa jenis minyak atsiri
mampu bertindak sebagai bahan aroma terapi atau bahan obat suatu jenis
penyakit. Pada industri farmasi, minyak atsiri dimanfaatkan karena berkhasiat
sebagai karminatif, anestesi lokal dan analgesik. Sedangkan dalam industri
makanan dan minuman, minyak atsiri digunakan untuk memberikan rasa dan
aroma yang khas (Yuliani, 2006). Minyak atsiri beberapa tanaman juga terbukti
bersifat aktif sebagai antibakteri (Inouye et al., 2001; Chandarana et al., 2005).
Kegunaan minyak atsiri bagi tanaman sendiri adalah untuk menarik serangga,
membantu proses penyerbukan dan mencegah kerusakan tanaman oleh serangga.
Secara kimia minyak atsiri bukan merupakan senyawa tunggal, tetapi
tersusun dari berbagai macam komponen yang secara garis besar terdiri dari
kelompok terpenoid dan fenil propanoid (Padmawinata, 1987). Senyawa terpenoid
dibangun dari unit isoprena yang dibentuk dari asam asetat melalui jalur asam
mevalonat dan rantai samping sehingga membentuk C5 yang memiliki dua ikatan
ganda sedangkan fenilpropanoid terbentuk dari asam amino melalui jalur
biosintesis asam sikimat (Agusta, 2000).
Senyawa terpenoid tersusun dari dua unit isoprena atau lebih yang
bergabung menurut kaidah kepala - ekor (Agusta, 2000). Penyusun minyak atsiri
dari kelompok terpenoid terdiri dari monoterpenoid dan seskuiterpenoid dengan
titik didih berbeda. Titik didih monoterpenoid 140-180 ºC dan titik didih
seskuiterpenoid lebih dari 200 ºC (Padmawinata, 1987). Turunan terpenoid dapat
berupa terpen siklik maupun asiklik, masing-masing dapat memiliki percabangan,
gugus-gugus ester, alkohol, aldehida, dan keton. Sementara kelompok fenil
propanoid juga memiliki percabangan rantai berupa gugus-gugus fenol (Gunawan,
2004).
Lintasan biosintesis dari berbagai kelompok senyawa telah dibukukan
demikian pula prekursor atau senyawa induk dan zat antara telah diidentifikasi.
Reaksi yang dikatalisis oleh enzim dalam sel telah dipindahkan dalam pekerjaan
in vitro dan mekanismenya dapat dikorelasikan dengan mekanisme reaksi organik
yang telah diketahui. Sebagian besar dan berbagai khas senyawa organik bahan
yang mencakup mono, seskui, di, tri dan senyawa politerpenoid. Nama terpen
diberikan terhadap senyawa yang mempunyai perumusan molekul C10H16 yang
secara etimologi berasal dari pohon terebinth, Pistacia terebinthus.
Senyawa terpenoid dikaitkan terhadap bentuk strukturnya. Komposisi
senyawa terpenoid (C10, C15, C20, C30, dan sebagainya) dapat dipandang merupakan
kelipatan satuan lima-atom karbon dan satuan tersebut mempunyai kerangka
karbon isopentil (Sastrohamidjojo, 1996). Penemuan peranan asam mevalonat
(asam 3-metil-3,5 dihidroksi pentanoat) dalam biosintesis senyawa steroid
membuka jalan para peneliti untuk menguak sintesis segala senyawa terpenoid.
Asam mevalonat, senyawa enam-atom karbon yang diturunkan dari kondensasi
tiga molekul asam asetat merupakan progenitor pokok dan universal senyawa
terpenoid yang membentuk “satuan isoprena” dengan cara pelepasan air dan
karbondioksida secara bersamaan (Sastrohamidjojo, 1996). Hanya bentuk R dari
asam mevalonat yang digunakan oleh organisme untuk memproduksi terpena,
sedang yang bentuk S, bersifat metabolik inert. Hal ini menguntungkan, karena
resolusi optik dari rasemat yang diperoleh dari sintesis sangat sukar dilaksanakan
(Manitto, 1992).
Asam asetat, atau turunannya asetil Ko-A, merupakan satu-satunya sumber
atom karbon dari asam mevalonat (Manitto, 1992). Asetil Ko-A, juga dikenal
dengan asam asetat teraktivasi, merupakan prekursor biogenetik dari terpena.
Dengan kondensasi Claissen, 2 asetil Ko-A berpasangan dengan asetil Ko-A, yang
menunjukkan analog biologi asetoasetat. Diikuti dengan reaksi aldol, asetoasetil
Ko-A bereaksi dengan asetil Ko-A sebagai karbon nukleofil untuk menghasilkan
β-hidroksi-β-metilglutaril Ko-A, diikuti dengan reduksi enzimatik dengan
dihidronikotinamida adenin dinukleotida (NADPH + H+) dalam air, menyerang
(R)-asam mevalonat. Fosforilasi asam mevalonat oleh adenosin trifosfat (ATP)
melalui monofosfat menghasilkan difosfat asam mevalonat yang terdekarboksilasi
dan terhidrasi ke isopentenilpirofosfat (isopentenildifosfat,IPP). Isomerasi
menghasilkan isomer γ,γ-dimetilalilpirofosfat. Gugus elektrofil afilik CH2 dari
commit to user
monoterpen. Reaksi lanjut dari geranildifosfat dengan isopentenildifosfat
menghasilkan farnesildifosfat sebagai seskuiterpen. Unit isoprena dapat
ditunjukkan oleh Gambar 2.
Gambar 2. Unit Isoprena
Penggabungan terjadi karena serangan elektron dari ikatan rangkap IPP
terhadap atom karbon dari DMAPP yang kekurangan elektron, diikuti
penghilangan ion pirofosfat yang menghasilkan geranil pirofosfat (GPP), yaitu
senyawa prekursor bagi monoterpenoid. Penggabungan selanjutnya antara satu
unit IPP dan GPP dengan mekanisme yang sama, menghasilkan farnesil pirofosfat
(FPP) yang merupakan senyawa prekursor bagi seskuiterpen (Lenny, 2006).
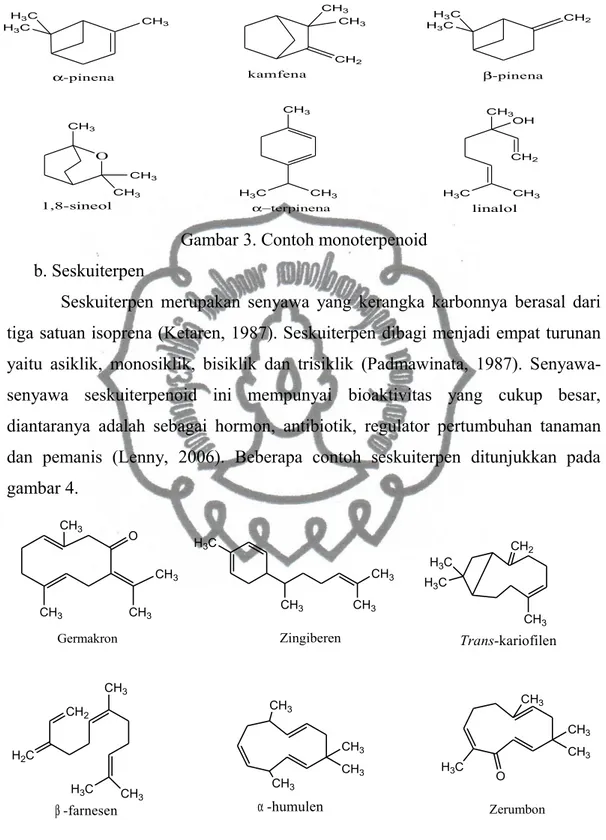
a. Monoterpen
Monoterpenoid memiliki bau yang spesifik, dibangun oleh dua unit
isoprena atau dengan jumlah atom karbon 10 (Lenny, 2006). Monoterpenoid
berupa cairan tak berwarna, tidak larut dalam air, dan berbau harum. Dasar
kerangka monoterpenoid dapat dibagi menjadi rantai terbuka (asiklik),
sikloheksana (monosiklik dan bisiklik). Senyawa monoterpenoid dapat
dimanfaatkan sebagai antibiotik, ekspektoran dan sedatif. Selain itu,
monoterpenoid juga banyak dimanfaatkan sebagai pemberi aroma makanan dan
CH3
Seskuiterpen merupakan senyawa yang kerangka karbonnya berasal dari
tiga satuan isoprena (Ketaren, 1987). Seskuiterpen dibagi menjadi empat turunan
yaitu asiklik, monosiklik, bisiklik dan trisiklik (Padmawinata, 1987).
commit to user
3. Isolasi Minyak Atsiri
Proses isolasi minyak atsiri adalah proses pemisahan minyak atsiri dari
tanaman aromatik. Proses ini meliputi penanganan produk yang bersifat padat dan
persiapan bahan dengan menjaga agar keadaan bahan cukup baik sehingga
minyak atsiri yang dihasilkan dapat dijamin mutunya (Ketaren, 1987).
Perajangan, pelayuan atau pengeringan dan penyimpanan merupakan
perlakuan yang sering dilakukan sebelum destilasi. Perajangan bertujuan agar
kelenjar minyak dapat terbuka sebanyak mungkin, sehingga memudahkan
penguapan minyak atsiri dalam herba saat destilasi berlangsung, karena minyak
atsiri dikelilingi oleh kelenjar minyak, pembuluh-pembuluh dan kantung minyak.
Apabila dibiarkan utuh, maka minyak atsiri tidak dapat terisolasi secara maksimal
karena minyak atsiri hanya dapat diekstrak bila uap air berhasil melalui jaringan
tumbuhan dan mendesak ke permukaan dengan perlahan. Pengeringan bertujuan
untuk menjamin keawetan, mencegah tumbuhnya jamur, kerja enzim dan bakteri.
Proses pengeringan dan penyimpanan mempengaruhi kehilangan minyak atsiri.
Sebagian minyak atsiri dalam bahan akan menguap selama pengeringan.
Kehilangan minyak atsiri selama proses pengeringan lebih besar dibanding pada
saat penyimpanan, karena pada saat pengeringan tumbuhan masih mengandung
sebagian besar air dalam sel dan dengan proses difusi akan membawa minyak ke
permukaan, kemudian menguap. Kehilangan minyak atsiri ini dapat diminimalisir
dengan menyuling bahan dengan segera. Apabila bahan harus disimpan sebelum
didestilasi, maka penyimpanan dilakukan pada udara kering yang bersuhu rendah
dan udara tidak disirkulasikan sehingga dapat mengurangi penguapan minyak dari
bahan. Penyusutan minyak selama penyimpanan dalam udara kering tergantung
dari beberapa faktor yaitu: kondisi bahan, metode penyimpanan, dan lama
penyimpanan serta komposisi kimia minyak atsiri dalam bahan (Ketaren, 1987).
Minyak atsiri dapat diisolasi dengan metode destilasi. Destilasi adalah
suatu proses yang terdiri atas beberapa tahap yang mengubah suatu senyawa
menjadi bentuk uapnya, mengkondensasikan uap yang terbentuk menjadi cair
kembali dan menampung hasil kondensasi ke dalam suatu penampung (Kristanti,
atau padatan dari dua macam campuran atau lebih berdasarkan perbedaan titik
didih. Pengambilan minyak atsiri dengan penyulingan dipengaruhi oleh tiga faktor
yaitu: besarnya tekanan uap yang digunakan, bobot molekul masing-masing
komponen dalam minyak atsiri dan kecepatan keluarnya minyak atsiri dari
simplisia (Ketaren, 1987). Metode destilasi minyak atsiri ada tiga macam yaitu:
destilasi dengan air, destilasi dengan uap dan destilasi uap dan air. Prinsip metode
destilasi dengan air (hidrodestilasi) adalah bahan yang akan didestilasi kontak
langsung dengan air mendidih. Bahan tersebut mengapung di atas air atau
terendam secara sempurna, tergantung dari berat jenis dan jumlah bahan yang
didestilasi. Peristiwa pokok yang terjadi pada proses hidrodestilasi, yaitu: difusi
minyak atsiri dan air panas melalui membran tanaman, hidrolisa terhadap
beberapa komponen minyak atsiri dan dekomposisi yang disebabkan oleh panas.
Proses hidrodestilasi bahan dan kecepatan penguapan minyak tidak hanya
dipengaruhi oleh sifat menguapnya komponen-komponen minyak atsiri,
melainkan juga dipengaruhi oleh derajat kelarutannya dalam air. Kelemahan
metode destilasi dengan air adalah adanya air dalam jumlah besar dan pada suhu
tinggi menyebabkan proses hidrolisa relatif lebih ekstensif, akibatnya rendemen
minyak atsiri yang dihasilkan akan berkurang sedangkan keuntungannya adalah
metode destilasi dengan air baik untuk menyuling bunga-bunga atau bahan yang
mudah menggumpal jika terkena panas (Ketaren, 1987).
Destilasi Stahl merupakan metode yang sering digunakan untuk isolasi
minyak atsiri. Prinsip kerja destilasi Stahl sama dengan destilasi dengan air
(hidrodestilasi). Namun destilasi Stahl memiliki beberapa kelebihan. Kelebihan
penggunaan destilasi Stahl untuk isolasi minyak atsiri antara lain; minyak atsiri
yang dihasilkan tidak berhubungan langsung dengan udara luar sehingga tidak
mudah menguap dan volume minyak atsiri yang dihasilkan dapat langsung
diketahui jumlahnya karena alatnya dilengkapi dengan skala (Sastrohamidjojo,
commit to user
4. Kromatografi Gas – Spektroskopi Massa
Minyak atsiri yang memiliki komponen dengan porsi yang sangat besar
sedikit sekali ditemukan, kebanyakan mengandung campuran senyawa dengan
berbagai tipe. Karena itu analisis karakterisasi komponen minyak atsiri menjadi
masalah rumit, ditambah sifatnya yang mudah menguap pada suhu kamar. Jadi
untuk menganalisis minyak atsiri diperlukan suatu metode yang tepat
(Agusta,2000).
Perkembangan teknologi instrumentasi menghasilkan alat yang merupakan
gabungan dari dua sistem dengan prinsip dasar yang berbeda satu sama lainnya
tetapi dapat saling melengkapi, yaitu gabungan kromatografi gas dan
spektrofotoskopi massa. Peubah utama dalam GC adalah sifat fasa diam dalam
kolom dan suhu kerja. Keduanya diubah menurut keatsirian senyawa yang
dipisahkan. Pada fasa diam terjadi pemisahan komponen – komponen dan
cuplikan (Day, JR, 2001). Dasar kerjanya adalah partisi antara fase diam dan fase
gerak (gas). Jadi untuk pemisahan senyawa – senyawa organik berlaku aturan
“like dissolve like”. Polaritas dari komponen cuplikan harus sama dengan fase
diam untuk memperoleh pemisahan terbaik, sehingga senyawa polar akan terpisah
pada fasa diam yang polar dan senyawa non polar akan terpisah pada senyawa
diam yang bersifat non polar (Khopkar, 1990). Skema alat GC-MS ditunjukkan
pada Gambar 5.
1
2
Gambar 5. Skema alat GC – MS
Tempat gas pembawa
Pengatur aliran dan tekanan
3. Tempat injeksi
5. Detektor
spektrometer massa 4. Kolom
7. Thermostat
5. Bakteri
Bakteri merupakan mikrobia prokariotik uniseluler, termasuk kelas
schizomycetes, berkembang biak secara aseksual dengan pembelahan sel. Semua
bakteri memiliki struktur sel yang relatif sederhana. Struktur bakteri yang paling
penting adalah dinding sel (Jawetz, et al., 2005).
Bakteri adalah yang paling berkelimpahan dari semua organisme. Mereka
tersebar (berada di mana-mana) di tanah, air, dan sebagai simbiosis dari
organisme lain. Banyak bakteri merupakan patogen. Kebanyakan dari mereka
kecil, biasanya hanya berukuran 0,5-5 μm, meski ada jenis dapat menjangkau 0,3
mm dalam diameter (Thiomargarita). Mereka umumnya memiliki dinding sel
seperti sel hewan dan jamur tetapi dengan komposisi sangat berbeda
(peptidoglikan). Banyak yang bergerak menggunakan flagela, yang berbeda dalam
strukturnya dari flagela kelompok lain.
Tabel 1. Beberapa ciri bakteri gram positif dan gram negative.
commit to user
Klasifikasi bakteri yang digunakan untuk uji
1. Staphylococcus epidermidis
Gambar 6. Staphylococcus epidermidis
Klasifikasi Staphylococcus epidermidis adalah sebagai berikut :
Kingdom : Bacteria
Phylum : Firmicutes
Class : Bacilli
Order : Bacillales
Family : Staphylococcaceae
Genus : Staphylococcus
Spesies : Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri yang berasal dari genus
Staphylococcus. Staphylococcus epidermidis merupakan agen infeksi yang dapat
menyerang setiap jaringan dan organ tubuh.
Staphylococcus epidermidis adalah salah satu spesies bakteri dari genus
Staphylococcus yang diketahui dapat menyebabkan infeksi oportunistik
(menyerang individu dengan sistem kekebalan tubuh yang lemah) (Jodi A, 2008).
Staphylococcus epidermidis adalah bakteri yang umumnya terdapat pada
kulit manusia yang kadang-kadang menyebabkan penyakit manusia. Infeksi yang
disebabkan oleh Staphylococcus epidermidis biasanya berhubungan dengan
alat-alat medis, seperti kateter dan sering terjadi pada orang dengan melemahkan
sistem kekebalan. Organisme ini biasanya resisten terhadap beberapa antibiotik
dan telah menjadi penyebab penting infeksi serius pada pasien rumah sakit
2. Streptococcus pyogenes
Gambar 7. Streptococcus pyogenes
Klasifikasi
Kingdom : Eubacteria
Phylum : Firmicutes
Class : Bacilli
Order : Lactobacillales
Family : Streptococcaceae
Genus : Streptococcus
Spesies : Streptococcus pyogenes
Streptococcus pyogenese ialah bakteri gram-positif bentuk bundar yang
tumbuh dalam rantai panjang. Streptococcus pyogenes adalah penyebab banyak
penyakit penting pada manusia yang berkisar dari infeksi kulit permukaan yang
ringan hingga penyakit sistemik yang mengancam hidup. Infeksi khasnya bermula
di tenggorokan atau kulit. Infeksi ringan Streptococcus pyogenes termasuk
faringitis ("radang kerongkongan") dan infeksi kulit setempat ("impetigo") (Ryan
KJ, Ray CG, 2004).
Infeksi akibat strain tertentu Streptococcus pyogenes bisa dikaitkan dengan
pelepasan toksin bakteri. Infeksi kerongkongan yang dihubungkan dengan
pelepasan toksin tertentu bisa menimbulkan penyakit jengkering (scarlet fever).
Infeksi toksigen Streptococcus pyogenes lainnya bisa menimbulkan sindrom syok
commit to user
3. Proteus mirabilis
Gambar 8. Bakteri Proteus mirabilis
Klasifikasi
Kingdom : Bacteria
Phylum : Proteobacteria
Class : Gamma Proteobacteria
Order : Enterobacteriales
Family : Enterobacteriaceae
Genus : Proteus
Species : Proteus mirabilis
Proteus mirabilis adalah bakteri gram negatif, dalam kultur muda yang
mengerumun di media padat, kebanyakan sel panjang, bengkok, dan seperti
filamen, mencapai 10 - 20, bahkan sampai panjang 80 µm. dalam kultur dewasa,
organisme ini tidak memiliki pengaturan karakteristik : mereka mungkin
terdistribusi tunggal, berpasangan atau rantai pendek. Jika bakteri ini memasuki
saluran kencing, luka terbuka, atau paru-paru akan menjadi bersifat patogen.
Perempuan muda lebih beresiko terkena daripada laki-laki muda, akan tetapi pria
dewasa lebih beresiko terkena daripada wanita dewasa karena berhubungan pula
dengan penyakit prostat. Proteus sering juga terdapat dalam daging busuk dan
sampah serta feses manusia dan hewan. Juga bisa ditemukan di tanah kebun atau
4. Shigella flexneri
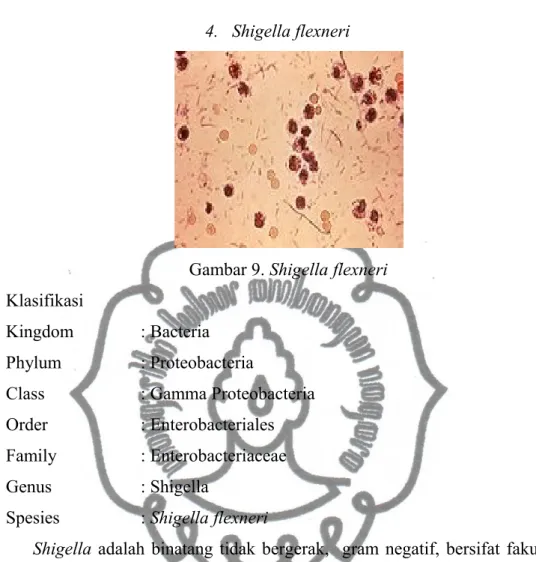
Gambar 9. Shigella flexneri
Klasifikasi
Kingdom : Bacteria
Phylum : Proteobacteria
Class : Gamma Proteobacteria
Order : Enterobacteriales
Family : Enterobacteriaceae
Genus : Shigella
Spesies : Shigella flexneri
Shigella adalah binatang tidak bergerak, gram negatif, bersifat fakultatif
anaerobik.Habitat alamiah Shigella terbatas pada saluran pencernaan manusia dan
primata lainnya dimana sejumlah spesies menimbulkan disentri basiler. Batang
ramping, tidak berkapsul, tidak bergerak, tidak membentuk spora, gram negatif.
Kuman ini sering ditemukan pada perbenihan diferensial karena
ketidakmampuannya meragikan laktosa (Anonim, 2008).
Shigella adalah penyakit yang ditularkan melalui makanan atau air.
Organisme Shigella menyebabkan disentri basiler dan menghasilkan respons
inflamasi pada kolon melalui enterotoksin dan invasi bakteri. Secara klasik,
Shigellosis timbul dengan gejala adanya nyeri abdomen, demam, BAB berdarah,
dan feses berlendir. Gejala awal terdiri dari demam, nyeri abdomen, dan diare
cair tanpa darah, kemudian feses berdarah setelah 3 – 5 hari kemudian (Procop,
commit to user
Pertumbuhan bakteri dipengaruhi oleh beberapa faktor. Menurut Pratiwi
(2008) faktor tersebut dapat dibedakan menjadi faktor fisika dan faktor kimia.
Faktor fisika yang mempengaruhi pertumbuhan bakteri adalah faktor kondisi
lingkungan hidup bakteri seperti temperatur, tekanan osmotik, pH dan oksigen.
Faktor kimia yang mempengaruhi pertumbuhan bakteri adalah
komponen-komponen kimia atau nutrisi dan media kultur (Jawetz, et al., 2005).
6. Antibiotik
Antibiotik adalah segolongan senyawa, baik alami maupun sintetik, yang
mempunyai efek menekan atau menghentikan suatu proses biokimia di dalam
organisme, khususnya dalam proses infeksi. Penggunaan antibiotika khususnya
berkaitan dengan pengobatan penyakit infeksi, meskipun dalam bioteknologi dan
rekayasa genetika juga digunakan sebagai alat seleksi terhadap mutan atau
transforman (Ritschel, 1976). Antibiotika berasal dari sumber–sumber berikut,
yaitu Actinomycetales (58,2%), jamur (18,1%), tanaman tinggi (12,1%),
Eubacteriales terutama Bacilli (7,7%), binatang (1,8%), Pseudomonales (1,2%)
dan ganggang atau lumut (0,9%) (Siswandono, Bambang Soekardjo, 2000).
Berdasarkan mekanisme kerjanya, antibiotik dapat dibagi menjadi empat
cara, yaitu :
1) Perusakan dinding sel
Sel bakteri dikelilingi oleh struktur yang kaku disebut dinding sel yang
melindungi membran protoplasma dibawahnya terhadap trauma baik osmotik
maupun mekanik (Chatim dan Suharto, 1994). Struktur dinding sel dapat dirusak
dengan cara menghambat pembentukannya atau mengubahnya setelah selesai
terbentuk (Pelczar, 1988). Dinding sel bakteri terdiri dari peptidoglikan dan
komponen yang lain. Sel yang aktif secara konstan akan mensintesis
peptidoglikan yang baru dan menempatkannya pada posisi yang tepat pada
amplop sel. Antibakteri bereaksi dengan satu atau banyak enzim yang dibutuhkan
pada proses sintesis, sehingga akan menyebabkan pembentukan dinding sel yang
2) Penghambatan terhadap fungsi membran sel
Sitoplasma semua sel hidup dibatasi oleh membran sitoplasma yang
berperan sebagai barrier permeabilitas selektif membawa fungsi transpor aktif dan
kemudian mengontrol komposisi internal sel. Antibakteri akan berikatan dengan
membran fospolipid yang menyebabkan pemecahan protein dan basa nitrogen
sehingga membran bakteri akan pecah yang menyebabkan kematian bakteri.
3) Penghambatan terhadap sintesis protein (penghambatan translasi
dan transkripsi material genetik)
Kebanyakan obat menghambat translasi atau sintesis protein, bereaksi
dengan ribosom-mRNA. Walaupun manusia mempunyai ribosom, tetapi ribosom
eukariotik berbeda dalam ukuran dan struktur dari prokariotik, sehingga
menyebabkan aksi yang selektif terhadap bakteri, bakteri mempunyai 70S
ribosom, sedangkan sel mamalia mempunyai 80S ribosom. Subunit
masing-masing tipe ribosom, komposisi kimianya, dan spesifikasi fungsinya berbeda, bisa
untuk menerangkan mengapa antibakteri dapat menghambat sintesis protein
dalam ribosom bakteri tanpa berpengaruh pada ribosom mamalia.
4) Penghambatan terhadap sintesis asam nukleat.
Pembentukan DNA dan RNA bakteri merupakan perjalanan yang panjang
dan membutuhkan enzim di beberapa proses. Penghambatan proses pembentukan
dapat terjadi pada tempat-tempat tertentu. Antibakteri menginteferensi sintesis
asam nukleat dengan menghambat sintesis nukleitida, menghambat replikasi, atau
menghentikan transkripsi. Karena pembentukan DNA dan RNA sangat penting
dan berefek dalam metabolisme protein, obat akan berikatan sangat kuat pada
enzim DNA Dependent RNA Polymerase bakteri. Jadi ini menghambat sintesis
RNA bakteri (Jawetz, et al, 2005).
Penggolongan antibiotika berdasarkan spektrum aktivitasnya :
1. Antibiotik dengan spektrum luas, efektif baik terhadap bakteri
gram positif maupun gram negatif, contohnya : turunan tetrasiklin, turunan
amfenikol, turunan amino glikosida, turunan makrolida, rifampisin, beberapa
commit to user
hetasilin, pivampisilin, sulbesilin dan tikarsilin, dan sebagian besar turunan
sefalosporin.
2. Antibiotika yang aktivitasnya lebih dominan terhadap bakteri gram
positif, contoh : basitrasin, eritromisin, sebagian besar turunan penisilin,
seperti benzilpenisilin, penisilin G prokain, penisilin V, fenitisilin K, metisilin
Na, nafsilin Na, oksasilin Na, kloksasilin Na, dikloksasilin Na dan floksasilin
Na, turunan linkosamida, asam fusidat dan beberapa turunan sefalosporin.
3. Antibiotika yang aktivitasnya lebih dominan terhadap bakteri gram
negatif, contoh : kolistin, polimiksin B sulfat dan sulfomisin.
4. Antibiotika yang aktivitasnya lebih dominan terhadap
Mycobacteriae (antituberkulosis), contoh : streptomisin, kanamisin, sikloserin,
rifampisin, viomisin dan kapreomisin.
5. Antibiotika yang aktif terhadap jamur (antijamur), contoh :
griseofulvin dan antibiotika polien, seperti nistatin, amfoterisin B dan
kandisidin
6. Antibiotika yang aktif terhadap neoplasma (antikanker), contoh :
aktinomisin, bleomisin, daunorubisin, mitomisin dan mitramisin.
Berbagai jenis antibiotik sintetik telah dikembangkan untuk melawan
infeksi bakteri. Masing-masing golongan antibiotik sintetik mempunyai target
penghambatan yang berbeda. Antibiotik yang dapat mempengaruhi dinding sel
adalah penisilin, monobaktam, karbapenem, vankomisin, sefalosporin, isoniazid
dan basitrasin. Antibiotik sintetik yang dapat menghambat sintesis protein bakteri
adalah kloramfenikol, tetrasiklin, aminoglikosida, dan makrolida. Antibiotik yang
dapat menghambat fungsi membran sel adalah nistatin, dan polimiksin sedangkan
antibiotik yang dapat menghambat sintesis asam nukleat diantaranya quinolon dan
rifampin (Pratiwi, 2008).
Amoksisilin merupakan salah satu antibiotika semisintesik yang memiliki
spektrum luas dimana aktif terhadap bakteri gram positif maupun gram negatif.
Amoksisilin adalah antibiotik dengan spektrum luas, digunakan untuk pengobatan
infeksi pada saluran napas, saluran empedu, dan saluran seni, gonorhu,
tipoid. Amoksisilin adalah turunan penisilin yang tahan terhadap asam tetapi tidak
tahan terhadap penisilinase. Beberapa keuntungan dibanding ampisilin adalah
absorpsi obat dalam saluran cerna lebih sempurna, sehingga kadar darah dalam
plasma dan saluran seni lebih tinggi, absorpsi obat. Kadar darah maksimalnya
dicapai dalam 1 jam setelah pemberian oral, dengan paro waktu ± 1 jam. Dosis
oral : 250 -500mg 3 dd (Siswandono, Bambang Soekardjo. 2000).
HO
H N
O N
S NH2
COOH O
Gambar 10 . Struktur Amoksisilin
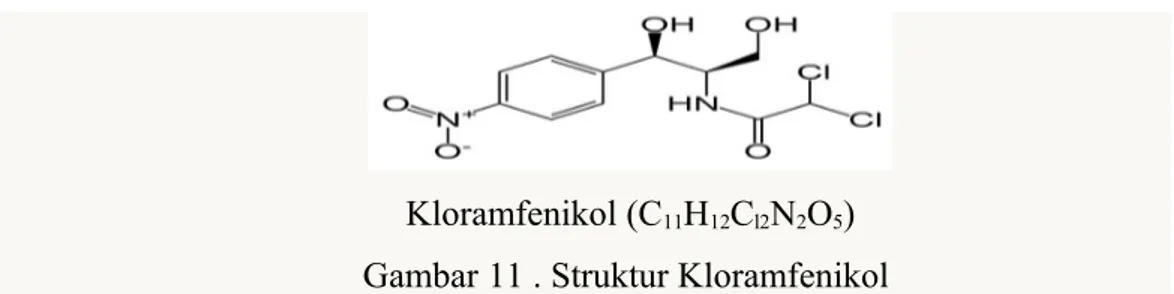
Disamping amoksisilin dapat digunakan kloramfenikol yang memiliki
spektrum luas dan aktif terhadap bakteri gram positif maupun gram negatif
maupun ricketsia, klamidia, spirokaeta dan mikoplasma. Mengenai indikasi
penggunaan kloramfenikol untuk mengobati tifus (demam tifoid) dan paratifoid,
infeksi berat karena Salmonella sp, H. influenza (terutama meningitis), rickettzia,
limfogranuloma, psitakosis, gastroenteristis, bruselosis, disentri. Kloramfenikol
masih merupakan pilihan utama kerana efektif, murah didapat dan dapat diberikan
secara oral (Anonim, 2000).
Kloramfenikol bekerja dengan jalan menghambat sintesis protein kuman.
Yang dihambat adalah enzim peptidil transferase yang berperan sebagai
katalisator untuk membentuk ikatan-ikatan peptida pada proses sintesis protein
kuman. Setelah pemberian oral, kloramfenikol diserap dengan cepat. Kadar
puncak dalam darah tercapai hingga 2 jam dalam darah. Dosis oral 50 mg/kg BB.
Penggunaan jangka panjang dapat menyebabkan superinfeksi atau pertumbuhan
berlebihan dari mikroorganisme yang tidak peka, termasuk jamur (Setyabudi,
2007)
commit to user
7. Metode Pengujian Aktivitas Antibakteri
Prinsip umum untuk menentukan aktivitas antibakteri adalah dengan
melihat adanya hambatan pertumbuhan bakteri. Zat antibakteri dapat diperoleh
dari hasil fermentasi, sintetik dan dapat diperoleh dari hasil isolasi dari tanaman.
Penapisan zat antibakteri dilakukan secara in vitro (Anonim, 1994). Metode yang
digunakan dalam pengujian antibakteri ini adalah metode difusi agar, substansi
antibakteri diletakkan pada media agar yang telah diinokulasi pada bakteri uji
sehingga antibakteri pada media agar akan berdifusi dan akan membentuk zona
bening disekitar substansi yaitu zona pertumbuhan yang dihambat. Berdasarkan
pada tujuan penggunaannya metode pengujian kepekaan senyawa antimikroba
dapat dibagi menjadi 3 jenis yaitu difusi, dilusi, dan kombinasi antara difusi dan
dilusi (Latitha, 2004).
Menurut Pratiwi (2008), pengujian aktivitas antibakteri dapat dilakukan
dengan metode sebagai berikut :
a. Metode difusi
1). Metode disc diffusion (tes Kirby & Bauer)
Piringan yang berisi sampel antibakteri diletakkan di atas permukaan agar
yang telah ditanami bakteri, diinkubasi selama 18-24 jam pada suhu 37oC
kemudian diamati pertumbuhan bakteri, area jernih di sekitar piringan
mengindikasikan adanya penghambatan pertumbuhan bakteri oleh sampel
antibakteri.
2). Metode E-test
Strip plastik yang mengandung sampel antibakteri dari kadar terendah
hingga tertinggi diletakkan pada permukaan media agar yang telah ditanami
bakteri, diinkubasi selama 18-24 jam pada suhu 37oC. Pengamatan dilakukan pada
area jernih disekitar strip plastik yang mengindikasikan adanya penghambatan
pertumbuhan bakteri oleh sampel antibakteri.
3). Ditch-plate technique
Pada metode ini sampel uji berupa sampel antibakteri diletakkan pada parit
yang dibuat dengan cara memotong media agar dalam cawan petri pada bagian
antibakteri, diinkubasi selama 18-24 jam pada suhu 37oC. Aktivitas antibakteri
ditunjukkan dengan daerah bening disekitar parit.
4). Cup-plate technique
Metode ini serupa dengan disc diffusion, dimana dibuat sumuran pada
media agar yang telah ditanami bakteri uji. Sampel antibakteri dimasukkan ke
dalam sumuran tersebut dengan jumlah tertentu dan konsentrasi tertentu pula.
Plate diinkubasi selama 18-24 jam pada suhu 37oC untuk memungkinkan agar
sampel antibakteri berdifusi pada permukaan media agar. Aktivitas antibakteri
ditunjukkan dengan daerah bening disekitar sumuran.
b. Metode Dilusi
1). Dilusi cair (broth dilution test)
Antibakteri disuspensikan pada media cair dengan pH 7-7,4 kemudian
dilakukan pengenceran dengan menggunakan beberapa tabung reaksi. Selanjutnya
dilakukan inokulasi bakteri uji yang telah disuspensikan dengan NaCl steril atau
dengan TSB, yang tiap milimeternya mengandung kurang lebih 105-106 bakteri.
Suspensi zat antibakteri dimasukkan ke dalam suspensi bakteri uji. Setelah itu,
diinkubasikan pada suhu 37oC selama 18-24 jam dan diamati pertumbuhan
bakteri. Pengamatan pertumbuhan bakteri berdasarkan pada kekeruhan suspensi.
Tabung yang keruh menunjukkan adanya pertumbuhan bakteri, sedangkan tabung
yang lebih bening menunjukkan bahwa zat antibakteri dapat menghambat
pertumbuhan bakteri yang diuji.
2). Dilusi padat (solid dilution test)
Zat antibakteri dicampur sampai homogen pada agar steril yang masih cair
dengan suhu serendah mungkin dengan menggunakan berbagai konsentrasi aktif,
larutan tersebut dituangkan ke dalam cawan petri steril kemudian setelah memadat
dioleskan bakteri uji pada permukaannya.
8.
Konsentrasi Hambat Minimum (KHM) dan Uji Potensi
Konsentrasi hambat minimum (KHM) adalah konsentrasi terkecil
commit to user
KHM sangat penting untuk menentukan dosis efektif terkecil dari obat dan
memberikan indek perbandingan dengan obat yang lain.
Uji potensi suatu sampel (zat antibakteri) bertujuan untuk mengetahui
grafik atau kurva standart dari zat pembanding, dimana logaritma konsentrasi zat
pembanding diplotkan terhadap sumbu x dan diameter daerah hambat diplotkan
terhadap sumbu y, sehingga diperoleh persamaan garis linier. Berdasarkan
persamaan garis linier tersebut, nilai diameter daerah hambat pada konsentrasi
yang telah ditetapkan disubtitusikan ke y maka akan diperoleh nilai x. Antilog
dari nilai x merupakan nilai konsentrasi sampel yang setara dengan zat
pembanding, sehingga dapat ditetapkan nilai uji banding sampel terhadap zat
pembanding, yaitu dengan menggunakan rumus sebagai berikut.
%
Minyak atsiri merupakan salah satu hasil metabolisme sekunder. Senyawa
golongan monoterpen dan seskuiterpen merupakan senyawa penyusun dominan
dalam minyak atsiri yang mempunyai bioaktivitas sebagai antibakteri. Proses
isolasi minyak atsiri dilakukan dengan destilasi stahl. Pemilihan metode stahl
lebih efisien bila dibandingkan dengan metode ekstraksi. Berdasarkan adanya
perbedaan metode pengambilan tersebut dimungkinkan akan berpengaruh
terhadap kadar senyawa golongan monoterpen dan sesquiterpen, sehingga akan
Uji aktivitas antibakteri dari ekstrak daun legundi telah dilakukan terhadap
beberapa bakteri gram positif dan gram negatif. Ekstrak petroleum eter dan
diklrometan dari daun legundi memberikan aktivitas tertinggi dibandingkan
ekstrak methanol, etanol maupun heksan (Hernandez dkk., 1999). Penelitian
Inouye dkk., (2001) menunjukkan bahwa senyawa terpenoid dari minyak atsiri
dari daun Piper batle seperti geraniol, mentol, terpinen-4-ol, linalool, kampor,
menton, D-limonen dan α-pinen memiliki aktivitas antibakteri. Berdasarkan
penelitian tersebut minyak atsiri daun legundi diduga memiliki aktivitas
penghambatan terhadap bakteri gram positif : Staphylococcus epidermidis,
Streptococcus pyogenes dan bakteri gram negatif: Proteus mirabilis, Shigella
flexneri.
Identifikasi komponen minyak atsiri daun legundi menggunakan analisa
data GC-MS. Dari data kromatogram diperoleh informasi jumlah senyawa yang
terdeteksi, sedangkan data spektra untuk mengidentifikasi struktur senyawa dalam
minyak atsiri daun legundi. Dari senyawa yang dapat diidentifikasi dapat
dilakukan penentuan senyawa aktif antibakteri berdasarkan data literatur
penelitian sebelumnya yang pernah dilakukan.
Uji aktivitas antibakteri dilakukan dengan metode difusi sehingga
diperoleh Diameter Daerah Hambat (DDH) kemudian dapat ditentukan
Konsentrasi Hambat Minimum (KHM). Hasil tersebut dapat digunakan untuk
mengetahui seberapa besar aktivitas antibakteri minyak atsiri daun legundi
terhadap masing-masing bakteri uji. Selain itu dilakukan uji banding antibakteri
minyak atsiri daun legundi terhadap pembanding sintetis yaitu amoksisilin dan
kloramfenikol. Hasil uji banding dapat digunakan untuk mengetahui seberapa
commit to user C. Hipotesis
1. Kadar minyak atsiri yang diperoleh dari metode stahl lebih banyak
dibandingkan metode ekstraksi
2. Minyak atsiri daun legundi berpotensi sebagai anti bakteri terhadap bakteri
patogen gram positif : Staphylococcus epidermidis, Streptococcus pyogenes, dan
bakteri gram negatif : Proteus mirabilis, Shigella flexneri
3. Komponen minyak atsiri daun legundi meliputi senyawa golongan
monoterpen dan seskuiterpen yang berpotensi sebagai antibakteri
4. Potensi antibakteri minyak atsiri daun legundi lebih kecil dibandingkan
commit to user
A. Metode Penelitian
Penelitian dilakukan dengan menggunakan metode eksperimental di laboratorium.
Isolasi minyak atsiri daun legundi (Vitex trifolia Linn) dilakukan dengan metode destilasi
stahl. Identifikasi komponen minyak atsiri dilakukan melalui pendekatan struktur dengan
metode spektrometri. Spektrometer yang digunakan merupakan gabungan kromatografi gas
dan spektrometer massa (GC-MS). Uji aktivitas minyak atsiri dilakukan dengan metode
difusi yang selanjutnya dilakukan penentuan KHM dan uji banding.
B. Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Oktober 2010 – Juni 2011 di Laboratorium Kimia
Dasar FMIPA UNS dan Sub. Lab. Biologi Laboratorium FMIPA UNS Surakarta.
C. Alat dan Bahan
1. Alat
Alat – alat yang digunakan sebagai berikut :
a. Destilasi stahl
b. Labu alas bulat 750 ml (pyrex)
c. Statif
d. Klem
e. Selang air
f. Timbangan elektrik (AND GF-300)
g. Heating mantel (J.P. SELETA., s.a)
h. Water pump
i. Gelas beker (pyrex)
j. Inkubator suhu 37°C (J.P. SELECTA Hotcold M)
k. Inkubator suhu 0 – 10 º C (J.P. SELECTA Hotcold M)
l. Gelas ukur 10 ml & 50 ml (pyrex)
m. Mikropipet 2µl - 20µl
n. Mikropipet 20µl - 200µl
commit to user s. Autoklaf (J.P. SELECTA Hotcold M)
t. Jarum ose
u. Spatula logam
v. Pembakar spirtus
w. GC-MS (QP2010S SHIMADZHU)
2. Bahan
a. Daun legundi dari daerah Magelang, Jawa Tengah
b. Na2SO4 anhidrous (Merck)
c. Aquades
d. Aquabidest
e. Kertas payung
f. Isolat Staphylococcus epidermidis (ATCC 1228)
g. Isolat Streptococcus pyogenes(ATCC 19430)
h. Isolat Proteus mirabilis (ATCC 12453)
i. Isolat Shigella flexneri (ATCC 91193)
j. Kapas
k. Alumunium foil
l. Media NA (Nutrien Agar) Merck
m. Media MHA (Muller Hinton Agar) Merck
n. Amoksisilin (Merck)
o. Kloramfenikol (Merck)
p. Alkohol 70%
q. Isopropil alkohol (Merck)
r. Buffer phosphat pH 7
Determinasi tanaman yang digunakan dalam penelitian ini dilakukan di bagian
Taksonomi Biologi, Fakultas Biologi Universitas Gadjah Mada. Determinasi berdasarkan
pada pengamatan ciri makroskopis tanaman legundi (Vitex trifolia Linn).
2. Persiapan sampel daun legundi
Daun Vitex trifolia Linn dibersihkan, dicuci, kemudian dikeringkan pada suhu kamar
atau diangin-anginkan kurang lebih 1 minggu. Daun Vitex trifolia Linn. kering kemudian
diserbuk kasar dengan blender.
3. Isolasi Minyak Atsiri
Sebanyak 100 gram simplisia daun legundi didestilasi stahl dengan ±500 ml aquades,
selama kurang lebih 4 jam hingga volume minyak atsiri tidak bertambah lagi. Selanjutnya
minyak atsiri dipisahkan. Minyak atsiri yang masih bercampur dengan sedikit air dihilangkan
dengan menambahkan Na2SO4 anhidrous sampai jenuh kemudian dipisahkan dan dihitung
kadarnya. Minyak atsiri yang diperoleh digunakan sebagai sampel untuk proses selanjutnya.
4. Kromatografi Gas-Spektrometer Massa (GC-MS)
Uji GC-MS dilakukan untuk mengidentifikasi komponen minyak atsiri daun legundi.
Kondisi alat GC-MS sebagai berikut:
Jenis pengion : EI (Electron Impact)
Jenis kolom : Rtx-5MS
Panjang kolom : 30 meter
Diameter kolom : 0,25 milimeter
Suhu kolom : 700C
commit to user
Alat yang digunakan untuk aktivitas antibakteri disterilkan dalam autoklaf dengan
temperatur 1210C selama kurang lebih 30 menit.
b). Pembuatan media agar miring
NA (Nutrien Agar) ditimbang sebanyak 1 g kemudian dilarutkan dalam 50 ml
aquades steril, dipanaskan diatas hotplate stirer sampai mendidih dan terbentuk larutan agar
yang berwarna kuning bening. Larutan agar tersebut dimasukkan ke dalam 10 tabung reaksi
masing-masing sebanyak 5 ml dan ditutup dengan kapas serta alumunium foil. Tabung yang
berisi agar disterilisasi pada suhu 121ºC selama 20 menit. Selanjutnya ditempatkan pada rak
miring dan didiamkan sampai padat pada suhu kamar.
c). Pembuatan biakan bakteri
Sebanyak 1 ose isolat bakteri ditempelkan pada media miring agar NA dengan pola
zig zag, masing-masing bakteri dibuat 3 biakan bakteri. Lakukan dalam keadaan steril pada
ruang isolasi dengan sinar UV. Kemudian inkubasi biakan pada suhu 37ºC selama 18-24 jam.
d). Uji antibakteri minyak atsiri
Sebanyak 5,1 gram MHA (Muller Hinton Agar) dilarutkan dalam aquades steril 150
ml, panaskan sampai kuning bening. Masukkan ke dalam botol duran masing – masing
sebanyak 15 ml. Siapkan aquabides steril untuk membuat bakteri dalam bentuk suspensi
dengan memasukkan 3 ml aquabides ke dalam tabung reaksi dan tutup rapat dengan kapas,
dengan catatan 1 tabung untuk 1 bakteri. Sterilisasi aquabides, cawan petri yang telah
dibungkus kertas, media MHA dalam erlenmeyer dan alat – alat yang dibutuhkan dalam uji
antibakteri (pervorator, tip, spatula, kapas) pada suhu 121ºC selama 20 menit.
Untuk membuat suspensi bakteri, ambil 1 ose bakteri kemudian masukkan dalam
aquabides steril dan divortex, sampai larutan keruh. Ambil 100 µl suspensi bakteri lalu taruh
dalam cawan petri yang steril. Ke dalam cawan petri yang berisi suspensi bakteri, kemudian
tuangkan media MHA steril dalam suhu tubuh sekitar 30 - 37ºC (tidak terlalu panas dan tidak
terlalu dingin), goyangkan cawan petri dengan pola angka delapan sehingga kedua larutan
tercampur rata. Diamkan campuran tersebut sampai beku (diamkan ±15 menit). Setelah itu,
buatlah lubang dengan ukuran 6 mm dengan alat pervorator dan spatula. Isikan lubang
tersebut dengan 20 µl sampel atau bahan yang diujikan. Bungkus kembali dengan kertas dan
inkubasi selama 18-24 jam pada suhu 37ºC.
diameter zona penghambatan sampel.
f). Penentuan Konsentrasi Hambat Minimum (KHM)
Minyak atsiri yang menunjukkan adanya penghambatan terhadap pertumbuhan
bakteri kemudian dibuat dengan variasi konsentrasi 75%, 50% dan 25% dengan pelarut
DMSO yang selanjutnya dilakukan uji antibakteri dari masing – masing konsentrasi untuk
mengetahui Konsentrasi Hambat Minimum (KHM). Kemudian dibandingkan dengan
pembandingnya yaitu amoksilin dan kloramfenikol yang diberi perlakuan sama dengan
sampel uji tetapi digunakan bufer fosfat pH 7 dan isopropil alkohol dalam pengencerannya.
E. Teknik Pengumpulan dan Analisis Data
Penelitian ini akan menghasilkan beberapa data. Dari isolasi minyak atsiri
menggunakan metode stahl akan diperoleh kadar minyak atsiri.
Kadar minyak atsiri dinyatakan sebagai berikut ( v/b % ) :
Dari data kromatogram GC diperoleh informasi jumlah senyawa yang terdeteksi dan
dari spektra GC–MS didapatkan struktur senyawa yang terdeteksi dalam minyak atsiri daun
legundi dengan membandingkan dengan data sekunder dari literatur.
Dari uji antibakteri dengan metode difusi akan didapat nilai diameter zona hambatan
pertumbuhan bakteri dan kemudian akan dibandingkan dengan zona hambat antibiotik
sintesis (amoksisilin dan kloramfenikol). Dari hasil yang diperoleh kemudian dibuat kurva
standar antara log konsentrasi (ppm) terhadap diameter hambatan (mm). Kurva ini digunakan
sebagai pembanding bagi sampel yang memiliki aktivitas antibakteri tertinggi dengan cara
commit to user
Pada uji potensi, aktivitas antibakteri minyak atsiri data dengan One-Way Anova dilanjutkan
analisa LSD. Analisa data dengan Anova bertujuan untuk menguji ada tidaknya perbedaan
secara signifikan diameter daya hambat diantara keempat bakteri uji dan juga perbedaan
secara signifikan diameter daya hambat masing-masing bakteri uji pada variasi konsentrasi.
Analisa LSD bertujuan untuk mengetahui adanya perbedaan signifikan diameter daya hambat
antara bakteri yang satu dengan yang lain dan juga antara konsentrasi yang satu dengan yang
BAB IV
HASIL DAN PEMBAHASAAN
A. Persiapan sampel
Daun Vitex trifolia Linn. dicuci pada air mengalir kemudian
diangin-anginkan sampai layu kurang lebih satu minggu. Proses pengeringan ini bertujuan
untuk mengurangi kadar air hingga kadar air dalam simplisia menjadi ≤ 10%,
sehingga dapat meminimalkan pertumbuhan jamur selama proses penyimpanan
simplisia.
Daun Vitex trifolia Linn. setengah kering diserbuk kasar sebelum
dilakukan penyulingan. Penghalusan simplisia bertujuan untuk membuka
kelenjar minyak sebanyak mungkin sehingga mempermudah penguapan minyak
atsiri saat proses destilasi. Hal ini dikarenakan minyak atsiri dikelilingi oleh
kelenjar minyak, pembuluh-pembuluh, dan kantung minyak. Apabila dibiarkan
utuh, maka proses difusi minyak atsiri berlangsung sangat lambat (Ketaren,
1987). Simplisia yang telah diserbuk sesegera mungkin didestilasi untuk
mengurangi kehilangan minyak atsiri sebelum proses isolasi.
B. Isolasi minyak atsiri
Isolasi minyak atsiri pada penelitian ini dilakukan dengan menggunakan
alat destilasi Stahl karena memiliki beberapa kelebihan antara lain: minyak atsiri
yang dihasilkan tidak berhubungan langsung dengan udara luar sehingga
kehilangan minyak atsiri selama proses penyulingan dapat diminimalkan. Selain
itu, volume minyak atsiri yang dihasilkan dapat langsung diketahui jumlahnya
karena alatnya dilengkapi dengan pipa skala.
Prinsip kerja destilasi Stahl sama dengan destilasi air (hidrodestilasi) yaitu
bahan yang didestilasi kontak langsung dengan air mendidih sehingga terjadi
hidrodifusi atau penembusan air pada jaringan-jaringan tanaman. Kelenjar yang
terpecah oleh uap air menyebabkan minyak atsiri lepas dan terbawa bersama-sama
uap air. Uap air yang membawa minyak atsiri tersebut kemudian didinginkan
commit to user
dengan natrium sulfat anhidrat untuk mengikat sisa-sisa air sehingga diperoleh
minyak atsiri. Minyak atsiri yang diperoleh dari hasil penelitian ini berupa cairan
berwarna kuning jernih dan berbau khas dengan kadar 0,20% (v/b). Hasil ini tidak
berbeda jauh dengan hasil penelitian sebelumnya yang dilakukan Shanosaki,.
Berdasarkan penelitiannya kadar minyak atsiri daun legundi (Vitex trifolia Linn)
yang berasal dari Jepang sebesar 0,11-0,28%. Kandungan minyak atsiri dalam
suatu bahan tergantung umur tanaman dan kandungan mineral tempat hidupnya.
Faktor fisika dan kimia juga dapat berpengaruh. Faktor fisika disebabkan oleh
proses pengeringan dan penyimpanan. Selama proses pengeringan, minyak atsiri
yang menguap lebih besar dibanding pada saat penyimpanan. Karena pada saat
pengeringan daun masih mengandung sebagian besar air di dalam sel dan dengan
proses difusi akan membawa minyak ke permukaan kemudian menguap karena
sinar matahari. Kadar dan mutu minyak juga dipengaruhi oleh keadaan geografis
tanaman itu tumbuh. Cara isolasi minyak atsiri juga berpengaruh dalam proses
mendapatkan minyak atsiri contohnya ukuran potongan daun juga berpengaruh
terhadap rendemen minyak atsiri legundi (Trisnowati,2008).
Menurut Ketaren (1987) lingkungan juga bisa mempengaruhi kadar dan
kualitas minyak yang dihasilkan. Penyimpanan pada tempat yang terbuka
menyebabkan sejumlah minyak akan menguap disertai pula oleh proses oksidasi
sehingga menyebabkan sejumlah minyak akan menguap disertai pula oleh proses
oksidasi sehingga menyebabkan penurunan mutu minyak tersebut. Faktor kimia
disebabkan oleh komponen dalam minyak atsiri sebagian terdiri dari senyawa
yang mengandung heteroatom oksigen seperti alkohol, aldehid, dan oksida
beberapa minyak atsiri bahkan mengandung senyawa-senyawa tersebut dalam
jumlah besar. Adanya heteroatom oksigen menyebabkan senyawa-senyawa
tersebut mudah terurai (Ketaren,1987).
C. Hasil Analisis Kromatografi Gas-Spektrometer Massa
Hasil analisis dengan GC-MS akan diperoleh dua data yaitu kromatrogram
yang berasal dari hasil analisis GC dan spektra massa dari hasil analisis MS. Hasil
puncak. Kromatogram GC minyak atsiri daun Vitex trifolia Linn. ditunjukkan
pada gambar 12.
Gambar 12. Kromatogram minyak atsiri daun Vitex trifolia Linn.
Identifikasi komponen lebih lanjut dilakukan dengan spektrometer massa,
dari hasil spektrometer massa akan diperoleh spektra massa dari masing-masing
puncak yang terdeteksi pada kromatogram GC. Analisa spektra massa didasarkan
pada nilai Similiarity Indeks (SI), base peak (puncak dasar), dan trend pecahan
spektra massa yang dibandingkan dengan spektra dari library yaitu Wiley
229.LIB. dan NIST12.LIB. Spektra massa senyawa yang teridentifikasi dan spektra
massa senyawa standar dari Wiley 229.LIB dan NIST12.LIB ditunjukkan pada
lampiran 4c.
Berikut ini beberapa contoh analisis spektra massa senyawa yang
terdeteksi dengan GC-MS yang terkandung dalam minyak atsiri daun Vitex
trifolia Linn. dan dibandingkan dengan spektra massa senyawa standar dari Wiley
226.LIB dan NIST12.LIB yang memiliki nilai SI > 90 serta mempunyai “base
peak” dan tren pecahan spektra massanya sesuai dengan data pembanding.
commit to user
Tabel 2. Data komponen kimia penyusun minyak atsiri daun legundi.
No Senyawa Waktu
retensi
Puncak
(% area)
SI BM Perkiraan senyawa
1 I 6,21 0,68 95 C10H16 α-tuyan
2 II 6,46 10,18 97 C10H16 α-pinen
3 III 7,49 9,20 95 C10H16 sabinen
4 IV 7,55 2,31 97 C10H16 β-pinen
5 V 7,85 0,60 96 C10H16 mirsen
6 VI 8,49 1,06 96 C10H16 α – terpinen
7 VII 8,97 18,94 97 C10H18O 1,8 sineol
8 VIII 9,51 1,90 96 C10H16 γ – terpinen
9 IX 10,14 0,45 97 C10H16 terpinolen
10 X 11,84 0,44 93 C10H18 α –terpineol
11 XI 12,06 5,33 95 C10H18O 3-sikloheksan-1-ol
12 XII 12,32 2,87 96 C13H22O2 linalil propionat
13 XIII 14,37 0,19 - - belum diketahui
14 XIV 14,37 7,98 96 C12H20O2 α-terpineol asetat
15 XV 16,13 15,81 96 C15H24 kariofilen
16 XVI 16,50 0,81 96 C15H24 α-humulen
17 XVII 16,87 0,53 93 C15H24 germakren
18 XVIII 17,39 0,41 92 C15H24 Δ-kadinen
19 XIX 18,29 1,04 95 C15H24O kariofilen oksida
20 XX 18,97 0,51 - - belum diketahui
21 XXI 19,14 0,31 - - belum diketahui
22 XXII 20,80 0,64 - - belum diketahui
23 XXIII 21,77 2,94 - - belum diketahui
24 XXIV 22,32 0,75 - - belum diketahui
25 XXV 22,53 3,98 - - belum diketahui
26 XXVI 22,73 4,70 - - belum diketahui
27 XXVII 22,91 2,91 - - belum diketahui
28 XXVIII 23,17 0,55 - - belum diketahui
29 XXIX 23,30 0,19 - - belum diketahui
30 XXX 23,76 0,29 - - belum diketahui
31 XXXI 23,92 0,40 - - belum diketahui
32 XXXII 24,19 0,56 - - belum diketahui
33 XXXIII 25,00 0,21 - - belum diketahui
34 XXXIV 25,82 0,32 - - belum diketahui
Beberapa struktur senyawa penyusun minyak atsiri daun legundi yang
α-tuyan α-pinen sabinen β-pinen
mirsen terpinen 1,8 sineol γ – terpinen
terpinolen α -terpineol 3-sikloheksan-1-ol linalil propionat
α-terpineol asetat kariofilen α-humulen germakren
Δ-kadinen kariofilen oksida
Gambar 13. Struktur senyawa penyusun minyak atsiri daun Legundi
Secara kimia, minyak atsiri terdiri dari golongan monoterpen dan
seskuiterpen yang berupa isoprena C10 dan C15 dengan titik didih yang berbeda
commit to user
Hasil identifikasi di atas menunjukkan bahwa komponen minyak atsiri
daun Vitex trifolia Linn. tersusun dari golongan monoterpen (51,09%) dan
seskuiterpen (30,22%). Komponen minyak atsiri daun Vitex trifolia Linn yang
tergolong monoterpen adalah α-tuyan, α-pinen, sabinen, β-pinen, mirsen, α–
terpinen, 1,8 sineol, γ–terpinen, terpinolen, , 3-sikloheksan-1-ol, linalil propionat,
α-terpineol asetat dan α–terpineol. Golongan seskuiterpen terdiri dari kariofilen
oksida, azulen, α-humulen, germakren, Δ-kadinen, kariofilen, dan α-kadinol.
Dari beberapa senyawa yang dapat terdeteksi dengan GC-MS ada 5
komponen utama penyusun minyak atsiri Vitex trifolia Linn. yang ditunjukkan
dengan presentase komponen diatas 5%. Komponen utama penyusunnya yaitu
sabinen (9,20%), α-pinen (10,18%), 1,8 sineol (18,94%), α-terpineol asetat
(7,98%), caryophylen (15,81%), dan 3-sikloheksan-1-ol (5,33%).
Hasil analisis GC-MS menunjukkan ada beberapa komponen yang sama
sebagai komponen minyak atsiri Vitex trifolia Linn. dari penelitian sebelumnya.
Komponennya sebagai berikut: α-pinen, α-humulen, terpinyl asetat, dan
kariofilen oksida (Pan et al,1989). Dan komponen yang terkandung dalam sampel
daun legundi (Vitex trifolia Linn.) dari Magelang Jawa Tengah lebih banyak
terdeteksi daripada penelitian sebelumnya.
Perbedaan hasil analisis GC-MS kedua minyak atsiri daun legundi ini
dapat disebabkan oleh beberapa faktor antara lain : perbedaan tempat/daerah
pengambilan sampel, perlakuan pasca panen misalnya pengeringan dan
penyimpanan, serta kondisi operasional alat yang digunakan dalam mendeteksi
komponen tersebut khususnya kolom yang digunakan. Salah satu perbedaan yang
sangat terlihat pada metode isolasi minyak atsiri daun legundi. Metode stahl yang
digunakan dalam penelitian ini dapat memisahkan senyawa golongan monoterpen
dan sesquiterpen lebih banyak dibandingkan metode ekstraksi yang telah
digunakan pada penelitian sebelumnya. Senyawa golongan monoterpen dan
sesquiterpen sangat dominan terkandung dalam minyak atsiri.
Analisis data GC-MS minyak atsiri daun legundi dari Magelang
menggunakan jenis kolom semipolar rastek RXi-5MS dengan panjang kolom