ISOLASI DAN IDENTIFIKASI SENYAWA
ANTIBAKTERI MINYAK ATSIRI DAUN ZODIA
(Evodia sp.)
AGNES ERI MARYUNI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Isolasi dan Identifikasi Senyawa
Antibakteri Minyak Atsiri Daun Zodia (Evodia sp.) adalah karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya
yag diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam
teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
Agnes Eri Maryuni
ABSTRACT
AGNES ERI MARYUNI. Isolation and Identification Antibacterial Active Compound from Zodia’s Essential Oil Leaves (Evodia sp.) Under direction of MARIA BINTANG and MASNIARI POELOENGAN.
Some plant essential oil compounds has antibacterial properties, such as linalool. Linalool was one of zodia’s essential oil compound. The aim of this research was to isolate and identificate antibacterial active compound of the essential oil of zodia leaves. The the major components of essential oil are evodone 72.32%, menthofurane 7.52%, limonene 4.73%, curcumene 4.28%, and fonenol 1.66%. The oil had wide spectrum antibaterial activities. MIC value are 1% against S. aureus, 0.8% against S. epidermidis, 1.25% against Salmonella enteritidis and 1.2% against E. coli. It’s bactericidal effect against S. aureus began on the 7th hours. Toxicity evaluation showed that the essential oil has moderately toxic properties. Essential oil decayed bacterial membran cell. The bacterial cell became “swell” and change to a “ghost cell”. The active identificated as evodone. It’s activity was lower than the oil. It indicated that the essential oil’s antibacterial activity was sinergestic effect from it’s compounds.
RINGKASAN
AGNES ERI MARYUNI. Isolasi dan Identifikasi Senyawa Antibakteri Minyak Atsiri Daun Zodia (Evodia sp.). Dibimbing oleh MARIA BINTANG dan MASNIARI POELOENGAN.
Sejak pertama kali ditemukan hingga akhir abad 20, kemoterapi antimikroba telah berhasil menyembuhkan berbagai jenis penyakit infeksi. Masalah muncul pada saat terjadi resistensi bakteri. Meskipun berbagai jenis antibiotik baru ditemukan, muncul masalah baru berkaitan dengan resistensi terhadap berbaai jenis antibiotik
Tumbuhan memghasilkan ribuan molekul yang berfungsi bagi tumbuhan itu sendiri maupun lingkungannya. Beberapa jenis komponen minyak atsiri menghasilkan aktivitas antibakteri. Penelitian ini bertujuan untuk menentukan potensi antibakteri minyak atsiri daun zodia, mengisolasi dan mengidentifikasi senyawa aktifnya.
Dalam penelitian ini, sampel daun zodia diambil dari daerah Sentani, Jayapura, Papua. Minyak atsiri diisolasi dengan menggunakan destilasi uap. Minyak atsiri yang dihasilkan dianalisis komponen penyusunnya dengan metode GC-MS. Uji antibakteri menggunakan metode paper dish assay. Uji toksisitas menggunakan metode Brine-Shrimp Letality Test. Nilai minimum inhibitory concentration (MIC) ditentukan untuk mengetahui konsentrasi paling kecil dari minyak atsiri yang dapat membunuh bakteri. Terhadap bakteri diinteraksikan berbagai variasi konsentrasi minyak atsiri. Bakteri disubkulturkan pada media padat kemudian jumlah koloni yang tumbuh dihitung. Waktu kontak minyak atsiri dengan bakteri ditentukan untuk mengetahui waktu munculnya efek bakterisida. Setelah diinteraksikan dengan minyak atsiri dengan konsentrasi dua kali nilai MIC, bakteri disubkulturkan pada media padat setiap jam selama 24 jam. Jumlah koloni bakteri dihitung selanjutnya dibuat kurva ”survival plot”. Data waktu kontak digunakan sebagai dasar waktu kontak bakteri yang akan dianalisis perubahan morfologinya dengan scanning electron microscopy.
Isolasi senyawa aktif antibakteri dilakukan dengan metode cooling freeze.
Minyak atsiri didinginkan sampai 180C. Kristal yang terbentuk dipisahkan kemudian direkristalisasi menggunakan pelarut heksan. Kristal hasil rekristalisasi dianalisis dengan GC-MS. Uji antibakteri kristal dilakukan terhadap bakteri S. aureus.
Isolasi minyak atsiri daun zodia menghasilkan rendemen 1%. Dari analisis GC-MS didapatkan bahwa komponen utama minyak atsiri adalah evodone 72.32%, menthofurane 7.52%, limonene 4.73%, curcumene 4.28%, dan fonenol 1.66%.
Minyak atsiri menghasilkan aktifitas antibakteri berspektrum luas, dapat menghambat pertumbuhan bakteri Gram positif Staphylococcus aureus, Staphylococcus epidermidis dan bakteri Gram negatif Salmonella enteritidis dan
MIC minyak atsiri bernilai 1% terhadap S. aureus, 0.8% terhadap S. epidermidis, 1.25% terhadap Salmonella enteritidis and 1.2% terhadap E. coli. Efek bakterisida minyak atsiri muncul setelah tujuh jam interaksi dengan bakteri uji dan mematikan secara total setelah 24 jam interaksi. Bakteri sebagian besar mati pada fase stasionernya. Pada fase stasioner bakteri bersifat rentan. Hal ini dimungkinkan oleh makin terbatasnya nutrisi dan meningkatnya produk-produk toksik hasil metabolisme bakteri.
Toksisitas minyak atsiri terhadap artemia salina bernilai 376.7 ppm. Minyak atsiri daun zodia bersifat toksik sedang. Berdasarkan analisis scanning electron microscopy, minyak atsiri daun zodia mampu merusak membran sel bakteri. Interaksi minyak atsiri dengan membrane sel menyebabkan terjadinya “swelling” hingga pada akhirnya bakteri menjadi “sel ghost”.
Senyawa antif antibakteri minyak atsiri daun zodia berhasil diisolasi dan diidentifikasi sebagai evodone. Aktivitas antibakteri senyawa tersebut lebih rendah daripada aktivitas antibakteri minyak atsiri sehingga dapat disimpulkan bahwa aktivitas minyak atsiri merupakan efek sinergis dari aktivitas komponen penyusunnya.
©. Hak Cipta milik IPB tahun 2008
Hak Cipta dilindungi Undang-Undang
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini
tanpa mencantumkan atau menyebutkan sumber .
a.
Pengutipan hanya untuk kepentingan pendidikan
penelitian, penulisan karya ilmiah, penyusunan
laporan, penulisan kritik atau tinjauan suatu
masalah.
b.
Pengutipan tidak merugikan kepentingan yang wajar
IPB.
ISOLASI DAN IDENTIFIKASI SENYAWA
ANTIBAKTERI MINYAK ATSIRI DAUN ZODIA
(Evodia sp.)
AGNES ERI MARYUNI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Kupersembahkan karyaku ini sebagai tanda kasihku untuk:
Ayah Bundaku Ibu Sugiyem dan Alm. Bapak Maridjan,
Kakanda Agustinus Sroyer,
Buah hatiku Marchelino Mario dan Amadhea Putri,
Mbakyu dan Kangmasku:
Yanti, Eni, Maryono, Eti, Endang, Budi, Endah, Robert, Esti, Ermi, Bondan, Tri
Keponakan-keponakanku:
Eka, Wien, Galih, Yogi, Tian, Lina, Lita, Rahma, Widie, Tedi, Tio, Bian
Keagungan Sang Pencipta dan dian Ilmu Pengetahuan
Semoga dapat menjadi motivasi dan sumber inspirasi bagiku, suami dan anakku, keponakanku
PRAKATA
Segala hormat, puji dan syukur penulis persembahkan pada Tuhan Yesus
Kristus. Cinta dan kasih-Nya telah menyertai penulis hingga penulis berhasil
menyelesaikan pendidikan pascasarjana di Program Studi Biokimia FMIPA IPB
dengan baik. Judul penelitian yang dipilih adalah ”Isolasi dan Identifikasi
Senyawa Antibakteri Minyak Atsiri Daun Zodia (Evodia sp.)”. Dana penelitian bersumber dari beasiswa BPPS Dirjen DIKTI dan bantuan dari FMIPA
Universitas Cenderawasih.
Terimakasih sedalam-dalamnya kepada Prof. Dr. drh. Maria Bintang, MS.
dan Dra. Masniari Poeloengan, MS. yang telah memberikan bimbingan, dukungan
dan bantuan sarana penelitian. Kepada Dr. Suryani, MS., terimakasih untuk
koreksi dan masukan-masukan yang telah diberikan Terimakasih juga diucapkan
kepada keluarga Yabansabra dan Bapak Drs. Robert Masreng atas tersedianya
contoh daun zodia, Bapak Supartono dari Balai Penelitian Veteriner dan Bapak
Djaswanto dari Labkrim Mabes Polri dan Ibu Endang dari Lab. SEM
Zoologi-Biologi LIPI Cibinong yang telah membantu selama penelitian berlangsung serta
semua pihak yang tidak dapat disebutkan satu persatu. Terimakasih khusus
diberikan kepada Dirjen DIKTI atas bantuan dana studi dan FMIPA Universitas
Cenderawasih atas bantuan dana penelitian yang telah diberikan.
Akhir kata semoga hasil penelitian ini dapat bermanfaat bagi para pembaca.
Bogor, 26 Agustus 2008
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 19 Oktober 1978 sebagai anak ke-8
pasangan Alm. Maridjan dan Sugiyem. Pendidikan sarjana ditempuh di Jurusan
Kimia FMIPA Institut Pertanian Bogor sejak tahun 1997 sampai 2002.
Setelah lulus sarjana, tahun 2002 penulis bekerja sebagai staf quality
control PT Focus Makmur Indah Jakarta. Selanjutnya pada tahun 2003 penulis
bertugas sebagai staf pengajar di Jurusan Kimia FMIPA Universitas
Cenderawasih Jayapura Papua. Pendidikan Pascasarjana S2 di Program Studi
Biokimia FMIPA IPB dimulai tahun 2006 atas bantuan dana pendidikan BPPS
Dirjen Dikti.
Pada tahun 2006 penulis pernah mendapatkan hibah Penelitian Dosen
Muda yang diadakan oleh Dirjen Dikti. Penelitian tersebut berjudul ”Potensi
Antibakteri Minyak Atsiri Daun Zodia (Evodia sp.)”. Penelitian dilanjutkan pada
saat menyelesaikan pendidikan pascasarjana S2 dengan judul ”Isolasi dan
Identifikasi Senyawa Aktif Antibakteri Minyak Atsiri Daun Zodia (Evodia sp.).
Sebagian dana penelitian bersumber dari beasiswa BPPS Dirjen Dikti dan bantuan
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAfTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Zodia ... 4
Antibakteri ... 7
Komponen Antibakteri Tanamani ... 9
Bakteri ... 11
Pengaruh Zat Antibaktei terhadap Sel Bakteri ... 12
Isolasi Senyawa Aktif ... 14
METODE PENELITIAN ... 16
Waktu dan tempat penelitian ... 16
Bahan dan Alat ... 16
Metode Penelitian ... 16
Isolasi Minyak Atsiri ... 16
Karakterisasi menggunakan GC-MS... 17
Pengujian Aktifitas Antibakteri... 17
Uji Toksisitas Minyak Atsiri ... 17
Kromatografi Lapis Tipis ... 18
Penentuan minimum inhibitory concentration (MIC) ... 18
Penentuan Waktu Kontak Minyak Atsiri ... 19
Analisis Perubahan Morfologi Sel ... 19
Isolasi Senyawa Aktif Antibakteri ... 20
HASIL DAN PEMBAHASAN ... 21
Komposisi Minyak Atsiri ... 23
Aktivitas Antibakteri Minyak Atsiri ... 23
Nilai MIC Minyak Atsiri Daun Zodia ... 26
Penentuan Waktu Kontak Minyak Atsiri ... 27
Analisis Perubahan Morfologi Sel ... 28
Nilai Toksisitas Minyak Atsiri terhadap Artemia salina ... 30
Pemisahan Komponen Minyak Atsiri Dengan Kromatografi Lapis Tipis ... 31
KESIMPULAN ... 38
Kesimpulan ... 38
Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Halaman 1 Komponen utama beberapa jenis minyak atsiri yang memiliki aktivitas
antibakteri ... 9
2 Beberapa pelarut organik dan sifat fisiknya ... 15
3 Komponen minyak atsiri daun zodia... 22
4 Aktivitas antibakteri minyak atsiri ... 23
5. Sensitifitas Antibiotik ... 24
6 Klasifikasi Aktivitas Antibakteri ... 25
7 Hubungan antara LC50, LD50 dan EC50 dan Klasifikasi Toksisitas Tonkes (Verma, 2008) ... 31
8 Nilai hRf kromatogram minyak atsiri ... 32
DAFTAR GAMBAR
Halaman
1 Zodia ... 4
2 Rutaecarpine ... 5
3 Alkaloid quinolon dari Evodia Rutaecarpa ... 7
4 Spektra GC-MS minyak atsiri daun zodia ... 21
5 Struktur senyawa terpena yang memiliki kemiripan dengan komponen utama minyak atsiri daun zodia ... 22
6 Struktur dinding sel bakteri Gram positif dan Gram negatif ... 26
7 Kurva penetapan MIC minyak atsiri daun zodia terhadap bakteri S. aureus(a), S. epidermidis (b), Salmonella enteritidis(c), dan E. Coli (d) ... 26
8 Penetapan waktu kontak minyak atsiri ... 27
9 Kurva pertumbuhan bakteri S. aureus ... 28
10 Mikrograf elektron bakteri S. aureus ... 29
11 Kurva regresi linier penentuan toksisitas minyak atsiri ... 30
12 Kromatogram minyak atsiri dalam pelarut heksan:dietileter (8:2) pada plat silika gel 60F254 ... 32
13 Kristal hasil isolasi dari minyak atsiri daun zodia ... 33
14 Uji kelarutan kristal dalam air (1), heksan (2), aseton (3), etil asetat (4) dan benzene (5) ... 33
15 Aktivitas antibakteri fraksi heksan (1), etil asetat (2), dan kristal kasar (3) ... 34
15 Kromatogram fraksi heksan (a) dan fraksi etil asetat (b) dalam pelarut heksan:dietileter (8:2) pada plat silika gel 60F254 ... 33
16 Bentuk dua dimensi fraksi heksan (a) dan fraksi etilasetat (b) ... 34
17 Spektra GC-MS kristal hasil kristalisasi fraksi etil asetat ... 36
DAFTAR LAMPIRAN
Halaman 1 Spektra Minyak Atsiri Daun Zodia ... 44
2 Spektra GC-MS Komponen ke-1 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 45
3 Fragmentasi Komponen ke-1 dan Senyawa Referens ... 46
4 Spektra GC-MS Komponen ke-2 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 47
5 Fragmentasi Komponen ke-2 dan Senyawa Referens ... 48
6 Spektra GC-MS Komponen ke-3 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 49
7 Fragmentasi Komponen ke-3 dan Senyawa Referens ... 50
8 Spektra GC-MS Komponen ke-4 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 51
9 Fragmentasi Komponen ke-4 dan Senyawa Referens ... 52
10 Spektra GC-MS Komponen ke-5 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 53
11 Fragmentasi Komponen ke-5 dan Senyawa Referens ... 54
12 Spektra GC-MS Komponen ke-6 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 55
13 Fragmentasi Komponen ke-6 dan Senyawa Referens ... 56
14 Spektra GC-MS Komponen ke-7 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 57
15 Fragmentasi Komponen ke-7 dan Senyawa Referens ... 58
16 Spektra GC-MS Komponen ke-8 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 59
17 Fragmentasi Komponen ke-8 dan Senyawa Referens ... 60
18 Spektra GC-MS Komponen ke-9 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 61
20 Spektra GC-MS Komponen ke-10 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 63
21 Fragmentasi Komponen ke-10 dan Senyawa Referens ... 64
22 Spektra GC-MS Komponen ke-11 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 65
23 Fragmentasi Komponen ke-11 dan Senyawa Referens ... 66
24 Spektra GC-MS Komponen ke-12 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 67
25 Fragmentasi Komponen ke-12 dan Senyawa Referens ... 68
26 Spektra GC-MS Komponen ke-13 Minyak Stsiri Daun Zodia dan
Fragmentasinya ... 69
27 Fragmentasi Komponen ke-13 dan Senyawa Referens ... 70
28 Spektra GC-MS Komponen ke-14 Minyak atsiri Daun Zodia dan
Fragmentasinya ... 71
29 Fragmentasi Komponen ke-14 dan Senyawa Referens ... 72
30 Spektra GC-MS Komponen ke-15 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 73
31 Fragmentasi Komponen ke-15 dan Senyawa Referens ... 74
32 Spektra GC-MS Komponen ke-16 Minyak Stsiri Daun Zodia dan
Fragmentasinya ... 75
33 Fragmentasi Komponen ke-16 dan Senyawa Referens ... 76
34 Spektra GC-MS komponen ke-17 minyak atsiri daun zodia dan
fragmentasinya ... 77
35 Fragmentasi Komponen ke-17 dan Senyawa Referens ... 78
36 Spektra GC-MS Komponen ke-18 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 79
37 Fragmentasi Komponen ke-18 dan Senyawa Referens ... 80
38 Spektra GC-MS Komponen ke-19 Minyak Atsiri Daun Zodia dan
Fragmentasinya ... 81
39 Fragmentasi Komponen ke-19 dan Senyawa Referens ... 82
40 Spektra GC-MS Komponen ke-20 Minyak Atsiri Daun Zodia dan
41 Fragmentasi Komponen ke-20 dan Senyawa Referens ... 84
42 Spektra GC-MS Komponen ke-21 Minyak Atsiri Daun Zodia dan Fragmentasinya ... 85
43 Fragmentasi Komponen ke-21 dan Senyawa Referens ... 86
44 Spektra GC-MS Komponen ke-22 Minyak Atsiri Daun Zodia dan Fragmentasinya ... 87
45 Fragmentasi Komponen ke-22 dan Senyawa Referens ... 88
46 Spektra GC-MS Komponen ke-23 Minyak Atsiri Daun Zodia dan Fragmentasinya ... 89
47 Fragmentasi Komponen ke-23 dan Senyawa Referens ... 90
48 Spektra GC-MS Komponen ke-24 Minyak Atsiri Daun Zodia dan Fragmentasinya ... 91
49 Fragmentasi Komponen ke-24 dan Senyawa Referens ... 92
50 Spektra GC-MS Komponen ke-25 Minyak Atsiri Daun Zodia dan Fragmentasinya ... 93
51 Spektra GC-MS Komponen ke-26 Minyak Atsiri Daun Zodia dan Fragmentasinya ... 94
52 Spektra GC-MS Senyawa dalam Fraksi Etil Asetat ... 95
53 Data Fragmentasi Senyawa dalam Fraksi Etil Asetat ... 96
54 Spektra GC-MS Sebyawa dalam Fraksi Heksan ... 97
55 Komposisi media Mueller-Hinton Agar... 98
56 Komposisi Larutan Standard McFarland ... 99
PENDAHULUAN
Latar Belakang
Sejak penemuannya hingga akhir abad 20, obat-obatan antimikrobial telah
berhasil meyembuhkan berbagai jenis penyakit yang berkaitan dengan infeksi.
Penggunaan antibiotik yang disertai dengan perbaikan sanitasi, tempat tinggal,
dan nutrisi serta meluasnya program imunisasi menyebabkan turunnya angka
kematian. Selama bertahun-tahun, obat-obatan antimikrobial telah menyelamatkan
hidup dan menghapuskan penderitaan jutaan manusia serta memperpanjang usia
harapan hidup.
Keberhasilan obat-obatan antimikrobial dalam terapi penyembuhan
penyakit-penyakit infeksi kini terancam oleh munculnya resistensi bakteri. Dalam
artikelnya, Hill (2005) melaporkan beberapa hasil penelitian. Disebutkan bahwa
lebih dari 90% Staphylococcus aureus resisten pada penicillin. Lima puluh persen
bakteri resisten terhadap methisilin. Dengan mempelajari mekanisme bakteri
methycillin-resistant Staphylococcus aureus (MRSA), Ibba dan Hervey Roy
(2008) dari Ohio State University berhasil menemukan suatu jenis protein yang
berhubungan dengan berkembangnya resistensi pada 200 jenis bakteri. MRSA
juga resistensi terhadap linezoid dan vancomycin (Johnson dalam Hill (2005)).
Multiresistensi juga terjadi pada bakteri E. Coli. Beberapa kasus infeksi saluran
kencing tidak dapat sembuh dengan terapi trimetroprim dan ciplofloxacin.
Penggunaan antibiotik yang tidak tepat juga menimbulkan resistensi pada
bakteri patogen pangan. Dalam penelitiannya yang mengambil contoh bakteri dari
beberapa jenis makanan cepat saji, SIRELI & Ali (2008) menemukan adanya
bakteri Listeria monocytogenes resisten terhadap rifapin dan gentamisin. Dalam
kondisi normal, umumnya bakteri tesebut suseptibel terhadap berbagai jenis
antibiotik kecuali cephalosporin dan phosphomycin.
Tumbuhan mensintesis lebih dari 100.000 molekul, meskipun tidak
banyak yang memiliki aktivitas antimikroba. Beberapa jenis antimikroba yang
berasal dari tumbuhan didapatkan pada kadar tinggi dan hanya memerlukan
konsentrasi beberapa milimolar untuk perlindungan yang memadai. Pada
pertahanan diri terhadap organisme lain dalam lingkungannya (Lewis & Ausubel,
2006).
Jauh sebelum mikroba ditemukan, pemikiran akan adanya tumbuhan
tertentu yang berpotensi sebagai obat telah diterima dengan baik. Manusia
menggunakan tumbuhan untuk menyembuhkan berbagai penyakit infeksi, dan
sebagian sudah dilakukan sebagai kebiasaan dalam kehidupan sehari-hari
(Mendonςa-Filho, 2006). Sejak awal 1980-an, ketertarikan dalam penggunaan
bahan alam yang kemudian disebut senyawa bioaktif tumbuhan bangkit kembali.
Kebangkitan tersebut dapat dipahami sebagai jawaban keprihatinan akan segi
keamanan, sitotoksisitas, dan efek samping obat-obatan sintetik, dan kebutuhan
akan adanya senyawa obat baru, termasuk antibiotik baru untuk menangani
penyakit-penyakit infeksi yang ditimbulkan oleh bakteri patogen multiresisten dan
terapi penyakit kronik.
Hasil penelitian etnobotani menunjukkan bahwa telah terjaring 106
simplisia tanaman obat Indonesia yang menghasilkan aktivitas antibakteri
(Dzulkarnain et al, 1996). Diantara simplisia tersebut, 42 simplisia diketahui
digunakan secara empirik untuk infeksi saluran pencernaan, 33 simplisia
digunakan secara empirik sebagai obat penyakit kulit, 6 simplisia digunakan
secara empirik untuk infeksi kandung kemih, 1 simplisia digunakan secara
empirik sebagai obat infeksi tenggorokan. Beberapa simplisia lain tidak jelas
penggunaan empiriknya tetapi diteliti daya antibakterinya.
Minyak atsiri (disebut juga minyak menguap atau minyak etheral) adalah
cairan berwujud minyak yang beraroma yang berasal dari berbagai bagian
tumbuhan (bunga, kuncup, biji, daun, ranting, kulit batang, rempah, kayu, buah
dan akar) (Guenther, 1948 dalam Burt (2004)). Minyak atsiri akhir-akhir ini
menarik perhatian dunia. Hal ini disebabkan minyak atsiri dari beberapa
tumbuhan bersifat aktif biologis sebagai antibakteri dan antijamur sehingga dapat
dipergunakan sebagai bahan pengawet pada makanan dan sebagai antibiotik alami
(Burt, 2004). Dalam Ignacimuthu (2006) dijelaskan bahwa sebagian besar minyak
atsiri menunjukkan aktivitas antibakteri terhadap berbagai jenis bakteri uji, baik
Carvacrol, thymol, dan eugenol adalah komponen minyak atsiri yang
diketahui memiliki aktivitas antibakteri yang tinggi. Ketiga senyawa ini masuk
dalam golongan fenol. Selain itu, komponen minyak atsiri yang bersifat
antibakteri adalah linalool. Linalool masuk dalam golongan monoterpen, senyawa
terpena yang terdiri dari sepuluh atom karbon (Baudoux, 2005).
Linalool merupakan kandungan utama minyak atsiri dalam tanaman
pengusir nyamuk zodia (Kardinan, 2007). Menurut hasil analisis yang dilakukan
di Balai Penelitian Tanaman Rempah dan Obat (Balitro) dengan gas kromatografi,
minyak yang disuling dari daun tanaman ini mengandung linalool (46%) dan α
-pinene (13,26%).
Adanya komponen dalam minyak atsiri daun zodia yang berpotensi
menghasilkan aktivitas antibakteri memacu untuk dilakukannya penelitian tentang
penelusuran senyawa antibakteri dalam minyak atsiri daun zodia.
Tujuan Penelitian
Dari permasalahan di atas dirumuskan tujuan penelitian sebagai berikut:
1. Menentukan aktivitas antibakteri minyak atsiri daun zodia terhadap
beberapa bakteri Gram positif dan Gram negatif
2. Menentukan spektrum antibakteri yang dihasilkan.
3. Menentukan toksisitas minyak atsiri
4. Menentukan pengaruh minyak atsiri terhadap sel bakteri
5. Mengisolasi senyawa aktif antibakteri
6. Mengidentifikasi senyawa aktif antibakteri
Manfaat Penelitian
Penelitian ini diharapkan dapat menambah informasi ilmiah di bidang
kimia, farmasi dan kedokteran tentang manfaat tanaman zodia, mengembangkan
simplisia tanaman zodia sebagai sediaan fitofarmaka dan mendukung upaya
TINJAUAN PUSTAKA
Zodia
Zodia merupakan tanaman asli Indonesia yang berasal dari daerah Papua.
Oleh penduduk setempat tanaman ini biasa digunakan untuk menghalau serangga,
khususnya nyamuk apabila hendak pergi kehutan, yaitu dengan cara
menggosokkan daunnya ke kulit. Selain itu, tanaman yang mempunyai tinggi
antara 50 cm hingga 200 cm (rata-rata 75cm), dipercaya mampu mengusir
nyamuk dan serangga lainnya dari sekitar tanaman. Oleh sebab itu tanaman ini,
sering ditanam di pekarangan atau di pot untuk menghalau nyamuk. Aroma yang
dikeluarkan oleh tanaman zodia cukup wangi.
Gambar 1 Zodia
Oleh masyarakat Jayawijaya dan masyarakat Indonesia umumnya, tanaman
ini disebut zodia. Masyarakat Biak Numfor menyebutnya sirih hutan. Berikut
klasifikasi tanaman zodia:
Kingdom : Plantae
Divisi : Spermathophyta
Subdivisi : Angiospermae
Ordo : Rutales
Famili : Rutaceae
Genus : Evodia
Tanaman termasuk dalam golongan perdu . Panjang daun tanaman dewasa
20-30 cm. Tanaman tumbuh baik di ketinggian 400-1000 m dpl.
Daun zodia dapat disuling untuk menghasilkan minyak atsiri (essential oil).
Linalool merupakan kandungan utama minyak atsiri dalam tanaman pengusir
nyamuk zodia (Kardinan, 2007). Menurut hasil analisis yang dilakukan di Balai
Penelitian Tanaman Rempah dan Obat (Balitro) dengan gas kromatografi, minyak
yang disuling dari daun tanaman ini mengandung linalool (46%) dan α-pinene
(13,26%). Selain itu minyak atsiri zodia juga mengandung evodiamin dan
rutaecarpin yang juga berfu.ngsi sebagai antinyamuk.
Rebusan kulit batang zodia bermanfaat sebagai pereda demam malaria.
Rebusan daun dipakai sebagai tonik penambah stamina tubuh
http://www.proseanet.org/prohati4/printer.php?photoid=15.
Gambar 2 Rutaecarpine
Dalam Wu, et al. (1995) tumbuhan yang masuk dalam golongan Evodia
terbagi dalam tiga genera, yaitu Tetradium, Evodia s.s. dan Melicope. Klasifikasi
ini didasarkan pada senyawa-senyawa kimia yang diisolasi dari tumbuhan
tersebut. Jenis evodia yang berbeda mengandung beberapa jenis senyawa yang
berbeda pula. Wu et al. berhasil mengisolasi enam jenis alkaloid dari batang kayu
Taiwan), yaitu bocconoline, norcherithrine, 6-acetonyl dihydrocelerythrine,
arnottianamide dan decarine. Selain itu ditemukan juga senyawa-senyawa berikut:
dictanine, γ-fagarine, robustine, skimmianine; rutaecarpine, hortiacine quinolone;
sitosteryl glucoside, atractylenolide, lupeol, (-)matariesinol, umbeliferone, p
-hydroxybenzaldehide, vanilin, metylvanillate, metylparaben, methylsyringate,
syringaldehide, methyl-p-hydroxycinnamate,
trans-4’-hydroxy-3’methoxycinnamaldehyde, 3,4,5-trimethoxybenzyl alcohol,
2’-hydroxy-4’-methoxyacetophenone, p-hydroxybenzoic acid, ω-hydroxypropioguaicone,
evofolin-C, hortiamide, limonin, evodol, 12αhydroxyevodol, 6β
-acetoxy-5-epilimonin, rutaevine, graucin, cis-N-p-coumaroyltyramine,
trans-N-p-coumaroyltyramine, cis-N-feruloyltyramine dan trans-N-feruloyltyramine serta
senyawa anorganik KNO3. Evodia lepta dari Hainan, Cina, mengandung leptonol,
metylleptol A, alloevodione, 7,4-dihydroxy-3,5,3’-trimethoxyflavone,
3,7-dimethylcaemferol dan clovandiol (Li & Zhu, 1998).
Tiga belas jenis Evodia juga tersebar di Madagaskar. Satu senyawa baru
diidentifikasi dari Evodia fatraina oleh Ravelomanantsoa et al.(1995) yaitu
furoquinoline. Senyawa tersebut diisolasi dari bagian akar dan ranting Evodia.
Tang et al. (1996) menemukan lima jenis alkaloid baru golongan quinolon
dari bagian buah Evodia rutaecarpa, yang merupakan obat tradisional Cina. Oleh
masyarakat setempat, digunakan untuk terapi sakit kepala, sakit perut, disentri,
pendarahan setelah melahirkan, nyeri tulang, migrain dan rasa mual. Selain
quinolon, telah dilaporkan adanya senyawa-senyawa alkaloid golongan lainnya
yaitu indol dan limonoid. Dari ekstrak metanol buah kering ditemukan senyawa
1-,etil-2-nonil-4-quinolon, 1-metil-2-undesil-4-quinolon,
1-metil-2-dodesil-4-quinolon, 2-tridesil-4-1-metil-2-dodesil-4-quinolon, dihidroevocarpine,
1-metil-2-pentadesil-4-quinolon, 1-metil-2-[(Z)-5-undekenil]-4(1H)-quinolon dan
1-metil-2-[(Z)-6-undekenil]-4(1H)-quinolon. Selain itu terdapat
1-metil-2-[(Z)-7-tridekenil]-4(1H)-quinolon, evocarpine, 1-metil-2-[(Z)-9-pentadekenil]-4(1H)-quinolon. Ditemukan
sejumlah kecil senyawa 1-metil-2-dodesil-4(1H)-quinolon. Terdapat juga
komponen dalam bentuk minyak: campuran
1-metil-2-[(Z)-7-tridekenil-4(1H)-quinolon dan evocarpine serta campuran
1-metil-2-[(Z)-9-entadekenil-4(1H)-quinolon dan 1-metil-2-[(Z)-10-pentadekenil]-4(1H)-quinolon.
Gambar 3 Alkaloid quinolon dari Evodia Rutaecarpa (Tang et al. (1996)
Antibakteri
Komponen antimikroba adalah suatu komponen yang bersifat dapat
menghambat pertumbuhan bakteri atau kapang atau membunuh bakteri atau
kapang (Fardiaz, 1992). Antimikroba meliputi antibakteri, antiprotozoa, antifungi,
dan antivirus. Antibakteri termasuk dalam antimikroba yang digunakan untuk
menghambat pertumbuhan bakteri (Schunack et al., 1990).
Zat antibakteri adalah zat yang dapat mengganggu pertumbuhan dan
metabolisme bakteri (Pelczar dan Chan, 1986). Berdasarkan aktivitasnya, zat
antibakteri dibedakan menjadi dua, yaitu antibakteri yang memiliki aktifitas
bakteriostatik (menghambat pertumbuhan bakteri) dan aktivitas bakterisidal
(membunuh bakteri).Antibakteri bakteriostatik bekerja dengan cara menghambat
antibakteri bakteriostatik juga dapat bertindak sebagai bakterisida (Schunack et
al.1990).
Beberapa faktor dapat mempengaruhi aktivitas penghambatan atau
pembunuhan bakteri oleh suatu zat (Pelzcar & Chan, 1986). Faktor-faktor tersebut
adalah konsentrasi zat, jumlah mikroorganisme, suhu, spesies mikroorganisme,
adanya bahan organik dan pH.
Terdapat beberapa metode yang dapat digunakan dalam uji antibakteri
secara in vitro. Secara garis besar, uji dikelompokkan atas tes difusi dan tes dalam
media cair (Edward, 1980). Masing-masing metode meiliki kekurangan dan
kelebihan. Ada tiga teknik uji yang termasuk dalam kelompok tes difusi, yaitu
disc technique, ditch technique dan hole atau well technique. Tes dalam media
cair biasanya digunakan untuk menentukan nilai minimum inhibitory
cancentration (MIC).
Metode disc dffusion adalah metode paling sederhana yang secara rutin
digunakan dalam uji sensitivitas. Metode ini direkomendasikan oleh komite WHO
dan Asosiasi Patologis Klinis. Dalam metode ini paper disc yang mengandung
sejumlah tertentu zat antibakteri ditempatkan pada permukaan media agar yang
sudah diinokulasi dengan bakteri uji.
Ditch technique saat ini sudah jarang digunakan. Dalam metode tersebut,
dilakukan pengambilan sebagian agar pada salah satu sisi petri untuk diganti
dengan agar yang mengandung antibiotik atau zat uji.
Dalam well technique, media agar padat dilubangi menggunakan
cork-borer kemudian diisi dengan sejumlah antibiotik atau larutan obat. Teknik ini
memiliki kelebihan yaitu bahwa konsentrasi antibiotik atau obat yang digunakan
dapat berbeda-beda serta dapat dibuat lubang dengan ukuran besar sehingga uji
lebih kuantitatif.
Uji menggunakan media cair adalah metode paling sederhana untuk
menentukan nilai MIC (Edward, 1980). Menurut Edberg (1986), MIC merupakan
konsentrasi terendah yang akan menghambat pertumbuhan mikroorganisme
makroskopik. Pertumbuhan mikroorganisme makroskopik dapat dilihat dalam
batas 106 sampai 107 mikroba/ml. Jumlah bakteri pada kontrol dapat mencapai
Komponen Antibakteri Tanaman
Zat aktif yang terkandung dalam berbagai jenis ekstrak tanaman diketahui
dapat menghambat beberapa mikroba patogen maupun perusak pangan. Zat aktif
tersebut dapat berasal dari bagian tanaman, seperti biji, buah, rimpang, batang,
daun, dan umbi.
Komponen antibakteri maupun antifungi dapat ditemukan pada minyak
atsiri suatu tanaman. Efek antimikroba minyak atsiri telah banyak
didokumentasikan dan digunakan dalam pengobatan berbasis herbal di beberapa
negara (Schilcher, 1998; Cowan, 1999; Schilcher, 2002; Longbottom et al. 2004;
Sonboli et al. 2005) diacu dalam Mahboobi et al. (2006). Dalam penelitiannya,
Mahboobi (2006) mempelajari efek sinergis dari minyak atsiri tembakau, lavender
dan geranium. Kerja sinergi beberapa minyak atsiri tersebut menghasilkan
hambatan kuat terhadap P. aeroginosa. Minyak atsiri lengkuas (Alpinia galanga)
juga mampu menghambat pertumbuhan B. subtilis dan S. aureus serta jamur
Neurospora sp. dan Penicillium sp.
Harborne (1987) menyebutkan bahwa zat bioaktif yang terdapat pada
minyak atsiri digolongkan dalam golongan terpenoid. Terpenoid terdiri atas
beberapa macam senyawa, mulai dari minyak atsiri yang mudah menguap, yaitu
monoterpena dan sesquiterpena (C10 dan C15), diterpena yang lebih sukar
menguap (C20), sampai ke senyawa yang tidak menguap, yaitu triterpenoid dan
sterol (C30, serta pigmen karotenoid (C40). Beberapa komponen minyak atsiri yang
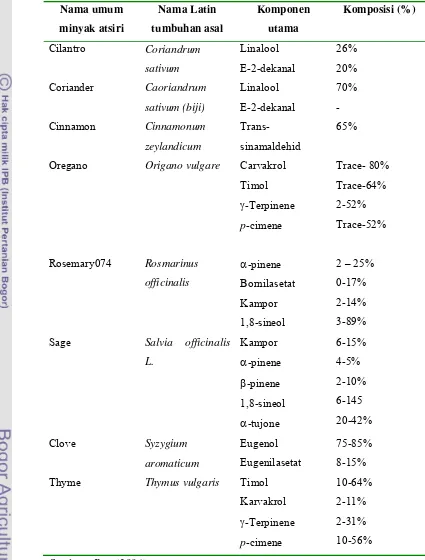
memiliki aktivitas antibakteri ditampilkan dalam tabel berikut ini:
Minyak atsiri terdapat di dalam sel kelenjar khusus pada permukaan daun
dan dapat dipisahkan menggunakan metode destilasi. Teknik destilasi terdiri dari
tiga cara yaitu; destilasi air, dimana bahan ditempatkan bersama air kemudian
dipanaskan; destilasi uap dan air, yaitu bahan hanya berhubungan dengan uap
tetapi tidak dengan air panas dan uap dalam keadaan basah, jenuh dan tidak terlalu
panas; dan destilasi uap, dimana bahan yang didetilasi berhubungan dengan uap
jenuh atau lewat jenuh pada tekanan lebih dari satu atmosfer (Heath dan
Tabel 1 Komponen utama beberapa jenis minyak atsiri yang memiliki aktivitas
Oregano Origano vulgare Carvakrol
Timol
Sage Salvia officinalis
L.
Thyme Thymus vulgaris Timol
Bakteri
Bakteri adalah sel prokariotik yang khas, bersifat uniseluler dan tidak
mengandung struktur yang terbatasi membran di dalam sitoplasmanya. Sel bakteri
memiliki bentuk yang khas, seperti bola, batang, atau spiral. Umumnya bakteri
berdiameter antara 0.5 – 1.0 μm (Pelczar & Chan, 1986).
Struktur utama yang ada di bagian luar sel bakteri adalah flagella, pili, dan
kapsul. Flagela berbentuk seperti rambut tipis yang berfungsi sebagai alat gerak.
Pilus atau pili adalah sebuah bentuk filamen yang lebih kecil, lebih banyak
flagela. Kapsul adalah lapisan lendir yang menyelubungi dinding sel bakteri dan
merupakan pelindung sel serta berfungsi sebagai makanan cadangan. Bakteri
dapat hidup berpasangan, bergerombol, membentuk rantai atau filamen.
Bakteri melakukan reproduksi melalui pembelahan biner sederhana atau
membentuk sel khusus yang disebut spora. Selang waktu khusus yang dibutuhkan
bakteri untuk membelah diri agar populasinya menjadi dua kali lipat disebut
waktu generasi (Pelczar dan Chan, 1988). Berdasarkan komposisi dinding sel
bakteri, bakteri dibedakan menjadi bakteri Gram positif dan Gram negatif.
Bakteri Gram positif memiliki struktur dinding sel yang tebal (15-80 μm)
dan berlapis tunggal dengan komposisi dinding sel terdiri atas lipid peptidoglikan
dan asam teikoat. Kandungan lipid pada bakteri Gram positif antara 1-4%.
Dinding sel terdiri dari lapisan tunggal peptidoglikan yang mencapai lebih dari
50% berat kering sel bakteri. Asam teikoat sebagai bagian utama dinding sel yang
hanya terdapat pada bakteri Gram positif adalah polimer linear yang diturunkan
baik dari gliserol fosfat maupun dari ribitol fosfat. Bakteri Gram positif rentan
terhadap gangguan fisik (Pelczar dan Chan, 1986; Cummins, 1990; Williams et al.
1996).
Bakteri Gram negatif memiliki struktur dinding sel berlapis tiga dengan
ketebalan 10-15 nm. Komposisi dinding sel terdiri atas lipid dan peptidoglikan
yang berada dalam lapisan sebelah dalam dengan jumlah sekitar 10% berat kering.
Kandungan lipid pada bakteri Gram negatif cukup tinggi, yaitu 11-22%. Bakteri
ini umumnya kurang rentan terhadap penisilin dan gangguan fisik. Selain itu,
Pengaruh zat antibakteri terhadap sel bakteri
Senyawa antibakteri dalam menghambat pertumbuhan bakteri bahkan
membunuhnya. Menutur menurut Pelczar dan Chan (1986) hal tersebut
disebabkan oleh:
1.Kerusakan struktur dinding sel
Unit dasar dari dinding sel bakteri adalah peptidoglikan yang secara
mekanis memberikan ketegaran pada sel bakteri, disamping sebagai dasar
membran sitoplasma. Peptidoglikan tersebut terdiri dari turunan gula, yaitu asam
N-asetilglukosamin dan N-asetilmuramat serta asam amino L-alanin, alanin,
D-glutamat, dan lisin. Struktur dinding sel bakteri Gram positif mengandung 90%
peptidoglikan serta lapisan tipis asam teikoat dan asam teikuronat yang bermuatan
negatif. Ada bakteri Gram negatif, selain peptidoglikan 5-10%, terkandung juga
protein, lipoprotein dan lipopolisakarida. Perbedaan utama kedua Gram tersebut
terletak pada lapisan membran luar, yang meliputi lipopolisakarida (Madigan et
al. 2003). Kehadiran membran ini menyebabkan bakteri kaya akan lipid
(11-22%). Membran tersebut tidak hanya terdiri dari fosfolipida saja seperti pada
membran plasma tetapi mengandung juga lipid lainnya, seperti polisakarida dan
protein. Lipid dan polisakarida ini berhubungan erat dan membentuk struktur yang
khas yang disebut lipopolisakarida. Lipopolisakarida terikat satu sama lain dengan
kation divalen Ca2+ dan Mg2+ (Murray, 1998).
Membran luar bakteri Gram negatif mempunyai peranan sebagai barrier
masuknya senyawa-senyawa yang tidak dibutuhkan oleh sel, diantaranya
bakteriosin, enzim dan senyawa-senyawa yang bersifat hidrofobik (Alakomi et al.
2000). Dalam upaya untuk mencapai sasaran, senyawa antimikroba dapat
menembus lipopolisakarida dinding sel. Molekul-molekul yang bersifat hidrofilik
lebih mudah melewati lapisan lipopolisakarida dibandingkan dengan yang bersifat
hidrofobik. Bakteri Gram positif mempunyai sisi hidrofilik, yaitu karboksil, asam
amino, dan hidroksil. Asam-asam organik dapat menghambat pertumbuhan
bakteri Gram negatif dengan mengkelat kation Ca2+ dan Mg2+ (Stratford, 2000).
Mekanisme kerusakan dinding sel dapat disebabkan oleh adanya
akumulasi komponen lipofilik yang terdapat pada dinding sel atau membran sel
akumulasi senyawa antibakteri dipengaruhi oleh bentuk terdisosiasi. Gugus
hidrofobik pada senyawa antibakteri dapat mengikat daerah hidrofobik membran
serta melarut baik ada fase lipid membran bakteri.
Umumnya senyawa antimikroba dapat menghambat sintesis peptidoglikan
karena kemampuan dari senyawa tersebut dalam menghambat enzim-enzim yang
berperan dalam pembentukan peptidoglikan seperti karboksipeptidase,
endopeptidase dan transpeptidase. Jika aktifitas enzim-enzim tersebut dihambat
oleh senyawa antibakteri maka sifat enzim autolitik sebagai reseptor hilang dan
enzim tidak mampu mengendalikan aktifitasnya sehingga dinding sel akan
mengalami degradasi.
2. Perubahan permeabilitas membran sitoplasma.
Sel bakteri dikelilingi oleh struktur kaku yang disebut dinding sel, yang
melindungi sitoplasma baik osmotik maupun mekanik. Setiap zat yang dapat
merusak dinding sel atau mencegah sintesisnya akan menyebabkan terbentuknya
sel-sel yang peka terhadap osmotik. Adanya tekanan osmotik dalam sel bakteri
akan menyebabkan terjadinya lisis yang merupakan dasar efek bakterisidal pada
bakteri yang peka.
3. Perubahan molekul protein dan asam nukleat
Hidup suatu sel tergantung pada terpeliharanya molekul-molekul protein
dan asam nukleat dalam keadaan alamiahnya. Suatu kondisi atau substansi yang
mengubah keadaan ini, yaitu mendenaturasikan protein dan asam-asam nukleat
dapat merusak sel tanpa dapat diperbaiki kembali. Suhu tinggi dan konsentrasi
pekat beberapa zat kimia dapat mengakibatkan koagulasi irreversibel
komponen-komponen selular yang vital ini.
4. Penghambatan kerja enzim di dalam sel sehingga mengakibatkan
terganggunya metabolisme atau matinya sel.
Senyawa antibakteri dapat menghambat pertumbuhan atau membunuh
mikroorganisme dengan cara mengganggu aktifitas enzim-enzim metabolik.
Beberapa senyawa antibakteri yang dapat menginaktifasi enzim adalah asam
benzoat, asam lemak, sulfit dan nitrit. Nitrit dapat menghambat sistem enzim
fosfat dehidrogenase sehingga mengakibatkan reduksi ATP dan ekskresi piruvat
dehidrogenase dan suksinat dehidrogenase. Hal ini akan menghambat konversi α
-ketoglutarat menjadi suksinil-KoA dan suksinat menjadi fumarat.
5. Penghambatan sintesis asam nukleat dan protein
Kim et al. (1995) menyatakan bahwa senyawa antimikroba dapat merusak
sistem metabolisme di dalam sel dengan cara menghambat sintesis protein bakteri
dan menghambat kerja enzim entraseluler. Sistem enzim yang terpengaruh akan
mengakibatkan gangguan pada produksi energi penyusun sel dan sintesis
komponen secara struktural.
Branen dan Davidson (1993) menyatakan adanya mekanisme antimikroba
yang mendestruksi atau menginaktivasi fungsi dari materi genetik. Sintesis protein
merupakan hasil akhir dari proses transkripsi dan translasi. Dalam Kim et al.
(1995) dijelaskan bahwa suatu senyawa yang bersifat antimikroba dapat
mengganggu pembentukan asam nukleat sehingga transfer informasi genetik akan
terganngu. Hal ini disebabkan senyawa antimikroba menghambat aktifitas enzim
RNA polimerase dan DNA polimerase yang selanjutnya dapat menginaktifasi atau
merusak materi genetik sehingga mengganggu proses pembelahan sel untuk
pembiakan.
Kerja antibakteri dipengaruhi oleh lingkungannya, antara lain konsentrasi zat
antibakteri, spesies antibakteri, pH, dan lingkungannya. Bakteri Gram positif
cenderung lebih sensitif terhadap komponen antibakteri. Hal ini disebabkan oleh
struktur dinding sel bakteri Gram positif berlapis tunggal yang relatif sederhana
sehingga memudahkan senyawa antibakteri masuk ke dalam sel dan menemukan
sasarannya untuk bekerja. Bakteri gram negatif lebih resisten karena struktur
dinding sel bakteri Gram negatif relatif lebih kompleks dan berlapis tiga, yaitu
lapisan luar berupa lipoprotein, lapisan tengah berupa polisakarida dan lapisan
dalam peptidoglikan (Pelczar dan Chan, 1986).
Isolasi Senyawa Aktif
Ekstraksi merupakan suatu proses yang secara selektif mengambil zat
terlarut dari campuran dengan bantuan pelarut. Teknik ekstraksi didasarkan pada
kenyataan bahwa jika suatu zat dapat larut dalam dua fase yang tidak tercampur
bersama-sama. Zat terlarut yang diekstraksi dapat berada dalam medium padat
maupun cair. Pelarut yang digunakan untuk ekstraksi dapat bersifat larut dalam air
seperti alkohol atau yang tidak larut air seperti heksana dan kloroform. Pemilihan
pelarut yang digunakan tergantung pada sifat zat yang dilarutkan karena setiap zat
memiliki kelarutan yang berbeda-beda (Achmadi, 1992).
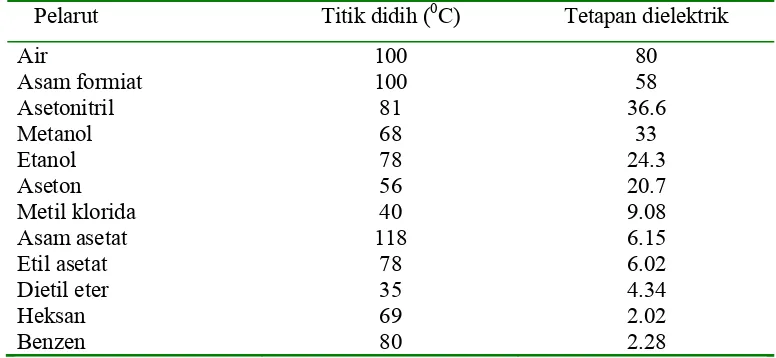
Dalam memilih pelarut yang dipakai harus diperhatikan sifat metabolit
yang akan diekstrak. Sifat yang penting adalah sifat kepolaran dan gugus polar
pada senyawa yang akan diekstrak. Dengan mengetahui sifat metabolit yang akan
diekstraksi dapat dipilih pelarut yang sesuai berdasarkan kepolaran. Senyawa
polar akan lebih mudah larut dalam pelarut polar dan senyawa nonpolar lebih
mudah larut dalam pelarut nonpolar. Derajat kepolaran bergantung pada tetapan
dielektrik. Makin besar tetapan dielektrik makin polar pelarut tersebut.
Tabel 2 Beberapa pelarut organik dan sifat fisiknya
Pelarut Titik didih (0C) Tetapan dielektrik
Air
KLT adalah metode yang sederhana dan murah untuk mendeteksi
unsur-unsur dalam tumbuhan (Hostettman, 1998). Metode tersebut mudah dalam
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan sejak bulan Maret sampai dengan Juli 2008.
Kegiatan penelitian dilakukan di Laboratorium Bakteriologi Balai Veteriner
Bogor, Laboratorium Biokimia IPB dan Laboratorium Pusat Studi Biofarmaka
IPB. Identifikasi GC-MS dilakukan di Laboratorium Kesehatan Daerah Jakarta
dan Laboratorium Kriminal Mabes Polri Jakarta. Scanning electron microscopy
dilaksanakan di Laboratorium Zoologi-Biologi LIPI Cibinong.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini meliputi daun zodia, pelarut
organik , media padat Mueler Hinton, plat silika gel 60 G F254, allumunium foil,
kertas saring Whatman 42, telur Artemia salina, bakteri biakan uji
Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli, dan
Salmonella enteritidis.
Alat yang digunakan adalah alat –alat gelas, perangkat destilasi,
mikrosentrifuse, mikropipet, shaker, bejana KLT, lampu UV panjang gelombang
254 nm dan 365 nm, microwell, aerator, perangkat GC-MS, scanning electron
microscop tipe JSM-5000.
Metode Penelitian
Isolasi Minyak Atsiri (Lopes et al. 1997)
Minyak atsiri daun zodia diisolasi mengunakan metode destilasi uap. Daun
zodia dicuci dan dikeringudarakan. Selanjutnya sebanyak 400g daun kering
didestilasi uap selama 4 jam sampai. Destilat diambil, air yang tercampur
dipisahkan dengan penambahan Na2SO4 anhidrat. Minyak atsiri dipisahkan
Karakterisasi menggunakan GC-MS (Lopes et al. 1997)
Senyawa aktif dilarutkan dalam metanol. Larutan kemudian diinjeksikan ke
dalam alat GC-MS. Adapun spesifikasi alat GC-MS yang digunakan adalah
sebagai berikut:
instrumen GC-MS Agilent Technologies 6890 GC dengan auto sampler
5973 Mass Selective Detector
chemstation data system.
Kolom innowax dengan panjang kolom kapiler 30 m diameter 0.25 mm dan
ketebalan 0.25 μm.
Gas pembawa adalah helium dengan kecepatan alir 0.6 µl/menit
Pengujian Aktifitas Antibakteri (Simons & Craven, 1980)
Pengujian antibakteri dilakukan dengan metode disc difusion. Bakteri
biakan uji diinkubasikan pada temperatur 370C selama 24 jam. Ke dalam media
Mueller Hinton yang telah membeku dalam cawan petri diinokulasikan bakteri
biakan uji dengan densitas bakteri 108 (menggunakan standard Mac Farland no. 2.
Paper disc yang telah ditetesi contoh sebanyak 15 μl diletakkan pada permukaan
media. Pengamatan dan pengukuran zona bening dilakukan setelah inkubasi
selama 18 jam pada suhu 370C.
Uji Toksisitas Minyak Atsiri (Latha et al. 2007)
Uji toksisitas minyak atsiri menggunakan metode Brine-Shrimp Letality
Test. Disiapkan larutan uji minyak atsiri dengan konsentrasi 0, 100, 500, dan 1000
ppm dalam akuades dengan Tween 80 sebanyak 0,1% sebagai penurun tegangan
permukaan. Ke dalam setiap sumur yang berisi larutan dimasukkan larva udang
Artemia salina berumur 28 jam. Interaksi artemia dan larutan uji dilakukan selama
24 jam, selanjutnya jumlah larva udang yang mati dihitung. Data persen larva
udang hidup diplotkan terhadap konsentrasi minyak atsiri dalam kurva regresi
linier. Nilai LC50 ditentukan dengan menggunakan persamaan kurva yang
Kromatografi Lapis Tipis (Stahl, 1969)
Pemisahan senyawa antibakteri dilakukan dengan teknik kromatografi
lapis tipis dengan mencari eluen yang cocok. Lempeng lapis tipis silika gel 60 G
F254 dengan ukuran panjang 10 cm dan lebar 2.5 cm diberi tanda garis dengan
pensil pada jarak 1 cm dari setiap ujung lempeng. Fraksi aktif dilarutkan dalam
pelarut asal. Eluen dimasukkan dalam tabung kromatografi hingga tingginya
mencapai 0.5 cm dari dasar tabung dan ditutup rapat lalu dibiarkan agar tabung
jenuh dengan uap pelarut. Larutan ektrak sampel diteteskan pada lempeng silika
gel. Plat dicelupkan ke dalam larutan pengembang. Setelah mencapai batas 1 cm
dari bagian atas plat, elusi dihentikan selanjutnya plat dikeringkan pada suhu
ruang. Spot hasil pemisahan dideteksi menggunakan sinar UV dengan panjang
gelombang 254 nm dan 365 nm dan diberi tanda dengan pensil lalu dihitung nilai
retardation factor (Rf) masing-masing noda yang terbentuk.
Rf = jarak tempuh analit dari titik awal Jarak tempuh pelarut
Penentuan Minimum Inhibitory Concentration (MIC) (Edberg, 1986 yang dimodifikasi)
Nilai MIC adalah konsentrasi terendah yang mematikan semua bakteri
yang diinokulasikan ke dalam medium. MIC ditentukan menggunakan metode
broth dillution menggunakan kaldu Mueller Hinton. Minyak atsiri diencerkan
dalam suatu rangkaian konsentrasi dalam kaldu Mueller Hinton dengan bantuan
pengemulsi. Bakteri patogen dibuat konsentrasinya menjadi 105 sampai 106
organisme/ml. Ke dalam setiap tabung dimasukkan inokulum termasuk juga satu
tabung yang hanya berisi kaldu Mueller Hinton sebagai kontrol. Setelah inokulasi,
tabung ditempatkan dalam inkubator suhu 370C selama 18 jam. Selanjutnya kultur
bakteri disubkultur kembali pada media padat Mueller Hinton dan diinkubasi
kembali pada suhu 370C selama 18 jam. Setelah inkubasi selesai, dilakukan
pengamatan terhadap adanya pertumbuhan bakteri. Konsentrasi minyak atsiri
yang menyebabkan bakteri tidak tumbuh pada subkultur merupakan konsentrasi
Penentuan Waktu Kontak Minyak Atsiri (metode Bintang, 1993)
Disiapkan media cair Mueller Hinton yang mengandung ekstrak dengan
konsentrasi 2%. Disiapkan pula satu tabung yang hanya berisi media cair sebagai
kontrol. Semua tabung diinkubasi pada 200C selama 5 menit. Selanjutnya ke dalam
setiap tabung dimasukkan bakteri biakan uji S. aureus sebanyak 100 μl dengan
interval waktu 30 detik untuk setiap tabung. Setelah diinkubasi selama 1 jam, diambil
20 μl kultur untuk disubkulturkan pada media padat Mueller Hinton. Subkultur
dilakukan lagi pada setiap jam berikutnya selama 24 jam. Media yang telah
diinokulasi diinkubasi pada 370C selama 24 jam. Setelah itu jumlah bakteri yang
tumbuh dalam setiap media subkultur dihitung.
Analisis Perubahan Morfologi Sel (Ritz et al. 2001)
Tahap ini bertujuan untuk mengetahui perubahan morfologi dan struktur sel
bakteri. Perubahan-perubahan yang diamati diantaranya adalah perubahan
penampakan sel secara umum, ketebalan dinding sel, ukuran sel dan lainnya yang
dapat diamati dengan SEM.
Suspensi bakteri yang telah diinteraksikan dengan minyak atsiri daun
zodia dengan konsentrasi 2% selama 17 jam disentrifus dengan kecepatan 3500
rpm selama 15 menit. Supernatan dibuang, contoh direndam dengan
glutaraldehyde 2% selama beberapa jam. Contoh disentrifus kembali, larutan
fiksatif dibuang, ditambahkan buffer caccodylate, dilakukan perendaman selama
10 menit. Perendaman dilakukan dua kali. Contoh disentrifus kembali, buffer
dibuang, lalu ditambahkan osmium tetra oksida 1% dan direndam selama 1 jam.
Contoh disentrifuse, larutan dibuang, ditambahkan alkohol 50 % dan direndam
selama 10 menit sebanyak 2 kali. Selanjutnya berturut-turut tambahkan alkohol 70
% , alkohol 80%, dan 95 %, masing 2 kali 10 menit dan alkohol absolut selama 10
menit. Pengerjaan ini dilakukan sekali lagi. Contoh disentrifus, larutan dibuang,
ditambahkan t- butanol, contoh direndam 2 kali 10 menit, sentrifus dilakukan lagi,
butanol dibuang, ditambahkan butanol, dibuat suspensi dalam butanol, Potongan
cover slip dibekukan, dibuat ulasan suspensi pada cover slip lalu coverslip
dikeringkan dengan dengan Freeze Drier dan dilapisi dengan. Preparat siap
Isolasi Senyawa Aktif Antibakteri (Atkins, 1994)
Minyak atsiri daun zodia didinginkan mencapai suhu 18oC sampai terbentuk
kristal. Kristal yang dihasilkan dipisahkan dari fase cair. Kristal dicuci beberapa kali
menggunakan akuades. Kristal hasil cucian dilarutkan dalam heksan. Fraksi heksan
dipisahkan kemudian kristal sisa dilarutkaan dalam etil asetat. Pelarut dari setiap
fraksi kemudian dihilangkan dengan metode penguapan pada suhu kamar.
Selanjutnya aktivitas antibakteri diuji kembali serta dilakukan analisis kemurnian
HASIL DAN PEMBAHASAN
Komposisi Minyak Atsiri
Minyak atsiri daun zodia diisolasi menggunakan metode destilasi uap.
Rendemen yang dihasilkan adalah 1% berdasarkan bobot kering dengan kadar air
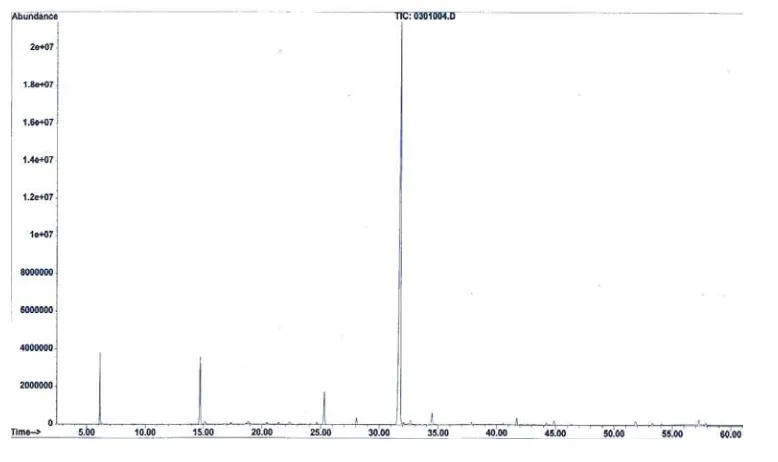
11%. Komponen minyak atsiri dianalisis dengan metode GC-MS.
Gambar 4 Spektra GC-MS minyak atsiri daun zodia
Spektra GC-MS menampakkan 26 puncak yang menunjukkan adanya 26
komponen penyusun minyak atsiri. Total persentase komponen penyusun adalah
100% dengan komponen utama adalah evodone dengan kadar 72.32%, diikuti
dengan menthofuran sebesar 7.52%, limonene 4.73%, curcumene 4.28% dan
fonenol 1.66%, sedangkan sisanya merupakan komponen-komponen berkadar
rendah (Tabel 3).
Evodone dan mentofuran termasuk dalam golongan monoterpena yang
terbentuk dari dua unit isoprena, terdiri dari 10 atom karbon. Evodone merupakan
furanomonoterpena. Komponen ini secara alami dapat diisolasi dari tumbuhan
Evodia hortensis (Lee et al. 2002). Dilaporkan bahwa evodone mampu
juga ditunjukkan terhadap Rudbeckia hirta (Weidenhamer, 1994). Seperti halnya
evodone, monoterpene golongan mentofuran juga memiliki efek allelopati
(Weidenhamer, 1994).
Tabel 3 Komponen minyak atsiri daun zodia
No. Nama komponen Kadar (%)
Curcumene terbentuk dari tiga unit isoprena. Komponen yang termasuk
dalam golongan sesquiterpena ini telah banyak diteliti akan aktivitas biologisnya,
diantaranya adalah sebagai antioksidan, antikanker, antiinflamasi, antibakteri dan
hepatoprotektor (Saiki (2008); Hwang et al (2008); Sidik (2008)).
Aktivitas Antibakteri Minyak Atsiri
Pengujian aktivitas antibakteri dilakukan untuk menentukan potensi
minyak atsiri dalam menghambat pertumbuhan bakteri. Uji dilakukan terhadap
bakteri Gram positif dan Gram negatif. Dengan demikian spektrum antibakteri
minyak atsiri dapat ditentukan. Hasil uji aktivitas antibakteri dapat dilihat dalam
Tabel 4.
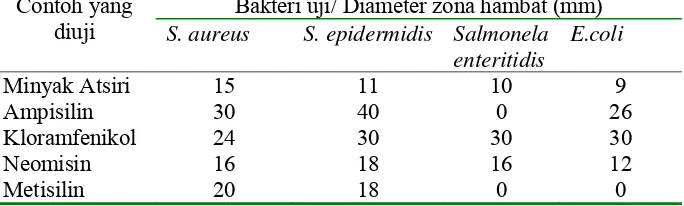
Tabel 4 Aktivitas antibakteri minyak atsiri
Contoh yang diuji
Bakteri uji/ Diameter zona hambat (mm)
S. aureus S. epidermidis Salmonela enteritidis
Minyak atsiri mampu menghambat bahkan membunuh pertumbuhan S.
aureus, S epidermidis, Salmonella enteritidis maupun E. coli. Aktivitasnya
berspektrum luas dan bersifat bakterisida. Aktivitas dimungkinkan berasal dari
senyawa-senyawa golongan terpenoid yang terkandung dalam minyak atsiri.
Karena sifatnya yang lipofilik, senyawa golongan terpenoid mampu berinteraksi
dengan membran biologis (Brehm-Strecher & Johnson, 2003). Akumulasi
senyawa-senyawa tersebut mempengaruhi struktur dan sifat fungsional membran.
Dibandingkan beberapa antibiotik komersial, aktivitas minyak atsiri
terhadap bakteri S. aureus mencapai 95% aktivitas neomisin. Aktivitas sebesar
61% aktivitas antibiotik neomisin dan metisilin dihasilkan dari uji terhadap
bakteri S. epidermidis. Untuk Salmonella enteritidis dan E. coli, aktivitasnya juga
dan 75% E. Coli). Ampisilin dan kloramfenikol menghasilkan aktivitas sangat
kuat. Aktivitas antibakteri minyak atsiri dapat dikatakan kecil jika dibandingkan
dengan kedua jenis antibiotik ini.
Salmonella enteritidis merupakan bakteri penyebab infeksi akut (Winarno,
2004). Bakteri ini mampu bertahan hidup pada kondisi pH 3.7-9.5 dan suhu
0-45.6oC. Dalam penelitian ini, bakteri Salmonella entritidis diisolasi dari karkas
ayam. Uji aktivitas antibakteri menunjukkan bahwa bakteri telah resisten terhadap
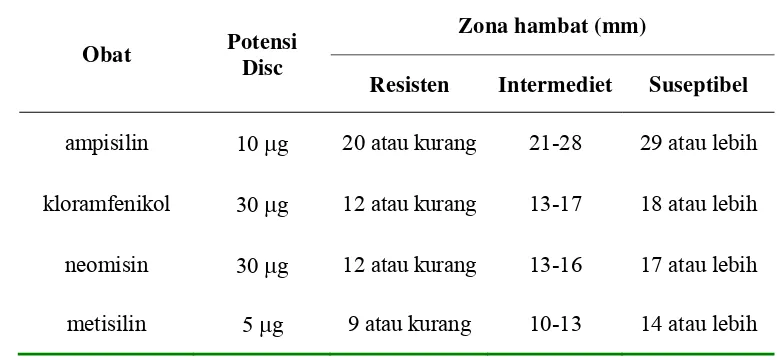
antibiotik ampisilin (Tabel 5). Resistensi mungkin disebabkan oleh pemberian
antibiotik terus menerus untuk meningkatkan produksi ternak ayam. Terhadap
bakteri resisten ini, minyak atsiri daun zodia mampu menghasilkan penghambatan
pertumbuhan dengan pembentukan zona hambat sebesar 10 mm (Tabel 4).
Tabel 5 Sensitifitas antibiotik (Simmons & Craven, 1980)
Obat Potensi
Disc
Zona hambat (mm)
Resisten Intermediet Suseptibel
ampisilin 10 μg 20 atau kurang 21-28 29 atau lebih
kloramfenikol 30 μg 12 atau kurang 13-17 18 atau lebih
neomisin 30 μg 12 atau kurang 13-16 17 atau lebih
metisilin 5 μg 9 atau kurang 10-13 14 atau lebih
Merujuk pada sensitifitas antibiotik dalam tabel 5, bakteri E. Coli juga
telah mengalami resistensi terhadap neomisin. Zona hambat yang terbentuk hanya
12 mm. Terhadap E. Coli resisten ini, minyak atsiri daun zodia mampu
menghasilkan penghambatan sebesar 9 mm.
David Stount mengelompokkan aktivitas antibakteri ke dalam tiga
golongan, yaitu rendah, sedang dan besar. Berdasarkan klasifikasi tersebut (Tabel
6), aktivitas antibakteri minyak atsiri daun zodia termasuk dalam golongan sedang
Tabel 6 Klasifikasi aktivitas antibakteri menurut David Stount (Suryawiria, 1978)
Aktivitas Diameter zona hambat (mm)
Rendah < 5
Sedang 5 – 10
Besar >10
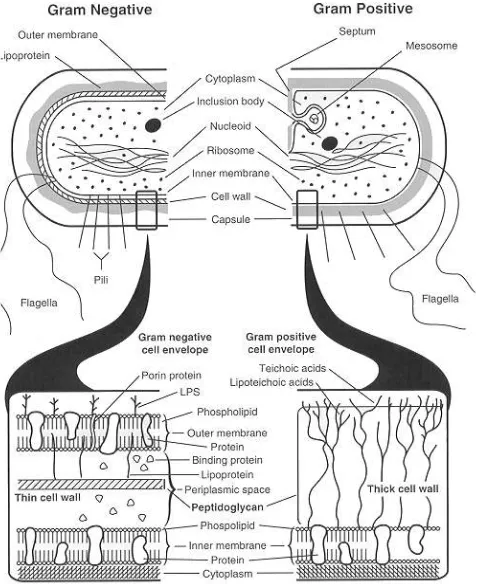
Bakteri Gram positif lebih peka terhadap minyak atsiri. Hal ini mungkin
disebabkan oleh karekteristik membran sel yang berbeda antara bakteri Gram
positif dan Gram negatif.
Bakteri Gram negatif memiliki pembatas permeabilitas tambahan yang
terdapat dari struktur membran luar (Brehm-Stecher & Johnson (2003). Dinding
sel bakteri Gram negatif lebih kompleks dibandingkan dengan bakteri Gram
positif. Perbedaan utama terletak pada adanya lapisan lipopolisakarida pada
lapisan membran luar sel bakteri Gram negatif. Lapisan inilah yang berperan
sebagai barrier (Gambar 6).
Hipotesis lain yang dikemukakan oleh McBroom & Kuehn (2007)
menjelaskan bahwa kemampuan bakteri Gram negatif untuk bertahan hidup
berhubungan dengan kemampuan bakteri Gram negatif dalam memanajemen
stress. Faktor stress dapat berupa temperatur, ketersediaan nutrisi, paparan
toksikan, salah satunya adalah antibiotik. Peningkatan jumlah vesikel merupakan
bentuk manajemen stress yang dimiliki bakteri
Vesikel berasal dari tonjolan membran luar yang melingkungi komponen
periplasma. Tonjolan membran tersebut mengalami fisi kemudian memisah
membentuk vesikel. Vesikel dapat bertindak sebagai sarana transport intraselular.
Vesikel yang berasosiasi dengan komponen berperan dalam pencernaan nutrisi
dan eliminasi organisme kompetitor (McBroom & Kuehn, 2005, dalam
McBroom& Kuehn (2007)).
Lepasnya vesikel membran luar menghasilkan mekanisme efektif bagi sel
untuk membuang materi seperti makromolekul kompleks, memungkinkan sel
membuang materi tersebut atau mengubah selubung bakteri yang menguntungkan
mekanisme perlindungan diri bakteri. Senyawa-senyawa antimikroba dapat terikat
pada vesikel kemudian terperangkap dalam lingkungan sel atau terikat pada
membran luar dan terlepas bersamaan dengan dibentuknya vesikel (McBroom &
Kuehn, 2007).
Gambar 6 Struktur dinding sel bakteri Gram positif dan Gram negatif
Nilai MIC Minyak Atsiri Daun Zodia
Nilai MIC menunjukkan konsentrsi terendah komponen antimikroba
dimana tidak terjadi pertumbuhan mikroba pada masa inkubasi 24 jam. Dalam
penelitian ini, konsentrasi minyak atsiri yang dicoba 0.2-1.25, bervariasi untuk
setiap jenis bakteri berdasarkan range yang dipersempit dari hasil uji pendahuluan.
Dari Gambar 7 terlihat bahwa nilai MIC minyak atsiri daun zodia
berbeda-beda untuk setiap jenis bakteri. Bakteri yang paling sensitif adalah S. epidermidis.
Salmonella enteritidis mempunyai ketahanan paling besar. Hal ini dapat dilihat
Gambar 7 Kurva penetapan MIC minyak atsiri daun zodia terhadap bakteri S. aureus (a) S. epidermidis (b) Salmonella enteritidis (c) dan E. col i(d)
Penetapan Waktu Kontak Minyak Atsiri
Kecepatan efek bakterisida atau durasi efek bakteriostatik dapat ditentukan
dengan analisis “time-killing” (Burt, 2004). Survival curve plot sebagai hasil
analisis menggambarkan hubungan antara jumlah sel yang hidup setelah
berinteraksi dengan minyak atsiri terhadap waktu.
Gambar 8 Penetapan waktu kontak minyak atsiri
Bakteri S. aureus mulai mati pada jam ke-3, akan tetapi sebagian besar
bakteri dapat bertahan dan masih dapat berkembang biak hingga jam ke-5. Jumlah
bakteri hidup menurun tajam mulai jam 7 hingga mati semuanya pada jam
ke-24.
Penurunan jumlah viabel sel dalam jumlah besar berada pada fase
stasioner bakteri. Menurut Pelczar & Chan (1986) dan Thiel (1999), pada fase
stasioner ini bakteri tumbuh dan membelah dalam kecepatan tetap. Nutrisi yang
tersedia mulai terbatas. Bakteri lebih sensitif terhadap stress (Carson et al. 2002).
Gambar 9 Kurva pertumbuhan bakteri S. aureus
Analisis Perubahan Morfologi Sel
Kerusakan dinding sel dan hilangnya material seluler dapat diamati
menggunakan scanning electron microscope. Prototip mikroskop ini pertama kali
dibuat oleh Ruska dan Knell dari Jerman pada tahun 1931, digunakan pertama kali
pada tahun 1940 serta dikomerialisasikan sekitar tahun 1965 (Suryanto, 1997).
Pada dasarnya peralatan terbagi dalam tiga komponen utama, yaitu sistem lensa
elektromagnetik, sistem pelarikan dan sistem deteksi. Sistem lensa berfungi
menfokuskan cahaya yang berupa berkas–berkas elektron dari filamen yang
dipanaskan. Pada sistem pelarikan, berkas elektron melarik obyek yang diamati.
Hasil interaksi berkas elektron menghasilkan elektron sekunder dan terhambur
balik dimana elektron-lelektron tersebut dikumpulkan dan diolah oleh detektor.
Detektor elektron sekunder kemudian mengolah dan memberikan informasi
tentang topografi dan morfologi permukaan sampel.
Analisis mikroskop elektron menunjukkan terjadinya kerusakan pada
membran sel bakteri S. aureus (Gambar 10 b, c dan d) karena berinteraksi dengan
minyak atsiri daun zodia. Permukaan sel mengkerut, kasar sehingga bentuknya
menjadi tidak beraturan (Gambar 10b). Ukuran sel menjadi lebih besar 3 sampai 5
kali lipat ukuran normal yang berkisar 1 µm (Gambar 10a). Respon yang sama
dihasilkan oleh bakteri P. aeruginosa dan E. coli yang terpapar antibiotik
ciprofloksaxin (Wojnicz et al. (2007). Dalam Clinkenbeard et al. (1989), keadaan
sel yang demikian dikatakan sedang mengalami swelling.
Masuknya toksin ke dalam plasma membran menyebabkan terbentuknya
pori transmembran (Bernheimer (1947) dalam Clinkenbeard et al. (1989)). Sel
yang menurut Cook (1965) mengalami “kebocoran” (Gambar 10c)
memungkinkan pergerakan ion secara pasif lebih cepat daripada yang berlangsung
melalui transport aktif. Dijelaskan dalam Clinkenbeard et al. (1989)) bahwa
ion-ion K+ keluar dari dalam sel melalui pori, sedangan komponen sitoplasma yang (d)
(c)
Gambar 10 Mikrograf elektron bakteri S. aureus
Ket: tanpa perlakuan (a) dan setelah perlakuan dengan minyak atsiri daun zodia (b, c, d) dengan pembesaran 10.000x (a, b, c,) dan 750x (d)
berukuran lebih besar seperti protein tetap berada dalam sel. Tekanan osmotik
dalam sel menjadi lebih besar daripada tekanan osmosis media sehingga sel
mengalami swelling.
Setelah mengalami swelling, komponen-komponen sitoplama yang
berukuran besar dapat keluar ke lingkungannya (Clinkenbeard et al. (1989)). Sel
tidak lagi memiliki nukleus atau organel lainnya. Kini sel hanya terdiri dari
membran sel yang kosong tanpa isi. Sel demikian disebut sebagai sel “ghost”
(Gambar 10d).
Nilai Toksisitas Minyak Atsiri terhadap Artemia salina
Uji toksisitas larva udang merupakan salah satu metode uji yang paling
banyak digunakan untuk memprediksi adanya aktivitas farmakologis suatu
senyawa. Menurut Olila et al (2001), beberapa kelebihan yang dimiliki oleh
metode ini adalah sederhana, tidak memerlukan sterilitas, hasil dapat diperoleh
dalam waktu singkat (24 jam).
Dalam uji toksisitas minyak atsiri daun zodia ini dicoba empat vaiasi
konsentrasi minyak atsiri, yaitu 0, 100, 500, dan 1000 ppm. Jumlah larva yang
mati diamati dihitung setelah larva berinteraksi dengan contoh selama 24 jam.
Dengan cara memplotkan jumlah larva yang mati dan konsentrasi minyak atsiri
dalam sebuah kurva regresi (Latha et al, 2007) maka didapatkan nilai toksisitas
minyak atsiri sebesar 376.7 ppm.
Uji toksisitas menunjukkan bahwa minyak atsiri daun zodia memiliki
potensi bioaktif farmakologis. Berdasarkan klasifikasi toksisitas menurut Tonkes
(Verma, 2008), toksisitas minyak atsiri daun zodia termasuk dalam golongan
sedang. Dengan demikian minyak atsiri tersebut tidak disarankan digunakan
secara oral, melainkan baik untuk penggunaan secara topikal. Meski demikian
perlu dilakukan analisis toksisitas lebih lanjut untuk melihat efeknya toksiknya.
Tabel 7 Hubungan Antara LC50, LD50 and EC50 dan Klasifikasi Toksisitas Tonkes
(Vema, 2008)
Pemisahan Komponen Minyak Atsiri Dengan Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan metode sederhana dan efisien untuk
memisahkan komponen yang jumlahnya sangat sedikit. Minyak atsiri bersifat
hidrofobik. Menurut Stahl (1969), semua jenis adsorben anorganik, kecuali
kieselguhr baik digunakan untuk memisahkan komponen yang bersifat lipofilik.
Silika gel dan alumina umum digunakan dalam pemisahan komponen minyak
atsiri.
Berdasarkan analisis menggunakan KLT diperoleh eluen terbaik yang
terdiri dari campuran heksan : dietileter dengan perbandingan 8 : 2 menggunakan
plat silika gel 60F254. Pemisahan menggunakan eluen tersebut menghasilkan 11
Gambar 12 Kromatogram minyak atsiri dalam pelarut heksan:dietileter
(8:2) pada plat silika gel 60F254
Tabel 8 Nilai hRf kromatogram minyak atsiri No.
Isolasi Senyawa Aktif Antibakteri
Dalam penelitian ini isolasi senyawa aktif dilakukan dengan metode
kristalisasi menggunakan temperatur dingin. Adapun tempertur yang digunakan
adalah 180C. Dari proses ini didapatkan kristal berwarna putih yang bersifat tidak
larut dalam air, akan tetapi larut dalam etanol dan pelarut organik semipolar
seperti etil asetat dan aseton dan pelarut nonpolar benzena. Dengan pelarut
heksan, kristal tidak dapat larut sempurna, ada sebagian yang larut dan ada pula
yang bertahan bentuknya sebagai kristal. Diperkirakan bahwa kristal terdiri dari
Kristal kasar hasil proses kristalisasi kemudian dipartisi. Pertama-tama
kristal dicuci menggunakan akuades untuk membersihkan pengotor. Selanjutnya
kristal dilarutkan dalam pelarut heksan. Fraksi heksan diambil kemudian
dikeringudarakan. Pencucian dengan heksan dilakukan berulang kali hingga
didapat fraksi heksan dan kristal sisa pelarutan dengan heksan. Kristal sisa
dilarutkan dalam etil asetat. Selanjutnya dilakukan uji antibakteri terhadap fraksi
heksan, etil asetat dan kristal kasar dalam aseton.
Gambar 13 Kristal hasil isolasi dari minyak atsiri daun zodia (mikroskop BHS Olympus pembesaran 10.000 x)
Gambar 14 Uji kelarutan kristal dalam air (1) heksan (2), aseton (3),
etil asetat (4) dan benzene (5)
1
4
5 2
Tabel 9 Aktivitas antibakteri fraksi heksan, etil asetat dan fraksi air terhadap
bakteri S. aureus
Jenis fraksi Diameter zona hambat (cm)
Fraksi heksan 7
Fraksi etil asetat 6
Kristal kasar dalam aseton 10
Uji aktivitas fraksi menunjukkan bahwa aktivitas fraksi lebih kecil jika
dibandingkan dengan aktivitas kristal kasar maupun aktivitas minyak atsiri (Tabel
9). Aktivitas antibakteri kristal kasar ternyata merupakan hasil kerja sinergi antara
komponen-komponen penyusun kristal kasar tersebut. Demikian juga dengan
aktivitas antibakteri minyak atsiri yang meruakan efek sinergi
komponen-komponennya.
Gambar 15 Aktivitas antibakteri fraksi heksan (1), etil asetat (2)
dan kristal kasar (3)
Untuk menguji kemurnian kristal hasil isolasi, kristal yang berasal dari
fraksi heksan dilarutkan kembali dalam pelarut heksan, kristal yang larut dalam
etil asetat dilarutkan dalam etil asetat, kemudian dianalisis dengan metode