DAYA HIPOGLIKEMIK HIDROLISAT, KONSENTRAT, DAN
ISOLAT PROTEIN TERIPANG PASIR (
Holothuria scabra
J.)
PADA TIKUS PERCOBAAN
RAHMAN KARNILA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Daya Hipoglikemik Hidrolisat, Konsentrat, dan Isolat Protein Teripang Pasir (Holothuria scabra J.) pada Tikus Percobaan adalah karya saya dengan arahan dari komisi pembimbing. Karya tersebut belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2012
ABSTRACT
RAHMAN KARNILA 2012. The Hypoglycemic activity 0f Protein Hydrolysate, Concentrate, and Isolate of Sea Cucumber (Holothuria scabra J.) in Rats. Under supervision of MADE ASTAWAN as Head of Supervisor, TUTIK WRESDIYATI and SUKARNO as Members.
Sea cucumber (Holothuriascabra J.) contains high protein. The protein consists of several specific amino acids that can lower blood glucose, making it beneficial for patients with diabetes melitus (DM). The research aims to study the influence of free amino acids content in protein hydrolysate, concentrate, and isolate of sea cucumber on the reduction of blood glucose in rats. The study consisted of five stages: (1) preparation and proximate analysis of sea cucumber meat, (2) analysis of total and free amino acids hydrolysate, concentrate, and isolate, (3) determination of the hypoglycemic effect in rats, (4) bioassay (in vivo), and (5) testing of histopathology (hematoxylin-eosin and imunohistochemical). The results showed that protein content of sea cucumbers of meat and powder were 72.93%db and 72.07%db, respectively. Hydrolysate, concentrate, and isolate showed relativelely similar content of total amino acid at level, 48.6%, 47.77%, and 48.61% respectively. However, the free amino acid content of hydrolysate was higher (2.88 %) than those of free amino acid content of concentrate (0.25%) and isolate (0.22%). The treatment of 300 mg/kg (dw) of hydrolysate, concentrate, and isolate showed the best hypoglicemic effect in rats. In vivo test showed that treatment of DM+hydrolysate, DM+concentrate, and DM+isolate lower blood glucose levels and promote weight loss. These result were better than treatment of positive control (DM). Decreasing of blood glucose levels was noticed at about 53.9%, 6.6%, and 27.6% respectively, whereas weight gain was noticed at about 22.6%, 12.9%, and 17.3% respectively. The result intracellular antioxidant enzyme activity showed that hydrolisate, concentrate, and isolate was quite capable of maintaining the activity of the enzyme superoxide dismutase (SOD) and was unable to maintain the activity of the enzyme glutathione peroxidase (GPx) and catalase. Histopathologic test with hematoxylin-eosin staining showed that the number of islets per field of view in group DM+hydrolysate treated rats was greater than those found in the DM+concentrate and DM+isolate groups. The number of islet were 2.47±0.92, 1.80±0.78, and 2.00±0.93 respectively. The number of islets of Langerhans found in positive and negative control rats were 1.80±0.78 and 3.07±0.80 respectively. Imunohistochemical test showed that the number of beta cells in the DM+hydrolysate group was higher than those of the DM+concentrate and DM+isolate groups, namely 40.10±6:35, 37.42±27.61, and 28.40±10.75. The number of beta cells in negative and positive control groups were 84.30±20.02 and 12.50 ±3.21 respectively.
RINGKASAN
RAHMAN KARNILA 2012. Daya Hipoglikemik Hidrolisat, Konsentrat, dan Isolat Protein Teripang Pasir (Holothuria scabra J.) pada Tikus Percobaan. Di bawah bimbingan MADE ASTAWAN sebagai Ketua Komisi serta TUTIK WRESDIYATI dan SUKARNO sebagai Anggota Komisi.
Teripang pasir (Holothuria scabra J.) memiliki kandungan protein tinggi dan tersusun atas beberapa asam amino spesifik yang dapat menurunkan glukosa darah, sehingga bermanfaat bagi penderita penyakit diabetes melitus yang prevalensinya di Indonesia terus meningkat secara nyata. Penelitian ini bertujuan untuk mempelajari hubungan antara kandungan asam amino bebas pada hidrolisat, konsentrat, dan isolat protein teripang dengan kemampuan penurunan glukosa darah pada tikus percobaan. Penelitian ini terdiri dari 5 tahap yaitu: (1) persiapan (preparasi daging teripang) dan analisis komposisi kimia (proksimat) daging teripang, (2) pembuatan dan analisis komposisi kimia hidrolisat, konsentrat, dan isolat protein teripang, serta uji daya hambat terhadap enzim α-glukosidase (in vitro), (3) uji efek hipoglikemik hidrolisat, konsentrat, dan isolat protein teripang pada tikus percobaan, (4) pengujian bioassay (in vivo) pengaruh hidrolisat, konsentrat, dan isolat protein teripang pada kadar glukosa darah tikus percobaan, dan (5) pengujian histologi (Hematoksilin-Eosin dan imunohistokimia) pengaruh hidrolisat, konsentrat, dan isolat protein teripang pada jaringan pankreas dan hati tikus percobaan.
Teripang yang digunakan dalam penelitian ini merupakan teripang yang sudah dewasa. Tubuh teripang secara garis besar terbagi atas empat bagian utama yaitu daging, kulit, jeroan dan gonad, air dan kotoran. Persentase terbesar adalah bagian daging yang mencapai 37.52% dengan kadar protein 72.93%bk, sedangkan dalam bentuk tepung teripang sekitar 72.07%bk.
Pembuatan hidrolisat, konsentrat, dan isolat protein teripang menggunakan bahan baku tepung teripang menghasilkan rendemen berturut-turut 51.03, 91.73, dan 9.03% dengan kandungan protein 89.57, 73.07, dan 82.17%bk. Profil asam amino total dan bebas terdiri dari asam amino penstimulasi insulin dan asam amino non-penstimulasi insulin. Kadar asam amino total hidrolisat, konsentrat, dan isolat protein teripang berturut-turut adalah 48.60, 47.77, dan 48.61%bk, sedangkan kadar asam amino bebas, 2.88, 0.25, dan 0.22%bk. Hidrolisat memiliki daya hambat tertinggi terhadap aktivitas enzim α-glukosidase dan berbeda sangat nyata (P<0.01) dibandingkan konsentrat dan isolat untuk setiap konsentrasi yang diuji. Rata-rata daya hambat hidrolisat sebesar 22% pada konsentrasi 1000 ppm dan 72% pada konsentrasi 10 000 ppm, untuk konsentrat 12% (1000 ppm) dan 56% (10 000 ppm), sedangkan isolat 13% (1000 ppm) dan 58% (10 000 ppm).
luas area di bawah kurva menyamai kelompok tikus perlakuan kontrol obat acarbose dan kontrol negatif (tikus normal), bahkan sangat nyata lebih kecil dibandingkan kelompok tikus perlakuan kontrol positif (tikus DM).
Selanjutnya daya hipolikemik hidrolisat, konsentrat, dan isolat protein teripang dievaluasi melalui pengukuran kadar glukosa darah dan perubahan berat badan tikus setiap 4 hari selama 28 hari masa percobaan. Hasil pengukuran menunjukkan kadar glukosa darah kelompok tikus perlakuan kontrol positif (tikus DM) berfluktuasi dan mengalami kenaikan selama 28 hari percobaan, sebaliknya untuk kelompok tikus DM yang diberi perlakuan hidrolisat, konsentrat, dan isolat protein teripang cenderung mengalami penurunan kadar glukosa darah selama 28 hari percobaan, sedangkan kelompok tikus kontrol negatif (tikus normal) kadar glukosa darahnya tetap normal (118-121.8 mg/dl). Kelompok tikus DM yang diberi perlakuan hidrolisat memiliki penurunan rata-rata kadar glukosa paling besar yaitu 186.4 mg/dl (53.9%), dibandingkan kelompok yang diberi perlakuan konsentrat (97.8 mg/dl atau 27.6%), dan isolat (23.4 mg/dl atau 6.6%). Kelompok tikus kontrol positif memiliki kadar glukosa darah terus meningkat, dengan rata-rata peningkatan 193.4 mg/dl (56.1%). Pengukuran perubahan berat badan menunjukkan kelompok tikus yang diberi perlakuan hidrolisat memiliki persentase kenaikan berat badan paling besar yaitu 42.4 g (22.6%), dibandingkan dengan kelompok tikus yang diberi perlakuan isolat (30.6 g atau 17.3%) dan konsentrat (22.8 g atau 12.9%). Berat badan kelompok tikus kontrol negatif (tikus normal) mengalami peningkatan rata-rata sebesar 51.6 g (27.9%), sebaliknya kelompok tikus kontrol positif (tikus DM) mengalami penurunan berat badan sebesar 58.8 g (33.3%).
Pada hari ke-29 dilakukan pembedahan dan pengukuran enzim antioksidan intrasel organ hati. Hasil penelitian menunjukkan bahwa hidrolisat, konsentrat, dan isolat protein teripang cukup mampu mempertahankan aktivitas SOD dan tidak mampu mempertahankan aktivitas GPx dan katalase.
Pada tahap akhir penelitian dilakukan analisis histologi jaringan pankreas meliputi pewarnaan hematoksilin-eosin (HE) dan pewarnaan imunohistokimia untuk mengamati profil sel beta pankreas sebagai penghasil insulin. Hasil penelitian menunjukkan jumlah pulau Langerhans per lapang pandang pada kelompok tikus yang diberi perlakuan hidrolisat tidak berbeda sangat nyata (P>0.01) dengan kelompok tikus kontrol negatif (tikus normal) dan lebih banyak dibandingkan kelompok tikus perlakuan kontrol positif (tikus DM), sedangkan kelompok tikus yang diberi perlakuan konsentrat dan isolat lebih sedikit dibandingkan kelompok tikus perlakuan kontrol negatif dan tidak berbeda sangat nyata (P>0.01) dibandingkan kelompok perlakuan kontrol positif. Hasil pewarnaan imunohistokimia terhadap sel beta pankreas dengan menggunakan antibodi monoklonal insulin menunjukkan kelompok tikus yang diberi perlakuan hidrolisat mempunyai rata-rata jumlah sel beta lebih banyak dibandingkan dengan kelompok tikus yang diberi perlakuan konsentrat dan isolat, serta kelompok tikus perlakuan kontrol positif (tikus DM), namun masih lebih rendah dan berbeda sangat nyata (P<0.01) dibandingkan kelompok tikus perlakuan kontrol negatif (tikus normal).
daya hipoglikemik terbaik dan mampu menurunkan kadar glukosa darah, serta meningkatkan berat badan tikus percobaan yang mengalami DM. Jumlah pulau Langerhans pada kelompok tikus yang diberi perlakuan hidrolisat tidak berbeda sangat nyata dibandingkan kelompok tikus kontrol negatif (tikus normal) dan lebih banyak dibandingkan kelompok tikus perlakuan kontrol positif (tikus DM). Jumlah rata-rata sel beta kelompok tikus yang diberi perlakuan hidrolisat lebih banyak dibandingkan kelompok tikus yang diberi perlakuan konsentrat dan isolat, namun masih lebih sedikit dibandingkan kelompok tikus perlakuan kontrol negatif (tikus normal).
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
DAYA HIPOGLIKEMIK HIDROLISAT, KONSENTRAT, DAN
ISOLAT PROTEIN TERIPANG PASIR (
Holothuria scabra
J.)
PADA TIKUS PERCOBAAN
RAHMAN KARNILA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: Dr.Ir. Feri Kusnandar, M.Sc
Dr. Dyah Iswantini Pradono, M.Sc. Agr
Judul Disertasi : Daya Hipoglikemik Hidrolisat, Konsentrat, dan Isolat Protein Teripang Pasir (Holothuria Scabra J.) pada Tikus Percobaan
Nama : Rahman Karnila
NIM : F 261070031
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Made Astawan, MS Ketua
Prof. Dr. drh. Tutik Wresdiyati, PA.Vet Dr. Ir. Sukarno, M.Sc
Anggota Anggota
Mengetahui
Ketua Mayor Ilmu Pangan Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti Haryadi, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia dan hidayahNya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan disertasi ini. Disertasi berjudul Daya Hipoglikemik Hidrolisat, Konsentrat, dan Isolat Protein Teripang Pasir (Holothuria scabra J.) pada Tikus Percobaan ini, merupakan salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Ilmu Pangan, Sekolah Pascasarjana Institut Pertanian Bogor.
Penulis menyampaikan terima kasih dan penghargaan kepada:
1. Bapak Prof. Dr. Ir. Made Astawan, MS. sebagai Ketua Komisi Pembimbing, yang sejak awal penulis menjalani tugas belajar di IPN-IPB selalu memberikan bimbingan, arahan, semangat, dan motivasi belajar serta masukan yang sangat berarti selama proses penelitian dan penyusunan disertasi ini.
2. Ibu Prof. Dr. drh. Tutik Wresdiyati. PA.Vet. sebagai Anggota Komisi Pembimbing, yang dengan penuh kesabaran dan disiplin telah memberikan bimbingan dan masukan sangat bermanfaat selama penelitian, khususnya bidang Histologi yang merupakan hal baru bagi penulis, dan dalam proses penyusunan disertasi ini.
3. Bapak Dr. Ir. Sukarno, M.Sc. sebagai Anggota Komisi Pembimbing, yang telah memberikan bimbingan, motivasi, dan semangat, yang sangat bermanfaat dalam penelitian dan penyusunan disertasi ini.
4. Ibu Dr. Ir. Ratih Dewanti-Haryadi, MSc. selaku Ketua Program Studi Ilmu Pangan dan seluruh staf pengajar IPN yang telah banyak membantu selama penulis menjalani tugas belajar di IPN.
5. Bapak Prof. Dr. Ir. Bustari Hasan, M.Sc, Dekan Fakultas Perikanan dan Ilmu Kelautan Universitas Riau yang telah memberikan kepercayaan penugasan belajar.
6. Tim Manajemen Beasiswa Program Pascasarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional yang telah memberikan dana untuk mengikuti program doktor.
7. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional yang telah memberikan bantuan dana penelitian melalui program penelitian Hibah Bersaing.
9. Ungkapan terima kasih yang mendalam dan tulus saya sampaikan kepada istriku tercinta Dewitha Suryaningsih, S.Pi, yang dengan penuh kasih sayang, pengertian dan kesabaran, selalu memberi dukungan dan semangat selama penulis menjalani tugas belajar. Demikian juga untuk kedua putriku Nadiah Ocvinitha Rahman dan Salsabilah Aulia Rahman, yang penuh kemandirian dan pengertian mendukung papanya yang sedang menjalani tugas belajar. 10. Endang Yuli Purwani, Paini S, Mala Nurilmala, Nida, Sarah Tsaqqofa, Bapak
Adi, Bapak Taufik, Bapak Iwan, teman-teman peneliti, teknisi dan analis di Laboratorium Kimia dan Mikrobiologi PAU IPB, serta Laboratorium Histologi FKH IPB.
11. Pihak-pihak lain yang tidak bisa penulis sebutkan satu per satu, atas bantuan langsung maupun tidak langsung yang diberikan selama penulis menjalankan tugas belajar
Akhirul kalam, penulis berharap semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Kari, Taluk Kuantan, Riau pada tanggal 30 Oktober 1969, dari ayahanda H. Ramahan Syarif dan ibunda Hj. Raja Kartini. Penulis adalah putra sulung dari lima bersaudara. Pada tahun 1989 penulis lulus dari SMA Negeri 1 Pekanbaru, kemudian melanjutkan studi sarjana (S1) di Jurusan Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Riau. Tahun 1995 penulis mendapat beasiswa URGE World Bank untuk program Magister (S2) pada Program Studi Teknologi Pasca Panen, IPB dan lulus pada Tahun 1998. Pada Tahun 1997, penulis diterima sebagai Dosen (Staf Pengajar) pada Jurusan Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Riau.Tahun 2001-2005 penulis menjabat sekretaris jurusan dan Tahun 2005-2007 menjabat ketua jurusan pada Jurusan Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Riau. Tahun 2007 penulis mendapat kesempatan melanjutkan pendidikan program doktor (S3) di Program Studi Ilmu Pangan, IPB yang disponsori oleh Beasiswa Program Pascasarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional.
DAFTAR ISI
2.2.1. Pengertian Diabetes Melitus ... 11
2.2.2. Klasifikasi Diabetes Melitus ... 12
2.3. Hiperglikemia ... 15
2.4. Pankreas dan Kerusakan Jaringan ... 16
2.5. Insulin ... 18
2.5.1. Struktur Insulin ... 19
2.5.2. Pengaturan Sekresi Insulin ... 19
2.5.3. Mekanisme Kerja Insulin ... 20
2.5.4. Resistensi Insulin ... 21
2.6. Aloksan ... 21
2.7. Antioksidan dalam Sistem Pertahanan Tubuh ... 23
2.8. Protein dan Asam Amino ... 26
3.3.2. Pembuatan dan Analisis Komposisi Kimia Hidrolisat, Konsentrat, dan Isolat Protein Teripang serta Uji Daya Hambat terhadap Aktivitas Enzim α-Glukosidase (in vitro)
(Percobaan 2) ... 43
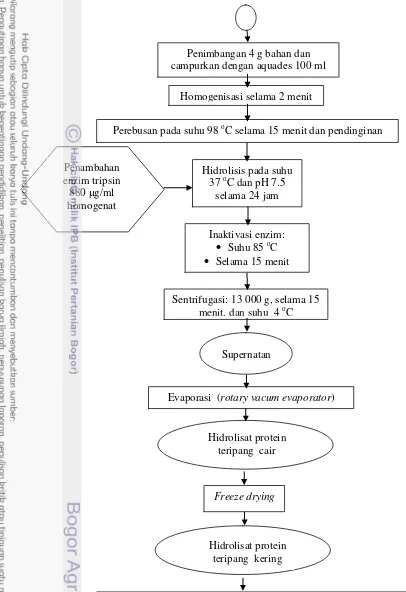
3.3.2.1. Hidrolisat protein teripang ... 43
3.3.2.2. Konsentrat protein teripang ... 46
3.3.2.3. Isolat protein teripang ... 46
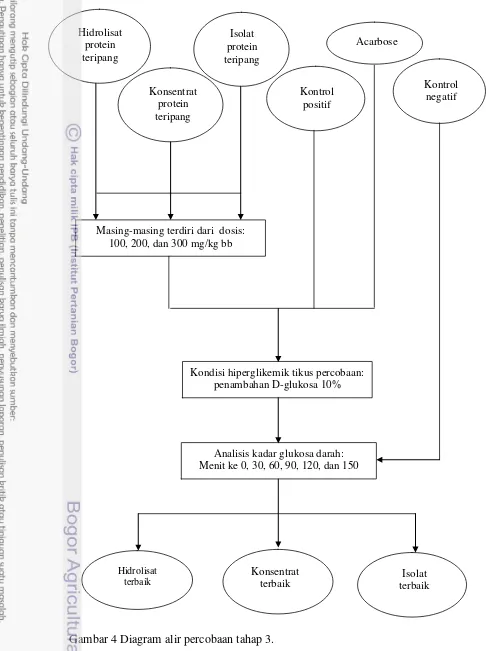
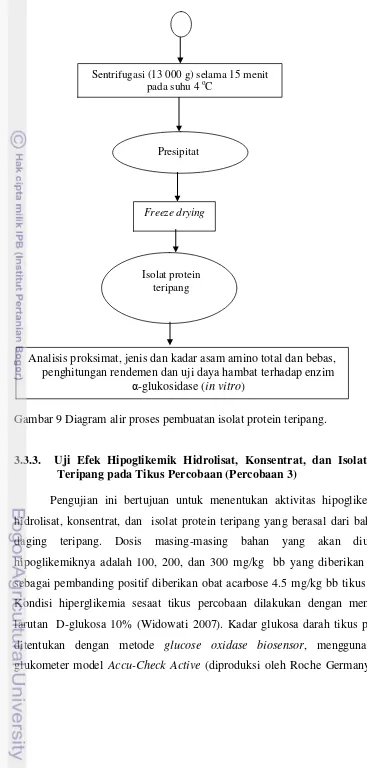
3.3.3. Uji Efek Hipoglikemik Hidrolisat, Konsentrat, dan Isolat Protein Teripang pada Tikus Percobaan (Percobaan 3) ... 50
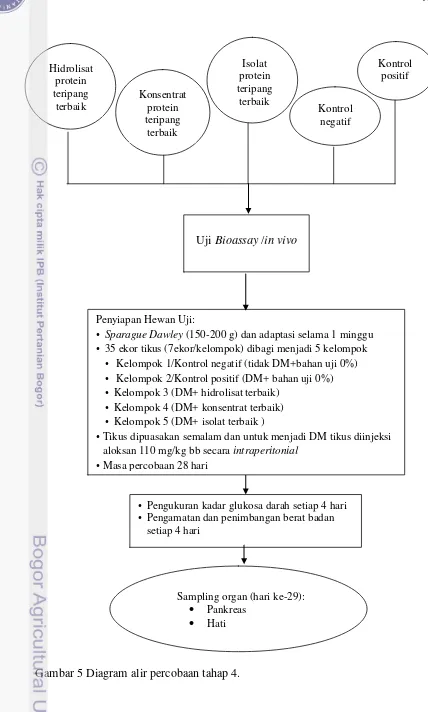
3.3.4. Pengujian Bioassay (in vivo) Pengaruh Hidrolisat, Konsentrat, dan Isolat Protein Teripang terhadap Kadar Glukosa Darah Tikus Percobaan (Percobaan 4)... 52
3.3.4.1. Penyiapan hewan percobaan ... 52
3.3.4.2.Pengukuran kadar glukosa darah dan berat badan tikus percobaan... 53
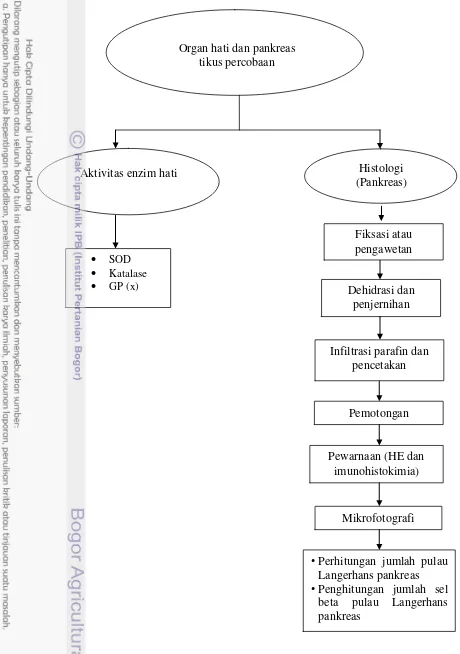
3.3.5. Pengujian Pengaruh Hidrolisat, Konsentrat, dan Isolat Protein Teripang terhadap Aktivitas Enzim Antioksidan Intrasel Hati dan Histologi (Hematoksilin-Eosin dan Imunohistokimia) Jaringan Pankreas Tikus Percobaan (Percobaan 5) ... 54
3.3.5.1.Pembuatan sediaan histologi (HE dan Imunohistokimia) ... 54
3.3.5.2. Pengukuran aktivitas enzim katalase ... 59
3.3.5.3. Pengukuran aktivitas enzim superoksida dismutase (SOD) ... 60
3.3.5.4. Pengukuran aktivitas enzim glutation peroksidase ... 60
3.3.6. Rancangan Percobaan dan Analisis Data ... 61
4. HASIL DAN PEMBAHASAN ... 62
4.1. Karakterisasi, Preparasi dan Analisis Kimia Bahan Baku Teripang .. 62
4.1.1. Karakterisasi Teripang Pasir (Holothuria scabra J) ... 62
4.1.2. Preparasi Bagian Tubuh Teripang Pasir ... 62
4.1.3. Analisis Kimia (Proksimat) Daging dan Tepung Teripang Pasir 64 4.1.4. Tepung Teripang ... 66
4.2. Hidrolisat, Konsentrat, dan Isolat Protein Teripang ... 67
4.2.1. Rendemen dan Analisis Proksimat... 67
4.2.2. Jenis dan Kadar Asam Amino Total dan Bebas ... 72
4.2.3. Penghambatan Aktivitas Enzim α- Glukosidase secara In Vitro 74 4.3. Aktivitas Hipoglikemik ... 77
4.4. Evaluasi Daya Hipoglikemik Hidrolisat, Konsentrat, dan Isolat Protein Teripang... 83
4.4.1. Komposisi Kimia Ransum Tikus Percobaan ... 83
4.4.2. Hewan Model Diabetes Melitus dan Induksi Aloksan ... 84
4.4.3. Daya Hipoglikemik Hidrolisat, Konsentrat, dan Isolat pada Tikus Percobaan ... 85
4.5. Aktivitas Enzim Antioksidan Intrasel (SOD, GPx, dan Katalase)
Hati ... 92
4.6. Analisis Histologi Jaringan Pankreas ... 97
4.6.1. Pewarnaan Hematoksilin-Eosin (HE) ... 97
4.6.2. Pewarnaan Imunohistokimia terhadap Sel Beta Pankreas ... 101
4.7. Mekanisme Sifat Hipoglikemik Hidrolisat Protein Teripang ... 104
4.7.1. Peningkatan Sekresi Insulin oleh Asam Amino Bebas ... 105
4.7.2. Penghambatan Aktifitas Enzim α-Glukosidase ... 107
5. KESIMPULAN DAN SARAN ... 109
5.1. Kesimpulan ... 109
5.2. Saran ... 110
DAFTAR PUSTAKA ... 111
DAFTAR TABEL
Halaman
1. Karakterisasi sel-sel endokrin pulau Langerhans ... 16
2. Pengelompokan asam amino berdasarkan produk akhir yang diperoleh dari katabolisme berbagai macam asam amino untuk pembentukan energi 33 3. Pengelompokan perlakuan tikus untuk uji efek hipoglikemik ... 52
4. Persentase bagian tubuh teripang pasir (Holothuria scabra J) ... 63
5. Hasil analisis proksimat daging teripang pasir ... 64
6. Rendemen pembuatan tepung daging teripang ... 66
7. Hasil analisis proksimat tepung daging teripang pasir ... 67
8. Rata-rata rendemen hidrolisat, konsentrat, dan isolat protein teripang ... 70
9. Analisis proksimat hidrolisat, konsentrat, dan isolat protein teripang pasir 72 10. Profil asam amino total dan bebas HPT, KPT, dan IPT ... 73
11. Perubahan kadar glukosa darah tikus setelah pemberian hidrolisat protein teripang terhadap kadar glukosa darah puasa (n=5) ... 78
12. Perubahan kadar glukosa darah tikus setelah pemberian konsentrat protein teripang terhadap kadar glukosa darah puasa (n=5) ... 78
13. Perubahan kadar glukosa darah tikus setelah pemberian isolat protein teripang terhadap kadar glukosa darah puasa (n=5)... 79
14. Formulasi ransum standar tikus percobaan (per 100 g, AOAC 1995) ... 83
15. Analisis proksimat ransum standar tikus percobaan ... 84
16. Rata-rata kadar glukosa darah tikus selama 28 hari percobaan (mg/dl) (n=5) ... 86
17. Rata-rata berat badan tikus selama 28 hari percobaan (gram) (n=5) ... 91
18. Pengaruh pemberian HPT, KPT, dan IPT terhadap aktivitas enzim antioksidan intrasel pada hati tikus percobaan ... 93
19. Rata-rata jumlah pulau Langerhans pada jaringan pankreas tikus percobaan per lapang pandang pada pembesaran 20x ... 98
DAFTAR GAMBAR
Halaman
1. Jalur umum katabolisme protein dan asam amino ... 34
2. Diagram alir percobaan tahap 1 ... 38
3. Diagram alir percobaan tahap 2 ... 39
4. Diagram alir percobaan tahap 3 ... 40
5. Diagram alir percobaan tahap 4 ... 41
6. Diagram alir percobaan tahap 5 ... 42
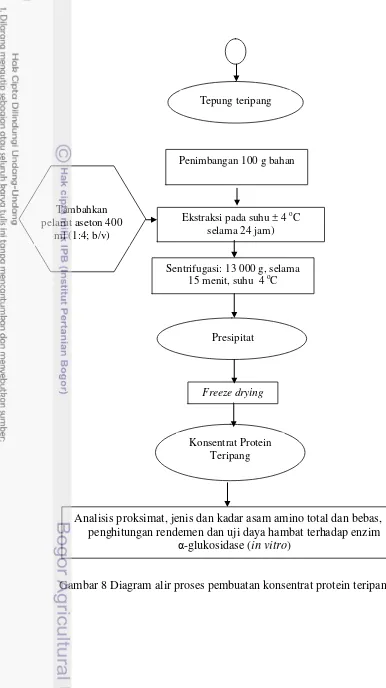
7. Diagram alir proses pembuatan hidrolisat protein teripang ... 45
8. Diagram alir proses pembuatan konsentrat protein teripang ... 48
9. Diagram alir proses pembuatan isolat protein teripang... 50
10. Bahan baku teripang pasir (Holothuria scabra J) ... 62
11. Bagian tubuh teripang pasir (Holothuria scabra J)... 63
12. Tepung daging teripang pasir (Holothuria scabra J) ... 66
13. Hidrolisat protein teripang kering ... 68
14. Konsentrat protein teripang kering... 69
15. Isolat protein teripang kering ... 70
16. Kurva derajat hidrolisis pada pembuatan hidrolisat protein teripang ... 71
17. Daya hambat HPT, KPT, dan IPT terhadap aktivitas enzim α -glukosidase ... 75
18. Perubahan kadar glukosa darah tikus setelah pemberian HPT ... 81
19. Perubahan kadar glukosa darah tikus setelah pemberian KPT ... 81
20. Perubahan kadar glukosa darah tikus setelah pemberian IPT ... 81
21. Perubahan kadar glukosa darah tikus selama 28 hari percobaan ... 87
22. Perubahan berat badan tikus selama masa percobaan 28 hari ... 90
23. Foto mikrograf pulau Langerhans pankreas tikus dengan pewarnaan HE ... 100
24. Foto mikrograf sel beta pulau Langerhans dengan pewarnaan imunohistokimia... 102
DAFTAR LAMPIRAN
Halaman
1. Analisis proksimat ... 120 2. Analisis jenis dan kadar asam amino total dan bebas serta pengukuran
derajat hidrolisis ... 122 3. Perhitungan jumlah rendemen dan uji daya hambat aktivitas enzim α
-glukosidase ... 126 4. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
rendemen hidrolisat, konsentrat, dan isolat protein teripang ... 128 5. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
proksimat hidrolisat, konsentrat, dan isolat protein teripang ... 129 6. Hasil kromatogram HPLC asam amino standar, jenis dan kadar asam
amino total hidrolisat, konsentrat, dan isolat protein teripang ... 132 7. Hasil kromatogram HPLC asam amino bebas hidrolisat, konsentrat,
dan isolat protein teripang ... 135 8. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
daya hambat hidrolisat, konsentrat, dan isolat protein teripang
terhadap aktivtas enzim α-glukosidase ... 142 9. Rata-rata kadar glukosa darah tikus pada uji aktivitas hipoglikemik ... 148 10. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
kadar glukosa darah menit ke-30 dan luas area di bawah kurva tikus setelah pemberian hidrolisat protein teripang terhadap kadar glukosa
darah puasa ... 149 11. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
kadar glukosa darah menit ke- 30 dan luas area di bawah kurva tikus setelah pemberian konsentrat protein teripang terhadap kadar glukosa
darah puasa ... 151 12. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
kadar glukosa darah menit ke- 30 dan luas area di bawah kurva tikus setelah pemberian isolat protein teripang terhadap kadar glukosa darah
puasa... 153 13. Analisis ragam (ANOVA) dan uji lanjut Duncan perubahan kadar
glukosa darah tikus menit ke-30 pada perlakuan pemberian hidrolisat
protein teripang ... 155 14. Analisis ragam (ANOVA) dan uji lanjut Duncan perubahan kadar
glukosa darah tikus menit ke- 30 pada perlakuan pemberian konsentrat
15. Analisis ragam (ANOVA) dan uji lanjut Duncan perubahan kadar glukosa darah tikus menit ke- 30 pada perlakuan pemberian isolat
protein teripang ... 157 16. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
perubahan kadar glukosa darah tikus selama 28 hari percobaan ... 158 17. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
perubahan berat badan (BB) tikus selama 28 hari percobaan ... 163 18. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
pengaruh pemberian hidrolisat, konsentrat, dan isolat protein terhadap
enzim antioksidan intrasel pada hati tikus percobaan ... 168 19. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
jumlah pulau Langerhans pada jaringan pankreas tikus percobaan pada
15 lapang pandang ... 171 20. Hasil analisis statistik, sidik ragam (ANOVA), dan uji lanjut Duncan
jumlah sel beta pulau Langerhans pankreas tikus percobaan pada 10
1.
PENDAHULUAN
1.1.Latar Belakang
Indonesia adalah negara kepulauan terbesar di dunia yang memiliki 17 504 pulau dengan panjang garis pantai 81 000 km dan perairan laut sekitar 5.8 juta km2 (75% dari total wilayah Indonesia), membentang pada garis khatulistiwa. Hal tersebut menyebabkan Indonesia mempunyai sumberdaya hayati yang sangat kaya dan beragam, baik untuk wilayah darat maupun laut, sehingga dikenal sebagai negara mega biodiversity. Kekayaan hayati tersebut perlu dimanfaatkan sebaik-baiknya untuk kesejahteraan rakyat Indonesia.
Bentuk-bentuk pemanfaatan tersebut, terutama di bidang bioteknologi kelautan, saat ini berkembang sangat pesat. Pemanfaatan terutama untuk obat-obatan dan bahan farmasi seperti anti kanker, anti asma, obat diabetes, anti bakteri, obat sakit jantung, anti tetanus, obat penenang dan lain-lain. Hal tersebut dilakukan dengan mengekstraksi komponen-komponen bioaktif yang terkandung pada sumberdaya hayati laut tersebut.
Salah satu hasil laut yang mempunyai nilai ekonomis penting adalah teripang atau disebut juga dengan sea cucumber, teat fish atau ginseng laut. Secara ekonomi, teripang memiliki nilai penting, yaitu sebagai sumber biofarmaka hasil laut potensial dan sebagai makanan kesehatan (Dance et al. 2003). Teripang memiliki potensi yang cukup besar di Indonesia, yaitu dengan total hasil tangkapan mencapai 184 631 ton tahun 2004. Hasil tangkapan teripang pada dasawarsa terakhir cenderung meningkat, dengan rata-rata peningkatan pada tahun 2003-2004 sebesar 51.37%. Saat ini perdagangan teripang telah meluas, terutama ke Hongkong dan Singapura, yang merupakan dua negara pusat perdagangan teripang dunia (DKP 2006).
teripang adalah EPA dan DHA (Dewi 2008). Kandungan gizi dan bahan bioaktif yang dikandung teripang sangat bermanfaat untuk penyembuhan berbagai penyakit, di antaranya diabetes melitus (Dance et al. 2003).
Diabetes Melitus (DM) merupakan penyakit metabolik yang disebabkan oleh ketidakmampuan pankreas untuk memproduksi insulin yang cukup, atau tubuh tidak mampu menggunakan insulin yang diproduksinya dengan efektif. Diabetes melitus dapat pula diartikan sebagai penyakit yang ditandai oleh kelainan metabolisme karbohidrat, lemak, dan protein yang diikuti oleh penurunan produksi insulin dan aktivitasnya, sehingga terjadi kelainan cara tubuh mencerna makanan menjadi energi (American Diabetes Association 2004).
Pankreas merupakan organ yang berperan penting dalam terjadinya DM. Pankreas memiliki dua fungsi yaitu fungsi endokrin dan fungsi eksokrin. Fungsi endokrin pankreas adalah menghasilkan hormon. Paling sedikit terdapat empat peptida yang mempunyai aktivitas hormonal yang disekresi oleh pulau Langerhans pankreas (insulin, glukagon, somatostatin dan pancreatic polypeptide). Dua di antara hormon ini mempengaruhi metabolisme karbohidrat, protein, dan lemak, yaitu hormon insulin yang dikeluarkan oleh sel beta dan hormon glukagon yang dihasilkan sel alfa. Kerusakan pada sel beta pankreas akan menurunkan produksi insulin sehingga menimbulkan terjadinya DM (Suarsana 2009).
terjadinya gangguan pada sekresi insulin yang antara lain ditimbulkan oleh kurangnya ketersediaan energi untuk sekresi insulin dari sel beta pankreas.
Pencegahan DM tipe 2 ini dapat dilakukan secara primer maupun sekunder. Pencegahan primer adalah pencegahan melalui modifikasi gaya hidup, seperti pola makan yang sesuai, aktivitas fisik yang cukup, dan penurunan berat badan dengan dukungan program edukasi berkesinambungan. Pencegahan sekunder dilakukan melalui pemeriksaan dan pengobatan, serta mengkonsumsi oral hipoglicemic drugs (OHG) tipe pankreatik (Depkes 2005). OHG ditujukan untuk perawatan dan harus diberikan secara terus-menerus, sehingga berdampak membosankan bagi penderita. Selain itu pemberian OHG yang berkepanjangan dapat menimbulkan efek samping yang bisa memperparah penderita DM tipe 2. Oleh karena itu perlu dilakukan upaya untuk menyembuhkan DM tipe 2 ini dengan memanfaatkan komponen bioaktif bahan pangan alami menjadi suatu pangan fungsional tanpa menimbulkan efek samping yang berbahaya dan dapat dikonsumsi dengan nyaman oleh penderita DM tipe 2.
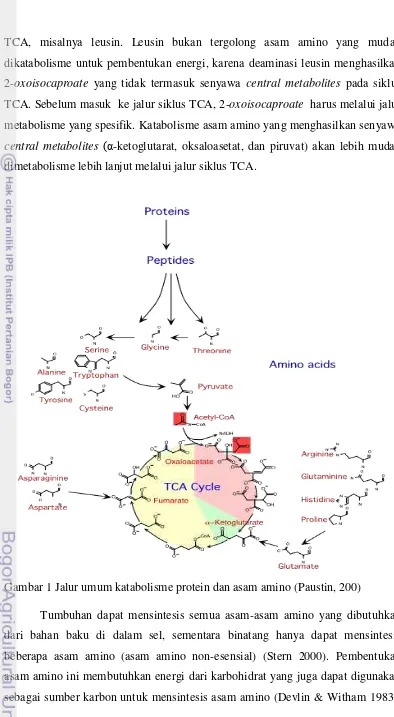
sekresi insulin kemungkinan jauh lebih rendah dibandingkan dengan asam amino dalam bentuk bebasnya.
Hasil penelitian menunjukkan bahwa secara in vitro dengan menginkubasi beberapa asam amino dan glukosa dengan pancreas islet tikus, maupun secara in vivo yaitu dengan mencampurkan asam amino pada diet hewan percobaan, diketahui bahwa leusin, isoleusin (Sans et al. 2006 dan Yang et al. 2006), arginin (Kim et al. 2004 dan Yang et al. 2006), alanin, fenilalanin, lisin (Van Loon et al. 2000, Calbeat dan Mac Lean 2002, Van Loon et al. 2003) dan metionin (Kanetro 2009) mampu menstimulasi sekresi insulin. Mekanisme stimulasi sekresi insulin oleh asam amino antara lain adalah bersinergi dengan glukosa untuk meningkatkan ketersediaan energi dalam sel beta pankreas melalui jalur siklus tricarboxylic acid (TCA). Oleh karena itu konsumsi bahan pangan yang mengandung asam amino spesifik dalam keadaan bebas diduga dapat meningkatkan kecepatan sekresi insulin oleh sel beta pankreas, sehingga mempercepat peningkatan kadar insulin darah. Hal tersebut sangat bermanfaat bagi penderita DM tipe 2 untuk mempercepat penurunan kadar glukosa darah.
1.2.Tujuan Penelitian 1.2.1. Tujuan Umum
Penelitian ini secara umum bertujuan untuk mempelajari hubungan antara kandungan asam amino bebas pada hidrolisat, konsentrat, dan isolat protein teripang dengan kemampuan penurunan glukosa darah pada tikus percobaan. 1.2.2. Tujuan Khusus
Secara khusus penelitian ini bertujuan untuk:
1. Mendapatkan hidrolisat, konsentrat, dan isolat protein teripang serta
menganalisis komposisi kimia dan daya hambatnya terhadap enzim α-glukosidase.
2. Menentukan dosis hidrolisat, konsentrat, dan isolat protein teripang yang bersifat hipoglikemik pada tikus hiperglikemik sesaat.
3. Mengevaluasi kadar glukosa darah tikus percobaan yang diberi hidrolisat, konsentrat, dan isolat protein teripang.
4. Menganalisis aktivitas enzim antioksidan intrasel hati dan perubahan histologi jaringan pankreas (sel beta) tikus percobaan yang diberi hidrolisat, konsentrat, dan isolat protein teripang.
1.3.Manfaat Penelitian
Manfaat penelitian ini adalah:
1. Memberikan informasi kepada masyarakat tentang jenis asam amino bebas spesifik pada protein teripang yang dapat meningkatkan kemampuan stimulasi sekresi insulin oleh sel beta pankreas.
2. Memberikan informasi ilmiah bahwa teripang yang mengandung asam amino bebas spesifik dapat digunakan sebagai pangan fungsional yang murah dan mudah dikonsumsi, khususnya bagi penderita DM tipe 2.
3. Memberikan peluang pengembangan produk pangan bagi industri dengan memanfaatkan asam amino bebas dari teripang sebagai komponen fungsional untuk mencegah dan mengatasi DM tipe 2.
1.4.Perumusan Masalah
Beberapa hasil penelitian telah menunjukkan bahwa asam amino spesifik dalam bentuk bebas, seperti: leusin, arginin, lisin, alanin, fenilalanin, isoleusin, dan metionin dapat meningkatkan stimulasi sekresi insulin oleh sel beta pankreas sehingga bersifat hipoglikemik. Pada sisi lain, teripang pasir (Holothuria scabra J) merupakan salah satu komoditas perikanan yang mempunyai nilai ekonomis tinggi karena dapat dimanfaatkan sebagai biofarmaka dan sebagai pangan kesehatan serta sebagai bahan baku berbagai industri. Hal tersebut disebabkan oleh kandungan proteinnya yang tinggi yaitu 70-80%bk, serta tersusun atas beberapa asam amino. Akan tetapi jenis asam amino penyusun protein teripang tersebut belum diketahui dan keberadaannya masih saling berikatan satu dengan yang lain membentuk komponen protein. Kemudahan protein untuk dimanfaatkan oleh sel beta pankreas dalam menstimulasi sekresi insulin dan menurunkan kadar glukosa darah diduga jauh lebih rendah dibandingkan dengan asam amino dalam bentuk bebas. Sejauh ini jenis asam amino penyusun protein teripang dan bagaimana perannya dalam kondisi bebas terhadap penurunan kadar glukosa darah belum diketahui. Oleh karena itu penelitian ini dimaksudkan untuk mengungkap jenis asam amino penyusun protein teripang terutama dalam bentuk hidrolisat, konsentrat, dan isolat, serta kemampuannya dalam menurunkan kadar glukosa darah.
1.5.Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Hidrolisat, konsentrat, dan isolat protein teripang mengandung jenis asam amino bebas yang berbeda dengan kemampuan daya hambat terhadap enzim α-glukosidase berbeda, sehingga memberikan dampak yang berbeda pula terhadap DM.
2. Pemberian hidrolisat, konsentrat, dan isolat protein daging teripang dapat bersifat hipoglikemik pada tikus percobaan yang hiperglikemik.
2. TINJAUAN PUSTAKA
2.1. Teripang
Teripang adalah hewan tidak bertulang belakang dengan tubuh berbentuk silinder memanjang dengan garis oral dan aboral sebagai sumbu yang menghubungkan bagian anterior dan posterior. Bentuk tersebut menyerupai mentimun sehingga teripang dikenal dengan nama mentimun laut (sea cucumber). Mulut dan anus terletak di ujung poros berlawanan, yaitu mulut di anterior dan anus di posterior, di sekitar mulut teripang terdapat tentakel yang dapat dijulurkan dan ditarik dengan cepat. Tentakel merupakan modifikasi kaki tabung yang berfungsi untuk menangkap makanan (Wibowo et al. 1997).
Teripang termasuk salah satu hewan berkulit duri atau Echinodermata, tetapi duri-duri pada teripang tidak dapat dilihat dengan mata biasa karena sangat kecil dan hanya dapat dilihat dengan menggunakan mikroskop. Duri-duri teripang merupakan butir-butir kapur mikroskopis yang letaknya tersebar dalam lapisan epidermis. Dinding tubuh teripang bersifat elastis, dengan mulut di bagian anterior dan anus di bagian posterior, dengan panjang tubuh dewasa untuk spesies terkecil 2.54 cm dan ukuran terpanjang 90 cm, sedangkan spesies teripang pasir mempunyai ukuran 25-35 cm. Pada saat hidup bobotnya dapat mencapai 500 g, bahkan panjang teripang dapat mencapai 60 cm dengan bobot 2 kg (Wibowo et al. 1997).
Permukaan tubuh teripang pasir tidak bersilia dan diselimuti lapisan kapur yang ketebalannya dipengaruhi umur. Kondisi mulut yang membujur ke anus terdapat lima deret kaki tabung (ambulaceral), tiga deret kaki tabung berpenghisap (trivium) terdapat di perut berperan dalam pergerakan dan pelekatan. Dua deret kaki tabung terdapat di punggung (bivium) sebagai alat respirasi. Lapisan bawah kulit memiliki satu lapis otot melingkar dan lima lapis otot memanjang. Pada lapisan bawah otot terdapat rongga tubuh yang berisi organ tubuh, seperti gonad dan usus (Fechter 1969).
dan Holothuridae, Genus Holothuria, Stichopus, Thelonota, Actinopyga, Muelleria, dan Spesies Holothuria scabra J, Holothuria nobilis J, Stichopus variegatus J, Thelonota ananas J, Actinopyga lecanora J, Actinopyga miliaris, Actinopyga echinites, Muelleria lecanora.
Jumlah spesies teripang di dunia sekitar 2 000 spesies dengan daerah penyebaran teripang sangat luas. Terdapat tiga genus teripang yang ditemukan di Indonesia yaitu genus Holothuria, Muelleria dan Sticopus. Spesies yang ditemukan 23 dan baru lima spesies (dari genus Holothuria) yang sudah dieksploitasi dan dimanfaatkan serta mempunyai nilai ekonomis penting. Kelima jenis teripang tersebut adalah teripang hitam (Holothuria edulis), teripang getah atau keling (Holothuria vacabunda), teripang merah (Holothuria vatiensis), teripang coklat (Holothuria mamiorata), dan teripang pasir (Holothuria scabra) yang merupakan spesies yang paling banyak dibudidayakan dan diperdagangkan di Indonesia.
Penyebaran teripang di Indonesia cukup luas terutama ekosistem terumbu karang yang jernih, berpasir, berlumpur, bebas dari polusi, air relatif tenang dengan kualitas air cukup baik. Habitat yang ideal bagi teripang adalah air laut dengan salinitas 29-33‰ yang memiliki kisaran pH 6.5-8.5, kecerahan air 50-150 cm, kandungan oksigen terlarut 4-8 ppm dan suhu air laut 20-25 oC (Wibowo et al. 1997). Makanan utama teripang pada semua habitat adalah detritus, dan zat organik dalam pasir, sedangkan plankton, bakteri dan biota mikroskopis adalah makanan pelengkapnya. Daerah penyebaran teripang antara lain Bangka, Sulawesi (sepanjang pantai selatan, Sulawesi Tenggara, Sulawesi Tengah, Sulawesi Utara termasuk Sangir Talaut), Maluku (Maluku Tengah, Maluku Tenggara, dan Maluku Utara), Nusa Tenggara Barat (Sumbawa), Nusa Tenggara Timur (Flores dan Sumba) dan Papua (Tuwo 2004).
Teripang muda dengan ukuran dan bobot tertentu yang dipelihara selama 8-10 bulan akan menghasilkan teripang yang siap panen dengan ukuran komersial. Budidaya terpadu yaitu mulai dari pembenihan, pemeliharaan sampai pemanenan telah dirintis oleh Sub Balai Budidaya Laut di Lampung, akan tetapi sampai saat ini masih dalam taraf penelitian. Jenis teripang yang paling banyak dibudidayakan adalah teripang pasir (sandfish) atau teripang putih (Holothuria scabra).
Potensi teripang dari perikanan tangkap di Indonesia cukup besar, yaitu 184 631 ton pada tahun 2004 (DKP 2006). Daerah penghasil utama teripang adalah perairan pantai Sulawesi Tengah, perairan pantai NTT dan Sulawesi Selatan. Sedangkan produksi teripang di Indonesia sejak dasawarsa terakhir cenderung meningkat dengan rata-rata peningkatan pada tahun 2003-2004 sebesar 51.37% (DKP 2006). Saat ini perdagangan teripang telah meluas, terutama Hongkong dan Singapura, yang merupakan dua negara pusat perdagangan ekspor teripang dunia. Teripang kering telah diolah dan diperdagangkan di USA, Kanada, Eropa, Taiwan, Republik Korea, Cina, Australia, Malaysia, Thailand dan beberapa negara lain.
Zat gizi yang terkandung dalam teripang antara lain air (88.99%bb), protein (38.96%bk), abu (31.43%bk), lemak (4.18%bk), dan karbohidrat (25.43%bk) (Nurjanah 2008). Selain itu teripang juga mengandung fosfor, besi, iodium, natrium, vitamin A dan B (thiamin, riboflavin dan niasin) (Wibowo et al. 1997). Sedangkan Martoyo et al. (2004) menyatakan bahwa kandungan gizi teripang kering adalah protein 82%, lemak 1.7%, air 8.9%, abu 8.6% dan karbohidrat 4.8%.
Selain itu teripang juga mengandung beberapa bahan aktif seperti: antibakteri dan antifungi (Aryantina 2002), antikoagulan (Mulloy et al. 2000), penghasil protease (Xue-Yuan Fu et al. 2005) dan arginin kinase pada Stichopus japonicus (Guo et al. 2003), antihipertensi (Zhao et al. 2007), T-antigen lectin (Gowda et al. 2008), sterol bebas (Panomarenko et al. 2000), serum amyloid A pada Holothuria glaberrina (Cardona et al. 2003), glikosida pada Stichopus mollis (Moraes et al. 2004), fucan sulfat pada Stichopus japonicus sebagai penghambat osteoclastogenesis (Kariya et al. 2004).
Kaswandi et al. (2000) dan Lian et al. (2000) melaporkan bahan aktif yang dihasilkan Holothuria sp. sebagai antibakteri dan antifungi. Hasil penelitian menunjukkan bahwa bahan aktif dari teripang Holothuria tubolosa tersebut dapat menghambat pertumbuhan Saccharomyces cerevisiae. Selain kandungan antibakteri, teripang juga mengandung berbagai asam lemak tak jenuh seperti linoleat, oleat, eikosa pentaenoat (EPA), dan docosaheksaenoat (DHA) (Fredalina et al. 1998). Sedangkan Putri (2002) menunjukkan hasil penelitian ekstraksi komponen antibakteri dari teripang (Holothuria vacabunda) cukup efektif menghambat pertumbuhan bakteri Escherichia coli, Vibrio damsela, Vibrio harveyi, Vibrio parahaemolyticus dan Vibrio charcariae.
24-O-(2,4-Di-O-methyl-D-xylopyranosyl-(12)-D-xylofuranoside), dan hasil uji bioassay menunjukkan bahwa teripang pasir dapat dijadikan sebagai aprodisiaka sehingga dapat memberikan nilai tambah.
Berdasarkan hasil penelitian terlihat bahwa sampai saat ini penelitian yang sudah dilakukan masih terbatas pada teknik budidaya, daerah penyebaran, ekologi dan teknologi pengolahan serta berbagai peranan bahan aktif sebagai antibakteri, antifungi, antihipertensi, antikoagulan, dan lain-lain. Sedangkan penelitian mengenai pemanfaatan bahan aktif teripang yang diyakini dapat memperbaiki sel beta pangkreas dan peningkatan hormon insulin belum pernah dilakukan.
2.2. Diabetes Melitus
2.2.1. Pengertian Diabetes Melitus
Penyakit diabetes melitus (DM) telah dikenal ribuan tahun yang lalu oleh masyarakat Mesir Kuno, seperti dalam Ebers Papirus (± 1500 SM), mengungkapkan beberapa pengobatan terhadap suatu penyakit yang ditandai dengan sering kencing (Pusparaj et al. 2001). DM diambil dari kata diabetes = mengalir terus, dan melitus = madu, yang berarti minum dan urine yang dikeluarkan mengandung glukosa. DM merupakan penyakit metabolik serius dengan kandungan glukosa darah meningkat sebagai akibat berkurangnya insulin secara relatif maupun absolut. Perubahan ini akan diperburuk dengan meningkatnya sekresi glukagon oleh pankreas ke dalam tubuh (Brady & Saltiel 1999).
American Diabetes Association (ADA) (2004) mendefinisikan DM merupakan kelompok penyakit metabolik dengan karakteristik hiperglikemia yang terjadi karena sekresi insulin, kerja insulin atau kedua-duanya. WHO (2006) menyatakan DM sebagai penyakit kronis yang terjadi akibat ketidakmampuan pankreas untuk memproduksi insulin yang cukup, atau tubuh tidak mampu menggunakan insulin yang diproduksinya dengan efektif. Gejala-gejala yang dapat menandai terjadinya hiperglikemia di antaranya: poliuria (sering buang air kecil), polidipsia (sering minum karena selalu merasa haus), poliphagia (sering makan), kehilangan berat dan gangguan penglihatan.
dalam sel sehingga terjadi peningkatan kadar glukosa darah. Kedua hal tersebut disebabkan kekurangan insulin, gangguan fungsi insulin, atau peningkatan faktor yang memiliki fungsi berlawanan dengan insulin, sehingga pada akhirnya akan menimbulkan gangguan pada metabolisme karbohidrat, lemak, dan protein.
American Diabetes Association menggunakan tiga standar untuk menentukan diagnosa terjadinya DM, yaitu: (1) konsentrasi glukosa darah sesaat lebih dari atau sama dengan 200 mg/dL atau 11.1 mmol/L, (2) glukosa darah puasa lebih dari atau sama dengan 126 mg/dL atau 7 mmol/L, puasa dilakukan selama 8 jam, (3) glukosa darah lebih dari atau sama dengan 200 mg/dL atau 11.1 mmol/L (Rimbawan & Siagian 2004; Rubin 2004). Sebelum terjadinya DM, biasanya diawali dengan prediabetes. Standar yang digunakan untuk mengetahui terjadinya prediabetes adalah bila kadar glukosa darah sebelum makan mencapai 100-126 mg/dL atau 5.5-7 mmol/L dan kadar glukosa darah setelah satu jam makan mencapai 140-199 mg/dL atau 7.8-11.1 mmol (Rubin 2004).
2.2.2. Klasifikasi Diabetes Melitus
Badan kesehatan dunia (WHO), melalui laporan kedua Expert Committee on Diabetes Mellitus mengelompokkan diabetes menjadi dua kelompok utama yaitu Insulin-dependent diabetes mellitus (IDDM atau tipe 1) dan Non-insulin-dependent diabetes mellitus (NIDDM atau tipe 2) (WHO 2006). Sedangkan ADA (2004) mengelompokkan DM menjadi empat tipe, yaitu diabetes melitus tipe 1, diabetes melitus tipe 2, diabetes melitus jenis lain, dan diabetes melitus saat hamil.
Individu yang mengalami DM tipe 1 mempunyai ciri-ciri poliuria (sering kencing), polidipsia (rasa haus terus menerus), poliphagia (perasaan lapar yang berlebih). Pada pengujian glukosa darah, pasien yang mengalami diabetes tipe ini apabila diberi 75 g glukosa secara oral dan sebelumnya telah melakukan puasa selama semalam, konsentrasi glukosa darahnya akan meningkat lebih dari 200 mg/dL, sedangkan pada individu normal perlakuan yang sama akan meningkatkan glukosa darahnya berkisar 140 mg/dL. Tingginya kandungan glukosa darah dalam tubuh, mengakibatkan laju filtrasi glomerulus terhadap glukosa menjadi berlebih dan urine akan mengandung banyak glukosa (Carolyn 2001 dan Jacquie et al. 2004).
Peningkatan kadar glukosa darah pada penderita diabetes tipe 1 lebih tinggi (400 mg/dL) daripada penderita diabetes tipe 2 (150-300 mg/dL). Bila kadar glukosa darah telah melebihi ambang batas ginjal (180 mg/dL), maka glukosa tidak dapat lagi diserap oleh ginjal dan akan dikeluarkan melalui urine (glukosuria). Glukosa merupakan zat yang bersifat hidrofilik sehingga peningkatan glukosa darah dapat meningkatkan osmotic diuresis dari sel sekitarnya dan akhirnya terjadi dehidrasi intraseluler diikuti dengan poliuria (Jacquie et al. 2004).
Diabetes tipe 2 ditandai oleh resistensi insulin pada jaringan perifer dan gangguan sekresi insulin dari sel beta pankreas, serta tidak membutuhkan penambahan hormon insulin untuk mempertahankan keseimbangan glukosa darah. Diabetes tipe 2 merupakan akibat lemahnya kemampuan pankreas guna mensekresikan insulin yang dikombinasikan dengan lemahnya aksi insulin, sehingga menyebabkan menurunnya sensitivitas insulin yang terjadi pada pintu masuk di permukaan sel tubuh yang dinamakan reseptor insulin. Reseptor insulin akan memberikan signal pada glukosa transporter untuk memungkinkan lewatnya gula (glukosa) yang dibawa oleh hormon insulin masuk ke dalam sel. Pada mitokondria gula tersebut kemudian akan digunakan untuk menghasilkan energi atau tenaga yang diperlukan dalam pelaksanaan fungsi setiap sel tubuh (Jacquie et al. 2004).
Meningkatnya sekresi insulin akan membawa pada kegagalan dari sel beta pankreas dalam menghasilkan insulin, yang merupakan inti dari ketidaknormalan diabetes tipe 2. Orang yang obesitas dan kurang olahraga mempunyai resiko terhadap penyakit diabetes tipe 2 dengan menunjukkan gejala penurunan sensitivitas insulin, yaitu: (1) jumlah insulin dalam darahnya meningkat lebih tinggi dibandingkan dengan orang normal dan (2) penyuntikan insulin tidak dapat menurunkan kadar glukosa darah pada keadaan menurunnya sensitivitas insulin (Jacquie et al. 2004 & Rubin 2004).
Pada diabetes tipe 2 ini pankreas masih mampu untuk menghasilkan cukup insulin, tetapi insulin kurang bekerja optimal karena terjadi resistensi insulin akibat kegemukan. Kegemukan dan resistensi insulin memiliki korelasi yang tinggi terhadap gangguan metabolik. Individu yang mengalami kegemukan, kandungan glukosa dalam darahnya tinggi dan diimbangi dengan peningkatan produksi insulin. Insulin yang diproduksi terus menerus akan mengakibatkan sel-sel tidak sensitif lagi dan akibatnya akan terjadi resitensi insulin (Takada 2008).
Disamping itu diabetes tipe 2 ini dapat pula disebabkan oleh kerusakan fungsi membran sel akibat kehadiran asam lemak. Konsumsi asam lemak dalam jumlah sedikit dan dalam jangka waktu yang lama mengakibatkan resistensi insulin dan secara klinis meningkatkan resiko diabetes (Riserus 2006). Sekresi insulin oleh asam lemak ini dipengaruhi oleh panjang rantai dari asam lemak tersebut. Semakin panjang rantai asam lemak maka semakin berat kerja tubuh untuk memetabolismenya. Absorpsi asam lemak rantai panjang ini membutuhkan proses pemecahan terlebih dahulu sebelum dibawa oleh aliran darah menuju hati. Asam lemak selanjutnya dipecah menjadi molekul yang lebih sederhana yaitu lipoprotein yang mampu diabsorpsi oleh vili-vili usus. Setelah dibawa ke hati, lipoprotein akan dimetabolisme menjadi energi, lemak dan kolesterol. Lemak dan kolesterol inilah yang akan meningkatkan resiko terjadinya diabetes yang dapat mengganggu fungsi kerja insulin (Carpentier et al. 2000).
bagian kelamin, mati rasa pada kaki atau tungkai, dan penyakit jantung (Rubin 2004).
Gestational diabetes mellitus didefinisikan sebagai glucose intolerance yang pertama kali diketahui terjadi selama kehamilan. Diabetes tipe ini merupakan klasifikasi operasional dan bukan klasifikasi berdasarkan kondisi fisiologis. Gestational diabetes mellitus merupakan salah satu tipe diabetes yang banyak terjadi pada wanita selama kehamilan. Biasanya gejala ini menghilang setelah melahirkan. Penyebabnya adalah perubahan hormonal pada kehamilan yang dapat mengubah kemampuan tubuh untuk menggunakan insulin. Insulin merupakan hormon penting untuk mempertahankan kadar glukosa darah yang sehat. Selama wanita mengalami perubahan hormon, hanya beberapa wanita yang berkembang mengalami gestational diabetes mellitus (Godwin et al. 1999).
2. 3. Hiperglikemia
Kadar glukosa darah merupakan refleksi dari status zat gizi, emosi dan fungsi endokrin. Suatu keadaan ketika kadar glukosa darah sangat tinggi melebihi kadar normal disebut hiperglikemia. Hiperglikemia biasanya terjadi apabila sel beta dalam pulau Langerhans tidak dapat menghasilkan insulin atau mengalami defisiensi insulin. Defisiensi insulin akan menyebabkan gangguan proses biokimia dalam tubuh, yaitu penurunan pemasukan glukosa ke dalam sel dan peningkatan pelepasan glukosa dari hati ke dalam sirkulasi. Hal inilah yang menyebabkan terjadinya hiperglikemia (Dominiczak 2005).
2.4. Pankreas dan Kerusakan Jaringan
Pankreas merupakan kelenjar majemuk, terdiri dari kelenjar eksokrin dan kelenjar endokrin. Unit kelenjar eksokrin menghasilkan sejumlah enzim pencernaan antara lain amilase, lipase, dan tripsin yang berfungsi untuk mencerna makanan yang telah dicerna di lambung setelah memasuki duodenum. Unit kelenjar endokrin disebut pulau Langerhans. Pulau Langerhans merupakan suatu cluster dari kelenjar endokrin yang tersebar di sepanjang kelenjar endokrin pankreas dan banyak dilalui oleh kapiler-kapiler darah. Pulau-pulau Langerhans merupakan kelompok sel-sel yang menyebar di antara alveoli dan duktus pankreas dengan beberapa jenis sel epitel yang terdapat di dalamnya. Sel-sel tersebut adalah sel alfa, sel beta, sel delta, dan sel PP (polipeptida pankreas). Sel beta menghasilkan hormon insulin yang berperan penting untuk mencegah diabetes melitus. Sel alfa menghasilkan hormon glukagon yang bersifat antagonis terhadap hormon insulin (Gepts 1981).
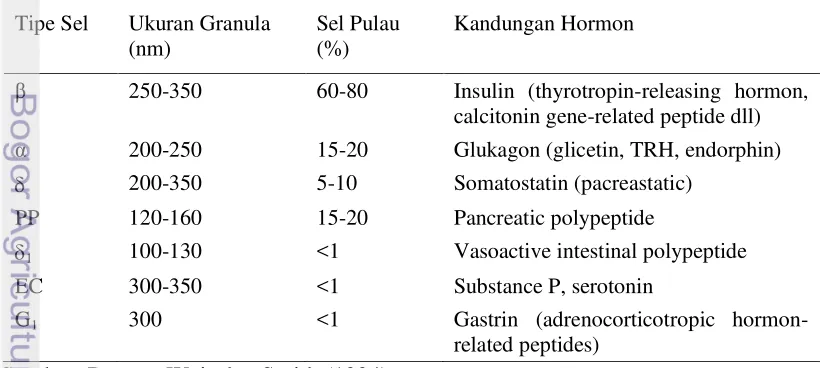
Hormon somatostatin dihasilkan oleh sel delta dan polipeptida pankreas dihasilkan oleh sel F. Sel beta merupakan sel yang paling banyak ditemukan (70-80%), selanjutnya sel alfa (15-20%) yang terletak di daerah tepi pulau Langerhans, sedangkan sel beta terletak lebih ke dalam. Sel delta mensekresikan somatostatin sebesar 5-10% (Kim et al. 2006). Karakterisasi sel-sel endokrin dapat dilihat pada Tabel 1.
Tabel 1 Karakterisasi sel-sel endokrin pulau Langerhans Tipe Sel Ukuran Granula
(nm)
Sel Pulau (%)
Kandungan Hormon
β 250-350 60-80 Insulin (thyrotropin-releasing hormon, calcitonin gene-related peptide dll) α 200-250 15-20 Glukagon (glicetin, TRH, endorphin)
200-350 5-10 Somatostatin (pacreastatic)
PP 120-160 15-20 Pancreatic polypeptide
1 100-130 <1 Vasoactive intestinal polypeptide
EC 300-350 <1 Substance P, serotonin
G1 300 <1 Gastrin (adrenocorticotropic
Berdasarkan fungsi sel, maka sel-sel asinar berfungsi untuk mensekresi enzim-enzim pencernaan dan ion-ion untuk keperluan proses pencernaan, sedangkan sel-sel pulau Langerhans pankreas mensekresikan sedikitnya 4 macam hormon, yaitu insulin, glukagon, somatostatin, dan polipeptida pankreas. Hormon tersebut dilepaskan ke dalam vena pankreatika yang mengalirkan isinya ke dalam vena porta. Hormon insulin dan glukagon terlibat dalam pengaturan metabolisme karbohidrat. Insulin berfungsi menurunkan kadar gula darah, sementara glukagon kebalikannya adalah menaikkan kadar gula darah. Somatostatin adalah hormon yang menghambat sekresi hormon pertumbuhan, sedangkan hormon polipeptida pankreas mempengaruhi sekresi enzim gastrointestinal (Gepts 1981).
Kerusakan sel-sel beta pankreas dapat disebabkan oleh faktor genetik, nutrisi (toksisitas glukosa), infeksi oleh mikroorganisme, stres oksidatif (radikal bebas), dan zat-zat kimia (diabetogenik). Stres oksidatif timbul akibat reaksi metabolisme yang menggunakan oksigen yang mengakibatkan terganggunya keseimbangan sistem antioksidan dan prooksidan dalam sel.
Kerusakan oksidatif sel beta pankreas oleh toksisitas glukosa telah dikemukakan oleh Robertson et al. (2004). Pada keadaan hiperglikemia kronis, glukosa mengalami beberapa jalur metabolisme seperti fosforilasi oksidatif, autooksidasi glukosa, metabolisme heksosamin, metabolisme sorbitol, dan pembentukan alfa ketoaldehid. Semua jalur metabolisme ini dapat menghasilkan Reactive Oxigen Specific (ROS) yang mengakibatkan stres oksidatif dan menyebabkan kapasitas enzim intraseluler pankreas menurun. Kondisi ini menyebabkan ROS bereaksi dengan komponen penyusun membran sel beta menimbulkan penyakit DM yang dikarakterisasi dengan kondisi hiperglikemia. Kondisi hiperglikemia kronis dan jalur biokimia metabolisme glukosa sampai menghasilkan ROS dan menyebabkan disfungsi sel beta.
berkurang, sel beta mengalami nekrosis, sel beta mengalami atropi, dan deposisi amiloid ekstrasel (Boudreau et al. 2006 & Hayden et al. 2007).
Penanda kerusakan jaringan secara oksidatif dapat diketahui dengan cara analisis biokimia terhadap status antioksidan atau menilai daya hambat plasma terhadap oksidasi probe spesifik oleh sistem pembentuk radikal bebas. Kerusakan jaringan akibat radikal bebas dapat diketahui secara langsung dengan mengukur kadar radikal bebas atau secara tidak langsung dengan mengukur produk yang dihasilkan dari kerusakan sel. Pengukuran kadar radikal bebas relatif lebih sulit karena sifat radikal bebas yang berumur sangat singkat, dan sangat reaktif (Kohen & Nyska 2002), namun demikian penanda kerusakan jaringan secara tidak langsung akibat radikal bebas dapat diukur misalnya peroksidasi lipid (MDA), isoprostan, dan 8-hidroksi-2’-deoksiguanosin.
2.5. Insulin
Insulin pertama kali ditemukan oleh Banting dan Best pada tahun 1922 dengan mengikat saluran pankreas sehingga kelenjar endokrin dan bagian asinar mengalami atropi. Insulin merupakan dua rantai asam amino lurus dengan tiga ikatan disulfida (BM 5 733). Insulin merupakan suatu hormon polipeptida yang dihasilkan oleh sel beta dari pulau Langerhans dan merupakan kelompok sel yang terdiri dari 1% massa pankreas. Insulin sangat penting dalam mengkoordinasikan penggunaan energi oleh jaringan. Efek metaboliknya ialah anabolik, seperti sintesis glikogen, triasilgliserol, dan protein (Champe & Harvey 1994).
2.5.1. Struktur Insulin
Insulin dibentuk oleh 51 asam amino yang tersusun dalam dua rantai polipeptida (rantai A dan rantai B). Rantai A dihubungkan dengan rantai B melalui jembatan disulfida. Molekul insulin juga mengandung jembatan disulfida intramolekuler antara residu asam amino 6 dan 11 pada rantai A. Struktur insulin manusia berbeda dengan struktur insulin babi atau sapi. Pada rantai A, posisi asam amino treonin dan isoleusin (residu ke 8 dan ke 10) pada insulin manusia, berturut-turut digantikan oleh alanin dan valin. Sementara treonin pada ujung C (C terminal) rantai B digantikan oleh valin. Insulin babi berbeda dengan manusia hanya pada ujung C rantai B, yaitu alanin menggantikan treonin pada insulin manusia (Champe & Harvey 1994). Secara alami kebutuhan insulin di dalam tubuh dipenuhi dengan mensintesisnya (biosintesis) dari dua prekursor (bahan dasar insulin), yaitu preproinsulin dan proinsulin. Sintesis ini berlangsung pada sitoplasma sel beta pankreas.
2.5.2. Pengaturan Sekresi Insulin
Pengaturan sekresi insulin merupakan proses kunci dalam pengendalian kadar glukosa darah. Mekanisme sekresi insulin juga berperan dalam pengendalian kadar trigliserida plasma. Sekresi insulin oleh sel beta pulau Langerhans pankreas dikoordinasikan dengan pelepasan glukagon dari sel alfa pankreas. Jumlah relatif insulin dan glukagon yang dilepaskan oleh pankreas diatur sehingga laju pembentukan glukosa di hati dijaga agar sama dengan laju penggunaan glukosa oleh jaringan perifer. Berdasarkan peran koordinasinya, sel beta merespon berbagai rangsangan. Secara khusus sekresi insulin ditingkatkan oleh glukosa, asam amino, hormon gastrointestinal dan glukagon (Champe & Harvey 1994).
merupakan bahan yang kuat untuk menstimulir pelepasan insulin. Asupan protein menyebabkan peningkatan sementara kadar asam amino plasma, sedangkan selain arginin, metionin juga menunjukkan adanya kecenderungan dalam menstimulasi sekresi insulin (Krisetiana et al. 2001).
Hormon peptida intestinal dan hormon-hormon gastrointestinal lain merangsang sekresi insulin. Hormon ini dilepaskan setelah asupan pangan yang menyebabkan peningkatan insulin sebelum terjadi peningkatan aktual kadar glukosa darah. Hal ini menunjukkan bahwa jumlah glukosa yang sama diberikan secara oral menginduksi lebih banyak sekresi insulin daripada diberikan secara intravena. Glukosa menstimulir sekresi insulin dan menghambat pelepasan glukagon. Aksi yang terakhir ini sangat penting bagi penderita DM tipe 1, karena kerusakan sel beta menghilangkan efek penghambatan dalam pelepasan glukagon oleh insulin (Champe & Harvey 1994).
2.5.3. Mekanisme Kerja Insulin
Sesaat setelah glukosa terserap dan masuk ke dalam sistem peredaran darah, maka glukosa akan segera terdistribusi ke seluruh jaringan tubuh. Dampak tersebarnya glukosa ke seluruh tubuh akan meningkatkan keberadaan insulin pada jaringan tersebut. Mekanisme klasik kerja insulin ialah meningkatkan pemindahan glukosa darah menuju otot dan mencegah proses glikogenolisis, glukoneogenesis dalam hati dan lipolisis pada jaringan adiposa. Proses ini akan diikuti dengan penyimpanan dan pembentukan glikogen dalam sel otot (Bessesen 2001).
Reseptor yang dikenali dan diikat oleh insulin, merupakan reseptor spesifik yang terdapat pada jaringan hati, otot dan adiposa. Reseptor insulin disintesis sebagai polipetida tunggal. Reseptor tersebut diglikosilasi dan dipecah menjadi sub-unit alfa dan beta, kemudian dirangkai menjadi ikatan tetramer oleh ikatan disulfida. Domain hidrofobik pada masing-masing sub-unit beta merenggangkan membran plasma. Sub-unit alfa ekstraseluler mengandung isi pengikat insulin (insulin binding site). Domain sitisolik sub-unit beta adalah tirosin kinase yang diaktifkan oleh insulin (Champe & Harvey 1994 dan Rimbawan & Siagian 2004).
unit alfa menginduksi perubahan konformasi yang ditransduksikan ke sub-unit beta. Pengikatan ini mendorong autofosforilasi residu tirosin spesifik yang cepat dari setiap sub-unit beta. Substrat insulin reseptor yang telah terfosforilasi akan menstimulasi vesicle yang mengandung glukosa transporter untuk dipindahkan ke membran sel. Keberadaan glukosa transporter akan memfasilitasi proses difusi glukosa untuk masuk ke dalam sel. Bessesen (2001) menyatakan bahwa masuknya glukosa ke dalam sel akan memberikan efek pertumbuhan dan metabolik.
Pengikatan insulin diikuti oleh internalisasi kompleks hormon-reseptor. Pada bagian dalam sisi sel, insulin didegradasi di dalam lisosom. Reseptor kemungkinan didegradasi, namun lebih banyak didaurulang ke permukaan sel. Jumlah insulin yang meningkat akan mendorong pendegradasian reseptor, kemudian menurunkan jumlah reseptor insulin pada permukaan.
2.5.4. Resistensi Insulin
Resistensi insulin merupakan kelainan metabolik yang dicirikan oleh menurunnya sensitivitas jaringan terhadap insulin. Resistensi insulin menyebabkan keadaan konsentrasi insulin yang dihasilkan normal, namun respon biologisnya rendah. Keadaan ini terjadi ketika jaringan gagal merespon insulin secara normal. DM tipe 2 sering disertai oleh resistensi pada organ sasaran yang mengakibatkan penurunan responsivitas, baik terhadap insulin endogenous maupun eksogenous. Sebagai contoh, resistensi insulin di hati menyebabkan produksi glukosa hepatik (glukoneogenesis) tidak terkendali (Kendall & Harmel 2002). Pada otot dan jaringan adiposa, resistensi insulin mengakibatkan penurunan pengambilan glukosa oleh jaringan tersebut. Resistensi insulin yang berkembang secara terus-menerus akan mengakibatkan sekresi insulin oleh sel beta mengalami gangguan (Cefalu 2001).
2.6. Aloksan
terhadap sel-sel beta pankreas, sehingga menghasilkan keadaan hiperglikemia permanen yang merupakan salah satu etiologi dari IDDM.
Aloksan merupakan kombinasi dari klorin dan xanthine. Xanthine merupakan senyawa kimia alami yang dapat ditemukan pada kopi, teh, coklat, dan vitamin E, sedangkan klorin adalah zat kimia yang sering ditambahkan pada air bersih terutama pada negara-negara berkembang. Secara alami aloksan dapat ditemukan pada tubuh antara lain akibat minum kopi atau minum teh. Akumulasi aloksan dalam tubuh meningkatkan kerentanan tubuh terhadap penyakit jantung, multiple sclerosis, arthritis, kanker payudara dan kolon, serta diabetes.
Aloksan (2,4,5,6-tetraoxypyrimidine;5,6-dioxyuracil) pertama kali ditemukan oleh Brugnatelli pada tahun 1818. Aloksan merupakan zat kimia yang tidak stabil, hidrofilik, dan dapat bereaksi dengan thiol tertentu. Zat ini memiliki keselektifan yang sangat tinggi, sehingga penting dalam penelitian DM. Sifat diabetogenik aloksan telah diketahui dengan mempelajari pemberian aloksan pada kelinci dan melaporkan adanya nekrosis spesifik pada pulau Langerhans.
Szkudelski (2001) mengemukakan bahwa aloksan merusak sel beta pankreas melalui pembentukan spesies oksigen reaktif yang diawali oleh reduksi aloksan. Aloksan akan bereaksi dengan agen-agen pereduksi seperti sistein dan kelompok protein bergugus SH (termasuk enzim-enzim yang bergugus SH-), glutation tereduksi atau GSH. Glukokinase merupakan enzim yang berperan penting atas sekresi insulin dan memiliki gugus SH-, maka aloksan memiliki afinitas yang tinggi terhadap enzim glukokinase. Aloksan akan bereaksi dengan dua gugus SH- dari enzim glukokinase membentuk ikatan dimer dan menyebabkan inaktivasi enzim sehingga sekresi insulin terganggu dan terjadi kerusakan pada sel beta dan kemudian timbul keadaan diabetes.
Fe dan mereduksinya menjadi ion Fe2+. Ion Fe3+ juga dapat direduksi oleh radikal aloksan (HA*). Selain itu, radikal superoksida juga mengalami dismutasi menjadi hidrogen peroksida. Reaksinya adalah sebagai berikut:
O2’ + O2’ + 2H+ H2O2 + O2
Reaksi tersebut dapat terjadi secara spontan atau dikatalisis oleh superoksida dismutase. Kehadiran Fe2+ dan hidrogen peroksida, radikal hidroksil yang sangat reaktif terbentuk melalui reaksi Fenton. Reaksinya adalah sebagai berikut:
Fe2+ + H2O2 Fe3+ + OH- + OH’
Selanjutnya Szkudelski (2001) menyatakan bahwa radikal bebas yang terjadi dapat merusak sel beta pankreas sehingga insulin tidak dapat dihasilkan. Dosis pemberian aloksan bervariasi tergantung pada spesies, nutrisi, dan rute pemberiannya. Hewan percobaan yang sering digunakan untuk meneliti DM dengan pemberian aloksan adalah tikus, marmot, anjing, dan kucing. Pemakaian aloksan pada ayam, unggas, bebek, dan burung-burung karnivora tidak memberikan efek diabetogenik karena hewan-hewan tersebut resisten terhadap aloksan. Dosis pemberian aloksan pada tikus yang sering digunakan berkisar antara 70-120 mg aloksan/kg berat badan tikus.
Injeksi aloksan akan menghasilkan tiga fase kurva kadar glukosa darah. Mula-mula terjadi hiperglikemia yang berlangsung selama 1-4 jam setelah injeksi, yang diikuti hipoglikemia antara 6-12 jam, dan akhirnya hiperglikemia permanen pada 12-24 jam setelah injeksi. Efek hipoglikemia disebabkan kemampuan aloksan untuk mendepolarisasi sel beta. Akibatnya pintu Ca2+ terbuka dan Ca2+ akan masuk ke dalam sel dan terjadilah influks Ca2+. Banyaknya Ca2+ yang terdapat dalam sel menyebabkan peningkatan sekresi insulin sehingga terjadilah hipoglikemia (Szkudelski 2001).
2.7. Antioksidan dalam Sistem Pertahanan Tubuh
yang diakibatkan oleh radikal bebas. Secara garis besar, antioksidan dapat dibedakan atas dua golongan, yaitu antioksidan endogen atau dikenal dengan enzim antioksidan intraseluler, yang terdapat di dalam sel dan antioksidan eksogen, yang berasal dari luar tubuh yang diperoleh dari asupan bahan makanan dan berbagai bahan alami.
Antioksidan endogen berperan sebagai lini pertahanan terdepan dan bekerja bersama-sama dengan antioksidan eksogen yang membentuk suatu lini pertahanan kedua terhadap serangan radikal bebas. Peran antioksidan ini dapat diartikan sebagai suatu fungsi homeostasis dari organisme untuk menanggulangi akibat-akibat kerusakan dari stres oksidatif terhadap jaringan dan organ yang terpengaruh.
Berdasarkan sifat-sifat dan mekanisme kerjanya, antioksidan diklasifikasikan menjadi tiga kelompok besar (Asikin 2001, Soewoto 2001, dan Valko et al. 2007) yaitu:
1. Antioksidan primer (antioksidan endogen atau antioksidan enzimatis). Termasuk antioksidan endogen adalah SOD, katalase dan glutation peroksidase (GPx). Enzim-enzim antioksidan ini terdapat di dalam sel yang bekerja dengan cara membersihkan radikal bebas atau spesies oksigen reaktif (ROS) yang dihasilkan oleh proses oksidatif, dengan reaksi enzimatis dan mengubahnya menjadi produk yang lebih stabil. Reaksi ini disebut sebagai free radical scavenger.
2. Antioksidan sekunder (antioksidan eksogen atau non-enzimatis). Termasuk antioksidan sekunder adalah vitamin E, vitamin C, beta karoten, isoflavon, asam urat, billirubin, albumin, transferin, dan caeruplasmin. Senyawa-senyawa ini bekerja dengan cara berperan sebagai donor hidrogen atau penerima hidrogen sehingga terjadi pembersihan (scavenging) terhadap radikal bebas, dan mengubahnya ke bentuk yang lebih stabil. Reaksi ini dikenal dengan pemutusan rantai propagasi dari radikal bebas (free radical chain breaking).