PEPTIDA PENGIKAT KALSIUM HASIL HIDROLISIS ISOLAT PROTEIN TEPUNG KACANG KOMAK (Lablab purpureus (L) sweet)
DENGAN ENZIM BROMELIN, PANKREATIN DAN PEPSIN
LAITS ASSAMARQANDI MUFA
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2014 M/ 1435 H
PEPTIDA PENGIKAT KALSIUM HASIL HIDROLISIS ISOLAT PROTEIN TEPUNG KACANG KOMAK (Lablab purpureus (L) sweet)
DENGAN ENZIM BROMELIN, PANKREATIN DAN PEPSIN
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh:
LAITS ASSAMARQANDI MUFA 107096002830
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2014 M/ 1435H
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, April 2014
LAITS ASSAMARQANDI MUFA 107096002830
v
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang senantiasa melimpahkan rahmat dan nikmat kepada seluruh hamba-Nya. Segala puji bagi Allah atas segala kemudahan dan semata-mata atas kehendak-Nya penulis dapat menyelesaikan skripsi ini, insya Allah, dengan baik.
Skripsi ini berjudul Aplikas Enzim Bromelin, Pankreatin dan Pepsin terhada Isaolat Protein Kacang Komak (Lablab purpureus (L) sweet) Untuk menghasilkan Peptida Bioaktif Pengikat kalsium. Skripsi ini disusun untuk memenuhi tugas akhir sebagai salah satu syarat kelulusan dalam menempuh pendidikan sarjana Strata1 (S1).
Penulisan skripsi ini juga tak luput dari bantuan berbagai pihak. Atas kerjasama dan bantuan dari pihak-pihak terkait, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Sandra Hermanto, M.Si selaku pembimbing I yang selalu memberikan bimbingan, motivasi, dan nasihat kepada penulis.
2. Dra. Noer Laily, M.Si selaku pembimbing II yang telah memberikan perhatian dan bimbingannya kepada penulis.
3. Drs. Dede Sukandar, M.Si selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Dr. Agus Salim, M.Si, selaku Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
5. Kedua orangtua, Kakak, adik, dan keluarga penulis yang selalu melimpahkan doa, kasih sayang, dan dukungannya kepada penulis.
vi 6. Dosen-dosen Fakultas Sains Dan Teknologi UIN Jakarta atas ilmu dan
pengalaman berharga yang dibagikan selama penulis menjalani perkuliahan.
7. Staf dan teknisi Laptiab, BPPT, PUSPITEK, Serpong. Atas keikhlasannya membantu penulis dalam penelitian.
8. Delsy Syamsumarsih yang selalu memberi dukungan, perhatian, dan semangat yang diberikan untuk penulis
9. Try Surya Anditya atas kebersamaannya selama penelitian serta dukungannya terhadap penulis.
10. Kelurga besar GMC, khususnya : Dendy, Ahong, Febri, Syihab dan Lian atas kebersamaan, kekeluargaan dan dukungan yang diberikan kepada penulis.
11. Yustiar, Rijal, Ardi, subhan yang telah memberikan dukungan moril selama penulis melaksanakan tugas akhir.
12. Teman-teman Kimia 2007 yang telah memberikan dukungan moril selama penulis melaksanakan tugas akhir.
Penulis sepenuhnya menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini. Untuk itu penulis mengharapkan saran dan kritik yang bersifat membangun. Penulis mengharapkan agar skipsi ini bermanfaat bagi penulis, pembaca, atau peminat lain pada umumnya.
Jakarta, Juni 2014
Penulis
vii ABSTRACT
LAITS ASSAMARQANDI MUFA. Ca-Binding Peptide Hidrolysis Product for Komak Bean Powder Protein Isolate by Bromelin, Pankreatin and Pepsin.
Mentored by NOER LAYLI and SANDRA HERMANTO.
Komak bean with its high productivity has the potency as a source of bioactive peptide producer. Bioaktive peptide to komak bean’s isolate was measured its activity as Ca-binding. The result of proximate analysis komak bean powder consist of carbohydrate (59.79 % bk), protein (26.47 % bk), fat (1.44 % bk), water (4.70 % bk) and ash (7.60 % bk). The highest hydrolysis degree value is obtained in hydrolysis treatment of enzyme pepsin at incubation time 24 hours (40.83%).
SDS-PAGE analysis shows komak bean powder protein isolate producing peptides with specification molecul weight range at 6-71 kDa. Ca-binding assay using spektrophotometric methode shows hidrolisate of product hydrolysis with pancreatin enzyme had the potency as bioactive peptide with Ca content 2.750 mg/dl.
Key words : komak bean, bioactive peptide, enzymatic hydrolysis, Ca-binding protein.
viii ABSTRAK
LAITS ASSAMARQANDI MUFA. Peptida Pengikat kalsium Hasil Hidrolisis Isolat Protein Tepung Kacang Komak (Lablab purpureus (L) sweet) Dengan Enzim Bromelin, Pankreatin dan Pepsin . Dibimbing oleh NOER LAILY dan SANDRA HERMANTO.
Kacang komak (Lab-lab purpureus (L.) Sweet) dengan produktifitasnya yang tinggi memiliki potensi sebagai sumber protein penghasil peptida bioaktif.
Menggunakan metode hidrolisis enzimatik dengan menggunakan enzim bromelin, pankreatin, dan pepsin telah dilakukan untuk memperoleh peptida bioaktif.
Peptida bioaktif dari isolat protein kacang komak (Lab-lab purpureus (L.) Sweet) diukur aktifitasnya sebagai pengikat kalsium. Hasil analisis proksimat terhadap tepung kacang komak (Lab-lab purpureus (L.) Sweet) meliputi kadar karbohidrat (59,79% bk), kadar protein (26,47% bk), kadar lemak (1,44% bk), kadar air (4,70% bk), dan kadar abu (7,60% bk). Nilai derajat hidrolisis tertinggi diperoleh pada perlakuan hidrolisis dengan enzim pepsin dengan waktu inkubasi 24 jam sebesar 40,83%. Analisis SDS-PAGE menunjukkan hidrolisat isolat protein tepung kacang komak menghasilkan peptida-peptida yang spesifikasi pada kisaran berat molekul 6-71 kDa. Pengujian kadar kalsium dengan metode spektrofotometri menunjukkan hidrolisat dengan enzim pankreatin mempunyai potensi sebagai peptida bioaktif dengan kadar Ca sebesar 2,750 mg/dL.
Kata kunci: kacang komak, peptida bioaktif, hidrolisis enzimatik,protein pengikat kalsium.
ix DAFTAR ISI
Halaman
KATA PENGANTAR ... v
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4. Tujuan ... 3
1.5. Manfaat ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1. Kacang Komak (Lab-lab purpureus (L.) Sweet) ... 4
2.2. Protein ... 7
2.3. Peptida Bioaktif ... 10
2.4. Hidrolisis Protein ... 11
2.5. Enzim ... 11
2.5.1. Hidrolisis enzimatik ... 12
a. Bromelin ... 12
b. Pankreatin ... 13
c. Pepsin ... 14
x 2.6. Elektroforesis SDS-PAGE ( Sodium Dodesil Sulfate Polyacrylamide
Gel ) ... 16
2.7. Kalsium ... 17
2.7.1. Proses Metabolisme Kalsium ... 18
2.7.2. Uji Pengikatan Kalsium ... 18
BAB III METODE PENELITIAN ... 20
3.1. Waktu dan Tempat Pelaksanaan ... 20
3.2. Alat dan Bahan ... 20
3.2.1. Alat ... 20
3.2.2. Bahan ... 20
3.3. Prosedur Kerja ... 21
3.3.1. Pembuatan Tepung Kacang Komak Bebas Lemak ... 21
3.3.2. Analisis Proksimat ... 21
3.3.3. Pembuatan Isolat Protein ... 22
3.3.4. Hidrolisis Protein ... 23
a. Larutan Sampel ... 23
b. Pembuatan Larutan Enzim ... 24
c. Hidrolisis Dengan Enzim Bromelin ... 24
d. Hidrolisis Dengan Enzim Pankreatin ... 25
e, Hidrolisis Dengan Enzim Pepsin ... 25
3.3.5. Derajat Hidrolisis (% DH) ... 25
3.3.6. Uji Protein Metode Bradford ... 26
3.3.7. Analisis Kalsium dengan Metode Kolorimetri dengan Reagen ortho-cresolphtalein complexone ... 26
xi
a. Pencucian alat ... 26
b. Preparasi sampel ... 26
c. Pembuatan colour reagen ... . 27
d.Penyiapan AMP Buffer pH 10,7 (2-amino-2-methyl-1-propanol) ... ... 27
e. Pembuatan Working standar ... 27
3.3.8. Elektroforesis SDS-PAGE ... 28
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1. Hasil Uji Proksimat Tepung Kacang Komak ... 31
4.2. Hidrolisis Protein Dengan Enzim ... 31
4.3. Derajat Hidrolisis (% DH) ... 33
4.4. Profil Protein Dengan Mengguanakan Gel Elektroforesis ... 34
4.5. Analisis Kalsium ... 41
BAB V KESIMPULAN DAN SARAN ... 44
5.1. Kesimpulan ... 44
5.2. Saran ... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN ... 51
xii DAFTAR TABEL
Halaman
Tabel 1. Komposisi kimiawi kacang komak ... 6
Tabel 2. Komposisi Asam Amino Pada Kacang Komak ... 6
Tabel 3. Perbandingan volume standar CaCO3 dan mili-Q ... 28
Tabel 4. Komposisi reagen untuk analisis kalsium ... 28
Tabel 5. Komposisi reagen untuk pembuatan Gel akrilamid ... 29
Tabel 6. Komposisi kimiawi tepung kacang komak ... 31
Tabel 7. Berat molekul isolat protein hasil hidrolisis dengan enzim bromelin ... 37
Tabel 8. Berat molekul isolat protein hasil hidrolisis dengan enzim Pankreatin ... 38
Tabel 9. Berat molekul isolat protein hasil hidrolisis dengan enzim pepsin .. 38
Tabel 10. Kadar kalsium terlarut dalam isolat protein hasil hidrolisis ... 42
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Kacang komak (Lablab purpureus (L.) Sweet) ... 4
Gambar 2. Biji kacang komak ... 5
Gambar 3. Struktur primer, sekunder, tersier dan kwartener protein ... 8
Gambar 4. Struktur ikatan peptida ... 9
Gambar 5. Skematik elektroforesis SDS-PAGE ... 16
Gambar 6. Skema pembuatan isolat protein tepung kacang komak ... 22
Gambar 7. Skema pembuatan larutan sampel untuk hidrolisis dengan masing-masing enzim bromelin, pankreatin dan pepsin ... 23
Gambar 8. Perbandingan Kadar Protein Hasil Hidrolisis Enzimatik ... 32
Gambar 9. Persen Derajat Hidrolisis ... 33
Gambar 10. Profil Protein Isolat Protein Tepung Kacang Komak Hasil Hidrolisis dengan Enzim Bromelin ... 35
Gambar 11. Profil Protein Isolat Protein Tepung Kacang Komak Hasil Hidrolisis dengan Enzim Pankreatin ... 36
Gambar 12. Profil Protein Isolat Protein Tepung Kacang Komak Hasil Hidrolisis dengan Enzim Pepsin ... 36
Gambar 13. Hasil Silver Staining gel pada gambar 10 ... 37
xv DAFTAR LAMPIRAN
Halaman
Lampiran 1. Tabel standar BSA untuk uji protein dan Derajat hidrolisis ... 51
Lampiran 2. Kurva standar BSA untuk uji protein dan Derajat hidrolisis ... 51
Lampiran 3. Rekapitulasi data uji kadar protein isolat protein tepung kacang komak hasil hidrolisis dengan berbagai enzim ... 52
Lampiran 4. Grafik nilai kadar protein tepung kacang komak hasil hidrolisis dengan enzim bromelin, pankreatin dan pepsin ... 53
Lampiran 5. Nilai kadar protein terlarut pada isolat protein tepung kacang komak hasil hidrolisis ... 53
Lampiran 6. Rekapitulasi data uji derajat hidrolisis isolat protein tepung kacang komak ... 54
Lampiran 7. Grafik %DH pada isolat protein tepung kacang komak hasil hidrolisis dengan enzim bromelin, pankreatin dan pepsin ... 55
Lampiran 8. Nilai %DH isolat protein tepung kacang komak hasil hidrolisis dengan enzim bromelin, pankreatin dan pepsin ... 55
Lampiran 9. Persiapan pereaksi untuk proses pewarnaan SDS-PAGE ... 56
Lampiran 10. Proses pewarnaan perak (silver staining) ... 58
Lampiran 11. Tabel standar uji SDS-PAGE ( Bromelin) ... 60
Lampiran 12. Kurva standar nilai Rf terhadap log BM (Bromelin) ... 61
Lampiran 13. Berat molekul dari isolat protein tepung kacang komak tanpa perlakuan ... 62
Lampiran 14. Berat molekul dari hidrolisat dengan enzim bromelin (0 jam) .. 62
Lampiran 15. Berat molekul dari hidrolisat dengan enzim bromelin (2 jam) ... 62
Lampiran 16. Berat molekul dari hidrolisat dengan enzim bromelin (4 jam) ... 63
Lampiran 17. Berat molekul dari hidrolisat dengan enzim bromelin (8 jam) ... 63
xvi Lampiran 18. Berat molekul dari hidrolisat dengan enzim bromelin (18 jam) . 63 Lampiran 19. Berat molekul dari hidrolisat dengan enzim bromelin (24 jam) . 63
Lampiran 20. Tabel standar untuk uji SDS-PAGE (Pankreatin) ... 64
Lampiran 21. Kurva standar nilai Rf terhadap log BM (Pankreatin) ... 64
Lampiran 22. Berat molekul dari hidrolisat dengan enzim pankreatin (0 jam) ... . 65
Lampiran 23. Berat molekul dari hidrolisat dengan enzim pankreatin (2 jam) ... 65
Lampiran 24. Berat molekul dari hidrolisat dengan enzim pankreatin (4 jam) ... 65
Lampiran 25. Berat molekul dari hidrolisat dengan enzim pankreatin (8 jam) ... 66
Lampiran 26. Berat molekul dari hidrolisat dengan enzim pankreatin (18 jam) ... 66
Lampiran 27. Berat molekul dari hidrolisat dengan enzim pankreatin (24 jam) ... 66
Lampiran 28. Tabel standar untuk uji SDS-PAGE (pepsin)... 67
Lampiran 29. Kurva standar nilai Rf terhadap log BM (Pepsin) ... 67
Lampiran 30. Berat molekul dari hidrolisat dengan enzim pepsin(0 jam) ... 68
Lampiran 31. Berat molekul dari hidrolisat dengan enzim pepsin (2 jam) ... 68
Lampiran 32. Berat molekul dari hidrolisat dengan enzim pepsin (4 jam) ... 68
Lampiran 33. Berat molekul dari hidrolisat dengan enzim pepsin (8 jam) ... 69
Lampiran 34. Berat molekul dari hidrolisat dengan enzim pepsin (18 jam) ... 68
Lampiran 35. Berat molekul dari hidrolisat dengan enzim pepsin (24 jam) .. 68
Lampiran 36. Tabel standar kalsium untuk uji kalsium ... 69
Lampiran 37. Kurva standar kalsium ... 70
xvii Lampiran 38. Kadar kalsium dalam larutan isolat protein hasil hidrolisis
dengan enzim bromelin ... 70 Lampiran 39. Kadar kalsium dalam larutan isolat protein hasil hidrolisis
dengan enzim pankreatin ... 70 Lampiran 40. Kadar kalsium dalam larutan isolat protein hasil hidrolisis
dengan enzim pepsin ... 71 Lampiran 41. Kurva kada kalsium dalam isolat protein tepung kacang komak
hasil hidrolisis dengan enzim bromelin, pankreatin dan pepsin .... 71
1 BAB I
PENDAHULUAN
1.1. Latar Belakang
Pertumbuhan pesat di bidang bioteknologi, pertanian, dan industri pangan menyebabkan peningkatan dalam jumlah besar produk sampingan protein berkualitas tinggi untuk konsumsi manusia. Protein dapat dikonversi menjadi produk bernilai tambah dengan sifat fungsional dan gizi yang ditingkatkan dengan hidrolisis enzimatik (Li et al., 2007). Dalam beberapa dekade terakhir, para peneliti menemukan bahwa peptida bioaktif dapat diperoleh dari protein yang dikonsumsi. Peptida tersebut dapat berdiri sendiri atau masih terikat pada protein asalnya. Telah diketahui bahwa selama hidrolisis dalam saluran pencernaan atau selama pengolahan pangan (fermentasi), peptida tersebut dapat dilepaskan dari protein, kemudian di dalam tubuh dapat bekerja sebagai senyawa regulator yang aktivitasnya menyerupai hormon.
Penelitian mengenai peptida bioaktif pengikat kalsium telah banyak dikembangkan. Jung dan Kim (2007) melakukan penelitian mengenai peptida pengikat kalsium yang dihasilkan dari hidrolisat tulang ikan Hoki. Sebelumnya CPP (casein phosphopeptide) juga telah diketahui dapat meningkatkan kelarutan kalsium karena muatan negatif pada molekulnya. Penyerapan kalsium sangat bervariasi tergantung usia dan kondisi tubuh. Beberapa faktor yang dapat menghalangi penyerapan kalsium adalah adanya zat organik yang dapat
2 bergabung dengan kalsium membentuk senyawa tak larut, contohnya asam oksalat dan asam fitat (Winarno, 1992). Berdasarkan penelitian yang dilakukan Tanimoto (2001), kacang kedelai yang difermentasi mengandung asam poli-γ-glutamat yang dapat meningkatkan kelarutan kalsium dalam usus.
Kacang komak (Lablab purpureus (L.) Sweet) merupakan salah satu bahan pangan yang potensial untuk memenuhi kebutuhan gizi masyarakat. Produktivitas kacang komak berkisar 6 sampai 10 ton per hektar, jauh lebih tinggi dibandingkan kedelai yang rata-rata hanya 1,3 ton per hektar sehingga kacang komak dapat diproduksi di dalam negeri dengan jumlah yang lebih besar daripada kedelai (Hartoyo, 2008). Selain itu, kacang komak memiliki karakteristik yang mirip dengan kacang kedelai sehingga berpotensi untuk menjadi alternatif pengganti kedelai dalam produk olahannya. Kandungan lemak yang rendah dalam kacang komak memiliki keuntungan tersendiri dalam penyediaan menu rendah lemak dan rendah kolestrol. Kacang komak dapat berperan menurunkan kadar kolesterol dan sebagai antioksidan.
Menurut penelitian yang telah dilakukan Anita (2009), tepung kacang komak memiliki potensi sebagai antioksidan. Untuk mengetahui potensi lain dari kacang komak dilakukan penelitian mengenai peptida bioaktif yang dihasilkan dari isolat kacang komak yang dapat mengikat kalsium. Penelitian yang dilakukan bertujuan untuk mengetahui derajat hidrolisis, kadar asam amino bebas, dan kadar kalsium dari hasil hidrolisis protein tepung kacang komak dengan menggunakan enzim bromelin, pankreatin, dan pepsin. Pada penelitian ini diharapkan akan diperoleh peptida bioaktif yang memiliki potensi sebagai pengikat kalsium.
3 1.2. Perumusan Masalah
Apakah hidrolisis isolat protein kacang komak (Lablab purpureus (L.) Sweet) dengan enzim bromelain, pankreatin, dan pepsin dapat menghasilkan peptida bioaktif pengikat kalsium.
1.3. Hipotesis
Protein kacang komak (Lab-lab purpureus (L.) sweet) berpotensi menghasilkan peptida bioaktif pengikat kalsium melalui hidrolisis enzimatik yang spesifik dari masing-masing enzim.
1.4. Tujuan
a. Mempelajari hidrolisis kacang komak (Lab-lab purpureus (L) sweet) dengan menggunakan enzim bromelain, pankreatin, dan pepsin untuk mendapatkan peptida bioaktif.
b. Mengetahui derajat hidrolisis, profil protein, dan aktivitas peptida pengikat kalsium dari hasil hidrolisis isolat kacang komak.
1.5. Manfaat
Manfaat yang diharapkan dari penelitian ini adalah memberikan kontribusi dalam penyediaan peptida bioaktif hasil hidrolisis enzimatik dari tepung kacang komak (Lab-lab purpureus (L) sweet) sebagai sumber bahan pangan fungsional.
4 BAB II
TINJAUAN PUSTAKA
2.1. Kacang Komak (Lab-lab purpureus (L.) Sweet)
Indonesia kaya akan jenis kacang-kacangan yang merupakan sumber protein nabati. Kacang-kacangan dari ordo Leguminose (kacang polong) secara umum diketahui sebagai sumber protein nabati, karbohidrat kompleks, serat pangan, dan beberapa jenis mineral. Somaatmadja dan Maesen (1993) dalam Subagio et al. (2006), mengatakan bahwa umumnya kacang-kacangan mengandung protein antara 18% sampai dengan 25% dari biji.
Kacang komak (Lablab purpureus (L.) Sweet) merupakan tanaman asli Indonesia dengan produktivitas yang tinggi berkisar 6 sampai 10 ton per hektar, jauh lebih tinggi dibandingkan kedelai yang rata-rata hanya 1,3 ton per hektar (Hartoyo, 2008). Kacang komak (Lab-lab purpureus (L.) Sweet) merupakan salah satu dari 13 jenis kacang-kacangan potensial yang telah dibudidayakan secara turun temurun oleh petani di daerah Nusa Tenggara Barat. Kacang komak dikenal pula di daerah Madura dan merupakan kerabat dekat Kacang Koro di Pulau Jawa (Sumarjan, 2004).
Gambar 1. Kacang Komak (Republika.co.id, 2012)
5 Secara tradisional kacang komak ditanam di daerah kering, buahnya digunakan sebagai bahan sayuran sedangkan bijinya yang sudah cukup tua biasanya dimanfaatkan sebagai makanan ringan (camilan). Selain itu tanaman kacang komak juga digunakan sebagai pakan ternak, silase, pupuk hijau, pelindung tanah dari erosi, penambat nitrogen dan tanaman penutup tanah pada tanaman kopi atau kelapa (Heriyanto dan Rozi, 2002; Trustinah dan Kasno, 2002).
Kingdom : Plantae
Divisi : Spermathopyta Kelas : Magnoliopsida Ordo : Fabales
Famili : Fabaceae Genus : Lablab
Spesies : Lablab purpureus (L.) Sweet
Menurut hasil penelitian Subagio et al., (2006), dilihat dari komposisi kimiawi kacang komak, kandungan karbohidrat merupakan yang paling tinggi yaitu rata-rata 67,0 % disusul dengan protein, lemak, kadar air, dan kadar abu.
Kadar karbohidrat dan protein yang tinggi menjadikan kacang komak cukup menjanjikan untuk digunakan sebagai bahan makanan pokok dan protein alternatif.
Gambar 2. Biji kacang komak
6 Tabel 1. Komposisi kimiawi kacang komak
Kandungan Kimiawi Kadar (%)
Karbohidrat 67,9 ± 4,2
Protein 17,1 ± 1,5
Lemak 1,1 ± 0,4
Kadar Air 9,3 ± 0,5
Kadar Abu 3,6 ± 0,1
Sumber: Subagio et al., (2006)
Kacang komak merupakan salah satu bahan pangan yang potensial untuk memenuhi kebutuhan gizi masyarakat. Kandungan lemak yang rendah memiliki keuntungan tersendiri dalam penyediaan menu rendah lemak dan rendah kolestrol.
Komposisi asam amino kacang komak juga cukup baik seperti terlihat pada Tabel 2. Kadar protein kacang komak sebesar 21.5 % dengan susunan asam amino yang mendekati pola protein kedelai yaitu kurang mengandung asam amino yang mengandung belerang (metionin dan sistein), tetapi kaya akan asam amino lisin sehingga dapat dipakai sebagai suplemen dalam pembuatan bahan makanan campuran yang tersusun atas kacangkacang yang umumnya kekurangan lisin (Martoyuwono, 1984).
Tabel 2. Komposisi Asam Amino Pada Kacang Komak
Asam amino mg/ g N Asam amino mg/ g N
Isoleusin 256 Tirosin 197
Leusin 436 Treonin 207
Lysin 360 Alanin 266
Metionin 36 Valin 294
Sistein 57 Arginin 393
Fenilalanin 299 Histidin 186
Asam aspartat 727 Asam glutamat 978
Glisin 240 Prolin 288
Sumber : Kay (1979)
7 2.2. Protein
Protein merupakan suatu zat makanan yang sangat penting bagi tubuh karena zat ini berfungsi sebagai sumber energi dalam tubuh serta sebagai zat pembangun dn pengatur. Protein adlaah polimer dari asam amino yang dihubungkan dengan ikatan peptida. Molekul protein mengandung unsur-umsur C, H, O, N, P, S, dan terkadang mengandung unsur logam seperti besi dan tembaga (Winarno, 1992).
Protein merupakan suatu polipeptida dengan BM yang sangat bervariasi dari 5000 sampai lebih dari satu juta karena molekul protein yang besar, protein sangat mudah mengalami perubahan fisis dan aktivitas biologisnya. Banyak regensia yang menyebabkan perubahan sifat alamiah dari protein seperti panas, asam, basa, solven organik, garam, logam berat, radiasi sinar radioaktif (Sudarmadji, 1996).
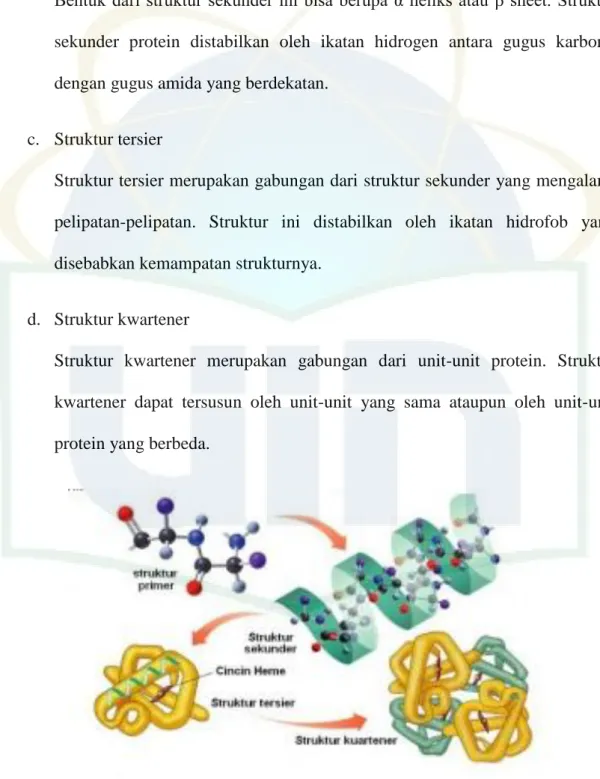
Struktur protein dapat dibagi menjadi empat bentuk; primer, sekunder, tersier, dan kuartener. Susunan linier asam amino dalam protein merupakan struktur primer. Susunan tersebut akan menentukan sifat dasar protein dan bentuk struktur sekunder serta tersier. Bila protein menandung banyak asam amino dengan gugus hidrofobik, daya kelarutannya kurang dalam air dibandingkan dengan protein yang banyak mengandung asam amino dengan gugus hidrofil (Winarno, 1992).
a. Struktur primer
Struktur primer protein tersusun oleh asam-asam amino yang dihubungkan oleh ikatan peptida.
8 b. Struktur sekunder
Struktur sekunder merupakan gabungan dari beberapa struktur primer.
Bentuk dari struktur sekunder ini bisa berupa α heliks atau β sheet. Struktur sekunder protein distabilkan oleh ikatan hidrogen antara gugus karbonil dengan gugus amida yang berdekatan.
c. Struktur tersier
Struktur tersier merupakan gabungan dari struktur sekunder yang mengalami pelipatan-pelipatan. Struktur ini distabilkan oleh ikatan hidrofob yang disebabkan kemampatan strukturnya.
d. Struktur kwartener
Struktur kwartener merupakan gabungan dari unit-unit protein. Struktur kwartener dapat tersusun oleh unit-unit yang sama ataupun oleh unit-unit protein yang berbeda.
Gambar 3. Struktur primer, sekunder, tersier, dan kwartener protein
9 Protein yang terdapat dalam bahan pangan mudah mengalami perubahan- perubahan, antara lain:
1. Dapat terdenaturasi oleh perlakuan pemanasan.
2. Dapat terkoagulasi atau mengendap oleh perlakuan pengasaman.
3. Dapat mengalami dekomposisi atau pemecahan oleh enzim-enzim proteolitik.
4. Dapat bereaksi dengan gula reduksi, sehingga menyebabkan terjadinya warna coklat.
Denaturasi protein dapat diartikan suatu perubahan atau modifikasi terhdap struktur sekunder, tersier, dan kuartener molekul protein tanpa terjadinya pemecahan ikatan-ikatan kovalen. Karena itu denaturasi dapat diartikan suatu proses terpecahnya ikatan hidrogen, interaksi hidrofobik, ikatan garam, dan terbukanya lipatan atau wiru molekul protein (Winarno, 1992).
Pada dasarnya suatu peptida adalah asil-asam amino, karena gugus – COOH dan –NH2 membentuk ikatan peptida. Peptida didapatkan dari hidrolisis protein yang tidak sempurna. Apabila peptida yang dihasilkan hidrolisis lebih lanjut akan dihasilkan asam-asam amino (Poedjiadi, 1994).
Gambar 4. Struktur ikatan peptida
10 Sifat peptida ditentukan oleh gugus –COOH, –NH2, dan gugus R. Sifat asam dan basa pada peptida ditentukan oleh gugus –COOH dan –NH2 , namun pada rantai panjang gugus –COOH dan –NH2 yang terletak di ujung rantai tidak lagi berpengaruh. Suatu peptida juga mempunyai titik isolistrik seperti pada asam amino. Reaksi biuret merupakan reaksi warna untuk peptida dan protein (Poedjiadi, 1994).
2.3. Peptida Bioaktif
Beberapa molekul asam amino dapat berikatan satu dengan lain membentuk suatu senyawa yang disebut peptida. Peptida diperoleh dengan cara hidrolisis protein yang tidak sempurna. Apabila dihidrolisis lebih lanjut, akan dihasilkan asam-asam amino (Poedjiadi, 1994).
Peptida bioaktif adalah suatu jenis peptida yang memiliki urutan komposisi asam amino yang pasti, merupakan fragmen pecahan protein, dengan protein aslinya sendiri tidak memiliki keaktifan biologis. Senyawa peptida tersebut memiliki dan menunjukkan sifat-sifat spesifik, segera setelah lepas dari atau dilepaskan dari molekul protein aslinya oleh kerja enzim (Winarno, 2001).
Insulin merupakan peptida yang berfungsi sebagai hormon yang dikeluarkan kelenjar pankreas. Di samping itu penisilin, suatu antibiotika yang dihasilkan oleh jamur Penucillium notatum adalah suatu peptida (Poedjiadi, 1994).
11 2.4. Hidrolisis Protein
Ikatan peptida yang membangun rantai polipeptida dalam protein dapat diputus (dihidrolisis) menggunakan asam, basa, atau enzim. Pemecahan ikatan peptida dalam kondisi asam atau basa kuat merupakan proses hidrolisis kimia dan pemecahan ikatan peptida menggunakan enzim merupakan proses hidrolisis biokimia. Reaksi hidrolisis peptida akan menghasilkan produk reaksi yang berupa satu molekul dengan gugus karboksil dan molekul lainnya memiliki gugus amina (Juniarso, et al., 2007).
Pada umumnya asam amino diperoleh sebagai hasil hidrolisis protein, baik menggunakan enzim maupun asam. Dengan cara ini diperoleh campuran bermacam-macam asam amino dan untuk menentukan jenis asam amino maupun kuantitas masing-masing asam amino perlu diadakan pemisahan antar asam amino tersebut. Ada beberapa metode analisis asam amino, misalnya metode gravimetri, kolorimetri, mikrobiologi, kromatografi, dan elektroforesis (Poedjiadi, 1994).
2.5. Enzim
Enzim dikenal untuk pertama kalinya sebagai protein oleh Sumner pada tahun 1926 yang telah berhasil mengisolasi urease, beberapa tahun kemudian Northrop dan Kunitz dapat mengisolasi pepsin, tripsin dan kimotripsin.
Selanjutnya makin banyak enzim yang telah dapat diisolasi dan telah dibuktikan bahwa enzim tersebut ialah protein (Poedjiadi, 1994).
Enzim adalah biokatalisator sejati. Molekul ini meningkatkan dengan nyata kecepatan reaksi kimia spesifik dengan efisiensi yang sangat tinggi tanpa
12 menyebabkan produk samping. Enzim meningkatkan kecepatan reaksi dengan menurunkan harga energi aktivasi (Hermanto, 2008).
Terdapat dua cara umum dalam meningkatkan kecepatan reaksi kimia, yang pertama adalah meningkatkan suhu. Biasanya, kecepatan reaksi kimia meningkat sampai kira-kira dua kali dengan kenaikan suhu 10oC, dan yang kedua adalah dengan menambahkan katalisator, katalisator ini mempercepat reaksi kimia dengan menurunkan batas penghalang energi (Lehninger, 1995).
2.5.1. Hidrolisis Enzimatik
a. Bromelin
Bromelin merupakan salah satu jenis enzim protease yang mampu menghidrolisis ikatan peptida pada protein atau polipeptida menjadi molekul yang lebih kecil yaitu asam amino. Bromelin banyak digunakan dalam bidang industri pangan maupun nonpangan seperti industri daging kalengan, minuman bir dan lain-lain (Wiseman, 1986).
Bromelin dapat diperoleh dari tanaman nanas baik dari tangkai, kulit, daun, buah maupun batang dalam jumlah yang berbeda.
Dilaporkan bahwa kandungan enzim bromelin lebih banyak tedapat pada batang yang selama ini kurang dimanfaatkan. Distribusi bromelin pada batang nanas tidak merata dan tergantung pada umur tanaman.
Kandungan bromelin pada jaringan yang umurnya belum tua terutama yang belum bergetah sangat sedikit sekali bahkan terkadang tidak ada sama sekali. Sedangkan bagian tengah batang mengandung bromelin lebih banyak dibandingkan dengan bagian tepinya (Hartadi, 1980).
13 Bromelin dari bonggol nanas memiliki sifat karakteristik (Anonim, 2000) sebagai berikut :
a. Berat molekul : 33,5 kDa b. Titik isoelektrik : pH 9,55
c. Derajat keasaman (pH) optimum : 6-8 d. Suhu optimum : 50oC
e. Aktivitas spesifik : 5-10 U/mg protein
f. Warna : putih sampai kekuning-kuningan dengan bau khas.
Bromelin tergolong ke dalam enzim protease tiol yang merupakan endopeptidase yang mempunyai residu sistein pada sisi aktifnya (Fersht (1985) dalam Puspitasari et al., 2009).
b. Pankreatin
Pankreatin merupakan kombinasi dari enzim pencernaan yang disekresikan oleh pankreas. Pankreatin mengandung amilase, tripsin, lipase, protease, dan aktivitas ribonuklease, meskipun hanya amilase, protease dan aktivitas lipase yang ditetapkan dalam National Formulary (NF) dan US Pharmacopeia (USP). Bobot molekul protease, amilase, dan lipase dalam pankreatin adalah masing-masing 23,8 kDa, 45 kDa, dan 38 kDa (Rhui Shen et.al., 2013). Pankreatin mengandung masing- masing dalam mg, tidak lebih dari 25 unit USP (United States Pharmacopeia) aktivitas amylase dan tidak lebih dari 2,0 unit USP aktivitas lipase.
14 c. Pepsin
Pepsin pertama kali ditemukan oleh seorang peneliti bernama Theodor Schwann pada 1836. Zat tersebut dinamai pepsin karena terinspirasi oleh bahasa Yunani, pepsis, yang berarti pencernaan.
Selanjutnya, pada 1929, pepsin menjadi enzim pertama yang berhasil dikristalkan. Tokoh yang berjasa dalam proses kristalisasi ini adalah John H. Northrop (Ahira, 2011).
Pepsin merupakan enzim yang dikeluarkan dalam bentuk prekursor enzim berupa pepsinogen. Pepsin mampu mendegradasi protein makanan menjadi ikatan-ikatan peptida. Pepsin merupakan salah satu enzim yang sangat efektif untuk mendegradasi protein di dalam sistem pencernaan makanan. Dua enzim lainnya adalah kimotripsin dan tripsin (Ahira, 2011).
Pepsin yang termasuk ke dalam protease karboksil, mempunyai berat molekul 34 KDa dengan 327 residu asam amino dan dapat mengakomodasi 4, 5, atau 7 residu asam amino dari substrat. Protease karboksil mempunyai berat molekul kira-kira 35 KDa dan semua spesifik untuk menghidrolisis ikatan peptida yang terletak antara residu hidrofobik. Protease karboksil mempunyai dua residu aspartat pada sisi aktifnya (Fersht (1985) dalam Puspitasari et al., 2009). Enzim dari kelas ini dikenal juga sebagai protease asam karena umumnya enzim ini aktif pada pH asam (Creighton (1993) dalam Puspitasari et al., 2009).
15 Pepsin merupakan enzim paling efisien dalam memecah ikatan antara peptida hidrofobik dan asam amino aromatik, seperti fenilalanin, triptofan, dan tirosin. Pepsin diekspresikan sebagai pepsinogen (bentuk prozimogen) yang struktur kimia utamanya memiliki 44 asam amino tambahan. Di dalam perut, setelah mengeluarkan pepsinogen, zat tersebut diaktifkan oleh HCl yang dilepas oleh dinding lambung. HCl menciptakan lingkungan yang asam. Hal ini memungkinkan struktur pepsinogen tersingkap dan terbelah dengan sendirinya sehingga menghasilkan pepsin (bentuk aktif). Pepsin menampilkan fungsi terbaiknya ketika kondisi lingkungan sekitar sangat asam, dengan pH antara 1,5 hingga 2. Pepsin akan mengalami denaturasi jika pH lebih dari 5,0. Pepsin dapat bekerja dengan optimal pada suhu 37-40°C dalam tubuh manusia. Pepsin memilki kemungkinan dihambat oleh inhibitor peptida lain, yaitu pepstatin (Ahira, 2011).
Setelah diisolasi pepsin harus disimpan pada suhu ruangan yang sangat dingin, antara -20°C sampai -80°C untuk mencegah struktur pepsin mengalami denaturasi autolisis atau pembelahan secara otomatis (self cleaveage). Peristiwa autolisis ini sebenarnya dapat dihindari dengan menyimpan pepsin pada pH 11. Ketika pH dikembalikan pada tingkat keasaman 4, pepsin akan bekerja seperti sedia kala (Ahira, 2011).
16 2.6. Elektroforesis SDS-PAGE ( Sodium Dodesil Solfat Polyacrylamide Gel )
Elektroforesis adalah suatu cara untuk memisahkan fraksi-fraksi suatu zat berdasarkan migrasi partikel bermuatan atau ion-ion makromolekul dibawah pengaruh medan listrik. Migrasi partikel bermuatan tersebut dapat terjadi karena perbedaan muatan total, ukuran dan bentuk (Pomranz dan Meloan, 1994).
Sedangkan menurut Rybicky dan Purves (1996) tingkat migrasi partikel tergantung pada muatan total, ukuran, bentuk dan juga kekuatan ionik, viskositas, dan suhu medium.
Beberapa kegunaan elektroforesis antara lain adalah untuk menentukan berat molekul, mendeteksi terjadinya kerusakan bahan seperti protein dalam pengolahan dan penyimpanan, memisahkan spesies molekul yang berbeda secara kualitatif maupun kuantitatif serta menentukkan titik isoelektrik (Nur dan Adijuwana, 1989). Faktor-faktor yang mempengaruhi pemisahan dengan elektroforesis adalah muatan penyangga, sistem buffer, suhu, waktu dan besar arus. Semakin tinggi arus maka pemisahan akan semakin cepat, namun suhu akan bertambah ( Bintang 2010 ).
Gambar 5. Skematik elektroforesis SDS-PAGE (Widyastuti & Nurcholis, 2012)
17 Gel poliakrilamid dibentuk dari polimerisasi akrilamid dengan sejumlah kecil metilen bisakrilamid sebagai cross-linking agent yang diinisiasi oleh TEMED (tetrametilen-etilendiamin) dan APS (amonium persulfat) (Wilson &
Warker, 2000). Radikal-radikal bebas dari amonium persulfat akan bereaksi dengan akrilamid sehingga terbentuk akrilamid aktif. Akrilamid ini aktif dapat bereaksi dengan cara yang sama dengan molekul akrilamid yang lain sehingga dihasilkan suatu rantai polimer yang panjang. Larutan yang mengandung rantai polimer yang panjang ini tidak membentuk gel. Untuk membentuk gel diperlukan N,N’-metilen-bis-akrilamid yang bertindak sebagai cross-linking agent.
Polimerisasi menyebabkan terbentuknya “jala” dari rantai akrilamid. Ukuran pori dari jala tersebut ditentukan oleh jumlah akrilamid yang dipergunakan per unit volume medium reaksi dan derajat ikatan silangnya (Nur & Adijuwana, 1989).
2.7. Kalsium
Kalsium Merupakan mineral yang paling banyak terdapat dalam tubuh, yaitu 1,5-2 % dari berat badan orang dewasa. Kalsium tulang berada dalam keadaan seimbang dengan kalsium dalam plasma pada konsentrasi kurang lebih 2,25-2,60 mmol/l (9-10,4 mg/100ml). Di dalam cairan ekstraseluler dan intraseluler kalsium memegang peranan penting dalam mengatur fungsi sel, seperti untuk transmisi saraf, kontraksi otot, penggumapalan darah dan menjaga permebilitas membran sel, kalsium juga mengatur pekerjaan hormon-hormon dan faktor pertumbuhan (Almatsier, 2004),
18 2.7.1 Proses Metabolisme Kalsium
Proses absorbsi kalsium, yang terutama terjadi di dalam bagian atas usus halus, ditingkatkan oleh 1,25- dehidroks ikolekalsiferol (dan metabolit aktif lain dari vitamin D) disertai kerja hormon paratiroid yang sinergis . Adanya metabolit aktif di dalam sirkulsai umum dan bukan di dalam lumen usus dapat meningkatkan sintesa protein pengikat kalsium dalam enterosit. Absorbsi kalsium dapat dikurangi dengan memberikan filtrat per oral ataupun asam lemak atau fosfat berlebihan. (DN. Baron, 1995).
Kalsium di dalam feses terkandung dari diet yang tak diabsorbsi, juga kalsium yang keluar dari plasma ke dalam usus. Dari masukan sehari-hari 25 mmol (1 kg) kalsium, 2,5-7,5 (0,1-0,3 g) diekskresikan ke dalam urin dan sisanya ditemukan di dalam feses. Hampir semua kalsium yang difiltrasi akan diabsorbsi kembali. Kalsium berlaku sebagai zat ambang dan bila kadar kalsium turun maka eksresinya ke dalam urin berhenti. Pada fungsi ginjal yang normal jumlah kalsium yang diekskresikan ke dalam urin meningkat karena kadar kalsium serum meningkat. Sekitar 2.5 mmol (0,1 g) kalsium hilang setiap hari pada kulit dan keringat. (DN. Baron, 1995).
2.7.2 Uji Pengikatan Kalsium
Penyerapan kalsium dari usus relatif lambat. Secara umum, agar diserap, kalsium harus terlarut dalam usus. Kelarutan kalsium dalam usus disebabkan oleh beberapa faktor. Selain faktor asupan, fitat dan oksalat diketahui membentuk kompleks-kompleks dengan kalsium yang tak larut dan tak terserap di dalam usus dan mengurangi penyerapan kalsium dalam usus (Tanimoto et al., 2001).
19 Pengujian kalsium terlarut dilakukan dengan memanfaatkan reaksi o- Cresolphtalein-kalsium yang stabil yang akan membentuk kompleks warna ungu dengan adanya kalsium.
Kalsium + o-Cresolphtalein Complexone → kompleks kalsium-Cresolphtalein Complexone
Dalam suasana basa, kalsium bereaksi dengan o-Cresolphtalein Complexone membentuk kompleks warna ungu. Intensitas warna yang dihasilkan setara dengan konsentrasi kalsium dalam sampel dan diukur dengan spektrofotometer UV-Vis pada λ 540 nm.
20 BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Pengembangan Teknologi Industri Agro dan Biomedika (LAPTIAB), Badan Pengkajian dan pengembangan Teknologi (BPPT), Pusat Penelitian Ilmu Pengetahuan dan Teknologi (Puspiptek), Serpong. Penelitian ini dilakukan pada bulan Oktober 2011 – Februari 2013.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan antara lain: penangas air, penggiling, magnetic stirrer, centrifuge, tabung centrifuge, pHmeter, oven, hot plate, kertas saring, neraca analitik, inkubator, cawan petri, water bath, microwall plate, microwell plate reader, Spektrofotometer UV-Vis dan alat gelas lainnya.
3.2.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah: kacang komak BALITKABI-Malang, enzim pepsin, enzim pankreatin, enzim bromelin, asam trikloroasetat (TCA), n-heksan, akuades, NaOH, HCl, buffer fosfat pH 6; 7,8; dan 8, buffer KCl-HCl pH 2, BSA, larutan Bradford, bahan pereaksi untuk SDS- PAGE (akrilamid, APS, TEMED, SDS, buffer tris-HCl), metanol, etanol, asam asetat, formaldehid, perak nitrat, natrium karbonat, CaCl2, hydroxy-quinoline, Na2HPO4, CaCO3, mili-Q, dan aseton.
21 3.3. Prosedur Kerja
3.3.1 Pembuatan Tepung Kacang Komak Bebas Lemak
Sebanyak 500 gram tepung kacang komak ditambahkan 1 liter heksan (1:2). Dilakukan dengan metode perendaman setiap 30 menit selama 90 menit diganti dengan n-heksan yang baru dan selanjutnya setiap 1 jam selama 3 jam diganti dengan n-heksan yang baru, lalu dikeringkan di dalam oven dengan suhu 45oC selama 1 jam.
3.3.2 Analisis Proksimat
Pengukuran kadar protein menggunakan metode Kjedhal, kadar lemak menggunakan metode Soxhlet, sedangkan kadar air dan kadar abu menggunakan metode gravimetri.
22 3.3.3 Pembuatan Isolat Protein
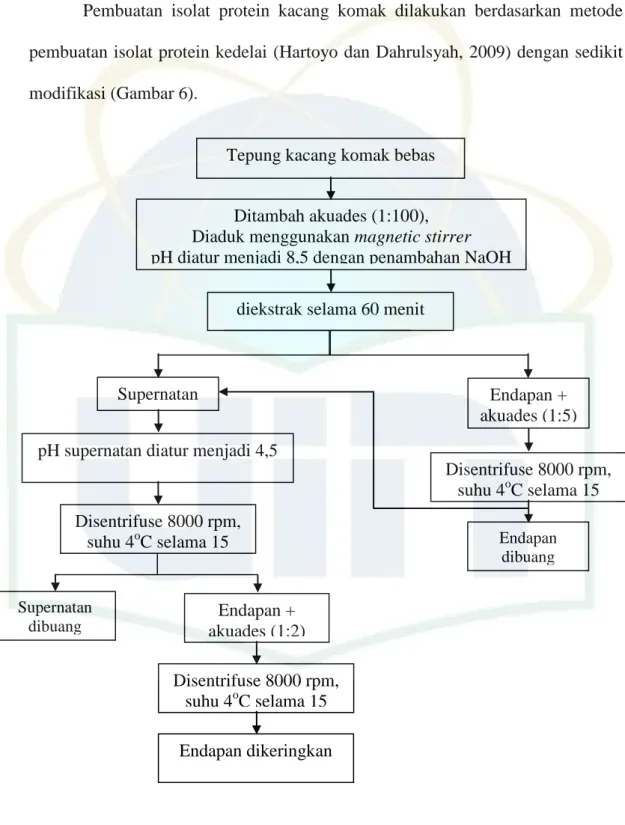
Pembuatan isolat protein kacang komak dilakukan berdasarkan metode pembuatan isolat protein kedelai (Hartoyo dan Dahrulsyah, 2009) dengan sedikit modifikasi (Gambar 6).
Gambar 6. Skema pembuatan isolat protein tepung kacang komak Ditambah akuades (1:100),
Diaduk menggunakan magnetic stirrer pH diatur menjadi 8,5 dengan penambahan NaOH
2N
Tepung kacang komak bebas lemak
Endapan + akuades (1:5) diekstrak selama 60 menit
Supernatan
pH supernatan diatur menjadi 4,5 dengan penambahan HCl 2N
Disentrifuse 8000 rpm, suhu 4oC selama 15
menit
s u
h u 4
o
C s e l a m a 1 5 m e n i t
Disentrifuse 8000 rpm, suhu 4oC selama 15
menit
s u
h u 4
o
C s e l a m a 1 5 m e n i
Endapan dibuang
Supernatan dibuang
Endapan + akuades (1:2) Disentrifuse 8000 rpm,
suhu 4oC selama 15 menit
s u
h u
4
o
C
s e l a m a
Endapan dikeringkan
(isolat protein)
s u
h u
4
o
C
s e l
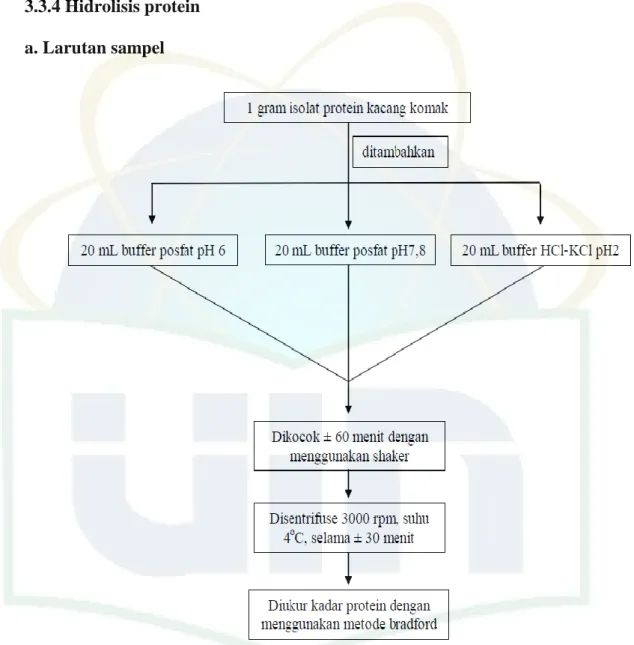
23 3.3.4 Hidrolisis protein
a. Larutan sampel
Gambar 7. Skema pembuatan larutan sampel untuk hidrolisis dengan masing-masing enzim bromelin, pankreatin dan pepsin
24 b. Pembuatan larutan enzim
Larutan bromelin dibuat dengan cara mengencerkan 4 gram bromelin dengan 10 mL larutan buffer fosfat pH 6, kemudian dikocok dengan menggunakan shaker selama 60 menit. Larutan disentrifuse dengan kecepatan 3000 rpm, suhu 4oC selama 30 menit.
Larutan pankreatin dibuat dengan cara mengencerkan 4 gram pankreatin dengan 10 mL larutan buffer fosfat pH 7,8 kemudian dikocok dengan menggunakan shaker selama 60 menit. Larutan disentrifuse dengan kecepatan 3000 rpm, suhu 4oC selama 30 menit.
Larutan pepsin dibuat dengan cara mengencerkan 4 gram pepsin dengan 10 mL larutan buffer HCl-KCl pH 2, kemudian dikocok dengan menggunakan shaker selama 60 menit. Larutan disentrifuse dengan kecepatan 3000 rpm, suhu 4oC selama 30 menit.
Kelarutan protein larutan sampel dan larutan enzim diukur memakai metode Bradford. Pengukuran dilakukan menggunakan microwell plate reader dengan panjang gelombang λ 450 nm dan λ 595 nm.
c. Hidrolisis dengan Enzim Bromelin
Dimasukkan 900 µL larutan sampel pH 6 dengan konsentrasi 2,2 mg/mL kedalam tabung eppendorf ukuran 2 mL, kemudian ditambahkan 100 µL larutan enzim bromelin dengan konsentrasi 0,4 mg/mL. Larutan selanjutnya diinkubasi dengan variasi waktu (0, 2, 4, 8, 18, 24 jam) pada suhu 50oC.
Aktivitas enzim dinonaktifkan dengan penambahan 100 µL HCl 2N dan
25 pemanasan pada air mendidih selama 10 menit, kemudian disentrifuse selama 30 menit, suhu 4oC, dan kecepatan 11.000 rpm.
d. Hidrolisis dengan Enzim Pankreatin
Dimasukkan 900 µL larutan sampel pH 7,8 dengan konsentrasi 2,2 mg/mL kedalam tabung effendof ukuran 2 mL, kemudian ditambahkan 100 µL larutan enzim pankreatin dengan konsentrasi 0,4 mg/mL. Larutan selanjutnya diinkubasi dengan variasi waktu (0, 2, 4, 8, 18, 24 jam) pada suhu 50oC.
Aktivitas enzim dinonaktifkan dengan penambahan 100 µL HCl 2N dan pemanasan pada air mendidih selama 10 menit, kemudian disentrifuse selama 30 menit, suhu 4oC, dan kecepatan 11.000 rpm.
e. Hidrolisis dengan Enzim Pepsin
Dimasukkan 900 µL larutan sampel pH 2 dengan konsentrasi 2,2 mg/mL ke dalam tabung effendof ukuran 2 mL, kemudian ditambahkan 100 µL larutan enzim pepsin dengan konsentrasi 0,4 mg/mL. Larutan selanjutnya diinkubasi dengan variasi waktu (0, 2, 4, 8, 18, 24 jam) pada suhu 50oC. Aktivitas enzim dinonaktifkan dengan pemanasan pada air mendidih selama 10 menit, kemudian disentrifuse selama 30 menit, suhu 4oC, dan kecepatan 11.000 rpm.
3.3.5 Derajat Hidrolisis (%DH)
DH dinyatakan sebagai rasio persentase protein terlarut dalam asam trikloroasetat (TCA) 10% untuk protein total (Hoyle dan Merritt, 1994).
Selanjutnya, TCA 10% ditambahkan ke dalam hidrolisat (1:1). Setelah 1 jam inkubasi pada suhu 4°C sampel disentrifus selama 15 menit dengan kecepatan 11.000 rpm dengan suhu 4°C. Kadar protein diukur dengan metode Bradford dan
26 pembacaan menggunakan microwell plate reader dengan panjang gelombang λ 450 nm dan λ 595 nm.
3.3.6 Uji Protein Metode Bradford
Sampel uji hasil hidrolisis enzimatik sebanyak 10 µL dimasukkan ke dalam lubang sumur pada microwell plate. Sampel kemudian ditambahkan 260 µL larutan Bradford dan dilakukan pembacaan konsentrasi protein menggunakan microwell plate reader dengan panjang gelombang . Pembacaan pada microwell plate reader harus disertakan dengan standar BSA.
Selanjutnya dibuat kurva standar BSA untuk menghitung konsentrasi protein sampel uji.
3.3.7. Analisis Kalsium dengan Metode Kolorimetri dengan Reagen ortho- cresolphtalein complexone (Gitelman, 1967)
a. Pencucian alat
Semua alat-alat gelas yang akan digunakan untuk analisis kalsium direndam dengan larutan HCl 3% selama 24 jam agar bebas dari trace material khususnya kalsium.
b. Preparasi sampel
Sebanyak 0,5 mL larutan sampel, 0,5 mL CaCl2 10 mM, dan 1 mL buffer fosfat pH 8 20 mM dimasukkan kedalam tabung reaksi 15 mL, kemudian dikocok dan diinkubasi pada suhu 37oC selama 2 jam, setelah diinkubasi kemudian disentrifuse selama 30 menit, 25oC, dan kecepatan 6000 rpm.
27 Diambil supernatan untuk analisis kalsium. Larutan sampel untuk analisis kalsium harus segera dianalisis setelah dilakukan preparasi.
c. Pembuatan colour reagent (reagen pewarna)
Reagen ini dibuat dengan cara melarutkan 25 mg O-Cresolpthalein Complexone powder dengan 15 mL HCl 37% dan 25 mL mili-Q. Larutan divorteks dan ditambahkan 250 mg 8 hydroxy-quinoline, kemudian dimasukkan kedalam labu ukur 250 mL dan ditambahkan mili-Q hingga tanda tera. Reagen ini harus disimpan di botol gelap pada suhu 25-35oC dan hanya bertahan selama 1 minggu.
d. Penyiapan AMP Buffer pH 10,7 (2-amino-2-methyl-1-propanol ) Buffer ini dibuat dengan cara menambahkan 37,8 mL AMP dan 150 mL mili-Q pada labu ukur 250 mL. pH larutan diatur sampai 10,7 dengan cara menambahkan HCl 6N, kemudian ditambahkan lagi mili-Q hingga tanda tera pada labu ukur. Buffer disimpan di botol gelap dan diletakkan di dalam kulkas, buffer ini hanya stabil selama 3 minggu.
e. Pembuatan Working Standar (Larutan Standar Kalsium)
Larutan standar kalsium dibuat dengan variasi konsetrasi 5; 7,5; 10;
12,5 mg/dL dengan mengencerkan CaCO3 dengan mili-Q sesuai dengan Tabel 2. Analsis kadar kalsium dilakukan menggunakan instrumen spektrofotometer UV-Vis pada λ 540 nm secara duplo.
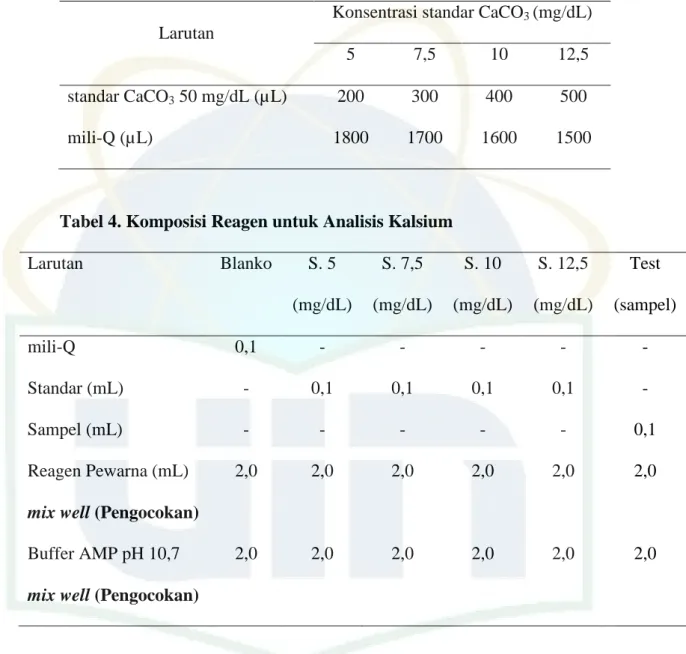
28 Tabel 3. Perbandingan Volume Standar CaCO3 dan mili-Q
Larutan
Konsentrasi standar CaCO3 (mg/dL)
5 7,5 10 12,5
standar CaCO3 50 mg/dL (µL) 200 300 400 500
mili-Q (µL) 1800 1700 1600 1500
Tabel 4. Komposisi Reagen untuk Analisis Kalsium
Larutan Blanko S. 5
(mg/dL)
S. 7,5 (mg/dL)
S. 10 (mg/dL)
S. 12,5 (mg/dL)
Test (sampel)
mili-Q 0,1 - - - - -
Standar (mL) - 0,1 0,1 0,1 0,1 -
Sampel (mL) - - - 0,1
Reagen Pewarna (mL) 2,0 2,0 2,0 2,0 2,0 2,0
mix well (Pengocokan)
Buffer AMP pH 10,7 2,0 2,0 2,0 2,0 2,0 2,0
mix well (Pengocokan)
3.3.8. Elektroforesis SDS-PAGE
Elektroforesis SDS-PAGE (Sodium Dodecyl Sulphate Polycrylamde Gel Electrophoresis) dilakukan dengan menggunakan metode standar (Sambrook, 1989) dengan menggunakan alat Mini-Protean II Slab Cell Electrophoresis (Bio Rad). Uji SDS-PAGE terdiri dari persiapan pereaksi, pembuatan media gel, preparasi sampel dan marker, serta proses pemisahan.
29 Tabel 5. Komposisi Reagen untuk Pembuatan Gel Akrilamid
Bahan
Volume (µL)
Separating Gel Stacking Gel
Akuades 1580 1195
Buffer tris HCl 1,5 M pH 8,8 1250 -
Buffer tris HCl 0,5 M pH 6,8 - 500
SDS 10% 50 20
Akrilamid 2080 260
APS 10% 25 15
TEMED 15 10
Untuk membuat media gel pada uji SDS-PAGE membutuhkan bahan- bahan dengan volume seperti yang tertera pada tabel 5.
1. Persiapan Sampel dan Marker
Larutan isolat protein tepung kacang komak hasil hidrolisis dipekatkan konsentrasinya menjadi 60 µg/ml dengan perbandingan sampel dan aseton dingin (1:4) dan disimpan dalam freezer. Setelah 1 jam larutan disentrifuse dengan kecepatan 14.000 rpm pada suhu 40C selama 10 menit. Larutan dievaporasi sampai kering dan hanya tersisa endapan yang akan dinalisis.
Endapan hasil evaporasi dilarutkan dengan 25 µL 2x sampel buffer, kemudian di-vortex selama 40 detik. Setelah itu diinkubasi dalam water bath pada suhu 95 0C selama 5 menit dan di-vortex selama 40 detik. Untuk menghindari
30 adanya endapan yang terbawa pada saat larutan sampel disuntikkan kedalam gel larutan sampel terlebih dahulu disentrifuse kembali dengan kecepatan 14.000 rpm pada suhu 4 0C selama 10 menit. Running Buffer 1x, alat elektroforesis dan power supply disiapkan dan dirangkai.
2. Proses pemisahan
Sebanyak 15 µL sampel dimasukkan kedalam sumur (well) dengan menggunakan pipet mikro, sedangkan marker dimasukkan sebanyak 10 µL.
Kemudian alat elektroforesis dihubungkan dengan arus listrik dan diatur tegangannya sebesar 140 volt (tegangan listrik dinaikkan menjadi 160 volt apabila larutan sampel telah mencapai separating gel) dengan arus 100 ampere. Running dilakukan sampai protein standar mencapai batas (kira-kira 0,5 cm dari ujung gel), setelah itu gel dikeluarkan dengan sangat hati-hati agar tidak pecah atau robek.
3. Proses Pewarnaan Gel
Gel diletakkan dalam cawan petri dan dicuci dengan menggunakan akuades sebanyak lima kali, selanjutnya direndam dengan larutan stain (Coomassie Blue R 250) dan didiamkan semalaman. Sebelum disimpan gel dicuci telebih dahulu dengan larutan pencuci yang telah disiapkan, apabila pita-pita protein pada gel belum terlihat jelas, maka dilakukan proses pewarnaan perak (silver staining), langkah kerja silver staining terdapat pada lampiran 10.
31 BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil uji Proksimat Tepung Kacang Komak
Dalam penelitian ini yang menjadi bahan sampel uji adalah isolat protein yang dihasilkan dari tepung kacang komak. Hasil analisis proksimat dari tepung kacang komak bebas lemak dihasilkan sebagai berikut:
Tabel 6. Komposisi Kimiawi Tepung Kacang Komak
Komponen % Bobot Kering (bk)
Karbohidrat 59,79
Protein 26,47
Lemak 1,44
Kadar Air Kadar Abu
4,70 7,60
Kadar protein tepung kacang komak mencapai 26,47 % bk, sedangkan kadar protein kacang komak hasil uji proksimat oleh Subagio et al., (2006) hanya sebesar 17,1 % bk, hal ini membuktikan bahwa kandungan protein lebih banyak terdapat pada tepung kacang komak di bandingkan dengan kacang komak.
4.2. Hidrolisis Isolat Protein dengan Enzim
Pada proses hidrolisis menggunakan enzim, substrat yang digunakan akan diubah menjadi produk hidrolisat, protein merupakan komponen penting dalam produk hidrolisat. Tingkat mutu dari produk hidrolisat sangat ditentukan kadar zat terlarut, terutama kadar protein (Syahrizal, 1991).
32 Isolat protein hasil ekstraksi dihidrolisis dengan masing-masing enzim bromelin, pankreatin, dan pepsin dengan perbandingan konsentrasi subtrat : enzim yaitu (10:1). Kadar protein dihitung dengan cara memasukkan absorbansi sampel ke dalam persamaan regresi dari kurva standar BSA (Bovine Serum Albumin).
Gambar 8. Perbandingan kadar protein hasil hidrolisis enzimatik Gambar 8 menunjukkan kurva hidrolisis protein isolat protein kacang komak oleh enzim bromelin, pankreatin, dan pepsin. Kadar protein hasil hidrolisis dari ketiga enzim tersebut, terbukti semakin lama waktu hidrolisis maka semakin rendah kadar protein dalam larutan sampel uji. Hal ini dikarenakan semakin asam larutan yang digunanakan dan semakin lama waktu hidrolisis maka semakin banyak ikatan peptida yang telah terhidrolisis sehingga kandungan proteinnya semakin rendah.
0.00 500.00 1000.00 1500.00 2000.00 2500.00
0 5 10 15 20 25 30
kadar protein (mg/ml)
Waktu inkubasi (jam)
bromelin pankreatin pepsin
33 4.3 Derajat Hidrolisis (% DH)
Derajat hidrolisis merupakan suatu parameter yang menunjukan kemampuan protease untuk menguraikan protein, derajat hidrolisis digunakan untuk menentukan derajat kesempurnaan proses hidrolisis (Hasnaliza et al., 2010).
Derajat hidrolisis dalam proses hidrolisis isolat protein tepung kacang komak bebas lemak dapat dilihat pada gambar.
Gambar 9. Persen Derajat Hidrolisis
Hidrolisis isolat protein tepung kacang komak menggunakan enzim bromelin, pankreatin, dan pepsin menghasilkan derajat hidrolisis antara 6,12%
sampai 40,83%. Nilai derajat hidrolisis terendah pada perlakuan hidrolisis dengan enzim pankreatin dengan waktu inkubasi 0 jam sebesar 6,12% dan nilai derajat hidrolisis tertinggi pada perlakuan hidrolisis dengan enzim pepsin dengan waktu inkubasi 24 jam sebesar 40,83 %. Hal ini sesuai dengan hasil penelitian yang dilakukan oleh Raharja et al. (2011) tingkat hidrolisis yang memberikan nilai tertinggi diperoleh pada pH yang lebih asam, pH yang digunakan pada larutan enzim pepsin dan larutan isolat protein yang dihidrolisis menggunakan enzim
0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 45.00
0 5 10 15 20 25 30
Derajat Hidrolisis (%)
Waktu inkubasi (jam)
bromelin pankreatin pepsin
34 pepsin menggunakan pH 2. Hal ini membuktikan bahwa semakin asam dan semakin lama waktu hidrolisis maka akan semakin tinggi nilai derajat hidrolsisnya.
Nilai derajat hidrolisis dipengaruhi oleh jumlah senyawa peptida dan asam amino sebagai hasil pemecahan protein oleh enzim. Peningkatan derajat hidrolisis disebabkan oleh peningkatan peptida dan asam amino yang terlarut dalam TCA akibat dari pemutusan ikatan peptida selama hidrolisis protein (Hasnaliza et al., 2010).
4.4. Profil Protein Dengan Menggunakan Gel Elektroforesis
SDS-PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis) mempunyai kelebihan dalam mengklasifikasikan suatu protein dengan cara membandingkan berat molekul dari bahan yang digunakan. Berat molekul dari rantai polipeptida dapat ditentukan dengan cara membandingkan mobilitas elektroforesis pada SDS Gel dengan mobilitas protein marker dengan rantai polipeptida dari berat molekul yang diketahui. Protein yang mempunyai berat molekul paling tinggi akan berada pada lapisan paling atas dari gel pemisah (Wilson dan Walker, 2000).
Poliakrilamid gel elektroforesis dilakukan dengan lempeng tipis di antara dua plat kaca (slab gel). Penggunaan mini slab gel memiliki keuntungan dapat memisahkan sampel lebih dari satu dalam satu kali elektroforesis yang berbeda dengan gel batang yang hanya dapat memuat satu sampel (Wilson dan Walker, 2000). Selain itu keuntungan lain dalam aplikasi analitis, penggunaan mini slab
35
K 0 2 4 8 18 24 LMW
gel sangat populer karena dapat meningkatkan resolusi, mengurangi waktu, dan material yang dibutuhkan (Bollag dan Edelstein, 1991).
Penelitian ini menggunakan gel poliakrilamida sebesar 12,5% sehingga mobilitas protein yang diperoleh besar dan protein dengan berat molekul yang tinggi dapat dipisahkan. Hal ini sesuai dengan Hames dan Rickwood (1981), yaitu semakin tinggi konsentrasi gel poliakrilamid yang digunakan maka semakin kecil ukuran molekul yang dipisahkan dan semakin besar mobilitas molekul tersebut.
Waktu dan arus listrik yang optimum akan menghasilkan pola pemisahan molekul yang optimum (Wilson dan Walker, 2000).
Hasil pemisahan protein hasil hidrolisis isolat protein tepung kacang komak dengan enzim bromelin, pankreatin dan pepsin ditunjukkan pada gambar 10, 11, dan 12.
Gambar 10. Profil protein isolat protein tepung kacang komak hasil hidrolisis dengan bromelin (k = kontrol, 0-24 waktu hidrolisis (jam), LMW (marker))
250 150 100 75 50 37 25 20 15 10
36
0 2 4 8 18 24 LMW
0 2 4 8 18 24 LMW
Gambar 11. Profil protein isolat protein tepung kacang komak hasil hidrolisis dengan pankreatin (0-24 waktu hidrolisis (jam), LMW (marker)).
Gambar 12. Profil protein isolat protein tepung kacang komak hasil hidrolisis dengan Pepsin (0-24 waktu hidrolisis (jam), LMW (marker))
Hasil yang ditunjukkan oleh gambar 10, 11, dan 12 menampilkan profil potein dari isolat protein tepung kacang komak hasil hidrolisis menggunakan enzim bromelin, pankreatin, dan pepsin dengan variasi waktu hidrolisis 0, 2, 4, 8, 18,24 jam dan LMW (Low Molecular Weight). Pada gambar 10 pada waktu
250 150 100 75 50 37
25 20 15 10
250 150 100 75 50 37
25 20 15 10
37 hidrolisis 4 jam tidak tampak pita protein pada gel akrilamid, agar dapat terlihat perlu dilanjutkan dengan proses pewarnaan perak (silver staining) sehingga didapat seperti pada gambar 13.
Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein diukur dari garis awal separating gel sampai ujung pita protein yang dibandingkan dengan jarak migrasi tracking dye. Mobilitas relatif tersebut dapat dirumuskan sebagai berikut :
Persamaan garis regresi dibuat dari nilai Rf protein standar terhadap nilai log BM molekulnya dan menghasilkan kurva standar (Gambar 14) dengan persaman regresi : y = 5,177 – 1,542x
K 0 2 4 8 18 24 LMW
Gambar 13. Hasil silver staining gel pada gambar 10
38 Tabel 7. Berat molekul isolat protein hasil hidrolisis dengan enzim bromelin
Pita
Berat Molekul Isolat Protein Hasil Hidrolisis dengan Enzim Bromelin
(kDa)
Waktu Inkubasi (jam)
Kontrol 0 2 4 8 18 24
1 125 125 - - - - -
2 98 98 - - - - -
3 81 - - - -
4 68 68 68 - - - -
5 - - - 47
6 44 44 - 44 - - -
7 37 - - - -
8 33 33 33 - 33 33 33
9 29 - - - -
10 23 23 23 - 23 - -
11 18 18 18 18 18 18 -
12 14 14 - - - - -
13 - - 13 - 13 13 13
14 10 - 10 - 10 10 10
15 7 - 7 - 7 7 7
16 6 - 6 - 6 6 6
39 Tabel 8. Berat molekul isolat protein hasil hidrolisis dengan enzim pankreatin
Pita
Berat Molekul Isolat Protein Hasil Hidrolisis dengan Enzim Pankreatin
(kDa)
Waktu Inkubasi (jam)
0 2 4 8 18 24
1 69 69 - 69 69 -
2 59 59 - 59 59 -
3 45 - - - - -
4 34 34 - 34 34 34
5 29 29 - 29 29 29
6 25 25 - 25 25 25
7 - 21 - 21 21 21
8 18 - - 18 18 18
9 15 - - 15 15 -
10 12 - - - - -
11 10 10 10 10 10 -
12 7 7 7 7 7 -
Tabel 9. Berat molekul isolat protein hasil hidrolisis dengan enzim pepsin
Pita
Berat Molekul Isolat Protein Hasil Hidrolisis dengan Enzim Pepsin
(kDa)
Waktu Inkubasi (jam)
0 2 4 8 18 24
1 79 - - - - -
2 71 71 71 71 71 71
3 54 - - 54 54 54
4 - 48 48 - - -
5 43 43 43 43 43 -
6 36 36 36 36 36 36
7 23 23 23 23 23 -
8 19 19 - - - -
9 16 16 16 16 16 16
10 12 12 12 - - -
11 8 10 10 - - -
12 - 8 - - 8 8
13 - 7 - - - -
40 Profil protein dari tepung kacang komak yang dihidrolisis dengan enzim dan pH yang berbeda menunjukkan pita yang berbeda (Gambar 9,10 dan 11).
Berdasarkan Kay (1979), globulin merupakan protein utama dalam kacang komak. Subunit monomer glisinin (frakasi 11) mempunyai struktur umum A-S-S- B, dimana A mewakili polipeptida asam berbobot molekul 34-44 kDa dan B mewakili polipeptida basa bebobot molekul sekitar 20 kDa (Liu, 1997). Dari perhitungan bobot molekul pita protein sampel bahwa subunit peptida asam terdapat pada kontrol tepung kacang komak sebesar 37 dan 44 kDa, hidrolisat dengan enzim bromelin (0 dan 4 jam) sebesar 44 kDa, hidrolisat dengan enzim pankreatin (0, 2, 8, 18, dan 24 jam) sebesar 34 kDa dan pada hidrolisat dengan enzim pepsin (0, 2, 4, 8, dan 18 jam) sebesar 43 kDa. Subunit peptida basa terdapat pada kontrol tepung kacang komak, hidrolisat dengan enzim bromelin (0, 2, 4, 8, dan 18 jam) sebesar 18 kDa, hidrolisat dengan enzim pankreatin (2, 8, 18, dan 24 jam) sebesar 21 kDa, hidrolisat dengan enzim pepsin (0 dan 2 jam) sebesar 19 kDa.
Kacang komak juga memiliki protein β-konglisinin (7S globunin), β- konglisinin memiliki berat molekul sekitar 180 kDa dan mempunyai tiga jenis subunit α’, α dan β dengan berat molekul masing-masing sekitar 57, 57 dan 42 kDa (Liu, 1997). Sementara menurut Tanh dan Shibasaki (1977) didalam Utsumi et, al. (1977), menyatakan bahwa berat molekul tersebut berturut-turut 68, 72 dan 52 kDa. Pita protein tepung kacang komak yang menunjukkan berat molekul yang mendekati berat molekul subunit α ditunjukkan dengan pita protein tepung kacang