MANIPULASI HORMONAL PADA PEMATANGAN GONAD
IKAN PATIN SIAM Pangasianodon hypopthalmus
BOEDI RACHMAN
MAYOR ILMU AKUAKULTUR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Manipulasi Hormonal pada Pematangan Gonad Ikan Patin Siam Pangasianodon hypopthalmus adalah karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun ke perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Boedi Rachman
RINGKASAN
BOEDI RACHMAN. Manipulasi Hormonal Pada Pematangan Gonad Ikan Patin Siam Pangasianodon hypopthalmus. Dibimbing oleh AGUS OMAN SUDRAJAT, dan NUR BAMBANG PRIYO UTOMO.
Patin siam, Pangasianodon hypophthalmus, merupakan komoditas budidaya ikan air tawar yang potensial sebagai bahan filet karena memiliki rasa enak, bertekstur lembut, serta mengandung gizi yang baik. Laporan dari Food and Agriculture Organization menyebutkan bahwa hingga akhir Juni 2011 besarnya filet patin yang terserap oleh negara – negara pengimpor tercatat : Amerika Serikat sekitar 92.000 ton, Eropa 188.100 ton, India 1.500 ton dan Filipina 7.200 ton. Peluang ini tidak dapat dimanfaatkan oleh exportir Indonesia karena hingga akhir tahun 2010 produksi filet ikan patin masih rendah hanya sekitar 104.975 ton. Jika ditelusuri penyebab rendahnya produksi filet patin adalah, tidak maksimalnya usaha pembesaran akibat terbatasnya ketersediaan benih sepanjang tahun. Kondisi ini juga sangat terkait sifat bioreproduksi alami patin yang matang gonad setahun sekali yaitu pada musim hujan saja. Upaya yang dapat dilakukan untuk memperbanyak produksi benih adalah dengan meningkatkan frekuensi pematangan gonad dan pemijahan melalui induksi hormon.
Penelitian ini dilakukan untuk mengetahui peran PMSG dan Antidopamin dalam menginduksi pematangkan secara hormonal gonad ikan patin. Pelaksanaan penelitian selama 60 hari, pengambilan sampel dilakukan setiap 14 hari sekali meliputi ; (1) laju pertumbuhan spesifik, yang dilakukan dengan menimbang tiap individu dalam semua perlakuan ;(2) analisa hormon estradiol - 17 β, dilakukan dengan menganalisa plasma darah ikan uji menggunakan metode ELISA;(3) kadar glukosa darah, dicatat dari hasil pengukuran kadar glukosa pada plasma darah; (4) pengambilan nilai hepatosomatik indeks, dilakukan dengan menimbang bobot hati menggunakan timbangan digital 2 digit;(5) pengambilan nilai gonadosomatik indeks dilakukan dengan menimbang bobot gonad menggunakan timbangan digital 2 digit ;(6) histologi gonad, dilakukan dengan membuat preparat histologi; (7) diameter telur, diamati dan dipotret dengan menggunakan mikroskup binokuler Olympus type SZX16 perbesaran lensa 100 kali ; (8) penghitungan persentase induk matang gonad, dilakukan dengan melihat rata – rata ukuran telur ikan uji pada masing - masing perlakuan menggunakan kateter pada hari ke – 28 dan 42, dan (9). kualitas air diamati tiap 7 hari.
Penelitian ini menggunakan rancangan faktorial yang terdiri 3 level dosis PMSG dan 2 level dosis AD. Formulasi dosis yang tersusun yaitu: (1) P1A0 kombinasi dosis dan kontrol diujikan terhadap 7 ekor ikan. Data yang diperoleh diolah dengan minitab 16 yang dilanjutkan dengan uji Tukey.
yang mengandung PMSG, maupun kombinasi antar PMSG dan Antidopamin, yaitu : P1A0, P2A0, P1A1, dan P2A1. Fakta ini diperlihatkan dari naiknya laju pertumbuhan spesifik, hormon estradiol - 17β, nilai hepatosomatik indeks, nilai gonadosomatik indeks, gambaran histology gonad dan pertumbuhan diameter telur, serta presentase induk matang gonad.
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa kombinasi dosis terbaik yang memacu proses rematurasi induk
Pangasianodon hypophthalmus adalah, P1A1 (PMSG 10 IU/ kg bobot ikan +AD 0,01 mg/ kg bobot ikan).
SUMMARY
BOEDI RACHMAN. Hormonal rematuration at the gonad of Pangasianodon hypopthalmus Under direction of AGUS OMAN SUDRAJAT and NUR BAMBANG PRIYO UTOMO.
Pangasianodon hypophthalmus or stripped catfish is a potential freshwater aquaculture fish commodity as filet because has the good taste, soft texture, and contain good nutrition. Food and Agriculture Organization reported at the end of June 2011 the amount of stripped catfish filet absorbed by the importing countries recorded are, United States approximately 92,000 tonnes, Europe 188, 100 tonnes, India 1,500 tons and Philippines 7,200 tons. This opportunity not be utilized by Indonesian exporters because until the end of 2010 the production of stripped catfish filet is still low, around 104, 975 tonnes. Exploring the cause of low production stripped catfish filet it is not maximal of growing up because the limited availability of seeds for growing. This happen cause maturation of gonad and spawning from stripped catfish parents only in rainy season.
This research was carried out to determine the role between PMSG and Antidopamin used as a combination in gonads rematuration of Pangasianodon hypophthalmus. The lasted for 60 days, sampling was done every 14 days involve : (1) specific growth rate, by weighing each individual in all treatments, (2) analysis of the hormone estradiol - 17 β, by observing the blood plasma using the ELISA method, (3) blood glucose levels by observing the blood plasma method (4) hepatosomatic index, by weighing using digital scales 2 digits (5) gonadosomatic index, by weighing using digital scales 2 digits (6) histology of the gonads, making histological preparations method (7) egg diameter with observation and photography using a binocular Olympus mikroskup type SZX16 100 times magnification lens (8) percentage of gonads fish mature, by cannulation using a catheter on day 28 and 42, and (9). Water quality observed every 7 days.
This research uses a factorial design consist 3 PMSG dose level and 2 AD dose level. Doses formulation that is composed as follows : 1.P1A0 (PMSG 10 IU / kg fish + AD 0 mg / kg fish),2.P2A0 (PMSG 20 IU / kg fish +AD 0 mg/ kg fish), 3.P0A1 (PMSG 0 IU / kg fish + AD 0.01 mg / kg fish), 4.P1A1 (PMSG 10 IU/ kg fish + AD 0.01 mg/ kg fish), 5. P2A1 (PMSG 20 IU / kg fish + AD 0.01 mg/ kg fish), and 6. P0A0 (Nacl 0,09%) as control. Each combination of dose and control were tested to 7 fishes. Data obtained were processed with Minitab 16. followed by Tukey test.
In this research showed that the test fishhes had significantly gonad development are injected with formulations containing PMSG, or combinations between PMSG and Antidopamin namely: P1A0, P2A0, P1A1, and P2A1. This fact shown from the increase in specific growth rate, hormone estradiol - 17β, hepatosomatik index, gonadosomatik index, gonad development and eggs diameter and percentage of gonads mature.
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang - Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah. dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
MANIPULASI HORMONAL PADA PEMATANGAN GONAD
IKAN PATIN SIAM Pangasianodon hypopthalmus
BOEDI RACHMAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Master Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Manipulasi Hormonal pada Pematangan Gonad Ikan Patin Siam Pangasianodon hypopthalmus
Nama : Boedi Rachman NIM : C151110121
Disetujui oleh
Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Dr Ir Nur Bambang Priyo Utomo, MSi
Diketahui.oleh
Ketua Departemen Budidaya Perairan
Dekan Sekolah Pascasarjana
Dr Ir Sukenda, MSc Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia – Nya sehingga karya ilmiah ini berhasil di selesaikan. Tema yang dipilih dalam penelitian yang dilakukan sejak bulan Pebruari 2013 sampai Maret 2013 ialah hormon reproduksi, dengan judul Manipulasi Hormonal Pada Pematangan Gonad Ikan Patin Siam Pangasianodon hypopthalmus.
Terimakasih yang mendalam penulis ucapkan kepada Bapak Dr Ir Agus Oman Sudrajat, MSc dan Bapak Dr Ir Nur Bambang Priyo Utomo, MSi yang telah membimbing dan mengarahkan hingga selesainya tulisan ini. Di samping itu, penghargaan penulis sampaikan kepada Kepala Balai Besar Pengembangan Budidaya Air Tawar Sukabumi Bapak Ir H Sarifin, MS atas ijin studi yang diberikan beserta staff atas dukungan selama penelitian. Ungkapan terimakasih juga disampaikan kepada Ibu beserta seluruh keluarga atas doa dan dukungan yang telah diberikan.
Semoga karya ilmiah ini bermanfaat bagi perkembangan penelitian dan ilmu pengetahuan.
Bogor, Oktober 2013
DAFTAR ISI
Aspek Biologi Ikan Patin Siam Pangasionodon hypophthalmus 4
Siklus Reproduksi pada Ikan 4
Oogenesis dan Vitellogenesis pada Teleostei 5
Aksi Hormon dalam Perkembangan Gonad 8
Pregnant Mare’s Serum Gonadotropin (PMSG) 11
Dopamin dan Antidopamin 11
Perlunya Protein dan Vitamin E pada Pakan dalam Fase
Vitologenesis 12
Laju pertumbuhan spesifik (specific growth rate) 19
Analisa hormon estradiol - 17β 20
Kadar glukosa darah 22
Hepatosomatik indeks 23
Gonadosomatik indeks 24
Histologi gonad dan perkembangan telur 26
DAFTAR PUSTAKA 31
LAMPIRAN 36
DAFTAR TABEL
1. Komposisi kisaran proksimat dan kadar vitamin E pakan penelitian (%
bobot kering) 15
2. Ragam formulasi dari dosis perlakuan 16
DAFTAR GAMBAR
1. Pangasionodon hypophthalmus 4
2. Siklus reproduksi yang terjadi pada ikan 5
3. Pengaturan hormon pada saat pertumbuhan sel kuning telur (fase
vitelogenesis) 6
4. Pertumbuhan oosit ikan medaka Oryzias latipes pada berbagai tahap 8 5. Naiknya konsentrasi hormon dalam darah hingga batas tertentu yang
menyebabkan bertambahnya kematangan telur ikan 9 6. Pengaturan hormon pada saat pematangan oosit dalam tubuh ikan 10 7. Mekanisme kerja Dopamin (DA), yang mampu sebagai pendukung
dan penghambat kerja hipotalamus dalam mensintesa dan
melepaskan hormon – hormon gonadotropin pada proses pematangan
gonad 12
8. Alur rematurasi gonad pada induk ikan melalui penyuntikan hormon
PMSG dan Antidopamin 14
9. Laju pertumbuhan spesifik (% / hari) ikan uji pada masing – masing
formulasi dosis selama 42 hari penelitian. 19
10. Fluktuasi hormon estradiol - 17 β dalam plasma darah ikan uji pada
masing – masing formulasi selama penelitian 21 11. Fluktuasi glukosa dalam plasma darah ikan uji pada masing –
masing formulasi dosis selama penelitian. 22
12. Nilai Hsi ikan uji pada masing – masing formulasi dosis selama
penelitian. 24
13. Nilai Gsi ikan uji pada masing – masing formulasi dosis selama
penelitian. 25
14. Fase dan perubahan oosit pada tiap - tiap sampling selama 42 hari
masa penelitian 28
15.. Kondisi ovari ikan uji pada masing–masing formulasi dosis setelah
42 hari perlakuan 30
DAFTAR LAMPIRAN
1. Prosedur pengukuran ELISA 36
3. Prosedur pembuatan histology gonad 38 4. Analisa ragam formulasi dosis kombinasi antara Pregnant Mare’s
Serum Gonadotropin dan Antidopamin terhadap laju pertumbuhan
spesifik Pangasianodon hypopthalmus selama 42 hari masa penelitian 39 5. Analisa ragam formulasi dosis kombinasi antara ulangan (kelompok),
Pregnant Mare’s Serum Gonadotropin dan Antidopamin terhadap konsentrasi hormone estradiol - 17β Pangasianodon hypopthalmus
selama 42 hari masa penelitian 40
6. Analisa ragam formulasi dosis kombinasi antara Pregnant Mare’s Serum Gonadotropin dan Antidopamin terhadap kadar glukosa plasma darah Pangasianodon hypopthalmus selama 42 hari masa
penelitian 41
7. Analisa ragam formulasi dosis kombinasi antara Pregnant Mare’s Serum Gonadotropin dan Antidopamin terhadap Hepatosomatik
indeks Pangasianodon hypopthalmus selama 42 hari masa penelitian 42 8. Analisa ragam formulasi dosis kombinasi antara Pregnant Mare’s
Serum Gonadotropin dan Antidopamin terhadap Gonadosomatik
indeks Pangasianodon hypopthalmus selama 42 hari masa penelitian 43
9. Data fluktuasi konsentrasi hormon ikan uji pada masing – masing
formulasi dosis selama 42 hari masa penelitian 44 10. Persentase (%) jumlah induk matang gonad yang disesuaikan Tingkatka
Kematangan Gonadnya (TKG) pada sampling hari ke – 28 dan ke – 42. 45 11. Data pengukuran parameter kualitas air pemeliharaan ikan uji selama
1
1 PENDAHULUAN
Latar Belakang
Pangasianodon hypophthalmus atau yang biasa disebut patin siam merupakan nama ilmiah dari spesies ikan air tawar bersungut yang berasal dari perairan umum di wilayah Vietnam, Kamboja dan Thailand. Daging patin dalam bentuk filet sangat digemari dan laku dipasar lokal maupun internasional karena mempunyai rasa yang enak, dengan tekstur lembut, serta mengandung nutrisi yang baik dengan total lemak : 6%, dan protein : 19, 21% Faktor lain yang menyebabkan komoditas ini laku adalah secara ekonomi harganya terjangkau (Food and Agriculture Organization 2011).
Vietnam Association of Seafood Exporters and Producers (VASEP) melaporkan bahwa, hingga bulan Juni 2012 eksport filet beku patinyangterserap ke pasaran Amerika Serikat sebesar 92.000 ton, Eropa 188.100 ton, India 1.500 ton dan Filipina 7.200 ton (Food and Agriculture Organization 2011). Peluang pasar ini tidak dapat diambil oleh exportir Indonesia karena hingga tahun 2010 produksi filet patinIndonesia masih cukup rendah yaitu sekitar 104.975 ton (Dir. Jend PPHP 2011). Salah satu faktor yang kurang mendukung tersedianya jumlah filet patin yang cukup bagi pasokan ekspor setiap saat pada taraf pembudidaya diantaranya, tidak selalu dilakukannya usaha pembesaran sepanjang tahun karena terbatasnya ketersediaan benih. Laporan Direktorat Perbenihan Kementerian Kelautan dan Perikanan tahun 2011 memperlihatkan bahwa target produksi benih patin yang diperuntukan untuk produksi daging sebesar 383.000 ton adalah sekitar 478.000.000 ekor, namun pada tahun yang sama hanya terealisasi sekitar 164.491.250 ekor (Kementrian Kelautan dan Perikanan 2011).
Kekurangan benih dirasakan masih cukup besar apabila disertakan pula pembesaran bagi penyediaan filet untuk ekspor. Kondisi ini perlu dipikirkan mengingat benih bermutu harus tersedia dalam jumlah besar dan ada secara terus menerus sepanjang tahun.
Hingga saat ini masalah yang di temui dalam pembenihan ikan patin adalah rendahnya frekuensi pemijahan, karena secara alami waktu yang dibutuhkan untuk pematangan gonad sekitar 6 bulan, dengan masa pemijahan pada musim penghujan saja (Sularto 2002). Lamanya masa pematangan gonad inilah yang menyebabkan rendah dan tidak stabilnya produksi benih sepanjang tahun.
2
Rekayasa aplikasi hormonal yang dapat dilakukan adalah penyuntikan
Pregnant Mare Serum’s Gonadotropin (PMSG) dan Antidopamin. Pengaruh penyuntikan PMSG akan menambah konsentrasi Folicle Stimulating Hormone
(FSH) dalam darah yang mampu mengaktifasi gonad untuk mensintesis estradiol - 17 β. Hormon estrogen, terutama estradiol - 17 β inilah yang mempengaruhi sintesis vitelogenin, serta mendukung hingga fase maturasi (Donaldson et al.
1983). Sementara penyuntikan Antidopamin akan dapat membuka blok dopamin pada hipotalamus agar dapat mensekresikan hormon – hormon gonadotropin. Antidopamin juga dapat mengaktifkan reseptor antagonis, sehingga memperlancar aliran neurotransmitter ke hipotalamus.
Walaupun PMSG dapat mengaktifasi gonad untuk mensintesis estradiol - 17 β dan Antidopamin dapat membuka blok dopamin, namun hingga saat ini belum diketahui formulasi kombinasi yang tepat dari PMSG dan Antidopamin yang digunakan untuk pematangan gonad patin, sehingga perlu dilakukan penelitian induksi pematangan gonad menggunakan kombinasi PMSG dan Antidopamin untuk mendapatkan formulasi yang paling tepat.
Penelitian ini menggunakan ikan patin spesies Pangasianodon hypophthalmus sebagai ikan uji karena, mudah dikenai perlakuan baik melalui penyuntikan hormon maupun pada pemberian pakan, dapat dirunut profile hormon dalam darah, secara histologi dapat diamati perkembangan gonadnya serta dapat diketahui Tingkat kematangan Gonad (TKG) melalui kanulasi. Selain itu ikan patin merupakan komoditas ekspor potensial yang mempunyai prospek cerah.
Perumusan Masalah
3
mempercepat kematangan gonad famili Clarias sp menggunakan formulasi kombinasi antara hormon maupun Antidopamin telah menunjukan hasil yang memuaskan, namun hingga saat ini tidak banyak diketahui penelitian pematangan gonad pada Pangasianodon hypophthalmus dengan menggunakan formulasi kombinasi antara hormon dan Antidopamin.
Secara khusus faktor yang teridentifikasi sebagai penyebab lambatnya kematangan gonad Pangasianodon hypophthalmus, adalah berkurangnya kadar FSH dalam darah serta lemahnya aliran neurotransmitter ke hipotalamus akibat terhambat kerja dopamin. Untuk dapat mendukung pematangan gonad, perlu dilakukan terapi hormon dengan formulasi secara kombinasi dan penggunaanya tetap memperhatikan keselarasan kerja dari hormon tersebut didalam tubuh terhadap perkembangan gonad. Formulasi hormon dan Antidopamin yang dapat digunakan secara bersama dalam mendukung pematangan gonad diantaranya adalah PMSG yang mengandung unsur FSH dan Antidopamin.
Permasalahan yang dihadapi dalam pematangan gonad Pangasianodon hypophthalmus adalah sebagai berikut:
1. Belum diketahui secara tepat hubungan antara PMSG dan Antidopamin dalam proses pematangan gonad ikan Pangasianodon hypophthalmus.
2. Perlu pengkajian formulasi kombinasi yang tepat antara PMSG dan Antidopamin dalam mendukung pematangan gonad ikan
Pangasianodon hypophthalmus.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mengevaluasi peran antara PMSG dan Antidopamin yang digunakan secara kombinasi dalam mematangkan gonad ikan
Pangasianodon hypophthalmus. Hasil penelitian diharapkan dapat memberi informasi mengenai perkembangan dan pematangan telur, profile fluktuasi hormon dalam darah serta kombinasi dosis yang tepat dalam pematangan gonad.
Hipotesis
Mengacu pada identifikasi masalah, perumusan masalah, tujuan dan manfaat penelitian maka diajukan hipotesis sebagai berikut :
H0 : Penyuntikan kombinasi dosis hormon PMSG dan Antidopamin
tidak berpengaruh terhadap proses pematangan gonad
Pangasianodon hypophthalmus.
H1 : Penyuntikan kombinasi dosis hormon PMSG dan Antidopamin
4
2 TINJAUAN PUSTAKA
Aspek Biologi Ikan Patin Siam Pangasionodon hypophthalmus
Ikan patin siam, diklasifikasikan kedalam Ordo Ostariophysi, Famili
Pangasidae, Genus Pangasius dengan Species Pangasionodon hypophthalmus
(Rainboth,1996). Patin Siam pertama kali di datangkan dari Bangkok ke Indonesia pada tahun 1972 (Hardjamulia 1975). Habitat dinegara asalnya adalah sungai dan danau (Zalinge et al. 2002).Bentuk tubuh bulat dan semakin memipih pada bagian ekor, posisi mulut cenderung kebawah dan mempunyai 2 pasang sungut, terdapat 6 tulang penyusun pada sirip punggung, dan tulang saring insangnya tumbuh dengan baik. Punggung berwarna abu kehitaman dengan perut berwarna putih (Gambar 1).
Gambar 1 Pangasionodon hypophthalmus (Roberts dan Vidthayanon 1991)
Pangasionodon hypophthalmus termasuk ikan yang lambat dalam memijah, umumnya mulai matang kelamin setelah berusia 3 tahun (Food and Agriculture Organization 2013). Produksi telurnya meningkat secara drastis dari sekitar 30.000 butir untuk ikan berbobot 5 kg menjadi lebih dari 1.000.000 butir untuk bobot 10 kg (Zalinge etal. 2002).
Siklus Reproduksi pada Ikan
5
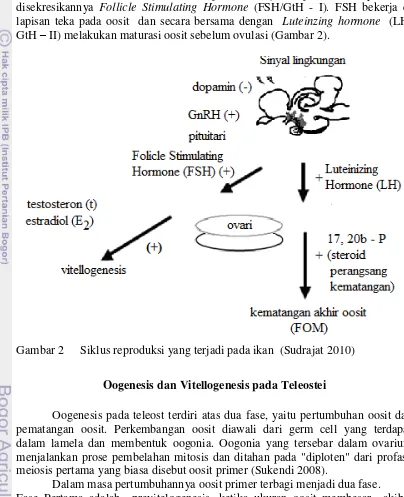
Menurut Bernier et al. (2009), faktor tersebut merupakan sinyal lingkungan yang akan diterima oleh otak dan disampaikan ke syaraf pusat yang selanjutnya diteruskan ke hipotalamus. Hipotalamus akan merespon dengan melepaskan Gonadotropin releasing hormone (GnRH). Chen dan Fernald (2008) menambahkan bahwa, aksi GnRH pada kelenjar hipofisis menyebabkan disekresikannya Follicle Stimulating Hormone (FSH/GtH - I). FSH bekerja di lapisan teka pada oosit dan secara bersama dengan Luteinzing hormone (LH/ GtH – II) melakukan maturasi oosit sebelum ovulasi (Gambar 2).
Gambar 2 Siklus reproduksi yang terjadi pada ikan (Sudrajat 2010)
Oogenesis dan Vitellogenesis pada Teleostei
Oogenesis pada teleost terdiri atas dua fase, yaitu pertumbuhan oosit dan pematangan oosit. Perkembangan oosit diawali dari germ cell yang terdapat dalam lamela dan membentuk oogonia. Oogonia yang tersebar dalam ovarium menjalankan prose pembelahan mitosis dan ditahan pada "diploten" dari profase meiosis pertama yang biasa disebut oosit primer (Sukendi 2008).
6
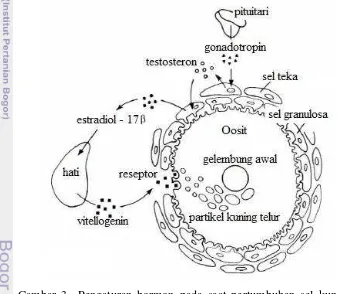
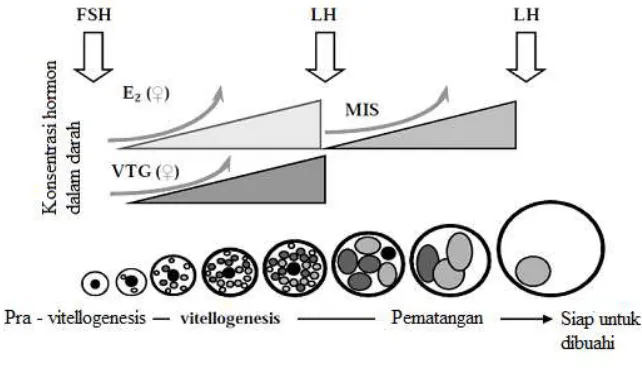
deposisi kuning telur atau vitelogenin (Sukendi 2008). Vitelogenin (vg) disintesis dihati dibawah rangsangan hormon estrogen. Sekresi vitelogenin selanjutnya di didistribusikan melalui aliran darah dalam bentuk persenyawaan dengan Ca 2+ (Yaron dan Silvan 2006). Pada beberapa spesies ikan, rangsangan hormon estrogen (seperti : estradiol - 17β) dapat menyebabkan peningkatan konsentrasi plasma dari vitelogenin. Tang dan Affandi (2000) mengemukakan, viteloginin merupakan komponen utama dari oosit yang sudah tumbuh berupa glikoposfoprotein dan mengandung kira-kira 20% lemak, terutama posfolipid, trigliserida serta kolesterol (Gambar 3).
Fase vitellogenesis merupakan tahap yang penting karena pada prosesnya akan mendukung pertumbuhan oosit hingga 90% mendekati ukuran telur (Sun dan Pankhrust, 2004). Oleh sebab itu faktor – faktor seperti kualitas pakan, lingkungan dan aktifitas hormon sangat besar peranannya dalam menunjang keberhasilan proses tersebut (Fujaya 2004).
Gambar 3 Pengaturan hormon pada saat pertumbuhan sel kuning telur (fase vitelogenesis) Nagahama (1995).
Oogenesis atau proses perkembangan sel telur (oosit), fasenya dapat ditelusuri melalui analisa histology, seperti yang telah dilakukan oleh Santos et al
7
sel – sel germinatif. Terdapat 8 fase perkembangan oosit yang diamati pada betina
O. Hepsetus :
1. Fase I. oogonia
Sel – selnya berbentuk oval dan berukuran kecil (7,5 µm – 10 µm). Pada tahap ini terlihat adanya nucleolus kromatin (cn) dan tahap awal perinukleolus (ep).
2. Fase II. Oosit nucleolus kromatin
Pada fase ini terdapat sedikit sitoplasma, dan posisi inti sudah mulai nampak, Oosit sudah berukuran 20 µm – 30 µm.
3. Fase III. Oosit perinukleous.
Pada fase ini ukurannya sudah bertambah menjadi 38 µm – 48 µm dan sudah mempunyai sitoplasma basofil dan membran sel yang disebut karioteka.
4. Fase IV. tahap akhir Oosit perinukleolus. Oosit berukuran 69 µm – 85 µm.
5. Fase V. Versikel kuning telur.
Oosit berukuran 195 µm – 210 µm, bentuk nucleus tidak beraturan dan posisi nukleoli di zona peripheral, zona radiata atau korion, berada antara oosit dan sel folikel.
6. Fase VI. Vitelogenesis
Oosit berukuran antara 570 µm – 750 µm dan menunjukan adanya deposisi ekstra vesikular kuning telur didalam zona radiate. Nukleus garis tepi yang tidak beraturan dan mengandung beberapa nukleolus periferial. 7. Fase VII. Oosit vitellogenik
Ukuran sel ovari menjadi (850 µm – 1020 µm) dan mempunyai granula protein kuning telur (protein vitellus) dan vesikel kortikal (lipid vitellus).Ukuran vesikel kuning telur bertambah demikian juga dengan granula kuning telur.
8. Fase VIII. Folikel post – ovulatory.
Setelah matang folikel pecah dan oosit dilepaskan.
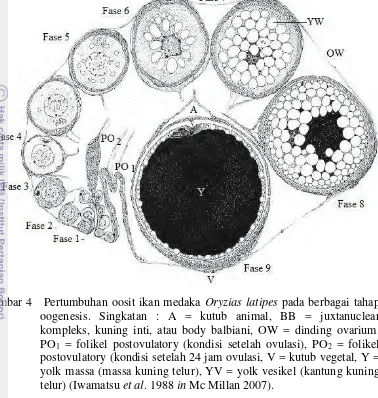
Telur sendiri merupakan hasil akhir proses gametogenesis yang terjadi setelah oosit mengalami pertumbuhan serta kondisinya sangat dipengaruhi oleh cukupnya konsentrasi hormon gonadotropin serta nutrisi dalam tubuh ikan. Gambaran pertumbuhan oosit dalam fase oogenesis ditampilkan dalam Gambar 4 dibawah ini.
8
Gambar 4 Pertumbuhan oosit ikan medaka Oryzias latipes pada berbagai tahap oogenesis. Singkatan : A = kutub animal, BB = juxtanuclear kompleks, kuning inti, atau body balbiani, OW = dinding ovarium. PO1 = folikel postovulatory (kondisi setelah ovulasi), PO2 = folikel
postovulatory (kondisi setelah 24 jam ovulasi, V = kutub vegetal, Y = yolk massa (massa kuning telur), YV = yolk vesikel (kantung kuning telur) (Iwamatsu et al. 1988 in Mc Millan 2007).
Aksi Hormon dalam Perkembangan Gonad
9
berwarna kuning didalam gonad. Pada saat vitelogenesis berlangsung, granula kuning telur bertambah dalam jumlah dan ukurannya, sehingga volume oosit membesar (Yaron dan Silvan 2006). Gambar 5.
Gambar 5 Naiknya konsentrasi hormon dalam darah hingga batas tertentu yang menyebabkan bertambahnya kematangan telur ikan. (sumber : Mananos et al. 2009)
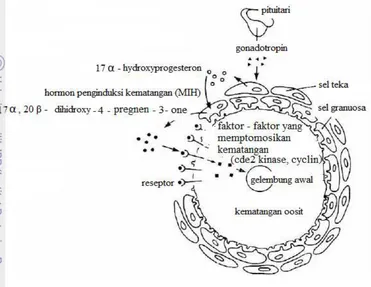
Perkembangan telur pada tahap penyerapan vitelogenin akan berhenti ketika oosit telah mencapai ukuran maksimal. Menurut Nagahama et al. (1995), proses pematangan oosit terjadi karena adanya rangsangan LH pada folikel, yang menyebabkan terjadinya proses sintesa hormon - hormon steroid pada sel teka yang selanjutnya menghasilkan 17α - hidroksiprogesteron dan pada sel granulose menghasilkan 17α , 20β - dihidroksi - 4 - pregnen - 3 - one. Hormon steroid terakhir inilah yang mempunyai peranan sebagai mediator kematangan oosit lebih lanjut. Kondisi yang terjadi dengan menurunnya produksi estradiol - 17 β dan aktivitas aromatase, biasanya diikuti peningkatan testosterone, dan 17 α,20 β - dihidroksi - 4 - pregnen - 3 - one (17α, 20β - DP) sehingga oosit mengalami GVBD (germinal vesicle break down) yang berakhir pada ovulasi.(Gambar 6).
10
diatas 1 mm dengan posisi nukleolus sudah tertarik ke pinggir (Food and Agriculture Organization 2013).
Gambar 6 Pengaturan hormon pada saat pematangan oosit dalam tubuh ikan (Nagahama 1995).
Menurut Nikolsky in Effendie (1979) Tingkat Kematangan Gonad (TKG)
digolongkan menjadi 7 tahap, sebagai berikut :
Tingkat 1 : Gonad masih muda ukurannya sangat kecil.
Tingkat 2 : Tahap istirahat, produk seksual belum berkembang, gonad masih kecil, oosit belum dapat dibedakan dengan mata biasa. Tingkat 3 : Tahap pemasakan, oosit – oosit dapat dibedakan dengan mata
biasa, pekembanagan gonad sedang berkembang dengan cepat. Tingkat 4 : Tahap matang gonad, gonad mendapat bobot yang maksimal,
oosit belum keluar bila telurnya ditekan.
Tingkat 5 : Tahap reproduksi, oosit keluar bila telur ditekan perlahan. Tingkat 6 : Kondisi salin, oosit sudah dikeluarkan, lubang genital kemerah
– merahan, ovari biasanya berisi beberapa oosit sisa.
11
Pregnant Mare’s Serum Gonadotropin (PMSG)
Pregnant Mare’s Serum Gonadotropin (PMSG) merupakan hormon yang berasal dari serum pada plasenta kuda hamil, yang mengandung glikoprotein dan molekulnya tersusun dari sub unit alfa dan sub unit beta (Maurel et al. 1992). Komposisi PMSG terdiri dari 75% FSH dan 25% LH dan memiliki aktivitas biologi serupa FSH dan LH dimana pengaruh FSH nya lebih besar (Hardjopranjoto 1995). Aksi fisiologis PMSG dalam tubuh selain dapat menyebabkan penekanan produksi LH, juga mempunyai waktu paruh yang panjang sekitar 123 jam (Menzer dan Schams 1979 dalam Supriatna et al. 1998 ), Menurut Bolamba et al. (1992), pada konsentrasi tertentu dalam darah, PMSG akan mampu mengaktifasi proses – proses pada FSH dan LH sehingga dapat merangsang kenaikan produksi GnRH dan hal ini akan mempengaruhi kelenjar pituitary untuk memproduksi gonadotropin. Dijelaskan lebih lanjut oleh Menzer dan Schams (1979) dalam Supriatna et al. (1998 ), bahwa terjadinya kenaikan kadar gonadotropin dalam darah akan mampu merangsang pertumbuhan sel interestial ovarium dan pemasakan folikel yang mempengaruhi pertambahan diameter dan kematangan telur hingga tahap siap untuk di ovulasikan.
Dopamin dan Antidopamin
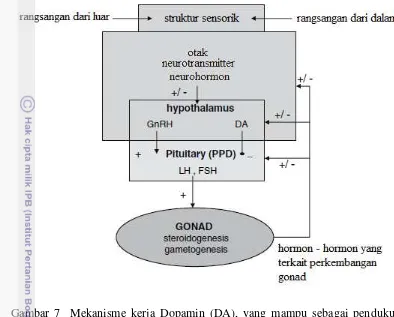
Pada ikan, dopamin diproduksi di beberapa daerah otak termasuk nigra substantia dan tegmental ventral. Sebagai neurotransmitter posisi dopamin banyak terdapat dalam saraf pusat dan bertindak sebagai aktifator modulasi
neuronal yang mampu mengatur beberapa fungsi fisiologis tubuh seperti pematangan gonad (Callier et al. 2003), dijelaskan lebih lanjut bahwa modulasi akan berlangsung jika terjadi rangsangan sensorik pada retina atau organ penciuman sehingga hipotalamus mengatur perilaku seksual dan kelenjar hipofisis akan mengatur pelepasan prolaktin. Menurut Mylonas dan Zohar (2001), di luar musim pemijahan dopamin akan menghambat neurotransmitter saat melakukan instruksi kepada hipotalamus dalam mensekresi gonadotropin pada proses pematangan gonad.
Djelaskan oleh Vidal et al. (2004). Salah satu upaya yang dapat dilakukan dalam pematangan gonad agar kerja fisiologis kelenjar hipotalamus dalam menghasilkan gonadotropin endogen (Gth) tetap berlangsung tanpa dipengaruhi oleh rangsangan sensorik, adalah dengan pemberian antidopamin, ditambahkan bahwa pengaruh antidopamin akan mengakibatkan terjadinya pelepasan
12
Gambar 7 Mekanisme kerja Dopamin (DA), yang mampu sebagai pendukung dan penghambat kerja hipotalamus dalam mensintesa dan melepaskan hormon – hormon gonadotropin pada proses pematangan gonad (Vidal et al. 2004).
Perlunya Protein dan Vitamin E pada Pakan dalam Fase Vitologenesis
Dalam tubuh ikan, kandungan asam amino dari protein dibutuhkan untuk pertumbuhan, pemeliharaan jaringan, pembentukan enzim dan beberapa hormon serta sumber energi. Protein, merupakan komponen utama pembentuk kuning telur (Kamler 1992). Pada fase vitelogenesis, estradiol akan menstimulus hati untuk mensintesa komponen protein (sejumlah asam amino) sebagai pengikat vitamin yang diserap oosit agar embrio yang terbentuk pada tahap – tahap awal lebih tahan terhadap serangan bakteri dalam tubuh induk (Sukendi 2008). Dijelaskan lebih lanjut oleh Izquierdo et al. (2001), pengaruh keseimbangan asam amino dalam pakan akan dapat memperbaiki proses sintesa vitelogenin, sehingga mampu menyempurnakan pembentukan embrio.
13
Pangasius hypophthalmus yang diberi pakan dengan kisaran protein antara 34% – 37,5% memberikan rata – rata diameter telur lebih besar, jumlah telur lebih banyak dan kelulus hidupan larva lebih tinggi.
Halver (1989) menjelaskan bahwa, vitamin E adalah zat antioksidan yang mampu mencegah oksidasi lemak. Lemak sendiri merupakan salah satu penyusun terbesar fosfolipid yang ditimbun sitoplasma dan kutub animal telur. Pada fase vitelogenesis, folikel yang sedang tumbuh akan mensintesa dan mengeksekresikan hormon – hormon steroid didalam darah dan salah satu target hormon steroid adalah estrtradiol – 17 β yang mensintesa dan mengangkut viteloginin ke gonad. Keterkaitan vitamin E dengan vitelogenin dalam perkembangan oosit adalah, sebagai antioksidan asam lemak essensial agar sintesa prostaglandin tetap terjaga (Djojosoebagio 1996), sehingga oosit akan tetap tumbuh. Pada penelitian Yulfiperius (2001) memperlihatkan bahwa, dosis vitamin E yang optimal bagi pematangan gonad Pangasius hypophthalmus adalah sekitar 190,65 mg / kg pakan.
Kombinasi Pregnant Mare’s Serum Gonadotropin (PMSG) dan Antidopamin dalam Mempercepat Kematangan Gonad Kembali (Rematurasi)
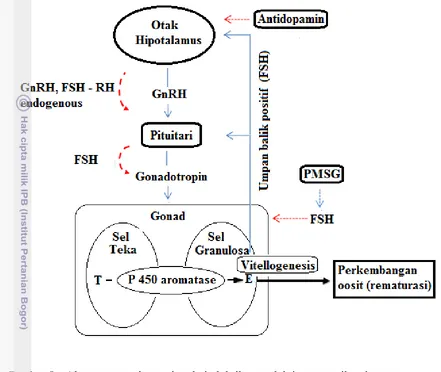
Percepatan pematangan gonad kembali atau rematurasi sebenarnya merupakan rekayasa penyuntikan hormon dengan menggunakan variasi dosis kombinasi yang berbeda antara PMSG dan Antidopamin sehingga dapat meningkatkan konsentrasi FSH dan LH serta Antidopamin didalam tubuh ikan, serta mendorong kerja fisiologi yang berporos pada hipotalamus dan pituitari dalam mendukung pematangan gonad.
Pengaruh penyuntikan PMSG pada dosis tertentu selain akan menaikan kadar FSH juga memicu vitologenesis yang berlangsung dalam organ gonad dan hati, serta merangsang pituitari mendorong hipotalamus untuk melepaskan GnRH dan FSH – RH. Sehingga, akibat sekresi FSH dari pituitari dan penyuntikan PMSG akan menaikan konsentrasi FSH darah dan memicu dalam mempercepat kematangan gonad.
14
Gambar 8 Alur rematurasi gonad pada induk ikan melalui penyuntikan hormon PMSG dan Antidopamin ( Sudrajat 2010).
15
3 METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan Pebruari sampai Maret 2013, di areal perkolaman Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi. Histologi gonad, analisa hormon estradiol - 17 β dan glukosa darah dilakukan di Laboratorium Histopatology dan Fisologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Prosedur Penelitian Wadah
Hapa pemeliharaan berukuran 6 m x 3 m x 1,5 m. Ditempatkan pada kolam yang dilengkapi dengan saluran pemasukan air (inlet) dan saluran pembuangan (outlet). Debit air sekitar 1,5 liter / menit.
Ikan uji
Seluruh ikan uji berjumlah 42 ekor, ditagging dan dipelihara dalam satu hapa dengan kepadatan 3500 gram / m3 volume air . Ikan uji merupakan induk yang berumur 3,5 tahun, dengan kisaran bobot 1200 – 2500 gram / ekor. Kondisi saat dikanulasi tidak diperoleh telur pada gonadnya (TKG - 0). Jumlah ikan setiap perlakuan adalah 7 ekor, setiap sampling 2 ekor ditimbang bobot biomassnya, diamati fluktuasi hormonnya, sementara salah satunya dibedah untuk ditimbang bobot hati dan gonad serta dihistologi.
Pakan
Pakan yang digunakan berupa pelet dengan komposisi untuk pematangan gonad Pangasius hypophthalmus (Yulfiperius2001).
16
Feeding rate selama penelitian sebesar 2,5% dengan frekuensi pemberian sebanyak dua kali per hari yaitu, jam 08.00 dan jam 16.00 . Pakan mulai diberikan 1 hari setelah ikan di tebar.
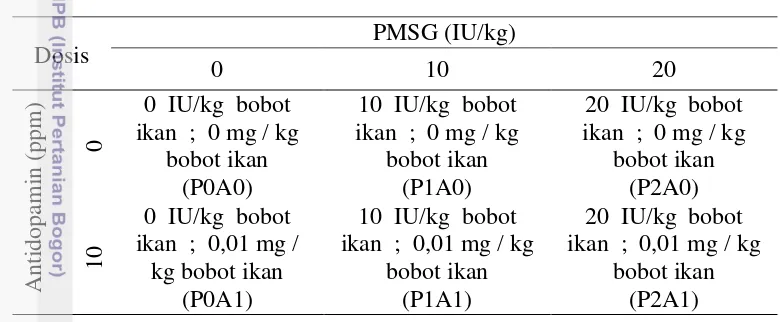
Penentuan dosis dan penyuntikan hormon
Penentuan kisaran dosis PMSG : 10 IU/kg merupakan dosis terbaik bagi pematangan induk Pangasionodon hypophthalmus (Samara 20 10), sedang dosis Antidopamin 0,01 mg / kg mengacu pada kombinasi kisaran terbaik bagi pematangan gonad Clarias gariepinus antara 0,004 – 0,012 mg / kg bobot Clarias gariepinus (Sharaf 2011). Penyuntikan dilakukan secara intramuscullar pada otot punggung. Waktu penelitian selama 60 hari, dengan jadwal penyuntikan pada hari ke – 1, ke – 14, ke – 28 dan ke – 42.
Tabel 2. Ragam formulasi dari dosis perlakuan
Parameter yang Diamati
Laju pertumbuhan spesifik (specific growth rate)
Data pertambahan bobot ikan uji selama penelitian diambil setiap 14 hari diawali hari ke – 1, selanjutnya penimbangan dilakukan bersamaan dengan waktu penyuntikan. Laju pertumbuhan spesifik ikan uji (Lps) dihitung dengan menggunakan rumus dari Dawes et al. (1993) :
Analisa hormon estradiol - 17 β
17
Kadar glukosa darah
Untuk mengetahui kadar glukosa darah ikan uji maka selama penelitian dilakukan pengukuran sebanyak 4 kali, yaitu : pada hari ke – 1, ke – 14, ke – 28 dan ke – 42.Cara pengukuran menggunakan metode dari Wedemeyer dan. Yasutake. ( 1977). lihat (Lampiran 2).
Hepatosomatik indeks (Hsi)
Pengukuran nilai bobot hati atau Hepatosomatik indeks (Hsi) ikan uji dilakukan pada hari ke – 1, ke – 14, ke – 28 dan ke – 42, dengan menggunakan rumus dari (Effendi 1979) : (Lampiran 3).
Gonadosomatik indeks (Gsi)
Pengukuran nilai bobot gonad atau Gonadosomatik indek (Gsi) dari ikan uji selama penelitian dilakukan pada hari ke – 1, ke – 14, ke – 28 dan ke – 42, dengan menggunakan rumus dari (Effendi 1979) :
Histologi gonad
Histologi gonad dilakukan pada hari ke – 1, ke – 14, ke – 28 dan ke – 42, dengan menggunakan metode yang dilakukan oleh Gunarso (1989), ( Lampiran 3).
Diameter telur
Pengamatan dilakukan pada hari ke – 28 dan ke – 42. Telur diambil dengan kanulator nomer 8. Sampel telur diambil sebanyak 100 butir per ekor dan difiksasi dengan formalin bufer fosfat 10%. Diameter telur diukur menggunakan
Keterangan : : Hepatosomatik Indeks
: Bobot hati (g) : Bobot tubuh ikan (g)
Keterangan : GSI : Gonadoosomatik Indeks
Wg : Bobot gonad (g)
18
mikroskup binokuler Olympus type SZX16 perbesaran lensa 100 kali dan sambungan lup nomer 7, hasil pengamatan diarahkan dengan remote Olympus U – RVL – T yang ditampilkan pada monitor komputer menggunakan program software DP 2 BSW. Nilai diameter dicari dengan menarik garis grafis menggunakan mouse antara sisi terpanjang ke sisi terpendek telur. Angka pengamatan yang tampak pada monitor menunjukan nilai diameter telur.
Persentase induk matang gonad
Induk matang gonad ditandai dengan perut yang terlihat membuncit dari sirip dada ke arah gonad, dan bila dikanulasi ke dalam gonadnya akan mengeluarkan telur. Pengamatan induk matang gonad mulai dilakukan sejak hari ke – 28. Persentase induk matang gonad dihitung dengan rumus :
∑ ∑
Keterangan : PIM = Prosentase Induk Matang Gonad
∑IB : Jumlah individu matang gonad pada masing – masing perlakuan
∑TIP : Jumlah total induk pada masing – masing perlakuan
Kualitas air
Parameter kualitas air yang diukur meliputi oksigen terlarut (DO), suhu, amoniak (NH3) dan pH yang diukur setiap minggu.
Rancangan Penelitian
Penelitian ini menggunakan rancangan faktorial (Steel dan Torrie 1991). 2 faktor penyusunya yaitu PMSG yang terdiri atas 3 taraf dosis dan Antidopamin 2 taraf dosis. Sementara target pengambilan data adalah ikan uji yang dipelihara dalam satu hapa.
Data laju pertumbuhan harian (growth rate), kadar estradiol - 17 β, glukosa darah, nilai Hepatosomatik indeks (Hsi), dan nilai Gonadosomatik indeks (Gsi) ditampilkan dalam bentuk grafik agar terlihat fluktuasinya selama penelitian. Sedangkan perkembangan gonad ditampilkan berupa foto histlogi untuk memudahkan fase pembacaan TKG pada oositnya.
Analisa data mengenai pengaruh perlakuan akibat penyuntikan formulasi dosis kombinasi antara PMSG dan Antidopamin, meliputi ; Laju pertumbuhan spesifik (specific growth rate), konsentrasi hormon estradiol -
17 β, kadar glukosa darah, nilai Hepatosomatik indeks (Hsi), dan nilai
19
yang memberikan respon terbaik antara formulasi dosis dilakukan uji lanjut Tukey.
4 HASIL DAN PEMBAHASAN
Laju pertumbuhan spesifik (spesific growth rate)
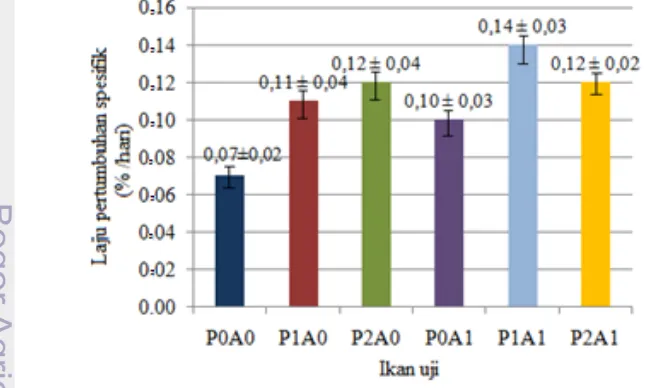
Dari penelitian yang dilakukan dapat diketahui bahwa Laju pertumbuhan spesifik ikan uji tertinggi dicapai pada formulasi dosis P1A1 yaitu sebesar (0,14 ± 0,03 %/hari) kemudian berturut – turut menurun pada P2A1 (0,12 ± 0,02 %/hari), P2A0 (0,12 ± 0,04 %/hari), P0A1 (0,10 ± 0,03 %/hari) dan terendah pada P0A0 (kontrol) (0,07 ± 0,02 %/hari).
Hasil analisa faktorial pada uji statistik terhadap PMSG, Antidopamin maupun interaksi PMSG dan Antidopamin sebagai penyusun formula masing – masing dosis memperlihatkan, baik formulasi dosis yang menggunakan PMSG atau Antidopamin saja, maupun interaksi antara PMSG dan Antidopamin tidak
memberikan pengaruh yang berbeda nyata (P ≥ 0,05) terhadap laju pertumbuhan
spesifik ikan uji. (Lampiran 4).
Dari uji lanjut Tukey memperlihatkan bahwa, formulasi dosis yang menggunakan PMSG 20 IU (P2) tidak berbeda nyata (P ≥ 0,05) dengan 10 IU (P1) maupun formulasi dosis tanpa PMSG (P0) . Demikian juga penggunaan formulasi dosis Antidopamin 0,01 mg/kg bobot tubuh memperlihatkan nilai yang tidak berbeda nyata (P < 0,05) dengan P0A0.(kontrol).
20
Sedangkan perbedaan dosis antar perlakuan yang terkait interaksi dari PMSG dan Antidopamin, tidak menunjukan nilai yang berbeda nyata (P ≥ 0,05) terhadap laju pertumbuhan spesifik ikan uji. Ilustrasi Laju pertumbuhan spesifik ikan uji dapat dilihat pada Gambar 9.
Pertumbuhan gonad pada ikan betina dewasa sangat dipengaruhi oleh sekresi dan konsentrasi hormon gonadotropin yang mengalir dalam tubuh. Hardjopranjoto (1995) mengemukakan, PMSG merupakan gonadotropin yang mengandung FSH sebesar 75% dan LH 25%. Pengaruh penyuntikan PMSG akan menyebabkan meningkatnya FSH dalam tubuh ikan uji, selanjutnya aktifitas FSH, akan menginduksi gonad untuk memproduksi hormon estrogen. Sukendi (2008) menjelaskan bahwa meningkatnya konsentrasi hormon estrogen (estradiol - 17β) didalam darah akan mendorong fase previtelogenesis menuju fase vitelogeenesis sehingga menyebabkan perkembangan gonad. Menurut Effendi (1979) perkembangan gonad hingga stadium matang, bobotnya akan dapat mencapai 10% - 25% dari bobot tubuh ikan. Pengaruh perkembangan gonad inilah yang menyebabkan naiknya laju pertumbuhan spesifik
Analisa hormon estradiol - 17 β
Hasil pengukuran konsentrasi hormon estradiol - 17 β pada plasma darah ikan uji selama penelitian memperlihatkan kenaikan konsentrasi hormon estradiol - 17 β terutama ikan uji yang disuntik dengan formulasi dosis yang mengandung PMSG yaitu : P1A1, P2A1, P2A0, dan P1A0
Konsentrasi tertinggi hormon estradiol - 17 β dicapai ikan uji pada formulasi dosis P1A1 yaitu sebesar (409,74 pg / ml) dan berturut – turut menururn pada formulasi dosis P2A1 (340,93 pg / ml), P2A0 (318,02 pg / ml), P1A0 (201,61 pg / ml), P0A1 (184,97 pg / ml) serta terendah pada P0A0 yaitu (132,51
pg / ml).
Hasil analisa faktorial pada uji statistik terhadap PMSG, Antidopamin maupun interaksi PMSG dan Antidopamin sebagai penyusun formula masing – masing dosis memperlihatkan bahwa, PMSG memberikan pengaruh yang berbeda nyata (P < 0,05) terhadap kenaikan konsentrasi hormon estradiol - 17 β dalam plasma darah ikan uji, namun baik Antidopamin maupun interaksi antara PMSG dan Antidopamin tidak memberikan pengaruh yang berbeda nyata (P ≥ 0,05). (Lampiran 5).
Dari uji lanjut Tukey yang dilakukan untuk masing – masing unsur penyusun formulasi dosis, yaitu : PMSG, Antidopamin, maupun interaksi dari PMSG dan Antidopamin memperlihatkan bahwa, formulasi dosis yang mengandung PMSG 20 IU tidak berbeda nyata (P ≥ 0,05) dengan 10 IU namun berbeda nyata dengan formulasi dosis tanpa PMSG .
21
Demikian pula konsentrasi hormon antar perlakuan dari interaksi PMSG dan Antidopamin, pada formulasi dosis : P1A1 dan P2A1 memperlihatkan nilai yang tidak berbeda nyata (P ≥ 0,05).
Pada Gambar 10 terlihat bahwa, setelah hari ke - 1 kurva konsentrasi hormon estradiol - 17 β dalam plasma darah ikan uji yang disuntik dengan formulasi dosis P1A1, P2A1, P2A0 dan P1A0 cenderung meningkat hingga hari ke - 28.
Gambar 10 Fluktuasi hormon estradiol - 17 β dalam plasma darah ikan uji pada masing – masing formulasi selama penelitian
Peningkatan konsentrasi hormon estradiol - 17 β dalam proses rematurasi ini disebabkan oleh 2 hal, yaitu : 1). FSH endogeneous yang berasal dari sekresi kelenjar pituitari akibat rangsangan GnRH yang release dari otak, yang disebabkan dibukanya blok dopamin oleh Antidopamin, dan 2). FSH yang berasal dari PMSG yang disuntikan tiap 14 hari selama penelitian. Keduanya akan bercampur sehingga meningkatkan konsentrasi FSH dalam plasma darah.
FSH diketahui merupkan hormon gonadotropin sebagai pemicu diproduksinya hormon estradiol - 17 β. Alur mekanismenya sebagaimana dijelaskan oleh Nagahama (1983) bahwa, FSH yang terbawa oleh darah dan masuk ke dalam gonad selanjutnya akan menginduksi lapisan teka untuk memproduksi testosteron, dan secara parakrin testosterone akan masuk ke sel granulosa yang selanjutnya di konversi oleh enzym aromatase menjadi estradiol -
17 β. Menurut Berg et al (2004) keberadaan estradiol - 17 β sangat penting karena
merupakan kontrol estrogenik dari vitelogenin pada reseptor estrogen. Meningkatnya hormon estrogen (estradiol - 17 β), akan mendorong fase previtelogenesis menuju fase vitelogenesis (Sukendi, 2008).
22
adanya PMSG dalam formulasi dosis tersebut sehingga tidak memicu berlangsungnya fase vitelogenesis.
Dari Gambar 10, juga terlihat setelah hari ke 28 kurva konsentrasi hormon estradiol - 17 β dalam plasma darah ikan uji pada formulasi dosis P1A1, P2A1 dan P2A0 mulai menurun jika dibandingkan P1A0, P0A1 maupun P0A0. Hal ini diduga sudah terlewatinya fase vitelogenesis pada ikan uji dalam formulasi dosis tersebut.
Kadar glukosa darah
Hasil pengukuran kadar glukosa pada plasma darah ikan uji selama penelitian memperlihatkan bahwa, fluktuasi konsentrasi kadar glukosa pada plasma darah ikan uji yang disuntik dengan formulasi dosis yang mengandung PMSG, yaitu : P1A1, P2A1, P1A0 dan P2A0 cenderung lebih tinggi terutama pada hari ke - 28, jika dibandingkan dengan ikan uji yang menggunakan Antidopamin saja yaitu P0A1 maupun P0A0.
Hasil analisa faktorial pada uji statistik terhadap PMSG, Antidopamin maupun interaksi PMSG dan Antidopamin sebagai penyusun formula masing – masing dosis memperlihatkan, baik PMSG atau Antidopamin saja, maupun interaksi antara PMSG dan Antidopamin memberikan pengaruh yang tidak
berbeda nyata (P ≥ 0,05) terhadap kenaikan konsenterasi glukosa dalam plasma
darah ikan uji (Lampiran 6).
Gambar 11 Fluktuasi glukosa dalam plasma darah ikan uji pada masing – masing formulasi dosis selama penelitian.
23
yang cenderung datar setelah hari ke – 14 hingga akhir penelitian, dengan konsentrasi yang dicapai sebesar 113,86 mg / dl dan 106,67 mg / dl. Sementara pada ikan uji P0A0 polanya lurus dan cenderung menurun pada pengamatan hari ke – 42 yaitu sebesar 88,72 mg / dl, sedangkan P0A1 cenderung menurun setelah hari ke – 1 dan menaik setelah sampling hari ke – 14 hingga mencapai konsentrasi glukosa dalam plasma darahnya sebesar 88,72 mg / dl pada sampling hari ke – 42.
Menurut Wahyuningsih (2012) glukosa diketahui sebagai sumber energi bagi kehidupan ikan, serta dicerna dalam semua sel sebagai bahan bakar glikolisis yang disimpan dalam hati dan otot sebagai glikogen. Didalam plasma darah fluktuasinya akan sangat dipengaruhi oleh tekanan fisiologis tubuh. Svoboda et al
(2001) mengemukakan bahwa, selama proses perkembangan gonad akan memicu peningkatan konsentrasi glukosa dalam plasma darah ikan seperti yang diperlihatkan ikan Tinca tinca yang meningkat dari 106,85 mg/dl sebelum masa reproduksi, dan menjadi lebih tinggi sebesar 171,53 mg/dl pada masa reproduksi.
Diduga menurunnya konsentrasi glukosa plasma darah ikan uji pada formulasi dosis P1A1 dan P2A1 setelah sampling hari ke – 28 adalah akibat berkurangnya stress dan tekanan fisiologis yang terjadi karena sudah terlewatinya fase vitelogenesis.
Hepatosomatik indeks
Hasil penimbangan bobot hati ikan uji memperlihatkan bahwa, hingga hari ke 28 nilai Hsi tertinggi ikan uji dicapai pada formulasi dosis P1A1 sebesar (0,18) dan menurun dengan nilai yang sama sebesar (0,17) pada formulasi dosis P2A1 dan P2A0. Nilai Hsi secara berturut – turut semakin menurun pada ikan uji dengan formulasi dosis P1A0 sebesar (0,16), P0A1 (0,13) dan terendah pada P0A0 (0,12).
Hasil analisa faktorial pada uji statistik terhadap PMSG, Antidopamin maupun interaksi PMSG dan Antidopamin sebagai penyusun formula masing – masing dosis memperlihatkan bahwa, PMSG memberikan pengaruh yang berbeda nyata (P < 0,05) terhadap kenaikan nilai Hsi, namun baik Antidopamin maupun interaksi antara PMSG dan Antidopamin tidak memberikan pengaruh berbeda nyata (P ≥ 0,05) terhadap kenaikan nilai Hsi. (Lampiran 7).
Pada uji lanjut Tukey memperlihatkan, formulasi dosis yang mengandung PMSG 20 IU mempunyai kemampuan yang tidak berbeda nyata (P ≥ 0,05) dengan 10 IU, namun baik formulasi dosis yang mengandung PMSG 20 IU maupun 10 IU mempunyai kemampuan yang berbeda nyata (P < 0,05), jika dibandingkan formulasi yang tidak mengandung PMSG.
Selanjutnya pada formulasi dosis yang mengandung Antidopamin 0,01 mg / kg bobot ikan memberi pengaruh yang berbeda nyata (P < 0,05) dibanding formulasi dosis tanpa Antidopamin.
24
P1A0 namun berbeda nyata (P < 0,05) dengan P0A1 dan P0A0, sedangkan P2A1 tidak berbeda nyata (P ≥ 0,05) dengan P2A0 dan P1A0 namun berbeda nyata (P < 0,05) dengan P0A1 dan P0A0.
Gambar 12 Nilai Hsi ikan uji pada masing – masing formulasi dosis selama penelitian.
Pada Gambar 12 terlihat bahwa, setelah hari ke – 1 kurva nilai His
cenderung naik terutama pada formulasi dosis P1A1, P2A1, P2A0 dan P1A0 hingga hari ke – 28. Dari nilai Hsi yang terlihat pada Tabel 5, ternyata kecenderungannya sangat terkait dengan kenaikan konsentrasi hormon estradiol -
17 β pada Gambar 10.
Indikasi fase vitelogenesis pada umumnya ditandai dengan naiknya nilai
Hsi ikan. Tang dan Affandi (2000) menjelaskan bahwa, pengaruh induksi hormon estradiol - 17β akan merangsang hati untuk mensintesis dan mensekresi vitelogenin. Ditambahkan oleh Siregar (1999), selama terjadi aktifitas produksi vitelogenin, akan menyebabkan penambahan bobot dan volume hati yang menyebabkan kenaikan nilai Hsi.
Turunnya nilai Hsi pada hari ke- 42 terhadap ikan uji pada formulasi dosis P1A1, P2A1 dan P2A0 diduga karena telah terlewatinya fase vitelogenesis.
Gonadosomatik indeks
Hasil penimbangan bobot gonad ikan uji memperlihatkan bahwa, nilai Gsi
ikan uji tertinggi dicapai oleh formulasi dosis P1A1, yaitu sebesar (0,19), dan berturut – turut menurun pada P2A1 (0,18), P2A0 (0,17), P1A0 (0,14), P0A1 (0,13) dan terendah pada P0A0 (0,12).
25
masing dosis memperlihatkan bahwa, PMSG memberikan pengaruh yang berbeda nyata (P < 0,05) terhadap kenaikan nilai Gsi, namun baik Antidopamin maupun interaksi antara PMSG dan Antidopamin tidak memberikan pengaruh yang berbeda nyata (P ≥ 0,05) terhadap kenaikan nilai Gsi.(Lampiran 8).
Pada uji lanjut Tukey memperlihatkan bahwa, formulasi dosis yang mengandung PMSG 20 IU mempunyai kemampuan yang tidak berbeda nyata (P
≥ 0,05) dengan 10 IU, namun keduanya mempunyai kemampuan yang berbeda
nyata (P < 0,05), dibandingkan formulasi yang tidak menggunakan PMSG . Demikian juga pada formulasi dosis yang mengandung Antidopamin 0,01 mg/ kg bobot ikan, yang tidak memberi pengaruh berbeda nyata (P ≥ 0,05) dengan formulasi dosis tanpa Antidopamin.
Sementara interaksi dari PMSG dan Antidopamin menunjukan bahwa, formulasi dosis P1A1 tidak berbeda nyata (P ≥ 0,05) dengan P2A1, P2A0, dan P1A0 namun berbeda nyata (P < 0,05) dengan P0A1 dan P0A0, sedangkan P2A1 tidak berbeda nyata (P ≥ 0,05) dengan P2A0 dan P1A0 namun berbeda nyata (P < 0,05) dengan P0A1 dan P0A0. Sementara P2A0 dan P1A0 tidak berbeda nyata (P ≥ 0,05) dengan P0A1 dan P0A0.
Gambar 13 Nilai Gsi ikan uji pada masing – masing formulasi dosis selama penelitian.
26
Bertambahnya ukuran oosit secara komulatif pada proses vitelogenesis inilah yang menyebabkan bertambahnya nilai GSI.
Menurunnya nilai Gsi pada hari ke – 42 yang terjadi pada ikan uji formulasi dosis P1A1, P2A1 dan P2A0 setelah hari ke 28 diduga telah terlewatinya puncak vitelogenesis, sehingga aktifitas pertumbuhan oosit berhenti berganti proses pematangan sebelum ovulasi, dan menyebabkan pertumbuhan gonad mulai berkurang.
Histologi gonad dan perkembangan telur
Dari hasil histologi gonad dan perkembangan telur ikan uji, terlihat mulai terjadi perbedaan gambaran histology gonad pada masing – masing ikan uji setelah hari ke – 14, ini dapat dilihat pada Gambar 14. Sementara uraian perkembangan setiap sampling dijelaskan dibawah ini :
Hari ke – 1, kondisi oosit pada gonad masih dalam fase 1 (oogonia). Sel – selnya berbentuk oval dan berukuran kecil. Pada tahap ini terlihat adanya nucleolus kromatin (cn) dan tahap awal perinukleolus (ep).
Hari ke – 14, pada ikan uji dengan formulasi dosis;
a. P0A0 dan P0A1; kondisi oosit pada fase II (kromatinn nucleolus), yang hanya terdapat sedikit sitoplasma dan posisi inti sudah mulai nampak. b. P1A0, kondisi oosit pada fase IV (perinukleous akhir), yang ditandai ditandai ukuran oosit lebih besar jika dibandingkan dengan fase versikel kuning telur awal, bentuk nucleus tidak beraturan dan posisi nukleoli di zona peripheral, zona radiata atau korion, berada antara oosit dan sel folikel.
d. P2A1, oosit masuk fase VI (vitelogenesis awal), yang ditandai adanya deposisi ekstra vesikular kuning telur didalam zona radiata. Garis tepi nukleus tidak beraturan dan mengandung beberapa nukleolus periferial. e. P1A1, oosit telah memasuki fase VI (vitelogenesis akhir), yang ditandai
dengan semakin besarnya ukuran oosit serta semakin banyaknya deposisi ekstra vesikular kuning telur didalam zona radiata.
27
Hari ke – 42, pada ikan uji P0A0, hanya terjadi perbesaran diameter oosit (fase perinukleolar), sedangkan P0A1 telah memasuki fase III (formasi kortikal alveoli). (Mc. Millan 2007)
Pada penelitian ini terlihat bahwa, hingga hari ke – 42 perkembangan oosit ikan uji yang disuntik tanpa PMSG yaitu ; P0A0 hanya baru memasuki fase II (perinukleolar) sementara P0A1 memasuki fase III (formasi kortikal alveoli), sedangkan pada ikan uji yang disuntik dengan formulasi dosis yang mengandung PMSG pada sampling hari ke - 14, untuk P1A0 dan P2A0 mencapai fase V (versikel kuning telur awal) serta P1A1 dan P2A1 telah mencapai fase 6 (vitelogenesis).
Diduga berkembangnya oosit pada formulasi dosis P1A0, P2A0, P1A1 dan P2A1 terjadi akibat kerja FSH yang terkandung dalam PMSG yang disuntikan setiap 14 hari selama penelitian.
1
Gambar 14. Fase dan perubahan oosit pada tiap - tiap sampling selama 42 hari masa penelitian
Keterangan : P0A0, P1A0, P2A0, P0A1, P1A1 dan P2A1 adalah formulasi dosis uji.
28
29
Diameter telur
Hasil pembedahan dan pengamatan diameter telur pada hari ke - 28 dan ke – 42 memperlihatkan penambahan ukuran diameter telur yang terjadi hanya pada ikan uji yang disuntik dengan formulasi dosis yang mengandung PMSG saja, yaitu : P1A0, P2A0, P1A1 dan P2A1. (Lampiran 10).
Diameter terbesar telur ikan uji dicapai pada formulasi dosis P1A1 yaitu (0,89 ± 0,11 mm) dan secara beruntun ukurannya semakin berkurang pada P2A1 (0,83 ± 0,07 mm), P2A0 (0,79 ± 0,13 mm) hingga ukuran terkecil pada P1A0 (0,63 ± 0,14 mm).
Terlihat pula bahwa, ternyata kenaikan diameter telur ikan uji polanya seiring dengan kenaikan konsenterasi hormon estradiol - 17 β hingga hari ke – 28 (Gambar 10), setelah itu konsentrasi hormon pada plasma darah ikan uji menurun sedangkan diameter telur ikan uji terus bertambah dan fasenya berganti pematangan yang menuju persiapan untuk ovulasi.
Persentase induk matang gonad
Dari hasil kanulasi dan pembedahan setiap sampling terhadap ikan uji pada masing – masing formulasi dosis, ternyata gonad ikan uji mulai berisi telur setelah hari ke – 28, dan diameternya bertambah besar pada sampling hari ke – 42 (Lampiran 10). Sementara kondisi ovari ikan uji dapat dilihat pada Gambar 15.
Terlihat setelah hari ke – 28, rata – rata ikan uji yang disuntik dengan formulasi dosis P1A0, P2A0 dan P2A1 telah memasuki TKG 6 dengan presentase secara berurutan 20%, 40% dan 60%, sementara sebagian besar populasi ikan uji pada formulasi dosis P1A1 telah memasuki TKG 7*.
Sedangkan pada hari ke - 42 terlihat rata – rata ikan uji pada formulasi dosis P1A0 telah memasuki TKG 6, P2A0 TKG 7*, P1A1 masuk TKG 7** dan P2A1 masuk TKG 7* dengan presentase induk yang matang secara berurutan ; 75%, 75%, 100% dan 100%.
30
Gambar 15. Kondisi ovari ikan uji pada masing–masing formulasi dosis setelah 42 hari masa penelitian.
30
31
Kualitas Air
Data kisaran kualitas air yang diperoleh selama penelitian adalah sebagai berikut : suhu 24,50C – 25,50C, pH 5,62 – 6,58, Oksigen terlarut 1,13 ppm – 1,96 ppm dan Amonia (NH3) 1,12 ppm – 1,86 ppm, data lengkapnya dapat dilihat pada
Lampiran 11.
Pada penelitian ini dengan tidak adanya kematian dan tetap berlangsungnya pertumbuhan gonad ikan uji khusunya pada formulasi dosis yang mengandung PMSG yaitu : P1A0, P2A0, P1A1 dan P2A1 memperlihatkan bahwa kisaran nilai parameter kualitas air yang diukur kondisinya masih mampu mendukung sebagai media pemeliharaan ikan uji. Menurut Food and Agriculture Organization (2013) induk – induk Pangasionodon hypophthalmus mampu hidup pada media yang terpolusi dengan nilai (chemical oxygen demand = 25), dan kandungan oksigen terlarut antara 0,05 - 0,10 mg/ liter, hal ini karena
Pangasionodon hypophthalmus mampu mengambil udara secara fakultatif.
5 KESIMPULAN DAN SARAN
Kesimpulan
Ikan patin siam pasca memijah dapat diinduksi rematurasi dengan menggunakan kombinasi hormon PMSG 10 IU/ kg boboti ikan + AD 0,01 mg / bobot ikan dalam waktu 42 hari.
Saran
Rematurasi induk ikan patin siam dengan kombinasi hormon PMSG 10 IU / kg bobot ikan + AD 0,01 mg / bobot ikan, dapat dilakukan setelah dipijahkan, melalui penyuntikan sebanyak 3 kali dengan dosis 0,5 ml / kilogram bobot ikan.
DAFTAR PUSTAKA
Balai Pengembangan Budidaya Air Tawar Subang. 2009. Laporan Tahunan. Subang. 12 hal.
Berg H, Modig C, Olsson PE. 2004. 17 beta - estradiol induced vitellogenesis is inhibited by cortisol at the post-transcriptional level in Arctic char (Salvelinus alpinus). Reproductive Biology and Endocrinology, 2: 62. Bernier NJ, Kraak GV, Farrel, Brauner CJ. 2009. Fish neuroendocrinology.in :
fish physilogy Vol 28. by : Farrel AP and Brauner CJ. first edition. academic press. London. 537 p.
32
Callier S, Marina S, Stephanie LC, Delphine P, Jean DV and Philippe V. 2003. Evolution and cell biology of dopamine receptors in vertebrates. review, biology of the cell. Institut of neurobiology Alfred Fessand CNRS. Gif – sur – Yvelle, France.
Chen C C and Fernald D. 2008.GnRH and GnRH receptors: distribution, function and evolution. Journal of fish biology. 73, 1099 – 1120.
Crime LW and Evans DM. 1983. Influence of testosterone and / or luteinzing hormone releasing hormone analologue on precocius sexual development in the juvenile trout biology of reproduction. 29: 137 – 142.
Daves C J. Kovach and Ffriedlander M. 1993. Exposure of Gracilaria to various enviromental conditions II. The effect on fatty acid composition. Botanica Marina, 36 : 289 – 296.
Direktorat Jenderal Pengolahan dan Pemasaran Hasil Perikanan.2011.Ikan dan kemandirian pangan. Warta pasar ikan, bulletin edisi April 2011.32 hal Djojosoebagio S. 1996. Fisiologi kelenjar endokrin. UI – Press, Jakarta, 501 hal. Donaldson EM and. Hunter G A. 1983. Induced final maturation, ovulation and
spermation in cultured fish. P : 354 – 390. In W.S. Hoar, D.J. Randall, and E.M. Donaldson (Eds), Fish physiologi, Vol. XB, Academic Press.
Effendie M I. 1979. Biologi perikanan. Penebar Swadaya, Jakarta.
Food and Agriculture Organization. 2011. Market of fish. Globe blogspot market of pangasius.
Food and Agriculture Organization. 2013. Cultured aquatic species information Programme Pangasius hypophthalmus (Sauvage, 1878). United Nations. Fujaya Y. 2004. Fisiologi ikan. Dasar pengembangan tehnik perikanan. Penerbit
Rineka Cipta. Jakarta. 179 hal.
Gunarso W. 1989. Mikroteknik. PAU, Ilmu hayat. Institut Pertanian Bogor. 112 hal.
Halver J E. 1989. Fish nutrition, the vitamins. Academic Press, Inc . California. pp. 32 – 102.
Hardjamulia. A. 1975. Budidaya perikanan. Badan Pendidikan dan Penyuluhan Pertanian. Departemen Pertanian. SUPM Bogor.
Hardjopranjoto S. 1995. Ilmu Kemajiran Pada Ternak. Airlangga University Press, Surabaya.
Izquierdo M S. H. Fernandez-Palacios, A.G.J. Tacon. 2001. Effect of broodstock nutrition on reproductive performance of fish. Aquaculture. 197: 25-42. Jobling M. 1994. Fish bioenergetics. Chapman and Hall, London. 309 pp.
Kamler E. 1992. Early life history of fish, an energetic approach. Chapmann and Hall, London. 181 p.
Kementrian Kelautan dan Perikanan. 2011.Pembenihan patin. Direktorat Budidaya, Jakarta.29 hal.
33
Lieberman E. 1995. A guide to the application of endocrine techniques in aquaculture. Argent Laboratories Press. 40 p.
Ling S W and Pinyonging S. 1966. On the induced spawning of Pla Sawai (Pangasius sutchi). Proc. Indo – Pacific. Coun. 12 (2). P: 244 – 250.
Lubzens E, Young G, Bobe J, Cerdá J. 2010. Oogenesis in teleosts: How fish eggs are formed. General and Comparative Endocrnology, 165: 367-389.
Mananos E, Duncan N. and Mylonas C. 2009. Reproduction and control of ovulation spermiation and spawning in cultured fish. pp 5-81.
Maurel M C, Ban E, Bidart J M, Combarnous Y. 1992: Immunochemical study of equine Chorionic Gonadotropin (eCG/PMSG): Antigenic Determinants on Alpha - and Beta-Subunits, Biochim biophys acta. 1159 (1) : 74 - 80.
Millan Mc DB. 2007. Fish histology female reproductive system. Departemen of Biology, University of Western Ontario, Canada.
Mylonass CC. Zohar Y. 2001. Endocrine regulation and artificial induction of oocyte maturation and spermiation in basses of the genus morone. Aquaculture. 202: 205 – 220.
Nagahama Y. 1983. The functional morphology of teleost gonad. P. 223 – 275. In Hoar WS, Randall D J and Donaldson EM. (Eds), Fish physiologi, Vol. IXA. Academic Press, Inc.
Nagahama Y, Yoshikuni M, Yamashita M, Tokumoto T, Katsu Y. 1995. Regulation of Oocyte Growth and Maturation in Fish. Dev Biol 30 : 103 145.
Pusdatin. 2009. Kelautan dan Perikanan dalam Angka 2009. Kementerian Kelautan dan Perikanan. Jakarta. 154 hlm.
Rainboth W J. 1996. Fishes of the Cambodian Mekong. species identification sheets for fishery purposes. Food and Agriculture Organization, Rome Rottmann R W, Shireman J V and Chapman F A. Hormonal Control of
Reproduction in Fish for Induced Spawning.1991. Southern Regional Aquaculture Center, Institute of Food and Agricultural Services, University of Florida. USA. 3 p.
Roberts T and Vidthayanon C. 1991. Systematic revision of the Asian catfish family Pangasidae with biological observations and descriptions of three new species. In : Proceedings of the Academy of Natural Sciences of Philadelphia 143: 97-144.
Rudiana E, Moeljono E, Handari S. 2000. Pengaruh pregnant mare’s serum gonadotropin (PMSG) dan prostaglandin (PGF2-α) terhadap pematangan
telur dan ovulasi ikan lele dumbo (Clarias gariepinus Burchell). Program Pascasarjana Studi Biologi, Universitas Gadjah Mada, Yogyakarta.
Samara H S. 2010. Rekayasa rematurasi ikan Pati Siam (Pangasionodon hypophthalmus) dengan penyuntikan hormone PMSG dan hCG serta penambahan vitamin mix 300 mg/kg. Skripsi, Fakultas Perikanan dan Ilmu Kelautan, IPB. 25 hal.
Santos I N, Andrade C C, Santos A F, Santos L N and Araujo F G. 2005. Hystological analysis of ovarian development of the characiform
34
Sharaf S M. 2011. Effect of gnrha, pimozide and Ovaprim on ovulation and plasma Sex steroid hormones in African catfish Clarias gariepinus. Journal, Animal Production and Fish Resources Dept, Faculty of Agriculture, Suez Canal University, Egypt.
Siregar M. 1999. Stimulasi pematangan gonad bakal induk betina ikan jambal siam Pangasius hypopthalmus F dengan hormon hCG. Tesis Program Pascasarjana. Institut Pertanian Bogor. 41 hal.
Steel R G D dan Torrie J H. 1991. Prinsip dan prosedur statistika suatu pendekatan biometrik. (Eds) : 2. Gramedia Pustaka Utama, Jakarta.
Sun B and Pankhrust N W. 2004. Patterns of oocyte growth. vitellogenin and gonadal steroids concentration in greenback flounder. Journal of Fish Biology. 64 : 1399 – 1412.
Sudrajat A O. 2010. Diktat kuliah endokrinologi. Fakultas Perikanan dan Ilmu Kelautan, IPB, Bogor.
Sukendi. 2008. Peran biologi reproduksi ikan dalam biotehnologi pembenihan, Pada pidato pengukuhan guru besar tetap bidang biologi reproduksi. Jurusan budidaya perairan, Fakultas perikanan dan Ilmu kelautan, UNRI. Pekanbaru, Riau.
Sularto. 2002. Pengaruh implantasi LHRH dan estradiol - 17β terhadap perkembangan gonad ikan pangasius djambal.Tesis. Program Pascasarjana, IPB. 57 hal.
Supriatna L, Yusuf T L, Purwantara B, Moekti G dan. Hernomoadi LP.1998. Kajian pemberian human Chorionic Gonadotropin (hCG) pada sapi perah yang telah di superovulasi dengan Pregnant Mare Serum Gonadotropin Monocolonal Antibody (PMSG – Mo Ab) Anti – PMSG. Fakultas Kedokteran Hewan, IPB, Media veterriner 1998. 5 (2) : 15 – 20.
Tang U M. dan R Affandi. 2000. Biologi reproduksi ikan. Fakultas Perikanan dan
Ilmu. Kelautan. IPB. Bogor. Bogor. 150 hal.
Vidal V, Catherine P, Nadine L B, Claire H, Holland, Miskal S, Philippe V, Yonathan Z and Sylvie D. 2004. Dopamine inhibits luteinizing hormone synthesis and release in the juvenile european Eel: A neuroendocrine lock for the onset of puberty. Journal, Biology of reproduction 71, 1491–1500 (2004). Center of Marine Biotechnology,5 University of Maryland Biotechnology Institute, Baltimore, Maryland 21202. USA.
Wahyuningsih H. 2012. Induksi buatan pada perkembangan gonad Ikan Tor soro. Desertasi . Program Pascasarjana, IPB. 94 hal.
Wedemeyer G.A. & W.T. Yasutake. 1977. Clinical Methods for the Assesment of the Effects of Environmental Stress on Fish Health. Technical Paper of the US Fish and Wildlife Service. Volume 89. US Departement of the Interior Fish and Wildlife Service, USA Washington DC.
Yaron Z. 1995. Endocrine control of gametogenesis on spawning induction in Carp. Aquaculture I, 29: 49 – 73.