SINTESIS 3-BENZOIL-7-HIDROKSIFLAVON DARI
RESORSINOL
DWI ARTHA SOLOVKY
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis 3-Benzoil-7-hidroksiflavon dari Resorsinol adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2012
ABSTRAK
DWI ARTHA SOLOVKY. Sintesis 3-Benzoil-7-hidroksiflavon dari Resorsinol. Dibimbing oleh BUDI ARIFIN dan SUMINAR SETIATI ACHMADI.
Flavonoid merupakan kelompok senyawa polifenolik terbesar yang ditemukan di alam dengan kerangka karbon C6-C3-C6. Salah satu kelompok flavonoid yang memiliki bioaktivitas yang luas ialah flavon. Dalam penelitian ini, 3-benzoil-7-hidroksiflavon telah berhasil disintesis melalui 2 tahap dari bahan awal resorsinol. Pada tahap pertama, resorsinol diasetilasi dengan AcOH/ZnCl2 menghasilkan resasetofenon dengan rendemen 89%. Benzoilasi serta penataan-ulang resasetofenon dengan 2 ekuivalen benzoil klorida dan 7 ekuivalen K2CO3 dalam aseton selanjutnya menghasilkan senyawa 3-benzoil-7-hidroksiflavon dengan rendemen 62%. Pembentukan 3-benzoil-7-hidroksiflavon dari resorsinol memberikan bukti untuk usulan mekanisme reaksi pembentukan flavon tanpa melalui penataan-ulang Baker-Venkataraman yang telah dinyatakan oleh beberapa peneliti sebelumnya. Semua produk sintesis dalam penelitian ini telah dicirikan secara spektroskopi.
Kata kunci: asetilasi, benzoilasi, flavon, resasetofenon.
ABSTRACT
DWI ARTHA SOLOVKY. Synthesis of 3-Benzoyl-7-hydroxyflavone from Resorcinol. Supervised by BUDI ARIFIN and SUMINAR SETIATI ACHMADI.
Flavonoid is the most abundant naturally-occuring polyphenolic compound with C6-C3-C6 carbon skeleton. Flavones is a group of flavonoid having a broad bioactivity spectrum. In this experiment, 3-benzoyl-7-hydoxyflavone was successfully synthesized via 2-steps from resorcinol. In the first step, resorcinol was acetylated with AcOH/ZnCl2 producing resacetophenone with 89% yield. Subsequently, benzoylation and rearrangement of resacetophenone using 2 equivalent of benzoyl chloride and 7 equivalent of K2CO3 in acetone produced hydroxyflavone with 62% yield. Synthesis of 3-benzoyl-7-hydroxyflavone from resorcinol provided evidence for new reaction mechanism of flavon formation without Baker-Venkataraman rearrangement proposed by several previous researchers. All products in this study has been characterized spectroscopically.
SINTESIS 3-BENZOIL-7-HIDROKSIFLAVON DARI
RESORSINOL
DWI ARTHA SOLOVKY
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis 3-Benzoil-7-hidroksiflavon dari Resorsinol Nama : Dwi Artha Solovky
NIM : G44104024
Disetujui oleh
Budi Arifin, SSi MSi Pembimbing I
Prof Dr Ir Suminar S Achmadi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Puji syukur penulis panjatkan ke hadirat Tuhan YME atas segala berkat dan rahmat-Nya penulis dapat menyusun dan menyelesaikan karya tulis ini. Karya tulis ini disusun berdasarkan kegiatan penelitian dengan judul Sintesis 3-Benzoil-7-hidroksiflavon dari Resorsinol yang dilaksanakan pada bulan April 2012 sampai dengan September 2012 di Laboratorium Kimia Organik, Departemen Kimia FMIPA IPB, Bogor.
Karya tulis ini merupakan sebuah wujud penghargaan untuk Ibu dan Kakak yang telah memberikan motivasi, doa, serta kasih sayang selama menempuh studi, penelitian, dan menyelesaikan karya tulis ini. Penulis juga memberikan apresiasi kepada Budi Arifin, SSi MSi dan Prof Dr Ir Suminar Setiati Achmadi selaku pembimbing yang telah memberikan bimbingan, arahan, dan waktu selama penelitian berlangsung.
Penulis juga mengucapkan terima kasih kepada Bapak Sabur, Lia Anggraini, Dwi Utami, Dumas Flis Tang, semua rekan peneliti di Laboratorium Kimia Organik Kimia FMIPA IPB, dan teman-teman Program S1 Penyelenggaraan Khusus Departemen Kimia angkatan 4 atas diskusi dan kebersamaan selama penulis menempuh studi dan menjalankan penelitian. Semoga karya tulis ini dapat bermanfaat bagi ilmu pengetahuan.
Bogor, Oktober 2012
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Lingkup Penelitian 2
Sintesis Resasetofenon 3
Sintesis p-Benzoil Resasetofenon 3
Sintesis 3-Benzoil-7-hidroksiflavon 3
HASIL 4
Resasetofenon 4
p-Benzoil Resasetofenon 5
3-Benzoil-7-hidroksiflavon 6
PEMBAHASAN 7
Resasetofenon 7
p-Benzoil Resasetofenon 8
3-Benzoil-7-hidroksiflavon 10
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1 Rendemen sintesis resasetofenon 4
2 Rendemen sintesis p-benzoil resasetofenon dan dibenzoil resasetofenon 5
3 Rendemen sintesis 3-benzoil-7-hidroksiflavon 6
4 Analisis sinyal 1H-NMR p-benzoil resasetofenon (pelarut CDCl3) 10 5 Analisis sinyal 1H-NMR 3-benzoil-7-hidroksiflavon (pelarut aseton-d6) 11
6 Dugaan Analisis sinyal 13C-NMR 3-benzoil-7-hidroksiflavon (pelarut CDCl3) 12
DAFTAR GAMBAR
1 Analisis retrosintesis 3-benzoil-7-hidroksiflavon 2 2 Padatan resasetofenon (a); kromatogram lapis tipis endapan resasetofenon hasil sintesis penelitian ini (kiri) dan Aryani (2011) (eluen: MTC) (b) 4 3 Uji kualitatif FeCl3 1% pada kontrol negatif (a) dan resasetofenon (b) 4 4 Padatan p-benzoil resasetofenon (a); kromatogram lapis tipis berturut-turut dari kiri ke kanan, resasetofenon, produk metode Wheeler (1963), Verma et al. (2011), dan Aryani (2011) (eluen: n-heksana-EtOAc 9:1) (b) 5 5 Uji kualitatif FeCl3 1% pada kontrol negatif (a) & p-benzoil resasetofenon (b) 5 6 Padatan 3-benzoil-7-hidroksiflavon (a); kromatogram lapis tipis p-benzoil resasetofenon (kiri) dan produk metode Tang et al. (2005) (kanan) (eluen: n
-heksana-EtOAc 9:1) (b) 6
7 Padatan produk sintesis metode Chee et al. (2011) (a); kromatogram lapis tipis produk metode Chee et al. (2011) (kiri) dan Tang et al. (2005) (kanan) (eluen:
n-heksana-EtOAc 9:1) (b) 7
8 Uji kualitatif FeCl3 1% pada kontrol negatif (a), produk metode Tang et al. (2005) (b), dan produk metode Chee et al. (2011) (c) 7
9 Reaksi asetilasi resorsinol 7
10 Reaksi benzoilasi resasetofenon membentuk p-benzoil resasetofenon (a) dan
dibenzoil resasetofenon (b) 9
11 Reaksi sintesis 3-benzoil-7-hidroksiflavon 11
12 Dugaan mekanisme pembentukan 3-benzoil-7-hidroksiflavon 14
DAFTAR LAMPIRAN
1 Bagan alir penelitian 18
2 Elusidasi struktur resasetofenon 19
3 Elusidasi struktur p-benzoil resasetofenon 20
PENDAHULUAN
Flavon merupakan salah satu jenis flavonoid yang dikenal memiliki beragam aktivitas hayati. Sebagai contoh, krisin memiliki aktivitas inhibitor tirosinase, antiradang, antialergi, antikanker, dan antiestrogenik, serta kuersetin sebagai inhibitor pelepasan histamin (Murthy et al. 2010). Pola substitusi hidroksil flavon yang lazim dijumpai ialah pada karbon nomor 5 dan 7 di cincin A
serta karbon 3’ dan 4’ di cincin B. Beberapa contoh ialah apigenin (4’,5,7
-trihidroksiflavon), luteolin (3’,4’,5,7-tetrahidroksiflavon), krisin
(5,7-dihidroksiflavon), baikalein (5,6,7-trihidroksiflavon), skutelarein (4’,5,6,7 -tetrahidroksiflavon), dan wogonin (5,7-dihidroksi-8-metoksiflavon). Beberapa aktivitas juga telah dilaporkan, antara lain antibakteri, antioksidan, antiradang, antialergi, dan antikanker (Murthy et al. 2010). Oleh sebab itu, upaya sintesis banyak diarahkan pada senyawa 5-hidroksiflavon dan 5,7-dihidroksiflavon sebagai kerangka dasar ke turunan flavon yang lebih kompleks (Tang et al. 2004, Tang et al. 2005, Verma et al. 2011, dan Venkatesh et al. 2012).
Beberapa metode telah digunakan untuk menyintesis flavon, di antaranya sintesis Allan-Robinson, siklisasi oksidatif kalkon, penataan-ulang Baker-Venkataraman (BV), dan reaksi Wittig intramolekul (Sarda et al. 2006). Metode BV paling sering digunakan dalam sintesis flavon antara lain telah dilaporkan oleh Fukui dan Nakayama (1969), McGarry dan Detty (1990), Ares et al. (1993), Zembower dan Zhang (1998), Dekermendjian et al. (1999), Nagendrappa (2004), Sarda et al. (2006), Verma et al. (2011), dan Venkatesh et al. (2012).
Sebelumnya Aryani (2011) telah menyintesis prekursor 1,3-diketon untuk 7-hidroksiflavon dari resorsinol. Sintesis diawali dengan pembentukan senyawa resasetofenon melalui asetilasi resorsinol. Resasetofenon diperoleh dengan rendemen 4457%. Benzoilasi resasetofenon menghasilkan dibenzoil resasetofenon sebesar 4664%. Penataan-ulang BV terhadap dibenzoil resasetofenon menghasilkan -diketon sebesar 12%. Secara keseluruhan, Aryani (2011) memperoleh rendemen -diketon dari bahan awal resorsinol hanya sebesar 4.3%. Sementara itu, penelitian beberapa tahun terakhir telah mengusulkan perbedaan mekanisme sintesis flavon terhidroksilasi bergantung pada dosis pereaksi benzoilasi yang digunakan. Ketika digunakan benzoil klorida berlebih, terbentuk turunan 3-benzoilflavon yang pembentukannya tidak melalui penataan ulang BV (Tang et al. 2005 dan Chee et al. 2011).
2
Gambar 1 Analisis retrosintesis 3-benzoil-7-hidroksiflavon
BAHAN DAN METODE
Bahan dan Alat
Pereaksi menggunakan bahan-bahan untuk analisis (p.a) seperti resorsinol, ZnCl2 98%, asam asetat glasial 99.8%, benzoil klorida, piridina kering (<0.0075% H2O), K2CO3, AlCl3, H2SO4 9597%, metanol, HCl pekat, pelet NaOH, silika gel 60 F254 untuk kromatografi lapis tipis (TLC), dan aseton (Merck®). Semua bahan p.a digunakan langsung tanpa praperlakuan. Pelarut teknis didistilasi 2 kali sebelum dipakai, meliputi metilena klorida (MTC), n-heksana, etil asetat, dan aseton.
Peralatan yang digunakan antara lain pelat pemanas, radas refluks, radas distilasi, radas penentuan titik leleh Mel-Temp Model 1202D Barnstead® (tanpa koreksi), dan alat-alat kaca yang lazim digunakan di laboratorium. Spektrum ultraviolet-tampak (UV-Vis) direkam oleh spektrometer Shimadzu UV-1601 di Laboratorium Bersama, Departemen Kimia IPB. Spektrum resonans magnetik inti (NMR) diperoleh dengan spektrometer JEOL ELCA 500 yang bekerja pada frekuensi 500 MHz (1H) dan 125 MHz (13C) di Pusat Penelitian Kimia LIPI, Puspiptek Serpong.
Lingkup Penelitian
3
proses sintesis flavon diidentifikasi dengan membandingkan nilai Rf, titik leleh,
dan kenampakannya dengan produk sintesis Aryani (2011).
Sintesis Resasetofenon
Resasetofenon disintesis dengan memodifikasi prosedur Cooper et al. (1955). Sebanyak 60 mmol ZnCl2 98% dicampurkan dengan 135 mmol asam asetat glasial dalam labu leher dua. Campuran ini dilarutkan pada penangas minyak dengan suhu 120140 °C. Sebanyak 50 mmol resorsinol ditambahkan ke dalam campuran tersebut lalu suhu dinaikkan hingga 140150 °C. Reaksi dibiarkan berlangsung selama 1 jam dengan suhu dijaga tidak lebih dari 159 °C dan dialiri gas N2. Larutan yang telah berubah warna menjadi merah ditambahkan 25 mL HCl-akuades 1:3 (dingin). Resasetofenon dibiarkan mengendap semalam pada suhu ±5 °C, dibiarkan di suhu ruang kemudian disaring. Filtrat yang masih mengandung resasetofenon diekstraksi dengan MTC dan dipantau dengan TLC. Ekstrak dipekatkan; endapan resasetofenon yang diperoleh digabung dengan endapan sebelumnya.
Sintesis p-Benzoil Resasetofenon
p-Benzoil resasetofenon disintesis dengan 2 metode. Metode pertama mengadaptasi Wheeler (1963). Sebanyak 5 mmol resasetofenon ditambahkan 16.67 mmol piridina kering hingga larut (diaduk dengan batang pengaduk). Kemudian ditambahkan 10 mmol benzoil klorida tetes demi tetes sambil terus diaduk tanpa dialiri gas N2. Saat penambahan, suhu berangsur-angsur naik, warna campuran memucat dan berbentuk seperti mentega. Pengadukan dilakukan selama ±20 menit atau hingga suhu turun. Kemudian ke dalam campuran ditambahkan 24 mL HCl 3% dingin tetes demi tetes. Endapan dibiarkan ±1 jam pada suhu 5 °C hingga menggumpal kemudian disaring dan direkristalisasi dengan 1 mL metanol dingin dan 1 mL akuades dingin. Produk dimurnikan menggunakan kromatografi kolom tekan dengan eluen n-heksana-EtOAc (9:1).
Metode kedua mengadaptasi Verma et al. (2011). Perbedaan dengan metode pertama ialah pada jumlah pelarut dan reaktan yang digunakan. Pada metode ini 5 mmol resasetofenon dilarutkan dalam 12.5 mmol piridina kering dan direaksikan dengan 7.5 mmol benzoil klorida. Pengasaman dilakukan dengan 12 mL HCl 1 M dingin, dan produk direkristalisasi dengan 4 mL metanol dingin dan 4 mL akuades dingin.
Sintesis 3-Benzoil-7-hidroksiflavon
4
memucat. Larutan diaduk kembali selama 30 menit pada suhu kamar selanjutnya direfluks selama 24 jam dengan suhu 4556 °C dengan dialiri gas N2. Filtrat didekantasi untuk memisahkan produk dari basa K2CO3. Produk yang terbentuk dibilas dengan akuades dingin, diasamkan dengan HCl dingin, dan direkristalisasi dengan CH3COOH dingin.
Metode kedua mengadaptasi Chee et al. (2011). Perbedaan dengan metode Tang et al. (2005) ialah 5 mmol resasetofenon dilarutkan dengan 75 mL aseton dan direaksikan dengan 15 mmol benzoil klorida dalam 50 mmol K2CO3 tanpa dialiri gas N2.
HASIL
Resasetofenon
Resasetofenon diperoleh sebagai endapan merah-cokelat dengan Rf ~ 0.16
pada eluen MTC (Gambar 2). Titik leleh 135138 °C, berbeda dengan yang dilaporkan Cooper et al. (1955), yaitu 142144 °C. Rendemen berkisar 8890% (Tabel 1). Uji kualitatif dengan FeCl3 1% menghasilkan warna cokelat kehitaman (Gambar 3). Spektrum UV-Vis (Lampiran 2) menunjukkan 3 puncak serapan di 212, 223, dan 275 nm. Setelah penambahan 3 tetes NaOH, pita I (212 nm) bergeser ke 234 nm, pita II (223 nm) menjadi 253 nm, dan pita III (275 nm) menjadi 330 nm. Penambahan AlCl3 menggeser puncak di 212, 223, dan 275 nm berturut-turut ke 218, 225, dan 297 nm, yang tidak berubah dengan penambahan HCl.
Gambar 2 Padatan resasetofenon (a); kromatogram lapis tipis endapan resasetofenon hasil sintesis penelitian ini (kiri) dan Aryani
(2011) (kanan) (eluen: MTC) (b)
Gambar 3 Uji kualitatif FeCl3 1% pada kontrol negatif (a) dan resasetofenon (b)
Tabel 1 Rendemen sintesis resasetofenon
5
p-Benzoil Resasetofenon
p-Benzoil resasetofenon diperoleh sebagai endapan putih pucat dengan Rf ~
0.4 pada eluen n-heksana-EtOAc 9:1 (Gambar 4). Rendemen p-benzoil resasetofenon yang diperoleh berkisar 5060% untuk metode Wheeler (1963) dan 5375% untuk metode Verma et al. (2011) (Tabel 2) dengan titik leleh 9095 °C. Produk minor dari hasil sintesis kedua metode ini diidentifikasi sebagai dibenzoil resasetofenon berdasarkan kesamaan nilai Rf dengan hasil sintesis Aryani (2011),
yaitu ~0.22 dengan titik leleh 7075 °C. Uji kualitatif dengan FeCl3 1% menghasilkan warna cokelat (Gambar 5). Spektrum UV-Vis (Lampiran 3a) menunjukkan puncak serapan di 201 nm. Penambahan 3 tetes NaOH menggeser puncak tersebut ke 332 nm. Penambahan AlCl3 menggeser puncak ke 270 nm, yang tidak berubah dengan penambahan HCl. Spektrum 1H-NMR (Lampiran 3b) menunjukkan 2 sinyal singlet di 2.64 ppm dan 12.49 ppm, 2 sinyal doblet di 6.87 dan 7.81 ppm, 2 sinyal triplet di 7.52 dan 7.66 ppm, serta 2 sinyal doblet dari doblet di 6.82 dan 8.19 ppm.
Gambar 4 Padatan p-benzoil resasetofenon (a); kromatogram lapis tipis berturut- turut dari kiri ke kanan, resasetofenon, produk metode Wheeler (1963), Verma et al. (2011), dan Aryani (2011) (eluen: n-heksana EtOAc 9:1) (b)
Gambar 5 Uji kualitatif FeCl3 1% pada kontrol negatif (a) dan p-benzoil resasetofenon (b)
Tabel 2 Rendemen sintesis p-benzoil resasetofenon dan dibenzoil resasetofenon
Ulangan
Keterangan: a) resasetofenon terhadap benzoil klorida b) Wheeler (1963) c) Verma et al. (2011) (a) (b)
6
3-Benzoil-7-Hidroksiflavon
Senyawa 3-benzoil-7-hidroksiflavon diperoleh dengan metode Tang et al. (2005) sebagai endapan berwarna cokelat dengan Rf~ 0.43 pada eluen n-
heksana-EtOAc (9:1) (Gambar 6). Rendemennya 6162% (Tabel 3) dengan titik leleh 160 °C, berbeda dengan yang dilaporkan Chee et al. (2011), yaitu 132 °C .
Gambar 6 Padatan 3-benzoil-7-hidroksiflavon (a); kromatogram lapis tipis p- benzoil resasetofenon (kiri) dan produk metode Tang et al. (2005) (kanan) (eluen: n-heksana-EtOAc 9:1) (b)
Tabel 3 Rendemen sintesis 3-benzoil-7-hidroksiflavon
Ulangan Resasetofenon
Spektrum UV-Vis (Lampiran 4a) menunjukkan 2 puncak serapan di 269 dan 365 nm. Setelah penambahan 3 tetes NaOH, puncak II (365 nm) bergeser ke 377 nm. Penambahan AlCl3 juga menggeser puncak di 365 nm ke 377 nm, yang tidak berubah dengan penambahan HCl.
Spektrum 1H-NMR (Lampiran 4b) menunjukkan 3 sinyal doblet di 6.96 dan 6.97 (bertumpang tindih) serta di 8.32 ppm, 4 sinyal triplet di 7.57, 7.62 dan 7.65 (bertumpang tindih) serta 7.76 ppm, dan 2 sinyal doblet dari doblet di 8.14 dan 8.19 ppm. Dua sinyal singlet di 1.28 dan 7.32 ppm diduga berasal dari pengotor. Spektrum 13C-NMR (Lampiran 4c) menunjukkan 2 sinyal karbon-sp2 keton (177.7 dan 195.0 ppm), 14 sinyal karbon-sp2 aromatik (92.5, 111.8, 113.4, 117.1, 127.0, 128.9, 129.0, 129.2, 129.9, 130.5, 132.7, 133.7, 134.1, 156.8, 164.2, dan 164.5 ppm), 2 sinyal karbon-sp2 (117.1 dan 164.2 ppm), 3 sinyal pelarut CDCl3 (76.9, 77.2, dan 77.4 ppm), dan 1 sinyal karbon-sp3 pengotor (29.9 ppm).
Produk sintesis metode Chee et al. (2011) merupakan campuran 3 produk, salah satunya diduga 3-benzoil-7-hidroksiflavon berdasarkan kesamaan nilai Rf
pada eluen tunggal (MTC) dan campuran (n-heksana-EtOAc 9:1) jika dibandingkan dengan produk sintesis metode Tang et al. (2005) (Gambar 7). Ketiga produk tidak diidentifikasi lebih lanjut dikarenakan sulitnya proses pemisahan (noda sangat berekor). Uji kualitatif dengan FeCl3 1% pada produk sintesis metode Tang et al. (2005) dan Chee et al. (2011) masing-masing menghasilkan warna cokelat dan cokelat kehitaman (Gambar 8).
(a) (b)
7
Gambar 7 Padatan produk sintesis metode Chee et al. (2011) (a); kromatogram lapis tipis produk metode Chee et al. (2011) (kiri) dan Tang et al.
(2005) (kanan) (eluen: n-heksana-EtOAc 9:1) (b)
Gambar 8 Uji kualitatif FeCl3 1% pada kontrol negatif (a), produk metode Tang et al. (2005) (b), dan produk metode Chee et al. (2011) (c)
PEMBAHASAN
Resasetofenon
Resasetofenon disintesis dari bahan awal resorsinol dengan asilasi Friedel-Crafts. Asam asetat glasial berperan sebagai penyumbang kation asil dan ZnCl2 sebagai katalis asam Lewis (Gambar 9). Menaikkan suhu pemanasan dari 140 ke 150 °C selama 1 jam memberikan rendemen sekitar 8890%. Hasil ini jauh lebih besar daripada yang dilaporkan oleh Cooper et al. (1955) dan Aryani (2011), yaitu berturut-turut 65% pada suhu 140152 °C dan 57% pada suhu 140150 °C.
Gambar 9 Reaksi asetilasi resorsinol
Produk sintesis sudah menghasilkan 1 noda tunggal pada TLC sehingga tidak perlu direkristalisasi seperti yang dilaporkan dalam prosedur asli. Hal ini yang menyebabkan produk diperoleh dengan rendemen sangat tinggi. Kendali suhu diperkirakan menjadi faktor yang menentukan kemurnian produk resasetofenon. Tingginya suhu mendorong terbentuknya produk resasetofenon dengan rendemen yang lebih tinggi karena reaktivitas reagen asetilasi meningkat pada suhu tinggi sehingga tidak tersisa bahan awal resorsinol.
(a) (b) (c) (a) (b)
8
Analisis spektrum UV-Vis menunjukkan bahwa asetilasi terjadi pada posisi orto terhadap salah satu gugus hidroksil fenolik. Hal ini dikarenakan gugus hidroksil merupakan pengarah orto-para. Substitusi tidak terjadi di posisi orto terhadap kedua hidroksil karena adanya halangan sterik. Gugus asetil dapat membentuk ikatan hidrogen intramolekul yang menstabilkan dengan hidroksil fenolik di posisi orto (Gambar 9). Pergeseran batokromik puncak serapan spektrum UV-Vis dengan penambahan NaOH menunjukkan keberadaan gugus hidroksil fenolik. Basa kuat mendeprotonasi gugus tersebut sehingga meningkatkan delokalisasi elektron ke dalam cincin aromatik. Gugus fenolik tersebut disimpulkan berposisi orto terhadap gugus karbonil berdasarkan pergeseran batokromik dengan penambahan AlCl3 yang tidak kembali ke posisi semula dengan penambahan HCl. Penambahan AlCl3 membentuk kompleks tahan-asam Al3+ dengan gugus hidroksil dan keton yang bersebelahan, maka tidak terurai dengan penambahan HCl (Markham 1988). Penambahan FeCl3 membentuk kompleks warna cokelat kehitaman yang berbeda dengan kontrol negatif FeCl3 yang berwarna kuning. Hal ini menegaskan keberadaan gugus hidroksil fenolik pada resasetofenon.
p-Benzoil Resasetofenon
Senyawa 2’-benzoiloksi-4’-hidroksiasetofenon (o-benzoil resasetofenon) merupakan target awal sintesis dengan metode Wheeler (1963) dan Verma et al. (2011). Produk ini diharapkan terbentuk untuk kemudian dilakukan reaksi penataan-ulang BV membentuk β-diketon. Pembentukan produk ini dengan rendemen 81% dari resasetofenon telah dilaporkan oleh Verma et al. (2011). Dalam penelitian ini, produk yang diperoleh dengan kedua metode tersebut adalah 4’-benzoiloksi-2’-hidroksiasetofenon (p-benzoil resasetofenon) (Gambar 10a) dan bukan isomer orto yang diharapkan. Hal ini dibuktikan dengan analisis spektrum UV-Vis (Lampiran 3a). Masih teramati pergeseran saat penambahan AlCl3 yang menunjukkan bahwa gugus OH yang berposisi orto dengan gugus asetil masih ada dan belum terbenzoilasi. Keberadaan sinyal di 12.49 ppm pada spektrum 1H-NMR (Lampiran 3b) membuktikan lebih lanjut keberadaan gugus ini. Gugus OH fenolik ini juga memberikan hasil positif pada uji kualitatif dengan penambahan FeCl3.
Hasil ini menunjukkan bahwa dengan penambahan pereaksi benzoilasi dalam jumlah yang dibatasi (2 ekuivalen untuk metode pertama dan 1.5 ekuivalen untuk metode kedua), gugus benzoil cenderung memasuki posisi para yang kurang terhalangi. Gugus benzoil lebih sulit masuk pada posisi orto karena adanya ikatan hidrogen intramolekul dengan gugus asetil. Daniel (2008) telah melakukan analisis komputasi dengan metode ab initio dengan himpunan basis 3-21G dan diperoleh bahwa benzoilasi pada posisi orto memiliki energi pengaktifan yang lebih besar dibandingkan dengan posisi para. Begitupun dengan kestabilan secara termodinamika, isomer para akan lebih stabil secara termodinamika sebesar 31.26 kJ/mol dibandingkan dengan isomer orto.
Senyawa 2’,4’-dibenzoiloksiasetofenon (dibenzoil resasetofenon) diperoleh
9
resasetofenon hanya sedikit menurun. Hasil ini menunjukkan bahwa gugus benzoil kedua masuk pada p-benzoil resasetofenon yang terbentuk lebih dulu. Benzoilasi kedua ini agaknya telah mulai terjadi ketika pembentukan p-benzoil resasetofenon dari resorsinol masih berlangsung.
Gambar 10 Reaksi benzoilasi resasetofenon membentuk p-benzoil resasetofenon (a) dan dibenzoil resasetofenon (b)
Dalam penelitian sebelumnya, Paul et al. (2003) dengan bahan awal resasetofenon dan pereaksi benzoil klorida dalam alumina serta dengan menggunakan metode penyinaran mikrogelombang, juga memperoleh bahwa penggunaan 2 ekuivalen benzoil klorida cenderung menghasilkan isomer para sebagai produk utama (59%), sedangkan penggunaan benzoil klorida berlebih akan mengarah pada pembentukan dibenzoil resasetofenon (65%).
p-Benzoil resasetofenon tidak dapat mengalami penataan-ulang BV
membentuk senyawa β-diketon. Dibenzoil resasetofenon dapat mengalami
penataan-ulang tersebut seperti yang telah dilakukan oleh Aryani (2011). Dalam penelitian tersebut, dibenzoil resasetofenon dihasilkan sebagai produk utama dengan rendemen mencapai 64% menggunakan metode Tang et al. (2005) dan
selanjutnya menghasilkan β-diketon dengan rendemen 11.8%. Rendahnya
rendemen produk dibenzoil resasetofenon yang diperoleh dalam penelitian ini
menyebabkan reaksi tidak dilanjutkan ke sintesis β-diketon.
Spektrum 1H-NMR (Lampiran 3b) produk sintesis metode Verma et al. (2011) dan Wheeler (1963) terangkum pada Tabel 4 yang menunjukkan 8 sinyal. Sinyal di 12.49 ppm khas untuk gugus hidroksil fenolik bebas yang berposisi orto terhadap gugus asil dan karena itu, berikatan hidrogen intramolekul. Proton aromatik cincin A memberikan 3 sinyal, yaitu 7.52, 7.66, dan 8.19 ppm. Dua proton yang orto terhadap gugus karbonil ester merasakan tarikan-elektron sehingga sinyalnya lebih ke medan bawah (8.19 ppm). Demikian pula 1 proton di posisi para berada lebih ke medan bawah (7.66 ppm) daripada 2 proton di posisi meta (7.52 ppm) karena adanya perambatan tarikan-elektron tersebut.
10
penyumbang-elektron dari 2 buah atom O yang berposisi orto atau para sehingga geseran kimianya lebih ke medan atas.
Tabel 4 Analisis sinyal 1H-NMR p-benzoil resasetofenon (pelarut CDCl3)
Atom H δH 500 MHz (ppm)
Senyawa 3-benzoil-7-hidroksiflavon (Gambar 11) disintesis dengan metode Tang et al. (2005) dan Chee et al. (2011). Kedua metode ini merupakan cara sintesis 1-wadah yang belakangan ini lazim digunakan karena lebih menghemat waktu dan tidak memerlukan pemurnian senyawa antara sehingga rendemen yang diperoleh lebih tinggi. Dengan cara ini, reaksi esterifikasi, kondensasi Claisen intramolekul (penataan-ulang BV), dan siklisasi oksidatif membentuk flavon berlangsung dalam 1-tahap. Prinsip kerja kedua metode sintesis ini sama; perbedaannya terletak pada penggunaan gas N2, jumlah pereaksi benzoil klorida, dan katalis K2CO3. Pada metode Tang et al. (2005) digunakan gas N2 dengan 2 ekuivalen benzoil klorida dan 7.25 ekuivalen katalis K2CO3 (anhidrat), sedangkan metode Chee et al. (2011) tidak menggunakan gas N2 dengan 3 ekuivalen benzoil klorida dan 10 ekuivalen katalis K2CO3 (hidrat).
11
berwarna kuning. Hal ini membuktikan lebih lanjut keberadaan gugus fenolik bebas.
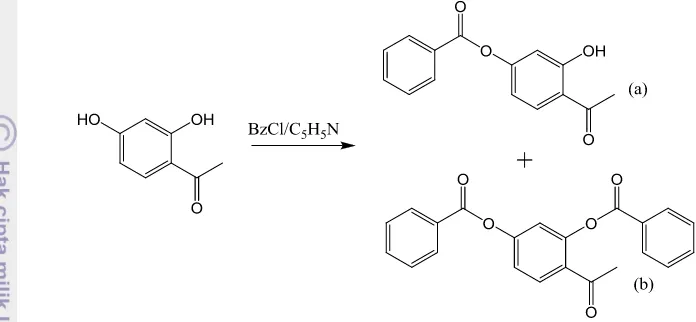
Sintesis dengan mengadaptasi metode Chee et al. (2011) menghasilkan 3 noda. Noda teratas teridentifikasi sebagai 3-benzoil-7-hidroksiflavon berdasarkan kesamaan Rf dengan produk sintesis metode Tang et al. (2005). Sulitnya proses
pemisahan ketiga komponen ini (noda sangat berekor) mengakibatkan 2 komponen lain yang sifatnya lebih polar (Rf lebih rendah pada eluen n-
heksana-EtOAc 9:1) belum dapat teridentifikasi dengan baik. 7-hidroksiflavon diduga merupakan salah satu komponen yang lebih polar tersebut.
Gambar 11 Reaksi sintesis 3-benzoil-7-hidroksiflavon
Tabel 5 Analisis sinyal 1H-NMR 3-benzoil-7-hidroksiflavon (pelarut aseton-d6)
Atom H δH 500 MHz (ppm)
12
terbenzoilasi dan berdasarkan spektrum UV-Vis, telah mengalami penataan-ulang serta siklisasi membentuk flavon.
Tiga sinyal proton aromatik cincin A diperoleh di 6.96, 6.97, dan 8.32 ppm. Sinyal di 1.28 ppm bukan berasal dari proton hidroksil karena lazimnya proton hidroksil fenolik flavonoid muncul di daerah > 9 ppm (Moon et al. 2005; Park et al. 2006). Tidak munculnya sinyal 7-OH diduga karena proton dapat-tukar tersebut berikatan hidrogen dengan aseton. Sinyal proton 6 dan 8 (6.97 dan 6.96 ppm) menunjukkan efek resonans penyumbang-elektron dari 2 atom O yang berposisi orto dan para sehingga geseran kimianya jauh lebih kecil dibandingkan dengan sinyal proton 5 (8.32 ppm) yang sebaliknya mengalami efek tarikan-elektron dari gugus keton.
Meskipun posisi 6 sinyal proton aromatik lainnya belum dapat dipastikan, analisis sinyal-sinyal tersebut pada Tabel 5 sudah bersesuaian dengan struktur 3-benzoil-7-hidroksiflavon. Sinyal di 8.14 dan 8.19 ppm berasal dari proton-proton yang berposisi orto dengan gugus keton atau perpanjangan sistem konjugasinya, yaitu H2’/6’ dan 3”/7”. Sinyal 1H di 7.76 dan 7.65 ppm berasal dari proton-proton di posisi para (H4’/5”), sedangkan proton-proton meta (H3’/5’ dan 4”/6”) memunculkan sinyal 2H di 7.57 dan 7.62 ppm.
13
berotasi. Oleh karena itu, sinyal C-4 jauh lebih ke medan atas (177.7 ppm) daripada sinyal C-1” (195.0 ppm).
Sinyal di 156.8, 164.2, dan 164.5 ppm berasal dari 3 buah karbon oksiaril di C-2, C-7, dan C-9. Tarikan elektron atom oksigen menggeser ke medan bawah posisi sinyal karbon aromatik tersebut. Sinyal di 92.5, 111.8, 113.4, dan 117.1 ppm sebaliknya bergeser ke medan atas. Pergeseran ini dialami oleh 2 buah karbon yang berposisi orto dengan gugus OH (6 dan 8) serta oleh 3 dan C-10 yang merupakan karbon-β dalam sistem vinil eter. Keempat karbon tersebut mengalami efek resonans sumbangan-elektron dari atom O sehingga lebih terperisai.
Sinyal di 127.0, 128.9, 129.0, dan 130.5 ppm memiliki intensitas 2 kali lebih tinggi daripada sinyal di 129.2, 129.9, 132.7, 133.7, dan 134.1 ppm. Hal ini menunjukkan bahwa keempat sinyal pada kelompok pertama masing-masing dihasilkan oleh 2H, yaitu oleh C-2’/6’, C-3’/5’, C-3”/7”, dan C-4”/6”. Sementara kelima sinyal pada kelompok kedua berasal dari 5 karbon aromatik lainnya, yaitu C-5, C-1’, C-4’, C-2”, dan C-5”. Posisi tiap sinyal tidak dapat dipastikan untuk tiap atom karbon, dan perlu dilakukan analisis NMR 2-dimensi untuk mengetahui lebih lanjut posisi tiap sinyal. Analisis sinyal pada Tabel 6 merupakan hasil pendugaan dengan menggunakan bantuan perangkat lunak ChemBioDraw 11.
Pembentukan 3-benzoil-7-hidroksiflavon dalam penelitian ini sesuai dengan yang dilaporkan dalam prosedur asli. Dengan bahan awal 2’,4’-dihidroksi-5’ -nitroasetofenon, Tang et al. (2005) melaporkan sintesis 3-aroilflavon dengan rendemen 3646% dengan menggunakan 2 ekuivalen aroil klorida. Dalam penelitian selanjutnya, Chee et al. (2011) dengan bahan awal 2’ -hidroksiasetofenon menghasilkan 5% flavon dengan 1 ekuivalen benzoil klorida dan campuran 65% flavon dengan 20% 3-benzoilflavon dengan 3 ekuivalen benzoil klorida pada atmosfer terbuka (tanpa gas N2). Hasil sebaliknya diperoleh saat sintesis dilakukan dengan aliran gas N2: 3 ekuivalen benzoil klorida menghasilkan 12% flavon dan 47% 3-benzoilflavon. Fenomena ini diduga akibat pengaruh jumlah basa dan kondisi atmosfer terbuka yang berperan dalam pemutusan 3-benzoil.
14
Gambar 12 Dugaan mekanisme pembentukan 3-benzoil-7-hidroksiflavon
SIMPULAN DAN SARAN
Senyawa 3-benzoil-7-hidroksiflavon telah disintesis tanpa produk samping dari bahan awal resorsinol melalui 2 tahap reaksi dengan rendemen keseluruhan 76% dari bahan awal resorsinol. Temuan ini mengindikasikan suatu mekanisme bahwa dengan benzoil klorida berlebih, tidak terjadi reaksi penataan-ulang BV. Senyawa antara -diketon dihasilkan melalui kondensasi Claisen antarmolekul dan bukan intramolekul.
DAFTAR PUSTAKA
Ares JJ, Outt PE, Kakodkar SV, Buss RC, Geiger JC. 1993. A convenient large-scale synthesis of 5-methoxyflavone and its application to analog preparation. J Org Chem. 58(27):7903-7905.
Aryani L. 2011. Sintesis prekursor 1,3-diketon untuk 7-hidroksiflavon dari resorsinol [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Chee CF, Buckle MJC, Rahman NA. 2011. An efficient one-pot synthesis of flavones. Tetrahedron Lett. 52:3120-3123.
Cooper SR. 1955. Resacetophenone. Org Synth Coll. 3: 761-762.
Daniel. 2008. Sintesis senyawa flavonoid teralkilasi dengan metode reaksi multikomponen serta studi ab initio mekanisme reaksi tahap awal sintesisnya [skripsi]. Bandung (ID): Institut Teknologi Bandung.
Dekermendjian K, Kahnberg P, Witt MR, Sterner O, Nielsen M, Liljefors T. 1999. Structure-activity relationship and molecular modeling analysis of flavonoid binding to the benzodiazepine site of the rat brain GABAA receptor complex. J Med Chem. 42(21):4343-4350.
Fukui K, Nakayama M. 1969. Synthetic studies of the flavone derivatives, the
synthesis of 8,3’-dimetoxy-5,7,4’-trihydroxyflavone. Bull Chem Soc Japan.
42(8):2327-2330.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung (ID): ITB Pr. Terjemahan dari: Techniques of Flavonoid Identification.
McGarry LW, Detty MR. 1990. Synthesis of highly functionalized flavones and chromones using cycloacylation reaction and C-3 functionalization. A total synthesis of hormothamnione. J Org Chem. 55(14):4349-4356.
Moon BH, Lee Y, Shin C, Lim Y. 2005. Complete assignments of the 1H and 13C NMR data of flavone derivatives. Bull Korean Chem Soc. 26(4):603-608. Murthy YLN, Viswanath IVK, Pandit EN. 2010. Synthesis, characterization, and
antibacterial activity of 7,4’-dihydroxy-3’-methoxyflavone. J Chem Tech. 2(2):1097-1101.
Nagendrappa G. 2004. An epitome of K Venkataraman’s chemistry [artikel].
Resonance: 45-51.
Park Y, Lee YU, Kim H, Lee Y, Yoon YA, Moon B, Chong Y, Ahn JH, Shim YH, Lim Y. 2006. NMR data of flavones derivatives and their anti-oxidative activities. Bull Korean Chem Soc. 27(10):1537-1541.
Paul S, Nanda P, Gupta R. 2003. PhCOCl-Py/basic alumina as a versatile agent for benzoylation in solvent-free condition. Molecules 8:374-380.
Sarda SR, Pathan MY, Paike VV, Pachmase PR, Jadhav WN, Pawar RP. 2006. A facile synthesis of flavones using recyclable ionic liquid under microwave irradiation. Arkivoc. 16:43-48.
Tang L, Zhang S, Yang J, Gao W, Cui J, Zhuang T. 2004. A novel approach to the synthesis of 6-amino-7-hydroxyflavone. Molecules 9:842-848.
16
Venkatesh P, Prakash G, Pavadai P. 2012. Design, synthesis and cytotoxic activity of some novel flavones. J Pharm Sci Res. 3(2):523-527.
Verma PN, Sheikh JI, Juneja HD. 2011. Synthesis of β-diketone and its metal complexes. J Basic Appl Sci. 3(2):35-38.
Wheeler TS. 1963. Flavone. Org Synth Coll. 4:478.
Zembower DE, Zhang H. 1998. Total synthesis of robustaflavone, a potential anti-hepatitis B agent. J Org Chem. 63(25):9300-9305.
18
Lampiran 1 Bagan alir penelitian
Asetilasi resorsinol menjadi resasetofenon
(modifikasi Cooper et al. 1955)
Benzoilasi resasetofenon menjadi p-benzoil resasetofenon
(Wheeler 1963 dan Verma et al. 2011)
Penataan-ulang BV menjadi 1,3-diketon
(Wheeler 1963)
Siklisasi intramolekul senyawa 1,3-diketon
menjadi flavon (Wheeler 1963)
Metode langsung (modifikasi Tang et al. 2005 dan Chee et al. 2011)
Pencirian dengan titik leleh, UV-Vis, dan
19
Lampiran 2 Elusidasi struktur resasetofenon
Spektrum UV-Vis resasetofenon (pelarut: metanol).
+ NaOH
20
Lampiran 3 Elusidasi struktur p-benzoil resasetofenon
(a) Spektrum UV-Vis p-benzoil resasetofenon (pelarut: metanol). + NaOH
21
22
Lampiran 4 Elusidasi struktur 3-benzoil-7-hidroksiflavon
(a) Spektrum UV-Vis 3-benzoil-7-hidroksiflavon (pelarut: metanol).
+ NaOH
23
24
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 15 Juni 1989 dari pasangan Hotman Edison dan Sinta Pakpahan. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2007 penulis lulus dari SMA Negeri 1 Cileungsi dan pada tahun yang sama lulus seleksi masuk Direktorat Program Diploma Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan penulis pernah melaksanakan kegiatan magang mandiri di Lembaga Ilmu Pengetahuan Indonesia (LIPI) pada tanggal 14 Juli30 Agustus 2008 dan kegiatan magang mandiri di PT Saritama Food Processing pada tanggal 14 Juli14 Agustus 2009. Tahun 2010 penulis melaksanakan kegiatan praktik kerja lapangan di Balai Pengujian Mutu Barang Ekspor dan Impor (BPMBEI), Ciracas Jakarta Utara dengan judul laporan
“Penentuan Kadar Cemaran Logam Timbal (Pb) dan Kadmium (Pb) dalam Sabun
Mandi dengan Spektrofotometri Serapan Atom”. Penulis juga pernah mengikuti Program Kreativitas Mahasiswa bidang Pengabdian Masyarakat (PKMM) dengan
judul “Edukasi Pengembangan Sistem Motorik Kasar dan Motorik Halus Siswa
SLB Dharma Wanita dan SLB Sejahtera (Metode Puzzle, Bola dan
Kesetimbangan Tubuh)”. Selain itu, penulis pernah menjadi asisten praktikum