EKSTRAK GLIKOGEN TEMILOK (Bactronophorus thoracites)
SEBAGAI KO-PRESIPITAN ASAM DEOKSIRIBONUKLEAT
DENNY SYAPUTRA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul
“Ekstrak Glikogen Temilok (Bactronophorus thoracites) sebagai Ko-presipitan Asam Deoksiribonukleat” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
Denny Syaputra
ABSTRACT
DENNY SYAPUTRA. Temilok (Bactronophorus thoracites) Glycogen Extract as Co-precipitant of Deoxyribonucleic Acid. Under direction of BUSTAMI IBRAHIM and SRI PURWANINGSIH
Temilok (Bactronophorus thoracites) is one of Teredinidae or family of wood-borer shellfish in fact it has a fairly high polysaccharide content, particularly interesting source of glycogen. The objectives of this experiment are to determine KOH concentration, percentation of cationic resin Amberlite IR-120 Na and its stirring time to extract the glycogen from temilok flesh based on Nicoletti and Baiocchi glycogen polysaccharide extraction patent method, and the ability of the extracted glycogen as co-precipitant in the precipitation of deoxyribonucleic acid (DNA) of human femur. Nitrogen content of extracted glycogen was measured by kjeldahl method. Nucleic acid content of extracted glycogen were spectrophotometrically measured at 260 nm, 280 nm and 320 nm. Extracted glycogen samples was characterized by determining the glucose content quantitatively using phenol-sulphate (phesul) method which measured spectrophotometrically at 490 nm . The treatment of 100g temilok flesh with 40% potassium hydroxide and heated to 100 oC decreased the nitrogen content of extracted glycogen to 250 ppm. Treated the solution with 12% resin cationic Amberlite IR-120 and stirring for 16 hours at room temperature yielded 10,19±2,23% glycogen characterized by the lowest nucleic acids content which is 0,07 mg/mL. In order to asses the ability of the glycogen extract as co-precipitant of low copy number DNA, 2% solution of glycogen extract were added until 20 µL per 800 µL solution of femur DNA and 40 µL sodium acetate. Results revealed that by adding the extracted glycogen solutions into the first step of DNA precipitation procedure, the yield of DNA were not significantly affected at the level of 0,05 though the yield of DNA decreased against blanko about 0,006 ng/µL of 0,0401 ng/µL.
RINGKASAN
DENNY SYAPUTRA. Ekstrak Glikogen Temilok (Bactronophorus thoracites) sebagai Ko-presipitan Asam Deoksiribonukleat. Dibimbing oleh BUSTAMI IBRAHIM dan SRI PURWANINGSIH
Temilok (Bactronophorus thoracites) adalah spesies kerang pengebor kayu dari famili Teredinidae. Kerang ini mengandung karbohidrat yang relatif tinggi yaitu sekitar 18%, sehingga merupakan sumber bahan baku potensial untuk glikogen. Glikogen dengan residu nitrogen dan asam nukleat yang sangat rendah dapat membantu presipitasi asam deoksiribonukleat (DNA) untuk keperluan forensik. Tujuan penelitian ini adalah mendapatkan konsentrasi potasium hidroksida (KOH), lama pengadukan dan persentase resin kationik Amberlite IR-120 Na terbaik dalam menghasilkan ekstrak glikogen dengan residu nitrogen dan asam nukleat paling rendah, lalu menguji kemampuan glikogen temilok terekstrak sebagai ko-presipitan dalam presipitasi DNA tulang paha (femur) manusia.
Metode ekstraksi yang digunakan berdasarkan metode paten ekstraksi glikogen dari Nicoletti dan Baiocchi. Prosedur utamanya terdiri dari perebusan daging temilok dengan larutan potasium hidroksida (KOH) hingga suhu 100 oC, dan pengadukan dengan penambahan resin kationik Amberlite IR-120 pada suhu kamar. Rancangan percobaan untuk perlakuan konsentrasi KOH (20%, 30%, dan 40%) adalah Rancangan Acak Lengkap, sedangkan untuk perlakuan interaksi persentase resin (9% dan 12%), dan lama pengadukan (8 jam, 16 jam, dan 24 jam) adalah Rancangan Acak Lengkap Faktorial. Uji lanjut dengan uji Tukey.
Residu nitrogen di dalam glikogen terekstrak diukur dengan metode kjeldahl. Residu asam nukleat di dalam glikogen terekstrak diukur dengan spektrofotometer pada panjang gelombang 260 nm, 280 nm dan 320 nm. Sampel glikogen terekstrak dikarakterisasi berdasarkan kadar glukosanya yang dengan metode fenol-sulfat.
Hasil analisis statistik menunjukkan bahwa perlakuan perebusan 100 g temilok utuh dengan KOH 40% hingga suhu 100oC menghasilkan glikogen terekstrak dengan residu nitrogen paling rendah yaitu 250 ppm. Pengadukan dengan penambahan 12 g resin kationik Amberlite IR-120 selama 16 jam pada suhu kamar adalah perlakuan terbaik yang menghasilkan ekstrak glikogen dengan rendemen 10,19±2,23%, dan asam nukleat paling rendah yaitu 0,07 mg/mL.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
EKSTRAK GLIKOGEN TEMILOK (Bactronophorus thoracites)
SEBAGAI KO-PRESIPITAN ASAM DEOKSIRIBONUKLEAT
DENNY SYAPUTRA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ekstrak Glikogen Temilok (Bactronophorus thoracites) sebagai Ko-presipitan Asam Deoksiribonukleat
Nama Mahasiswa : Denny Syaputra
NIM : C351090061
Disetujui Komisi Pembimbing
Dr. Ir. Bustami Ibrahim, M.Sc Dr. Ir. Sri Purwaningsih, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr.Tati Nurhayati, S.Pi M.Si Prof. Dr. Ir. Dahrul Syah, M.Sc Agr
Tanggal Ujian : Tanggal Lulus :
Fa inna ma’al ‘usri yusran. Inna ma’al ‘usri yusran. Fa idza faraghta fanshab. Wa ilaa Rabbika farghab.(Q.S Al-Insyirah : 5-8)
Artinya : “Karena sesungguhnya sesudah kesulitan ada kemudahan. Sesungguhnya sesudah kesulitan itu ada kemudahan. Maka apabila kamu telah selesai (dari sesuatu urusan), kerjakan dengan sungguh-sungguh (urusan) yang
PRAKATA
Puji dan syukur kepada Allah swt atas pertolongan-Nya kepada penulis sehingga dapat menyelesaikan tesis ini. Penulis melakukan penelitian dengan judul Ekstrak Glikogen Temilok (Bactronophorus thoracites) sebagai Ko-presipitan Asam Deoksiribonukleat.
Penulis mengucapkan terima kasih kepada :
1. Dr. Ir. Bustami Ibrahim, M.Sc dan Dr. Ir. Sri Purwaningsih, M.Si selaku komisi pembimbing atas bimbingan dan saran yang telah diberikan selama ini. 2. Dr. Pipih Suptijah, MBA selaku dosen penguji luar komisi atas segala saran
dan masukannya.
3. Dr. Tati Nurhayati, S.Pi, M.Si selaku Ketua Program Studi Teknologi Hasil Perairan atas saran dan masukannya.
4. Bapak Komisaris Besar Polisi Putut Tjahyo Widodo selaku Kepala Laboratorium Forensik DNA Pusdokkes Markas Besar Kepolisian Negara Republik Indonesia, beserta seluruh staf yaitu A.A.G Raka Ardian, S.Si., Lathifah Ismiyati, S.Si., Muh. Fuad Riyadi, S.Si, Dewi Monasari, S.Si, Restu Priyono, S.Si, Novi Wulandasari, S.Si, Riris Savitri, S.Si, Retno Dwi Wahyuningsih, S.Si, dan Ibu Neneng) atas segala bantuan dan kerjasamanya. 5. Ibu Ema dan Dini di Laboratorium Mikrobiologi dan Biokimia I THP-IPB,
serta Ibu Anna selaku Kepala Laboratorium Proling beserta seluruh staf laboran atas segala bantuannya, dan Saudara Tyas atas segala masukannya. 6. Direktorat Jenderal Pendidikan Tinggi (Dikti) atas Beasiswa Pendidikan
Pascasarjana (BPPS) selama penulis menempuh studi Program Pascasarjana di Institut Pertanian Bogor
Penulis mengucapkan terima kasih yang sedalam-dalamnya kepada kedua orangtuaku tercinta Yellie Indrian Teny dan Syabilal Rasyad di Pangkalpinang, istriku Tika Fitriana dan anak-anakku tercinta Umayr Ahmad Alfayyaadl, Hadya Taqiya Zulhajj, Halia Layla Syafithree, Hania Layli Syafithree, serta mertuaku Asmita dan Kornain, atas segala kesabaran, dukungan dan doa selama ini.
Penulis menyadari masih banyak kekurangan dalam tesis ini, sehingga kritik dan saran yang membangun sangat penulis harapkan. Semoga karya kecil ini bermanfaat besar bagi pengembangan ilmu, pengetahuan dan aplikasinya di masyarakat. Amiin.
Bogor, Oktober 2012
RIWAYAT HIDUP
Penulis dilahirkan di Pangkalpinang pada tanggal 6 Desember 1979 sebagai sulung dari dua bersaudara dari Bapak Syabilal Rasyad dan Ibu Yellie Indrian Teny. Penulis menamatkan pendidikan dasar di SD Melong 1, Bandung pada tahun 1992, lalu melanjutkan pendidikan ke SMP Negeri 9 Bandung, kemudian lulus dari SMP Negeri 3 Pangkalpinang pada tahun 1995. Pada Tahun 1998 penulis menamatkan pendidikan menengah atas di SMA Negeri 1 Pangkalpinang. Penulis menempuh pendidikan strata 1 di Institut Pertanian Bogor pada tahun 1999 pada Program Studi Teknologi Hasil Perikanan.
Pada tahun 2004, penulis menjadi staf pengajar luar biasa di Jurusan Perikanan, Sekolah Tinggi Ilmu Pertanian (Stiper) Bangka, kemudian pada tahun 2006 diangkat sebagai staf pengajar di Program Studi D III Perikanan, Universitas Bangka Belitung. Pada tahun 2007, penulis memuat dua karya ilmiah tentang temilok (Bactronophorus thoracites) yang berjudul “Produk fermentasi ikan dari cacing kapal Bactronophorus sp. segar” dan “Upaya peningkatan hasil tangkapan cacing kapal Bactronophorus sp. dari ekosistem bakau” di Jurnal Akuatik Volume 1 dan 2 yang diterbitkan oleh Universitas Bangka Belitung Press. Pada tahun 2009, penulis mendapat kesempatan melanjutkan pendidikan strata 2 dengan pembiayaan Beasiswa Pendidikan Pascasarjana (BPPS) Dikti di Sekolah Pascasarjana Institut Pertanian Bogor pada Program Studi Teknologi Hasil Perairan.
Bogor, Oktober 2012
DAFTAR ISI
2.2.3 Sifat resin kationik (Davis 2010) ... 13
2.3 Konsep Spektrofotometri Asam Nukleat ... 15
2.3.1 Konsep pengukuran RNA-DNA... 15
2.3.2 Penghitungan kadar asam nukleat ... 16
2.4 Glikogen sebagai Ko-presipitan Low Copy Number DNA ... 16
3 METODE PENELITIAN ... 19
3.1 Waktu dan Tempat Penelitian ... 19
3.2 Alat dan Bahan ... 19
3.3 Prosedur Penelitian ... 20
3.3.1 Karakteristik proksimat temilok (Metode SNI.01-2891-1992) ... 21
3.3.2 Optimasi ekstraksi glikogen temilok (modifikasi Metode Nicoletti dan Baiocchi 1994)... 21
3.3.3 Karakterisasi ekstrak glikogen (Bennett et al. 2007) ... 22
3.3.4 Aplikasi glikogen sebagai ko-presipitan DNA (Lennard et al. 2007) ... 24
3.4 Metode Analisis ... 25
3.4.1 Analisis proksimat (Metode SNI.01-2891-1992) ... 25
3.4.2 Analisis rendemen glikogen terekstrak (AOAC 1995) ... 27
3.4.4 Analisis kadar glukosa di dalam glikogen (Bennett et al. 2007) .28
3.4.5 Analisis residu asam nukleat (Adams et al. 1986) ...28
3.4.6 Analisis DNA terpresipitasi (Lennard et al. 2007) ...29
3.5 Rancangan Percobaan dan Analisis Data ...30
4 HASIL DAN PEMBAHASAN ...33
4.1 Karakteristik Proksimat Temilok (Bactronophorus thoracites) ...33
4.2 Optimasi Ekstraksi Glikogen ...36
4.2.1 Pengaruh konsentrasi potasium hidroksida (KOH) ...36
4.2.2 Karakterisasi glikogen terekstrak ...38
4.2.3 Interaksi perlakuan lama pengadukan dan persentase resin ...39
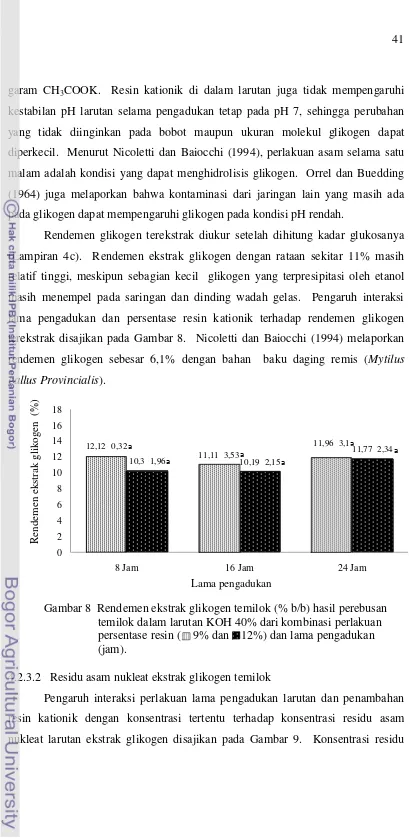
4.2.3.1 Rendemen ekstrak glikogen temilok ...40
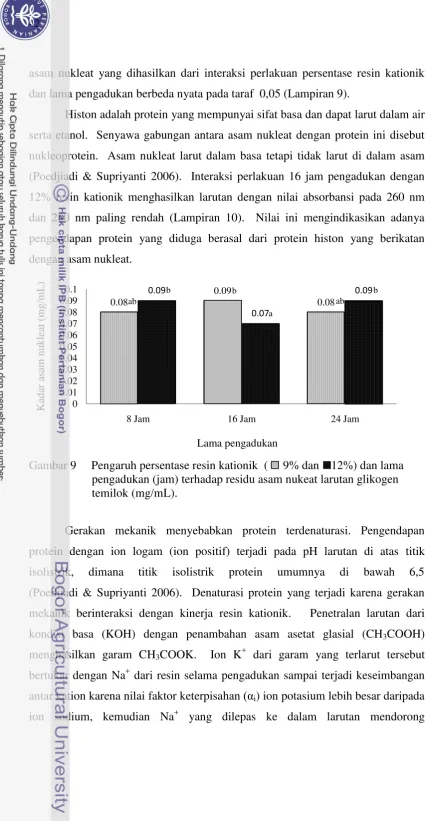
4.2.3.2 Residu asam nukleat ekstrak glikogen temilok ...41
4.3 Kapasitas Ko-presipitasi DNA Femur Ekstrak Glikogen Temilok ...43
5 SIMPULAN DAN SARAN ...47
5.2 Simpulan ...47
5.3 Saran ...47
DAFTAR PUSTAKA ...49
DAFTAR TABEL
Halaman 1 Nilai faktor keterpisahan (separation factor) [αi] beberapa kation ... 14
DAFTAR GAMBAR
Halaman 1 Roadmap penelitian ... 3 2 Bentuk fisik Bactronophorus thoracites (Leiwakabessy 2011) ... 7 3 Skema proses glikogenolisis dan glikogenesis
(Poedjiadi & Supriyanti 2006) ... 10 4 a. Model molekuler glikogen tiram (Matsui et al. 1996) ... 11 b. Monemer glukosa dan struktur dasar glikogen (McCormick 2006) ... 11 5 Skema tahapan penelitian ... 20 6 Prosedur optimasi ekstraksi glikogen temilok ... 23 7 Residu nitrogen (ppm) ekstrak glikogen temilok dengan perlakuan
konsentrasi KOH 20%, 30% dan 40% ... 37 8 Rendemen ekstrak glikogen temilok (% b/b) hasil perebusan temilok
dalam larutan KOH 40% dari kombinasi perlakuan persentase resin
(9% dan 12%) dan lama pengadukan (jam) ... 41 9 Pengaruh persentase resin kationik (9% dan 12%) dan lama pengadukan
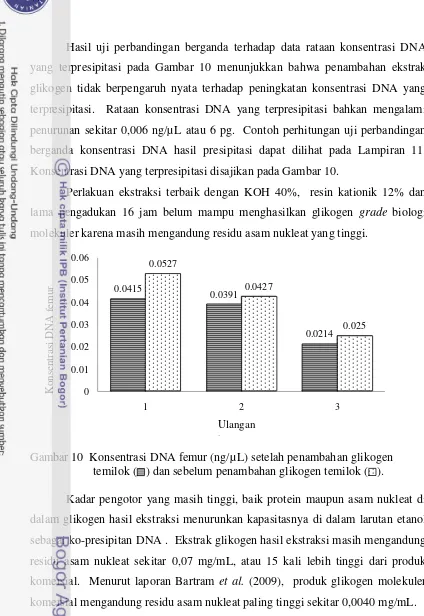
(jam) terhadap kadar asam nukleat larutan glikogen temilok (mg/mL) ... 42 10 Konsentrasi DNA femur (ng/µL) setelah penambahan glikogen
DAFTAR LAMPIRAN
Halaman 1 Persiapan sebelum tahapan kuantitasi DNA dengan RT-PCR ... 55 a. Penempatan larutan di dalam well sebelum DNA dikuantitasi
dengan RT-PCR ... 55 b. Pembuatan larutan standar DNA manusia untuk membuat kurva
standar konsentrasi DNA femur yang terpresipitasi ... 55 2 Nilai rataan asam amino temilok ... 56 3 Rekapitulasi data pengukuran dan tabel sidik ragam residu nitrogen
ekstrak glikogen (ppm) karena perlakuan konsentrasi KOH
(resin kationik 6%) ... 57 4 Nilai absorbansi glukosa standar dan glikogen terekstrak dengan konsentrasi
tertentu pada panjang gelombang 490 nm ... 58
5 Ekstrak glikogen temilok yang menempel pada dasar tabung
gelas dan warna larutan ekstrak glikogen temilok ... 59 6 Rekapitulasi data pengukuran dan tabel sidik ragam rendemen ekstrak
glikogen (%) karena perlakuan konsentrasi KOH (resin kationik 6%) ... 60
7 Rekapitulasi data pengukuran dan tabel sidik ragam rendemen
ekstrak glikogen (%) dengan perlakuan bobot resin kationik dan lama
pengadukan ... 61
8 Pengamatan bobot ekstrak glikogen selama pengeringan di dalam
desikator vakum gel silika ... 62 9 Rekapitulasi data pengukuran dan tabel sidik ragam residu asam nukleat
larutan glikogen temilok 2% (mg/mL) dengan perlakuan bobot
1
1.
PENDAHULUAN
1.1 Latar Belakang
Asam deoksiribonukleat atau deoxyribonucleic acid (DNA) merupakan salah satu jenis asam nukleat yang membawa ribuan gen yang menentukan sifat tertentu dari satu generasi ke generasi turunannya, termasuk informasi untuk diferensiasi sel sehingga terbentuk tumbuhan, hewan, manusia dan organisme lainnya. Karakteristik DNA tersebut sangat membantu dalam mengungkap identitas individu makhluk hidup berdasarkan hubungan kekerabatannya, termasuk manusia (Toha 2001).
Teknologi di bidang biologi molekuler mengalami kemajuan yang pesat. Kemajuan teknologi tersebut adalah ditemukannya teknik amplifikasi in vitro
fragmen gen tertentu yang terletak di antara pasangan oligonukleotida primer spesifik yang disebut polymerase chain reaction (PCR), dan teknik pelacak DNA (DNA probe) berdasarkan prinsip hibridisasi DNA. Kedua teknologi tersebut kini semakin memudahkan banyak bidang kehidupan manusia antara lain kesehatan, intensifikasi pertanian, konservasi, dan forensik.
Bidang forensik kini mengalami perkembangan sedemikian rupa. Teknik yang digunakan dalam bidang forensik sebelumnya adalah odontologi (susunan gigi geligi) dan fingerprint (sidik jari), namun teknik tersebut belum mampu untuk menyingkap identitas seseorang (baik korban maupun pelaku) dalam kasus-kasus kriminalitas, atau pun korban musibah dan bencana alam. Kesulitan yang sering dihadapi adalah proses identifikasi korban berdasarkan tulang belulang yang tersisa karena organ tubuh lainnya telah rusak akibat pembusukan atau pun terbakar.
2
tahap sequencing karena umumnya mengandung DNA yang sangat sedikit (picogram atau nanogram) atau low copy number sehingga proses ekstraksi dan presipitasi DNA tulang harus dilakukan berulang kali. Hal ini tentu membutuhkan waktu lebih lama, tenaga lebih besar, konsentrasi dan biaya yang lebih tinggi (Widodo, komunikasi pribadi 2012).
Presipitasi DNA tulang yang memiliki kadar DNA sangat rendah membutuhkan bahan pembantu yang dapat meningkatkan efektivitas etanol atau isopropanol dalam mempresipitasi DNA. Menurut Bartram et al. (2009), bahan yang ditambahkan untuk meningkatkan efektivitas presipitasi DNA lebih dikenal dengan istilah carrier atau ko-presipitan. Linear polyacrylamide (LPA), yeast-derived tRNA, dan glikogen adalah contoh bahan yang tergolong ko-presipitan dalam presipitasi DNA.
Sumber bahan baku glikogen komersial dengan grade biologi molekular atau kemurnian yang tinggi umumnya berasal dari kerang-kerangan. Temilok adalah salah satu jenis kerang-kerangan yang masih mudah dijumpai di hutan bakau di beberapa pulau di Indonesia, termasuk di Pulau Bangka. Harga temilok segar di Pulau Bangka berkisar antara Rp 30.000,00–Rp 45.000,00/ kg. Preparasi temilok juga relatif lebih mudah daripada tiram karena bagian mantel temilok tidak ditutupi oleh cangkang, dan tekstur sebagian besar mantel temilok yang lebih lunak.
Kadar karbohidrat pada daging hewan menjadi indikasi awal kandungan glikogen. Menurut Syaputra et al. (2007), kadar karbohidrat temilok juga relatif tinggi yaitu sekitar 17%, sedangkan kadar proteinnya relatif rendah, yaitu sekitar 4,29%. Temilok tidak populer sebagai bahan pangan seperti halnya remis dan tiram, sehingga sangat potensial sebagai bahan baku ekstraksi glikogen.
3
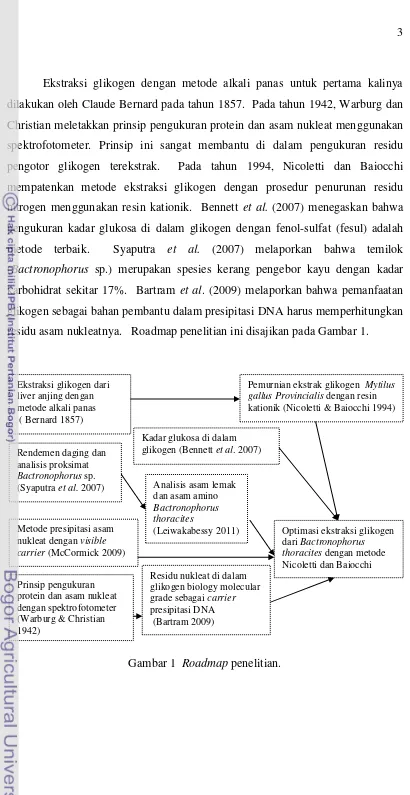
Ekstraksi glikogen dengan metode alkali panas untuk pertama kalinya dilakukan oleh Claude Bernard pada tahun 1857. Pada tahun 1942, Warburg dan Christian meletakkan prinsip pengukuran protein dan asam nukleat menggunakan spektrofotometer. Prinsip ini sangat membantu di dalam pengukuran residu pengotor glikogen terekstrak. Pada tahun 1994, Nicoletti dan Baiocchi mempatenkan metode ekstraksi glikogen dengan prosedur penurunan residu nitrogen menggunakan resin kationik. Bennett et al. (2007) menegaskan bahwa pengukuran kadar glukosa di dalam glikogen dengan fenol-sulfat (fesul) adalah metode terbaik. Syaputra et al. (2007) melaporkan bahwa temilok (Bactronophorus sp.) merupakan spesies kerang pengebor kayu dengan kadar karbohidrat sekitar 17%. Bartram et al. (2009) melaporkan bahwa pemanfaatan glikogen sebagai bahan pembantu dalam presipitasi DNA harus memperhitungkan residu asam nukleatnya. Roadmap penelitian ini disajikan pada Gambar 1.
Gambar 1 Roadmap penelitian.
Optimasi ekstraksi glikogen
4
1.2 Perumusan Masalah
Glikogen merupakan salah satu bahan ko-presipitan DNA yang dapat meningkatkan laju presipitasi low copy number DNA. Glikogen yang beredar di pasaran sebagian besar adalah produk impor dan masih menggunakan kerang sumber protein seperti remis dan tiram sebagai bahan baku sehingga harganya masih relatif mahal yaitu sekitar US$ 179 per mL. Temilok adalah salah satu jenis kerang air payau dengan kadar karbohidrat yang relatif tinggi sehingga sangat potensial sebagai bahan baku penghasil glikogen. Komposisi kimia bahan baku yang berbeda sangat mempengaruhi karakteristik glikogen hasil ekstraksi, sehingga uji proksimat terhadap temilok perlu dilakukan. Ekstraksi glikogen dengan alkali panas dapat menurunkan kadar pengotor glikogen yaitu residu nitrogen, namun juga dapat mendegradasi glikogen sehingga dapat menurunkan rendemen glikogen terekstrak. Residu nitrogen dari glikogen terekstrak dapat dikurangi dengan penambahan sejumlah resin kationik. Efektivitas resin kationik dalam menurunkan residu asam nukleat dari larutan ekstrak glikogen temilok selama pengadukan belum pernah dilaporkan. Residu nitrogen di dalam glikogen terekstrak, baik dalam bentuk protein maupun asam nukleat, dapat menurunkan kapasitas glikogen sebagai ko-presipitan DNA. Kapasitas dan kinerja glikogen temilok dengan residu nitrogen tertentu sebagai ko-presipitan DNA berukuran nanogram atau picogram yang diekstrak dari tulang manusia belum pernah dilaporkan sehingga penelitian ini penting untuk dilakukan.
1.3 Tujuan Penelitian
Tujuan penelitian ini adalah menentukan :
1) Konsentrasi KOH (%) yang optimal untuk menghasilkan ekstrak glikogen temilok dengan residu nitrogen yang rendah.
2) Lama pengadukan (jam) dan persentase resin kationik Amberlite IR-120 Na (g resin per 100 g temilok) yang optimal untuk menghasilkan ekstrak glikogen temilok dengan residu asam nukleat paling rendah.
5
1.4 Manfaat Penelitian
Penelitian ini dapat digunakan sebagai informasi dasar bagi optimalisasi ekstraksi glikogen temilok dengan metode alkali panas. Pemanfaatan temilok sebagai bahan baku alternatif sumber glikogen dapat menggantikan penggunaan remis dan tiram yang lebih populer sebagai bahan pangan. Glikogen yang dihasilkan diharapkan mengandung residu pengotor yang sangat rendah, sehingga dapat diaplikasikan sebagai ko-presipitan DNA yang pada saat ini harganya masih relatif mahal, yaitu sekitar US$ 179 per mL.
1.5 Hipotesis
1) Konsentrasi KOH mempengaruhi residu nitrogen ekstrak glikogen.
2) Lama pengadukan dan persentase resin kationik mempengaruhi rendemen glikogen terekstrak dan residu asam nukleatnya.
7
2.
TINJAUAN PUSTAKA
2.1Temilok
Temilok merupakan kerang pengebor kayu dari genus Bactronophorus
yang memanfaatkan fragmen kayu sebagai sumber makanan pokoknya (Allan 1962). Sebagian besar jenis kerang ini hidup di dalam kayu mati (Olsson 1961).
Identifikasi kerang famili Teredinidae berdasarkan bentuk cangkang ekor yang disebut pallet. Pallet adalah sepasang tulang pipih yang tersusun dari kapur dan khitin dan senantiasa melindungi bagian siphon, serta digunakan untuk menutup terowongan kayu yang dibuatnya (Olsson 1961).
Klasifikasi temilok menurut Allan (1962) adalah sebagai berikut: phylum : Molluska
class : Bivalvia ordo : Myoida family : Teredinidae genus : Bactronophorus
species : Bactronophorus thoracites Gould.
Anggota famili teredinidae yang termasuk genus Bactronophorus apabila memiliki pallet berbentuk engrang atau jangkungan (stilt), siphon yang pendek, panjang cangkang kepala kurang lebih 1,85 cm, dan panjang total pallet dapat mencapai kurang lebih 5 cm(Allan 1962). Bentuk fisik temilok dapat dilihat pada Gambar 2.
8
Lapisan kapur tersebut tetap menempel pada dinding kayu meskipun kerang ini ditarik keluar. Kerang ini dapat berputar dan melakukan kontraksi di dalam terowongan buatannya serta dapat menutup mulut terowongan buatannya menggunakan kedua palletnya dengan terlebih dulu menarik kedua siphonnya ke dalam sehingga dapat bertahan hidup di dalam dinding kapal kayu selama berminggu-minggu di dalam air tawar (Kaestner 1967). Terowongan kayu akan bertambah panjang seiring dengan pertumbuhan kerang yang hidup di dalamnya. Kerang ini mampu menggali terowongan sepanjang 18 cm hingga 2 m (Morton 1978). Usia harapan hidupnya antara satu hingga beberapa tahun bergantung pada jenisnya (Waterbury et al. 1983).
Kerang-kerangan dari famili teredinidae merupakan kerang spesialis pelobang kayu. Palvast dan Velde (2011) melaporkan bahwa dalam tahun pertama kehidupannya di dermaga yang rentang salinitas perairannya cukup lebar, kerang pengebor kayu (teredinidae) mengkonsumsi 12,4% panel kayu. Rata-rata
pertambahan panjang per hari kerang ini dapat mencapai 1,5 mm. Cragg et al. (2009) melaporkan bahwa kerang ini menjadikan kayu sebagai
makanan sekaligus terowongan tempat tinggal dengan mengebor. Apabila perairan hanya menyediakan sedikit plankton maka siphon kerang ini akan membuka lebih lebar. Larva kerang ini juga memperoleh makanan lewat mekanisme matrotrophy dimana induk menyediakan partikel kayu yang sudah dihancurkan sebagai bahan makanan bagi larva.
9
Kerang-kerangan anggota famili teredinidae adalah contoh yang paling umum dari hewan hermaprodit protandri. Kondisi saat perkembangan testis dipercepat dan perkembangan ovarium melambat atau menjadi terbelakang merupakan ciri hewan hermaprodit yang bersifat protandri. Fase muda dari organisme menjalankan fungsi sebagai organisme jantan, dan ketika menuju tahap akhir kedewasaan menjadi betina. Pada kondisi seperti ini, semua individu yang selamat hingga dewasa pertama kali harus melalui fase sebagai individu jantan dan kemudian harus memasuki fase sebagai individu betina (Purchon 1968).
2.2 Glikogen
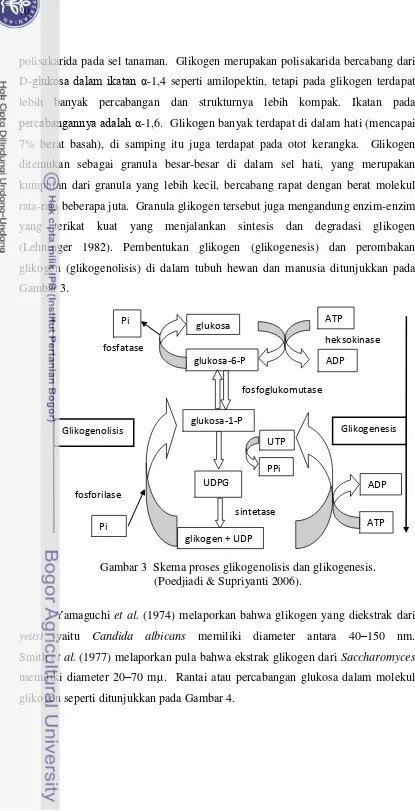
Sintesis glikogen pada hewan sebenarnya terjadi pada semua jaringan, terutama pada otot hati dan kerangka. Tahap awal sintesis glikogen dari glukosa bebas adalah reaksi heksokinase, yang melakukan fosforilasi glukosa menjadi glukosa 6-fosfat. Reaksi kunci di dalam biosintesis glikogen yaitu pembentukan uridin difosfat glukosa (UDP-glukosa) oleh kerja glukosa 1-fosfat uridiltransferase. Reaksi ini dialihkan menuju ke kanan oleh kerja pirofosfatase, yang menghidrolisis pirofosfat inorganik (PPi) menjadi ortofosfat inorganik (Pi). Uridin difosfat glukosa adalah senyawa antara di dalam pengubahan D-galaktosa menjadi D-glukosa. Uridin difosfat glukosa merupakan donor langsung residu glukosa di dalam pembentukan glikogen enzimatik oleh kerja glikogen sintetase, yang menggiatkan pemindahan residu glukosil dari UDP-glukosa ke ujung nonreduksi molekul glikogen bercabang. Pada reaksi ini, pautan baru α-1,4 dibentuk di antara atom karbon 1 molekul glukosa yang datang dan atom karbon 4 residu glukosa ujung pada cabang glikogen. Keseimbangan keseluruhan rangkaian reaksi ini sangat mendorong sintesis glikogen. Glikogen sintetase
memerlukan suatu rantai atau cabang α-1,4 poliglukosa primer dengan sedikitnya 4 residu glukosa yang menambahkan gugus glukosil secara berurutan pada ujung nonreduksi molekul primer (Lehninger 1982).
2.2.1 Glikogen alami
10
polisakarida pada sel tanaman. Glikogen merupakan polisakarida bercabang dari D-glukosa dalam ikatan α-1,4 seperti amilopektin, tetapi pada glikogen terdapat lebih banyak percabangan dan strukturnya lebih kompak. Ikatan pada
percabangannya adalah α-1,6. Glikogen banyak terdapat di dalam hati (mencapai 7% berat basah), di samping itu juga terdapat pada otot kerangka. Glikogen ditemukan sebagai granula besar-besar di dalam sel hati, yang merupakan kumpulan dari granula yang lebih kecil, bercabang rapat dengan berat molekul rata-rata beberapa juta. Granula glikogen tersebut juga mengandung enzim-enzim
yang terikat kuat yang menjalankan sintesis dan degradasi glikogen (Lehninger 1982). Pembentukan glikogen (glikogenesis) dan perombakan
glikogen (glikogenolisis) di dalam tubuh hewan dan manusia ditunjukkan pada Gambar 3.
Gambar 3 Skema proses glikogenolisis dan glikogenesis. (Poedjiadi & Supriyanti 2006).
Yamaguchi et al. (1974) melaporkan bahwa glikogen yang diekstrak dari
yeast yaitu Candida albicans memiliki diameter antara 40–150 nm. Smith et al. (1977) melaporkan pula bahwa ekstrak glikogen dari Saccharomyces
memiliki diameter 20–70 mµ. Rantai atau percabangan glukosa dalam molekul glikogen seperti ditunjukkan pada Gambar 4.
11
(a)
Gambar 4 (a) Model molekuler glikogen tiram (Matsui et al. 1996).
(b) Monomer glukosa dan struktur dasar glikogen (McCormick 2006).
Nicoletti dan Baiocchi (1994) melaporkan bahwa kandungan glikogen di dalam jaringan tubuh yang berbeda pada individu yang sama juga berbeda, bahkan di dalam jaringan tubuh yang sama pada spesies yang sama karena dipengaruhi oleh beberapa faktor seperti status gizi dan musim. Beberapa glikogen yang berasal dari jenis-jenis hewan berbeda, sejauh ini menunjukkan perbedaan pada derajat percabangan polisakaridanya. Percabangan polisakarida pada glikogen yang diekstrak dari mammalia berbeda nyata dengan invertebrata.
Alonso et al. (1995) melaporkan bahwa jumlah glikogenin sebagai protein yang mengawali sintesis glikogen mempengaruhi banyaknya glikogen yang dapat disimpan oleh suatu sel, atau sebagai pembatas tingkat pembentukan glikogen dan merupakan bagian di dalam molekul glikogen. Meezan et al. (1995) melaporkan bahwa glikogenin merupakan proteoglikan, suatu ikatan dengan rantai tepi asam amino serina, bertindak sebagai primer bagi pembentukan polisakarida dimana gula ditambahkan oleh kinerja enzim glikosil transferase. Proteoglikan yang mampu melakukan glukosilasi secara mandiri dan mengkatalis permulaan biosintesis glikogen. Proteoglikan ini juga tahan terhadap perlakuan alkali.
2.2.2 Ekstraksi glikogen
Ekstraksi adalah proses penarikan komponen yang diinginkan dari suatu bahan dengan memisahkan satu atau lebih komponen dari bahan sumber komponennya (Khopkar 2003). Cara ekstraksi yang paling sering digunakan adalah maserasi. Prinsip dasar ekstraksi dengan maserasi adalah menarik
12
komponen terlarut pada bahan padat menggunakan suatu pelarut yang disebut
solid-liquid extraction (Handa 2008).
Bueding dan Orrell (1964) telah membandingkan hasil ekstraksi glikogen dengan alkali panas dan air dingin. Bobot molekul glikogen Ascaris lumbricoides
hasil isolasi air dingin 50 kali lebih tinggi daripada dengan alkali panas, residu protein ikutan pada ekstraksi alkali panas 5-10 kali lebih tinggi daripada ekstraksi air dingin. Sentrifugasi dengan kecepatan tinggi dan waktu yang lama dapat meningkatkan hasil atau perolehan glikogen karena komponen-komponen glikogen berbobot molekul rendah terambil atau terpisah dari supernatannya, sedangkan sentrifugasi yang lambat dan lama akan menyebabkan kehilangan komponen berbobot molekul lebih tinggi. Kerly (1930) melaporkan bahwa ekstraksi glikogen dengan metode alkali panas dapat menurunkan kadar pengotor glikogen yaitu residu nitrogen, namun menurut laporan Orrel dan Buedding (1964) dan Yamaguchi et al. (1974) juga dapat mendegradasi glikogen sehingga dapat menurunkan rendemen ekstrak.
Kerly (1930) melaporkan bahwa ekstrak glikogen remis yang diperoleh dari perlakuan tanpa perebusan dalam larutan alkali dengan kadar nitrogen 0,5% dapat melarut sempurna di dalam air pada suhu 20 oC setelah 3-4 hari hingga konsentrasi glikogen sekitar 16%. Sahyun dan Alsberg (1930) melaporkan bahwa glikogen memiliki sifat adesif yang sangat kuat bahkan terhadap permukaan yang licin seperti kaca, serta memiliki warna sedikit coklat (opalescence) dalam bentuk larutan.
Pengukuran residu nitrogen di dalam glikogen terekstrak dapat dilakukan dengan metode Kjeldahl. Nicoletti dan Baiocchi (1994) melaporkan karakteristik ekstrak glikogen yang dihasilkan dari Mytilus gallus Provincialis memiliki residu nitrogen 0% diukur dengan metode Kjeldahl (dengan sensitivitas hingga 60 ppm) dan kandungan atom karbonsebesar 44.44 %.
13
sumber bahan baku glikogen sehingga fenol-sulfat digunakan untuk pengujian kadar glukosa di dalam glikogen secara kuantitatif.
2.2.3 Sifat resin kationik (Davis 2010).
Pertukaran ion merupakan reaksi yang dapat berbalik (reversible reaction) dimana ion bermuatan dari suatu larutan ditukar oleh ion lain yang sama muatannya yang menempel pada suatu partikel padat yang tidak bergerak (immobile solid particle).
1) Kapasitas pertukaran
Kapasitas pertukaran adalah banyaknya ion-ion pembalas (counter ions) yang dapat ditukar pada resin, dinyatakan sebagai miliequivalen per gram (meq/g) resin kering (3,6-5,5 meq/g) atau resin basah (1,8-2,0 meq CaCO3/mL).
2) Selektivitas
Resin penukar ion memiliki afinitas atau variabel kecenderungan terhadap ion-ion tertentu di dalam larutan. Kecenderungan ini disebut juga selektivitas yang dinyatakan secara kuantitatif dengan koefisien selektivitas bagi kation atau konstanta keseimbangan nyata. Jika nilai koefisien selektivitas (K) semakin besar maka semakin besar pula kecenderungan ion tersebut dengan resin. Faktor keterpisahan (separation factor) atau αi lebih sering digunakan daripada koefisien selektivitas di dalam evaluasi rancangan proses, seperti ditunjukkan pada Tabel 1. Matriks resin adalah polistirena divinilbenzena (DVB) dengan gugus fungsional yaitu sulfonat diaplikasikan di dalam 0,005-0,010 N larutan CaCO3 dengan nilai
total dissolved solid (TDS) sebesar 250-500 mg/L. 3) Ukuran partikel
14
Tabel 1 Nilai faktor keterpisahan (separation factor) [αi ] beberapa kation
Resin kation asam kuat
4) Stabilitas struktural dan umur kerja
Aliran larutan bertekanan tinggi dapat menyebabkan himpitan bahkan kerusakan pada bangun resin sehingga menurunkan umur kerjanya. Penurunan integritas struktural dan unjuk kerja resin dapat pula disebabkan oleh pembengkakan, pecah karena tertusuk, atau abrasi karena pencucian yang berlebihan. Klorinasi terhadap resin DVB tersulfonasi asam kuat menyebabkan resin teroksidasi yang dapat menurunkan umur kerjanya. Konsentrasi besi dan mangan yang berlebihan di dalam air, jika teroksidasi, akan membentuk presipitat yang dapat membuat resin saling menempel dan melekat satu sama lain sehingga kadar besi, mangan, atau kombinasi keduanya tidak boleh lebih dari 0,3 mg/L air. Turbiditas air yang digunakan bagi resin kationik sebaiknya tidak lebih dari 5 NTU (nephelometric turbidity unit). Turbiditas menyatakan banyaknya partikel-partikel bahan tersuspensi seperti tanah, plankton, dan bahan organik. Turbiditas lebih dari 5 NTU dapat dengan mudah diamati dalam segelas air yang biasanya digunakan sebagai alasan estetika.
15
fungsional pada resin penukar ion umumnya terdiri dari 4 kategori yaitu strongly acidic (contohnya –SO3- atau sulfonat), weakly acidic (contohnya –COO- atau
karboksilat), strongly basic (contohnya –N+(CH3)3), dan weakly basic (contohnya –N(CH3)2). Karakteristik resin kationik Amberlite IR-120 Na disajikan pada
Tabel 2.
Tabel 2 Karakteristik resin kationik Amberlite IR-120 Na
Parameter Keterangan
Bentuk fisik Butiran berbentuk bulat kecil
Matriks Polistirena divinilbenzena
Gugus fungsional Sulfonat
Bentuk ion Na+
Kapasitas pertukaran ion total >2,00 eq/L Kapasitas penahan kelembaban 45-50%
Massa jenis 840 g/L
Diameter partikel 0,6-0,8 mm
Suhu operasi maksimum 135 oC
Kisaran pH operasi 0-14
Sumber : Product Data Sheet www.amberlite.com
2.3 Konsep Spektrophotometri Asam Nukleat
Sifat dan perilaku basa purin dan pirimidin dari suatu asam nukleat yang terdenaturasi digunakan sebagai dasar dalam pelacakan asam nukleat. Protein juga menyerap sinar ultraviolet dengan panjang gelombang 260 nm meskipun pada tingkat yang rendah tergantung pada kandungan asam amino aromatik fenilalanina (Phe), triptofan (Trp) dan tirosina (Tyr). Trp dan Tyr mampu menyerap sinar 280 nm secara maksimum (Adams et al. 1986).
2.3.1 Konsep pengukuran RNA-DNA
16
dari 1,2 terhadap sinar ultraviolet pada panjang gelombang 260 nm (Adams et al. 1986). Bartram et al. (2009) melaporkan bahwa penyinaran larutan
glikogen dengan ultraviolet selama 30 menit sebelum digunakan bertujuan menghancurkan kontaminan berupa asam nukleat.
Warburg dan Christian (1942) menyajikan tiga prinsip dasar untuk pengukuran RNA-DNA, yaitu :
1) Asam nukleat kuat menyerap sinar pada 260 nm, 2) Protein menyerap sinar pada 280 nm, dan
3) Asam nukleat atau protein menyerap sinar pada 320 nm
Rasio spesifik dari nilai absorbansi yang ditentukan dari tiga prinsip di atas dapat digunakan untuk menentukan kemurnian dan jenis asam nukleat dalam sampel. Rumusan yang digunakan untuk mengukur asam nukleat ialah asam nukleat atau pun protein menyerap sinar pada 320 nm, oleh karena itu panjang gelombang ini digunakan untuk memperbaiki pembacaan yang didapat pada 260 nm dan 280 nm. Nilai absorbansi sampel pada panjang gelombang 260 nm dan 280 nm masing-masing dikoreksi dengan nilai absorbansi pada panjang gelombang 320 nm.
2.3.2 Penghitungan kadar asam nukleat
Persamaan yang digunakan untuk menghitung kadar asam nukleat adalah sebagai berikut (Adams et al. 1986) :
Kadar asam nukleat (mg/mL) = (0,064 x A260 nm) - (0,031 x A280 nm)
Warburg dan Christian (1942) melaporkan bahwa nilai absorbansi 1,0 pada 260 nm dengan koreksi latar pada 320 nm, setara dengan 50 µg/mL DNA, 40 µg/mL RNA atau DNA beruntai tunggal, atau 33 µg/mL oligonukleotida sintetik. Jika suatu sampel DNA memiliki absorbansi 0,345 pada 260 nm, maka konsentrasi DNA adalah 17,25 µg/mL, perhitungannya : 0,345 x 50 = 17,25.
2.4 Glikogen sebagai Ko-presipitan Low Copy Number DNA
17
presipitasi DNA dengan ukuran kurang dari atau sama dengan 1 µg maka perlu ditambahkan suatu molekul ko-presipitan, karena selain dapat meningkatkan laju presipitasi, ko-presipitan yang ditambahkan dapat mempersingkat waktu yang dibutuhkan untuk mendapatkan asam nukleat dari larutannya. Glikogen dan
transfer ribonucleic acid (tRNA) adalah contoh ko-presipitan yang paling sering digunakan. Glikogen sebagai ko-presipitan dalam presipitasi DNA yang baik karena memiliki sifat kelarutan dan presipitasi yang mirip dengan DNA. Hal ini karena kerangka utama penyusun asam nukleat adalah ribosa atau deoksiribosa yang dihubungkan oleh ikatan phosphodiester sehingga asam nukleat maupun glikogen larut di dalam air dan terpresipitasi ketika konstanta dielektrik
diturunkan dengan penambahan alkohol. Glikogen sangat baik sebagai ko-presipitan karena bermuatan netral dan tidak menghambat reaksi enzimatis
pada asam nukleat, sedangkan tRNA dapat mempengaruhi beberapa reaksi enzimatis seperti dengan kinase.
19
3. METODE PENELITIAN
3.1 Waktu dan Tempat PenelitianPenelitian dilakukan dari bulan Februari 2011 hingga Januari 2012. Temilok diperoleh dari hutan mangrove Dusun Tanjung Batu, Kabupaten Bangka, Provinsi Kepulauan Bangka Belitung. Uji proksimat dilakukan di laboratorium Analisis dan Kalibrasi Balai Besar Industri Agro, Bogor. Proses ekstraksi glikogen dilakukan di laboratorium Biokimia I, Departemen Teknologi Hasil Perairan, Institut Pertanian Bogor (IPB). Karakterisasi glikogen terekstrak dilakukan di laboratorium Proling Departemen Manajemen Sumberdaya Perairan, IPB. Proses ekstraksi, presipitasi, dan kuantitasi DNA dilakukan di laboratorium DNA, Pusat Kedokteran dan Kesehatan Markas Besar Kepolisian Negara Republik Indonesia, Jakarta Timur.
3.2 Alat dan Bahan
Alat- alat yang digunakan dalam peneltian ini meliputi alat-alat dalam uji proksimat, alat-alat untuk ekstraksi glikogen metode alkali panas dan karakterisasi glikogen metode fenol-sulfat yang meliputi gelas kimia, gelas ukur, pipet volumetrik, labu ukur, tabung erlenmeyer, timbangan digital Sartorius TE 502S, thermometer, magnetic stirrer Yamato Mag Mixer MD-41, desikator vakum gel silika, spektrofotometer Shimadzu UV-1800 ENG 240V, serta alat-alat untuk ekstraksi, presipitasi dan kuantitasi DNA seperti laminary flow cabinet, biological safety cabinet 1.2 Top Safe, freezer U725 Innova-New Brunswick Scientific, tabung microlit, sentrifugasi 200-R, vortex Model VM-100 Digisystem, shaker waterbath Memmert, Real-Time Polymerase Chain Reaction (PCR) Applied Biosystems 7500.
Bahan utama yang digunakan dalam penelitian ini meliputi temilok yang diambil pada bulan Maret 2011, dan bahan-bahan lainnya yang digunakan untuk uji proksimat, akuades (dH2O), akuabides (ddH2O), KOH padat, etanol 96%,
20
terdiri dari campuran Tris-HCl 2 M pH 8, EDTA 0,5 M, NaCl, Sodium Dodecyl Sulphates[SDS], ddH2O), bufer TE pH 8, etanol absolut, Quantifiler Human
DNA Standard, Human Primer Mix, PCR Reaction Mix.
3.3 Prosedur Penelitian
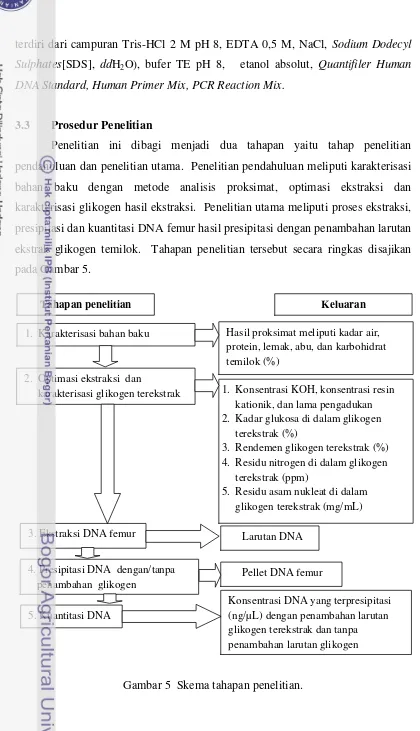
Penelitian ini dibagi menjadi dua tahapan yaitu tahap penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi karakterisasi bahan baku dengan metode analisis proksimat, optimasi ekstraksi dan karakterisasi glikogen hasil ekstraksi. Penelitian utama meliputi proses ekstraksi, presipitasi dan kuantitasi DNA femur hasil presipitasi dengan penambahan larutan ekstrak glikogen temilok. Tahapan penelitian tersebut secara ringkas disajikan pada Gambar 5.
Gambar 5 Skema tahapan penelitian.
Tahapan penelitian
1. Karakterisasi bahan baku
3. Ekstraksi DNA femur
1. Konsentrasi KOH, konsentrasi resin kationik, dan lama pengadukan 2. Kadar glukosa di dalam glikogen
terekstrak (%)
3. Rendemen glikogen terekstrak (%) 4. Residu nitrogen di dalam glikogen
terekstrak (ppm)
21
3.3.1 Karakteristik proksimat temilok (Metode SNI.01-2891-1992)
Kadar proksimat yang diuji meliputi air, abu, protein, lemak, dan karbohidrat (by difference). Glikogen adalah salah satu jenis karbohidrat, yaitu polisakarida yang terdiri dari unit terkecil (monosakarida) yaitu glukosa, oleh karena itu kadar karbohidrat yang dihitung dari hasil uji proksimat suatu bahan dapat dijadikan sebagai petunjuk awal kandungan glikogen di dalam bahan tersebut.
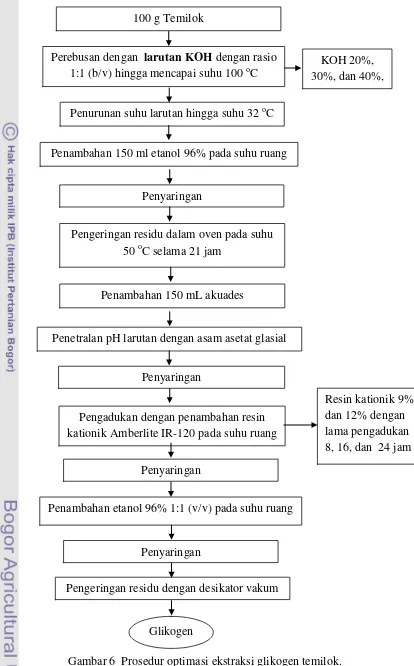
3.3.2 Optimasi ekstraksi glikogen temilok (modifikasi Metode Nicoletti dan Baiocchi 1994)
Ekstraksi glikogen temilok dilakukan dengan melakukan modifikasi proses ekstraksi glikogen metode Nicoletti dan Baiocchi. Optimasi proses yang dilakukan meliputi penentuan konsentrasi KOH (%), persentase resin kationik (%) yang digunakan, dan lama pengadukan (jam). Optimasi tersebut bertujuan untuk mendapatkan glikogen terekstrak dengan residu nitrogen dan asam nukleat yang terendah. Modifikasi proses yang dilakukan adalah konsentrasi etanol untuk mempresipitasi glikogen, suhu dan lama pengeringan presipitat glikogen kasar, serta volume pelarut (akuades) yang ditambahkan setelah pengeringan awal.
22
dikeringkan di dalam desikator vakum gel silika hingga diperoleh bobot tetap. Presipitat yang diperoleh kemudian ditimbang. Perbandingan antara bobot presipitat setelah pengeringan dan bobot awal bahan baku dihitung sebagai rendemen ekstrak glikogen temilok. Interaksi persentase resin kationik dan lama pengadukan yang optimal ditentukan setelah konsentrasi KOH optimal diperoleh, yaitu dengan percobaan konsentrasi resin kationik 9% dan 12% dengan lama pengadukan 8, 16, dan 24 jam. Resin kationik dipisahkan dari larutan dengan penyaringan menggunakan kertas saring. Prosedur optimasi ekstrasi glikogen temilok secara ringkas dapat dilihat pada Gambar 6.
3.3.3 Karakterisasi ekstrak glikogen (Bennett et al. 2007)
Karakterisasi ekstrak glikogen dilakukan untuk memastikan produk hasil ekstraksi adalah glikogen. Karakterisasi suatu bahan dapat dilakukan secara fisika, atau kimia, baik kualitatif maupun kuantitatif.
23
Gambar 6 Prosedur optimasi ekstraksi glikogen temilok. Penambahan 150 ml etanol 96% pada suhu ruang
Pengadukan dengan penambahan resin kationik Amberlite IR-120 pada suhu ruang
Penambahan 150 mL akuades Perebusan dengan larutan KOH dengan rasio
1:1 (b/v) hingga mencapai suhu 100 oC KOH30% selama 1 jam biarkan pada suhu
Penambahan etanol 96% 1:1 (v/v) pada suhu ruang
Pengeringan residu dengan desikator vakum Penyaringan
Penyaringan Penyaringan
Penetralan pH larutan dengan asam asetat glasial Pengeringan residu dalam oven pada suhu
50 oC selama 21 jam Penyaringan
Glikogen 100 g Temilok
Penurunan suhu larutan hingga suhu 32 oC
KOH 20%, 30%, dan 40%,
24
3.3.4 Aplikasi glikogen sebagai ko-presipitan DNA (Lennard et al. 2007)
Proses ekstraksi DNA femur dilakukan dengan menyiapkan bufer ekstraksi (campuran 50 µL Proteinase K 20 mg/mL, 1 mL bufer TENS, dan 6 mg DTT solid) lalu dikocok perlahan dengan inversi selama 5 detik. Sampel serbuk femur sebanyak 0,2 g ditimbang di dalam safe lock tube steril berukuran 2 mL, kemudian 1.000 µL larutan buffer ekstraksi ditambahkan ke dalam tiap tube yang berisi sampel serbuk femur, dan satu tube tanpa serbuk femur (sebagai blanko ekstraksi). Campuran yang dihasilkan kemudian divortex selama 10 detik dan sampel diinkubasi pada suhu 56 oC selama 20 jam dalam shaking water bath. Sampel disentrifugasi pada 3.000 rpm selama 5 menit hingga serbuk femur mengendap, lalu supernatan dipindahkan ke dalam safe lock tube steril berukuran 2 mL yang baru. Larutan PCIA sebanyak 800 µL ditambahkan ke dalam supernatan lalu dikocok dengan inversi selama 10 menit, dan disentrifugasi pada 5000 rpm selama 5 menit. Supernatan yang dihasilkan (bagian bening paling atas) diambil dari dalam tube dengan pipet volumetrik 200 µL. Langkah dari penambahan larutan PCIA hingga pengambilan supernatan hasil sentrifugasi diulang sebanyak 2 kali.
Presipitasi DNA femur hasil ekstraksi dilakukan dengan menambahkan 40 µL sodium asetat 3 M (pH 5,2) dan 20 µL larutan glikogen (20 µg glikogen dalam ddH2O hingga 1 µL) ke dalam 800 µL larutan DNA femur. Analisis
25
3.4 Metode Analisis
Analisis yang dilakukan dalam penelitian ini meliputi proksimat bahan baku, rendemen glikogen terekstrak, residu nitrogen di dalam glikogen terekstrak, residu asam nukleat di dalam glikogen terekstrak, dan kapasitas glikogen terekstrak sebagai ko-presipitan DNA dengan menghitung kuantitas DNA yang terpresipitasi menggunakan RT-PCR. Pengujian proksimat dilakukan secara duplo, sedangkan pengujian rendemen, residu nitrogen, residu asam nukleat dan kuantitas DNA hasil presipitasi dilakukan dengan 3 kali ulangan.
3.4.1 Analisis proksimat (Metode SNI.01-2891-1992) a) Kadar air
Sampel sebanyak 1–2 g ditimbang dengan seksama pada sebuah botol timbang bertutup yang sudah diketahui bobotnya. Botol yang dilengkapi dengan pengaduk dan pasir kuarsa/ kertas saring berlipat ditimbang untuk sampel berupa cairan. Sampel dikeringkan pada oven suhu 105 oC selama 3 jam, didinginkan dalam eksikator lalu ditimbang. Pekerjaan ini diulangi hingga diperoleh bobot tetap.
Perhitungan :
Kadar air = x 100% Keterangan :
W adalah bobot sampel sebelum dikeringkan, dalam gram. W1 adalah kehilangan bobot setelah dikeringkan, dalam gram.
b) Kadar abu
Sampel sebanyak 2-3 g ditimbang dengan seksama dalam sebuah cawan porselen (atau platina) yang telah diketahui bobotnya, untuk sampel cairan diuapkan di atas penangas air sampai kering lalu diarangkan di atas nyala pembakar. Pengabuan dilakukan dalam tanur listrik pada suhu maksimum 550 oC sampai pengabuan sempurna (sekali-kali pintu tanur dibuka sedikit, agar oksigen bisa masuk), selanjutnya didinginkan dalam eksikator, lalu ditimbang sampai bobot tetap.
Perhitungan :
26
Keterangan :
W adalah bobot sampel sebelum diabukan, dalam gram.
W1 adalah bobot sampel + cawan sesudah diabukan, dalam gram.
W2 adalah bobot cawan kosong, dalam gram.
c) Kadar protein
Sampel sebanyak 0,51 g ditimbang seksama dan dimasukkan ke dalam labu kjeldahl 100 mL, lalu ditambah dengan 2 g campuran selen (campuran 2,5 g serbuk SeO2, 100 g K2SO4 dan 30 g CuSO4.5H2O) dan 25 mL H2SO4 pekat.
Larutan dipanaskan di atas pemanas listrik atau api pembakar sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam). Larutan tersebut dibiarkan dingin, kemudian diencerkan dan dimasukkan ke dalam labu ukur 100 mL, lalu ditepatkan sampai tanda garis. Larutan tersebut dipipet sebanyak 5 mL kemudian dimasukkan ke dalam alat penyuling tambahkan 5 mL NaOH 30% dan beberapa tetes indikator PP untuk kemudian disulingkan selama lebih kurang 10 menit. Sebanyak 10 mL larutan asam borat 2% yang telah dicampur indikator digunakan sebagai penampung. Ujung pendingin dibilas dengan air suling. Penitaran dilakukan dengan larutan HCl 0,01 N, lalu penetapan blanko dikerjakan.
Perhitungan :
Kadar protein =
Keterangan :
W adalah bobot sampel.
V1 adalah volume HCl 0,01 N yang dipergunakan penitaran sampel.
V2 adalah volume HCl yang dipergunakan penitaran blanko.
N adalah normalitas HCl.
fk adalah protein dari makanan secara umum 6,25. fp adalah faktor pengenceran.
d) Kadar lemak
27
tidak bereaksi dengan asam lagi. Kertas saring berikut isinya dikeringkan pada suhu 100–105 oC lalu dimasukkan ke dalam kertas saring pembungkus (paper thimble) dan diekstrak dengan heksana atau pelarut lemak lainnya 2-3 jam pada suhu lebih kurang 80 oC. Larutan heksana atau pelarut lemak lainnya disulingkan dan ekstrak lemak dikeringkan pada suhu 100–105 oC lalu didinginkan dan ditimbang. Pengeringan ini diulangi hingga tercapai bobot tetap.
Perhitungan :
Kadar lemak = x 100%
Keterangan :
W adalah bobot sampel, dalam gram.
W1 adalah bobot labu lemak sesudah ekstraksi, dalam gram.
W2 adalah bobot labu lemak sebelum ekstraksi, dalam gram.
e) Kadar karbohidrat
Kadar karbohidrat dihitung by difference berdasarkan hasil pengurangan 100% dengan total persentase kadar air, abu, protein, dan lemak.
3.4.2 Analisis rendemen glikogen terekstrak (AOAC 1995)
Sampel glikogen terekstrak yang telah dikeringkan di dalam desikator vakum gel silika ditimbang hingga dicapai bobot tetap. Bobot sampel tersebut dibandingkan dengan bobot bahan baku awal, keduanya dengan satuan gram. Perhitungan :
Rendemen = x 100%
3.4.3 Analisis residu nitrogen (Winarno 2002)
Sampel sebanyak 1 g dimasukkan ke dalam labu kjeldahl 100 mL, lalu tambahkan 10 mL H2SO4 pekat. Sampel kemudian didestruksi selama 60 menit
sampai cairan berwarna hijau jernih lalu dibiarkan hingga dingin. Larutan tersebut kemudian ditambah dengan 35 mL air suling dan 10 mL NaOH pekat sampai warna coklat kehitaman, lalu didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 mL yang berisi H3BO3 dan indikator, lalu dititrasi dengan HCl
28
% N =
x 100%
3.4.4 Analisis kadar glukosa di dalam glikogen (Bennett et al. 2007)
Sampel ekstrak glikogen ditimbang sebanyak 8 mg lalu dilarutkan ke dalam akuades hingga volume larutan menjadi 10 ml. Konsentrasi larutan glikogen yang terbentuk adalah 800 ppm. Sebanyak 0,5 ml dari larutan tersebut ditambahkan 1 ml larutan fenol dengan konsentrasi 5% lalu divortex selama 10 detik, kemudian ditambah dengan 5 ml larutan H2SO4 pekat dan divortex lagi
selama 15 detik. Larutan tersebut diinkubasi selama 30 menit pada suhu ruang. Absorbansi larutan diukur dengan alat spektrofotometer pada panjang gelombang 490 nm.
Kurva standar untuk menghitung kadar glukosa di dalam glikogen terekstrak dibuat dengan melarutkan glukosa menjadi 5 konsentrasi berbeda yaitu 50, 100, 150, 200, dan 250 ppm. Sebanyak 0,5 ml dari setiap konsentrasi tersebut ditambah 1 ml larutan fenol dengan konsentrasi 5% lalu divortex selama 10 detik, kemudian ditambah dengan 5 ml larutan H2SO4 pekat dan divortex lagi selama
15 detik. Larutan tersebut diinkubasi selama 30 menit pada suhu ruang. Absorbansi larutan diukur dengan alat spektrofotometer pada panjang gelombang 490 nm. Hubungan antara konsentrasi (x) dan absorbansi (y) disajikan dalam bentuk persamaan regresi linear.
3.4.5 Analisis residu asam nukleat (Adams et al. 1986)
Ekstrak glikogen yang telah dikeringkan di dalam desikator vakum gel silika kemudian ditimbang untuk mengukur rendemennya. Ekstrak glikogen tersebut lalu dilarutkan di dalam ddH2O (akuabides) menjadi larutan 2% untuk
mengukur kadar asam nukleatnya (mg/mL) dengan spektrofotometer.
29
Kadar asam nukleat di dalam larutan glikogen 2% (mg/mL) ditentukan dengan persamaan:
[Asam nukleat] = [(0,064x[A260 -ABlanko]-[A320-ABlanko]-(0,031x[A280-ABlanko]-[A320-ABlanko])]
3.4.6 Analisis DNA terpresipitasi (Lennard et al. 2007)
Kapasitas glikogen temilok hasil ekstraksi sebagai ko-presipitan diukur berdasarkan konsentrasi DNA femur hasil presipitasi menggunakan RT-PCR dengan satuan ng/µL. Kuantitas DNA hasil presipitasi tanpa penambahan larutan ekstrak glikogen (blanko) dibandingkan dengan kuantitas DNA yang diperoleh dari penambahan larutan ekstrak glikogen.
Konsentrasi stok glikogen standar yang secara komersial digunakan sebagai ko-presipitanDNA adalah 2% di dalam akuabides bebas nuklease. Rasio antara bobot glikogen dengan volume campuran dari larutan glikogen, larutan DNA, dan sodium asetat umumnya berkisar antara 0,05 µg/µL hingga 1,00 µg/µL (Fermentas 2011). Rasio tersebut di dalam percobaan ini adalah 0,465 µg/µL sehingga larutan glikogen 2% yang ditambahkan (di dalam campuran sebelum presipitasi etanol) sebanyak 20 µL untuk setiap 800 µL larutan DNA, dan 40 µL sodium asetat (sebagai monovalen kationik). Campuran tersebut kemudian ditambah dengan 1100 µL etanol absolut.
Kuantitasi DNA hasil presipitasi yang dilakukan dengan mencampur 241,5 µL larutan Human Primer Mix dan 287,5 µL PCR Reaction Mix menjadi
Quantifiler Master Mix , lalu dimasukkan ke dalam 23 well sebanyak 23 µL/ well
sesuai dengan posisi yang telah ditentukan (Lampiran 1a) menggunakan
micropipet volumetrik. Larutan standar DNA manusia dibuat dengan 8 konsentrasi berbeda (Lampiran 1b) untuk membuat kurva standar. Larutan
standar DNA manusia sebanyak 2 µL ditambahkan ke dalam 16 well yang masing-masing berisi 23 µL Quantifiler Master Mix. Sampel larutan DNA sebanyak 2 µL ditambahkan ke dalam 6 well yang berisi masing-masing 23 µL
Quantifiler Master Mix. Larutan blanko ekstraksi sebanyak 2 µL ditambahkan ke dalam satu well extraction control (EC) yang berisi 23 µL Quantifiler Master Mix. Dua well yang tersisa adalah Non Template Control (hanya berisi bufer TE). Well
30
3000 rpm, lalu dimasukkan ke dalam RT-PCR selama kurang lebih 1 jam, dengan
thermal profile sebagai berikut :
a) Tahap ke-1 (denaturation), suhu 95 oC selama 10 menit sebanyak satu siklus. b) Tahap ke-2 (annealing), suhu 95 oC selama 15 detik dan suhu 60 oC selama 1
menit sebanyak 40 siklus.
3.5 Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan di dalam penelitian ini terdiri dari : 1) Rancangan Acak Lengkap dengan faktor konsentrasi KOH pada taraf 20%,
30%, dan 40%. Resin kationik yang digunakan sebanyak 6% (3 kali ulangan) per 100 gram daging temilok dengan pengadukan selama 24 jam. Data yang diamati dari 3 satuan percobaan ini adalah rataan residu nitrogen ekstrak glikogen. Percobaan ini dilakukan untuk menentukan konsentrasi KOH pada percobaan selanjutnya. Model observasi untuk perlakuan konsentrasi KOH (Steel 1989) :
glikogen atau residu nitrogen ekstrak glikogen temilok.
H1 : µ1 ≠ µ2, atau taraf konsentrasi KOH mempengaruhi rendemen glikogen
atau residu nitrogen ekstrak glikogen temilok.
ko-31
presipitan DNA femur. Model observasi untuk perlakuan persentase resin kationik dan lama pengadukan (Montgomery 2001) :
Yijk = µ + τi + βj + (τβ)ij +εijk
Keterangan :
Yijk = rendemen glikogen atau residu asam nukleat glikogen karena pengaruh lama pengadukan taraf ke-i, persentase resin kationik Amberlite IR-120 taraf ke-j, satuan percobaan ke-k.
µ = rataan umum rendemen glikogen atau residu asam nukleat glikogen hasil ekstraksi.
τi = rendemen glikogen atau residu asam nukleat glikogen karena
pengaruh lama pengadukan taraf ke-i
βj = rendemen glikogen atau residu asam nukleat glikogen karena
pengaruh persentase resin kationik Amberlite IR-120 taraf ke-j. (τβ)ij = Rendemen glikogen atau residu asam nukleat glikogen karena
pengaruh interaksi lama pengadukan dan persentase resin kationik Amberlite IR-120 taraf ke-ij.
εijk = pengaruh selain perlakuan yang acak dan menyebar normal.
Hipotesis uji meliputi :
H0: (αβ)11=( αβ)12=…=( αβ)ij= 0, atau interaksi perlakuan lama pengadukan dan
persentase resin kationik Amberlite IR-120 tidak mempengaruhi rendemen glikogen atau residu asam nukleat glikogen.
H1: (αβ)ij≠0, atau sedikitnya ada satu pasang interaksi perlakuan lama
pengadukan dan persentase resin kationik Amberlite IR-120 yang mempengaruhi rendemen glikogen atau residu asam nukleat glikogen. Jika hasil analisis ragam menunjukkan nilai F hitung > F tabel atau H0 ditolak
maka analisis dilanjutkan dengan Uji Beda Nyata Jujur dengan model uji (Steel 1989):
W = qα (p,dbg) Sy
Keterangan :
Sy = galat baku nilai tengah dari akar kuadrat dari KTG/r
dbg = derajat bebas galat p = jumlah perlakuan
qα = nilai pada tabel Tukey pada taraf nyata α.
Dari uji lanjut di atas diperoleh perlakuan lama pengadukan dan persentase resin kationik Amberlite IR-120 yang menghasilkan ekstrak glikogen temilok terbaik. 3) Rancangan Perbandingan Berganda (paired comparison design) dengan
32
penambahan larutan ekstrak glikogen temilok yang terbaik sebanyak 2% dan tanpa penambahan larutan ekstrak glikogen (blanko) masing-masing sebanyak 3 kali ulangan. Model observasi untuk menguji kapasitas ko-presipitan glikogen terhadap DNA femur dilakukan uji perbandingan berganda (Montgomery 2001) :
Yij = µi + βj + εij i = 1, 2 dan j = 1,2,3
Keterangan :
Yij = konsentrasi DNA femur pada larutan glikogen ke-i, ulangan ke-j.
µi = rataan umum konsentrasi DNA femur karena larutan glikogen ke-i. j = pengaruh ulangan ke-j.
εij = pengaruh selain perlakuan yang acak dan menyebar normal.
Hipotesis uji meliputi :
H0 : µ1 = µ2, atau penambahan glikogen tidak mempengaruhi presipitasi DNA
femur
33
4.
HASIL DAN PEMBAHASAN
4.1 Karakteristik Proksimat Temilok (Bactronophorus thoracites)
Hasil uji proksimat temilok memberikan informasi awal tentang karakteristik temilok sebagai bahan baku ekstraksi glikogen. Analisis terhadap karakteristik bahan baku dibutuhkan dalam modifikasi proses ekstraksi dengan alkali panas. Modifikasi proses ekstraksi dilakukan untuk menghasilkan glikogen pada tingkat yang paling ekonomis, khususnya glikogen untuk aplikasi di bidang biologi molekuler. Informasi mengenai kandungan karbohidrat sebagai indikasi awal kandungan glikogen yang terkandung di dalam temilok disajikan pada Tabel 3.
Tabel 3 Proksimat temilok utuh
34
metode alkali panas. Protein yang terdenaturasi memudahkan glikogen terekstrak lebih banyak dari jaringan daging temilok.
Kadar protein temilok dari hasil penelitian ini yaitu 4,11%. Syaputra et al.
(2007) melaporkan bahwa temilok segar mengandung protein sebesar 4,29%. Kadar protein temilok dari dua penelitian tersebut memiliki nilai yang hampir sama karena sampel bahan baku diambil pada musim dan lokasi yang sama, yaitu pada musim penghujan di kawasan hutan mangrove Dusun Tanjung Batu, Kabupaten Bangka. Pengujian proksimat temilok di dalam penelitian ini dilakukan dengan terlebih dahulu membuang isi saluran pencernaan temilok, lalu mencucinya sehingga sebagian besar plankton dan bakteri dihilangkan. Hal ini dilakukan agar protein yang berasal dari bakteri pada insang atau plankton dalam saluran pencernaan temilok tidak terhitung sebagai kadar protein temilok. Distel et al. (2002) melaporkan bahwa kerang pengebor kayu memperoleh sumber nitrogen dari fiksasi dinitrogen (N2) yang dilakukan oleh bakteri endosimbion
yang hidup di dekat kelenjar deshayes insang. Leiwakabessy (2011) melaporkan bahwa kadar protein tambelo segar (Bactronophorus thoracites) adalah 7,31%. Komposisi asam amino penyusun protein temilok disajikan pada Lampiran 2.
Kadar lemak temilok yang digunakan dalam penelitian ini yaitu 0,82%. Kadar lemak temilok yang rendah mempersingkat prosedur ektraksi karena tidak membutuhkan perlakuan khusus untuk memisahkan atau mengurangi residu lemak dari glikogen terekstrak. Kadar lemak temilok yang relatif rendah ini sangat menguntungkan dalam ekstraksi glikogen dengan alkali panas karena gliserol dan sabun yang larut ke dalam air menjadi sedikit. Leiwakabessy (2011) melaporkan bahwa kadar lemak temilok sekitar 0,3%.
35
Lemak dapat larut di dalam alkohol panas (Poedjiadi & Suryanti 2006), oleh karena itu di dalam proses presipitasi glikogen, etanol yang digunakan harus dingin, dan dengan konsentrasi tinggi yaitu 96% untuk menghindari terjadinya pelarutan gliserol dan sabun di dalam glikogen terekstrak. Residu lemak pada glikogen terekstrak juga dapat memicu reaksi oksidasi sehingga menurunkan mutu glikogen.
Kayu bakau biasanya mengandung selulosa sebesar 46,5% dan lignin sebesar 28,8% (Marthawijata et al. 1989). Kadar karbohidrat temilok sekitar 18% berasal dari kandungan glikogen yang disimpan sebagai cadangan energi. Menurut Syaputra et al. (2007), kadar karbohidrat temilok sekitar 17%. Leiwakabessy (2011) melaporkan bahwa kadar karbohidrat tambelo segar sekitar 7,7%. Distel et al. (2002) juga melaporkan bahwa sejumlah bakteri endosimbion gram negatif dengan satu flagela, yaitu Teredinibacter turnerae yang hidup di dalam insang kerang-kerangan famili teredinidae mensekresi enzim pendegradasi xilan, pektin, dan selulosa. Bakteri simbion ini juga berperan sebagai penyedia sumber nitrogen dalam metabolisme dan biosintesis protein karena kemampuannya dalam memfiksasi dinitrogen (N2) dari atmosfer.
Bahan baku ekstraksi glikogen dari hasil perairan umumnya masih menggunakan spesies kerang sumber protein bernilai ekonomis relatif tinggi seperti tiram dan remis. Pemanfaatan temilok sebagai alternatif bahan baku ekstraksi glikogen adalah solusi bagi permasalahan ini karena kadar proteinnya relatif rendah. Leiwakabessy (2011) melaporkan bahwa skor asam amino esensial
36
4.2 Optimasi Ekstraksi Glikogen
Hasil analisis data proksimat temilok menjadi informasi dasar bagi tahapan penelitian selanjutnya yaitu optimasi ekstraksi glikogen. Optimasi ekstraksi glikogen diukur berdasarkan rendemen glikogen dan residu pengotornya.
4.2.1 Pengaruh konsentrasi potasium hidroksida (KOH)
Protein yang terikat dengan gugus non protein disebut protein gabungan atau terkonjugasi. Apabila gugus non protein (gugus prostetik) suatu protein gabungan terdiri dari karbohidrat, maka molekul ini dinamakan glikoprotein (untuk kadar heksoamina kurang dari 4%), dan mukoprotein (untuk kadar heksoamina lebih dari 4%). Mukoprotein ini tidak mudah terdenaturasi oleh panas atau diendapkan oleh zat-zat yang biasanya dapat mengendapkan protein (Poedjiadi & Supriyanti 2006). Ekstraksi glikogen dari jaringan tubuh hewan perlu mempertimbangkan pengaruh struktur gabungan tersebut sehingga residu protein merupakan salah satu indikator mutu dalam optimasi ekstraksi glikogen temilok.
Protein sensitif terhadap basa dengan konsentrasi tinggi. Gugus NH3+
pada asam amino yang mengandung H+ diikat oleh ion OH- yang konsentrasinya tinggi (Poedjiadi & Supriyanti 2006). Konsentrasi KOH yang digunakan dalam proses ekstraksi glikogen merupakan salah satu faktor yang mempengaruhi residu nitrogen glikogen hasil ekstraksi. Residu nitrogen yang rendah di dalam ekstrak glikogen merupakan salah satu indikator mutu glikogen sehingga penentuan konsentrasi KOH pada tahap awal ekstraksi penting dilakukan untuk menghasilkan ekstrak glikogen dengan residu nitrogen yang paling rendah. Pengaruh perlakuan konsentrasi KOH 20%, 30% dan 40% terhadap residu nitrogen (ppm) ekstrak glikogen temilok disajikan pada Gambar 7.
37
tergolong glikogen murni. Matsui et al. (1996) melaporkan bahwa glikogen
murni dalam kondisi alaminya mengandung protein kurang dari 1,1%. Hastings dan Kirby (1966) melaporkan bahwa larutan yang mengandung
campuran DNA, glikogen, dan protein dengan kadar protein 0,2% memiliki nilai absorbansi rasio 260 nm dan 280 nm sebesar 1,92. Nedel et al. (2009) melaporkan bahwa larutan DNA dengan rasio nilai absorbansi pada 260 nm dan 280 nm sebesar 1,7-2,0 digolongkan sebagai DNA yang bersih (clean DNA).
Gambar 7 Residu nitrogen (ppm) ekstrak glikogen temilok dengan perlakuan konsentrasi KOH 20% , 30% , 40% .
Perlakuan perebusan dengan KOH 20% menghasilkan ekstrak glikogen dengan residu nitrogen sekitar 2.700 ppm (0,27%) dan tidak berbeda nyata dengan perlakuan KOH 30% dengan residu nitrogen sekitar 0,21% pada taraf 0,05 (Lampiran 3). Residu nitrogen yang masih tinggi pada perlakuan KOH 20% dan 30% berasal dari pecahan membran sel temilok. Wanson dan Tielemans (1971) menemukan pecahan membran sel di antara partikel glikogen yang telah dimurnikan yang diekstrak dari sel darah putih kelinci.
Penelitian lainnya yang dilakukan oleh Nicoletti dan Baiocchi (1994) melaporkan bahwa perebusan 1.000 gram daging remis di dalam 1 liter larutan KOH 30% tanpa disertai penambahan resin kationik dan pengadukan menghasilkan ekstrak glikogen dengan residu nitrogen hingga 0,18%, sedangkan dengan penambahan 1:1 (b/b) resin kationik terhadap ekstrak glikogen disertai pengadukan menghasilkan glikogen tanpa residu nitrogen (dengan sensivitas metode pengukuran 60 ppm). Perebusan temilok dengan konsentrasi KOH 40% efektif menurunkan residu nitrogen ekstrak glikogen temilok. Bernie et al. (2009)

![Tabel 1 Nilai faktor keterpisahan (separation factor) [αi ] beberapa kation](https://thumb-ap.123doks.com/thumbv2/123dok/668578.448573/40.595.73.479.81.838/tabel-nilai-faktor-keterpisahan-separation-factor-beberapa-kation.webp)