OPTIMASI BA/TDZ DAN NAA UNTUK PERBANYAKAN MASAL NENAS (Ananas comosus L. (Merr) KULT1VAR SMOOTH CAYENNE
MELALUI TEKNIK IN VITRO
ROSMAINA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
OPTIMASI BA/TDZ DAN NAA UNTUK PERBANYAKAN MASAL NENAS (Ananas comosus L. (Merr) KULTIVAR SMOOTH CAYENNE
MELALUI TEKNIK IN VITRO
ROSMAINA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRACT
ROSMAINA. BA/TDZ and NAA optimized for Rapid mass propagation of Pineapple (Ananas comosus L. (Merr)) cv. Smooth Cayenne through In-vitro culture.Under supervision of SOBIR and DARDA EFENDI.
The objectives of this research are to study the effect of BA or TDZ and its combination with NAA on multiplication; rooting and explants survive during acclimatization, and to obtain optimum concentration for uniform multiplication of pineapple cv Smooth Cayenne. The research was divided into two experiments: a) experiment to optimize BA and NAA, BA concentration consist of 0.00 µM, 4.44 µM, 8.88 µM, 13.32 µM, and 17.76 µM and NAA concentration consist of 0.00 µM, 0.50 µM, 1.00 µM and 2.00 µM. b) Experiment to optimize TDZ and NAA, TDZ concentration consist of 0.00 µM, 0.05 µM, 0.10 µM, 0.50 µM, 1.00 µM and 2.00 µM and NAA concentration consist of 0.00 µM, 0.50 µM, 1.00 µM and 2.00 µM. The experiments were conducted in completely randomized design with two factorial treatments. The results showed that BA treatment produced better explants than TDZ treatment does. The best treatment is 8.88 µM BA + 0.50 µM NAA with high multiplication rate, rooting, uniform plantlet and survive during acclimatization. All TDZ treatments could not produce high quality explants because explants showed necrosis symptoms after second subcultures.
ABSTRAK
ROSMAINA. Optimasi BA/TDZ dan NAA untuk perbanyakan masal Nenas (Ananas comosus L. (Merr) Smooth Cayenne melalui teknik In-Vitro. Di bawah bimbingan SOBIR dan DARDA EFENDI.
Tujuan penelitian ini adalah untuk mempelajari pengaruh BA atau TDZ dan kombinasinya dengan NAA terhadap multiplikasi, pengakaran dan eksplan survive selama aklimatisasi, dan untuk memperoleh konsentrasi optimum untuk perbanyakan seragam nenas kultivar Smooth Cayenne. Penelitian ini dibagi ke dalam dua percobaan: a) percobaan untuk optimasi BA dan NAA, konsentrasi BA terdiri dari 0.00 µM, 4.44 µM, 8.88 µM, 13.32 µM, dan 17.76 µM dan konsentrasi NAA terdiri dari 0.00 µM, 0.50 µM, 1.00 µM dan 2.00 µM. b) Percobaan untuk optimasi TDZ dan NAA, konsentrasi TDZ terdiri dari 0.00 µM, 0.05 µM, 0.10 µM, 0.50 µM, 1.00 µM dan 2.00 µM dan konsentrasi NAA terdiri dari 0.00 µM, 0.50 µM, 1.00 µM dan 2.00 µM. Percobaan ini menggunakan rancangan acak lengkap dengan dua faktor. Hasil percobaan kami menunjukkan bahwa perlakuan BA menghasilkan eksplan yang lebih bagus daripada eksplan yang diberi perlakuan TDZ. Perlakuan yang paling baik adalah 8.88 µM BA + 0.50 µM NAA dengan tingkat multiplikasi dan pengakaran yang tinggi, planlet yang seragam dan
survive selama aklimatisasi. Semua perlakuan TDZ tidak dapat menghasilkan eksplan yang berkualitas tinggi karena eksplan menunjukkan gejala nekrosis setelah subkultur kedua.
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa Tesis yang berjudul Optimasi BA/TDZ dan NAA Untuk Perbanyakan Cepat Nenas (Ananas comosus L. (Merr)
Smooth Cayenne Melalui Teknik In-Vitro adalah karya saya sendiri di bawah Bimbingan Dr. Ir. Sobir, M.Si dan Dr. Ir. Darda Efendi, M.Si belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang
berasal atau dikutip dari karya yang diterbitkan mau pun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di
bagian akhir Tesis ini.
Bogor, Juni 2007
Rosmaina
Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
Judul Tesis : Optimasi BA/TDZ dan NAA untuk perbanyakan masal Nenas (Ananas comosus L. (Merr) Smooth Cayenne melalui teknik In-Vitro.
Nama : Rosmaina
NIM : A351030201
Disetujui Komisi Pembimbing
Dr. Ir. Sobir, M.Si Dr. Ir. Darda Efendi, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Satriyas Il yas, MS Prof. Dr. Ir. Khairil Notodiputro, MS
PRAKATA
Bismillahirrahmaanirrahiim,
Segala puji dan syukur hanyalah untuk Allah SWT yang dengan kemurahan–Nya senantiasa menyiapkan kemudahan di balik setiap kesulitan,
menjadikan kenikmatan dalam setiap kemudahan, serta pelajaran di balik setiap kesulitan, sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih
dalam penelitian adalah Optimasi BA/TDZ dan NAA untuk perbanyakan cepat Nenas (Ananas comosus L. (Merr) Smooth Cayenne melalui teknik In-Vitro
Penulis menyampaikan terima kasih kepada :
1. Dr. Ir. Sobir, M.Si. dan Dr. Ir. Darda Efendi M.S selaku pembimbing yang
telah memberi kepercayaan dan bimbingan serta nasehat yang sangat berharga kepada penulis selama penelitian dan penyusunan tesis ini.
2. Dr. Ir. Agus Purwito, M.Sc. selaku penguji luar komisi.
3. Dr. Ir. Satriyas Ilyas, MS selaku ketua program studi agronomi dan seluruh dosen program studi agronomi yang selalu memberi dukungan.
4. Pimpinan Sekolah Tinggi Ilmu Pertanian Gunung Leuser yang telah memberikan kesempatan dan ijin untuk mengikuti program S2 di IPB. 5. Pemerintah Daerah Kabupaten Gayo Lues yang telah memberi ijin dan
bantuan dana selama mengikuti program S2 di IPB.
6. Pemerintah daerah Nangroe Aceh Darussalam atas bantuan dana pendidikan selama mengikuti program S2 di IPB.
7. Bapak dan Ibu tercinta, dengan rasa hormat dan cinta yang dalam penulis sampaikan terima kasih yang tak terhingga atas segenap kasih sayang, jerih payah, dan doa yang tiada putus-putusnya untuk menjadi sumber semangat
dan kekuatan bagi penulis. Juga untuk kedua adikku (Saidi Bahri dan Efan Efendi) dan seluruh keluarga yang telah ikut berbagi rasa dan memberikan
dukungan kepada penulis.
8. Mbak Lasih, Pipit, Luluk, Nunung, Mika, Endang, Esto, dan Iis, yang telah
banyak membantu selama penelitian
9. Bu Liza, dan Pak Arif teman seperjuangan selama penelitian, tetap
10.Suamiku tercinta (Zulfahmi, M. Si) dan anakku (Nazwa Aini Rofa), terima kasih atas semua cinta, kasih sayang, doa dan motivasi yang telah diberikan. 11.Kepala Pusat Kajian Buah-buahan Tropika dan seluruh staf yang telah
memberi bantuan dana, penggunaan fasilitas laboratorium selama melakukan penelitian.
12.Terima kasih kepada semua pihak yang telah membantu dengan tulus, semoga Allah SWT membalas dengan pahala yang dilipatgandakan.
Semoga karya kecil ini dapat bermanfaat.
Alhamdulillahirrabbil’alamiin.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Kotacane, pada tanggal 12 Juli 1979 sebagai anak pertama dari pasangan Bukhari dan Henny. Penulis menikah dengan Zulfahmi, M.Si dan telah dikaruniai seorang putri (Nazwa Aini Rofa). Pada tahun 1998 Penulis diterima di Institut Pertanian Bogor melalui Jalur Undangan Seleksi Masuk IPB (USMI) pada program studi Pemulian Tanaman, Fakultas Pertanian IPB dan lulus pada tahun 2003. Pada tahun yang sama Penulis diterima sebagai mahasiswa Pascasarjana IPB pada program studi Agronomi. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional Republik Indonesia, dan lulus pada tahun 2007.
Tahun 2003 Penulis bekerja sebagai staf pengajar di fakultas pertanian Sekolah Tinggi Ilmu Pertanian Gunung Leuser dan sejak tahun 2004 diterima
DAFTAR ISI
Halaman
DAFTAR TABEL... iii
DAFTAR GAMBAR ... v
1. PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 4
1.3 Tujuan penelitian ... 4
1.4 Hipotesis... 5
2. TINJAUAN PUSTAKA ... 6
2.1 Klasifikasi tanaman nenas ... 6
2.2 Morfologi tanaman nenas ... 8
2.3 Persyaratan tumbuh tanaman nenas ... 9
2.4 Bahan perbanyakan tanaman nenas... 10
2.5 Perbanyakan in-vitro ... 12
2.6 Kultur jaringan nenas ... 13
2.7 Zat pengatur tumbuh ... 14
3. BAHAN DAN METODE ... 18
3.1 Tempat dan waktu ... 18
3.2 Bahan dan alat ... 18
3.3 Metode penelitian ... 18
3.3.1 Pengaruh BA dan NAA terhadap regenerasi dan multiplikasi nenas kultivar Smooth Cayenne klon Curug Rendeng in vitro ... 18
3.3.2 Pengaruh TDZ dan NAA terhadap regenerasi dan multiplikasi nenas kultivar Smooth Cayenne klon Curug Rendeng in vitro ... 20
4. HASIL DAN PEMBAHASAN ... 22
4.1 Pengaruh BA dan terhadap regenerasi dan multiplikasi nenas Smooth Cayenne klon Curug Rendeng ... 22
4.1.1 Kondisi umum kultur ... 22
4.1.2 Regenerasi dan multiplikasi pada subkultur 1, subkultur 2, dan subkultur 3. ... 23
4.1.2.1 Regenerasi ... 23
4.1.2.2 Multiplikasi ... 28
4.1.2.3 Tunas ... 29
4.1.2.4 Nodul ... 32
4.1.2.5 Proporsi tunas terhadap nodul ... 34
4.1.3 Pengaruh perlakuan BA dan NAA pada media dasar MS ... 36
4.1.4 Pengaruh subkultur 1 dan subkultur 2 pada media pengakaran ... 40
4.1.5 Aklimatisasi subkultur 1 dan subkultur 2 ... 46
4.2 Pengaruh TDZ dan NAA terhadap multiplikasi nenas Smooth Cayenne klon Curug Rendeng ... 50
4.2.1 Kondisi umum kultur ... 50
4.2.2 Regenerasi dan multiplikasi ... 50
4.2.2.1 Tunas ... 50
4.2.2.2 Nodul ... 53
4.2.2.3 Proporsi jumlah tunas terhadap jumlah nodul ... 54
4.2.3 Pengaruh perlakuan TDZ dan NAA pada media dasar MS .... 56
4.2.4 Pengaruh perlakuan TDZ dan NAA pada media pengakaran . 58 4.2.5 Aklimatisasi perlakuan TDZ dan NAA... 61
4.3 Pembahasan umum... 62
5. SIMPULAN DAN SARAN ... 70
5.1 Simpulan ... 70
5.2 Saran... 70
DAFTAR TABEL
Halaman
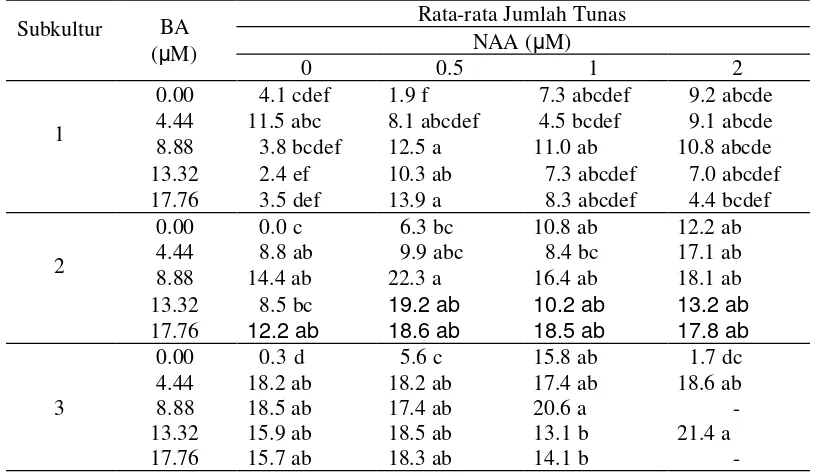
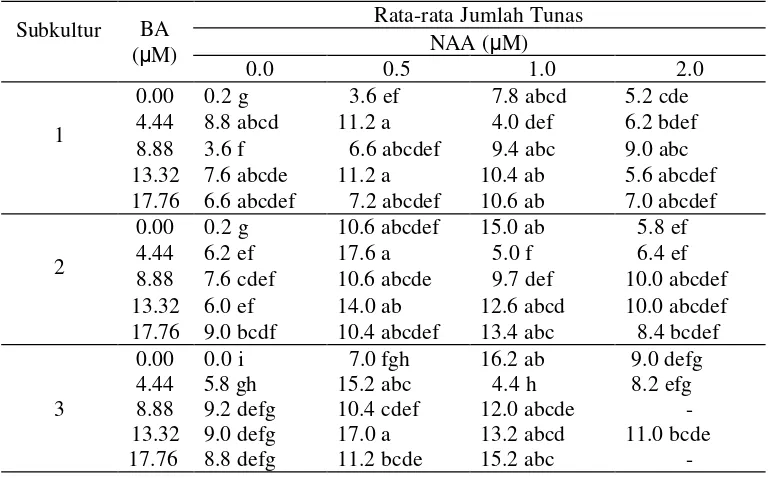
1. Kondisi tunas dan nodul pada subkultur 1, subkultur 2 dan subkultur 3
dari perlakuan BA dan NAA ... 25
2. Rekapitulasi hasil analisis ragam jumlah tunas dan nodul yang dihasilkan pada 5 MST ... 29
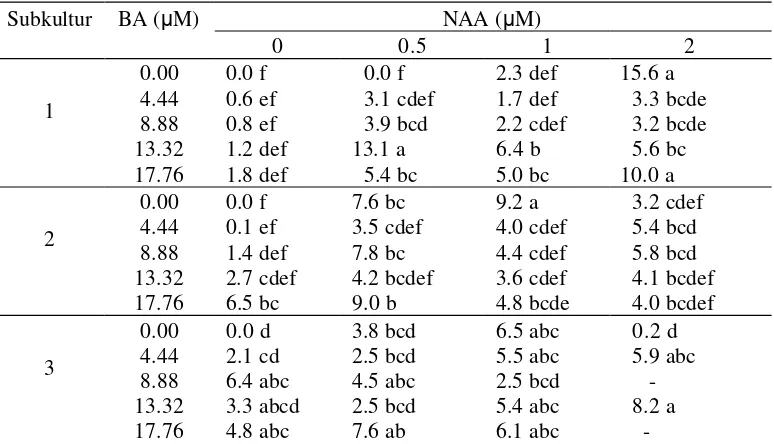
3. Jumlah tunas subkultur 1, subkultur 2, dan subkultur 3 pada 5 MST ... 29 4. Jumlah nodul subkultur 1, subkultur 2, dan subkultur 3 pada 5 MST ... 32
5. Rekapitulasi hasil analisis ragam jumlah tunas dan jumlah nodul
antar subkultur pada media multiplikasi ... 33
6. Rekapitulasi hasil analisis ragam jumlah tunas dan jumlah nodul
antar subkultur pada media multiplikasi ... 34
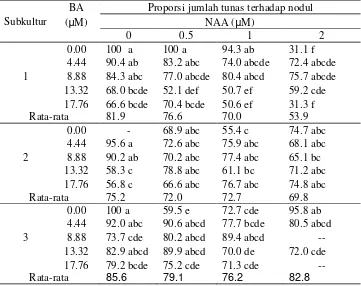
7. Proporsi jumlah tunas (%) terhadap nodul dari perlakuan BA dan NAA pada subkultur 1, subkultur 2, dan subkultur 3 umur 5 MST... 35 8. Rekapitulasi hasil analisis ragam jumlah tunas dari eksplan subkultur 1, subkultur 2, dan subkultur 3 dalam media MS pada 4 MST ... 37 9. Jumlah tunas dari eksplan subkultur 1, subkultur 2, dan subkultur 3 dalam media MS pada 4 MST ... 37 10. Rekapitulasi hasil analisis ragam pada media pengakaran subkultur 1 dan subkultur 2 pada 5 MST ... 41 11. Pengaruh subkultur 1 dan subkultur 2 terhadap panjang akar dalam media pengakaran pada 5 MST... 42 12. Pengaruh subkultur 1 terhadap jumlah daun dalam media perakaran
pada 5 MST ... 44
13. Rekapitulasi hasil analisis ragam jumlah daun, jumlah akar, panjang akar dan tinggi tanaman antar subkultur pada media pengakaran ... 45
14. Rekapitulasi hasil analisis ragam aklimatisasi ... 46 15. Rekapitulasi hasil analisis ragam tinggi tanaman, jumlah daun dan persen
hidup anatar subkultur pada saat aklimatisasi ... 48 16. Rekapitulasi hasil analisis ragam jumlah tunas dan jumlah nodul dari
17. Rata-rata jumlah tunas eksplan dari media perlakuan TDZ dan NAA
pada 5 MST ... 52 18. Rata-rata jumlah nodul eksplan dari media perlakuan TDZ dan NAA
pada 5 MST. ... 54 19. Rekapitulasi hasil analisis ragam proporsi jumlah tunas dan jumlah nodul dari perlakuan TDZ dan NAA pada 5 MST ... 55 20. Proporsi jumlah tunas terhadap jumlah nodul dari perlakuan TDZ dan
NAA pada 5 MST ... 55 21.Rata-rata jumlah tunas pada media MS0-1 dan MS0-2 pada 4 MST
setelah dikultur pada media TDZ dan NAA ... 57 22. Rekapitulasi hasil analisis ragam perlakuan TDZ dan NAA pada media
pengakaran pada 5 MST... 58
23. Pengaruh perlakuan TDZ dan NAA terhadap panjang akar dalam media pengakaran pada 5 MST... 59
24. Pengaruh perlakuan TDZ dan NAA terhadap tinggi tanaman dalam media pengakaran pada 5 MST... 60
25. Rekapitulasi hasil analisis ragam saat aklimatisasi ... 61 26.Hasil uji T dari perlakuan BA dan NAA Vs TDZ dan NAA terhadap
jumlah tunas dan jumlah nodul pada media multiplikasi, Jumlah daun, tinggi tanaman, dan panjang akar pada media pengakaran, dan persen
DAFTAR GAMBAR
Halama n
1. Produksi nenas nasional tahun 2000-2005 ... 1
2. Bagian tanaman nenas pada penampang melintang ... 11
3. Bagan alur penelitian... 19
4. Morfologi eksplan subkultur 1 pada berbagai konsentrasi NAA ... 24
5. Morfologi eksplan pada subkultur 1... 26
6. Morfologi eksplan pada subkultur 2 dari perlakuan NAA. ... 26
7. Bentuk-bentuk tunas yang tidak normal... 27
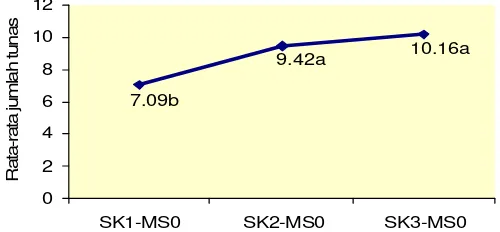
8. Rata-rata jumlah tunas dari perlakuan BA dan NAA pada subkultur 1, subkultur 2 dan subkultur 3 ... 33
9. Proporsi jumlah tunas terhadap nodul antar subkultur ... 36
10. Rata-rata jumlah tunas eksplan dari perlakuan BA dan NAA pada media MS0. ... 39
11. Morfologi tanaman dalam media perakaran pada 5 MST ... 41
12. Multiplikasi pada tanaman nenas ... 44
13. Rata-rata jumlah daun, jumlah akar, tinggi tanaman dan panjang akar antar subkultur pada media pengakaan ... 45
14. Persen hidup planlet subkultur 2 pada saat aklimatisasi ... 47
15. Tinggi tanaman pada subkultur 2 ... 47
16. Jumlah daun, tinggi tanaman dan persen hidup planlet pada subkultur 1 dan subkultur 2 ... 48
17.Proses organoge nesis pada tanaman nenas Smooth Cayenne ... 51
18. Morfologi tunas pada perlakuan TDZ ... 53
19. Morfologi eksplan hasil perlakuan TDZ ... 56
1. PENDAHULUAN
1.1 Latar belakang
Nenas merupakan salah satu buah tropika yang memiliki peran penting dalam perdagangan dunia. Indonesia merupakan negara pengekspor jus nenas dan nenas kaleng terbesar ketiga setelah Filipina dan Thailand (USDA 2005). Nenas berpotensi menjadi komoditas ekspor andalan Indonesia. Produksi nenas nasional terus meningkat dari 677.089 ton pada tahun 2003, 709.918 ton pada tahun 2004, 925.082 ton pada tahun 2005 (Gambar 1). Produksi nenas menempati urutan terbesar keempat setelah pisang, jeruk, dan mangga (BPS 2006). Pada tahun 2000-2004, ekspor nenas Indonesia terus meningkat, dengan negara tujuan adalah Amerika Serikat, Singapura, Belanda, Jerman dan Jepang (BPS 2006). Industri
pengalengan nenas berpeluang besar untuk dikembangkan di Indonesia. Berdasarkan kondisi agroklimat, Indonesia merupakan wilayah yang sesuai untuk
pengembagan nenas, ketersediaan lahan yang cukup luas, terutama di daerah-daerah yang belum termanfaatkan secara optimal, sehingga Indonesia berpeluang
besar untuk meningkatkan suplai nenas di pasar global.
0 200000 400000 600000 800000 1000000
2000 2001 2002 2003 2004 2005
Tahun
Produksi nenas (Ton)
Gambar 1. Produksi nenas nasional tahun 2000-2005
Kendala yang dihadapi dalam pengembangan agroindustri nenas antara
menghasilkan 3 anakan/tanaman/tahun. 2) Produktivitas nenas yang rendah. 3) Jumlah kultivar yang tersedia masih sedikit. 4) Kebun produksi yang ada umumnya merupakan kebun tua. 5) Adanya seranga n penyakit MWaV (Mealybug Wilt associated Virus) pada tanaman nenas. 6) Teknologi pengendalian pertumbuhan vegetatif dan reproduktif untuk menghasilkan produktivitas dan kualitas hasil yang tinggi masih terbatas. Oleh karena itu untuk meningkatkan produksi nenas perlu dilakukan pembukaan kebun-kebun baru, meremajakan kebun-kebun yang sudah tua dan memperkenalkan kultivar-kultivar baru. Usaha tersebut harus didukung oleh penyediaan bibit yang berkualitas dan seragam.
Selama ini pemenuhan kebutuhan bibit dilakukan dengan teknik konvensional. Sumber bahan perbanyakan berasal dari tunas batang, tunas akar, tunas leher buah, tunas mahkota, mahkota, batang, potongan daun, potongan
batang dan plantlet kultur jaringan (International Board for Plant Genetic Resources 1991). Perbanyakan vegetatif lebih menguntungkan untuk produksi buah, karena sifat-sifat tanaman induk dapat diturunkan kepada keturunannya secara identik, dan dapat berproduksi dengan cepat dan seragam. Rangan (1984)
menyatakan bahwa sumber bahan perbanyakan nenas akan mempengaruhi kecepatan pertumbuhan, ukuran tanaman, kecepatan berbuah, rasa buah dan
produksi tanaman. Tanaman nenas yang bersumber dari bahan perbanyakan yang
berbeda memiliki kemampuan produksi buah yang berbeda, seperti bahan
perbanyakan dari anakan akan berbuah setelah melewati 12 bulan, dari tunas batang akan berbuah setelah 15 sampai 18 bulan, dari tunas tangkai akan berbuah setelah 18 bulan, dari tunas dasar buah akan berbuah setelah 20 bulan, dari mahkota akan berbuah setelah 22 sampai 24 bulan, dari batang bermata akan berbuah setelah 24 sampai 36 bulan dan dari biji akan berbuah setelah 16 sampai 30 bulan (Dinas Pertanian Tanaman Pangan 1994). Pada nenas jenis Smooth Cayenne dengan bahan perbanyakan yang berbeda (crown, slip, sucker) akan menunjukkan pola pertumbuhan yang berbeda sehingga sangat mempengaruhi kualitas (Mustikarini 2005) tentu saja hal tersebut sangat tidak diharapkan dalam produksi skala industri yang menghendaki keseragaman.
pemotongan mata tunas pada axilar daun dari crow, slip dan sucker. 2) metode pemotongan memanjang dari slip dan sucker (teknik kuarter), 3) metode pemotongan batang (Selamat 1999). Bibit yang dihasilkan dengan metode pemotongan mata tunas sebanyak 15 sampai 25 bibit/crown, (Wong 1992 dalam
Selamet 1996), dengan teknik kuarter dihasilkan 256 bibit/crown/tahun, dengan metode pemotongan batang dihasilkan 25 bibit/batang (Selamet 1996).
Teknik perbanyakan konvensional memiliki kelemahan, yaitu membutuhkan waktu yang lama, jumlah bibit yang dihasilkan sedikit, dan tidak seragam. Hal ini akan berakibat pada ketidak seragaman pembungaan dan pembentukan buah. Metode perbanyakan konvensional kurang efisien untuk menyediakan bibit dalam jumlah banyak, kontinu, cepat dan seragam. Oleh karena itu, teknik perbanyakan
in vitro (kultur jaringan) merupakan alternatif yang tepat untuk mengatasi kelemahan tersebut.
Teknik kultur jaringan tanaman nenas telah banyak digunakan untuk
memenuhi kebutuhan bibit, antara lain telah dilaporkan oleh Zepada & Sagawa (1981) yang menghasilkan 5000 planlet/tahun dengan menggunakan media ½ MS
+ 1 mg/l BAP. Firoozabady & Gutterson (2003) dan Kiss et al. (1995) menghasilkan 2.025 planlet/tahun dengan penambahan 20 µM kinetin, regenerasi
tanaman nenas melalui embrio somatik (Firoozabady & Moy 2004; Sripoaraya et al. 2003), enkapsulasi tunas mikro pada tanaman nenas (Gangopadhyay et al. 2005), kultur kalus (Fernadez & Pomilia 2003), kultur nodul (Teng 1997), metode perbanyakan dengan menggunakan Temporary immersion system (Escolana et al.
1999). Keberhasilan dalam perbanyakan secara in vitro dipengaruhi oleh banyak faktor, antara lain: jenis tanaman, komposisi media kultur, jenis dan konsentrasi
1.2 Perumusan masalah
Teknik perbanyakan tanaman nenas secara konvensional yang menggunakan bagian vegetatif kurang efesien untuk produksi bibit dalam skala komersial, sehingga metode perbanyakan in vitro merupakan alternatif yang tepat untuk pengadaan bibit dalam jumlah besar, cepat, bebas patogen, seragam dan kontinue (Asra et al. 2000). Teknik kultur jaringan telah banyak digunakan dalam perbanyakan in vitro tanaman nenas, tetapi permasalahan yang sering muncul adalah biaya produksi yang tinggi, tingkat multiplikasi yang rendah, kemampuan tanaman untuk survive rendah pada saat diaklimatisasi, dan munculnya keragaman diantara tanaman hasil perbanyakan atau variasi somaklon. Hal ini menjadi masalah yang serius dalam perbanyakan secara komersial yang menghendaki keseragaman. Agar teknik in vitro efesien maka perlu dicari metode yang dapat meningkatkan laju multiplikasi setinggi mungkin dengan variasi somaklon rendah dan biaya produksi yang relatif murah. Oleh karena itu perlu dilakukan studi
perbanyakan nenas Smooth Cayenne secara in vitro melalui pendekatan
penggunaan zat pengatur tumbuh sitokinin (TDZ dan BA) yang dikombinasikan
dengan auksin (NAA) dan frekwensi subkultur. Sitokinin jenis BA dan TDZ digunakan dalam penelitian ini karena fungsi fisiologis sitokinin berkaitan erat
dengan pembelahan dan pembesaran sel. Sitokinin memiliki peran utama dalam pembentukan benang gelondong pada fase metaphase mitosis. Berdasarkan
stuktur kimia ada dua kelompok sitokinin yaitu turunan adenin (BA, zeatin dan kinetin) dan turunan fenilurea (TDZ). BA banyak menjadi pilihan karena harganya BA yang relatif murah, sedangkan TDZ dilaporkan memiliki efektifitas pada konsentrasi rendah. Dalam menginduksi tunas adventif, sitokinin dan auksin memiliki peran yang sangat penting. Nisbah auksin dan sitokinin menentukan apakah suatu kalus akan membetuk tunas adventif atau akar. Sitokinin bersinergi dengan auksin dalam menstimulasi pembelahan sel.
1.3 Tujuan penelitian
Penelitian ini bertujuan untuk:
1. Mempelajari pengaruh BA, TDZ dan NAA terhadap regenerasi,
2. Mencari konsentrasi sitokinin (BA dan TDZ) dan kombinasinya dengan auksin (NAA) yang optimal untuk multiplikasi nenas Smooth Cayenne
klon Curug Rendeng.
3. Mencari kombinasi BA dan NAA, dan TDZ dan NAA yang cocok untuk multiplikasi nenas Smooth Cayenne klon Curug Rendeng.
1.4 Hipotesis
1. Zat pengatur tumbuh TDZ dapat menginduksi pembentukan tunas pada nenas Smooth Cayenne klon Curug Rendeng pada konsentrasi yang lebih rendah dibandingkan BAP
2. Terdapat konsentrasi sitokinin (TDZ/ BA) yang optimal untuk multiplikasi nenas kultivar Smooth Cayenne klon Curug Rendeng.
2. TINJAUAN PUSTAKA
2.1 Klasifikasi tanaman nenas
Nenas (Ananas comosus L. Merr) merupakan tanaman tahunan monokotil yang terdiri dari 45 genus dan 2000 jenis dalam satu famili. Nenas memiliki banyak macam dan jenis, tetapi yang bersifat komersil hanya Ananas comosus.
Secara taksonomi Ananas comosus termasuk dalam Devisi Spermatophyta, Ordo
Farinosae, Famili Bromeliaceae, Genus Ananas dan Spesies Ananas comosus.
Ananas camosus terdiri dari 4 golongan Cayenne, Queen, Spanish dan
Abacaxi-Punambuco (Dinas Pertanian Tanaman Pangan 1994; Samson 1980). Berdasarkan karakteristik tanaman dan buahnya, nenas dapat dikelompokkan dalam lima kelompok yaitu Cayenne, Queen, Spanish, Abacaxi dan Maipure
(Nakasone & Paull 1999). Pengelompokan tersebut berdasarkan pada ukuran tanaman, ukuran buah, warna dan rasa daging buah, serta pinggiran daun yang rata dan berduri (Nakasone & Paull 1999).
Kultivar Cayenne merupakan golongan yang heterozigot. Menurut sejarah,
Cayenne adalah hibrida yang berasal dari tipe tetua yang tidak diketahui. Perubahan genotipe nenas Cayenne terjadi akibat mutasi gen dan kromosom somatik. Pada saat terjadi mutasi somatik, Cayenne mampu bertahan hidup, sehingga populasi nenas Cayenne yang ada sekarang, bukan lagi sebuah klon, tetapi merupakan klon yang penampilannya mirip (Collins 1968).
Nenas Cayenne merupakan jenis yang paling banyak dibudidayakan, tinggi tanaman ini berkisar 1 m, lebar 1.5, berdaun panjang (100 cm x 6.5 cm), ujung daun sedikit berduri, jarak antar daun berdekatan, dan berbunga hanya satu
kali (Samson 1980). Permukaan atas daun berwarna hijau tua dengan warna belang merah kecoklatan yang tidak teratur, karena adanya antocianin dalam
epidermis. Pada permukaan daun atas terdapat beberapa trikoma yang tersebar. Permukaan daun bawah berwarna kelabu keperakan, karena tertutup oleh trikoma
Nenas Queen pada umumnya ditanam didataran rendah, ukuran tanaman, daun dan buah yang lebih kecil (0.5-1.1 kg). Nenas Queen memiliki ciri-ciri, yaitu tepi daun berduri, bentuk buah konicol, mata menonjol, warna kulit kuning, warna daging buah kuning tua, hati kecil, rasa manis, kandungan asam dan serat rendah, kurang baik untuk pengalengan. Varietas yang termasuk jenis ini adalah Queen, Mac Gregor, Natal, Ripley dan Alexandria (Sari 2002). Nenas Queen kurang disukai untuk pengolahan dan pembekuan karena bau dan rasa tidak diinginkan untuk penyimpanan. Nenas Queen rasanya manis, renyah dan aromanya harum dibandingkan yang lain (Ensminger et al. 1995 dalam Sari 2002)
Nenas Spanish memiliki ukuran tanama n dan ukuran buah antara Cayenne
dan Queen. Nenas ini mempunyai daun panjang dan berduri, berat buah berkisar 0.9–1.8 kg dan berbentuk segi empat, tangkai buah ramping dengan panjang
20-25 cm, fruitlet (buah kecil) lebih besar daripada Cayenne namun jumlahnya lebih sedikit. Rata-rata jumlah buah kecil antara 75–85. Cawan bunga lebih dalam
menyerupai Queen. Aroma menyenangkan sama sekali berbeda dengan Cayenne
dan Queen. Kulit buah kasar dan kuat sehingga buah tidak mudah rusak dalam pengangkutan. Warna kulit buah merah oranye, hati buah relatif lebih besar dari pada Cayenne. Panjang mahkota 20–25 cm, daun membengkok ke belakang, panjang dan berduri, seringkali terdapat mahkota-mahkota kecil mengelilingi dasar dari mahkota besar. Tunas tangkai berjumlah 2–8, tumbuh berdekatan
dengan buah dan kadang melekat pada dasar buah. Tunas batang berjumlah 1–3 (Dinas Pertanian Tanaman Pangan 1994).
Nenas Abacaxi, nenas ini memiliki ciri-ciri panjang daun berkisar antara 60-65 cm dan berduri, tangkai buah kaku, dengan panjang sekitar 40 cm. Golongan Abacaxi banyak ditanam di Brazilia untuk keperluan lokal. Buah berbentuk seperti paramida, berat kurang lebih 1.5 kg, fruitlet kecil, cawan bunga dangkal, daging buah kuning pucat sekali. Buah mempunyai serat sangat kecil, cairan buah banyak, flavor bagus. Nenas ini kurang baik untuk pengalengan. Contoh varietas adalah Abacaxi, Abaka, Sugar Loaf, Papelon, Venezolara dan
Amarela.
sekitar 0.8–2.5 kg, berbentuk silinder, warna kulit buah kuning atau merah-orange, warna daging buah putih atau kuning tua, hati kecil sampai medium, rasa lebih manis dari Cayenne, berserat, sangat juicy, kurang baik untuk pengalengan.
Maipure, Perolena, Lebrija, Monte Libio, dan Rondon termasuk varietas jenis
Maipure.
2.2 Morfologi tanaman nenas
Nenas memiliki daun berbentuk pedang dengan panjang mencapai 1 m atau lebih, lebar 5 sampai 8 cm, pinggir daun berduri atau hampir rata, berujung lancip, bagian atas daun berdaging, berserat, beralur, tersusun dalam spiral yang tertutup, bagian pangkalnya memeluk poros utama (Verheij & Coronel 1992). Jumlah daun yang terbentuk dapat mencapai 70 sampai 80 helai. Permukaan daun atas, licin
seperti lapisan lilin, berwarna hijau terang atau coklat kemerahan, permukaan bawahnya terdapat garis-garis linier berwarna putih keperakan, mudah lepas dari
epidermis yang berwarna hijau terang. Stomata tersusun dalam garis putus-putus. Stomata berada di bagian sisi dan bawah permukaan daun diantara garis-garis
linier (Collins 1960).
Batang nenas selalu tertutup daun, jika daun dilepas terlihat ruas-ruas
pendek dengan panjang bervariasi antara 1 sampai 10 cm dengan ruas yang paling panjang terdapat di bagian tengah batang, panjang batang berkisar 20 sampai 25
cm dengan diameter bagian bawahnya 2 sampai 3.5 cm dan semakin ke atas diameter batang semakin besar yaitu 5.5 sampai 6.5 cm serta bagian puncaknya mengecil (Collins 1960).
Nenas memiliki akar serabut dengan sebaran ke arah vertikal dan horizontal. Perakaran dangkal dan terbatas walaupun ditanam pada media yang paling baik. Kedalaman akar nenas tidak akan lebih dari 50 cm (Samson 1980). Akar tunggang hanya terbentuk jika bibit berasal dari biji.
satu lembar tangkai putik yang bercabang tiga (Coronel & Verheij 1997), bersifat hermaprodit dan self incompatible (Collins 1960). Sifat self-incompatible pada nenas (A. comosus) karena adanya lokus tunggal S dengan multiple alel, tetapi pada spesies A. ananassoides, A. bracteatus, dan A. saginarius adalah self-fertile
(Brewbaker & Gorrez 1967 dalam Hadiati 2002), sehingga biji akan terbentuk jika terjadi penyerbukan silang. A. comosus mempunyai fertilitas yang rendah. Hal ini terlihat dari persentase ovule yang menghasilkan biji setelah penyerbukan, yaitu kurang dari 5 %. Pada kultivar Cayenne, Red Spanish, Singapore Spanish, Perola, dan Queen dihasilkan kurang dari 2 biji/bunga, sedangkan pada genotipe yang mempunyai daun ‘piping’ dihasilkan 2 sampai 5 biji/bunga (Leah & Coppens 1996).
Buah nenas merupakan buah majemuk yang terbentuk dari gabungan 100
sampai 200 bunga, berbentuk silinder, dengan panjang buah sekitar 20.5 cm dengan diameter 14.5 cm dan beratnya sekitar 2.2 kg (Collins 1960). Kulit buah
keras dan kasar, saat menjelang panen, warna hijau buah mulai memudar. Soedibyo (1992) menyatakan bahwa diameter dan berat buah nenas semakin
bertambah sejalan dengan pertambahan umurnya, sebaliknya untuk tekstur buah nenas, semakin tua umur buah maka teksturnya akan semakin lunak (Coronel &
Verheij 1997).
2.3 Persyaratan tumbuh tanaman nenas
Nenas dapat tumbuh pada berbagai jenis tanah. Nenas sering ditemukan di daerah tropis, terutama di tanah latosol coklat kemerahan atau merah. Tanaman ini
memiliki sistem perakaran yang dangkal, sehingga memerlukan tanah yang memiliki sistem drainase dan aerase yang baik, seperti tanah berpasir dan banyak
mengandung bahan organik. pH yang optimum untuk pertumbuhan nenas adalah 4.5 sampai 6.5.
menyebabkan pertumbuhannya terhambat, buah menjadi kecil, kualitas buah menurun dan kadar gula menjadi berkurang. Sebaliknya bila sinar matahari terlalu banyak maka tanaman akan terbakar dan buah cepat masak. Intensitas rata-rata cahaya matahari pertahunnya yang baik untuk pertumbuhan nenas berkisar 33 sampai 71 % (Coronel & Verheij 1997).
Temperatur optimum untuk pertumbuhan nenas adalah 23oC sampai 32oC. Temperatur maksimum dan minimum adalah 30oC-20oC. Menurut Coronel & Verheij (1997) pada suhu dan kelembaban yang tinggi menyebabkan daun-daun tanaman menjadi lunak, buah menjadi besar dengan kandungan asam rendah dan pertumbuhan menjadi sangat rendah. Ketinggian tempat untuk tanaman nenas berkisar 100-800 m dpl. Untuk varietas Cayenne, bila ditanam di dataran rendah akan menghasilkan kualitas yang lebih rendah dengan ciri buah nenas dan
daunnya lebih kecil. Jika daerahnya lebih tinggi dari 760 m di atas permukaan laut, tanaman nenas menjadi lebih pendek, daun lebih pendek dan menyebar,
nenas lebih ringan dan fruitlet menonjol keluar, sehingga permukaan lebih kasar. Nenas Cayenne yang ditanam di Kenya pada ketinggian 1400 sampai 1800 mdpl memiliki perbandingan gula-asam 16:1. Pada ketinggian 1150 mdpl perbandingan gula-asam menjadi 38:1. Sementara di Guatemala, Amerika Tengah ada nenas
yang daunnya berduri, hidup pada ketinggian 1555 mdpl. Di Srilangka terdapat tanaman nenas yang ditanam pada daerah dengan ketinggian 1221 mdpl. Menurut
Dinas Pertanian Tanaman Pangan (1994) tanaman nenas dapat tumbuh di daerah dengan curah hujan 635 mm sampai dengan 2500 mm per tahun, namun curah hujan optimum untuk pertumbuhan dan perkembangannya adalah antara 1000 sampai 1500 mm per tahun. Daerah yang memiliki kelembaban tinggi baik untuk mencegah transpirasi yang terlalu besar, sehingga lahan di dekat pantai akan sangat mendukung pertumbuhan dan produksi nenas.
2.4 Bahan perbanyakan tanaman nenas
Perbanyakan vegetatif lebih menguntungkan karena sifat-sifat tanaman induk dapat diturunkan kepada keturunannya secara identik dan dapat berproduksi dengan cepat. Perbanyakan tanaman nenas secara vegetatif dapat dilakukan dengan mengunakan anakan, tunas batang, tunas tangkai, tunas dasar buah, mahkota dan batang bermata.
Sumber: Pineapple, the plant and its culture by Kenneth G. Rohrbach, Hawaii Agricultural Experiment Station, University of Hawaii, dalam (Bartholomew et al. 2000)
Gambar 2. Bagian tanaman nenas pada penampang melintang.
Tunas tangkai (rotons) muncul dari tangkai buah, pada umumnya ukuran tunas tangkai lebih kecil dari pada tunas batang. Jumlahnya relatif lebih sedikit, bentuknya lebih ramping dan daunnya lebih panjang dari pada tunas batang, mampu menghasilkan buah pada umur 18 bulan setelah ditanam. Tunas dasar buah (slips) adalah tunas yang keluar dari dasar buah atau ujung tangkai buah. Tunas dasar buah jumlahnya adalah 0 sampai 10 buah per tanaman, baik digunakan jika beratnya 340 sampai 450 g (Collins 1968). Tanaman dapat berbuah setelah berumur 20 bulan dari saat tanam.
Mahkota (crown) merupakan tunas yang tumbuh pada bagian pucuk dari buah, umumnya hanya satu, namun kadang-kadang dapat lebih. Tanaman dapat menghasilkan buah pada umur 22 sampai 24 bulan setelah ta nam (Dinas Pertanian Tanaman Pangan 1994). Mata tunas yang tidur terdapat pada bagian batang. Mata
tunas ini dapat dijadikan sebagai bahan untuk perbanyakan. Satu batang nenas yang telah tua memiliki 80 mata tunas yang tidur maka dapat dihasilkan 80 bibit.
Tanaman yang diperoleh akan berbunga setelah 2 sampai 3 tahun setelah ditanam.
2.5 Perbanyakan In-Vitro
Perbanyakan bibit dalam skala besar merupakan salah satu aspek yang
sangat penting, dimana produksi memerlukan bibit dari varietas unggul dalam jumlah banyak, seragam, bebas hama dan penyakit serta tersedia secara kontiniu.
Perbanyakan dengan kultur jaringan atau disebut juga dengan in-vitro culture, merupakan suatu teknik perbanyakan vegetatif yang banyak digunakan karena memiliki beberapa keuntungan antara lain, tingkat mutiplikasi yang tinggi, seragam secara genetik, memiliki sifat seperti induknya, bibit dapat dihasilkan setiap waktu, tidak tergantung pada musim, dapat menghasilkan bibit yang bebas penyakit, bahan tanaman yang dibutuhkan sedikit, tidak merusak pohon induk, dan tempat untuk produksi bibit yang relatif sempit.
langsung dari eksplan atau kalus. 3) Pembentukan benih somatik dari rege nerasi melalui embriogenesis somatik. Cara ke 2 dan ke 3 telah banyak dilaporkan tetapi menyebabkan ketidakstabilan pada keturunannya apabila terbentuk melalui kalus.
Jika dibandingkan dengan metode konvensional, metode kultur jaringan lebih menguntungkan, khususnya untuk perbanyakan yang dilakukan pada tanaman heterozigot, sexual incompatible, dan untuk genotipe yang steril
(Connger 2000). Jika tanaman heterozigot diperbanyak secara konvensional, maka terjadi segregasi sehingga sifat anakan tidak sama dengan induknya. Permasalahan ini dapat diatasi dengan teknik perbanyakan in vitro. Demikian juga halnya untuk tanaman steril dan sex incompatible yang tidak menghasilkan biji, dapat diperbanyak dengan mudah.
2.6 Kultur jaringan nenas
Menurut Wee dan Thongtham (1997) teknik kultur jaringan pada tanaman
nenas telah dikembangkan untuk produksi secara besar-besaran. Zepeda dan Sagawa (1981) menyatakan bahwa rata-rata 16 tunas diperoleh dari 23 tunas
aksilar per mahkota (crown) pada media ½ MS + 25% air kelapa. Sekitar 5.000 planlet dapat dihasilkan dalam 12 bulan dari satu buah mahkota nenas dengan
teknik in vitro. Berdasarkan penelitian Kiss et al. (1995) sekitar 1.521 planlet pada medium N6 + 20 µM BA atau 2.025 planlet pada medium N6 + 25 µM kinetin
dapat dihasilkan dari satu planlet berakar selama 12 bulan.
Hasil penelitian Kiss et al. (1995) pada tanaman nenas cv. Smooth Cayenne
Hasil penelitian Devilana (2005) pada tanaman nenas cv. Queen yang ditumbuhkan pada media MS + 0.1 mg/l NAA, dan MS + 0.01 mg/l NAA dapat meningkatkan jumlah akar pada 15 dan 17 MST. Hasil penelitian Murtini (2005) pada tanaman nenas cv. Smooth Cayenne yang ditumbuhkan pada media MS dengan penambahan 1.0 mg/l dan 2.0 mg/l NAA dapat meningkatkan rata-rata eksplan bertunas berakar pada 7 MST.
2.7 Zat pengatur tumbuh (ZPT)
Hormon merupakan senyawa organik yang mempengaruhi proses fisiologi tanaman pada konsentrasi rendah. Hormon tanaman mempengaruhi proses pertumbuhan, difrensiasi, dan perkembangan tanaman. Selain itu, hormon juga mengontrol proses pembukaan stomata (Devies 1995; Bidwell 1974). Secara
umum, hormon disintesis di suatu tempat, kemudian ditransportasikan ke jaringan target, dan mempengaruhi proses fisiologi jaringan tersebut pada konsentrasi
tertentu.
Sitokonin merupakan hormon turunan adenin. Golongan ini berperan
penting dalam pengaturan pembelahan sel dan morfogenesis (Gunawan 1988). Sitokinin dan turunannya, banyak terdapat pada bagian ujung akar dan meristem
yang mengalami pembelahan sel secara cepat, serta bagian tanaman yang sedang berkembang. Fungsi fisiologis sitokinin antara lain, berkaitan erat dengan
pembelahan sel, pembesaran sel, pertumbuhan tunas lateral, pembentukan kloroplas, pemecahan dormansi, pembukaan stomata, pembungaan dan pembentukan buah partenokarpi selain itu sitokinin juga berperan dalam penghambatan tumbuhan. Pembelahan mitosis tidak aka n terjadi tanpa siokinin. Sitokinin memiliki peran utama dalam pembentukan benang gelondong pada fase metaphase mitosis
arah yaitu dari pucuk ke pangkal melalui batang. Pada jaringan yang tua, biasanya batang atau tangkai daun, aliran hormon berlangsung melalui floem. Tidak semua auksin ditranslokasikan secara basepetal, tetapi ada juga auksin yang ditranslokasikan secara acropetal (Bidwell 1974).
Dalam menginduksi tunas adventif, sitokinin dan auksin memiliki peran penting. Nisbah auksin dan sitokinin menentukan apakah suatu kalus akan membetuk tunas adventif atau akar. Sitokinin bersinergi dengan auksin dalam menstimulasi pembelahan sel secara kontiniu dalam kultur jaringan pith
tembakau, tetapi bersifat antagonis dengan auksin dalam mengontrol inisiasi tunas dan akar dan juga dalam proses dominasi apikal (Binns 1994).
Pada konsentrasi tinggi, sitokinin mendorong proliferasi, sebaliknya menghambat pembentukan akar. Penggunaan sitokinin pada konsentrasi tinggi
pada Cymbidium sinensis willd menghambat pemanjangan tunas dan inisiasi akar (Chang dan Chang 2000), pada tanaman ubi kayu menghasilkan tunas hiperhidrik
(Konan et al. 1997), dapat menyebabkan fitrifikasi atau suatu kondisi fisiologis in vitro yang menyebabkan disorganisasi seluler (Ziv 1991). Membentuk kalus pada bagian dasar eksplan (Lakshamana et al. 1997), pembengkakan akar dan pembentukan akar terhenti (Fratini dan Ruiz 2002) dan meningkatkan produksi
etilen (Kevers dan Gasper 1985).
Berdasarkan stuktur kimia ada dua kelompok sitokinin yaitu turunan
adenin (BA, zeatin dan kinetin) dan turunan fenilurea (TDZ). TDZ (N-phenyl-N’(1,2,3-thidiazol-5-yl)urea) adalah jenis herbisida yang mempunyai aktivitas sama dengan sitokinin. TDZ dapat mengsubstitusi sitokinin jenis adenin dalam beberapa sistem kultur sel, meliputi kultur kalus dan perbanya kan pada jenis tanaman berkayu. TDZ dilaporkan memiliki efektivitas yang tinggi pada
TDZ telah banyak digunakan untuk meningkatkan kecepatan multiplikasi diantaranya pada tanaman Arachis hypogaea (Kanyand et al. 1994; Victor et al. 1999), Curcuma longa (Prathanturarug et al. 2005), hibrid Acer x freemanii
(Kerns dan Meyer 1986), hibrid Alocasia x Chantrieri (Henny dan Fooshee 1990), grape (Gribaudo dan Fronda 1991).
Efektivitas TDZ dan BA dalam menginduksi multiplikasi tunas berbeda-beda, tergantung pada jenis tanamannya. Pada tanaman angrek phalaenopsis konsentrasi optimal untuk pambentukan tunas adventif adalah 5-10 µM TDZ, dan
jika sitokinin yang digunakan BA konsentrasi optimal 40 µM (Chen dan Piluek,
1995). Pada tanaman ubi kayu perlakuan 10 mg/l BAP menghasilkan jumlah tunas/eksplan lebih banyak dibandingkan perlakuan 10 mg/l TDZ, tetapi
persentase eksplan membentuk tunas pada perlakuan TDZ lebih tinggi dibandingkan perlakuan BAP (Konan et al. 1997).
Efektivitas sitokinin berbeda-beda, pada tanaman lentil (Lensculinaris medik) dilaporkan efektivitas TDZ lebih tinggi dari BA, BA lebih tinggi dari kinetin dan efektivitas kinetin lebih tinggi dibanding zeatin dalam menginduksi tunas, sedangkan untuk pemanjangan tunas berlaku sebaliknya yaitu zeatin >
kinetin > BA > TDZ (Fratini dan Ruiz 2002).
Beberapa keuntungan pada mekanisme kerja TDZ seperti, dilaporkan pada
kacang tanah tidak memerlukan jenis ZPT lain untuk menginduksi somatik embriogenesis, (Victor et al. 1999), meningkatkan biosintesis atau akumulasi sitokinin dan auksin endogen, menginduksi embrio somatik tanpa dikombinasikan dengan zat pengatur tumbuh lainnya (Murthy et al. 1995), merangsang proliferasi tunas dan regenerasi organ adventif pada tanaman berkayu (Huetteman dan Preece1993), menginduksi dan meningkatkan proliferasi protocorm like body
(PLB) pada tanaman angrek (Ernst1994), memiliki efektivitas yang tinggi pada konsentrasi rendah (Thomas dan Katterman 1986).
Konsentrasi yang dibutuhkan dari masing-masing ZPT auksin dan sitokinin sangat tergantung dari jenis eksplan, genotipe, kondisi kultur serta jenis auksin dan jenis sitokinin yang digunakan, sehingga untuk mengetahui konsentrasi sitokinin dan auksin yang tepat untuk masing-masing tanaman perlu dilakukan
3. BAHAN DAN METODE
3.1 Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium kultur jaringan dan molekuler Pusat Kajian Buah-Buahan Tropis (PKBT-IPB), dimulai dari Desember 2004 sampai Juni 2006.
3.2 Bahan dan Alat
Bahan tanaman yang digunakan adalah planlet yang berasal BrMC ( bio-resources manejement center) Tajur. Bahan kimia yang digunakan adalah media MS, agar, zat pengatur tumbuh (NAA, BA, dan TDZ). Alat yang digunakan adalah peralatan tanam kultur jaringan, pH meter, timbangan, LAFC (Laminar Air Flow Cabinet), dan autoklaf.
3.3 Metode Penelitian
Penelitian ini dibagi dalam beberapa tahap, yaitu: multiplikasi tunas, pembesaran dan pemanjangan tunas, pengakaran dan aklimatisasi. Bagan alur penelitian ini dapat dilihat pada Gambar 3. Eksplan dari BrMc ditanam ke media dasar MS selama tiga bulan (dua kali subkultur). Tahap multiplikasi tunas terdiri
dari 2 percobaan yaitu: 1) Pengaruh BA dan NAA terhadap regenerasi dan multiplikasi nenas kultivar Smooth Cayenne klon Curug Rendeng secara in vitro, 2) Pengaruh TDZ dan NAA terhadap regenerasi dan multiplikasi nenas kultivar
Smooth Cayenne klon Curug Rendeng secara in vitro.
3.3.1 Pengaruh BA dan NAA terhadap regenerasi dan multiplikasi nenas kultivar Smooth Cayenne klon Curug Rendeng in vitro
Perlakuan dan rancangan percobaan
Percobaan menggunakan Rancangan Acak Lengkap (RAL) faktorial, dengan 2 faktor. Faktor pertama adalah BA yang terdiri dari 5 taraf konsentrasi
yaitu 0 µM, 4.44 µ M, 8.88 µM, 13.32 µM, dan 17.76 µM. Faktor kedua adalah NAA dengan 4 taraf konsentrasi yaitu 0 µ M, 0.5 µM, 1.0 µ M dan 2.0 µ M.
perlakuan, sehingga terdapat 240 satuan percobaan. Setiap satu satuan percobaan terdiri dari 1 botol kultur dengan 1 eksplan per botol kultur.
Gambar 3. Bagan alur penelitian
Multiplikasi, pembesaran dan pemanjangan tunas
sebagian eksplan disubkultur pada media perlakuan yang sama selama 30-35 hari dan sisanya ditanam pada media MS0 selama ± 30 hari untuk pembesaran dan pemanjangan tunas, agar eksplan siap diakarkan. Pengamatan pada media multiplikasi dilakukan tiap minggu selama 1-5 MST, terhadap peubah: jumlah tunas, jumlah nodul, jumlah akar, bentuk dan jumlah varian. Pada tahap pembesaran dan pemanjangan peubah yang diamati hanya jumlah tunas.
Pengakaran
Eksplan yang berasal dari MS0 dibuang daunnya dan dipotong sepanjang 0.5-1.0 cm dari pangkal batang dan ditanam pada media perakaran yaitu MS + 0.5 µM NAA selama ± 30 hari. Pada media pengakaran pengamatan dilakukan tiap minggu terhadap jumlah akar, persen tanaman berakar, jumlah tunas, persen
tanaman bertunas, sedangkan panjang akar, dan jumlah daun dihitung pada saat minggu terakhir
Aklimatisasi
Planlet yang berasal dari media pengakaran dikeluarkan dari botol, kemudian akarnya dicuci bersih untuk menghilangkan sisa agar, kemudian
ditanam pada media aklimatisasi dengan perbandingan pasir terhadap kompos sebanyak 1:3. Aklimatisasi dilakukan dirumah kaca selama ± 3 bulan.
Pengamatan saat aklimatisasi dirumah kaca terdiri dari: persen tanaman tumbuh, tinggi tanaman, jumlah daun, jenis dan jumlah variasi yang muncul dalam hal ini perubahan morfologi dari tanaman normal (warna daun, bentuk daun, ada tidaknya duri pada daun).
3.3.2 Pengaruh TDZ dan NAA terhadap regenerasi dan multiplikasi nenas kultivar Smooth Cayenne klon Curug Rendeng secara in vitro
Perlakuan dan Rancangan Percobaan
adalah NAA dengan 4 taraf konsentrasi yaitu 0.0 µM, 0.5 µM, 1.0 µ M dan 2.0 µM. Terdapat 24 kombinasi perlakuan dengan 12 kali ulangan untuk setiap kombinasi perlakuan. Sehingga terdapat 288 satuan percobaan. Setiap satu satuan percobaan terdiri dari 1 botol kultur dengan 1 eksplan per botol. Metode multiplikasi, pembesaran dan pemanjangan tunas, pengakaran dan aklimatisasi yang digunakan pada tahap ini sama dengan metode yang digunakan pada percobaan pertama yaitu pengaruh BA dan NAA.
3.4 Analisis Data
IV. HASIL DAN PEMBAHASAN
4.1 Pengaruh BA dan NAA terhadap regenerasi multiplikasi nenas Smooth Cayenne klon Curug Rendeng
4.1.1 Kondisi umum kultur
Secara umum, eksplan pada semua perlakuan mulai menunjukkan respon pada 1 MST, ditandai dengan terjadinya pemanjangan daun, pembengkakan pada pangkal atau bagian dasar eksplan dan pembentukan tunas. Eksplan dalam media yang diberi perlakuan ZPT akan berdiferensiasi membentuk sel yang meristematik atau embriogenik. Pada saat sel mengalami diferensiasi, terjadi pembelahan sel yang sangat cepat karena adanya ZPT sitokinin dan auksin. Menurut Schwarz et al. (2005) fase diferensiasi sel dapat dipertahankan melalui subkultur berulang pada media yang sama. Apabila eksplan mempunyai titik tumbuh dengan sel-sel
meristematis yang ditanam dalam media regenerasi yang tepat, maka sel tersebut dapat langsung beregenerasi me mbentuk tunas (Zhang & Lemaux 2005).
Persentase kontaminasi pada subkultur 1 adalah 2.2%, pada subkultur 2 sebesar 3.1%, dan pada subkultur 3 sebesar 40.6%. Pada subkultur 1
pembengkakan bagian dasar eksplan pada 1 MST adalah 63.5% dan pembentukan tunas sebesar 2.6%. Persentase pembentukan tunas meningkat yaitu 18% pada 2
MST sampai 79.5% pada 5 MST. Pembentukan nodul mulai terjadi pada 2 MST sebesar 10.12% dan terus meningkat sampai 58.4% pada 5 MST. Pembentukan kalus tidak terjadi sampai 5 MST pada subkultur 1.
Pada subkultur 2, tunas yang terbentuk pada 1 MST adalah 52.7% dan meningkat menjadi 79.3% pada 4 MST. Nodul yang terbentuk adalah 42.8% pada 1 MST dan 60.2% pada 4 MST. Kalus yang terbentuk adalah 3.1% pada 1 MST dan meningkat 13.3% pada 4 MST. Secara umum, persentase kontaminasi pada SK 2 sampai 4 MST adalah 3.1%, dimana kontaminasi paling banyak terjadi pada minggu kedua, yaitu 1.8%.
4.1.2 Regenerasi dan multiplikasi pada subkultur 1, subkultur 2 dan subkultur 3
4.1.2.1 Regenerasi
Regenerasi tanaman nenas pada kultur jaringan dapat terjadi secara
langsung dan tidak langsung. Dalam perbanyakan langsung, eksplan yang meristematik akan langsung beregenerasi membentuk tunas adventif. Dalam
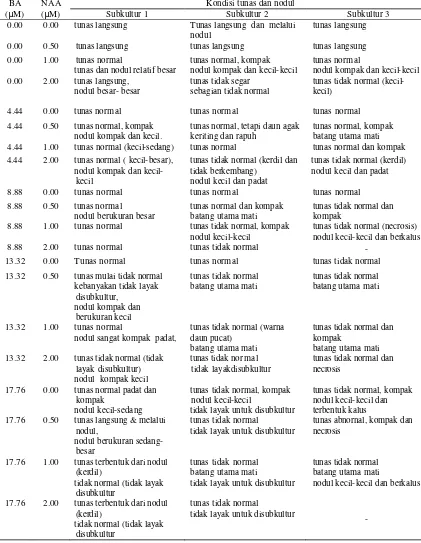
perbanyakan tidak langsung, eksplan akan tumbuh menjadi kalus yang meristematik terlebih dahulu sebelum membentuk tunas (Mattjik 2005). Regenerasi tunas pada penelitian ini terjadi secara langsung (tanpa melalui nodul) dan tidak langsung (melalui nodul). Pada regenerasi tunas secara langsung, tunas yang terbentuk umumnya berukuran relatif besar dan dapat membentuk akar. Pada regenerasi tidak langsung, eksplan tumbuh menjadi nodul terlebih dahulu, dan kemudian membentuk tunas, dengan ukuran tunas relatif kecil, kompak dan padat. Kondisi tunas dan nodul yang terbentuk pada subkultur 1, subkultur 2 dan subkultur 3 dapat dilihat pada Tabel 1. Pada subkultur 1 penambahan NAA
(0.5-2.0 µM) pada media MS menghasilkan tunas secara langsung dan tidak langsung.
Tunas yang terbentuk normal dengan ukuran bervariasi dari kecil, sedang dan besar. Morfologi tanaman dalam media NAA ditunjukkan pada Gambar 4.
Perlakuan 4.44 µM dan 8.88 µM BA pada berbagai taraf konsentrasi NAA
menghasilkan tunas secara langsung dan tidak langsung. Tunas yang terbentuk berukuran sedang sampai besar. Nodul yang terbentuk juga relatif besar sehingga
mudah untuk dipisahkan dan peluang untuk membentuk tunas sangat tinggi. Penambahan 13.32 µM dan 17.76 µM BA dengan 3 taraf NAA menghasilkan
tunas melalui pembentukan nodul terlebih dahulu. Umumnya tunas yang terbentuk berukuran kecil, kompak, daun agak keriting dan rapuh sehingga mudah
rusak saat penanaman (subkultur) seperti terlihat pada Gambar 5.
Nodul yang terbentuk umumnya berukuran kecil dan kompak, serta
berpotensi membentuk kalus. Sema kin tinggi konsentrasi NAA dan BA yang ditambahkan, dihasilkan tunas yang kompak dan padat, dan berukuran relatif kecil
melaporkan bahwa rasio auksin/sitokinin endogen menurun pada hari ketiga setelah kultur, dimana kandungan iP endogen meningkat, hal ini diduga sebagai pendorong induksi pembentukan nodul, yang akan beregenerasi menjadi tunas. Hal yang sama juga dilaporkan oleh Lakshamanan et al. (1997) dalam (mercier et al. 2003) pada tanaman Garcinia mangostana yang diberi tambahan BA, mengalami peningkatan iP dan iPR endogen pada hari ke 6, sehingga rasio auksin/sitokinin menurun dan terbentuk nodul. Pambahan BA dan NAA pada berbagai taraf konsentrasi pada media kultur akan membentuk nodul dan tunas pada tanaman nenas (Wasaka 1989) dikutip (Marcier et al. 2003).
Gambar 4. Morfologi eksplan subkultur 1 pada berbagai konsentrasi NAA .[A-B] pembentukan tunas secara langsung, [C] tunas terbentuk melalui nodul.
Pada subkultur 2, penambahan NAA 0.5 µM dan 1.0 µM menghasilkan
tunas secara langsung tanpa melalui nodul. Tunas yang terbentuk adalah normal
dengan ukuran yang beragam. Hal yang menarik dari penambahan 2.0 µM NAA
adalah daun yang dihasilkan tidak segar, adanya pertumbuhan akar, nodul dan primordia tunas yang sulit dibedakan (Gambar 6C). Pada konsentrasi rendah,
auksin merangsang pertumbuhan, sebaliknya pada konsentrasi tinggi menghambat pertumbuhan (Kusumo 1990). Akumulasi auksin pada konsentrasi tinggi
menginduksi pembentukan akar.
Penambahan 4.44 µM dan 8.88 µM BA pada berbagai taraf konsentrasi
NAA (kecuali 2.0 µM NAA) menghasilkan tunas secara langsung dan melalui
nodul. Tunas yang terbentuk merupakan tunas normal dengan ukuran bervariasi, tetapi bentuk daun umumnya terlihat agak keriting dan rapuh, sehingga mudah
rusak saat subkultur.
0.5 µM NAA 1,0 µM NAA 2,0 µM NAA
Tabel 1 Kondisi tunas dan nodul pada subkultur 1, subkultur 2, dan subkultur 3 dari perlakuan BA dan NAA
BA (µM)
NAA (µM)
Kondisi tunas dan nodul
Subkultur 1 Subkultur 2 Subkultur 3
0.00 0.00 tunas langsung Tunas langsung dan melalui nodul
tunas langsung
0.00 0.50 tunas langsung tunas langsung tunas langsung
0.00 1.00 tunas normal
tunas dan nodul relatif besar
tunas normal, kompak
4.44 0.00 tunas normal tunas normal tunas normal
4.44 0.50 tunas normal, kompak nodul kompak dan kecil.
tunas normal, tetapi daun agak keriting dan rapuh
tunas normal, kompak batang utama mati 4.44 1.00 tunas normal (kecil-sedang) tunas normal tunas normal dan kompak 4.44 2.00 tunas normal ( kecil-besar),
nodul kompak dan kecil-kecil
tunas tidak normal (kerdil dan tidak berkembang)
nodul kecil dan padat
tunas tidak normal (kerdil) nodul kecil dan padat
8.88 0.00 tunas normal tunas normal tunas normal
8.88 0.50 tunas normal nodul kecil-kecil dan berkalus
8.88 2.00 tunas normal tunas tidak normal -
13.32 0.00 Tunas normal tunas normal tunas tidak normal
13.32 0.50 tunas mulai tidak normal 13.32 2.00 tunas tidak normal (tidak
layak disubkultur)
tidak layak untuk disubkultur
tunas tidak normal, kompak nodul kecil-kecil dan terbentuk kalus 17.76 0.50 tunas langsung & melalui
nodul,
nodul berukuran sedang-besar
tunas tidak normal
tidak layak untuk disubkultur
tunas abnornal, kompak dan necrosis
17.76 1.00 tunas terbentuk dari nodul (kerdil)
tidak normal (tidak layak disubkultur
tunas tidak normal batang utama mati
tidak layak untuk disubkultur
tunas tidak normal batang utama mati
nodul kecil-kecil dan berkalus
17.76 2.00 tunas terbentuk dari nodul (kerdil)
tidak normal (tidak layak disubkultur
tunas tidak normal
tidak layak untuk disubkultur
4.44 µM BA + 0.00 µM NAA 8.88 µM BA + 0.5 µM NAA
13.32 µM BA + 0.5 µM NAA 17.76 µM BA + 0.5 µM NAA
8.88 µM BA + 2.0 µM NAA
13.32 µM BA + 1.0 µM NAA
F E
D D
C B
A
Gambar 5. Morfologi eksplan pada subkultur 1. [A] Tunas langsung terbentuk tanpa melalui nodul; [B] Tunas terbentuk melalui nodul dan tanpa nodul; [C] Nodul yang pecah membentuk tunas; [D-E] Kumpulan nodul; [ F] Tunas yang padat, dan kompak.
Gambar 6. Morfologi eksplan pada subkultur 2 dari perlakuan NAA
Nodul yang terbentuk sangat kompak dan kecil-kecil, dan pada sebagian
tanaman terjadi pembentukan kalus (Gambar 7). Penambahan 13.32-17.76 µM
BA dengan 3 taraf NAA menghasilkan tunas melalui pembentukan nodul terlebih dahulu, umumnya tunas yang terbentuk berukuran kecil, kompak, tidak normal seperti daun keriting dan agak rapuh sehingga mudah rusak saat subkultur. Nodul
0.5 µM NAA 1.0 µM NAA 2.0 µM NAA
B C
13.32 µM BA + 1.0 µM NAA 13.32 µM BA + 2 µM NAA 4.44 µM BA + 2.0 µM NAA
13.32 µM BA + 0.0 µM NAA 17.76 µM BA + 1.0 µM NAA
8.88 µM BA + 1.0 µM NAA
F E
D
C
B
A
yang terbentuk umumnya berukuran kecil dan kompak, pada akhir pengamatan banyak terbentuk kalus.
Gambar 7. Bentuk-bentuk tunas yang tidak normal. [A] tunas kompak, daun berlilin dan rapuh, [B] daun keriting, batang utama mati, [C dan F] nodul kompak dan kecil-kecil, [D] kalus ditunjukkan tanda panah, [E] tunas kompak, batang utama mati dan mulai mengalami necrosis.
Pada subkultur 3, penambahan 0.5-1.0 µM NAA, masih menghasilkan
tunas yang normal, tetapi pada 2.0 µM NAA tunas yang dihasilkan tidak normal
(kecil-kecil, daun keriting, dan berlilin), selain itu nodul yang dihasilkan juga kecil dan kompak. Tunas normal pada subkultur 3 diperoleh pada perlakuan 4.44 µM BA dengan 0.0, 0.5 dan 1.0 µM NAA dan 8.88 µM BA tanpa NAA,
sedangkan pada perlakuan 4.44 µM BA + 2.0 µM NAA dan perlakuan lainnya
menghasilkan tunas yang tidak normal dengan morfologi daun yang keriting, kaku, tanaman lebih pendek, batang utama mati dan pada beberapa perlakuan terbentuk kalus.
Semakin tinggi konsentrasi BA dan NAA dan semakin sering frekwensi subkultur (sampai subkultur ke-3) akan menghasilkan tunas yang tidak normal
sama juga dilaporka n pada kultivar Queen (Nursandi 2005). Penggunaan sitokinin konsentrasi tinggi dilaporkan menghasilkan tunas hiperhidrik pada tanaman ubi kayu (Konan et al. 1997), menyebabkan vitrifikasi atau suatu kondisi fisiologis in vitro yang menyebabkan disorganisasi seluler (Ziv 1991), menyebabkan pembentukan kalus pada bagian dasar eksplan pada Ixora coccinea (Lakshamana
et al. 1997), meningkatkan produksi etilen (Kevers & Gasper 1985), menyebabkan stomata terus membuka sehingga respirasi tanaman tinggi, yang pada akhirnya menyebabkan kematian pada tanaman (Wattimena et al. 1992).
Perlakuan NAA tanpa tambahan BA menghasilkan tunas dengan dominasi apikal (Gambar 4), auksin dapat menimbulkan terjadinya dominasi apika (Bidwell 1974), sedangkan pada perlakuan yang diberi tambahan sitokinin, terutama BA pada konsentrasi tinggi menghasilkan tunas dan tidak ditemui adanya dominasi
apikal (Gambar 5 dan 7). Penambahan zat pengatur tumbuh (terutama sitokinin) ke dalam medium kultur dapat menghilangkan dominasi apikal. Sebagai hasilnya
adalah tunas yang kompak dan padat (Wattimena et al. 1992).
4.1.2.2 Multiplikasi
Rekapitulasi hasil analisis ragam jumlah tunas dan jumlah nodul pada
subkultur 1, subkultur 2 dan subkultur 3 ditunjukkan pada Tabel 2. Interaksi BA dan NAA berpengaruh sangat nyata pada subkultur 1 dan subkultur 3 terhadap
jumlah tunas dan nodul. NAA berpengaruh sangat nyata pada subkultur 1 dan subkultur 2 terhadap jumlah tunas dan nodul, sedangkan BA berpengaruh sangat nyata pada subkultur 3 terhadap jumlah tunas dan berpengaruh sangat nyata pada subkultur 1, subkultur 2 dan subkultur 3 terhadap jumlah nodul.
4.1.2.3 Tunas
Rata- rata jumlah tunas setiap perlakuan pada subkultur 1, subkultur 2 dan subkultur 3 ditunjukkan pada Tabel 3. Pada subkultur 1 penambahan 4,44-17,76 µM BA + 0.5–2.0 µM NAA menghasilkan tunas dengan rata-rata 4.45-13.90
tunas/eksplan. Rataan jumlah tunas tertinggi diperoleh dari perlakuan 17.76 µM
BA + 0.5 µM NAA, tetapi tidak berbeda nyata dengan perlakuan 4.44 µM BA +
perlakuan 17.76 µM BA + 1.0 µM NAA. Jumlah tunas terendah diperoleh dari
perlakuan 0.5 µM NAA yaitu 1.92 tunas/eksplan yang tidak berbeda nyata dengan
tanaman kontrol. Jumlah tunas akibat penambahan 8.88 µM BA + 0.5 µM NAA
jika dibandingkan dengan tanaman kontrol meningkat 3 kali, sedangkan
penambahan 4.44 µM BA tanpa NAA dapat meningkatkan jumlah tunas 2.8 kali
tanaman kontrol.
Tabel 2. Rekapitulasi hasil analisis ragam jumlah tunas dan jumlah nodul yang dihasilkan pada 5 MST
Subkultur
Keterangan : tn: tidak nyata, *: berbeda nyata (a=5%), ** : berbeda sangat nyata (a=1%)
Tabel 3. Jumlah tunas subkultur 1, subkultur 2 dan subkultur 3 pada 5 MST
Keterangan : Nilai yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT 5%.- tidak ada pengamatan (tanaman mati)
NAA menghasilkan jumlah tunas yang tidak berbeda secara statistik, demikian juga dengan perlakuan 8.88 µM BA dan 17.76 µM BA, tetapi untuk perlakuan
13.32 µM BA tanpa tambahan NAA menghasilkan rataan jumlah tunas yang lebih
sedikit dibandingkan jika dikombinasikan dengan NAA.
Pada subkultur 3 rata-rata jumlah tunas yang dihasilkan adalah 1.7-21.1 tunas/eksplan. Pada subkultur 3, perlakuan BA dengan atau tanpa tambahan NAA menghasilkan jumlah tunas yang tidak berbeda nyata secara statistik. Meskipun tidak berbeda secara statistik, semakin sering frekwensi subkultur dilakukan semakin tinggi rataan jumlah tunas yang dihasilkan.
Eksplan yang ditanam pada media dasar MS (tanaman kontrol) memiliki laju multiplikasi yang rendah dengan bertambahnya frekwensi subkultur, yaitu 4.1
tunas pada subkultur 1, dan 0.3 pada subkultur 3, sedangkan pada subkultur 2 tanaman kontrol tidak menghasilkan tunas. Perubahan laju multiplikasi tersebut
diduga disebabkan oleh kandungan zat pengatur tumbuh endogen. Pada tahap awal subkultur kandungan sitokinin dan auksin endogen masih tinggi, dengan
adanya subkultur berulang pada media MS0 menyebabkan kandungan sitokinin dan auksin endogen berkurang sehingga menurunkan laju multiplikasi.
Dari hasil diatas maka perlakuan 4.44 µM BA tanpa tambahan NAA dapat dipertimbangkan untuk menjadi satu pilihan dalam perbanyakan nenas Smooth cayenne, selain bahan kimia yang dibutuhkan lebih sedikit, perlakuan ini juga menghasilkan jumlah tunas yang tidak berbeda dengan perlakuan lainnya, dan
tunas yang terbentuk merupakan tunas yang normal (Tabel 1). Selain alasan tersebut diatas, penelitian sebelumnya yang dilaporkan oleh Nursandi (2005) pada
nenas kultivar Queen, tanaman hasil perbanyakan in vitro dari perlakuan 4.44 µM BA memiliki diameter tajuk, tinggi tanaman, panjang, lebar dan jumlah daun yang
lebih baik dibandingkan tanaman yang berasal dari perlakuan 8.88-17.76 µM BAP
pada umur 44 minggu setelah aklimatisasi.
Jumlah tunas hasil penelitian ini lebih tinggi dibandingkan dengan hasil penelitian Nursandi (2005) pada konsentrasi BAP dan jenis kultivar nenas Smooth cayenne, yaitu 1.0-3.3 tunas pada subkultur 1, 4.7-6.0 tunas pada subkultur 2.
Imelda dan Erlyandari (2000) melaporkan penambahan 4.44 µM BA
langsung pada media yang mengandung BA. Prahardini (1995) menghasilkan 9 tunas/eksplan pada penambahan 8 mg BA + 0.5 mg GA3 selama 5 bulan. Zepada dan Segawa (1981) menghasilkan 3 tunas/eksplan pada penambahan 0.5 atau 1.0 µM BA selama 30 hari.
Perbedaan hasil ini diduga karena beberapa faktor, diantaranya perbedaan sumber eksplan yang digunakan dan konsentrasi NAA yang berbeda. Nursandi (2005) menggunakan eksplan yang diinisiasi pada media dasar MS, sedangkan pada penelitian ini eksplan yang digunakan berasal dari media multiplikasi BAP yang telah disubkultur sebanyak dua kali dalam media dasar MS. Wattimena et al. (1992) menyatakan bahwa jika eksplan dikultur pada media MS dengan tambahan sitokinin yang tinggi, tunas yang terbentuk bila dikulturkan kembali akan mengalami multiplikasi tunas dengan jumlah yang tinggi. Meskipun eksplan sebelumnya telah dikulturkan pada media dasar MS sebanyak dua kali untuk menurunkan kandungan sitokinin endogen pada eksplan, diduga pengaruh sitokinin endogen yang diperoleh dari media sebelumnya masih terbawa. Kandungan sitokinin endogen ini semakin meningkat dengan adanya penambahan
sitokinin dan auksin eksogen. Mercier et al. (2003) melaporkan penambahan 2.0 mg/l BA dan 1.0 mg/l NAA pada media dasar MS meningkatkan kandungan
sitokinin endogen, terutama N6(2isopentenyl)adenin (iP) yang diduga sebagai pendorong pertumbuhan tunas pada nenas.
Pada beberapa tanaman hasil perbanyakan in vitro mengalami perubahan genetik yang menyebabkan adanya variasi somaklonal (Larkin & Scowcroft
1981). Pada penelitian ini sampai pada 13 minggu setelah aklim pada semua perlakuan BA dan NAA tidak dijumpai adanya variasi atau keragaman
somaklonal. Walaupun pada perlakuan BA dan NAA dengan konsentrasi tinggi terdapat tunas yang tidak normal seperti, daun keriting dan berlilin, tanaman kerdil, dan pada beberapa tunas mengalami fitrifikasi, tetapi pada saat eksplan dipindah ke media MS tanpa zat pengatur tumbuh, tanaman kembali normal. Hal
ini menunjukkan penambahan 4.44-17.76 µM BA yang dikombinasikan dengan
0.5-2.0 µM NAA tidak menginduksi munculnya variasi. Sehingga metode ini
4.1.2.4 Nodul
Rata-rata jumlah nodul setiap perlakuan pada subkultur 1, subkultur 2 dan
subkultur 3 ditunjukkan pada Tabel 4. Pada subkultur 1, perlakuan 4.44-17.76 µM
BA + 0.5-2.0 µM NAA menginduksi pembentukan nodul sebanyak 1.7-13.1
nodul/eksplan pada 5 MST. Rataan jumlah nodul tertinggi diperoleh dari
perlakuan 0.0 µM BA + 2.0 µM NAA, 13.32 µM BA + 0.5 µM NAA dan 17.76 µM BA + 2.0 µM NAA. Pada Tabel 4 terlihat jumlah nodul yang dihasilkan dari
perlakuan BA tanpa ta mbahan NAA relatif sedikit yaitu rata-rata 0.6-1.8
nodul/eksplan. Sedangkan penambahan NAA meningkatkan pembentukan nodul.
Tabel 4. Jumlah nodul subkultur 1, subkultur 2 dan subkultur 3 pada 5 MST
Subkultur BA (µM) NAA (µM)
Keterangan : Nilai yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT 5%. - tidak ada pengamatan.
Pada subkultur 2, jumlah nodul tertinggi diperoleh dari perlakuan 1.0 µM
NAA tanpa tambahan BA yaitu 9.2 nodul/eksplan, sedangkan perlakuan
4.44-17.76 µM BA + 0.5-2.0 µM NAA menghasilkan rataan nodul yang tidak berbeda nyata secara statistik, dengan rataan 0.1-9.0 nodul/eksplan. Pola yang sama seperti
Pada subkultur 3, perlakuan 4.44-17,76 µM BA yang dikombinasikan
dengan 4 taraf NAA menghasilkan rataan jumlah nodul 2.1-8.2. Pada Tabel 4 terlihat penambahan BA dengan atau tanpa NAA menghasilkan rataan nodul yang tidak berbeda nyata.
Pengaruh subkultur terhadap jumlah tunas
Hasil rekapitulasi analisis ragam jumlah tunas dan jumlah nodul antar
subkultur pada media multiplikasi dapat dilihat pada Tabel 5. Jumlah tunas yang dihasilkan antar subkultur berbeda sangat nyata, tetapi jumlah nodul tidak berbeda
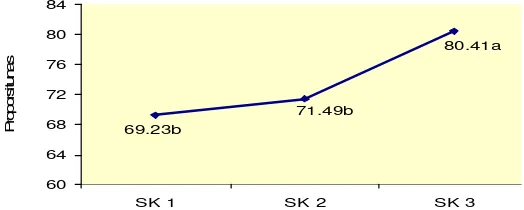
nyata. Jumlah tunas tertinggi diperoleh pada subkultur 3 yaitu rata-rata 15 tunas/eksplan, sedangkan pada subkultur 1 rata-rata jumlah tunas hanya
7.5/eksplan, sangat berbeda nyata dengan subkultur 2 dan subkultur 3 (Gambar 8). Hal ini berarti semakin lama eksplan berada dalam media kultur yang mengandung BA dan NAA semakin banyak jumlah tunas yang dihasilkan, tetapi tidak demikian dengan jumlah nodul.
Tabel 5. Rekapitulasi hasil analisis ragam jumlah tunas dan jumlah nodul antar subkultur pada media multiplikasi
Peubah Respon
Tunas **
Nodul tn
Keterangan : tn: tidak nyata, *: berbeda nyata (a=5%), ** : berbeda sangat nyata (a=1%)
7.58c
Gambar 8. Rata-rata jumlah tunas dari perlakuan BA dan NAA pada subkultur 1, subkultur 2 dan subkultur 3. (SK: subkultur)
subkultur 3). Fiorino dan Loreti (1997) menyatakan bahwa jumlah tunas baru yang dihasilkan dari satu eksplan meningkat sampai subkultur ketiga atau keempat kemudian stabil.
4.1.2.5 Proporsi tunas terhadapNodul
Rekapitulasi hasil analisis ragam proporsi jumlah tunas terhadap jumlah nodul antar subkultur pada media multiplikasi ditunjukkan pada Tabel 6. Proporsi tunas terhadap nodul yang terbentuk pada subkultur 1, subkultur 2 dan subkultur 3
dapat dilihat pada Tabel 7. Pada subkultur 1 perlakuan 0.5 µM NAA dan kontrol
100% menghasilkan tunas, tetapi tidak berbeda nyata dengan perlakuan 4.44 dan
8.88 µM BA dengan atau tanpa tambahan NAA. Pada 2.0 µM NAA proporsi
tunas hanya 31.1%, ini berarti jumlah nodul yang terbentuk lebih banyak dibandingkan jumlah tunas, tidak berbeda dengan perlakuan 13.32 µM BA yang
dikombinasikan 0.5 dan 1.0 µM NAA, dan 17.76 µM BA yang dikombinasikan
dengan 1.0 dan 2.0 µM NAA. Pada subkultur 1, semakin tinggi konsentrasi BA dan NAA semakin kecil proporsi jumlah tunas yang terbentuk, tetapi tidak
demi kian dengan subkultur 1 dan subkultur 2.
Tabel 6. Rekapitulasi hasil analisis ragam proporsi jumlah tunas terhadap jumlah nodul antar subkultur pada media multiplikasi
Proporsi tunas/nodul SK 1 SK 2 SK 3
BA ** tn tn
NAA ** tn tn
BA*NAA ** * **
Keterangan : tn: tidak nyata, *: berbeda nyata (a=5%), ** : berbeda sangat nyata (a=1%)
Pada subkultur 2, tanaman kontrol tidak membentuk tunas maupun nodul.
Perlakuan 4.44-8.88 µM BA menghasilkan rataan proporsi jumlah tunas yang
tinggi dan secara statistik tidak berbeda dengan adanya penambahan NAA atau
tanpa NAA, kecuali untuk perlakuan 8.88 µM BA + 2.0 µM NAA menghasilkan
proporsi tunas yang lebih rendah. Pada perlakuan 13.32-17.76 µM BA,
penambahan NAA meningkatkan proporsi jumlah tunas.
Pada subkultur 3 proporsi tunas dari tanaman kontrol adalah 100%, tetapi
![Gambar 5. Morfologi eksplan pada subkultur 1. [A] Tunas langsung terbentuk tanpa melalui nodul; [B] Tunas terbentuk melalui nodul dan tanpa nodul; [C] Nodul yang pecah membentuk tunas; [D-E] Kumpulan nodul; [ F] Tunas yang padat, dan kompak](https://thumb-ap.123doks.com/thumbv2/123dok/430176.420807/41.595.115.510.438.573/gambar-morfologi-subkultur-langsung-terbentuk-terbentuk-membentuk-kumpulan.webp)
![Gambar 7. Bentuk-bentuk tunas yang tidak normal. [A] tunas kompak, daun berlilin dan rapuh, [B] daun keriting, batang utama mati, [C dan F] nodul kompak dan kecil-kecil, [D] kalus ditunjukkan tanda panah, [E] tunas kompak, batang utama mati dan mulai menga](https://thumb-ap.123doks.com/thumbv2/123dok/430176.420807/42.595.116.512.133.395/gambar-bentuk-normal-kompak-berlilin-keriting-ditunjukkan-batang.webp)