TRANSFORMASI GENETIK TANAMAN KENTANG (Solanum
tuberosum L.) KULTIVAR JALA IPAM DENGAN GEN Hd3a
WIWIN WIDIARTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Transformasi Genetik Tanaman Kentang (Solanum tuberosum L.) Kultivar Jala Ipam dengan Gen Hd3a adalah benar karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
RINGKASAN
merupakan kentang olahan yang sangat penting. Produksi kentang untuk French fries beku masih sedikit, sehingga peningkatan produksi bibit dan perakitan kultivar baru menjadi penting untuk dilakukan. Jala Ipam merupakan kultivar kentang yang cocok untuk produksi French fries beku. Rekayasa genetik dengan gen Hd3a dapat memperbaiki produktivitas kultivar ini. Hd3a merupakan mobile florigen pada tanaman padi yang mempunyai homologi dengan FT (flowering locus T) dari Arabidopsis. Ekspresi berlebih gen Hd3a menginduksi pembungaan dan pengumbian pada kentang cv. Andigena transgenik. Penelitian ini bertujuan untuk melakukan transformasi genetik kentang Jala Ipam dengan gen Hd3a.Transformasi genetik dilakukan dengan perantara Agrobacterium tumefaciens strain LBA4404 yang membawa plasmid p2K1-Hd3a yang mengandung gen Hd3a di bawah kendali promoter rolC dan A. tumefaciens yang membawa plasmid pCambia1300-Hd3a yang mengandung gen Hd3a di bawah kendali promoter 35S CaMV. Ruas batang (internode) digunakan sebagai eksplan yang ditransformasi. Eksplan mulai membentuk kalus 2 minggu setelah kokultivasi. Efisiensi transformasi pada penelitian ini adalah sebesar 18% untuk tanaman yang ditransformasi dengan p2K1-Hd3a dan 7% untuk tanaman yang ditransformasi dengan pC1300-Hd3a.
Analisis molekuler dengan PCR dilakukan untuk mengetahui integrasi gen Hd3a di dalam tanaman transgenik. PCR dilakukan dengan menggunakan pasangan primer rolC-F dan Hd3a-FP-R untuk tanaman transgenik putatif yang dihasilkan dari transformasi menggunakan plasmid p2K1-Hd3a dan pasangan primer 35S-F dan Hd-R untuk tanaman transgenik putatif yang dihasilkan dari transformasi menggunakan plasmid pC1300-Hd3a. Analisis PCR menunjukkan bahwa dua dari tiga tanaman transgenik putatif adalah tanaman transgenik yang mengandung gen Hd3a di bawah kendali promoter rolC dan keempat tanaman transgenik putatif semuanya adalah tanaman transgenik yang mengandung gen Hd3a di bawah kendali promoter 35S CaMV. Hasil ini menunjukkan bahwa proses transformasi genetik kentang kultivar Jala Ipam dengan gen Hd3a telah berhasil dengan baik.
SUMMARY
WIWIN WIDIARTI. Genetic transformation of potato (Solanum tuberosum L.) cv Jala Ipam by using Hd3a gene. Supervised by SUHARSONO and GUSTAAF ADOLF WATTIMENA.
Potato is one important food that can be used as unprocessed food and processed food. Frozen French fries are very important processed potatoes. Production of potatoes for frozen French fries are still low, so increasing seed production and creating new cultivars are very important. Jala Ipam is a potato cultivar suitable for the production of frozen French fries. Genetic engineering by using Hd3a gene can improve the productivity of this cultivar. Hd3a is mobile florigen in rice plants that have homology to the FT (flowering locus T) from Arabidopsis. Overexpression of Hd3a gene induces flowering and tubering in transgenic potato cv. Andigena. This research has an objectic to transform genetically potato cv. Jala Ipam by using Hd3a gene.
Genetic transformation was done by using Agrobacterium tumefaciens strain LBA4404 harbouring p2K1-Hd3a plasmid that contains Hd3a gene under the control of rolC promoter and A. tumefaciens carrying pCambia1300-Hd3a that contains Hd3a gene under the control of CaMV 35S promoter. Internodes of stem were used as explants to be genetically transformed. Explant started to form calli 2 weeks after co-cultivation. The efficiency of transformation in this study is 18% for plants transformed with p2K1-Hd3a and 7 % for the plants transformed with pC1300-Hd3a.
Molecular analysis by PCR was carried out to determine Hd3a gene integration in transgenic plants. PCR was performed using primer pairs of rolC-F and Hd3a-FP-R for putative transgenic plants produced from the transformation using plasmid p2K1-Hd3a and primer pair of 35S-F and Hd-R for putative transgenic plants resulted from the transformation using a plasmid pC1300-Hd3a. PCR analysis showed that two of three putative transgenic plants are transgenic plants containing Hd3a gene under the control of rolC promoter and all four putative transgenic plants are transgenic plants containing Hd3a gene under the control of 35S CaMV promoter. These results indicate that the genetic transformation of potato cultivars Jala Ipam with Hd3a gene has been successful.
Keywords: Potato cv Jala Ipam, Hd3a gene, Agrobacterium tumefaciens, rolC promoter, 35S CaMV promoter
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
TANSFORMASI GENETIK TANAMAN KENTANG (Solanum
tuberosum L.) KULTIVAR JALA IPAM DENGAN GEN Hd3a
WIWIN WIDIARTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis berhasil menyelesaikan penelitian dan tesis yang berjudul Transformasi Genetik Tanaman Ketang (Solanum tuberosum L.) Kultivar Jala Ipam dengan Gen Hd3a.
Ucapan terimakasih sebesar-besarnya dari hati yang paling dalam penulis sampaikan kepada Prof Dr Ir Suharsono, DEA dan Prof Dr Ir Gustaaf Adolf Wattimena, MSc sebagai komisi pembimbing atas ilmu, perhatian, nasehat, masukan, kesabaran, dan waktu yang diberikan selama membimbing penulis. Riset Andalan Perguruan Tinggi dan Industri atas nama Prof Dr Ir Suharsono, DEA dengan judul “Peningkatan Produksi Bibit Kentang dan Perakitan Kultivar Baru Kentang untuk Membangun Industri Kentang Olahan” dengan kontrak no. 079/SP2H/LT/DRPM/II/2016, yang telah membiayai penelitian ini. Penulis mengucapkan terima kasih kepada penguji luar komisi Dr Ir Agus Purwito, MScAgr atas saran dan masukan sehingga tulisan ini menjadi lebih baik. Ucapan trimakasih juga disampaikan kepada staf dan rekan-rekan di Lab. Kultur Jaringan (Mbak Nia, Teh Sarah, Pak Asep, Pak Sairi, Ari, Isni) dan Lab. BIORIN (Mbak Pepi, Pak Mulya, Pak Asri, Pak Ilyas, Bu idha, Bu Ida, Bu Ifa, Mbak Nurul, Nurul, Fajri, Seni, Yusdar, Fatah, Tiwi, Destik, Lutfi, Nadea, Farhana), serta teman-teman S1 (Bustomi, Ika, Ica, Lisa, Ina, Eka) atas segala bantuan, semangat, ilmu, kebersamaan, keceriaan dan persahabat selama proses penelitian dan penulisan. Kepada suami terkasih Dody Darsono MSi, ananda tercinta dan tersayang Abrisam Nur Alam Syah dan Umi Titin, penulis mengucapkan terimakasih yang sebesar-besarnya atas segala bentuk pengorbanan, kesetiaan, kesabaran, pengertian, dukungan moril, dan doa sehingga penulis dapat menyelesaikan pendidikan S2. Karya ilmiah ini penulis persembahkan kepada suami, anak, dan orang tua tersayang. Bapak Askawi (alm.) dan Ibu Hartini atas doa, dukungan, kesabaran dan kasih serta Bapak Kadori dan Ibu Wastiri (alm.) atas doa, dukungan, dan pengertiannya. Terimakasih juga disampaikan kepada teman-teman seperjuangan BTK’12 dan BTK’13 atas segala semangat belajar, doa, persahabatan, dan perhatian. Semoga persahabat ini dapat tetap terjalin.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan dapat memberikan sumbangan bagi perkembangan bioteknologi tanaman terutama pada tanaman kentang.
Bogor, Juni 2016
DAFTAR ISI
DAFTAR ISI ix
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 3
Tanaman Kentang dan Manfaatnya 3 Pembungaan dan Pengumbian Kentang 3
Pembungaan 3
Pengumbian 5
Jalur Lintasan Fotoperiode 5
Jalur Lintasan Giberelin 6
Gen Hd3a 7
Transformasi Genetik dengan Perantara Agrobacterium tumefaciens 8 Perakitan Tanaman Kentang Transgenik 9
METODE PENELITIAN 10
Waktu dan Tempat 10
Bahan Penelitian 10
Metode 11
Perbanyakan Tanaman. 11
Transformasi Kentang dengan Gen Hd3a 11 Regenerasi Hasil Transformasi Tanaman Kentang 11 Identifikasi Tanaman Transgenik dengan Polymerase Chain Reaction 12
HASIL DAN PEMBAHASAN 13
Regenerasi Tanaman Kentang 13
Identifikasi Tanaman Transgenik 17
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
0
DAFTAR TABEL
1 Efisiensi transformasi dan efisiensi regenerasi gen Hd3a pada tanaman
kentang kultivar Jala Ipam 15
DAFTAR GAMBAR
1 Jalur pengaturan induksi pembungaan melalui dugaan fotoperiode pada
tanaman Arabidopsis thaliana 4 2 Jalur pengaturan pembungaan pada padi dibawah kondisi hari pendek 8 3 Posisi gen Hd3a di dalam daerah T-DNA dari vektor ekspresi 10 4 Kalus yang terbentuk pada media induksi kalus dan regenerasi 13 5 Tahapan transformasi genetik kentang Jala Ipam transgenik 14 6 Perkembangan kalus non-transgenik 14 7 Tanaman kentang kultivar Jala Ipam in vitro berumur 4 minggu 15 8 Hasil analisi PCR DNA tanaman kentang transgenik p2K1Hd3a 17 9 Hasil analisi PCR DNA tanaman kentang transgenik pC1300-Hd3a 18
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Tanaman kentang merupakan tanaman pangan utama keempat dunia setelah jagung, padi, dan gandum. Produksi kentang di Indonesia tahun 2013 adalah 1,124, 282 ton, naik menjadi 1,211,400 ton pada tahun 2014 (Kementan 2015). Kenaikan produksi kentang tersebut masih kurang memenuhi permintaan pasar yang semakin bertambah. Pertambahan jumlah penduduk dan berkembangnya gaya hidup modern berdampak pada peningkatan permintaan kentang. Peningkatan permintaan kentang belum diimbangi dengan peningkatan jumlah produksi. Kebutuhan kentang yang semakin meningkat mengharuskan kentang di Indonesia tumbuh baik pada daerah dataran tinggi yaitu 1300 meter di atas permukaan laut (Tantowijoyo dan Fliert 2006), serta menghendaki suhu rendah antara 15.5 °C – 18.3 °C (BPTPY 2004). Masalah penanaman pada daerah dataran tinggi adalah adanya aliran permukaan dan erosi tanah (Handoko et al. 2011) yang menyebabkan produksi rendah. Tanaman kentang mampu berbunga dan menghasilkan umbi jika ditanam pada daerah dataran tinggi. Pembentukan umbi pada beberapa varietas kentang seperti kentang Andigena sangat dipengaruhi oleh hari pendek (Jackson 1999; Navarro et al. 2011; Abelenda et al. 2014).
Rekayasa genetik merupakan salah satu cara untuk memperbaiki sifat-sifat tanaman. Perbaikan tanaman melalui rekayasa genetik didasarkan pada manipulasi gen yang relevan dan tersedianya bahan genetik untuk transformasi ke dalam sel tanaman (Nasir 2002). Rekayasa genetik pada tanaman kentang telah banyak dilakukan seperti untuk mendapatkan ketahanan terhadap penyakit bakteri (Nurhasanah et al. 2003), ketahanan terhadap jamur dan herbisida (Khan et al. 2008), serta ketahanan terhadap virus (Mikschofsky et al. 2011). Rekayasa genetik yang belum banyak dilakukan adalah merakit tanaman kentang varietas komersial yang mampu berbunga dan berproduksi tinggi.
Bunga mempunyai peranan yang sangat penting dalam perakitan kultivar baru melalui persilangan. Kentang kultivar Jala Ipam relatif sulit berbunga, sehingga induksi pembungaan pada kultivar ini sangat penting dalam rangka persilangan dengan kultivar kentang lainnya. Kentang kultivar Jala Ipam sangat cocok untuk diolah menjadi kentang goreng beku (frozen french fries). Kentang ini mempunyai umbi yang berukuran besar dan berbentuk lonjong. Kandungan pati umbi kentang kultivar Jala Ipam tinggi.
2 berpindah tempat (Tamaki et al. 2007). Ekspresi berlebih Hd3a yang dikendalikan oleh promoter konstitutif 35S CaMV (Kojima et al. 2002) dan promoter spesifik rolC (Tamaki et al. 2007) pada padi transgenik menyebabkan pembungaan lebih cepat. Keberadaan gen Hd3a yang dikendalikan baik oleh promoter konstitutif 35S CaMV maupun oleh promoter rolC mengakibatkan munculnya bunga lebih cepat pada tunas jarak pagar (Jatropha curcas) transgenik yang mengandung gen Hd3a secara in vitro (Sulistyaningsih 2012). Promoter rolC merupakan promoter spesifik floem yang mampu mengeskpresikan Hd3a dengan aktivitas tinggi, terbukti dari percepatan waktu pembungaan pada padi transgenik rata-rata 19.5 hari (Tamaki et al. 2007).
Ekspresi berlebih gen Hd3a mampu menyebabkan pembungaan lebih cepat pada beberapa tanaman seperti Oryza sativa L. (Kojima et al. 2002; Tamaki et al. 2007; Wang et al. 2013), Saussurea involucrata (Li et al. 2011), Jatropha curcas (Sulistyaningsih 2012), Nicotiana benthamiana (Syafitri 2012; Senjaya 2013), serta mampu mengaktifkan dua proses perkembangan sekaligus yaitu pembungaan dan pembentukan umbi pada kentang Andigena (Navarro et al. 2011). Pengaruh ekspresi berlebih gen Hd3a di dalam kentang Andigena trangenik terhadap pembungaan dan pengumbian menjadi fenomena yang menarik untuk dilakukan pada kentang yang ada di Indonesia.
Introduksi gen ke dalam genom tanaman merupakan suatu upaya perbaikan yang langsung mengenai karakter yang diinginkan. Introduksi gen melalui transformasi genetik dengan bantuan A. tumefaciens merupakan metode yang banyak digunakan. Respon beberapa kultivar kentang in vitro terhadap infeksi A. tumefaciens pernah dilakukan oleh Churiyah et al. (1994). Keberhasilan transformasi genetik pada kentang telah banyak dilakukan diantaranya pada varietas Cardinal dan Heera (Khatun et al. 2012), kultivar Desiree, Agria, dan Marfona (Khasani et al. 2012), kultivar Baraka (Bustomi 2014), kultivar Diamant (Mardiyyah 2015; Nurrizky 2015), kultivar Agria (Salsabila 2015), dan kultivar Kennebec (Maulani 2015).
Tujuan Penelitian
3
TINJAUAN PUSTAKA
Tanaman Kentang dan Manfaatnya
Tanaman kentang merupakan tanaman yang dipanen umbinya dan digunakan sebagai makanan pokok bagi sebagian penduduk dunia. Kentang merupakan tanaman pangan dunia setelah padi, gandum dan jagung (Wattimena 1992). Kentang diproduksi dalam jumlah besar di negara-negara maju. Di Indonesia kentang menjadi salah satu komoditas sayuran yang mendapat prioritas pengembangan, karena mempunyai potensi sebagai tanaman penunjang program diversifikasi pangan untuk memenuhi kebutuhan gizi masyarakat (Prabaningrum et al. 2014). Kentang dijadikan pengganti pangan yang ideal karena mengandung protein, karbohidrat, lemak, mineral dan vitamin yang seimbang bagi tubuh manusia (Wattimena 1992; McGregor 2007).
Kentang dikelompokkan dalam dua jenis yaitu kentang sayur dan kentang bahan baku industri (processing). Kentang sayur tidak terlalu membutuhkan karakter khusus seperti halnya pada kentang bahan baku industri. Sebagai bahan baku industri, kentang banyak digunakan untuk membuat keripik, tepung kentang, atau sebagai french fries. Kentang french fries memerlukan umbi kentang dengan kandungan gula rendah, bahan kering rendah, dan bentuk umbi yang panjang. Kentang olahan yang banyak dibudidayakan di Indonesia adalah kentang Atlantik, sementara kentang yang digunakan sebagai kentang french fries masih belum banyak. Saat ini Indonesia masih seratus persen mengimpor kentang french fries dari luar negeri (Suharsono 2015).
Kentang Jala Ipam merupakan klon hasil seleksi positif dari variasi somaklonal Russet Burbank. Karakteristik kentang kultivar Jala Ipam disajikan pada Lampiran 1. tanaman. Faktor-faktor tersebut dikelompokkan menjadi dua, yaitu faktor internal dan faktor eksternal. Faktor internal meliputi faktor genetik dan fitohormon, sedangkan faktor eksternal atau faktor lingkungan diantaranya adalah fotoperiode, suhu, dan intensitas cahaya (Song et al. 2013).
Pembungaan
4
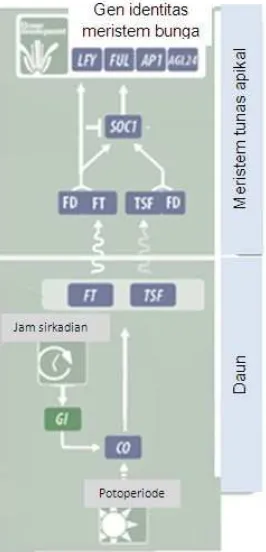
panjang hari mempengaruhi induksi pembungaan pada berbagai tumbuhan. Pada tanaman A. thaliana, respon tumbuhan terhadap fotoperiode dipengaruhi oleh jam sirkadian yang mengarah pada ekspresi Gigantea (GI), diikuti oleh pengaktifan ekspresi gen Constans (CO) (Coelho et al. 2013). CO menginduksi traskripsi FLOWERING LOCUS T (FT) dan TWIN SISTER OF FT (TSF). Proses transkripsi terjadi di dalam floem dan selanjutnya disampaikan ke meristem tunas apikal (SAM). Gen FT dan TSF bersama dengan FLOWERING LOCUS D mengaktifkan ekspresi gen identitas meristem bunga (Matsoukas 2015). Interaksi FT-FD secara langsung ataupun tidak langsung mengaktifkan gen tipe bunga seperti gen SOC1 dan APETALA1 (AP1) (Abe et al. 2005) (Gambar 1). AP1 mengaktifkan ekspresi gen LEAFY (LFY) yang pada gilirannya bertanggung jawab untuk mengikat promoter AP1 dan mengontrol ekspresi SEPALLATA3 (SEP3) baik langsung maupun tidak langsung yang terlibat dalam pembentukan organ bunga (Kaufmann et al. 2010).
Gambar 1 Jalur pengaturan induksi pembungaan melalui dugaan fotoperiode pada tanaman Arabidopsis thaliana. Penggalan gambar dari Bouche et al. (2016).
5 molekul GA mengikat reseptor sel, GID1, yang memfasilitasi perubahan bentuk yang memungkinkan pengikatan wilayah terminal-N dari DELLA (Goldberg-Moller et al. 2013). Giberelin mendorong pembungaan melalui pengaktifan beberapa gen yang menyandi beberapa protein seperti SUPRESSOR OF OVEREXPRESSION OF CONSTANS 1 (SOC1), LEAFY (LFY), dan FLOWERING LOCUS T (FT) pada daun dan meristem bunga (Mutasa-Gottegens dan Hedden 2009).
Pengumbian
Umbi kentang terbentuk dari cabang yang tumbuh di dalam tanah yang disebut stolon. Proses pembentukan umbi ditandai dengan terhentinya pertumbuhan dari stolon yang diikuti pembesaran stolon di bagian ujung dan diisi oleh sebagian berat kering hasil fotosintesis. Proses pengumbian pada kentang terdiri dari beberapa tahap: pembentukan dan pemanjangan stolon, induksi umbi, inisiasi umbi, dan pertumbuhan umbi (Aksenova et al. 2012).
Terdapat enam faktor kunci yang mendorong proses pembentukan umbi kentang. Faktor tersebut adalah antara lain: fotoperiode, fitokrom, cahaya yang optimal, sukrosa tinggi, suhu rendah dan nitrogen rendah. Faktor tersebut mempengaruhi beberapa jalur sinyal gen (Jackson 1999). Sama halnya dengan induksi pembungaan, paling sedikit ada dua jalur yang mengontrol pembentukan umbi pada kentang, yaitu jalur lintasan fotoperiode dan jalur lintasan giberelin (Martinez-Garcia et al. 2002).
Jalur Lintasan Fotoperiode
Panjang hari (fotoperiode) mempengaruhi induksi pengumbian pada kentang. Perbedaan kultivar (varietas) kentang terkadang mempengaruhi kebutuhan akan penyinaran. Kentang tipe liar dan beberapa kentang budidaya membutuhkan fotoperiode hari pendek (SD) untuk menginduksi pengumbian (Bou-Torrent et al. 2011). Adanya pengaruh night break (NB) dapat menghambat proses pembentukan umbi. Fitokrom diketahui terlibat dalam respon fotoperiode terhadap night break tersebut. Pengaruh cahaya merah (R) dapat menghambat proses pengumbian, namun jika dilanjutkan dengan perlakuan pemberian cahaya merah jauh (FR) proses pembentukan umbi akan tetap terjadi (Jackson 1999). Sementara lamanya siang hari (LD) dapat mengakibatkan proses pengumbian menjadi lambat dan terhambat (Haverkort 2007; Suarez-Lopez 2013).
6 negatif diatur oleh StCO, yang menahan pembentukan umbi dibawah non-induksi LDs (Navarro et al. 2011; Gonzalez-Schain et al. 2012).
Jalur Lintasan Giberelin
Hormon tanaman giberelin (GAs) hadir di dalam jaringan floem dan berperan sebagai molekul florigen pada beberapa spesies. Giberelin (GAs) terlibat juga dalam pengaturan pengumbian (Prat 2010). Kadar GA di daun menurun dibawah kondisi hari pendek dan meningkat pada kondisi hari panjang. Tingginya kadar GA pada ujung stolon ditemukan pada perpanjangan maristem stolon, sedangkan penurunan kadar GA berpengaruh pada inisisi pembentukan umbi (Bou-Torrent et al. 2011).
Percobaan pada tanaman kentang Andigena, sintesis GA menghambat pembentukan umbi pada kondisi hari panjang. Secara keseluruhan, kadar GA lebih besar terjadi pada kondisi yang menghambat pembentukan umbi. GA 20-oksidase dan GA 3-20-oksidase mengkatalisasi dua tahap terakhir dari pengaktifan biosintesis GA, dan hasil konversi GA 2-oksidase ke katabolisme menjadi tidak aktif. Ketiga jenis enzim disandikan oleh keluarga kecil gen GA20ox, GA3ox, dan GA2ox. Tiga langkah enzimatik dianggap sebagai situs utama pengaturan biosintesis GA. Ekspresi GA20ox dan GA3ox dikendalikan oleh umpan balik GA1/GA3 (Carrera et al. 1999), sedangkan ekspresi GA2ox diatur oleh umpan maju dari bioaktif GAs (Bou-Torrent et al. 2011). Pada tanaman kentang, tingkat transkripsi dari StGA20ox lebih kecil dalam daun di bawah kondisi non-induksi (SD+NB atau LD) dibandingkan kondisi tanaman dibawah kondisi SD (Bou-Torrent et al. 2011).
Pembungkaman potato GA20ox (StGA20ox1) dan manipulasi kadar GA3ox (StGA3ox) tidak dapat menginduksi pembentukan umbi pada hari panjang (Bou-Torrent 2011). Penambahan GA2ox, StGA2ox1, mengakibatkan pembentukan umbi in vitro, namun tidak pada penanaman di lapang (Kloosterman et al. 2007). StGA2ox1 lebih berperan sebagai gen identitas umbi dibandingkan sebagai pengatur pada induksi umbi. Peningkatan pengaturan StGA2ox1 di stolon dilakukan oleh StSP6A (Navarro et al. 2011).
7
Aktivitas GA dipengaruhi juga oleh suhu. GA menanggapi suhu tinggi dengan mencegah kondisi pembentukan umbi. Efek penghambatan terjadi pada suhu tinggi (suhu siang 32 oC dan malam 28 oC) dan efek mendorong pembentukan umbi terjadi pada suhu rendah (suhu siang 22 oC dan malam 18 oC). Suhu bepengaruh mengubah keseimbangan antara GA dan inhibitor lain yang bertindak secara langsung di ujung stolon (Menzel dalam Hannapel 2007).
Gen Hd3a
Hd3a merupakan salah satu florigen yang berperan dalam induksi pembungaan. Hd3a adalah gen ortholog FT Arabidopsis yang terdapat di padi. Protein ini berfungsi sebagai pendorong pembungaan. Ekspresi tinggi gen Hd3a terjadi saat siang hari sebagai bentuk kontrol dari jalur fotoperiode hari pendek (Kojima et al. 2002). Sebagai penyandi florigen Hd3a dapat bergerak dari daun menuju maristem tunas apikal (SAM) dan menyebabkan pembungaan (Tamaki et al. 2007). Bentuk ekspresi gen Hd3a sama dengan Rice FT- like 1 (RFT1) yang memperlihatkan ekspresi tinggi saat siang hari, dan puncaknya terjadi saat fajar (Kojima et al. 2002).
Pada lintasan pembungaan jalur fotoperiode, ekspresi gen Hd3a diaktifkan oleh gen Hd1. Hd1 merupakan gen ortholog CO Arabidopsis. Berbeda dengan CO, gen Hd1 diekspresikan pada hari pendek dan juga hari panjang. Akan tetapi Hd1 mendorong pembungaan dibawah kondisi hari pendak, dan menghambat pembungaan pada kondisi hari panjang. Ekspresi yang tinggi dari gen Hd1 terjadi saat gelap (Yano et al. 2000). Transkripsi dari Hd3a ditekan kuat pada mutan hd1 NILs dibawah kondisi hari pendek, sedangkan Hd1 mampu meningkatkan ekspresi Hd3a dibawah kondisi hari pendek (Kojima et al. 2002).
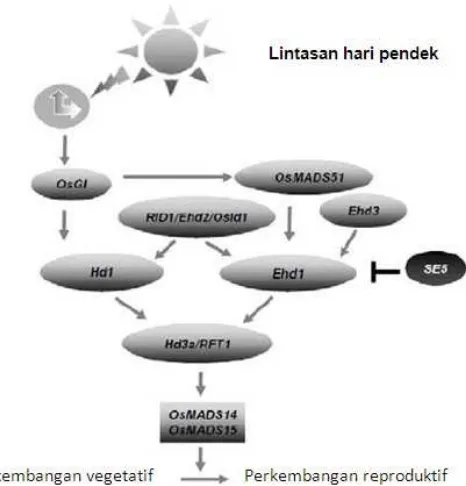
Jalur Hd1-Hd3a di padi sama dengan jalur CO-FT di Arabidopsis. Ekspresi dari Hd1 didorong oleh keberadaan gen OsGI (sebuah gen ortholog GIGANTEA di Arabidopsis). Gen OsGI menyandi protein GI sebagai akibat dari induksi jam sirkadian dibawah kondisi hari pendek dan hari panjang. OsGI akan mengaktifkan ekspresi Hd1 dan selanjutnya mendorong ekspresi dari gen Hd3a. OsGI mampu mengirimkan sinyal akibat fotoperiod hari pendek ke OsMADS51, kemudian akan mengaktifkan ekspresi Ehd1, Hd3a dan RTF1. Hd1 dan Ehd1 dapat diaktifkan oleh RID1, Ehd2, dan OsId1. Di sisi lain Ehd3 mampu mengaktifkan ekspresi Ehd1. Sementara daerah hilir dari gen Hd3a/RTF1 adalah gen-gen MADS-box seperti gen OsMADS14 dan OsMADS15 yang berfungsi sebagai gen penentu indentitas bunga (Gambar 2). Gen OsMADS14 dan OsMADS15 merupakan ortholog gen AP1 di Arabidopsis yang berperan penting dalam mendukung bentuk bunga (Komiya et al. 2008). Pembentukan bunga yang tidak normal dapat terjadi karena gen OsMADS14 dan OsMADS15 tidak diekspresikan secara optimal (Yuan-Li dan Wei-Jiang 2012). Jalur pembungaan padi dibawah kondisi hari pendek disajikan pada Gambar 2.
8
dibawah kondisi non-induksi hari panjang. Induksi pengumbian dapat terjadi pada kondisi hari panjang di kentang ssp. Andigena disebabkan perlakuan penyambungan tanaman tipe liar dengan galur kentang rolC::Hd3a-GFP. Galur kentang transgenik yang dijadikan batang atas (scion) ataupun batang bawah (stock), ternyata dapat menginduksi pengumbian pada kondisi hari panjang (Navarro et al. 2011). Hal ini membuktikan bahwa Hd3a merupakan penginduksi pembentukan umbi yang dapat bergerak.
Gambar 2 Jalur pembungaan pada padi dibawah kondisi hari pendek. Tanda menunjukkan mendorong. Tanda menunjukkan penghambatan (Yuan-Li dan Wei-Jiang 2012).
Penelitian terbaru menunjukkan bahwa selain sebagai aktivator pembungaan, protein Hd3a mampu mendorong percabangan pada tanaman padi. Tsuji et al. (2015) menjelaskan bahwa protein Hd3a mungkin terakumulasi dalam meristem aksilar sehingga mampu mempromosikan percabangan dan diperlukan bagi promosi pembentukan Florigen Activation Complex (FAC). FAC diperlukan untuk proses selain pembentukan bunga. Sebagai sinyal percabangan yang bergerak di padi, aktivitas Hd3a tergantung pada pembentukan FAC.
Transformasi Genetik dengan Perantara Agrobacterium tumefaciens
9
DNA), daerah vir (virulensi), daerah inisiasi replikasi plasmid (ORI-Origin of Replication), dan daerah katabolisme opin. Daerah tersebut memiliki fungsi yang berbeda. Daerah T-DNA dan daerah vir merupakan daerah yang paling berperan dalam proses transformasi genetik.
Proses transformasi genetik dari A.tumefaciens ke dalam sel tanaman diawali dengan pengenalan luka. Luka pada jaringan tanaman berfungsi sebagai jalur masuk bakteri menuju tempat yang dikenali pada permukaan sel tanaman, sehingga sel tanaman menjadi kompeten untuk ditransformasi. Luka menyebabkan tanaman menghasilkan senyawa fenolik (Asetosiringone) yang menarik A. tumefaciens dan menginduksi gen-gen vir yang diperlukan dalam proses transfer T-DNA (Galvin 2003).
Gen vir berperan secara langsung dalam transfer gen. Gen virA mendeteksi senyawa fenolik yang terbentuk diikuti dengan autofosforilasi protein virA dan mengaktifkan gen virG. Protein VirG akan menginduksi ekspresi gen VirD1 yang akan memotong daerah T-DNA pada Agrobacterium sehingga diperoleh utas tunggal T-DNA. Protein VirD2 yang terfosforilasi oleh protein VirD1 akan mengarahkan daerah T-DNA ke dalam nukleus, sedangkan gen virC1 akan melindungi daerah T-DNA dan meningkatkan aktivitas protein VirD. Gen virD menempel pada ujung 5’ T-DNA kemudian membawa DNA ke sitosol sel inang, dan T-DNA akan terinsersi ke dalam genom tumbuhan (Galvin 2003).
Perakitan Tanaman Kentang Transgenik
Kentang merupakan salah satu tanaman budidaya yang sukses ditransformasi. Transformasi tanaman kentang dilakukan untuk tujuan tertentu seperti ketahanan terhadap penyakit, ketahanan terhadap virus, dan juga untuk meningkatkan nutrisi umbi. Kultivar kentang yang pernah ditransformasi salah satunya adalah kentang kultivar Atlantik. Kentang kultivar Atlantik pernah ditransformasi menggunakan gen hordothionin yaitu gen penyandi thionin yang terdapat pada endosperma tanamanan barley sebagai anti bakteri yang dapat meningkatkan resistensi tanaman terhadap serangan bakteri (Nurhasanah et al. 2003). Kentang kultivar Atlantik juga pernah ditransformasi dengan gen penyandi lisozim. Hasil transformasi kentang dengan gen penyandi lisozim menghasilkan tanaman yang tahan terhadap penyakit layu dan busuk lunak (Manguntungi 2014). Penyakit layu merupakan penyakit yang banyak menyerang tanaman kentang sehingga dapat menurunkan produksi hingga 80% (Wattimena 2000).
Perakitan tanaman kentang bukan hanya bertujuan untuk menghasilkan tanaman yang tahan terhadap penyakit bakteri, namun juga untuk meningkatkan komposisi nutrisi. Kashani et al. (2012) melakukan transformasi genetik kentang dengan gen proinsulin manusia. Insulin merupakan senyawa metabolik yang dibutuhkan bagi penderita diabetes.
10
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan pada bulan September 2014 – Oktober 2015 di Laboratorium Biologi Molekuler dan Seluler Tanaman, dan Laboratorium Biotechnology Research Indonesia – The Netherland (BIORIN), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Lembaga Penelitian dan Pengabdian Kepada Masyarakat, Institut Pertanian Bogor.
Bahan Penelitian
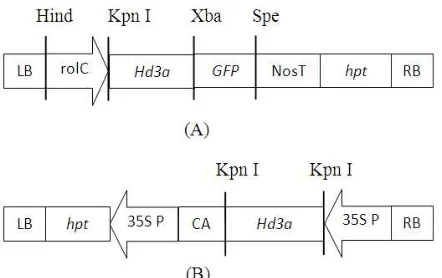
Bahan yang digunakan dalam penelitian ini adalah bagian ruas batang (internode) tanaman kentang in vitro kultivar Jala Ipam. Bakteri A.tumefaciens strain LBA4404 yang membawa plasmid p2K1-Hd3a (Tamaki et al. 2007) dan plasmid pCAMBIA1300-Hd3a (Sulistyaningsih 2012) digunakan untuk proses transformasi genetik tanaman kentang. Di daerah T-DNA pada plasmid p2K1-Hd3a, gen Hd3a dikendalikan oleh promoter rolC, sedangkan pada plasmid pCambia1300-Hd3a, gen Hd3a di bawah kendali promoter 35S CaMV. Peta fisik gen Hd3a di daerah T-DNA disajikan pada Gambar 3.
Gambar 3 Posisi gen Hd3a di dalam daerah T-DNA dari vektor ekspresi. (A) Daerah T-DNA dari p2K1-Hd3a (Tamaki et al. 2007), (B) Daerah T-DNA dari pC1300-Hd3a (Sulistyningsih 2012). LB: left border, RB: right border, rolC: promoter rolC dari A. rhizogenes, Hd3a: gen dari padi, GFP: gen penanda Green Fluorecent Protein, hpt: gen resistensi terhadap higromisin, 35S P: promoter 35S dari cauliflower mosaic virus (CaMV), CA: sekuen polyA dari 35S CaMV.
11
primer 35S-F CCAAGCTCTATCTGTCACTTCATC-3’) dan Hd-R (5’-CTAGGGGTAGACCCTCCTGCC-3’). Gen aktin yang didasarkan pada aktin dari kedelai digunakan untuk menguji kualitas DNA tanaman melalui PCR dengan primer Act-F (5’-ATGGCAGATGCCGAGGATAT-3’) yang terdapat pada ekson 1 dan Act-R (5’-CAGTTGTGCGACCACTTGCA-3’) yang terdapat pada ekson 2.
Media MS (Murashige dan Skoog 1962) digunakan sebagai media dasar untuk kultur tanaman kentang secara in vitro (Lampiran 2). Media MS2 makro digunakan untuk perbanyakan tanaman secara in vitro. Media kokultivasi tersusun dari media MS yang mengandung BA 0.5 g/L, IAA 0.1 g/L, dan acetocyringone 20 mg/L. Media regenerasi merupakan media MS yang mengandung IAA 2 mg/L, BAP 3 mg/L, GA3 1 mg/L, cefotaxime 100 mg/L dan higromisin 40 mg/L. Media LB (bacto tripton 5 g/L, yeast extract 10 g/L, dan NaCl 10 g/L) digunakan untuk kultur bakteri.
Metode
Perbanyakan Tanaman
Tanaman kentang kultivar Jala Ipam in vitro diperbanyak pada media MS2 makro selama satu bulan. Ruas batang yang mengandung satu mata tunas dengan panjang 0.5 cm – 1 cm digunakan sebagai eksplan untuk perbanyakan tanaman.
Transformasi Kentang dengan Gen Hd3a
Bakteri A. tumefaciens dari stok gliserol yang membawa gen Hd3a ditumbuhkan pada media LB cair yang mengandung 50 mg/Lantibiotik kanamisin dan 25 mg/L rifampisin pada suhu ruang pada kondisi gelap selama 48 jam dengan penggoyangan 100 rpm. Selanjutnya 100 μl bakteri dikulturkan kembali di dalam 10 ml media LB cair dengan penggoyangan 100 rpm di ruang gelap sehingga mencapai nilai absorbansi 0.5 pada panjang gelombang 600 nm (OD600). Sel bakteri selanjutnya dipisahkan dari medium LB cair dengan disentrifugasi dengan kecepatan 5000 rpm selama 15 menit. Sel bakteri yang mengendap dilarutkan pada medium kokultivasi cair.
Eksplan yang berupa ruas batang (internode) yang tidak mengandung mata tunas direndam dalam larutan bakteri A. tumefaciens selama 10 menit pada suhu ruang dengan penggoyangan. Eksplan tersebut selanjutnya dikeringkan di atas kertas tisu steril selama 10 menit dan ditanam pada media kokultivasi padat di dalam cawan petri, kemudian kokultivasi dilakukan pada ruang gelap pada suhu 23°C selama tiga hari. Tahapan ini bertujuan agar bakteri dapat menginfeksi eksplan. Setelah tiga hari, eksplan dicuci dengan air steril sebanyak 3 kali, kemudian direndam pada larutan 100 mg/L cefotaxime selama 10 menit untuk mematikan bakteri A. tumefaciens. Eksplan selanjutnya ditanam pada media penginduksi kalus/regenerasi. Efisiensi transformasi ditentukan berdasarkan rumus yang disajikan pada Lampiran 3.
Regenerasi Hasil Transformasi Tanaman Kentang
12
penambahan 100 mg/L cefotaxime dan 40 mg/L higromisin. Subkultur dilakukan setiap 2 minggu hingga kalus membentuk tunas. Tunas yang tumbuh dari kalus pada media regenerasi selanjutnya dipindahkan ke medium MS2 makro selama empat minggu. Setelah empat minggu tanaman disubkultur pada media seleksi yang berupa media MS2 makro yang mengandung higromisin 40 mg/L. Pertumbuhan tanaman diamati selama empat minggu. Tanaman yang tumbuh dianggap sebagai tanaman transgenik putatif yang kemudian dianalisis menggunakan metode Polymerase Chain Reaction (PCR). Efisiensi regenerasi dihitung berdasarkan rumus yang disajikan pada Lampiran 3.
Identifikasi Tanaman Transgenik dengan Polymerase Chain Reaction (PCR)
DNA genom tanaman kentang Jala Ipam diisolasi dari daun dengan metode CTAB (cetyl-trymethyl ammonium bromide) (Doyle dan Doyle 1987). Daun tanaman kentang sebanyak 100 gram digerus dengan nitrogen cair kemudian dimasukkan pada tabung eppendorf ukuran 1.5 ml dan ditambah larutan pengekstraksi yaitu 600 μl buffer CTAB 2% (20 g/L CTAB, 150 ml/L 1 M Tris-Cl Ph 8.0, 60 ml/L 0.5 M EDTA Ph 8.0) dan β-merkaptoetanol (0.2%). Tabung dibolak-balik beberapa kali lalu diinkubasi pada suhu 65 °C selama 30 menit. Setelah itu tabung disimpan di dalam es, kemudian ditambah kloroform-isoamil alcohol 24:1 (v/v) sebanyak 1 kali volume larutan, dan disentrifugasi dengan kecepatan 10000 rpm (Jouan BR 4i) selama 10 menit. Supernatan yang diperoleh, diambil dan dipindahkan pada tabung eppendorf baru, kemudian ditambah PCI (phenol-cloroform-isoamil alcohol) 25:24:1 (v/v/v) sebanyak 1 kali volume larutan, dibolak-balik dan disentrifugasi kembali dengan kecepatan 10000 rpm selama 15 menit. Supernatan yang terbentuk dipindahkan ke dalam tabung eppendorf baru, dan ditambah sodium asetat 0.2 M sebanyak 0.1 kali volume supernatan yang diperoleh, dan ditambah etanol absolute sebanyak 2 kali volume larutan. Tabung dibolak-balik beberapa kali, kemudian disimpan dalam freezer (-20 °C) selama semalam. Kemudian, tabung disentrifugasi lagi dengan kecepatan 10000 rpm selama 20 menit. Supernatant dibuang, dan endapan yang terbentuk ditambah dengan larutan etanol 70% (v/v) dan disentrifugasi dengan kecepatan 10000 rpm selama 10 menit, kemudian endapan dikeringkan menggunakan mesin vakum dan diberi 20 μl ddH2O dan 4 μl RNAse (1 mg/ml).
13
HASIL DAN PEMBAHASAN
Regenerasi Tanaman Kentang
Transformasi genetik tanaman kentang kultivar Jala Ipam dilakukan dengan menggunakan eksplan ruas batang (internode) tanpa mata tunas yang berumur 4 minggu. Penggunaan ruas batang tanpa mata tunas bertujuan untuk menghindari kemungkinan tumbuhnya tunas transgenik palsu dari mata tunas yang muncul pada bagian buku. Disamping itu pemilihan penggunaan ruas batang sebagai eksplan disebabkan karena ruas batang lebih cepat membentuk kalus dan lebih tinggi frekuensi regenerasi tunas dan jumlah tunas per eksplan dibandingkan eksplan lain seperti daun dan tangkai daun. Kecepatan induksi kalus dari eksplan ruas batang telah dibuktikan pada penelitian Dhital et al. (2010) dan Bustomi (2014). Hasil yang berbeda diperoleh Manguntungi (2014) yang menunjukkan bahwa potongan daun lebih cepat membentuk kalus dan kalusnya lebih banyak beregenerasi menjadi tunas daripada eksplan yang berupa ruas batang.
Gambar 4 Kalus yang terbentuk pada media induksi kalus dan regenerasi pada 2 minggu setelah tanam. (A) kalus dari eksplan yang ditransformasi dengan p2K1-Hd3a, (B) kalus dari eksplan yang ditransformasi dengan pCambia1300-Hd3a, (C) kalus dari eksplan kontrol.
Eksplan internode yang telah ditransformasi dengan gen Hd3a ditanam pada media induksi kalus dan regenerasi. Media induksi kalus dan media regenerasi menggunakan media yang sama yaitu media MS yang mengandung 2 mg/L IAA, 3 mg/L BAP, 1 mg/L GA3, 100 mg/L cefotaxime, seperti yang digunakan oleh Bustomi (2014) dan Manguntungi (2014). Eksplan tanaman kentang kultivar Jala Ipam yang telah ditransformasi dan juga eksplan kontrol mulai membentuk kalus dua minggu setelah ko-kultivasi (Gambar 4). Pembentukan kalus mulai terlihat dari ujung potongan buku kemudian merata pada semua bagian eksplan.
14
Gambar 5 Tahapan regenerasi tanaman kentang Jala Ipam transgenik. (A) Kalus bertunas, (B) tunas tumbuh menjadi tanaman utuh pada media MS2 makro yang mengandung antibiotik higromisin, (C) tanaman transgenik untuk diaklimatisasi.
Sebagian besar eksplan yang ditransformasi secara perlahan mengalami perubahan warna menjadi coklat (browning) dan kemudian mati (Gambar 8). Kematian kultur ini dapat diakibatkan karena gen Hd3a yang dipautkan dengan gen hpt tidak masuk, tidak terintegrasi kedalam genom dan tidak terekspresikan di dalam eksplan, sehingga tidak mampu bertahan dalam media yang mengandung antibiotik higromisin. Semua kalus dari eksplan yang tidak ditransformasi (kontrol) berubah warna menjadi hitam dan mati (Gambar 6). Kondisi ini terjadi karena pengaruh penambahan antibiotik pada media regenerasi. Konsentrasi 40 mg/L higromisin pada pembentukan kalus termasuk tinggi. Pada penelitian Salsabila (2015) penggunaan dosis 10 mg/L higromisin sudah dapat menyeleksi kalus yang resisten terhadap higromisin, dan dosis dinaikkan menjadi 20 mg/L untuk menyeleksi tunas kentang Agria transgenik. Penggunaan dosis yang lebih rendah pada seleksi kalus transgenik putatif dikarenakan kalus yang berupa kumpulan sel dan belum terdiferensiasi memiliki sifat yang lebih sensitif daripada tunas.
Gambar 6 Perkembangan kalus non-transgenik. (A) kalus yang ditransformasi mengalami browning, (B) kalus kontrol yang tidak ditransformasi mengalami browning.
15
menunjukkan bahwa gen Hd3a mampu menginduksi pembentukan umbi pada tanaman kentang kultivar Jala Ipam transgenik secara in vitro.
Gambar 7 Tanaman kentang kultivar Jala Ipam in vitro berumur 4 minggu. (A) Tanaman transgenik, (B) tanaman non-transgenik
Baik tanaman transgenik maupun tanaman non transgenik secara in vitro tidak menghasilkan bunga. Umur 4 minggu tidak cukup untuk berbunga baik pada tanaman transgenik maupun non-transgenik. Dalam kondisi di lapang di Indonesia kultivar Jala Ipam sulit berbunga. Untuk mengetahui pengaruh gen Hd3a terhadap pembungaan, tanaman kentang transgenik harus ditanam di lapang. Umbi G0 sangat baik digunakan sebagai bibit untuk mengetahui ekspresi gen Hd3a di lapang karena efek zat pengatur tumbuh di media kultur in vitro sudah tidak ada lagi.
Pada penelitian ini transformasi genetik pada kentang kultivar Jala Ipam memiliki efisiensi transformasi sebesar 18% pada tanaman yang ditransformasi menggunakan p2K1-Hd3a dan 7% pada tanaman tanaman yang ditransformasi dengan pC1300-Hd3a (Tabel 1). Efisiensi transformasi kentang kultivar Jala Ipam lebih rendah dibandingkan dengan efisiensi transformasi yang dilakukan pada penelitian sebelumnya yang juga menggunakan gen Hd3a, seperti pada Jatropa curcas sebesar 26.67% (Sulistyaninngsih 2012), pada Nicotiana benthamiana sebesar 86% (Syafitri 2012), dan kentang kultivar Diamant sebesar 21.21% (Mardiyyah 2014). Namun jika dibandingkan dengan kentang kultivar Agria, nilai efisiensi transformasi Jala Ipam lebih besar. Kentang kultivar Agria yang ditransformasi dengan gen Hd3a dibawah kendali promoter rolC yang terdapat pada plasmid p2K1-Hd3a memilikiefisiensi transformasi sebesar 5.01%.
16
Perbedaan nilai efisiensi transformasi dapat dipengaruhi oleh spesies dan kultivar yang digunakan. Rendahnya efisiensi transformasi pada penelitian ini antara lain disebabkan karena genotipe tanaman Jala Ipam merupakan kentang hasil seleksi positif dari variasi somaklonal Russet Burbank sehingga memiliki kesamaan ciri dan sifat dengan kentang varietas Russet Burbank. Penelitan Newell et al. (1991) melaporkan dari 225 eksplan kentang varietas Russet Burbank yang ditransformasi, efisiensi transformasi pada penelitian tersebut rata-rata sebesar 2%. Penelitian Chang et al. (2002) menginformasikan bahwa pembentukan tunas pada tanaman kentang varietas Russet Burbank dimulai dua bulan setelah kokultivasi dan pembentukan akar dua minggu setelahnya, dengan efesiensi transformasi sekitar 6.5% dari total semua perlakuannya. Jika dibandingkan dengan kedua penelitian tersebut, efisiensi transformasi kentang kultivar Jala Ipam pada penelitian ini relatif sama bahkan lebih besar.
Varietas Russet Burbank merupakan salah satu varietas kentang yang memiliki sifat rekalsitran (sulit) untuk ditransformasi dan memiliki kemampuan beregenerasi rendah jika dibandingkan dengan varietas lain dari Solanum tuberosum lainnya (Newell et al. 1991). Namun, penelitian ini membuktikan bahwa kultivar Jala Ipam termasuk kultivar yang cukup mudah untuk ditransformasi serta memiliki kemampuan regenerasi yang tinggi.
Efisiensi regenerasi kentang kultivar Jala Ipam sebesar 100% baik untuk eksplan yang ditransformasi dengan p2K1-Hd3a, maupun eksplan yang ditransformasi dengan pC1300-Hd3a (Tabel 1). Efisiensi regenerasi kultivar Jala Ipam sama dengan efisiensi regenerasi kentang kultivar Baraka (Bustomi 2014), kentang kultivar Diamant (Mardiyyah 2014), dan kentang kultivar Agria (Salsabila 2015), yang masing-masing memiliki efisiensi transformasi sebesar 100%. Namun jika dibandingkan dengan penelitian Newell et al. (1999) yang menyatakan bahwa efisiensi regenerasi dari hasil transformasi kentang varietas Russet Burbank sebesar 8%, efisiensi regenerasi kentang kultivar Jala Ipam jauh lebih besar.
Persentase regenerasi dipengaruhi oleh varietas, waktu infeksi, dan periode kokultivasi (Molla et al. 2012). Pada penelitian Molla et al. (2012) regenerasi 100% didapatkan dari waktu infeksi 30 menit dan waktu kokultivasi 3 hari. Waktu 40 menit akan menyebabkan penurunan persentase regenerasi, karena bakteri akan tumbuh secara berlebih pada permukaan eksplan sehingga viabilitas jaringan tanaman menurun. Pada penelitian ini walaupun menggunakan waktu infeksinya hanya 10 menit, tetapi bakteri A. tumefaciens yang digunakan sebagai perantara masih tumbuh secara berlebihan.
17
Identifikasi Tanaman Transgenik
Identifikasi tanaman transgenik melalui deteksi keberadaan transgen Hd3a pada tanaman hasil transformasi dilakukan dengan PCR. Pasangan primer yang digunakan adalah rolC-F dan Hd3a-FP-R untuk tanaman yang ditransformasi dengan p2K1-Hd3a. Pasangan primer tersebut merupakan sekuen yang digunakan oleh Tamaki et al. (2007) saat mengkonstruksi vektor. Primer rolC-F terletak pada promoter rolC dari plasmid p2K1-Hd3a. Primer rolC-F digunakan untuk mengetahui keberhasilan sisipan dan membuktikan bahwa sisipan tersebut benar adalah rolC, karena kentang tidak mempunyai rolC. Primer Hd3a-FP-R adalah sekuen yang terletak pada Hd3a dari p2K1.
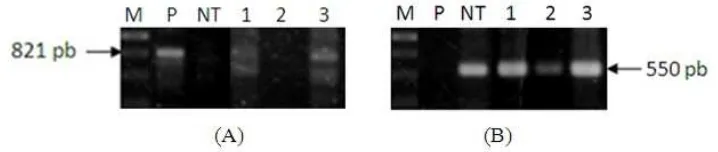
Hasil PCR dua tanaman dari tiga tanaman transgenik putatif yang diambil secara acak menunjukkan bahwa tanaman tersebut adalah transgenik. Hasil PCR menunjukkan bahwa dua tanaman tersebut memiliki fragmen DNA berukuran 821 pasang basa (pb) yang sama dengan fragmen DNA yang terdapat pada plasmid p2K1-Hd3a yang mengandung gen Hd3a dibawah kendali promoter rolC (Gambar 8A). Hasil ini menunjukkan bahwa transgen Hd3a terintegrasi pada genom tanaman kentang kultivar Jala Ipam transgenik. PCR pada tanaman non-transgenik dengan primer yang sama tidak menghasilkan pita.
Gambar 8 Hasil analisis PCR DNA tanaman kentang Jala Ipam transgenik yang ditrasformasi dengan p2K1-Hd3a. Hasil PCR genom dengan primer rolC-F dan Hd3a-FP-R (A) dan primer aktin (B). M= penanda 1kb, P = plasmid p2K1-Hd3a, NT = tanaman non transgenik, 1-3 = tanama Jala Ipam transgenik putatif.
Pada penelitian ini aktin digunakan sebagai kontrol keberadaan DNA tanaman. Semua tanaman, baik transgenik putatif maupun non-transgenik mengandung gen aktin, sedangkan p2K1-Hd3a tidak mengandung aktin (Gambar 8B). Hal ini menunjukkan bahwa DNA dari semua tanaman adalah dalam keadaan baik. Gen aktin merupakan housekeeping gene dan bersifat konservatif sehingga dipakai sebagai kontrol internal dalam analisis DNA dan RNA
18
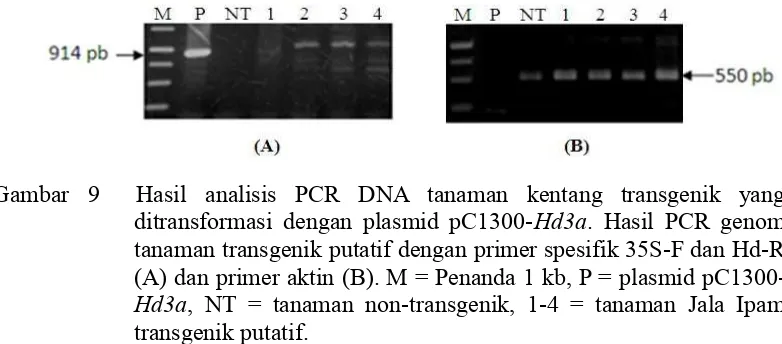
Gambar 9 Hasil analisis PCR DNA tanaman kentang transgenik yang ditransformasi dengan plasmid pC1300-Hd3a. Hasil PCR genom tanaman transgenik putatif dengan primer spesifik 35S-F dan Hd-R (A) dan primer aktin (B). M = Penanda 1 kb, P = plasmid pC1300-Hd3a, NT = tanaman non-transgenik, 1-4 = tanaman Jala Ipam transgenik putatif.
Hasil PCR terhadap empat tanaman transgenik putatif yang ditransformasi menggunakan pC1300-Hd3a menunjukkan bahwa empat tanaman tersebut mengandung gen Hd3a dan promoter 35S CaMV dengan ukuran fragmen DNA sebesar 914 pb, sedangkan tanaman non-transgenik tidak mengandung gen tersebut (Gambar 9A). Hal ini menunjukkan bahwa keempat tanaman transgenik mengandung transgen Hd3a dengan promoter 35S CaMV, sedangkan tanaman non-transgenik tidak mengandung gen tersebut. PCR menggunakan primer aktin pada tanaman transgenik dan non-transgenik menghasilkan pita berukuran 550 pb (Gambar 9B), yang menunjukkan bahwa kualitas DNA dari semua tanaman baik transgenik putatif maupun non-transgenik adalah baik.
SIMPULAN DAN SARAN
Simpulan
Transformasi genetik tanaman kentang kultivar Jala Ipam dengan plasmid p2K1-Hd3a dan plasmid pC1300-Hd3a secara terpisah telah berhasil dilakukan. Gen Hd3a dibawah kendali promoter rolC dan Hd3a dibawah kendali promoter 35S CaMV telah berhasil diintegrasikan ke dalam genom tanaman kentang Jala Ipam transgenik.
Saran
19
DAFTAR PUSTAKA
Abe M, Kobayasi Y, Yamamoto S, Daimon Y, Yamaguchi A, Ikeda Y, Ichinoki H, Notaguchi M, Goto K, Araki T. 2005. FD, a Bzip protein mediating signals from the floral pathway integrator FT at the shoot apex. Science. 309:1052-1056.
Abelenda JA, Navarro C, Prat S. 2014. Flowering and tuberization: a tale of two nightshades. Trends Plant Sci. 19(2):115-122
Aksenova NP, Konstantinova TN, Golyanovskaya SA, Sergeeva LI, Romanov GA. 2012. Hormonal regulation of tuber formation in potato plants. Rus J Physiol. 59(4):491-508.
Bouche F, D’Aloia M, Tocquin P, Lobet G, Detry N, P
é
rilleux C. 2006. Integrating roots into a whole plant network of flowering time genes in Arabidopsis thailiana. bioRxiv. doi: http://dx.doi.org/10.1101/036244. Bou-Torrent J, Martinez-Garcia JF, Garcia-Martinez JL, Prat S. 2011. GibberellinA1 metabolism contributes to the control of photoperiod-mediated tuberization in potato. Plos One. 6(9):e24458. 10p
BPTPY (Balai Pengkajian Teknologi Pertanian Yogyakarta). 2004. Teknologi
Carrera E, Jackson SD, Prat S. 1999. Feedback control and diurnal regulation of gibberellins 20-oxidase transcript levels in potato. Plant Physiol. 199:765-774.
Chang M, Culley D, Choi JJ, Hadwiger LA. 2002. Agrobacterium-mediated co-transformation of a pea β-1,3-glucanase and chitinase genes in potato model for flowering signaling pathway of sugarcane under photoperiodic control. Gen Mol Res. 12(2):1347-1359.
Dhital SP, Lim HT, Manandhar HK. 2010. Direct and efficient plant regeneration from different explants sources of potato cultivars as influenced by plant growth regulators. Nepal J Sci Tech. 12:1-6
Doyle JJ, Doyle JL. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem Bull. 19: 11-15. [internet]. [diunduh 2014 Januari 30]. Tersedia dari:http://www.Mendeley.co/research-papers/. Gelvin SB. 2003. Agrobacterium-mediated plant transformation: the biology
behind the “gene-jockeying” tool. Microb Mol Biol Rev. 1:16-37.
20
transcription of flowering-control genes in citrus buds. Plant Sci. 198 :46-57.
Gonzalez-Schain ND, Suarez-Lopez P. 2008. CONSTANS delay flowering and affects tuber yield in potato. Biol Plant. 52(2):251-258.
Gonzalez-Schain ND, Diaz-Mendoza M, Zurczak M, Suarez-Lopez P. 2012. Potato CONSTANS is involved in photoperiodic tuberization in graft-transmissible manner. Plant J. (70):678-690.
Hannapel DJ. 2007. Signalling the Induction of Tuber Formation. Di dalam : Vreugdenhil D, Bradshaw J, Gebharrdt C, Govers F, MacKorren DKL, Taylor MA, Ross HA, editor. Potato Biology and Biotechnology Advances and Perspectives. UK: Elsavier. Hlm 237-256.
Handoko, Irsal L, Salwati. 2011. Pengembangan teknologi adaptasi perubahan iklim pada tanaman kentang melalui perakitan model simulasi hubungan intersepsi radiasi surya dan curah hujan pada tajuk tanaman dalam menentukan hasil umbi. Ringkasan Eksekutif Hasil-hasil Penelitian. Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T). [internet]. [diunduh 2014 April 14]. Tersedia dari http://www.litbang.deptan.go.id/ks/one/749/file/PENGEMBANGAN-TEKNOLOGI-ADA.pdf.
Haverkort AJ. 2007. Potato Crop Respons to Radiation and Daylenght. Di dalam : Vreugdenhil D, Bradshaw J, Gebharrdt C, Govers F, MacKorren DKL, Taylor MA, Ross HA, editor. Potato Biology and Biotechnology Advances and Perspectives. UK: Elsavier. Hlm 353-363.
Imaizumi T, Kay S. 2006. Photoperiodic control of flowering, not only by coincidence. Trends Plant Sci. 11: 550-558.
Jackson SD. 1999. Multiple signaling pathways control tuber induction in potato. Plant Physiol. 199:1-8.
Kashani K, Javaran MJ, Mohebondini M, Moieni A, Abadi MSD. 2012. Regeneration and Agrobacterium-mediated transformation of three potato cultivars (Solanum tuberosum cv, Desiree, Agria and Marfona) by human proinsulin gene. AJCS. 6(7):1212-1220.
Kaufmann K, Wellmer F, Muiño JM, Ferrier T, Wuest SE, Kumar V, Serrano-Mislata A, Mudueño F, Krajewski P, Meyerowitz EW et al. 2010. Orchestration of floral initiation by APETALA1. Science.328:85-89. Kazemi EM, Jonoubi P, Majd A, Pazhouhandeh M. 2014. Restriction of negative
effects of cefotaxime in tomato transformation by using FeEDDHA. Inti J Farm Alli Sci. 3(5):538-542.
[KEMENTAN] Kementrian pertanian. 2015. Berita resmi PVT. [internet]. [diunduh 2015 September 3]. Tersedia pada http://ppvt.setjen.pertanian.go.id. [KEMENTAN] Kementrian pertanian. 2015. Rencana strategis kementrian
pertanian tahun 2015-2019. [internet]. [diunduh 2015 Desember 30]. Tersedia pada http://www.pertanian.go.id/file/RENSTRA_2015-2019.pdf Khan SK, Sjahril R, Nakamura I, Mii M. 2008. Production of transgeneic potato
exhibiting enhanced resistance to fungal in fections and herbicide application. Plant Biotechnol Rep. 2:13-20.
21
Kloosterman B, Abelenda JA, Gomez MC, Oortwijn M, Boer JM, Kowitwanich K, Horvath BH, Eck HJ, Smaczniak C, Prat S, et al. 2013. Naturally occurring allele diversity allows potato cultivation in northern latitudes. Nature. 495:246-250.
Kojima S, Takahashi Y, Kobayashi Y, Monna L, Sasaki T, Araki T, Yano M, 2002. Hd3a a rice ortholog of Arabidopsis FT gene, promotes transition to flowering downstream of Hd1 under short-day conditions. Plant Cell Physiol. 43:1096-1105.
Komiya R, Ikegami A, Tamaki S, Yokoi S. Shimamoto K. 2008. Hd3a and RFT1 are essential for flowering in rice. Development. 135:767-774.
Li M, Li H, Hu X, Pan X, Wu. 2011. Genetic transformation and overexpression of a rice Hd3a induces early flowering in Saussurea involucrate Kar. Et Kir. Ex Maxim. Plant Cell Tiss Organ Cult. 106:363-371.
Manguntungi B. 2014. Transformasi genetic kentang (Solanum tuberosum L.) kultivar Atlantik dengan gen penyandi lisozim melalui perantara Agrobacterium tumefaciens [tesis]. Bogor (ID): Institut Pertanian Bogor Mardiyyah IM. 2015. Introduksi gen pembungaan Hd3a ke dalam tanaman
kentang (Solanum tuberosum L.) kultivar Diamant [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Martinez-Garcia JF, Virgos-Soler A, Prat S. 2002. Control of photoperiod-regulated tuberization in potato by the Arabidopsis flowering-time gene CONSTANTS. Proc Natl Acad Sci. 99(23):15211-15216.
Matsoukas IG. 2015. Florigens and antiflorigens: a molecular genetic understanding. Essays Biochem. 58:133-149
Maulani E. 2015. Transformasi genetic kentang (Solanum tuberosum L.) kultivar Kennebec dengan gen Hd3a [skripsi]. Bogor (ID): Institut Pertanian Bogor.
McGregor I. 2007. The fresh potato market. Di dalam : Vreugdenhil D, Bradshaw J, Gebharrdt C, Govers F, MacKorren DKL, Taylor MA, Ross HA, editor. Potato Biology and Biotechnology Advances and Perspectives. UK: Elsavier. Hlm 3-25.
Mikschofsky H, Hartmann A, Janezyk P, Keil GM, KÖnig P, Schirrmeier H,
Hammer M, Junghans H, Schmidt K, Schmidtke J, et al. 2011. Expression of the viral antigen VP60 in transgenic potatoes and its effect on the nutritional composition of tuber. Food Nut Sci. (2):74-86. Doi:10.4236/fns.2011.22010
Molla MMH, Nasiruddin KM, Al Amin M, Haque MS, Maniruzzaman. 2012. Standarization of protocol for Agrobacterium-mediated transformation in potato (Solanum tuberosum L.). Bangladesh J Agril Res. 37(2):185-194. Mutasa-Gottgens E, Hedden P. 2009. Gibberellin as a factor in floral regulatory
network. J Exp Bot. 60(7):1979-1989.
Nasir M. 2002. Bioteknologi, Potensi dan Keberhasilannya dalam Bidang Pertanian. Jakarta (ID): PT Raja Grafindo Persada.
Navarro C, Abelenda JA, Oro EC, Ceullar CA, Tamaki S, Silva J, Shimamoto K, Prat S. 2011. Control of flowering and storage organ formation in potato by FLOWERING LOCUS T. Nature. 478:199-123.
22
transformation of Solanum tuberosum L. cv. Russet Burbank. Plant Cell Rep. 10:30-34.
Nurhasanah, Wattimena GA, Purwito A, Armini NMA, Suharsono. 2003. Transformasi genetic tanaman kentang cv. Atlantik dengan mengintroduksikan gen hordothionin untuk mendapatkan ketahanan terhadap penyakit bakteri. Bul. Argon. 31(2):63-67.
Nurrizky A. 2015. Rekayasa genetic pada tanaman kentang (Solanum tuberosum L.) kultivar Diamant dengan gen Hd3a dibawah kendali promoter 35S CaMV [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Prabaningrum L, Moekasan TK, Sulastrini I, Handayani T, Sahat JP, Sofiari E, Gunadi N. 2014. Teknologi Budidaya Kentang di Dataran Medium. Balai Penelitian Tanaman Sayuran Pusat Penelitian dan Pengembangan Hortikultura. Badan Penelitian dan Pengembangan Pertanian. Kementrian Pertanian.
Prat, S. 2010. Hormonal and daylength control of potato tuberization. Di dalam: Davis, editor. Plant Hormones, Biosynthesis, Signal Transduction, Action!. Netherlands (NL): Springer. Hal 574-596.
Salsabila L. 2015. Transformasi genetic kentang (Solanum tuberosum L.) kultivar Agria dengan gen pembungaan Hd3a [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Senjaya SK. 2013. Pewarisan genetik transgen Hd3a pada tanaman Nicotiana benthamiana transgenik [skripsi]. Bogor (ID): Institut Pertanian Bogor. Song YH, Ito S, Imaizumi T. 2013. Flowering time regulation: photoperiod and
temperature sensing in leaves. TrendsPlant Sci. 18 (10):575-584.
Suarez-Lopez P. 2013. A critical appraisal of phloem-mobile signals involved in tuber induction. [perspective article]. Front Plant Sci.4(253):1-7.
Suharsono. 2015. Modifikasi Genetik Tanaman untuk meningkatkan produksi pertanian. Bogor (ID). Orasi Ilmiah Guru Besar IPB. Fakultas Matematika dan Ilmu Pengetahuan Alam IPB, Bogor 28 Februari 2015. Sulistyaningsih YC. 2012. Rekayasa ekspresi gen pembungaan Hd3a pada
tanaman jarak pagar (Jatropa curcas L.) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Syafitri LN. 2012. Transformasi genetik Nicotiana benthamiana dengan gen pembungaan Hd3a dari padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Tamaki S, Matsuo W, Wong HL, Yokoi S, Shimamoto K. 2007. Hd3a protein is a mobile flowering signal in rice. Science. 316:1033-1036.
Tantowijoyo W, Fliert EV. 2006. All Abaout Potatoes, An Ecological Guide to Potato Integrated Crop Management. CIP-ESEAP Region and FAO Regional Vegetable IPM program in South and Southeast Asia.82 hal. Tran TN, Mishra NS. 2015. Effect of antibiotics on callus regeneration during
transformation or IR 64 rice. Biotech Rep. 7:143-149.
Tsuji H, Tachibana C, Tamaki S, Taoka K, Kyozuka J, Shimamoto K. 2015. Hd3a Promotes lateral brancing in rice. PlantJ. 2:256-266.
23
Wattimena GA. 1992. Bioteknologi Tanaman. Jakarta (ID): Dirjen Dikti. 185 hal. Wattimena GA. 2000. Pengembangan propagul kentang bermutu dan kultivar
kentang unggul dalam mendukung peningkatan produksi kentang di Indonesia. Bogor (ID). Orasi Ilmiah Guru Besar Tetap Ilmu Hortikultura. Fakultas Pertanian IPB, Bogor 2 September 2000.
Yano M, Katayose Y, Ashikari M, Yamanouchi U, Mona L, Fuse T, Baba T, Yamamoto K, Umehara Y, Nagamura Y, et al. 2000. Hd1, a major photoperiod sensitivity quantitative trait locus in rice, is closely related to the Arabidopsis flowering time gene CONSTANS. Plant Cell. 12:2473-2483.
24
LAMPIRAN
Lampiran 1 Karakteristik Kentang kultivar Jala Ipam (Kementan 2015)
Asal : Variasi somaklonal IPB 73 Silsilah : Seleksi klon unggul IPB 73 Bentuk penambapng batang : Bersegi tiga
Diameter batang : 1.0 - 1.1 cm Warna batang : Hijau Warna daun : Hijau
Bentuk daun : Oval memanjang
Ukuran daun : Panjang 6.5 - 9.3 cm, Lebar 4.4 - 4.8 cm Bentuk bunga : Seperti bintang
Warna kelopak bunga : Hijau Warna mahkota bunga : Putih
Warna kepala putik : Kuning keputihan Warna benangsari : Kuning
Umur mulai berbunga : 40 - 60 hari setelah tanam Umur mulai panen : 90 - 105 hari setelah tanam Bentuk umbi : Lonjong
Populasi per hektar : 30000 - 33000 tanaman Kebutuhan benih per hektar : 1400 - 1800 kg
Penciri utama : Bentuk daun oval memanjang, bentuk umbi lonjong, warna daging umbi putih, kulit umbi berwarna kuning dan bercorak menjala.
25
26
Lampiran 2 Komposisi Media Dasar MS (Murashige dan Skoog 1962)
Nama stock Bahan Konsentrasi senyawa dalam media (mg/L)
A NH4NO3 1650
B KNO3 1900
C KH2PO4 170
H3BO3 6.2
NaMoO4.2H2O 0.25 CoCl2.6H2O 0.025
KI 0.83
D CaCl2.2H2O 440 E MgSO4.7H2O 370 MnSO4.4H2O 22.3
ZnSO4.7H2O 8.6 CuSO4.5H2O 0.025
F Na2EDTA 37.3
FeSO4.7H2O 27.8 Vitamin Thiamine-HCl 0.1
Niacin (asam
nikotinat) 0.5
Pyridoxine-HCl 0.5
Glycine 2
Myo Myo inositol 100
Sukrosa Sukrosa 30
Agar Agar 8
27
Lampiran 3 Penentuan Efisiensi Transformasi dan Efisiensi Regenerasi
Efisiensi transformasi (%) = x 100%
28
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 23 Januari 1982, merupakan anak ke empat dari empat bersaudara pasangan Bapak Askawi (alm.) dan Ibu Hartini. Penulis menyelesaikan pendidikan dasar di SD Karang Anyar IV Indramayu pada tahun 1994, menyelesaikan pendidikan menengah pertama di SMP Negeri 2 Sindang pada tahun 1997, dan pendidikan menengah atas di SMA Negeri 1 Sindang Kabupaten Indramayu pada tahun 2000. Penulis melanjutkan pendidikan Sarjana di Institut Pertanian Bogor (IPB), Jurusan Budidaya Pertanian, Program Studi Hortikultura melalui jalus USMI, dan lulus pada tahun 2004. Tahun 2013, penulis melanjutkan pendidikan di Sekolah Pascasarjana Institut Pertanian Bogor (IPB) di Program Studi Bioteknologi.
Penulis pernah bekerja di Sekolah Alam Bogor dari tahun 2005 hingga tahun 2015. Penulis telah menikah dengan Dody Darsono ST MT dan memiliki seorang anak laki-laki bernama Abrisam Nur Alam Syah.