INDUKSI VARIASI SOMAKLONAL
DAN UJI IN VITRO UNTUK
PERBAIKAN KETAHANAN PHALAENOPSIS
TERHADAP PENYAKIT BUSUK LUNAK
SRI RIANAWATI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Variasi Somaklonal Dan Uji In Vitro Untuk Perbaikan Ketahanan Phalaenopsis Terhadap Penyakit Busuk Lunak” adalah benar-benar asli karya saya dengan arahan komisi pembimbing, dan bukan hasil jiplakan atau tiruan dari tulisan siapapun serta belum diajukan dalam bentuk apapun kepada perguruan tunggi manapun.
Bogor, Nopember 2010
SRI RIANAWATI. Somaclonal Variation Induction and In Vitro Testing for Phalaenopsis Resistance Improvement Againts Soft Rot Disease. Supervised by AGUS PURWITO, BUDI MARWOTO dan G.A. WATTIMENA.
Soft rot disease caused by Erwinia carotovora subsp. carotovora is an important disease of Phalaenopsis sp. Efforts have been made to control the disease, but the results are not sufficiently promising. The use of resistant varieties is commontly recommended to control the disease because of its save impact to the environment and human life. Therefore, development of new superior varieties that are highly resistant to the disease is very urgent at the moment. Somaclonal variation using mutagenic agents is proven to be one of feasible technique to provide promising resistant varieties. In this study, development new resistant varieties to soft rot disease was conducted by using physical mutagenesis gamma ray irradiation and chemical mutagenesis EMS that were induced somaclonal variation and combined with in vitro testing technique. Gamma ray and EMS were applied separately to the calli. The treated calli were regenerated on selected in vitro medium enriched with plant growth regulator. The results showed that somaclone variation occured on the three clones treated. Frequency of occurance of somaclone variation using gamma ray variation was 0.4- 6.85 while using EMS was 0.9 – 20.8%. The all variants were in vitro tested for their resistance to soft rot disease by using pathogen suspension agent Erwinia carotovora subsp. carotovora and it was obtained 162 potential mutant resistant to soft rot. After all potential mutant resistant being tested using the same agent in the field, it was proven that of the total available genetic materials, 14 mutants of SGN-PV2.11, 6 mutants of clone No. 642 and 4 mutants of clone No. 377 were resistant to Erwinia carotovora subsp. carotovora, the cause agent of soft rot disease.
Ketahanan Phalaenopsis Terhadap Penyakit Busuk Lunak. Dibimbing oleh AGUS PURWITO, BUDI MARWOTO dan G.A. WATTIMENA.
Penyakit busuk lunak yang disebabkan oleh bakteri Erwinia carotovora subsp. carotovora merupakan penyakit yang dapat menyebabkan kerugian bagi para petani anggrek Phalaenopsis. Salah satu metode untuk mengendalikan penyakit ini yaitu menggunakan kultivar tahan. Kultivar tahan penyakit busuk lunak dapat dirakit melalui berbagai cara di antaranya melalui hibridisasi dan seleksi. Sejatinya perakitan kultivar tahan Erwinia carotovora subsp. carotovora melalui hibridisasi tidak mudah dilakukan karena ketersediaan sumber genetik yang membawa sifat tahan sangat terbatas. Pendekatan untuk memperluas keragaman genetik dengan menggunakan kombinasi perlakuan mutagenesis radiasi sinar gamma dan EMS secara in vitro yang diikuti dengan pengujian in vitro merupakan metode yang efisien untuk memperolah kultivar Phalaenopsis tahan terhadap penyakit busuk lunak. Penelitian ini bertujuan untuk mendapatkan materi genetik anggrek Phalaenopsis yang tahan terhadap penyakit busuk lunak yang disebabkan oleh Erwinia carotovora subsp. carotovora.
Induksi ketahanan terhadap penyakit busuk lunak telah dilakukan melalui iradiasi sinar gamma dan EMS dalam beberapa tahap percobaan. Pertama, penyiapan kalus embriogenik klon SGN-PV2.11 , 642 dan klon 377. Kedua, kalus yang diperoleh, diradiasi dengan sinar gamma dan sebagian lainnya direndam dalam larutan EMS. Ketiga, kalus diregenerasikan pada media yang diberi zat pengatur tumbuh. Keempat, plantlet yang terbentuk (berukuran 5 cm atau memiliki 4 daun sejati) diuji ketahanannya terhadap Erwinia carotovora subsp. carotovora. Hasil pengujian tersebut diperoleh varian yang potensial tahan terhadap patogen busuk lunak. Kelima, varian potensial tahan hasil uji in vitro yang diperoleh, diaklimatisasi hingga tanaman berukuran 7-10 cm dan selanjutnya diuji kembali di lapangan menggunakan Erwinia carotovora subsp. carotovora. Hasil pengujian tersebut diperoleh mutan tahan terhadap penyakit busuk lunak.
Pembentukan kalus embriogenik dilakukan pada eksplan daun Phalaenopsis yang diinduksi melalui tahapan inisiasi kalus, proliferasi kalus dan selanjutnya regenerasi plantlet dan pemeliharaan plantlet menjadi tanaman. Media yang mengandung thidiazuron 0.1 mg.l-1 dan 10 mg.l-1 2.4-D merupakan media yang paling baik untuk menginisiasi kalus. Kalus yang terbentuk merupakan kalus embriogenik sehingga mudah diproliferasikan dan diregenerasikan. Media yang berisi 1/2 MS + 0.2 mg.l-1 TDZ + 0.5 mg.l-1 2.4-D merupakan media untuk proliferasi kalus sedangkan media yang mengandung ½ MS + 0.4 mg.l-1 BAP + 0.2 mg.l-1 2.4-D merupakan media yang sesuai untuk regenerasi tanaman.
Iradiasi sinar gamma pada kalus menggunakan beberapa dosis. Dosis iradiasi awal ini digunakan untuk menentukan LD50 yang akan dijadikan acuan untuk menentukan dosis utama untuk mendapatkan varian-varian dari klon Phalaenopsis. Besarnya LD50 menentukan radiosensitivitas klon Phalaenopsis. Klon 377 merupakan genotip yang memiliki radiosensitivitas terendah di antara ketiga klon yang digunakan yaitu sekitar 22 Gy, sedang klon 642 mempunyai radiosensitivitas tertinggi yang terlihat pada LD50 yang paling rendah yaitu 15.3 Gy. Klon SGN-PV2.11 merupakan genotip yang memiliki radiosensitivitas di antara kedua klon tersebut. Variasi yang ditimbulkan dari perlakuan iradiasi sinar gamma sebesar 0.4-6.8 %, yaitu perubahan 5 karakter fenotip dibanding karakter asalnya.
perendaman dalam larutan EMS berdasarkan metode sebelumnya menghasilkan beberapa varian yang tahan terhadap Erwinia carotovora subsp. carotovora. Uji in vitro dapat dilakukan pada varian somaklon yang diperoleh dari perlakuan iradiasi sinar gamma dan perendaman dalam larutan EMS. Masa inkubasi penyakit dalam kultur in vitro terjadi dalam 24 jam pertama setelah inokulasi patogen. Tanaman mati pada varian iradiasi sinar gamma berkisar antara 68- 93.75% dan membutuhkan waktu selama 4.66 - 7.37 hari untuk menyebabkan kematian plantlet setelah inokulasi. Pada varian yang diperoleh dari perlakuan perendaman dalam larutan EMS, tanaman mati lebih tinggi dibandingkan tanaman mati pada varian iradiasi, yaitu berkisar antara 77.5 - 100% dengan lama waktu kematian plantlet selama 3.7 – 6.59 hari. Berdasarkan skor kebusukan daun (SKD) varian hasil iradiasi sinar gamma dan varian EMS, diperoleh 162 varian potensial tahan terhadap penyakit busuk lunak yang dapat dikategorikan agak tahan dan tahan.
Pengujian di lapangan dari 162 varian yang berpotensi tahan menunjukkan kesamaan dengan pengujian ketahanan secara in vitro. Pola masa inkubasi, laju infeksi dan intensitas penyakit di lapangan menunjukkan kesesuaian dengan pola di dalam kultur in vitro. Beberapa varian potensial dapat dikategorikan sebagai varian Phalaenopsis tahan penyakit busuk lunak, yang berjumlah 14 varian dari klon SGN-PV2.11, 6 varian dari klon 642 varian dari klon 377. Analisis jumlah stomata, tebal daun dan konsentrasi asam salisilat tidak menunjukkan korelasi positif terhadap ketahanan tanaman tetapi peroksidase dan esterase berkorelasi positif.
©Hak cipta milik Institut Pertanian Bogor, tahun 2010 Hak cipta dilindungi Undang Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan kaerya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
INDUKSI VARIASI SOMAKLONAL
DAN UJI IN VITRO UNTUK
PERBAIKAN KETAHANAN PHALAENOPSIS
TERHADAP PENYAKIT BUSUK LUNAK
SRI RIANAWATI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : 1. Dr. Dewi Sukma, SP.Msi
2. Dr. Sinto Wahyuning Ardie, Msi
NRP : A161060101
Disetujui
Komisi Pembimbing
Dr. Ir. Agus Purwito, MSc.Agr Ketua
Dr. Ir. Budi Marwoto, MS. APU Prof. Dr. Ir. G.A. Wattimena, MSc Anggota Anggota
Mengetahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil. A. Notodiputro, MS
atas segala karuniaNya penelitian dan penulisan disertasi yang berjudul ” Induksi Variasi Somaklonal Dan Uji In Vitro Untuk Perbaikan Ketahanan Phalaenopsis Terhadap Penyakit Busuk Lunak” berhasil diselesaikan. Disertasi ini memuat tujuh bab yang merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Bab 1 berjudul ”Embriogenesis Somatik Dari Eksplan Daun Anggrek Phalaenopsis sp”, telah diterbitkan [J. Agron. Indonesia 37 (3) : 240-248 (2009)].
Pada kesempatan ini, penulis menyampaikan rasa terima kasih yang tak terhingga kepada Bapak Dr. Ir. Agus Purwito MSc.Agr, Bapak Dr.Ir. Budi Marwoto, MS. APU. dan Bapak Prof. Dr. Ir. G. A. Wattimena, MSc sebagai komisi pembimbing yang telah memberikan banyak saran dan telah membantu dalam medapatkan dana penelitian melalui KKP3T selama tahun 2007-2008.
Penghargaan juga penulis sampaikan kepada Badan Penelitian dan Pengembangan Pertanian yang telah menyediakan beasiswa dan memberikan kesempatan untuk mendapatkan dana penelitian melalui KKP3T. Selain itu juga kepada Kepala Pusat Penelitian Tanaman Hortikultura Bapak Dr. Ir.Yusdar Hilman, MS yang telah memberi kesempatan untuk melanjutkan studi S3 ini, kepada Bapak Kepala Balai Penelitian Tanaman Hias Dr. Ir. Muchdar Soedardjo, MSc yang selalu memberi kelancaran studi ini.
Kepada rekan-rekan sesama mahasiswa pascasarjana IPB yang selalu saling berbagi semangat dalam bekerja: Reni Indrayanti, Dwi Wahyu Ganefianti, Ali Husni, Budi Winarto juga teman - teman laboratorium Juariah, Kholifah, dan Joko, penulis mengucapkan terima kasih sebesar-besarnya. Tak terlupakan pula sahabat-sahabat lama di Balai Penelitian Tanaman Hias, Suskandari K, Ridho Kurniati yang telah merelakan materi penelitiannya untuk digunakan dalam disertasi ini, Minangsari dan juga Suryanah yang telah membantu kelancaran penelitian.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan dapat memberikan sumbangan bagi perkembangan IPTEK dan industri tanaman hias di Indonesia.
Bogor, Nopember 2010
sebagai anak pertama dari pasangan Bapak Soelardi (alm) dan Ibu Sri Hartini. Penulis telah menikah dengan Drs Eddy Soesanto dan telah dikaruniai 3 orang putra laki-laki, Rakai Daksa Yudistira (15th), Rakyan Panji Langit (alm), dan Eros Ulung Ranuwukir (5th).
Pendidikan sarjana ditempuh di perguruan tinggi Universitas Gadjah Mada Yogyakarta, jurusan Biologi lulus awal tahun 1990. Pada tahun 1999 penulis mendapat kesempatan melanjutkan pendidikan strata 2 bidang Bioteknologi di IPB dengan biaya ARMP II.
Penulis pernah bekerja sebagai staf peneliti di Balai Penelitian Bioteknologi Tanaman Pangan Bogor di bagian Kultur Jaringan Tanaman selama 7 tahun, selanjutnya, penulis mutasi tugas ke Balai Penelitian Tanaman Hias di Pasar Minggu Jakarta Selatan tepatnya pada tahun 1997 sampai sekarang.
DAFTAR TABEL……….……….…….……….………..………….. xv
DAFTAR GAMBAR………...……… xvii
DAFTAR LAMPIRAN………. xix
PENDAHULUAN.…….…..….……….………..……….….. 1
Latar Belakang…...……….……….. 1
Kerangka Pemikiran…...…..…...……….……….. 3
Permasalahan Penelitian …...…...……….……… 7
Tujuan Penelitian….…...………..……….………….…….. 10
Hipotesis..……..………...………...………… 10
Kegunaan Penelitian….……… 11
TINJAUAN PUSTAKA……...………….………..…………. 12
Botani Tanaman Phalaenopsis………... 12
Pemuliaan Tanaman Anggrek……….….………....… 15
Pemuliaan tanaman melalui persilangan konvensional……… 15
Pemuliaan tanaman melalui induksi keragaman somaklonal…..….. 17
Induksi mutasi menggunakan radiasi sinar Gamma………… 19
Induksi mutasi menggunakan EMS……… 21
Efek fisiologi mutagen….………..……… 22
Penyakit Busuk Lunak pada Phalaenopsis…..………...…. 23
Gejala Penyakit……….. 24
Bakteri Pektolitik Erwinia carotovora subsp carotovora…….…… 24
Jalur Pertahanan Tanaman terhadap Erwinia spp………..………… 25
Pengujian Ketahanan Terhadap Patogen secara in vitro….……...… 27
DAFTAR PUSTAKA……….………. 28
INDUKSI KALUS EMBRIOSOMATIK DARI EKSPLAN DAUN ANGGREK Phalaenopsis sp L... 33 ABSTRAK………..……… 33
ABSTRACT………...………..……… 34
PENDAHULUAN……….………..……… 34
BAHAN DAN METODE.……….……..……… 36
Induksi Pembentukan kalus……….. 36
Proliferasi Kalus ………....……….. 37
Perkembangan Kalus dan Regenerasi Tanaman………….…………..… 37
HASIL DAN PEMBAHASAN.….………..….…………. 38
Induksi Pembentukan kalus……….………. 38
Proliferasi Kalus ……….………. 41
Perkembangan Kalus dan Regenerasi Tanaman……….………. 43
KESIMPULAN.………..……… 45
DAFTAR PUSTAKA.……….……… 45
INDUKSI VARIAN SOMAKLON PADA KALUS PHALAENOPSIS MENGGUNAKAN RADIASI SINAR GAMMA... 47 ABSTRAK………...………... 47
ABSTRACT……… 48
PENDAHULUAN………...……… 48
BAHAN DAN METODE.………... 50
Induksi varian dengan iradiasi sinar gamma... 50
Daya regenerasi tanaman pasca iradiasi sinar gamma... 50
pada Kalus Phalaenopsis...
Daya Regenerasi Kalus Phalaenopsis pasca iradiasi... 54
Pembentukan Generasi M1V4 Melalui Embriogenesis langsung... 55
Keragaman fenotipik plantlet akibat radiasi sinar gamma... 57
KESIMPULAN.………..… 61
DAFTAR PUSTAKA.……….…………. 61
INDUKSI VARIAN SOMAKLON PADA KALUS PHALAENOPSIS MENGGUNAKAN EMS……….………… 65 ABSTRAK………...……… 64
ABSTRACT……….…… 65
PENDAHULUAN………..………….…… 65
BAHAN DAN METODE.………..….……… 66
Penyiapan kalus………..……….. 66
Daya hambat EMS terhadap proliferasi kalus dan regenerasi tanaman………..…….. 67 Evaluasi keragaman varian EMS……….……….……….. 67
HASIL DAN PEMBAHASAN.……….. 68
Penghambatan pada induksi somaklonal variasi menggunakan EMS.... 68
Evaluasi keragaman fenotip varian……….. 70
KESIMPULAN.………...… 73
DAFTAR PUSTAKA.………. 74
UJI IN VITRO KETAHANAN TERHADAP Erwinia carotovora subsp. carotovora PADA VARIAN SOMAKLON PHALAE NOPSIS SECARA IN VITRO MENGGUNAKAN SUSPENSI BAKTERI…….. 74 ABSTRAK………..…… 75
ABSTRACT………..……..… 76
PENDAHULUAN……….. 76
BAHAN DAN METODE.………..……….… 78
Bahan Tanaman dan Inokulum... 78
Uji In Vitro Menggunakan suspensi bakteri Erwinia carotovora Subsp. carotovora... 78 Evaluasi Varian Hasil Pengujian In Vitro……….…….... 80
HASIL DAN PEMBAHASAN………….………..………… 81
Uji Ketahanan Varian secara In Vitro ... 81
Evaluasi ketahanan padaVarian terhadap infeksi Erwinia carotovora subsp carotovora... 86
KESIMPULAN.……….………. 88
DAFTAR PUSTAKA.……….……… 89
PENGU JIAN DI LAPANG KETAHANAN VARIAN SOMAKLON PHALAENOPSIS TERHADAP PENYAKIT BUSUK LUNAK….…... 91 ABSTRAK……….. 91
ABSTRACT……….... 92
PENDAHULUAN………...… 92
BAHAN DAN METODE.………... 93
Bahan Tanaman... 93
Pengujian Varian terhadap Erwinia carotovora subsp carotovora di Lapang………...……. 94 Pengujian karakter varian potensial... 95
carotovora di Lapanan…………...………..……… Evaluasi Karakter Kualitatif Ketahanan Penyakit pada Varian
Potensial………...… 99
KESIMPULAN.………..… 103
DAFTAR PUSTAKA.……….…… 104
PEMBAHASAN UMUM……….…...… 106
SIMPULAN DAN SARAN……….…… 111
SIMPULAN………....……. 111
SARAN……… 112
DAFTAR PUSTAKA……….. 113
Phalaenopsis dan Vanda
2 Beberapa uji biokimia dan fisiologi untuk karakterisasi Erwinia carotovora subsp carotovora setelah didapatkan koloni tunggal.
25
3 Komposisi media inisiasi tanaman yang digunakan dalam penelitian.
36
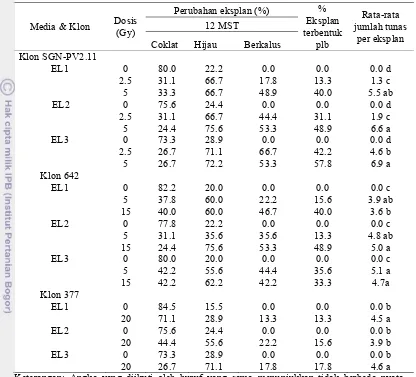
4 Pengaruh komposisi media inisiasi terhadap perubahan eksplan daun dari klon Phalaenopsis 377, 642 dan SGN-PV2.11 pada 12 MST (minggu setelah tanam).
39
5 Pengaruh komposisi media proliferasi terhadap perkembangan kalus klon Phalaenopsis 377, 642 dan SGN-PV2.11 pada 12 MST (minggu setelah tanam) .
41
6 Pengaruh komposisi media proliferasi kalus terhadap pembentukan kalus.
41
7 Daya pembentukan embriosomatik dan tunas klon SGN-PV2.11, 377 dan 642 pada media MR pada setiap gerombol kalus yang diamati setiap 4 minggu selama 12 MST.
43
8 LD50 pada kalus 3 klon Phalaenopsis akibat radiasi sinar gamma. 53
9 Pengaruh perlakuan dosis iradiasi pada kalus embriogenik klon SGN-PV2.11, 642 dan 377 terhadap persentase kalus yang bertunas dan jumlah tunas per kalus selama 12 minggu setelah tanam (MST).
54
10 Persentase pembentukan M1V4 melalui embriogenesis langsung menggunakan eksplan daun selama 12 MST
57
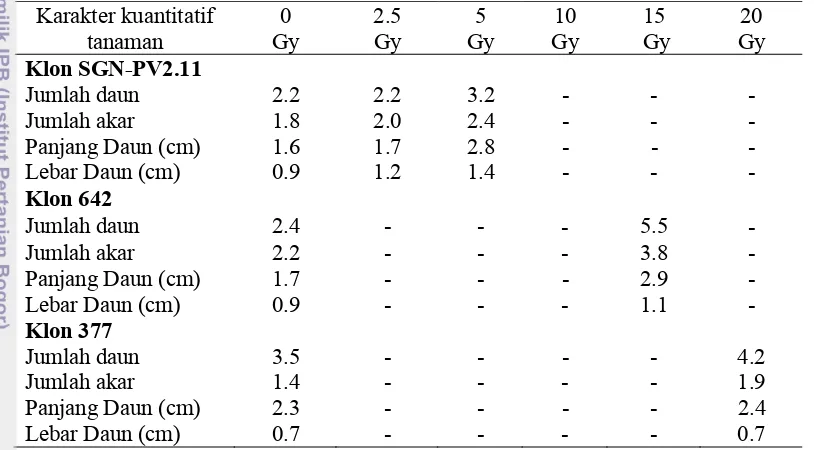
11 Rataan berbagai karakter kuantitiatif pada populasi varian Klon SGN-PV2.11, 642 dan 377 berumur 12 minggu setelah tanam (12 MST).
58
12 Tipe dan persentase keragaman karakter kualitatif diantara populasi varian klon SGN-PV2.11, 377 dan 642 yang diregenerasikan dari kalus embriogenik setelah diberi perlakuan radiasi sinar gamma 12 MST
59
13 LC50 pada klon SGN-PV2.11, 642 dan 377 berdasarkan persentase konsentrasi EMS dan waktu yang digunakan untuk perendaman. Pengamatan dilakukan pada 6 MST. Data diolah dengan persamaan Quadrqtic fit.
68
14 Pengaruh dua kelompok perlakuan konsentrasi dan waktu perendaman mutagen EMS pada kalus klon SGN-PV2.11, 377 dan 642 terhadap persentase eksplan hidup yang diamati selama 6
15 Tipe dan persentase keragaman karakter kualitatif abnormal diantara populasi varian klon 377, 642 dan SGN-PV2.11 yang diregenerasikan dari kalus embriogenik setelah diberi perlakuan EMS setelah 16 MST.
71
16 Jumlah kromosom dan kloroplas beberapa mutan normal maupun abnormal pada klon SGN-PV2.11, 642 dan 377 yang terjadi akibat perlakuan EMS.
73
17 Analisis ragam dan peragam. 80
18 Persentase plantlet mati dan lama waktu yang diperlukan plantlet dari awal inokulasi sampai plantlet mati pada plantlet yang diinokulasi dengan Erwinia carotovora subsp carotovora secara in-vitro.
82
19 Rata-rata skor kerusakan daun (SKD), intensitas penyakit (IP), dan ketahanan klon varian Phalaenopsis SGN-PV2.11, klon 377, dan klon 642 hasil seleksi in vitro
85
20 Hasil analisis ragam dan ragam genetik karakter ketahanan penyakit bususk lunak pada setiap genotip SGN-PV2.11, 377, 642 dan antara seluruh genotip.
87
21 Respon tanaman varian yang telah diuji secara in vitro terhadap infeksi Erwinia carotovora subsp carotovora di lapangan
99
22 Hubungan antara isoenzim peroksidase, esterase dan unit aktivitas enzim (UAE) peroksidase terkadap skor kebusukan daun (SKD) varian tanaman pada engamatan dilakukan 24 jam setelah diinokulasi dengan Erwinia carotovora subsp carotovora
100
23 Mutan tahan dan agak tahan dari klon SGN-PV2.11, 642 dan 377 hasil validasi dengan uji di lapangan menggunakan patogen Erwinia carotovora subsp. carotovora
busuk lunak pada tanaman anggrek Phalaenopsis.
2 (a) Tetua klon SGN-PV2.11, (b) klon 377 dan (c) klon 642 6
3 Morfologi tanaman Phalaenopsis sp (a) akar substrat (b) daun (c) calon bunga
14
4 Anggrek hasil silangan intergenerik (a) Renanthopsis Mildred Jameson, (b) Phalaendopsis Arizona Star’Jim Turnbow’
16
5 Persentase perubahan eksplan irisan daun Phalaenopsis menjadi hitam beberapa minggu setelah tanam pada media MI-0, MI-1, MI-2, MI-3, MI-4.
38
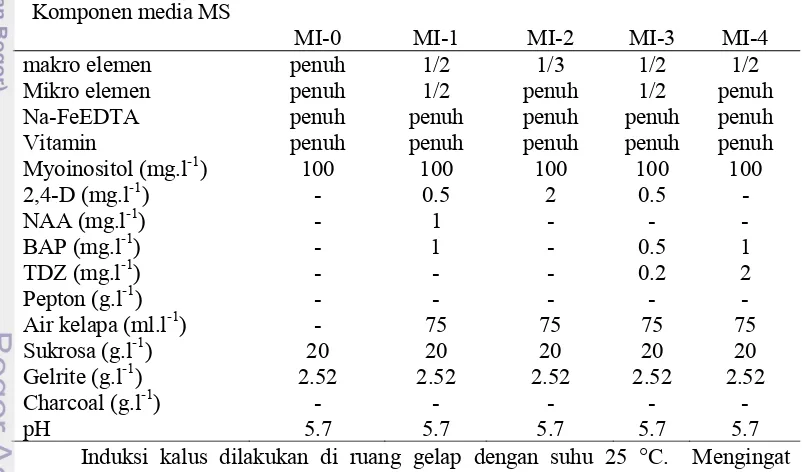
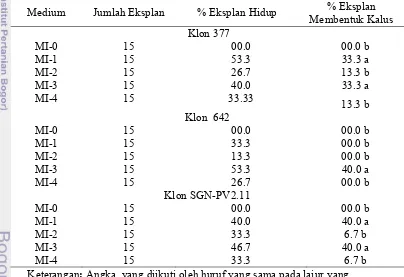
6 (a) dan (b) Inisiasi kalus dari irisan eksplan daun yang mulai membengkak dan berkalus membentuk proembrio (c) plb (d) regenerasi tanaman dari plb.
40
7 Penambahan berat kalus dari subkultur (SK) I hingga ke III pada media MP (1/2MS + 0,5 mg/L 2,4-D + 0,2 mg thidiazuron) dan MR (1/2MS + 0,2 mg/l 2,4-D + 0,4 mg/l BAP).
42
8 Proses embriogenesis somatik pada kalus Phalaenopsis sp L.(a) globuler dan jaringan kalus sekitarnya (b) bentuk torpedo (c) calon kotiledon, primordial tunas dan akar (d) telah membentuk daun.
44
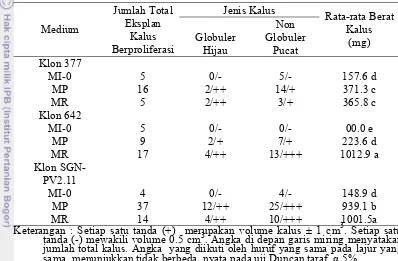
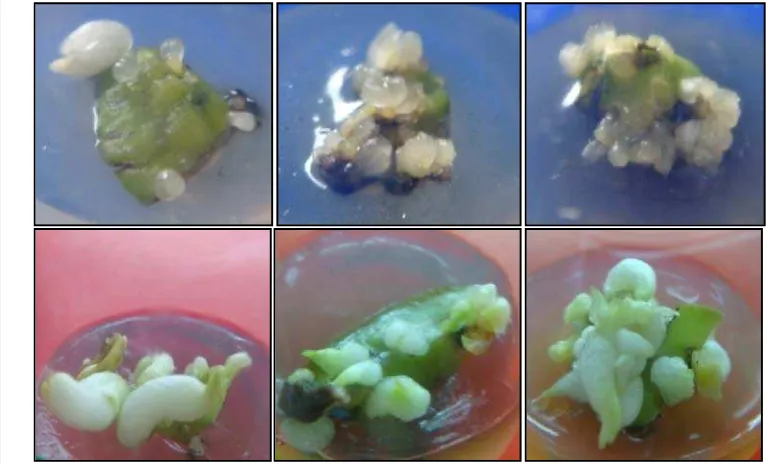
9 Penampilan plantlet hasil regenerasi tanaman pada klon 642, 377 dan SGN-PV2.11
44
10 Embriogenesis langsung pada pembentukan M1V4. Kalus –kalus bening muncul dari irisan daun pada media E1 (a), E2 (b), E3 (c) di ruang gelap. Perubahan kalus menjadi calon tunas setelah kalus dipindahkan ke ruang terang pada media E1 (d), E2 (e), E3 (f).
56
11 Fenotip varian yang dihasilkan dari iradiasi sinar gamma (a) plantlet dengan duduk daun roset, (b) daun plantelt merah, (c) daun terompet, (d) daun bergerigi, (e) daun terbelah
59
12 Pita isoenzim peroksidase (PER) dan aspartat aminotransferase (AAT) pada 26 sampel klon dan tetua
60
13 Fenotip yang terbentuk karena pengaruh mutagen EMS (a) plantlet SGN-PV2.11/88E/E1/2.2 dengan ciri normal, (b) plantlet 377/23F/E1/1.7 dengan pertumbuhan daun abnormal, (c) plantlet 642/13F/E2/1.4 dengan pertumbuhan daun abnormal, (d) plantlet SGN-PV2.11/71E/E5/2.2 dengan pertumbuhan duduk daun rapat (e) PV2.11/.K4/E0/1.1 bentuk terompet, (f) plantlet SGN-PV2.11/54E/E5/3.1 berdaun bulat.
kromosom 2n=3x=56 pada 642/13F/E2/4.4.
15 Skoring bercak gejala penyakit busuk lunak pada pengujian in vitro
79
16 (a) Korelasi antara masa infeksi dengan laju infeksi (b) korelasi antara masa infeksi dengan intensitas penyakit busuk lunak pada varian-varian hasil radiasi sinar gamma dan EMS yang diinokulasi secara in vitro.
82
17 Hasil inokulasi secara in vitro (a) plantlet mengalami hipersensitif respon, (b) tanaman mengalami kebusukan daun dengan skor 9, (c) seluruh plantlet busuk, d) cara memperkirakan luasan kebusukan daun.
83
18 Jumlah plantlet varian dalam kategori skor 1 dan 3 hasil perlakuan radiasi sinar gamma (Rad SGN, Rad 642, Rad 377) dan EMS (EMS SGN, EMS 642, EMS 377) yang telah diuji secara in vitro.
84
19 Konsentrasi peroksidase pada plantlet varian 24 jam setelah inokulasi dengan Erwinia carotovora subsp carotovora,
88
20 Inokulasi di lapang dengan Erwinia carotovora subsp carotovora pada varian tanaman tahan hasil seleksi in vitro : (a) diinkubasi tertutup dalam kumbung plastic, (b) dan (c) pelukaan setelah inokulasi ditutup dengan kapas basah dan selotip, (d) kebusukan yang terjadi setelah inokulasi 24 jam, (e) tanaman yang tetap sehat setelah inokulasi SKD 1, (f) tanaman dengan SKD 9
97
21 (a) Korelasi antara masa infeksi dengan laju infeksi penyakit (b) korelasi antara masa infeksi dengan intensitas penyakit busuk lunak varian potensial pada pengujian di lapangan
98
Diagram konsentrasi asam salisilat varian tanaman setelah 24 jam terinfeksi Erwinia carotovora subsp carotovora.
1 Daftar varian potensial klon SGN-PV2.11, 642 dan 377 yang tahan (SKD 1) dan agak tahan (SKD 3) terhadap Erwinia carotovora subsp carotovora hasil uji in vitro yang dilanjutkan dengan uji di lapangan.
119
2 Data mentah rata-rata jumlah plantlet per eksplant dari tiga klon SGN-PV2.11, 642 dan 377 yang diperoleh setelah 12 MST
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara yang memiliki keragaman anggrek
spesies alam yang sangat besar dan tersebar di seluruh wilayah nusantara. Di antara
5000 spesies anggrek yang ditemukan di wilayah Indonesia, Phalaenopsis merupakan
salah satu genus yang terkenal akan keindahan dan keragaman coraknya (Djafaarer
2002). Hibrida-hibrida yang dihasilkan dan terkenal di dunia banyak ditemukan
memiliki induk yang berasal dari Phalaenopsis spesies di Indonesia. Salah satu
spesies ialah Phalaenopsis amabilis yang berwarna putih seperti kupu-kupu.
Phalaenopsis tersebut menjadi induk yang sangat penting karena menurunkan
berbagai hibrida yang berpotensi komersial yang lebih indah, lebih seragam dan
kuntum lebih lebar. Spesies Phalaenopsis yang lain seperti Phalaenopsis
amboinensis dan Phalaenopsis venosa sangat potensial menurunkan warna kuning.
Produksi Phalaenopsis di dunia semakin meningkat dan menjadi komoditi
unggulan yang tetap prospektif di tengah kelesuan bisnis tanaman hias. Di Indonesia,
produksi anggrek diharapkan dapat meningkat dari 16.166.628 pot pada tahun 2005
menjadi 19.284.219 pot tahun 2010 (Dirjen Horti 2005), sesuai standar mutu yang
dipersyaratkan pasar domestik dan internasional. Sebagai salah satu negara yang
memiliki sumber genetik anggrek bervariasi, Indonesia memiliki kesempatan yang
cukup tinggi untuk lebih memberdayakan sumber daya genetik tersebut. Keberhasilan
dalam pemberdayaan sumber genetik akan menjadi kekuatan yang berarti dalam
pengembangan anggrek Indonesia khususnya Phalaenopsis.
Sesuai kenyataan di lapangan, budidaya Phalaenopsis di Indonesia yang ada
pada saat ini telah didominasi oleh hibrida - hibrida hasil dari mancanegara. Negara
yang memiliki kemampuan teknologi yang cukup terkemuka seperti Taiwan,
Thailand, Singapura, Hawaii dan Australia merupakan negara penghasil
Phalae-nopsis terbesar di dunia (Tang & Chen 2007). Pengembangan Phalaenopsis telah
mencapai titik klimaks yang dibuktikan dari adanya kejenuhan produksi dan
kejenuhan pasar. Persilangan konvensional yang dilakukan pada tetua-tetua yang
berasal dari satu genus sudah tidak memberikan corak baru yang mampu
mendongkrak perdagangan anggrek.
Upaya berinovasi baru sangat dibutuhkan untuk mendapatkan
untuk mendapatkan bentuk dan corak yang baru. Anggrek hasil persilangan
intergenerik telah diperoleh di berbagai negara terutama Belanda yang kini
merupakan penghasil anggrek intergenerik terbesar di dunia khususnya Phalaenopsis.
Di Indonesia, hasil persilangan intergenerik masih sangat jarang dijumpai meskipun
Indonesia memiliki ribuan jenis anggrek. Hal ini disebabkan karena terbatasnya
informasi mengenai karakter spesies alam yang ada.
Pengembangan anggrek di Indonesia seringkali terkendala oleh keterbatasan
iklim tropis basah yang menyebabkan serangan patogen yang lebih banyak. Beberapa
penyakit utama anggrek hingga saat ini sulit dikendalikan di antaranya ialah penyakit
degenerasi virus, penyakit layu dan penyakit busuk. Salah satu penyakit busuk yang
menyebabkan kerusakan pada semua jenis tanaman anggrek dengan kerugian yang
besar ialah penyakit busuk lunak (soft rot). Penyakit ini disebabkan oleh Erwinia
carotovora subsp. carotovora, bakteri yang menimbulkan pembusukan pada jaringan
lunak tanaman (Snijder et al. 2004) atau pseudobulb pada anggrek dan disertai bau
yang tidak enak dan mati hanya dalam beberapa hari.
Meskipun kerugian yang disebabkan oleh penyakit busuk lunak pada
anggrek di Indonesia belum pernah didata secara formal tetapi pada kenyataanya
banyak petani terutama petani kecil kesulitan mengatasinya. Petani anggrek
Phalaenopsis di Indonesia tidak semua mampu menyediakan kondisi lingkungan
buatan dapat menekan perkembangan penyakit busuk lunak. Kerugian yang
ditimbulkan oleh penyakit mampu mencapai 80-100%. (McMillan et al. 2007).
Secara umum penyakit akibat serangan bakteri lebih sulit dikendalikan
daripada penyakit lain. Tindakan tepat pengendalian kimia secara praktis dan efektif
belum ditemukan. Salah satu cara yang efektif untuk mengendalikan penyakit
tersebut ialah dengan menggunakan kultivar yang tahan (Snijder et al. 2004).
Pengendalian dengan menanam kultivar yang tahan merupakan cara yang efektif,
efisien dan aman bagi lingkungan (Sobiczewski 2008).
Perakitan kultivar baru melalui pemuliaan untuk menghasilkan Phalenopsis
yang berbunga indah dan tahan hama dan penyakit dapat dilakukan dengan
penggabungan teknik persilangan konvensional dan teknik in vitro melalui induksi
keragaman somaklonal. Sejak ditemukan teknik keragaman somaklonal banyak
dilakukan penelitian-penelitian mengenai aplikasi teknik ini terutama pada tanaman
hias. Teknik induksi keragaman somaklonal tersebut dapat digunakan untuk
warna bunga (Chen & Chen 2007). Teknik induksi keragaman somaklonal
merupakan salah satu teknik penting yang potensinya cukup tinggi dalam membantu
pemulia tanaman mencapai tujuan perbaikan tanaman, pengembangan kultivar
unggul dan mempelajari lebih jauh tentang keadaan karakter tertentu dari suatu
spesies tanaman (Nasir 2002).
Pengembangan Phalaenopsis yang mengarah pada karakter ketahanan
terhadap suatu penyakit belum banyak dilakukan khususnya di Indonesia.
Pengembangan yang dilakukan melalui hibridisasi masih terbatas pada pembentukan
karakter fenotip bunga. Informasi mengenai sumber ketahanan terhadap suatu
penyakit pada anggrek juga masih sangat jarang ditemukan, khususnya sumber
ketahanan terhadap penyakit busuk lunak. Teknik induksi variasi somaklonal dapat
digunakan untuk menginduksi munculnya satu atau dua karakter tertentu tanpa
merubah sifat dasar tanaman.
Peningkatan keragaman somaklonal dapat dilakukan dengan cara induksi
mutasi melalui pemberian mutagen. Mutagen yang digunakan dapat diklasifikasikan
dalam dua kelompok yaitu mutagen fisik seperti iradiasi sinar gamma, sinar X
ataupun neutron dan mutagen kimia dengan pemberian EMS, DES, dan NEU
(Ahloowalia et al. 2004). Hingga saat ini metode keragaman somaklonal yang
dikombinasikan dengan mutagenesis masih dapat diandalkan untuk tujuan pemuliaan
tanaman dalam mendapatkan karakter tertentu yang diinginkan seperti sifat
ketahanan terhadap cekaman biotik maupun abiotik.
Keberhasilan penggunaan mutagen kimia sebagai agen induksi mutan telah
banyak diketahui di antaranya pada ubijalar dengan skrining in vitro untuk toleran
garam (Luan et al. 2007), pada krisan untuk mutasi warna (Rodrigo et al. 2004), pada
Arabidopsis untuk toleran terhadap herbisida (Jender et al. 2003), dan juga pada
paku-pakuan (Jeong et al. 2006). Tidak hanya di luar negeri, di Indonesia teknik ini
juga telah dimanfaatkan pada tanaman panili dan telah didapatkan tanaman tahan
penyakit layu bakteri (Lestari et al. 2006), tanaman pisang ambon tahan fusarium
(Husni et al. 2005).
Kerangka Pemikiran
Kerangka pemikiran perakitan kultivar anggrek Phalaenopsis tahan penyakit
busuk lunak Erwinia melalui teknik in vitro dapat dilihat pada Gambar 1. Sumber gen
pengujian ketahanan terhadap penyakit busuk lunak pada beberapa spesies
Phalaenopsis telah dilakukan oleh Balai Penelitian Tanaman Hias sebagai lembaga
yang mengemban mandat melaksanakan penelitian dan pengembangan tanaman hias,
memperoleh hasil bahwa Phalaenopsis cornucervi dan Phalaenopsis amboinensis
bersifat tahan, sedangkan Phalaenopsis amabilis bersifat peka terhadap penyakit
busuk lunak (Handayati et al. 2004).
Hasil persilangan Phalaenopsis pada saat ini telah sangat berkembang luas,
mengingat genus ini memiliki keragaman genetik yang cukup tinggi terutama pada
keragaman bunga. Namun keragaman genus Phalaenopsis sangat sempit untuk sifat
ketahanan terhadap penyakit. Persilangan Phalaenopsis yang masih merupakan
persilangan spesies murni, seperti Phalaenopsis amboinensis dan Phalaenopsis
cornu-cervi, sangat jarang ditemui. Salah satu cara untuk mendapatkan keturunan
kultivar yang tahan Erwinia pada penelitian ini, ialah dengan menelusuri tetua
tanaman komersial yang memiliki keturunan Phalaenopsis cornu-cervi atau
Phalaenopsis amboinensis.
Penelitian ini menggunakan tiga klon yaitu 1) klon SGN-PV2.11
(Phalaenopsis Taisuco Kochdian/Yukimai x Vanda Fuch DeLight x Vanda
lombokensis) yang merupakan hasil persilangan intergenerik Phalaenopsis dengan
Vanda, 2) klon 377 (Phalaenopsis Golden Poeker/Sogolisa x Phalalaenopsis
Viogold), dan 3) klon 642 ([Phalaenopsis Chih Sang’s Stripe/ Alfonso Ibara/Matao
Freed] x Phalaenopsis amboinensis) x Ever Spring Prince) (Gambar 2). Tetua betina
persilangan intergenerik SGN-PV2.11 merupakan Phalaenopsis yang memiliki
keturunan Phalaenopsis amabilis yang rentan, sedang Vanda sebagai tetua jantan
diharapkan dapat menurunkan sifat fisiknya yang berdaun lebih keras dari daun
Phalaenopsis. Dua klon yang lain yaitu klon 642 dan klon 377, salah satu tetuanya
merupakan keturunan dari Phalaenopsis amboinensis yang bersifat tahan terhadap
penyakit busuk lunak. Klon 642 memiliki keturunan Phalaenopsis amboinensis dari
tetua betina yaitu Phalaenopsis Golden poeker sedang klon 377 mendapatkan dari
kedua tetuanya.
Klon SGN-PV2.11, klon 642 dan klon 377 ditingkatkan keragamannya
dengan menggunakan iradiasi sinar gamma dan EMS. Varian yang dihasilkan diuji
ketahanannya terhadap Erwinia carotovora subsp. carotovora secara in vitro.
Pembentukan kalus pada Phalaenopsis diinisiasi menggunakan eksplan daun.
beberapa media yang mengandung beberapa kombinasi zat pengatur tumbuh dalam
media MS. Kalus yang muncul diproliferasikan dan diregenerasikan dalam media
regenerasi.
Gambar 1 Kerangka pemikiran untuk mendapatkan kultivar baru tahan busuk lunak pada tanaman anggrek Phalaenopsis
Kalus yang terinduksi media dapat diinduksi dengan mutagen fisik iradiasi
sinar gamma dan mutagen kimia EMS untuk memperoleh varian somaklon. kalus
yang telah diberi perlakuan iradiasi, ditumbuhkan pada media proliferasi kalus dan 1. 377 (Phal. Golden Poeker/Sogolisa x Phal. Viogold)
2. 642 ([Phal. Chih Sang’s Stripe/ Alfonso Ibara/Matao Freed] x Phal. amboinensis) x Ever Spring Prince) 3. SGN-PV2.11 (Phal. Taisuco Kochdian/Yukimaix
Vanda Fuch delight / Vanda lombokensis)
Induksi Kalus Embriogenik -kalus embriogenik
Plasma Nutfah
Phalaenopsis
Penyinaran sinar gamma -varian somaklon
Pengujian ketahanan terhadap Erwinia carotovorasubsp. carotovoradi Lapangan
Pengujian in vitro Varian
pada ketahanan terhadap Erwinia carotovora subsp. carotovora terhadap :
- Varian Somaklon Potensial
tahan terhadap Erwinia carotovora subsp. carotovora
Klon
Phalaenopsis
Unggul Tahan
Erwinia carotovora
subsp.
carotovora
diamati persentase kematiannya untuk menentukan LD50 untuk dosis iradiasi dan
LC50 untuk konsentrasi EMS. LD50 dan LC50 digunakan untuk menentukan dosis dan
konsentrasi yang optimum pada pembentukan varian somaklon. Varian somaklon
yang diperoleh dari induksi mutasi, diuji secara in vitro untuk mendapatkan varian
yang tahan terhadap bakteri Erwinia carotovora subsp. carotovora. Varian yang telah
diuji secara in vitro diaklimatisasi dan diuji kembali di lapangan agar hasil yang
diperoleh lebih akurat ketahanannya terhadap penyakit busuk lunak yang disebabkan
oleh Erwinia carotovora subsp. carotovora.
.
Gambar 2 (a) Tetua klon SGN-PV2.11, (b) tetua klon 377 dan (c) tetua klon 642.
Permasalahan
Tanaman anggrek khususnya Phalaenopsis merupakan komoditas bernilai
ekonomi tinggi dan sangat prospektif untuk dibudidayakan sebagai sumber
pendapatan petani. Budidaya anggrek juga menjadi penyedia lapangan pekerjaan dan
sebagai penggerak pertumbuhan ekonomi di daerah. Adanya keberagaman manfaat
bunga anggrek dalam kehidupan manusia menyebabkan permintaan terus meningkat.
Hal ini menyebabkan minat masyarakat untuk memelihara tanaman anggrek dengan
tujuan komersial semakin meningkat. Kondisi pasar yang cerah baik di dalam
maupun di luar negeri memungkinkan ekspor anggrek dapat menjadi sumber devisa
yang potensial bagi negara, di samping menjadi sumber penghasilan petani dan
pendapatan asli daerah (Suryana et al. 2005).
Kondisi pasar anggrek khususnya Phalaenopsis akan tetap cerah apabila
didukung dengan pengembangan yang optimum untuk penyediaan pasokan
Phalaenopsis yang berkualitas secara berkesinambungan. Sejalan dengan globalisasi
ekonomi, maka usaha peningkatan dan pengkayaan keanekaragaman dalam
penyediaan produk anggrek yang berkualitas menjadi lebih penting di tengah
timbulnya kejenuhan pasar yang terjadi akhir-akhir ini. Keberhasilan dalam
penyediaan bibit berkualitas di dalam negeri dapat mengatasi permasalahan
ketergantungan penyediaan bibit impor dari luar negeri yang masih terjadi hingga
saat ini.
Terobosan baru pada pengembangan Phalaenopsis perlu dilakukan untuk
mengatasi hal tersebut. Pemilihan teknik in vitro perlu dilakukan sebagai upaya
terobosan untuk mendapatkan varietas unggul baru. Di dalam teknik in vitro,
komposisi media merupakan hal penting untuk penyediaan nutrisi yang bermanfaat
bagi pertumbuhan sel dan jaringan serta diferensiasi sel menjadi tanaman utuh
kembali. Penggunaan berbagai zat pengatur tumbuh akan mempengaruhi arah
diferensiasi sel maupun jaringan. Auksin dalam konsentrasi optimum akan medorong
terbentuknya kalus, sedangkan sitokinin akan mendorong terbentuknya tunas. Inisiasi
embrio somatik dapat dilakukan pada media yang mengandung kombinasi zat
pengatur tumbuh auksin dan sitokinin seimbang (Chowdhury et al. 2003).
Keseimbangan komposisi nutrisi dan zat pengatur tumbuh tambahan pada induksi
embrio somatik setiap tanaman adalah berbeda, oleh karena itu perlu dilakukan
penelitian mengenai komposisi tersebut.
Peningkatan keragaman genetik harus dilakukan apabila materi tanaman
merupakan klon, karena suatu klon tidak memiliki keragaman genetik. Keragaman
variasi somaklonal. Teknik ini merupakan teknik untuk mendapatkan variasi genetik
tanaman yang dapat dilakukan melalui kultur jaringan secara in vitro (Karp 2004).
Pada saat ini teknik in vitro dan mutagenesis merupakan metode yang paling
banyak digunakan untuk meningkatkan variabilitas pada tanaman yang diperbanyak
secara vegetatif. Teknik mutasi yang dikombinasikan dengan kultur in vitro dan
metode molekuler akan menyediakan metode-metode yang kuat untuk meningkatkan
pemuliaan tanaman pada banyak tanaman hias. Selain itu dengan perlakuan
mutagenesis dapat diinduksi perubahan ukuran tanaman, waktu mekar bunga,
pemasakan buah, warna buah, self-compatibility, dan juga resistensi terhadap patogen
(Predieri 2001). Teknik mutasi ini dapat dilakukan secara fisik dengan teknik nuklir
iradiasi sinar gamma maupun kimia (Konstantinov & Driníc 2007).
Dalam pemuliaan tanaman, penggunaan teknik nuklir paling berpengaruh
secara langsung untuk menginduksi mutasi sel. Sejak penemuan sinar-X sekitar
seratus tahun yang lalu, penggunaan iradiasi pengion seperti sinar-X, gamma dan
neutron telah menjadi suatu teknologi yang telah terbukti secara luas (Ahloowalia &
Maluszynski 2001). Bahan mutagen fisik ini dapat melepas energi (ionisasi), segera
setelah melewati atau menembus materi. Proses ionisasi akan terjadi dalam jaringan
dan selanjutnya dapat menyebabkan perubahan pada tingkat sel, genom, kromosom
dan DNA atau gen. Perubahan yang terjadi secara mendadak pada tingkat genom,
kromosom dan DNA atau gen sering bersifat permanen, dan diwariskan ke generasi
berikutnya, dikenal sebagai mutasi (Soeranto 2005).
Induksi mutasi dengan iradiasi ini paling banyak digunakan untuk
pengembangan metode perolehan varietas-varietas mutan secara langsung, dengan
frekuensi penggunaan yang paling tinggi yaitu 89%, sedangkan penggunaan mutagen
kimia relatif rendah. Di antara iradiasi pengion yang ada, induksi iradiasi
varietas-varietas mutan paling banyak dikembangkan dengan sinar-γ (65%), diikuti sinar-X
(22%). Dari 2.252 nomor aksesi, 75% merupakan tanaman pangan dan 25% tanaman
hias dan dekoratif (Ahloowalia et al. 2004).
Teknik induksi variasi somaklonal juga dapat diaplikasikan bersama dengan
teknik mutagenesis secara kimiawi. Mutagen kimia lebih mudah tersedia dan
perbandingan terhadap modifikasi yang tidak diinginkan lebih baik pada mutagen
kimia dibandingkan dengan iradiasi (Nasir 2002). EMS merupakan salah satu
alkilasi. Senyawa ini memiliki satu atau lebih gugus alkil reaktif yang dapat ditransfer
ke molekul lain pada posisi kepadatan cukup tinggi (Kodym & Afza 2003).
Jenis mutagen kimia sangat banyak, tetapi paling populer dan handal di
antaranya adalah jenis yang dikelompokkan dalam golongan senyawa ‘ethylating
agent’ dan ‘methylating agent’. Ethilmethanesulfonat (EMS), dan diethilsulfonat
(DES), merupakan mutagen kimia yang merupakan senyawa ‘ethylating agent’,
sedangkan Methylmethanesulfonat (MMS), Dimethylsulphate (DMS) dan sebagainya
(Kodym & Afza 2003). Keberhasilan penggunaan mutagen kimia sebagai agen
induksi mutan telah banyak diketahui di antaranya pada ubijalar dengan skrining in
vitro untuk toleran terhadap garam (Luan et al. 2007), pada tanaman arabidopsis yang
resisten terhadap herbisida (Jender et al. 2003), pada krisan (Rodrigo et al. 2004), dan
juga telah diaplikasikan pada kacang panjang (Svetleva & Crino 2005).
Metode pengujian ketahanan tanaman melalui cara inokulasi di lapangan telah
banyak dilakukan, tetapi metode ini sering mengalami disease escape. Di samping itu
lahan yang digunakan untuk pengujian tersebut dapat menjadi sumber penyakit baru.
Metode lain yang relatif aman diaplikasikan adalah metode uji secara in vitro.
Teknik ini lebih efisien dan efektif karena selain dapat mengurangi terjadinya escape,
hasil uji dapat diulang di rumah kaca, patogen yang digunakan tetap terbatas di
laboratorium dan umumnya memberikan hasil yang relatif tidak berbeda dengan
inokulasi di lapangan, tidak membutuhkan lahan yang luas dan lebih murah
(Samanhudi 2000).
Metode pengujian ketahanan tanaman secara in vitro terhadap penyakit busuk
lunak yang disebabkan oleh Erwinia spp khususnya pada Phalaenopsis belum pernah
dilakukan di Indonesia. Informasi mengenai masalah ketahanan Phalaenopsis
terhadap penyakit busuk lunak juga tidak banyak dijumpai, oleh karena itu masih
diperlukan penelitian mengenai baik penggunaan metode pengujian maupun sifat
ketahanan Phalaenopsis terhadap penyakit busuk lunak tersebut. Dalam penelitian ini
akan diaplikasikan penggunaan metode uji in vitro untuk ketahanan Phalaenopsis
terhadap penyakit busuk lunak menggunakan agen penguji bakteri, pada varian
somaklon hasil iradiasi dan perlakuan EMS. Beberapa analisis pendukung yang dapat
dilakukan antara lain analisis isoenzim, analisis kandungan peroksidase, dan
kandungan asam salisilat.
Secara umum penelitian ini bertujuan mendapatkan klon baru tahan penyakit
busuk lunak yang disebabkan oleh Erwinia carotovora subsp. carotovora melalui
pendekatan penelitian, yaitu melalui pengujian varian somaklon yang diinduksi
menggunakan iradiasi sinar gamma dan perendaman larutan EMS. Secara spesifik
penelitian ini bertujuan :
1. Mendapatkan teknik induksi embriosomatik dari klon SGN-PV2.11, klon 377
dan klon 642.
2. Mendapatkan varian somaklon melalui iradiasi sinar gamma.
3. Mendapatkan varian somaklon melalui perlakuan perendaman larutan EMS.
4. Mendapatkan varian-varian somaklon SGN-PV2.11, 377 dan 642 hasil iradiasi
sinar gamma dan perendaman larutan EMS yang tahan terhadap Erwinia
carotovora subsp. carotovora melalui uji ketahanan secara in vitro.
5. Mengkonfirmasi hasil uji ketahanan terhadap Erwinia carotovora subsp.
carotovora secara in vitro dan uji ketahanan terhadap penyakit di lapangan.
Hipotesis
Hipotesis yang dapat dikemukakan dalam penelitian ini antara lain:
1. Kemampuan pembentukan kalus setiap klon Phalaenopsis sangat ditentukan oleh
komposisi media.
2. Keragaman somaklonal dapat diinduksi dengan dosis iradiasi sinar gamma
tertentu dan keberadaan mutan ditentukan oleh kemampuan regenerasi pada
media yang sesuai dan seleksi diplontik yang dilakukan.
3. Keragaman somaklonal dapat diinduksi oleh konsentrasi mutagen EMS dan
keberadaan mutan ditentukan oleh kemampuan regenerasi pada media yang
sesuai dan seleksi diplontik yang dilakukan.
4. Uji ketahanan Erwinia carotovora subsp. carotovora secara in vitro dapat
menentukan tingkat ketahanan varian somaklon terhadap Erwinia carotovora
subsp. carotovora.
5. Uji ketahanan terhadap Erwinia carotovora subsp. carotovora di lapangan
memiliki tingkat akurasi yang sepadan dengan hasil uji ketahanan secara in
vitro.
Anggrek Phalaenopsis dengan sifat unggul tahan penyakit busuk lunak
berpeluang meningkatkan bisnis peranggrekan di dalam negeri. Dengan diperolehnya
klon unggul Phalaenopsis yang tahan penyakit busuk lunak pada penelitian ini
diharapkan dapat mendorong penelitian lain yang berbasis keragaman somaklonal
untuk mendapatkan klon-klon baru tahan penyakit yang lain, sehingga bermanfaat
dalam pengembangan industri pemuliaan di dalam negeri dalam penyediaan bibit
berkualitas.
Dampak positif lain yang diharapkan dari keberhasilan penelitian ini ialah
dapat meningkatkan minat petani anggrek dan luas areal bisnis anggrek
Phalaenopsis, sehingga akan meningkatkan peluang lapangan kerja.
TINJAUAN PUSTAKA
Botani Tanaman Phalaenopsis
Indonesia sebagai salah satu negara tropis di kawasan Asia memiliki
kekayaan flora yang tersebar di seluruh wilayah kepulauannya. Di antara ragam
dan bernilai ekonomi tinggi. Sebagian besar spesies anggrek belum termanfaatkan
dan masih berada di hutan belantara dataran rendah maupun dataran tinggi sebagai
habitat alamnya. Dari berbagai jenis anggrek yang tumbuh di alam Indonesia,
Phalaenopsis merupakan salah satu yang paling populer di dunia. Sebagian besar
spesies Phalaenopsis yang dikenal di dunia diketahui berasal dari Indonesia, sedang
sebagian kecil berasal dari Semenanjung Malaya, Filipina, Thailand, dan Birma
(Djaafarer 2002).
Beberapa spesies yang sangat populer dan terus diburu yaitu Phalaenopsis
gigantea (anggrek bulan raksasa) yang berasal dari Kalimantan, dan sangat potensial
sebagai induk silangan. Phalaenopsis amboinensis yang juga terkenal sebagai cikal
bakal lahirnya Phalaenopsis berbunga kuning. Salah satu yang berbunga kupu-kupu
putih, Phalaenopsis amabilis dapat dijumpai hampir di seluruh kepulauan Indonesia,
seperti Sumatra, Kalimantan, Sulawesi, Ambon, Buru, Timor, Papua dan Jawa,
mendapat julukan "Puspa Pesona". Phalaenopsis lain yang merupakan bahan induk
silangan berpotensi yaitu Phalaenopsis cornucervi dikenal sebagai anggrek bulan
loreng merupakan sumber genotip anggrek hibrida bercorak loreng (Djaafarer 2002).
Semua tanaman Phalaenopsis memiliki batang yang pendek dan merupakan
tanaman monopodial. Berbeda dengan anggrek monopodial berbatang panjang
(seperti Arachnis, Renathera), batang anggrek Phalaenopsis dapat dikatakan hampir
tidak ada. Jarak antara daun sangat pendek, dan apabila terjadi pemanjangan
internode biasanya merupakan pengecualian pertumbuhan. Ciri batang yang pendek
menandakan bahwa tanaman ini membutuhkan intensitas cahaya matahari cukup
rendah. Siklus hidup Phalaenopsis secara alami terjadi selama 2-3 tahun dari fase
vegetative hingga fase reproduktif (Christenson 2001).
Phalaenopsis memiliki tiga jenis akar: akar udara, akar epifit dan akar
substrat. Akar udara silindrik dan tidak bercabang, besar, memanjang pada ujungnya
berpigmen ungu atau hijau seperti pigmentasi pada daun. Pigmentasi ini
kemungkinan merupakan pola pewarisan alel tunggal. Akar epifit, atau akar yang
berpangkal pada batang dan tidak menempel pada substrat atau tidak tertutupi oleh
substrat, bentuknya tipikal pipih dan menyerupai pita. Akar substrat berbentuk
silindrik berdiameter lebih besar dari pada akar udara dan biasanya ujung akarnya
tidak berpigmen. Pada setiap tanaman memiliki satu atau dua jenis akar tersebut
mitosis sehingga jaringan ini cocok digunakan untuk pembentukan plb (protocorm
like bodies) dan berpeluang untuk menginduksi mutasi (Christenson 2001).
Ketebalan daun bervariasi dari spesies yang satu dengan spesies yang lain.
Namun, tekstur dan morfologinya semua hampir sama dalam satu genus
Phalaenopsis. Semua jenis daun ini sukulen dan mengkilap. Secara normal daun
bersifat evergreen, beberapa kadang-kadang menunjukkan variasi pigmentasi. Pada
Phalaenopsis daun kadang-kadang tampak keperakan kaya dengan spot-spot ungu.
Pola pewarnaan daun tampaknya berhubungan erat dengan tanda-tanda khusus untuk
pengenalan spesies. Pada spesies dengan daun yang tidak memiliki ciri, ada atau
tidaknya warna ungu di bagian bawah permukaan daun adalah bervariasi dan
dikontrol oleh satu sistem alel (Christenson 2001).
Tangkai bunga Phalaenopsis umumnya pendek, jumlah bunga sedikit.
Tetapi ada spesies yang tangkai bunganya bercabang sehingga hasil
silangan-silangannya hingga kini menghasilkan hibrid multiflora. Pangkal tangkai bunga
Phalaenopsis biasanya beruas 3-5 ruas dan masing-masing ruas terdapat mata tunas
yang diselubungi pelepah berukuran kecil. Setelah ruas-ruas tersebut, terdapat
kuntum-kuntum bunga. Kadang-kadang pada ruas tangkai bunga muncul keiki atau
tunas anakan (Djaafarer 2002).
Selama ini masih banyak orang yang beranggapan bahwa anggrek
Phalaenopsis spesies hanya dapat tumbuh di daerah dataran tinggi. Padahal
sebenarnya anggrek dapat tumbuh di sembarang ketinggian, dataran rendah,
menengah sampai tinggi, selama kondisi ekologinya optimum untuk pertumbuhan
dan perkembangan tanaman, Phalaenopsis merupakan jenis anggrek epifit atau litofit.
Di alam anggrek ini epifit pada batang kayu atau dinding bebatuan dengan akar
menempel kuat. Di alam, Phalaenopsis hidup di tiga macam habitat antara lain
daerah kering, daerah dingin dan dan daerah yang memiliki kelembaban udara tinggi
secara terus-menerus. Di daerah yang mempunyai kondisi ekstrim akan memacu
sistem adaptasi tanaman terhadap lingkungan tersebut. Salah satu sistim adaptasi
ialah adaptasi terhadap kondisi xerofitik dengan cara meningkatkan kesukulenannya.
Hal ini sering dijumpai pada Phalaenopsis cornucervi dan kerabatnya yang memiliki
daun lebih tebal. Beberapa spesies seperti Phalaenopsis gigantea hidup di daerah
berkanopi lebih tinggi dan agak lebih terbuka. Jenis seperti ini, memiliki daun yang
amat keras untuk menghindari pengeringan dan lebih toleran terhadap level cahaya
Phalaenopsis mudah ditanam di bawah kondisi buatan selama masih sesuai
dengan ekologi aslinya. Beberapa unsur ekologi yang berperan dalam pertumbuhan
dan perkembangan Phalaenopsis adalah, kelembaban, intensitas cahaya, suhu, air dan
sirkulasi uadara. Suhu yang sesuai untuk pertumbuhan Phalaenopsis berkisar antara
26-30 °C dengan suhu ideal 28 °C. Pada siang hari merupakan saat kritis bagi
Phalaenopsis karena pada saat itu membutuhkan lebih banyak air untuk mengurangi
risiko dehidrasi.
Gambar 3 Morfologi tanaman Phalaenopsis sp (a) akar substrat (b) daun (c) calon bunga.
Semua spesies Phalaenopsis memiliki 38 kromosom (2n = 2x=38) kecuali
Phalaenopsis buyssoniana yang menjadi tetraploid secara alami memiliki kromosom
2n=4x=76 (Christenson 2001; Kao et al. 2007). Kromosom di dalam satu genus ini
dapat berbeda ukuran maupun morfologi. Pada seksi Phalaenopsis memiliki
kromosom terpendek dalam satu genus ini. Anggrek populer seperti Phalaenopsis spp
memiliki ukuran genome yang besar yaitu berkisar antara 1 x 109 hingga 6 x 109 bp
(Lin et al. 2001) dan beberapa kultivar komersial ini multiploid. Seperti genom
tanaman lainnya, genom Phalaenopsis terdiri atas genom inti, chloroplas (cpDNA)
dan mitokondria (mtDNA). Pada Phalaenopsis aphrodite Reichbf diketahui memiliki
b
c
genom chloroplas yang merupakan molekul sirkuler berukuran 148.964 bp (Chang et
al. 2006).
Pemuliaan Tanaman Phalaenopsis
Pemuliaan anggrek terutama Phalaenopsis dapat dilakukan secara
persilangan konvensional, mutasi dan transformasi gen. Persilangan konvensional
mencakup persilangan intraspesies, interspesies maupun intergenerik antara genus
berbeda misalnya persilangan antara Vanda dan Phalaenopsis yang disebut
Vandopsis, Aranthera dan Vanda menjadi Aranda, Ascocentrum dan Vanda menjadi
Ascosenda dan sebagainya (Tanaka & Kamemoto 1961). Metode pemuliaan anggrek
yang diperbanyak secara vegetatif, antara lain dapat dilakukan melalui teknik
rekayasa genetik (Semiarti et al. 2007) dan teknik induksi keragaman somaklonal
atau mutasi induksi.
Induksi mutasi telah digunakan dalam peningkatan kemampuan genetik pada
beberapa tanaman, tetapi jumlah tanaman hasil induksi mutasi masih lebih kecil
dibandingkan dengan hasil pemuliaan melalui hibridisasi dan seleksi. Aspek yang
paling menjanjikan dari penerapan induksi mutasi pada tanaman yang diperbanyak
secara vegetatif adalah adanya kemungkinan untuk memperbaiki sedikit karakter,
tanpa mengubah secara mendasar susunan gen lain yang telah baik. Pada anggrek
Phalaenopsis, metode pemuliaan vegetatif seperti transformasi genetik, ataupun
melalui induksi variasi somaklonal belum banyak didapatkan, khususnya di
Indonesia. Pada saat ini di Indonedia, belum ditemukan varitas atau kultivar
Phalaenopsis yang merupakan hasil dari pengembangan metode transformasi ataupun
variasi somaklonal.
Pemuliaan Melalui Persilangan Konvensional
Persilangan anggrek telah dilakukan orang sejak tahun 1849 hingga saat ini
telah didaftarkan ribuan jenis baru termasuk di antaranya multigenerik, intragenerik
dan intergenerik. Dalam daftar persilangan intergenerik sendiri diketahui bahwa ada
589 macam yang bersifat intergenerik, 62 intergenerik di antaranya telah dihasilkan
disajikan dalam tabel 1. Hasil persilangan intergenerik antara Phalaenopsis dengan
Renanthera disebut Renanthopsis memiliki penampilan tanaman berbatang pendek,
berdaun dan berbunga menyerupai bunga Renanthera (Gambar 4a). Demikian juga
hasil persilangan intergenerik Phalaenopsis dan Vandopsis menghasilkan turunan
berbunga tidak menyerupai Phalaenopsis maupun Vandopsis (Gambar 4b).
Sumber : (a) Florzinha de Estufa (2009) dan (b) Pineland Orchid Society (2006)
Gambar 4. Anggrek hasil silangan intergenerik (a) Renanthopsis Mildred Jameson, (b) Phalaendopsis Arizona Star’Jim Turnbow’
Tabel 1 Beberapa nama intergenerik yang melibatkan tetua persilangan Phalaenopsis dan Vanda.
No Nama
Intergenerik Tetua asal intergenerik
1 Bogardara Bgd Ascocentrum xPhalaenopsisxVanda x Vandopsis
2 Bokchoonara Bkch Arachnis x Ascocentrum xPhalaenopsis xVanda
3 Deveneauxara Dvra Ascocentrum x Phalaenopsis xVanda
4 Himoniara Hmra Ascocentrum xPhalaenopsisx Rhynchosyllus xVanda
5 Aeridopsis Aerps Aerides xPhalaenopsis
6 Arachnopsis Arnps Arachnis xPhalaenopsis
7 Asconopsis Ascps Ascocentrumx Phalaenopsis
8 Doriotaenopsis Dtps Doritis x Phalaenopsis
9 Moirara Moir Phalaenopsisx Renanthera xVanda
10 Lutherara Luth Phalaenopsisx Renanthera x Rhynchostilis
11 Phalandopsis Phdps PhalaenopsisxVandopsis
12 Renanthopsis Renps Phalaenopsisx Renanthera
13 Rhynchonopsis Rhynps Pha laenopsis x Rhynchostilis
14 Vandopsis Vdps Phalaenopsis xVanda
15 Yapara Yapr Phalaenopsis x Rhynchostilis xVanda
Sumber : Royal Horticultural Society (2006).
Persilangan dari kelompok Sarcanthine termasuk di antaranya vandaceous
telah dikembangkan oleh Thailand, Singapura, Malaysia dan Hawaii pada akhir
a
b
dasawarsa. Poliploid pada vandaceous cenderung memberikan pengaruh pada bunga
yang menjadi lebih besar, sepal dan petal lebih lebar. Kelemahan dan sekaligus
keuntungan bagi produsen ialah karena pada vandaceous tersebut memiliki
keabnormalan meiosis dan fertilitasnya rendah dengan terjadinya afinitas kromosom
pada saat meiosis (Tanaka & Kamemoto. 1961).
Pemuliaan Melalui Induksi Keragaman Somaklonal
Keragaman somaklonal adalah keragaman genetik yang diinduksi melalui
kultur sel somatik, kultur sel tunggal, atau kultur protoplas. Keragaman somaklonal
telah sangat dikenal pemanfaatannya di dunia industri florikulturauntuk menginduksi
varietas unggul baru. Berbagai kondisi selama proses kultur mempengaruhi fenotipik
hasil. Penurunan dan kehilangan total kemampuan regenerasi merupakan fenomena
umum selama kultur sel, karena pembentukan sel dengan DNA abnormal pada saat
pertumbuhan sel yang tak terorganisir. Peningkatan kejadian keragaman somaklonal
juga terjadi ketika kultur somatik embriogenik dilakukan dalam jangka waktu lama di
dalam kultur in vitro atau akibat subkultur yang terus menerus menggunakan
tambahan zat pengatur tumbuh (Kaeppler et al. 2000).
Perubahan genetik yang berhubungan dengan keragaman somaklonal adalah
mutasi titik, perubahan karyotipe (jumlah kromosom dan struktur), perubahan jumlah
kopi, pindah silang sel somatik, amplifikasi DNA dan delesi (Rego & deFaria 2001).
Timbulnya keragaman genetik selama proses in vitro dipengaruhi juga oleh faktor
internal maupun eksternal. Faktor internal terdiri atas pengaruh genotip, sumber
eksplan yang digunakan dan tingkat ploidi (Karp 2004). Semakin rendah tingkat
ploidi, semakin stabil suatu genotip tanamn selama proses kultur in vitro. Sedangkan
faktor eksternal terdiri atas pengaruh komposisi media buatan, zat pengatur tumbuh
serta proses regenerasi dari kalus menjadi tanaman yang membutuhkan beberapa kali
subkultur (Akin-Idowu et al. 2009).
Penggunaan teknik keragaman somaklonal dalam pemuliaan meliputi
beberapa tahap (1) induksi kalus atau kultur suspensi sel (2) regenerasi dari sejumlah
besar tanaman dari kultur (3) skrining untuk perlakuan yang diinginkan pada tanaman
yang diregenerasikan (4) pengujian varian terseleksi (5) perbanyakan varian stabil
atau menggunakannya pada program pemuliaan (Jain et al. 1997).
Pada tanaman hias, keragaman yang ditimbulkan meliputi morfologi
Seneviratne & Wijesundara 2007)). Selama ini warna bunga merupakan target utama
dalam pemuliaan konvensional. Pigmen utama yang terlibat dalam pewarnaan bunga
ialah flavanoid yang merupakan pembentuk warna kuning, merah, ungu dan biru.
sedangkan carotenoid menyebabkan terbentuknya warna kuning hingga orange.
Pigmen warna sangat kuat tergantung pada pH dalam sel (Tsuda et al. 2004). Selain
karakter kualitatif seperti warna, sifat kuantitatif yang dapat berubah karena teknik
keragaman somaklonal pada tanaman hias antara lain perubahan durasi vase-life,
jumlah bunga, kerajinan berbunga.
Keragaman somaklonal dapat diinduksi untuk memperoleh mutan-mutan yang
diharapkan membawa sifat yang menguntungkan tanaman, dan telah dilakukan oleh
beberapa orang peneliti. Induksi mutasi dapat dilakukan dengan pemberian mutagen.
Mutagen terdiri atas dua tipe yaitu fisik dan kimia (Kodym & Afza 2003). Mutagen
tersebut bervariasi dalam spektrum penyebab mutasi. Induksi secara fisik yang dapat
digunakan antara lain iradiasi gelombang elektromagnetik dengan sinar ultraviolet
(UV), sinar-x (X), neutron dan sinar gamma (Co60) (Kovacs & Karesztes 2002).
Secara kimiawi dapat digunakan senyawa kimia penyebab metilasi, antara lain ENU,
EI, IPMS, EMS (etilmetan sulfonat), MMS (metilmetan sulfonat), dan colchicin
(Konstantinov & Driníc 2007).
Penggunaan induksi mutasi tampaknya merupakan salah satu alternatif
terbaik bagi program pemuliaan tanaman membiak vegetatif. Melalui perbanyakan
vegetatif, individu mutan hasil pemuliaan mutasi dapat secara langsung membentuk
klon komersial. Database FAO/IAEA menyatakan bahwa dari 552 mutan yang
dilepas di antara tanaman yang diperbanyak secara vegetatif, sebagian besar adalah
tanaman hias dan beberapa tanaman buah, termasuk Chrysanthemum, Dahlia,
Bougainvillea, Rosa, Begonia, Carnation, dan Azalea (Ahloowalia & Maluszynski
2001). Efek dari mutasi pada tanaman hias dapat terlihat secara jelas dengan kasat
mata. Seleksi untuk perubahan warna bunga, bentuk dan ukuran sangat mudah
dilakukan, dan hampir seluruh mutan yang dijumpai bernilai ekonomis tinggi.
Berdasarkan efek yang ditimbulkan tersebut, penggunaan teknik mutasi menjadi
sarana utama untuk pemuliaan tanaman hias (Rego & deFaria 2001).
Jumlah pasti kultivar-kultivar tanaman hias hasil mutasi induksi yang telah
dilepas dan berapa besar nilai ekonomisnya sulit untuk diprediksi. Perusahaan
komersial seringkali tidak melaporkan asal dari kultivar-kultivar mutan tanaman hias
Pada berbagai negara berkembang, kultivar-kultivar mutan yang dilepas dan didaftar,
dimanfaatkan oleh pihak lain, karena kultivar-kultivar tersebut dapat diperbanyak
secara bebas tanpa izin dari pemulia. Sebagai contoh, National Botanic Research
Institute (NBRI), Lucknow, India, selama 17 tahun terakhir telah melepas 70 kultivar
hasil induksi mutasi tanaman hias antara lain, Chrysanthemum, Mawar, Bougenvillia,
Lantana, Hibiscus, dan Portulaca (Ahloowalia et al. 2004). Demikian pula di negara
Thailand, Department of Applied Radiation and Isotopes, Kasetsart University, telah
melepas 6 mutan kultivar bunga Kana, 15 Chrysanthemum dan 2 mutan Portulaca.
Masalah-masalah yang dihadapi dalam pengembangan tanaman hias di India dan
Thailand, tampaknya juga dihadapi di Indonesia. Pelepasan varietas hasil induksi
mutasi banyak yang belum tercatat di kantor perlindungan varitas tanaman (PVT),
demikian pula kelanjutan penyebarannya.
Induksi Mutasi Menggunakan Iradiasi Sinar Gamma
Penggunaan sinar gamma untuk menginduksi keragaman pada tanaman hias
telah digunakan oleh banyak peneliti antara lain pada tanaman lotus (Arunyanart &
Soontronyatara 2002), dan chrysanthemum (Mandal et al. 2000). Pengujian berbagai
dosis iradiasi dilakukan untuk mengetahui radiosensitivitas suatu jaringan perlu
dilakukan untuk mengetahui seberapa besar sensitivitas jaringan tanaman yang diuji
terhadap dosis iradiasi yang diberikan. Penentuan dosis iradiasi yang tepat perlu
dilakukan untuk mendapatkan varian yang lebih banyak.
Pada beberapa studi mutagenesis, faktor kunci di dalam melakukan iradiasi
ialah dosis, yang merupakan jumlah energi iradiasi yang diabsorbsi oleh materi. Unit
pengukuran dosis iradiasi ialah Gray (Gy). 1 Gy setara dengan absorbsi 1 Joule
energi per kilogram produk yang diradiasi, yang setara dengan 100 rad. Dosis iradiasi
dibagi dalam tiga cakupan kategori: tinggi (> 10 kGy), medium (1-10 kGy), dan
rendah (< 1 kGy). Dosis yang tinggi digunakan untuk sterilisasi produk makanan, dan
untuk biji sebesar 60-700 Gy. Pada kultur in vitro kalus digunakan dosis 2-5 Gy dan
apabila dosis ditingkatkan menjadi 15-20 Gy menyebabkan nekrosis dan kapasitas
regenerasinya menjadi hilang. Pada tanaman kentang yang diperbanyak secara mikro,
dosis optimal untuk bertahan hidup ialah 20 Gy (Ahloowalia & Maluszynski 2001).
Secara visual tingkat sensitivitas ini dapat diamati dari respon yang
diberikan tanaman, baik dari morfologi tanaman, sterilitas, maupun dosis letal 50
diradiasi (Omar et al. 2008). Dari banyak penelitian mutasi induksi, telah diketahui
bahwa umumnya mutasi yang diinginkan terletak pada kisaran LD50 atau sedikit di
bawahnya. Pada kasus tertentu, misalnya pada perlakuan kalus digunakan dosis yang
besarnya sekitar LD30.
Faktor yang mempengaruhi tingkat sensitivitas tanaman terhadap iradiasi,
secara fisik bentuk morfologi tanaman, kesukulenan material dapat mempengaruhi
ketahanan fisik sel saat menerima iradiasi sinar gamma. Hal ini berhubungan dengan
faktor biologis lainnya seperti faktor genetika, dan juga faktor lingkungan seperti
oksigen, kadar air, penyimpanan pasca iradiasi dan suhu (Ashraf et al. 2003).
Pada plantlet lotus (Nelumbo nucifera Gaertn.), mutasi yang diinduksi
dengan dosis 20 Gy, menghasilkan laju pertahanan hidup sebesar 50%. Dosis 10 dan
20 Gy menghasilkan pemanjangan akar sekunder dan pembentukan sejumlah akar
adventif. Mutan-mutan ini juga terhambat pertumbuhan pucuk dan perkembangan
rhizoma. Sebagian besar tanaman yang diberi perlaknan 20-50 Gy memperlihatkan
karakteristik yang abnormal, termasuk vitrifikasi, klorosis, dan penampilan petiole
dan penghambatan pertumbuhan tunas lateral, akar-akar sekunder dan rhizoma.
Seluruh tanaman yang diberi perlakuan 60 Gy mati dalam 4 minggu (Arunyanart &
Soontronyatara 2002). Hasil penelitian Mandal et al. (2000) pada tanaman Krisan
(Chrysanthemum morifolium cv. Maghi), iradiasi dapat diberikan pada nodus batang,
internodus batang, pucuk, dan bunga (ray floret) dengan dosis 15, 20 dan 25 Gy.
Perlakuan sinar gamma 2 krad (20 Gy) menimbulkan daun-daun klorofil variegata,
2.5 krad (25 Gy) bunga kimera (mutan putih, wild-type ungu tua/mauve). Mutan solid
dengan daun variegata klorofil, dihasilkan dari eksplan nodus batang. Pada dosis
tersebut tidak dilaporkan adanya letalitas.
Efek iradiasi terhadap perubahan warna bunga tanaman tergantung pada
warna tetua sumber eksplan. Warna tetua biru yang mengandung antosianin,
malvidin, peonidin, petunidin dan cyanidin pada bunga torenia yang diradiasi
memberikan tambahan pelargonium dan delphinidin. Akibat ketidakadaan
malvinidin, menyebabkan bunga mutan menjadi biru pucat. Warna pink
mengandung peonidin, cyanidin dan pelargonium dan tidak mengandung malvinidin
dan petunidin (Miyazaki et al. 2006).
Induksi Mutasi Menggunakan EMS
Penggunaan mutagen kimia dinilai lebih efektif untuk menimbulkan mutasi
mutagen yang cukup berguna dan handal antara lain etilmetanasulfonat (EMS),
dietilsulfat (DES), etilenimin (El), N-nitro-N-etil urea (NEU) (Konstantinov &
Driníc 2007). Mutagen kimia khususnya EMS lebih mudah tersedia dan rasio
mutasionalnya terhadap modifikasi yang tidak diinginkan lebih baik dibandingkan
dengan iradiasi (Nasir 2002).
Sebagai sarana pemuliaan praktis, kelompok mutagen kimia yang paling
menarik ialah agensia yang membentuk alkilasi. Kelompok ini memiliki satu atau
lebih kelompok alkil reaktif yang dapat ditransfer ke molekul lain pada posisi di
mana kepadatannya tinggi. Agensia yang mengalkilasi dapat bereaksi dengan DNA.
Pada awalnya terbentuk triester yang tidak stabil karena fosfat triester dihidrolisa
antara gula dan fosfat yang menghasilkan pecahnya tulang punggung DNA. Alkilasi
dari nitrogen basa terjadi dan bereaksi dengan guanine pada posisi N-7. Kejadian ini
biasanya diikuti oleh adenine pada posisi N-3 dan citosin pada posisi N-1 (Kodym &
Afza 2003). Alkilasi guanine membentuk O6-ethyl guanine yang dapat berpasangan
dengan timin tetapi tidak dengan citosin (Kim et al. 2006). EMS menginduksi C ke T
menghasilkan C/G ke T/A yang bersifat substitusi, sedang methyl methansulfonate
menghasilkan transversi T/A ke G/C dan transisi A/T ke G/C (1,3,4). Pada frequensi
rendah EMS membentuk G/C ke CG atau transversi G/C ke T/A oleh hidrolisa
7-ethylguanin atau transisi A/T ke G/C oleh 3-ethyladenin (Kim et al. 2006).
Mutagen kimia dapat diintroduksi ke dalam jaringan tanaman dan bahkan sel
dapat menyebabkan jumlah mutasi yang lebih tinggi dibandingkan dengan cara lain
tetapi hasil yang memuaskan bergantung pada konsentrasi bahan kimia, lama masa
perlakuan, suhu, pH larutan mutagenik dan kadar air bahan yang diberi perlakuan
(Kovacs & Karesztes 2002). Penggunaan EMS telah banyak digunakan pada berbagai
tanaman, selain pada tanaman hias seperti krisan berwarna pink tua dengan perlakuan
EMS 0.77% selama 45 menit yang menghasilkan mutan 5.2% yan