GLUKOMANNAN DARI ILES-ILES
(
Amorphophalus oncophylus
)
SEBAGAI PENGIKAT AFLATOKSIN PADA
PAKAN AYAM BROILER
AGUS SUSANTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan dengan sebenar-benarnya bahwa disertasi berjudul Glukomannan dari Iles-Iles (Amorphophalus oncophylus) Sebagai Pengikat Aflatoksin pada Pakan Ayam Broiler adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutib dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
RINGKASAN
AGUS SUSANTO. Glukomannan dari Iles-Iles (Amorphophalus oncophylus)
sebagai Pengikat Aflatoksin pada Pakan Ayam Broiler. Dibimbing oleh ERIKA B. LACONI, DEWI APRI ASTUTI dan SJAMSUL BAHRI.
Aflatoksin dapat menyebabkan gangguan kesehatan pada ternak dan manusia, sebab aflatoksin bersifat karsinogenik kelas I. Pengaruh aflatoksin antara lain penurunan nafsu makan, pertumbuhan, performen ternak dan penekanan sistem kekebalan tubuh. Glukomannan menunjukan kemampuan mengikat aflatoksin. Tujuan dari penelitian ini adalah 1) mengekstraksi glukomannan dari umbi iles-iles (Amorphophallus oncophyllus) dan dilanjutkan pengujian
fisika-kimiawi pada glukomannan yeast product (GYP) dan glukomannan dari proses ekstrak iles-iles (EI), 2) menguji kemampuan EI sebagai pengikat aflatoksin dan teori pengikatan kimianya 3) melakukan kajian performa, gambaran hematologi, berat organ visceral dan pengamatan makroskopik dan mikroskopik hati dan 4) menentukan dosis EI untuk digunakan sebagai pengikat aflatoksin.
Metode pengujian fisika terdiri dari warna, tekstur, ukuran partikel dan gross energi. Pengujian kimia terdiri dari uji proksimat, glukosa, mannosa, NDF (Neutral Detergen Fiber), ADF (Acid Detergen Fiber), pH, Uji NIR (Near Infra Red) dan FTIR (Fourier Transform Infra Red). Uji in vitro menggunakan cairan gastointestinal 3% dalam larutan ringer dan aflatoksin (Biopure®) dengan parameter yang diukur adalah persentase pengikatan aflatoksin. Uji in vivo
menggunakan ayam broiler yang dipelihara selama 35 hari dengan menggunakan rancangan acak lengkap. Pengamatan pada uji in vivo terdiri dari performa (berat badan akhir, konsumsi dan efisiensi pakan), hematologi, berat organ dalam (hati, jantung, limpa dan ginjal) dan pengamatan makroskopik dan mikroskopik hati.
Hasil uji Fisika menunjukan bahwa tekstur dan gross energi GYP dan EI tidak berbeda nyata (p<0.05.). Hasil uji proksimat menujukan bahwa kadar air, abu, kadar protein kasar, lemak kasar dan serat kasar pada GYP berbeda nyata (p<0.05) dengan EI. Kadar air, lemak kasar, bahan ekstrak tanpa nitrogen dan karbohidrat dalam EI lebih tinggi daripada GYP tetapi kadar abu, protein kasar dan mannan dalam EI lebih rendah dibanding GYP.
Kandungan glukomannan pada GYP dan EI dibuktikan berdasarkan pada uji kimiawi dan spectrofotometer-Fourier Transform Infra- Red (FTIR). Secara uji kimiawi GYP dan EI mengandung mannosa dan glukosa dengan perbandingan 1:1.2 dan 1:1.8 secara berturut-turut. Berdasarkan uji FTIR, GYP dan EI memiliki bilangan gelombang yang sama yang menunjukan adanya polisakarida (1000 – 700 Cm-1) and ikatan β-1, 4 glucosidic and β-1,4 mannosidic (1300 – 1000 Cm-1). Perbandingan spektrogram antara GYP dan EI menggunakan Near Infra Red Reflectance Spectroscopy (NIRS) menunjukan bahwa GYP dan EI memiliki spektrogram yang lebih mirip jika dibandingkan dengan spektrogram karbon aktif. Spektrogram dari FTIR, GYP dan EI memiliki gugus aktif yang sama yakni O ̶ H, C ̶ H2, C ̶ H, C ̶ H3, C ̶ O ̶ C dan ≡C ̶ H, tetapi ada gugus fungsional yang hanya dimiliki GYP yakni C=O, sedangkan yang hanya dimiliki EI yakni gugus fungsional N ̶ H (bengkok).
GYP berkurangnya bilangan gelombang untuk gugus fungsional C ̶ H (di luar bidang), sedangkan dalam EI tidak tampak N ̶ H (regang) dan ditemukan gugus fungsional baru yaitu C≡C dan C=O. Bilangan gelombang yang diserap OH setelah berikatan dengan aflatoksin terjadi penurunan bilangan gelombang (frekuensi), hal ini menunjukan terjadinya ikatan hidrogen. Berdasarkan uji spektrogram dapat disimpulkan bahwa GYP dan EI mampu mengikat aflatoksin dengan ikatan hidrogen.
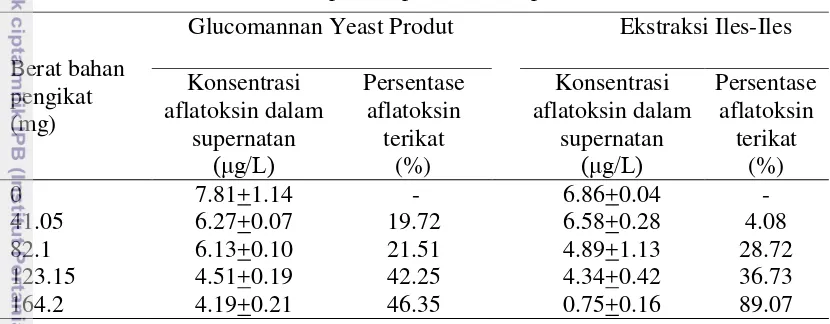
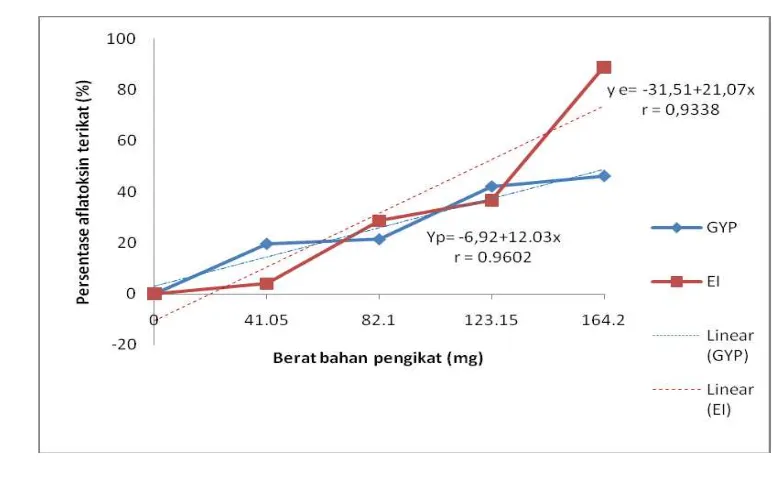
Uji in vitro menggunakan aflatoksin, bahan pengikat (GYP dan EI), cairan gastro intestinum ayam broiler 3 % dalam larutan ringer. Berat binder adalah 41.05; 82.1; 123.15 dan 164.2 mg dan berat aflatoksin 0.1642 µg di setiap tabung. Hasil penelitian menunjukan persentase pengikatan aflatoksin meningkat sesuai dengan bertambahnya berat bahan pengikat baik GYP maupun EI. Persentase daya ikat aflatoksin GYP adalah 20.08; 21.31; 41.20; 46.34% dan EI adalah 4; 38.12; 40.16 dan 97.61% secara berturut turut. Persamaan regresi GYP adalah Yp = -6.92 + 12.03x, sedangkan untuk EI adalah Ye = -31.53 + 21.07x.
Uji in vivo yang dilakukan pada ayam broiler berjumlah 63 ekor yang dibagi sama menjadi 9 kelompok perlakuan yakni: pemberian dengan pakan basal (kelompok 1), pemberian pakan yang terkontaminasi aflatoksin 50 μg/kg (kelompok 2) dan pemberian pakan yang terkontaminasi 2 mg/kg (Kelompok 3). Pemberian pakan yang terkontaminasi aflatoksin 50 μg/kg dan ditambah GYP 1 g/kg, EI 1 g/kg dan EI 2 g/kg secara berturut-turut pada kelompok 4, 5 dan 6. Pemberian pakan yang terkontaminasi aflatoksin 2 mg/kg dan ditambah GYP 1 g/kg, EI 1 g/kg dan EI 2 g/kg secara berturut-turut pada kelompok 7, 8 dan 9.
Pengujian plasma darah meliputi penghitungan packed cell volume (PCV), Hemoglobin (Hb) dan Mean Corpusculer Hemoglobin Cell (MCHC), diffrensial sel darah putih dan glukosa sedangkan serum digunakan untuk pengujian kadar titer antibodi terhadap ND. Kandungan Hemoglobin, nilai MCHC dan kadar gula darah tidak berbeda nyata dari 9 kelompok perlakuan. Jumlah sel darah putih neutrofil, limfosit dan eosinofil dari 9 perlakuan tidak berbeda nyata (p<0,05). Titer antibodi terhadap ND paling tinggi ditemukan pada kelompok yang mendapatkan pakan yang tidak terkontaminasi aflatoksin dan paling rendah pada kelompok yang mendapat perlakuan pada pakannya ditambah aflatoksin 2 mg/kg.
Kesimpulan dari penelitian ini adalah aflatoksin menyebabkan penurunan efisiensi pakan, penurunan nilai Packed Cell Volume dan titer antibodi terhadap New Castle Disease, perubahan warna hati dan mengalami peningkatan berat relatif organ hati. Pengujian histopatologi menunjukan aflatoksin menyebabkan organ hati pendarahan dan degenerasi lemak. Glucomannan Yeast Product dan ekstrak iles-iles mampu mengurangi pengaruh negatif dari aflatoksin. Dosis ekstrak iles-ilesI 1 g/kg pakan mampu melindungi ayam dari pengaruh negatif aflatoksin cemaran aflatoksin 50 μg/kg dan 2 mg/kg yaitu penurunan berat akhir ayam hidup, penurunan jumlah konsumsi pakan, penurunan efisiensi pakan, anemia, peningkatan berat organ hati, perubahan makroskopis dan mikroskopis dan penurunan titer antibodi terhadap New Catle Diseases pada cemaran aflatoxin 50 μg/kg, tetapi belum mampu meningkatkan titer antibodi terhadap New Castle Diseases pada cemaran aflatoksin konsentrasi 2 mg/kg.
SUMMARY
AGUS SUSANTO, Glucomannan from Iles-Iles (Amorphophalus oncophylus) as Aflatoxin Binder on Broiler Ration. Supervised by ERIKA B. LACONI, DEWI APRI ASTUTI and SJAMSUL BAHRI.
Aflatoxin caused health disorders of animal and human, because aflatoxin was carcinogenic level I. Adverse effects from consumption of feeds containing aflatoxin include depressed appetite, reduced growth rate, decreased performance, reduced reproductive function and suppressed immune function. Glucomannan are shown to have binding potential for aflatoxin. The study has four main objectives that include the following: (1) to extract glucomannan from Amorphophallus oncophyllus and to analyze physic and chemical on glucomannan Yeast Product (GYP) and glucomannan product of A. oncophyllus extraction (GPE), (2) to test ability of binding aflatoxin (in vitro) and to determine theory of chemical bonding
and 3) to test in vivo GYP and GPE with parameter performance, hematological, weight of visceral organ, microscopic and macroscopic of hepar and 4) to determinate dosage GPE for binding aflatoxin in broiler.
Physic testings comprise of colour, texture, size of particel and gross energy. Chemical analysis consist of proximate, glucose, mannose, NDF (Neutral Detergen Fiber), ADF (Acid Detergen Fiber), pH, NIR (Near Infra Red) and FTIR (Fourier Transform Infra Red). In vitro testing used broiler gastro-intestinum fluid 3% in ringer lactat and aflatoxin (Biopure®). In vivo testing were applied on broiler chickens which live for 35 days by completely random design. Observation methode in the in vivo testing consist of performance ( weight of life bird, consumtion and feed efficiency), hematological, macroscopic of hepar, weight of visceral organ (hepar, cardiac, spleen and kidney) and microscopic of hepar.
The Results of physic testing showed that texture and gross energy GPE were not significant different (p<0.05) with GYP. Result of chemical analysis showed that moisture, ash, crude protein and crude lipid GYP and GPE were significant different (p<0.05), but crude fiber was not difference. Moisture, crude lipid, nitrogen free extracts, carbohidrate and pH in GPE were higher than GYP but ash, crude protein and mannan in GPE were lower than GYP.
Containing glucomannan in GPE and GYP were proven by chemical analysis and spectroscopy testing. Chemically, GPE and GYP were contained mannosa and glucose with ratio 1:1.8 and 1:1.2 respectively. Spectroscopically, GPE and GYP have similar wavenumber especially polysacharide (1000 – 700 Cm-1) and β-1, 4 glucosidic and β-1,4 mannosidic binding (1300 – 1000 Cm-1).
Study spectroscopy used Near Infra Red Reflectance Spectroscopy (NIRS) and Fourier Transform Infra Red (FTIR) Spectroscopy. Spectrogram of NIRS in GPE were similar with GYP but were different of activated carbon. Based on Spectrogram of FTIR, the GYP and GPE showed have similar functional groups including O ̶ H, C ̶ H2, C ̶ H, C ̶ H3, C ̶ O ̶ C dan C ̶ H. Funtional group C=O was only had by GYP and N ̶ H (bend) was only had by GPE.
wavenumber for functional group C ̶ H (out of plane bend) and GPE disappeared N ̶ H (bend) and appeared C≡C dan C=O. There is decreasing wavenumber which is absorbed by OH between before and after reacted aflatoxin. It was concluded that the changing of the functional groups and decreasing wavenumber (frequency) showed there is bonding glucomannan-aflatoxin with Hidrogen bonding.
In vitro testing GYP and GPE can bind to aflatoxin. Weight of binders were 41.05; 82.1; 123.15 dan 164.2 mg and weight of aflatoxin 0,1642 µg each tube. The results of study showed that percentage of aflatoxin binding increase while glucomannan from yeast product and resulted from A. oncophylus
extraction increased too. Percentage of aflatoxin binding with binder of both glucomannan yeast product was 19.72; 21.51; 42.25; 46.35% dan glucomannan from A. oncophyllus extraction was 4.08; 28.72; 36.73 and 89.07% consecutively.
There was significant (p<0.05) positive correlation between weight of binder and percentage of aflatoxin binding (r GYP = 0.9338 and r GPE= 0.9602). In regression modelling, equation linear of GYP is Yp = -6.92 + 12.03x and GPE is Ye = -31.53 + 21.07x
In vivo testing were used a total of 63 one day old broiler chicken. They were assigned to 9 equal groups according to dietary treatment: the control negative chicken (group 1) received basal feed, group 2, received contaminated 50 μg/kg aflatoxin feed and group 3 received contaminated 2 mg/kg aflatoxin feed. Groups 4, 5 and 6 received contaminated 50 μg/kg aflatoxin feed and suplemented GYP 1 g/kg, GPE 1g/kg and GPE 2 g/kg respectively. Groups 7, 8 and 9 received contaminated 2 mg/kg aflatoxin feed and suplemented GYP 1 g/kg, GPE 1g/kg and GPE 2 g/kg respectively.
In Vivo testing, analysis of plasma were packed cell volume (PCV), hemoglobin and mean corpusculer hemoglobin cell (MCHC), concentration of glucose and differencial of leucocyt. Serum were analized antibody titers against ND with haemoglutination inhibition test. At the end experiment, chicken humanely euthanized. Weight of liver, candiac, spleen and kidney were collected. Haemoglobin, MCHC, concentration of glucose, neutrofil, lymphocyt and eosinofil were not different significantly (p<0.05) among 9 experimental groups. Aflatoxin decreased PCV and titer antibody against of ND. GYP and GPE can increased PCV and titer antibody against ND.
As the conclution, aflatoxin caused decreasing efficiency of feed, decreasing of Packed Cell Volume and titer antibody against New Castle Disease, changing of colour of hepar, and increasing weight of liver. The histopathological signs in hepatic of broilers are characterized by hepatic lesions such as, hemorhagic and lipid degeneration. Dosage of glucomannan product of A. oncophyllus extraction 1 g/kg can alleviate detrimental effects of contamination
aflatoxin 50 μg/kg and 2 mg/kg include the following decreasing weight of chicken, decreasing of feed consumption, decreasing efficiency of feed, anemia, increasing weight of liver, changing of liver makroscopis and microscopis and decreasing titer antibody against New Castle disease in aflatoxin 50 μg/kg but it can not increasing titer antibody against New Castle Diseases in contamination of aflatoxin 2 mg/kg.
© Hak Cipta milik IPB, tahun 2014 Hak Cipta dilindungi Undang-Undang
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB.
GLUKOMANNAN DARI ILES-ILES
(
Amorphophalus oncophylus
)
SEBAGAI PENGIKAT AFLATOKSIN PADA
PAKAN AYAM BROILER
AGUS SUSANTO
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Nutrisi dan Pakan
Penguji pada Ujian Tertutup : 1. Dr Ir Ibnu Katsir Amrullah, MS 2. Dr Ir Suryahadi, DEA
Penguji pada Ujian Terbuka : 1. Prof Dr Ir Tun Tedja Irawadi, MS
Judul Disertasi : Glukomannan dari Iles-Iles
(
Amorphophalus oncophylus
)
s
ebagai Pengikat Aflatoksin pada Pakan Ayam BroilerNama : Agus Susanto
NIM : D162090021
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Erika B. Laconi, MS Ketua
Diketahui oleh Ketua Program Studi
Ilmu Nutrisi dan Pakan
Dr Ir Dwierra Evvyernie A.M.S., M Sc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, M Sc Agr
Tanggal Ujian: 15 Juli 2014 Tanggal Lulus:……… Prof Dr Ir Dewi Apri Astuti, MS
Anggota
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN 1 PENDAHULUAN
x x xi
Latar Belakang 1
Permasalahan 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Alur Penelitian 4
2 EKSTRAKSI GLUKOMANNAN DARI ILES-ILES (Amorphophallus
oncophylus) DAN PENGUJIAN FISIKA DAN KIMIA
Abstrak 5
Pendahuluan 6
Metode Penelitian 7
Hasil dan Pembahasan 11
Simpulan 25
3 PENGIKATAN AFLATOKSIN OLEH GLUKOMANNAN YEAST PRODUCT DAN GLUKOMANNAN HASIL EKSTRAKSI ILES-ILES (Uji In Vitro)
Abstrak 27
Pendahuluan 28
Metode Penelitian 29
Hasil dan Pembahasan 31
Simpulan 34
4 PENGIKATAN AFLATOKSIN OLEH GLUKOMANNAN YEAST PRODUCT DAN GLUKOMANNAN HASIL EKSTRAKSI ILES-ILES (Uji In Vivo)
Abstrak 35
Pendahuluan 36
Bahan dan Metode 37
Hasil dan Pembahasan 40
Simpulan 49
5 PEMBAHASAN UMUM 51
6 SIMPULAN UMUM DAN SARAN 55
DAFTAR PUSTAKA 56
DAFTAR RIWAYAT HIDUP 61
DAFTAR TABEL
1 Hasil rendemen ekstraksi umbi Amorpophalus oncophyllus 11
2 Hasil pemeriksaan dan pengujian fisik 12
3 Hasil uji proksimat Glucomannan Yeast Product (GYP) dan
EkstraksiIles-Iles (EI) dalam persen (%)C 13
4 Hasil pengujian karbohidrat dan pH glukomannan yeast
product (GYP) dengan hasil ekstraksi iles-iles (EI) 15
5 Perbedaan gugus aktif antara GYP dengan EI 19
6 Perbedaan gugus fungsional antara GYP dengan
GYP+Aflatoksin 22
7 Perbedaan gugus fungsi antara ekstrak iles-iles dengan ekstrak iles-iles+Aflatoksin
23 8 Konsentrasi aflatoksin pada supernatan dan pesentase
aflatoksin terikat 31
9 Perlakuan penambahan aflatoksin, GYP dan EI pada pakan basal
38 10 Pengaruh pemberian aflatoksin, GYP dan EI terhadap
performen ayam broiler berumur 35 hari
40 11 Pengaruh pemberian aflatoksin pada beberapa parameter darah 42 12 Hasil pengujian titer antibodi terhadap penyakit New Castle
Disease (ND) dan diffrensial leukosit 44
13 Pengaruh pemberian aflatoksin, GYP dan terhadap berat relatif
organ ayam broiler (g/Kg berat hidup) umur 35 hari 46 14 Penilaian pengamatan histopatologi hati pada kontrol dan
perlakuan 48
DAFTAR GAMBAR
1 Proses pengupasan kulit (a), pengirisan umbi (b) dan pengeringan
iles-iles dengan sinar matahari (c) 8
2 Proses pemanasan dengan kompor elektrik (a), pemisahan hasil
ekstraksi (b) dan pengeringan dengan oven (c) 9
3 Hasil mikroskopis glukomannan yeast product (a) dan glukomannan
hasil ekstraksi Iles-Iles (b) 12
4 Komposisi penyusun dinding sel S.cerevisae (Evan dan Dowson, 2007) 15
5 Struktur molekul glukomannan (Sande 2009) 16
6 Spektrum Glukomannan yeast product dengan Near Infra Red 17
7 Spektrum Ekstrak Iles-Iles dengan Near Infra Red 17
8 Spektrum Karbon aktif dengan Near Infra Red 18
10 Gugus fungsi dalam senyawa beberapa jenis aflatoksin 21 11 Spektrum FTIR antara GYP sebelum (biru) dan sesudah (merah)
berikatan dengan aflatoksin 22
12 Spektrum FTIR antara ekstraksi iles-iles sebelum (biru) dengan sesudah
(merah) berikatan dengan aflatoksin 23
13 Teori ikatan glukomannan dengan aflatoksin (diolah dengan program
Chem Draw Ultra 8.0) 25
14 Inkubasi in vitro bahan pengikat dengan aflatoksin 30 15 Persentase pengikatan aflatoksin antara GYP dan EI 32 16 Sistem perkandangan sistem baterai, sumber dari Susanto, 2014 39 17 Pengambilan darah melalui Vena Pektoralis, sumber dari Susanto, 2014 39 18 Feses berwarna merah (a) dan tampilan wajah pucat (b) pada ayam yang
mendapat perlakuan pemberian aflatoksin 2 mg/kg 42
19 Bentuk dan warna hati kelompok tanpa aflatoksin (a); penambahan
aflatoksin 50μg/kg dan penambahan aflatoksin 2 mg/kg 45 20 Histopatologi hati menunjukan pendarahan ( ) dan perlemakan
( ) pada kontrol dan penambahan aflatoksin 50 μg/kg dan 2 mg/kg 48 21 Histopatologi hati pada penambahan aflatoksin 50 μg/kg dan
penambahan GYP 1 g/Kg (a), EI 1 g/Kg (b) dan EI 2 g/Kg (c);
penambahan aflatoksin 2 mg/kg dan penambahan GYP 1 g/Kg (d), EI 1
g/Kg (e) dan EI 2 g/Kg (f) 49
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga Disertasi ini dapat diselesaikan. Tema penelitian ini adalah tentang bahan pengikat aflatoksin, dengan judul Glucomannan dari Iles-Iles (Amorphophallus oncophylus) Sebagai Pengikat Aflatoksin pada Pakan Ayam
Broiler yang dimulai dari bulan Agustus 2012 sampai Pebruari 2014.
Bagian dari disertasi ini telah dipublikasi lewat Journal Internasional yakni International Journal of Poultry Science dengan judul “Efficacy of Glucomannan-Containing Yeast Product and Glucomannan Resulted from Amorphophallus Oncophyllus Extraction in Protecting Broiler Chicken from Aflatoxin” dan Journal nasional terakreditasi DIKTI, Media Peternakan dengan judul “In Vitro Testing to Aflatoxin Binding by Glucomannan Yeast Product and Glucomannan Extract from Amorphophallus oncophyllus” (tahap telaah penyunting ahli).
Terimakasih penulis ucapkan kepada Prof Dr Ir Erika B Laconi, MS, Prof Dr Ir Dewi Apri Astuti, MS dan Prof (R) Dr drh Sjamsul Bahri, MS selaku pembimbing yang telah memberikan bimbingan dan saran. Penulis juga tidak lupa mengucapkan banyak terimakasih kepada Pimpinan dan staf Laboratorium tempat penelitian disertasi ini antara lain: Balai Pengujian Mutu dan Sertifikasi Pakan Bekasi, Biofarmaka Bogor, Uji Material Badan Tenaga Nuklir Nasional Serpong dan Balai Besar Penelitian Veteriner yang telah memberikan fasilitas pengujian untuk menyelesaikan penelitian ini. Ungkapan terimakasih disampaikan pula kepada ayah, ibu, isteri dan anak-anak atas doa dan kasih sayangnya.
Harapan sebagai penulis semoga karya ilmiah ini dapat berguna untuk meningkatkan ketersediaan dan keamanan pakan di Negeri tercinta, Indonesia, khususnya dalam kemandirian produksi pakan imbuhan (feed additive).
1 PENDAHULUAN
Latar Belakang
Pakan ternak memiliki peran penting karena menentukan produktivitas ternak maupun keamanan pangan bagi manusia. Pakan yang berkualitas akan memberikan produk ternak yang berkualitas pula seperti telur, susu, daging dan wool. Sampai saat ini industri pakan ternak masih berbasis corn-soya. Jagung
merupakan bahan baku pakan sebagai sumber energi dan bungkil kedelai sebagai sumber protein. Jagung menjadi sumber energi karena kandungan karbohidrat/pati yang tinggi di dalam jagung (64%). Jagung merupakan salah satu biji-bijian yang mudah terserang jamur penghasil aflatoksin, sehingga mudah terkontaminasi aflatoksin. Selain di jagung, aflatoksin dapat ditemukan pada bahan baku pakan lainnya seperti kacang tanah, bungkil kelapa, biji kapuk, bungkil kedelai, bekatul dan sebagainya.
Senyawa aflatoksin diketahui dapat menimbulkan gangguan hepatotoksik, immunosupresif, koagulopathy dan carsinogenik baik pada hewan maupun manusia. Aflatoksin dapat menekan sistem kekebalan (immunosupresif) pada beberapa hewan, sehingga menyebabkan penurunan ketahanan tubuh dari infeksi, kegagalan vaksinasi, mastitis yang persisten dan sebagainya. Oleh karena itu pengaruh aflatoksin tidak bisa dianggap remeh, karena menimbulkan kerugian atau kerusakan baik pada ternak maupun manusia. Sifat karsinogenik dari aflatoksin telah ditetapkan oleh IARC (International Agency Research on Cancer) pada tahun 1988 bahwa aflatoksin merupakan bahan karsinogenik klas I.
Hewan yang peka terhadap aflatoksin adalah bangsa unggas (aves), mamalia dan ikan. Bangsa unggas yang peka adalah bebek, ayam, kalkun, dan burung puyuh, sedangkan bangsa mamalia adalah babi muda, babi bunting, anjing, kucing, sapi dan domba. Bebek peka terhadap aflatoksin disebabkan di dalam hati bebek memiliki jenis enzym cytocrom P450s lebih banyak dibanding hewan lainnya yakni CYP2A6, CYP1A1, CYP3A4 dan CYP1A2, sehingga hasil metabolit Aflatoksin B1-epoxide 8,9 yang merupakan racun yang bersifat tidak stabil dan reaktif diproduksi lebih banyak.
Di Indonesia batas maksimal kadar aflatoksin, berdasarkan Standar Nasional Indonesia (SNI) pada ransum pakan ayam ras petelur batas maksimal adalah 50 ppb untuk layer starter (anak) dan layer grower (dewasa), 60 ppb pada layer (masa bertelur). Pada ransum ayam ras pedaging/broiler starter batas maksimal 50 ppb, dan 60 ppb pada broiler finisher, pada ransum babi batas maksimalnya 50 ppb, pada pakan puyuh batas maksimalnya 40 ppb, pada pakan itik batas maksimalnya 20 ppb dan pada pakan konsentrat sapi perah dan sapi potong batas maksimalnya 200 ppb.
dan biji-bijian lainnya yang digunakan untuk penggemukan babi dengan berat badan 45 Kg atau lebih batas maksimal aflatoksinnya adalah 200 ppb.
Untuk menekan aflatoksin dengan metode dekontaminasi bahan baku pakan dalam pelaksanaannya kurang praktis, tidak efisien dan membutuhkan biaya yang tinggi. Oleh karena itu metode pengikatan aflatoksin dalam saluran pencernaan, supaya tidak terserap dalam tubuh ternak merupakan metode yang lebih efektif, praktis dan biaya lebih rendah. Bahan pengikat ada yang bisa dikelompokan bahan organik dan anorganik. Bahan pengikat yang dipakai selama ini dan telah diperjual belikan yang termasuk bahan organik adalah glucomannan containing yeast product (Girish dan Devewgoda 2006) dan karbon aktif (Gallo dan Masoero.
2010), sedangkan yang termasuk bahan anorganik adalah hydrated sodium calcium aluminosilicate (Wang et al. 2006), zeolit (Kaki et al. 2012), bentonit
(Nuryono et al. 2012) dan kaolin (Hesham 2004).
Glukomannan merupakan bahan alam dengan struktur kimia berupa heteropolimer dari glukosa dan manosa yang memiliki potensial sebagai pengikat aflatoksin. Selama ini glukomannan yang diproduksi sebagai pengikat adalah glukomannan dari dinding sel jamur Sacchromyces cereviseae dan sudah terbukti mampu mengikat aflatoksin (Girish dan Devewgoda 2006). Glukomannan yang berasal dari tanaman seperti iles-iles (Amorphophalus oncophylus) belum
diujicobakan sebagai pengikat aflatoksin. Tanaman iles-iles merupakan tanaman yang sangat cocok di lingkungan Indonesia dan selama ini hanya dimanfaatkan untuk diekspor dalam bentuk keripik (chips). Dengan ekstraksi menggunakan ethanol diperoleh glukomannan dari iles-iles (EI), walaupun sebenarnya dalam proses ekstraksi, glukomannan diperoleh dari hasil residu proses ekstraksi karena glukomannan tidak terlarut dalam fraksi ethanol. Dengan menggunakan ekstraktor ethanol dapat diperoleh glukomannan 60% dalam bahan kering. Harapan dari penelitian ini adalah glukomannan yang terkandung dalam iles–iles memiliki kemampuan mengikat aflatoksin.
Permasalahan
1. Pakan ternak masih berbasis corn-soya, komposisi bahan bakunya didominasi
oleh bungkil kedelai, jagung dan biji-bijian lainnya, yang mudah terkontaminasi aflatoksin.
2. Data dari survey Balai Pengujian Mutu Pakan Ternak (2006) diperoleh data kandungan pakan yang mengandung aflatoksin diatas batas maksimal SNI yakni di atas 50 ppb terdapat 10%, sedangkan pada jagung yang kadar aflatoksinnya di atas batas maksimum SNI yakni di atas 50 ppb ada 29%. 3. Aflatoksin bagi ternak menimbulkan gangguan pertumbuhan, gangguan
reproduksi, gangguan pencernaan, gangguan sistem kekebalan dan kematian. 4. Terdapat alternatif dalam pengikatan aflatoksin yaitu menggunakan
Tujuan Penelitian
1. Mendapatkan glukomannan hasil ekstraksi dari iles-iles (Amorphophallus oncophylus) dan mengetahui sifat fisika-kimianya.
2. Menguji kemampuan glukomannan hasil ekstraksi iles-iles sebagai pengikat aflatoksin dalam pakan.
3. Menemukan teori pengikatan glukomannan terhadap aflatoksin.
4. Melakukan kajian performa ternak, gambaran hematologi, berat organ visceral dan gambaran histopatologi hati dari ayam yang diberi perlakuan pada pakan ditambah aflatoksin, glukomannan yeast product dan glukomannan hasil ekstraksi iles-iles.
5. Menentukan dosis pengikat yang tepat dalam ransum pakan yang secara efektif mampu melindungi ternak dari serangan aflatoksin
Manfaat Penelitian
1. Ditemukannya bahan alternatif lokal dari herbal yang mampu mengikat aflatoksin pada pakan.
Alur Penelitian
Analisa hasil ekstraksi
a. Fisik b. Kimia
Uji in vitro ELISA
Uji in vivo
a. Pakan dilakukan uji Proksimat dan aflatoksin.
b. Formulasi (basal metabolisme) c. Uji pada broiler selama 35 hari d. Perlakuan: Pemberian aflatoksin
pada 50 ppb dan 2 ppm dan Glukomannan yeast Product (1 gram per Kg) dan Glukomannan hasil ekstraksi iles-iles (1 gram per Kg dan 2 gram per Kg)
Glukomannan dari iles-iles mampu mengikat aflatoksin pada pakan unggas didukung pembuktian baik secara fisik, kimia, in vitro dan invivo
Parameter pengujian:
Fisik: Pemeriksaan, ukuran partikel dan energi bruto.
Kimia: Proksimat, pH, Karbohidrat, NDF, ADF, Glukosa, Manosa, Near Infra Red (NIR), dan Fourier Transform Infra red (FTIR)
Uji spektral pengikatan aflatoksin Analisa Statistik : Deskriptif dan Uji t
Persentase pengikatan aflatoksin:
- Enzyme Linked Immunosorbent Assay (ELISA)
- Analisa Statistik: Deskriptif, korelasi dan regresi
a. Parameter performa: Berat ayam hidup umur 35 hari, konsumsi pakan, efisiensi pakan, gangguan kesehatan dan kematian. b. Parameter hematologi: Hb, PCV,
differencial leucocyt, gula darah dan antibodi terhadap ND.
c. Parameter berat organ dalam: hati, ginjal, jantung dan limpa
d. Gambaran histopatologi: organ hati. e. Analisa Statistik: Uji t, Anova dan Uji
Tukey Ekstraksi glukomannan dari
2 EKSTRAKSI GLUKOMANNAN DARI ILES-ILES
(
AMORPHOPHALLUS ONCOPHYLUS
) DAN
PENGUJIAN FISIKA-KIMIA
ABSTRAK
Tujuan dari penelitian ini untuk membandingkan hasil pengujian fisika dan kimia dari glucomannan yeast product (GYP) dengan glukomannan hasil ekstraksi
A. oncophyllus (EI) dan menemukan teori ikatan glukomannan dengan aflatoksin. Metode analisa fisika meliputi textur, ukuran partikel dan energi bruto, sedangkan analisa kimia terdiri dari uji proksimat, Near Infra Red (NIR) dan Fourier transform Infra Red (FTIR). Hasil uji Fisika menunjukan bahwa tekstur dan energi bruto GYP dan EI tidak berbeda nyata. Hasil uji proksimat menunjukan bahwa kadar air, kadar abu, protein kasar dan lemak kasar GYP dan EI berbeda nyata, tetapi kandungan serat kasar tidak berbeda nyata (p<0.05). Kandungan kadar air, lemak, bahan ekstrak tanpa nitrogen dan karbohidrat pada EI lebih tinggi dibandingkan GYP, tetapi kadar abu, protein, glukosa dan manosa EI lebih rendah dibandingkan dengan GYP. Terdapatnya polisakarida glukomannan pada GYP dan EI dibuktikan dengan uji kimia dan uji FTIR. Secara pengujian kimia di dalam GYP dan EI secara berturut turut memiliki perbandingan manosa dan glukosa 1 : 1,2 dan 1 : 1,8 sedangkan secara spektral ditemukan penyerapan bilangan gelombang 1000 – 700 Cm-1 ( vibrasi bengkok C-H), 1300 – 1000 Cm-1 (C-O regang pada piranosa) dan 3500-3300 Cm-1 (OH yang dapat membentuk ikatan Hidrogen). Berdasarkan spektrum Near Infra Red (NIR) bahwa spektrum GYP dengan EI lebih serupa dibanding GYP dengan karbon aktif. sehingga sebagai bahan pengikat aflatoksin GYP dan EI merupakan satu kelompok yang berasal dari bahan organik. Hasil pengujian dengan FTIR antara GYP dan EI memiliki gugus fungsi yang sama yaitu O ̶ H, C ̶ H2, C ̶ H, C ̶ H3, C ̶ O ̶ C dan
≡C ̶ H, tetapi ada gugus fungsi yang hanya dimiliki GYP yakni C=O, sedangkan yang hanya dimiliki EI yakni gugus fungsi N ̶ H (bengkok). Interaksi GYP and EI dengan aflatoksin menghasilkan perubahan gugus fungsi dan penurunan bilangan gelombang yang diserap oleh OH. Kesimpulan penelitian ini menunjukan GYP dan EI mampu mengikat aflatoksin dengan ikatan hidrogen.
Kata kunci : aflatoksin, ekstraksi, gugus fungsi, glukomannan
ABSTRACT
The purpose of the study was to compare result analysis of physics and chemical glucomannan containing yeast product (GYP) and Glucomannan Product of Extraction of Iles-Iles (Amorphophalus oncophylus) and to determine
not different significantly (p<0.05) with glucomannan product of extraction iles-iles (GPE). The Results showed analysis of chemical (proximate) moisture, ash, crude protein and crude lipid GYP and GPE were significant different (p<0.05), but crude fiber was not difference. Moisture, crude lipid, nitrogen free extracts and carbohidrat in GPE were higher than GYP but ash, crude protein and mannan in GPE were lower than GYP. Containing glucomannan in GPE and GYP were proven by chemical analysis and spectroscopy testing. Chemically, GPE and GYP were contained mannosa and glucose with ratio 1:1.8 and 1:1.2 respectively. Spectroscopically, GPE and GYP have similar wavenumber especially polysacharide 1000 – 700 Cm-1 (bending vibration C-H), 1300 – 1000 Cm-1 (C-O stretching from piranosa ring) and 3400-2400 Cm-1 (OH can make hidrogen bonding). Result of Comparation of spectrogram GYP and GPE used Near Infra Red Reflectance Spectroscopy (NIRS) and Fourier Transform Infra Red (FTIR) Spectroscopy that by spectrogram of NIRS in GYP were similar with GPE but were different of activated carbon. This showed that compounds in GYP and GPE were more similar than compounds in activated carbon . Based on Spectrogram of FTIR, the GYP and GPE showed have same similar functional groups including
O ̶ H, C ̶ H2, C ̶ H, C ̶ H3, C ̶ O ̶ C dan C ̶ H. Meanwhile, functional group C=O was only had by GYP and N ̶ H (bend) was only had by GPE . Interaction of GYP and GPE with aflatoxin resulted chemical changes and decreasing of wavenumber absorbtion by OH. It was concluded that GYP and GPE can bind aflatoxin, with hydrogen bonding.
Key Words : aflatoxin, extraction, functional group, glucomannan
PENDAHULUAN
Untuk mendapatkan bahan glukomannan hasil ekstraksi dari iles-iles, proses ekstraksi merupakan bagian yang sangat penting. Metode ekstraksi dengan pendidihan dengan air dan pelarutan dengan alkohol (ethanol). Ethanol dan air merupakan zat yang termasuk larutan yang bersifat polar sehingga akan lebih mudah melarutkan zat-zat yang bersifat polar.
Glukomannan hasil ekstraksi iles-iles sebelum dilakukan uji in vitro dan uji in vivo harus dilakukan uji kimia dan fisika untuk lebih mengenal sifat-sifat kimia dan fisika dari bahan hasil ekstraksi. Kemampuan daya ikat glukomannan dari hasil ekstrasi iles-iles dapat dikaji terlebih dahulu dari sifat-sifat kimia dan fisika bahan. Apabila sifat kimia mendukung teori pengikatan aflatoksin, maka dapat dilanjutkan uji invitro maupun uji invivo pengikatan glukomannan terhadap aflatoksin.
sesudah bereaksi dengan aflatoksin akan memberikan bukti kemampuannya dalam mengikat aflatoksin.
Pengujian spektral dengan Near Infra Red (NIR) maupun Fourier Transform Infra red (FTIR) akan memberikan gambaran susunan kimia baik pada glucomannan yeast product maupun glucomannan hasil ekstraksi iles-iles terutama gugus fungsi yang ada. Spektral dari NIR akan memberikan komposisi molekul, sedangkan spektral FTIR akan memberikan gambaran gugus fungsi yang ada pada bahan yang diuji. Kedua spektral sangat membantu memberikan gambaran struktur kimia dari glukomannan yeast product dan glukomannan hasil ekstraksi dari umbi iles-iles. Pengujian proksimat akan memberikan informasi kadar nutrisi dari dua bahan glukomannan tersebut secara kuantitatif.
Pengujian kimia dengan mereaksikan aflatoksin dengan bahan glukomanan yeast product dan glukomannan hasil ekstraski iles-iles kemudian diuji spektral dengan FTIR untuk mengamati perubahan kimia sebelum dan sesudah direaksikan. Perubahan kimia yang diamati adalah perubahan gugus fungsi karena dalam kimia organik, gugus fungsi merupakan bagian yang menentukan sifat dari senyawa tersebut dan merupakan bagian yang membentuk ikatan dengan molekul lain atau dengan kata lain melakukan reaksi kimia dengan senyawa lain.
METODE PENELITIAN
Penelitian ini dilaksanakan mulai dari Agustus 2012 sampai Desember 2013 yang dilaksanakan di Laboratorium Balai Pengujian Mutu Pakan dan Sertifikasi Pakan Bekasi, Laboratorium Badan Tenaga Atom Nasional dan Laboratorium Biofarmaka Bogor.
Penelitian yang telah dilaksanakan terdiri dari:
1. Ekstraksi umbi A. oncophyllus dan grinding dengan energi tinggi pada hasil ekstraksi.
2. Pemeriksaan, pengujian proksimat dan energi bruto hasil ekstraksi iles-iles dan glukomannan yeast product.
3. Pengujian Near Infra Red system dan Fourier Transform Infra Red ekstraksi hasil iles-iles dan glukomannan yeast product
4. Pengujian ikatan antara hasil ekstraksi iles-iles dan glukomannan yeast product dengan aflatoksin menggunakan fourier Transform Infra Red.
Bahan
Umbi A. oncophyllus diperoleh dari desa Grogol, Kecamatan Sambit,
Untuk pengukuran ukuran partikel menggunakan particel size analyzer Mavlen®. Analisa NIRS menggunakan instumen NIR Buchi® NIRLab N-200 dan analisa FTIR spectroscopy Brucker® Tensor 37 series dengan detektor DLATGS dan menggunakan software OPUS operating system versi 6.0.
Pelaksanaan Penelitian
Ekstraksi umbi iles-Iles dilakukan di Laboratorium Balai Pengujian Mutu dan Sertifikasi Pakan di Bekasi. Ukuran partikel hasil ekstraksi dikecilkan supaya ukuran partikelnya sama dengan glukomannan yeast product menggunakan grinding energi tinggi. Pengukuran diameter partikel menggunakan alat partikel size analizer Malvern® dilakukan di Laboratorium Uji Material Badan tenaga Nuklir Nasional Serpong. Pengujian kimia dan fisika terdiri dari uji proksimat, pemeriksaan, Energi bruto, Ukuran partikel, pH, Near Infra Red System dan Pengujian Fourier Transform Infra Red (FTIR). Pengujian kimia dilakukan di Balai Pengujian Mutu dan Sertifikasi Pakan kecuali Pengujian Fourier Transform Infra red (FTIR) dilaksanakan di Laboratorium Pusat Studi Biofarmaka Bogor. Penelitian dilaksanakan mulai Agustus 2012 sampai Oktober 2013.
Ekstraksi Glukomannan dan Analisa Hasil Ekstraksi
Umbi iles-iles dikupas kulitnya dengan menggunakan pisau untuk dipisahkan bagian kulitnya dengan daging buah, kemudian daging buah diiris-iris dengan ketebalan 0,5 cm. Irisan diratakan diatas tempat pengering, untuk dikeringkan dengan panas matahari atau dimasukan dalam oven dengan suhu 80°C selama 8 jam, seperti pada Gambar 1. Setelah kering, irisan umbi tersebut didinginkan sampai mencapai suhu kamar. Kemudian bahan tersebut digiling untuk membuat tepung iles-iles menggunakan grinder (Retsch ZM 200®) kemudian disaring dengan ayakan berukuran 100 mesh.
(a) (b) (c)
Gambar 1 Proses pengupasan kulit (a), pengirisan umbi (b) dan pengeringan iles-iles dengan sinar matahari (c)
giling dengan grinder untuk membuat tepung glukomannan. Metode ekstraksi glukomannan yang dilakukan dalam penelitian ini menggunakan metode Whistler dan Richards (1970). Untuk mencapai pengecilan partikel yang ukuran partikelnya sama dengan partikel GYP digunakan sistem milling energi tinggi.
(a) (b) (c)
Gambar 2. Proses pemanasan dengan kompor elektrik (a), pemisahan hasil ekstraksi (b) dan pengeringan dengan oven (c)
Glukomannan hasil ekstraksi dari iles-iles dan glukomannan dari yeast produk dianalisa dengan pengujian fisik maupun kimiawi. Pengujian fisik terdiri dari: warna, tekstur, bahu, ukuran partkel dan energi bruto. Pengujian kimiawi terdiri dari proksimat, pH (pada konsentrasi tepung 1%), Karbohidrat, Neutral Detergen Fiber (NDF), Acid Detergen Fiber (ADF) glukosa, mannosa Near Infra Red (NIR) dan Fourier Transform Infra Red (FTIR).
Pengujian proksimat terdiri dari analisa kadar air, kadar abu, protein kasar, serat kasar dan lemak kasar. Metode pengujian kadar air menggunakan metode oven metode 01-2891-1992 butir 5 (SNI 1992). Vochdoos kosong dimasukkan oven pada suhu 105˚C selama 1 jam kemudian dinginkan dalam desikator dan ditimbang (W1). Sampel dengan berat 2 gram (W) dimasukkan dalam vochdoos, dan dikeringkan dalam oven pada suhu 105˚C selama γ jam. Sampel dalam vochdoos didinginkan dalam desikator kemudian ditimbang sampai berat tetap (W2). Kadar air ditentukan dengan rumus :
% Kadar air = (W1 + W) – W2 X 100% W
Pengujian kadar abu dengan metode Tanur metode 01-2891- butir 6 (SNI 1992). Crusibel kosong dimasukkan dalam tanur pada suhu 550˚C selama 1 jam, kemudian didinginkan dalam desikator dan ditimbang (W1). Sampel ditimbang dengan bobot 2 gram (W) dimasukkan dalam crusibel kosong dan dibakar selama
45 menit, kemudian dimasukkan dalam tanur pada suhu 550˚C selama 4 jam.
Setelah waktu dalam tanur tercapai sampel didinginkan dalam desikator dan ditimbang (W2).
Kadar abu ditentukan dengan rumus :
% Kadar abu = (W2 – W1) X 100% W
destilasi dan hasil destilasi ditangkap oleh H3BO4 25 ml yang diberi 3 tetes mix indikator. Destilat di titrasi dengan HCl 0,1 N sampai mencapai perubahan warna.
Metode pengujian kadar lemak kasar dengan metode 2003.06 (AOAC 2005). Pengujian lemak kasar menggunakan alat soxlet dan pelarut lemak Ether. Sampel dengan berat 2 gram dimasukan dalam selongsong ditambah Ether 70 ml kemudian diekstraksi selama 4-6 jam. Hasil ekstraksi di oven selama 105°C selama 2 jam, sehingga akan diperoleh kadar lemak yang tertinggal di dalam selongsong tersebut.
Metode pengujian serat kasar dengan metode 01-2891 (SNI 1992). Sampel dengan berat 2 gram dimasukan dalam beaker glass untuk dilakukan pelarutan lemak (defatting) dengan petroleum benzena. Dilakukan penambahan H2SO4 1,25% sebanyak 50 ml, kemudian didihkan di kompor penangas selama 30 menit. Dilanjutkan penambahan NaOH 3,25% dan didihkan pada kompor penangas selama 30 menit, kemudian disaring dengan kertas saring dan dibilas dengan H2SO4 1,25% panas, aquades panas dan ethanol. Sampel dan kertas saring dipanaskan dalam oven pada suhu 105°C selama 2 jam dan diulang pengeringan dengan oven sampai mencapai bobot tetap, pengujian dilanjutkan dengan pengabuan dengan oven pada suhu 550°C selama 2 jam dan diulang sampai mencapai bobot tetap. Sampel yang tersaring dan telah diuapkan airnya merupakan kandungan serat kasar.
Pengujian Karbohidrat menggunakan metode 01-2891-1992 butir 9 (SNI 1992), basis pengujiannya adalah titrimetri. Sampel 5 gram dimasukan dalam erlenmeyer, kemudian tambahkan 200 ml larutan HCl 3% dan dididihkan selama 3 jam dengan pendingin tegak. Larutan didinginkan dan dinetralkan dengan larutan NaOH 30% dan ditambah sedikit CH3COOH 3% agar suasana larutan sedikit asam. Pipet 10 ml larutan ke dalam erlenmeyer 500 ml, tambahkan 25 ml larutan Luff Schoorl dan 15 ml air suling. Panaskan larutan tersebut dengan nyala yang tetap, usahakan larutan mendidih dalam waktu 3 menit dan biarkan mendidih terus selama 10 menit. Setelah dingin tambahkan 15 ml larutan KI 20% dan 25 ml H2SO4 dan titrasi dengan larutan tio 0,1 N. Perhitungan kandungan karbohidrat dapat dikonversi dari larutan tio yang digunakan dengan tabel penetapan gula menurut Luff Schoorl.
Pengujian kadar mannan menggunakan metode Ohtsuki (1968) atau disebut juga pengujian dengan metode Mannosa Phenylhydrazone, pengujian ini berbasis gravimetri. Sampel ditimbang 1 gram dan ditambahkan 50 ml HCl 2% dan didihkan selama 3 jam. Filtrat dinetralkan dengan NaOH dan tambahkan karbon aktif dan dilanjutkan dengan penyaringan. Filtrat yang diperoleh didestilasi sampai volume 10 ml, dan ditambahkan 0,4 gram phenylhydrazine hidrokhlorid dan 0,65 gram Na-asetat dalam 5 ml aquadest. Campuran disimpan di lemari es selama 24 Jam dan Kristal mannosaphenylhydrazine disaring lalu ditimbang.
Uji Ikatan Aflatoksin
Pembuatan pelarut A yang mengandung aflatoksin 0,821 µg/ml dengan cara melarutkan standar aflatoksin 1,2753 ml standard aflatoksin (2,06 µg/ml) dengan acetonitril hingga mencapai 3,2 ml. Bahan bahan pengikat GYP maupun EI ditimbang 246,3 mg dan dimasukan ke dalam tabung dan ditambah 0,6 ml pelarut A dan 40 ml aquademineral, tabung digoyang dengan hati hati. Hasil ekstraksi iles-iles diperlakukan sama dengan GYP. Tabung yang berisi GYP maupun Ekstrak iles-iles diinkubasi dalam suhu 39°C selama 2 jam. Setelah selesai diinkubasi, selanjutnya tabung disentrifuse dengan kecepatan 1500 rpm selama 15 menit, presipitat dikumpulkan, kemudian dianalisa dengan Fourier Transform Infrared (FTIR) Spectroscopy. Hasil spektrum dibandingkan antara spektrum bahan pengikat baik GYP maupun EI dengan spektrum bahan pengikat setelah diikatkan dengan aflatoksin. Teori ikatan glukomannan dengan aflatoksin menggunakan program Chem Draw Ultra versi 8.0.
Analisis Data.
Data hasil pengujian fisika dan kimia antara GYP dan EI dibandingkan nilai rata-ratanya dengan menggunakan uji-t sampel berpasangan (paired samples-t samples-tessamples-t). Unsamples-tuk analisa hasil pengujian NIRS dan FTIR menggunakan ssamples-tasamples-tissamples-tik deskriptif dengan membandingkan gambar spektrumnya maupun tabel untuk panjang gelombang yang terabsorpsi.
HASIL DAN PEMBAHASAN
Pengujian Fisik
Proses ekstraksi umbi iles-iles dengan menggunakan pelarut ethanol dan air. Hasil ekstraksi dari tepung iles-iles dalam penelitian ini mampu menghasilkan rendemen 74,1%, sebagaimana dipaparkan pada Tabel 1.
Tabel 1 Hasil rendemen ekstraksi tepung Amorpophalus oncophyllus
Berat tepung A. oncophyllus
sebelum di ekstraksi (gram)
Berat hasil ekstraksi (gram)
Persentase Rendemen (%)
33,3 25,1 75,4
33,3 24,4 73,3
33,3 24,4 73,9
33,3 24,6 74,5
33,3 25,0 75,0
33,3 24,2 72,7
Rata-rata 74,1
Kurniawan et al. (2011) melaporkan rendemen diperoleh antara 78,78 – 82,96% dengan teknik ekstraksi kering.
Hasil pemeriksaan dan pengujian fisik meliputi uji: warna, tekstur, ukuran partikel, pH dan energi bruto. Hasil pemeriksaan dan pengujian isik diperoleh data, sebagaimana pada Tabel 2.
Tabel 2 Hasil pemeriksaan dan pengujian fisik
Glukomannan Yeast Product Ekstrak Iles-Iles
Warna Coklat tua Coklat muda
Tekstur Halus Halus
Bau Harum Spesifik ekstrak
iles-iles Partikel size analizer
(d.nm)a
196,0+31,29 150,8+19,07
Energi bruto (kkal/kg) 3681,81+172.33 3631,01+105.64 a
d.nm: diameter in nano meter; kkal/kg: Kilo kalori/Kilogram.
Warna antara GYP dan EI mendekati sama yakni warna coklat hanya GYP lebih coklat tua dibandingkan dengan EI, sebagaimana pada Gambar 3.
Jenis warna mempengaruhi palatabilitas dari ternak, oleh karena itu dengan warna yang berdekatan antara GYP dan EI memberikan nilai palatabilitas yang sama. Penggunaan dari GYP dan EI juga sangat kecil yakni rata-rata 1 Kg/ton, sehingga warna pakan secara keseluruhan masih ditentukan dengan bahan baku utama yang lainnya seperti jagung, bungkil kedelai dan lainnya.
Bau juga mempengaruhi palatabilitas ternak, GYP maupun EI tidak ditemukan bau tengik yang dapat menurunkan palatabilitas ternak. Kedua bahan tersebut tidak memiliki potensi ketengikan karena kadar lemak yang rendah yakni di bawah 1%, GYP kadar lemaknya 0,47% sedangkan EI kadar lemaknya 0,74%. Lemak EI terlarut dalam air pada saat dilakukan ekstraksi sehingga terpisah dengan glukomannan (Yu et al. 2007). Bau GYP harum spesifik yeast produk,
sedangkan EI tercium bau ekstrak bahan alami dari iles-iles.
Ukuran partikel GYP dan EI diukur dengan metode pengujian struktur dan komposisi mikro dengan scanning electron microscopy (SEM)/energy dispersive spectroscopy (EDS). EI sebelum diukur ukuran partikelnya digrinding dengan
(a) (b)
energi tinggi, sehingga diperoleh ukuran 150,8 nm lebih kecil dibandingkan ukuran partikel GYP yakni 196 nm. Semakin ukuran partikel kecil memiliki kemudahan bercampur dengan pakan, sehingga memudahkan homogenitasnya dan meningkatkan peluang berinteraksi dengan molekul aflatoksin. EI dilakukan pengecilan partikel karena hasil grinding biasa masih menghasilkan partikel lebih besar dibandingkan GYP. Untuk membandingkan kemampuan pengikatan terhadap aflatoksin maka ukuran partikel diusahakan sama. Ukuran partikael EI sebesar 150,8 nm diperoleh setelah dilakukan grinding energi tinggi selama 7,5 jam. Sebelumnya telah dilakukan perlakuan grinding energi tinggi selama 0,5; 3 dan 5 jam tetapi partikel masih lebih besar daripada GYP, sehingga diperoleh ukuran partikel EI tersebut paling optimal untuk mencapai ukuran partikel yang sama dengan ukuran partikel GYP.
Energi kasar yang dihasilkan GYP dan EI tidak berbeda nyata (p< 0.05). hal ini disebabkan kandungan dari dua bahan tersebut didominasi karbohidrat dan protein, sebagaimana kita ketahui kandungan energi protein dan karbohidrat dalam satu gram adalah 4,1 kal/gram. Energi paling tinggi terdapat pada lemak yakni 9,2 kal/gram. sedangkan kandungan lemak antara GYP dengan EI sama-sama rendah yakni dibawah 1% sehingga pengaruhnya kecil dalam menetukan kandungan energi.
Pengujian Proksimat
Hasil pengujian kimia uji proksimat antara GYP dan EI menunjukan adanya perbedaan hasil pengujian secara signifikan ( p>0.05) , kecuali kandungan serat kasar tidak berbeda, sebagaimana dapat dilihat pada Tabel 4. Serat kasar menunjukan bagian yang tidak hancur oleh pelarut asam maupun basa, sehingga dalam saluran pencernaan tidak terserap dan tetap bertahan dalam saluran pencernaan, bagian yang tetap tertahan dalam saluran pencernaan ini antara GYP dan EI adalah sama yakni kurang lebih 10%.
Tabel 3 Hasil uji proksimat Glucomannan Yeast Product (GYP) dan Ekstraksi Iles-Iles (EI) dalam persen (%)c
Bahan
Kadar Air
Kadar abu
Protein kasar
Lemak kasar
Serat kasar
BETN
GYP 6.11+0,17a 15,7+0.06b 28.63+0.32b 0.47+0.04a 10.66+2.20a 38,45+2.08a
EI 8.01+0,07b 4,33+0.05a 6.96+0.09a 0.74+0.06b 9.98+ 0.52a 69,97+0.58b
c Banyaknya 6 contoh; a.b dalam satu kolom. huruf yang berbeda menunjukan berbeda secara nyata
pada taraf uji 5% (uji t).; BETN: Bahan Ekstrak Tanpa Nitrogen.
Kadar abu yang tinggi pada GYP yang digunakan, kemungkinan ada penambahan bahan lain selain bahan utama dari dinding sel S. cerevisae. Untuk
meningkatkan daya pengikat dan murahnya bahan baku dapat ditambahkan dengan menggunakan bahan pengikat bersumber clay, sehingga hasil pengujian menunjukan kadar abu tinggi. Hasil pengujian kadar abu pada dinding sel
S.cerevisae kurang lebih 3%, sebagaimana dilaporkan oleh Hisano et al. (2008)
Kadar air, lemak kasar dan bahan ekstrak tanpa nitrogen (BETN) dari EI lebih besar dibandingkan dengan GYP. Secara kimiawi GYP lebih banyak mengandung unsur nitrogennya, hal ini dapat dilihat dari kandungan protein kasar GYP (28.63%) dibandingkan kandungan protein kasar EI (6.96%), sehingga kandungan BETN EI lebih besar, hal ini didukung oleh hasil pengujian kadar karbohidrat secara titrasi, EI sebesar 61.67%. sedangkan pada GYP 31.89%, sebagaimana pada Tabel 3.
Kadar protein EI 6,96% lebih rendah apabila dibandingkan dengan hasil pengujian protein glukomanan oleh Chua (2012) sebesar 7,5%. Glukomannan hasil ekstraksi Amorphophallus menurut standar FCC (2003), kandungan protein glukomannan dari ekstraksi A. konjac maximal 8%, sehingga hasil ekstraksi yang dilakukan dalam penelitian ini memenuhi persyaratan standar tersebut.
Karbohidrat
BETN merupakan selisih karbohidrat dengan serat kasar. EI mengandung karbohidrat lebih tinggi dibandingkan dengan GYP, sedangkan kandungan serat kasar tidak berbeda nyata dengan kandungan serat kasar pada GYP sehingga BETN EI lebih tinggi dibandingkan GYP. BETN merupakan penilaian kadar karbohidrat berdasarkan perhitungan (by differance), sedangkan pengujian karbohidrat berdasarkan pengujian (SNI 01-2891-1992 butir 9 1992) diperoleh kadar karbohidrat EI lebih besar dibandingkan GYP, jadi hasil perhitungan bersesuaian dengan pengujian.
Kadar Karbohidrat tinggi pada EI tidak diikuti kandungan mannan yang tinggi karena kadar mannan pada GYP 25.7% sedangkan EI 15.2% (Tabel 4). Menurut Ohtsuki (1968) karbohidrat pada umbi iles-iles terdiri dari pati, serat kasar, mannan, gula bebas dan poliosa. Kadar karbohidrat tinggi pada EI, tersusun oleh komposisi glukosa dan mannosa. Glukosa dan mannosa merupakan monosakarida Karbon 6, dalam kelompok yang sama yakni aldoheksosa dan memiliki rumus kimia yang sama yakni C6H12O6. Kedua monosakarida tersebut merupakan isomer ruang (stereoisomer) kelompok diasteromer karena yang membedakan glukosa dan manosa adalah letak gugus –OH pada Karbon ke dua. Struktur molekul glukosa memiliki gugus OH pada sebelah kanan, sedangkan pada manosa terletak sebelah kiri (Sumardjo 2009).
Tabel 4 Hasil pengujian karbohidrat dan pH glukomannan yeast product (GYP) dengan hasil ekstraksi iles-iles (EI)C
Bahan
Glukosa (%)
Mannosa (%)
NDF (%)
ADF (%)
pH GYP 31.89+1.89b 25.7+5.4b 7.77+1.86a 4.14+0.37a 5.00+0.05a
EI 27.43+0.06a 15.2+3.1a
31.84+0.81b 14.26+0.96b 5.67+0.05b C
banyaknya 6 contoh; a.b dalam satu kolom. huruf yang berbeda menunjukan berbeda secara nyata pada taraf uji 5% (uji t) ; NDF: Neutral Detergen Fiber; ADF: Acid Detergen Fiber; KBHD: Karbohidrat.
Senyawa protein dan karbohidrat merupakan penyusun dari dinding sel
S.cerevisae sebagaimana dilaporkan oleh Evan dan Dowson (2007) seperti pada Gambar 4. Karbohidrat di dalam dinding sel S.cerevisae terdiri dari glukosa, manosa dan N-acetyglucosamine. Glukosa dan manosa adalah gula utama dalam dinding sel GYP dan EI. Protein memiliki ikatan kuat dengan ß1-4 glukosa-mannosa dibandingkan protein berikatan dengan xylan, hal ini disebakan affinitas protein dengan ß1-4 glukosa-mannosa lebih besar dibandingkan dengan xylan. Ikatan Protein dengan glukomannan membentuk ikatan hydrogen antara gugus hidroksil (OH) glukomannan dengan O2 atau NH2 pada asam amino dari protein (Flint et al. 2004).
Gambar 4 Komposisi penyusun dinding sel S.cerevisae (Evan dan Dowson, 2007)
Perbandingan glukosa dengan manosa dalam GYP diperoleh perbandingan 1,2:1 sedangkan pada EI adalah 1.8:1. Perbandingan Glukosa dan Manosa pada GYP yang mendekati 1: 1 mendukung teori penyusunan dinding sel S.cerevisae
dimana perbandingan Glukosa dengan manosa mendekati sama (Evan dan Dowson 2007). Glukomannan hasil ekstraksi umbi tanaman keluarga
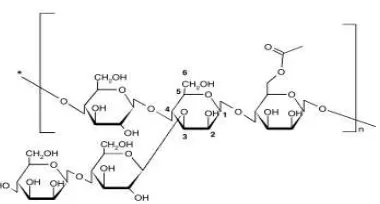
Amorphophallus merupakan polisakarida yang terikat dengan ikatan ß1-4
D-glukosa-D-mannosa (Gambar 5) dengan perbandingan manosa dan glukosa bervariasi tergantung dari jenis dan asal dari Amorphophallus, seperti pada A. konjac memiliki perbandingan 1,6: 1 (Sande et al. 2009). Perbandingan glukosa
Gambar 5 Struktur molekul glukomannan (Sande et al. 2009)
Kandungan NDF dan ADF antara GYP dengan EI berbeda secara signifikan, tetapi perbandingan ADF/NDF antara GYP dan EI berturut-turut adalah 0.53 dan 0.45. Kandungan ADF kurang lebih separuhnya dari kandungan NDF. Selisih antara NDF dan ADF menunjukan kadar hemiselulosa. Monomer penyusun hemiselulosa biasanya adalah rantai D-glukosa, ditambah dengan berbagai bentuk monosakarida yang terikat pada rantai, baik sebagai cabang atau mata rantai, seperti D-mannosa, D-galaktosa, atau monomer lainnya, tergantung dari bahan yang dianalisa.
Spektrum Near Infra Merah
Spektroskopi near infra merah merupakan salah satu alat yang banyak dipakai untuk mengidentifikasi senyawa baik alami maupun buatan. Bila gelombang elektromagnetik near infra merah dilewatkan melalui cuplikan senyawa organik. maka sejumlah energi akan diserap sedang energi yang lain diteruskan atau ditransmisikan tanpa diserap. Gambaran antara persen absorbansi atau persen transmitansi lawan panjang gelombang akan menghasilkan suatu spektrum infra merah. Transisi yang terjadi didalam serapan infra merah berkaitan dengan perubahan-perubahan vibrasi dalam molekul (Sastrohamidjojo 2001). Daerah radiasi spektroskopi infra merah berkisar pada bilangan gelombang 12.800 sampai 10 cm-1 atau pada panjang gelombang 0.78-1000 μm (Khopkar 1990). Bilangan gelombang 4000 – 1400 cm-1 merupakan daerah panjang gelombang gugus fungsi. sedangkan pada bilangan gelombang 1400 – 400 cm-1 merupakan daerah sidik jari (finger print) karena pada bilangan gelombang daerah ini meyebabkan vibrasi molekul secara keseluruhan.
Pengujian dengan NIRS memiliki beberapa keuntungan antara lain tidak membutuhkan bahan kimia karena sampel hanya digiling dan langsung dapat diuji, sampel tidak mengalami kerusakan pada saat pengujian, ramah terhadap lingkungan karena tidak membuang limbah pengujian dan tingkat presisi pengujian tinggi (Kadim et al. 2005). Setiap atom dan molekul saling mempengaruhi membentuk pita-pita absorpsi yang khas. Akan jauh lebih sulit untuk membedakan ikatan-ikatan tertentu dalam area dengan bilangan gelombang yang lebih besar. Hal penting dalam area sidik jari adalah setiap senyawa yang berbeda menghasilkan pola lembah yang berbeda-beda pada spektrum bagian ini (Kusumastuti 2011).
karbon aktif. Metode pembuatan dan perlakuan secara kimia terhadap bahan karbon aktif sangat mempengaruhi karakteristik permukaan karbon aktif yang berkait langsung dengan kemampuan dalam penyerapan terhadap mikotoksin (Galvano et al. 2001). GYP, EI dan Karbon aktif dapat mengurangi efek merugikan dari aflatoksin pada ayam broiler, walaupun secara rumus kimia ketiganya berbeda.
[image:33.595.166.493.359.514.2]Dari spektrum Near infra red GYP dan EI memiliki penyerapan pada beberapa panjang gelombang tertentu. sedangkan pada karbon aktif terjadi penyerapan terus menerus dari bilangan gelombang 4 500 sampai 9 500 (Gambar 6, 7 dan 8). Hal ini menggambarkan bahwa senyawa penyusun bahan GYP dan EI memiliki komposisi molekul lebih bervariasi dibandingkan dengan karbon aktif. Molekul penyusun GYP dengan iles-iles lebih serupa dibanding GYP dengan karbon aktif maupun EI dengan karbon aktif, sehingga sebagai bahan pengikat aflatoksin GYP dan EI merupakan satu kelompok yang berasal dari bahan organik yang terdiri dari berbagai molekul, sedangkan karbon aktif merupakan pengikat aflatoksin yang tersusun oleh karbon saja. Molekul penyusun GYP dan EI dapat dibuktikan dengan hasil pengujian kimia dari GYP dan EI yang mengandung protein, lemak, serat kasar dan karbohidrat.
Gambar 6 Spektrum glukomannan yeast product dengan Near Infra Red
[image:33.595.157.498.554.707.2]Absorpsi gelombang elektromagnetik yang terus menerus menunjukan bahwa karbon aktif mampu melakukan penyerapan (absorpsi) karena karbon aktif tersusun oleh pori-pori yang banyak. Sistem kerja pengikatan aflatoksin dari karbon aktif adalah secara fisik yakni dengan absorpsi, hal tersebut sesuai dengan penelitian sebelumnya (Denli dan Okan 2006) bahwa karbon aktif mampu mengurangi efek dari racun aflatoksin dengan sistem penyerapan.
Gambar 8 Spektrum Karbon aktif dengan Near Infra Red
GYP, EI dan karbon aktif memberikan gambaran bahwa GYP dan EI tersusun oleh beberapa molekul, sedangkan pada karbon aktif lebih sederhana molekul penyusunnya. Gallo dan Masoero (2010) menyatakan bahwa karbon aktif tersusun oleh unsur Carbon , Oksigen dan Calsium secara berturut-turut: 89.2; 11.1 dan 0.2% . Karbon aktif terdiri dari material karbon yang memiliki banyak porositas dari permukaan internal dan tidak memiliki formulasi molekul karena secara kimia disebut karbon (Cuhadaroglu dan Uygun 2008).
Gugus Fungsi
Gugus fungsi dapat diketahui dengan pengujian dengan FTIR, spektrum FTIR dari GYP dan EI dapat dilihat pada Gambar 9. Secara garis besar GYP dan EI memiliki puncak dan lembah yang bersesuaian. Gugus fungsi dari suatu senyawa ditentukan oleh absorbansi bilangan gelombang/frekuensi
Senyawa organik terdiri dari dua bagian yakni kerangka karbon yang merupakan ikatan Karbon dengan Karbon atau Hidrogen dan gugus fungsi. Bagian gugus fungsi merupakan sekelompok atom (dua atau empat atom) dalam molekul yang bertanggung-jawab terhadap reaksi kimia dan karakteristik molekul tersebut. Gugus fungsi yang sama akan mengalami reaksi kimia yang sama apapun bentuk dan jenis kerangka karbonnya akan tetapi reaktivitas relatifnya dapat dipengaruhi oleh keberadaan gugus fungsi lain di dekatnya. Kelebihan spektrofotometer FTIR (Fourier Transform Infra Red) adalah mampu memberikan informasi gugus fungsi secara tepat dan akurat. Untuk lebih mengenal gugus aktif dari GYP dengan EI dapat diketahui dari Tabel 5.
Tabel 5 Perbedaan gugus fungsi antara GYP dengan EI
*Penetapan Gugus fungsi berdasarkan Pavia et.
al (2001)
Persentase transmitansi tinggi memiliki makna nilai absorbansi rendah karena suatu panjang gelombang yang memiliki tranmitansi tinggi, ketika melewati sampel panjang gelombang tersebut akan melewati sampel, sehingga panjang gelombang tersebut sedikit yang terserap ke dalam sampel (absorban rendah). Beberapa penelitian sebelumnya telah mendapatkan hasil bahwa terdapat penyerapan spesifik pada bilangan gelombang tertentu yang menunjukan senyawa glukomannan maupun senyawa lainnya (Yu et al. 2007; Goran dan Milorad 2011). Jenis gugus fungsi yang ditemukan di dalam GYP memiliki kesamaan dengan yang dimiliki dalam EI. Berdasarkan Tabel 5 dapat diketahui bahwa GYP dan EI memiliki 6 gugus fungsi yang sama yakni O ̶ H, C ̶ H2, C ̶ H, C ̶ H3,
C ̶ O ̶ C dan ≡C ̶ H. Gugus fungsi tersebut sesuai dengan gugus fungsi yang ditemukan pada molekul glukomannan, yang tersusun oleh glukosa dan mannosa. Kepemilikan gugus fungsi yang sama ini memberikan peluang EI memiliki kemampuan mengikat aflatoksin seperti GYP yang sudah dilaporkan memiliki kemampuan mengikat aflatoksin maupun T-2 baik dalam bentuk tunggal ataupun kombinasi ke dua toksin tersebut, sehingga GYP mampu meningkatkan
GYP EI Acuan Spektrum
Bilangan gelombang terserap (Cm-1)
Inten-sitas
Bilangan gelombang
terserap (Cm-1)
Inten-sitas
Bilangan gelombang
terserap (Cm-1)
Gugus fungsi
3416.71 S 3428.87 S 3500 - 3300 O ̶ H
2924.46 S 2924.01 S 3400 - 2400 C ̶ H2
2136.86 W 2148.18 W 2250-2100 C ̶ H
1654.83 S - S 1850-1630 C=O
- 1623.13 S 1640 - 1550 N ̶ H
1406.97 S 1383.19
1321.71
S S
1475 - 1220 C ̶ H3 1242.49 1030.97 S S 1246.76 1027.00 S S
1300 - 1000 C ̶ O ̶ C 913.44 799.42 754.50 693.92 M M M M
pertumbuhan berat badan ayam dan titer antibodinya (Girish dan Devegowda 2006).
Dari molekul GYP dan EI terdapat perbedaan gugus fungsi, yakni GYP menyerap bilangan gelombang 1654.83, bilangan gelombang tersebut menunjukan daerah serapan 1850-1630 Cm-1 (gugus C=O). Sedangkan pada EI ditemukan gugus NH tekuk yakni pada bilangan gelombang 1623.13. Gugus NH regang yang merupakan gugus yang ditemukan pada senyawa protein tidak teridentifikasi dalam pengujian FTIR baik pada GYP maupun EI, hal ini disebabkan NH regang (3500-3100) dalam satu area dengan penyerapan OH regang yakni 3 500 – 3 300, sehingga ketika terjadi penyerapan gugus OH regang yang kuat akan menyebabkan penyerapan gugus fungsi NH tertutupi, sehingga yang muncul dalam spektrogram adalah serapan gugus OH.
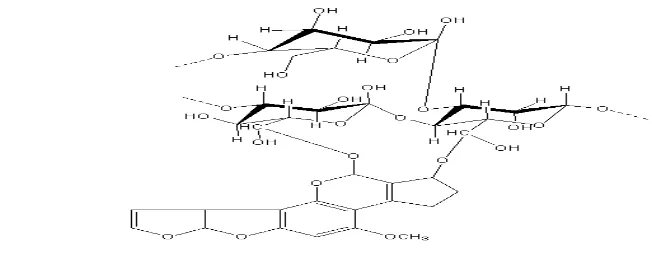
Spektrum Glukomannan
Glukomannan merupakan polisakarida dengan ikatan lurus dan sedikit percabangan, dengan komposisi -(1→4)-linked D-manosa and D-glukosa dengan perbandingan 1,6:1 (Tien et al. 2009). Perbandingan percabangan kira-kira 8%
pada ikatan -(1→6)-glucosyl linkages (Zhang et al. 2001). Dari pengujian yang dilakukan diperoleh perbandingan manosa dan glukosa pada GYP dan EI secara berturut turut 1 : 1.2 dan 1 : 1.8.
Adanya Polisakarida didukung juga dengan ditemukannya penyerapan bilangan gelombang antara 1000 – 700 Cm-1 baik di GYP dan EI, penyerapan dari bilangan gelombang tersebut menunjukan terjadinya vibrasi tekuk C-H (Goran dan Milorad 2011). Vibrasi tekuk C-H menunjukan ikatan glukosidic dan mannosidic dari glukomannan. Kondisi tersebut bersesuaian dengan pengujian kimia bahwa GYP dan EI mengandung glukosa dan manosa, zat tersebut berangkai membentuk heteropolisakarida.
Dari hasil pengujian FTIR baik GYP maupun EI memiliki serapan pada bilangan gelombang 1030.97 (GYP) dan 1027.00 (EI). Penyerapan di bilangan gelombang tersebut menunjukan gugus fungsi C-O yang spesifik pada glukomannan, sebagaimana dilaporkan oleh Chua et al. (2012) yakni penyerapan bilangan gelombang antara 1000 – 1300 Cm-1 menunjukan C-O-C bentuk regang dari group ring piranosa yang dimiliki oleh glukomannan.
GYP maupun EI menyerap bilangan gelombang 3416.71 dan 3428.87 secara berturut-turut. Bilangan gelombang tersebut menunjukan gugus fungsi OH, karena spesifik dengan bentuk serapannya yang kuat dan membentuk . Gugus fungsi yang mendukung adanya glukomannan baik pada GYP dan EI adalah OH. Widjonarko et al. (2011) menyampaikan bahwa struktur glukomannan hasil ekstraksi Amorphophallus konjac adalah ditemukannya gugus hidroksil (OH).
Struktur Aflatoksin
Secara kimia, aflatoksin adalah kelompok difuranocoumarin dengan jenis utama dari aflatoksin adalah aflatoksin B1 (AFB1), aflatoksin B2 (AFB2), aflatoksin G1 (AFG1) dan aflatoksin G2 (AFG2 (Murphy et al. 2006). Unsur pembentuk molekul aflatoksin terdiri dari unsur C, H dan O. Struktur kimia aflatoksin dapat dilihat pada Gambar 10. Nama kimia dari aflatoksin B1 adalah Cyclopenta [c] furo [3',2':4,5]furo [2,3h][1] benzopyran-1,11-dione,2,3,6a,9a-tetrahydro-4-methoxy-,(6aR,9aS), Aflatoksin B2 mengalami penambahan 2 Hidrogen (dihydroaflatoksin dari B1), sehingga rumus kimianya untuk B1 adalah C17H12O6 sedangkan B2 menjadi C17H14O6. Nama kimia dari aflatoksin G1 adalah 1H,12H-Furo [3',2':4,5] furo [2,3-h] pyrano [3,4-c][1] benzopyran-1,12-dione,3,4,7a,10a-tetrahydro-5-methoxy-,(7aR,10aS)-, G2 merupakan G1 yang mengalami penambahan 2 hidrogen, sehingga rumus kimia G1 adalah C17H12O7 sedangkan G2 adalah C17H14O7 (cbinfo.com 2013).
O O
O O
R3
R2
R1 R6
O R4
R5
Aflatoksin B dan turunannya
O O
O O
R3
R2
R1 OCH3
O O
Aflatoksin G dan turunannya
Aflatoksin R1 R2 R3 R4 R5 R6 B1 H H H =O H OCH3
B2 H2 H2 H =O H OCH3
M1 H H2 OH =O H OCH3
M2 H2 H OH =O H OCH
P1 H H2 H =O H OH Q1 H H H =O OH OCH3
Aflatoksin R1 R2 R3
G1 H H H
G2 H2 H2 H
G2a OH H2 H
GM1 H H OH
Gambar 10 Gugus fungsi dalam senyawa beberapa jenis aflatoksin
Aflatoksin B dengan G secara rumus kimia yang membedakan adalah kandungan unsur Oksigen, pada molekul aflatoksin G kandungan Oksigen lebih banyak 1 buah dibandingkan pada aflatoksin B yakni pada aflatoksin B memiliki O6, sedangkan pada aflatoksin G memiliki O7. Untuk tipe 1 dan 2 yang membedakan adalah kandungan unsur H pada tipe 1 jumlah Hidrogen 12 dan dan tipe 2 jumlah Hidrogennya 14.
Perubahan Gugus Fungsi GYP
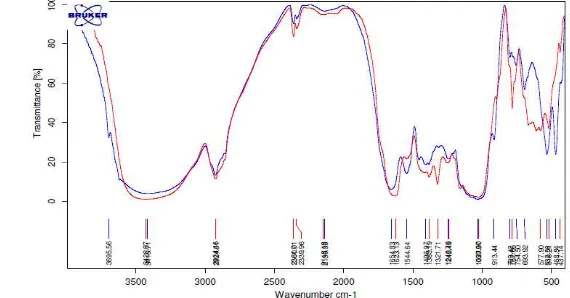
Gambar 11 Spektrum FTIR antara GYP sebelum (biru) dan sesudah (merah) berikatan dengan aflatoksin
[image:38.595.108.504.61.633.2]Secara lebih rinci perubahan gugus fungsi GYP sebelum dan sesudah bereaksi dengan aflatoksin dapat dilihat pada Tabel 6.
Tabel 6 Perbedaan gugus fungsi antara GYP dengan GYP + Aflatoksin
*Penetapan Gugus fungsi berdasarkan Pavia et.al (2001), S= strong, W=weak dan M=
medium
Jumlah bilangan gelombang yang terserap pada GYP berkurang setelah direaksikan dengan aflatoksin yakni pada gugus fungsi ≡C ̶ H (di luar bidang) pada bilangan gelombang 913.44 tidak tampak lagi setelah GYP berikatan dengan aflatoksin. Perubahan gugus fungsi menunjukan adanya perubahan kimiawi. Berkurangnya gugus ≡C ̶H memberikan gambaran perubahan dari rantai glukomannan GYP setelah bereaksi dengan aflatoksin.
GYP GYP+AFL Acuan spektrum
Bilangan gelombang terserap (Cm-1) Inten- sitas Bilangan gelombang terserap (Cm-1) Inten-sitas Bilangan gelombang terserap (Cm-1)
Gugus fungsi
3416.71 S 3417.59 S 3500 - 3300 O ̶ H
2924.46 S 2924.38 S 3400 - 2400 C-H2
2136.86 W 2135.28 W 2250-2100 C ̶ H
1654.83 S 1651.55 S 1850 - 1630 C=O
1406.97 S 1383.81 S 1475 - 1220 C ̶ H3
1242.49 1030.97 S S 1242.43 1031.90 S S
1300 - 1000 C ̶ O ̶ C 913.44 799.42 754.50 693.92 M M M M - 801.52 756.03 694.61 M M
[image:38.595.121.482.72.261.2]Perubahan Gugus Fungsi EI
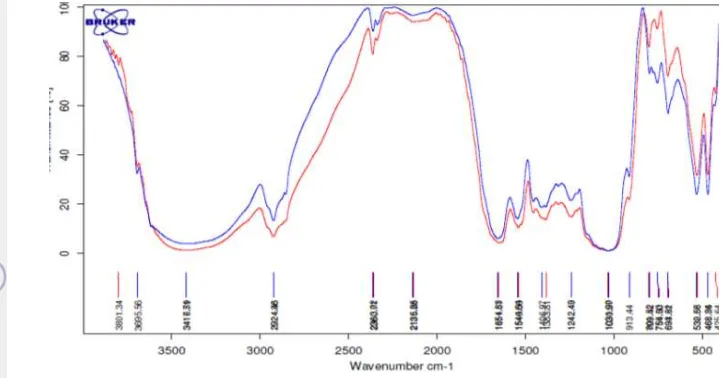
[image:39.595.111.476.136.330.2]Spektrum EI sebelum dan sesudah berikatan dengan aflatoksin dapat dilihat pada Gambar 12.
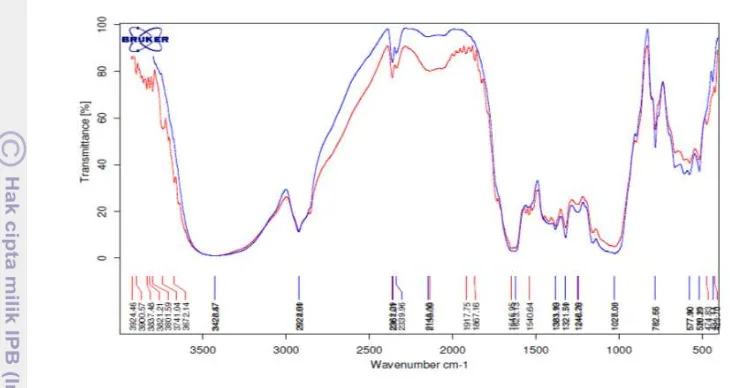
Gambar 12 Spektrum FTIR antara ekstraksi iles-iles sebelum (biru) dengan sesudah (merah) berikatan dengan aflatoksin
Untuk lebih jelasnya susunan gugus fungsi dapat dilihat pada Tabel 7 di bawah ini.
Tabel 7 Perbedaan gugus fungsi antara Ekstraksi iles-iles dengan Ekstraksi Iles- Iles bereaksi Aflatoksin
*Penetapan Gugus fungsi berdasarkanPavia et.
al (2001) S= strong, W=weak dan M= medium
EI EI+Aflatoksin Acuan Spektrum
Bilangan gelombang terserap (Cm