STUDI EMBRIOGENESIS DAN ORGANOGENESIS SERTA
RESPON BEBERAPA GENOTIPE UBI KAYU
TERHADAP AlCl
3CANDRA CATUR NUGROHO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Studi Embriogenesis dan Organogenesis serta Respon beberapa Genotipe Ubi Kayu terhadap AlCl3 adalah
benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2014
Candra Catur Nugroho
RINGKASAN
CANDRA CATUR NUGROHO. Studi Embriogenesis dan Organogenesis serta Respon beberapa Genotipe Ubi Kayu terhadap AlCl3. Dibimbing oleh NURUL KHUMAIDA dan SINTHO WAHYUNING ARDIE.
Ubi kayu (Manihot esculenta Crantz.) merupakan salah satu tanaman
penghasil karbohidrat yang dapat dimanfaatkan sebagai sumber substitusi tepung terigu. Pemanfaatan ubi kayu sebagai sumber substitusi tepung terigu perlu dilakukan karena tingginya nilai impor tepung terigu dan produk gandum dari tahun ke tahun. Produksi ubi kayu perlu ditingkatkan bukan hanya dalam rangka pemanfaatan ubi kayu sebagai sumber pangan, tetapi juga sebagai sumber pakan dan bio-energi. Akan tetapi, peningkatan produksi ubi kayu terkendala oleh terbatasnya varietas unggul ubi kayu, sulitnya pemenuhan bibit ubi kayu bermutu dalam jumlah besar dan seragam, serta perluasan areal tanam yang hanya dapat dilakukan ke lahan marginal karena semakin berkurangnya lahan subur (produktif) di Indonesia. Kultur in vitro merupakan teknologi yang dapat
diaplikasikan untuk perbanyakan cepat dan massal bibit ubi kayu bermutu serta untuk mendukung program pemuliaan ubi kayu berdaya hasil tinggi dan toleran cekaman abiotik, misalnya toksistas aluminium pada lahan bertanah masam. Tujuan umum penelitian ini adalah memperoleh protokol perbanyakan tunas beberapa genotipe ubi kayu secara in vitro melalui jalur embriogenesis somatik
dan organogenesis. Secara khusus, penelitian ini bertujuan untuk: 1) mempelajari pengaruh berbagai jenis media dasar dan zat pengatur tumbuh dengan jenis eksplan daun muda, tunas pucuk, dan petiol terhadap pembentukan kalus embriogenik pada beberapa genotipe ubi kayu; 2) mendapatkan media induksi kalus embriogenik optimum pada beberapa genotipe ubi kayu; 3) mendapatkan nilai LC20 dan LC50 AlCl3 pada kalus ubi kayu; dan 4) mempelajari penggunaan
jenis media kultur dan posisi single node (pangkal, tengah, dan ujung) terhadap
pertumbuhan dan multiplikasi planlet ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro. Penelitian ini terdiri atas lima percobaan, yaitu induksi kalus
embriogenik empat genotipe ubi kayu, optimasi induksi kalus embriogenik ubi kayu genotipe Adira 4 dan Gajah, penentuan nilai LC20 dan LC50 AlCl3 pada kalus
empat genotipe ubi kayu, multiplikasi tunas ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro, dan aklimatisasi bibit ubi kayu genotipe Jame-jame
hasil perbanyakan in vitro.
Percobaan optimasi induksi kalus embriogenik ubi kayu genotipe Adira 4 dan Gajah disusun berdasarkan rancangan acak lengkap faktorial dua faktor. Faktor pertama yaitu jenis eksplan (daun muda dan tunas pucuk). Faktor kedua yaitu suhu ruang kultur (21-23 0C dan 25-27 0C). Hasil percobaan menunjukkan bahwa pembentukan dan pertumbuhan kalus ubi kayu genotipe Adira 4 dan Gajah lebih baik dilakukan pada suhu 25-27 ⁰C dibandingkan pada suhu 21-23 ⁰C berdasarkan waktu muncul kalus, skor pertumbuhan dan diameter kalus. Penggunaan jenis eksplan daun muda dan tunas pucuk tidak menunjukkan perbedaan signifikan terhadap induksi pembentukan dan pertumbuhan kalus. Kalus yang terbentuk pada percobaan ini merupakan kalus non-embriogenik.
Seleksi in vitro terhadap cekaman aluminium dilakukan dengan
menggunakan agen seleksi AlCl3. Percobaan ini disusun berdasarkan rancangan
acak lengkap satu faktor yaitu konsentrasi AlCl3 (0, 100, 200, 400, 600, dan
800 mg L-1). Berdasarkan hasil seleksi in vitro diketahui bahwa genotipe
Jame-jame dan Gajah relatif peka terhadap toksisitas aluminium dibandingkan genotipe Adira 4 dan UJ 5. Hal ini dapat dilihat dari kepekaan kalus genotipe Jame-jame (LC20 = 19.39; LC50 = 236.37) dan Gajah (LC20 = 39.99; LC50 = 156.54) terhadap
pemberian AlCl3 dibandingkan kalus genotipe Adira 4 (LC20 = 831.88;
LC50 = 2897.10) dan UJ 5 (LC20 dan LC50 belum teridentifikasi hingga
konsentrasi maksimum AlCl3).
Percobaan multiplikasi tunas ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro disusun berdasarkan rancangan kelompok lengkap teracak faktorial
dua faktor pada genotipe Jame-jame dan UJ 5 dan rancangan acak lengkap faktorial dua faktor pada genotipe Gajah. Faktor pertama adalah komposisi media kultur (MS0 dan MS + 3 mg L-1 BAP). Faktor kedua adalah posisi single node
(pangkal, tengah, dan ujung). Hasil percobaan menunjukkan bahwa planlet memberikan respon pertumbuhan berupa tinggi planlet, jumlah daun, dan jumlah buku terbaik jika menggunakan single node bagian tengah dan dikulturkan dalam
media MS0, sedangkan untuk pertumbuhan jumlah tunas terbaik jika menggunakan single node bagian tengah dan dikulturkan dalam media MS +
3 mg L-1 BAP. Berdasarkan analisis uji-t pada parameter tinggi planlet, jumlah buku, dan jumlah tunas, genotipe lokal (Jame-jame dan Gajah) menunjukkan respon pertumbuhan lebih baik dibandingkan varietas nasional (UJ 5). Percobaan aklimatisasi bibit ubi kayu genotipe Jame-jame disusun berdasarkan rancangan acak lengkap satu faktor yaitu periode kultur sebelum aklimatisasi (12, 24, 36, dan 48 minggu sebelum kultur [MSK]). Hasil percobaan menunjukkan bahwa bibit dari periode 12 dan 24 MSK memiliki persentase kehidupan aklimatisasi (80%) lebih tinggi dibandingkan dengan bibit dari periode 36 (50%) dan 48 (40%) MSK. Kata kunci: AlCl3, 2.4-D, embriogenesis somatik, multiplikasi tunas, NAA,
SUMMARY
CANDRA CATUR NUGROHO. Embryogenesis and Organogenesis Study, and Response of Cassava Genotypes on AlCl3. Supervised by NURUL KHUMAIDA and SINTHO WAHYUNING ARDIE.
Cassava (Manihot esculenta Crantz.) is one of carbohydrate producing crops
that is important for food, feed and bio-fuel. Since the import value of wheat based product is increasing year by year in Indonesia, cassava is potentially used to partially substitute the use of wheat as carbohydrate source. The cassava development in Indonesia is constrained by the limited of superior varieties, the difficulty in providing a large number and continuous supply of high quality seedlings, and the limited productive area for cassava planting area expansion. In vitro propagation is an advance technology that can be used for the rapid and mass
propagation of cassava seedlings, as well as to assist the cassava breeding program for high yielding and abiotic stress tolerance traits. The general objective of this research was to obtain the in vitro shoots multiplication protocol on
cassava genotypes through somatic embryogenesis and organogenesis. Specifically, the objectives of this study were to: 1) study the effect type of basal mediums and growth regulators with the type of explants (immature leaves, shoot tips, and petioles) on embryogenic callus formation of cassava genotypes;
research consisted of five experiments, including the induction of embryogenic callus of four cassava genotypes, optimization of embryogenic callus induction of cassava Adira 4 and Gajah genotypes, determination of LC20 and LC50 of AlCl3 on
callus of four cassava genotypes, in vitro shoot multiplication of cassava
Jame-jame, UJ 5, and Gajah genotypes, and acclimatization of cassava seedlings of Jame-jame genotype.
The experiment of embryogenic callus induction of four cassava genotypes was arranged in the completely randomized design with two factors. The first factor was type of explants (immature leaves, shoot tips, and petioles). The second factor was embryogenic callus induction medium consisted of 8 medium compositions. The results showed that immature leaves and shoot tips cultured on the MS + 20 g L-1 sucrose + 8 mg L-1 2.4-D medium and MS + 20 g L-1 sucrose + 10 mg L-1 NAA medium resulted in the highest number and percentage of explants forming callus, fastest initiation of callus, highest callus growth, and highest diameter of callus for UJ 5, Jame-jame, Gajah, and Adira 4 genotypes.
diameter. The use of immature leaves and shoot tips explant showed no significant effect in the induction and growth of callus formation. Callus formed in this experiment was non-embryogenic callus.
The experiment of LC20 and LC50 of AlCl3 determination was arranged in
the completely randomized design with the concentration of AlCl3 (0, 100, 200,
400, 600 and 800 mg L-1) as treatment. Results of in vitro selection showed that
Jame-jame and Gajah genotypes relatively sensitive to aluminum toxicity than Adira 4 and UJ 5 genotypes. It can be seen from the sensitivity of Jame-jame (LC20 = 19.39; LC50 = 236.37) and Gajah (LC20 = 39.99; LC50 = 156.54)
genotypes callus’s to AlCl3 compared to Adira 4 (LC20 = 831.88; LC50 = 2897.10)
and UJ 5 (LC20 and LC50 was not identified since the curve was still linear until
the maximum AlCl3 concentration) genotypes callus’s.
The experiment of in vitro shoot multiplication of cassava was arranged in
the randomized complete block design for Jame-jame and UJ 5 genotypes, while it was arranged in the completely randomized design for Gajah genotype with two factors. The first factor was culture medium (MS0 and MS + 3 mg L-1 BAP) and the second factor was single node positions used as explant (basal, middle, and
top section of the stem). The results showed that based on height of planlet, number of leaves, and the number of nodes, single node at middle position was
the best explants when cultured on MS0 medium, while based on the number of shoots, the single node at middle position was best cultured on MS + 3 mg L-1
BAP medium. Based on t-test analysis on height of planlet, number of nodes, and number of shoots variables, local genotypes (Jame-jame and Gajah) showed better performance than national variety (UJ 5). The experiment of acclimatization of cassava seedlings Jame-jame genotype was arranged in the completely randomized design with culture period prior to acclimatization as treatment. The results showed that seedlings from period of 12 and 24 weeks after culture showed higher survival rates (80%) than seedlings from period of 36 (50%) and 48 (40%) weeks after culture.
Keywords: AlCl3, aluminum toxicity, cassava, culture period, 2.4-D, NAA, shoot
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
STUDI EMBRIOGENESIS DAN ORGANOGENESIS SERTA
RESPON BEBERAPA GENOTIPE UBI KAYU
TERHADAP AlCl
3CANDRA CATUR NUGROHO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Studi Embriogenesis dan Organogenesis serta Respon beberapa Genotipe Ubi Kayu terhadap AlCl3
Nama : Candra Catur Nugroho NIM : A253110161
Disetujui oleh Komisi Pembimbing
Dr Ir Nurul Khumaida, MSi Ketua
Dr Sintho Wahyuning Ardie, SP MSi Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis ini. Tesis yang berjudul ”Studi Embriogenesis dan Organogenesis serta Respon beberapa Genotipe Ubi Kayu terhadap AlCl3” disusun sebagai salah satu syarat kelulusan untuk memperoleh gelar Magister Sains pada Fakultas Pertanian, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr Ir Nurul Khumaida, MSi dan Dr Sintho Wahyuning Ardie, SP MSi selaku komisi pembimbing. Ucapan terima kasih juga penulis sampaikan kepada dosen penguji Dr Ir Agus Purwito, MScAgr dan kepada Ketua Program Studi Pemuliaan dan Bioteknologi Tanaman Dr Ir Yudiwanti Wahyu EK, MS. Di samping itu, ucapan terima kasih penulis sampaikan kepada Bapak Isman Saladin selaku Ketua Masyarakat Singkong Indonesia wilayah Kalimantan Timur dan Dr Ir Dorly, MSi selaku staf pengajar Departemen Biologi-IPB yang telah membantu dalam penelitian. Terima kasih kepada yang tercinta kedua orang tua Bapak Tarmudji dan Ibu Sumartun serta seluruh keluarga atas doa, restu, dan motivasi selama penulis menempuh pendidikan pascasarjana di IPB. Kemudian ucapan terima kasih juga penulis sampaikan kepada seluruh teman-teman di Laboratorium Kultur Jaringan III, teman-teman S2 dan S3 PBT angkatan 2011 atas kebersamaan, doa, dukungan, dan motivasinya selama ini.
Penulis berharap semoga tesis ini dapat menambah wawasan ilmu pengetahuan dan berguna bagi yang memerlukannya.
Bogor, Desember 2014
DAFTAR ISI
Botani dan Deskripsi Tanaman Ubi Kayu (Mannihot esculenta
Crantz.) 7
Kultur Jaringan Tanaman 8
Organogenesis dan Embriogenesis Somatik Ubi Kayu 10 Seleksi In Vitro terhadap Toksisitas Aluminium 12
3 INDUKSI KALUS EMBRIOGENIK BEBERAPA GENOTIPE UBI
KAYU 14
5 MULTIPLIKASI TUNAS UBI KAYU GENOTIPE JAME-JAME, UJ 5,
DAN GAJAH SECARA IN VITRO 41
Abstrak 41
6 AKLIMATISASI BIBIT UBI KAYU GENOTIPE JAME-JAME HASIL
Simpulan 58
7 PEMBAHASAN UMUM 59
8 SIMPULAN DAN SARAN 61
Simpulan 61
Saran 61
DAFTAR PUSTAKA 61
LAMPIRAN 69
DAFTAR TABEL
1. Data luas panen, produktivitas dan produksi ubi kayu nasional 2 2. Deskripsi ubi kayu varietas Adira 4 dan UJ 5 8 3. Komposisi media induksi kalus embriogenik ubi kayu 17 4. Persentase eksplan membentuk kalus pada ubi kayu genotipe UJ 5,
Jame-jame, Gajah, dan Adira 4 saat 4 MSK 20
5. Uji kontras ortogonal terhadap persentase pembentukan kalus ubi
kayu 21
6. Waktu terbentuknya kalus (hari) pada empat genotipe ubi kayu 22 7. Uji kontras ortogonal terhadap waktu terbentuknya kalus (HSK) ubi
kayu 23
8. Skor pertumbuhan kalus ubi kayu genotipe UJ 5, Jame-jame, Gajah,
dan Adira 4 pada 4 MSK 24
9. Diameter kalus (mm) ubi kayu genotipe UJ 5, Jame-jame, Gajah, dan
Adira 4 pada 4 MSK 25
10. Uji kontras ortogonal terhadap diameter kalus ubi kayu pada 4 MSK 26 11. Persentase eksplan membentuk embrio somatik fase globular pada
ubi kayu genotipe UJ 5, Jame-jame, Gajah, dan Adira 4 27 12. Uji kontras ortogonal terhadap persentase eksplan membentuk embrio
somatik 28
13. Skor pertumbuhan kalus ubi kayu genotipe Adira 4 dan Gajah saat
4 MSK 30
14. Diameter kalus (mm) genotipe Adira 4 saat 4 MSK 30 15. Diameter kalus (mm) genotipe Gajah saat 4 MSK pada media I7 31 16. Diameter kalus (mm) ubi kayu genotipe Jame-jame, UJ 5, Adira 4,
dan Gajah 37
17. Skor kematian kalus ubi kayu genotipe Jame-jame, UJ 5, Adira 4, dan
Gajah 38
18. Nilai LC20 dan LC50 AlCl3 pada kalus ubi kayu genotipe Jame-jame,
UJ 5, Adira 4, dan Gajah 39
19. Waktu munculnya tunas (hari) pada beberapa genotipe ubi kayu 45 20. Jumlah daun planlet ubi kayu genotipe UJ 5 dan Jame-jame 46 21. Jumlah daun planlet ubi kayu genotipe Gajah 46 22. Tinggi planlet (cm) ubi kayu genotipe Jame-jame dan Gajah 47 23. Jumlah tunas planlet ubi kayu genotipe Jame-jame dan Gajah 48 24. Jumlah buku planlet ubi kayu genotipe Gajah 49 25. Hasil analisis uji-t tinggi planlet, jumlah buku, dan jumlah tunas
genotipe lokal terhadap varietas nasional 51
26. Korelasi antar peubah gabungan tiga genotipe 51
1. Kerangka berpikir perbanyakan bibit ubi kayu 5 2. Diagram alir pelaksanaan penelitian studi embriogenesis dan
organogenesis ubi kayu. 6
3. Tahapan pembentukan embrio somatik pada tanaman ubi kayu: (a) Tunas apikal pada media induksi; (b) embrio somatik primer pada fase globular setelah dikulturkan 10 hari di media induksi; (c) fase torpedo dan kotiledon setelah dikulturkan 21 hari di media induksi; (d) kotiledon hijau pada embrio somatik primer; (e) induksi embrio somatik sekunder setelah 10 hari inkubasi dari kotiledon somatik pada media induksi; (f) fase torpedo dan kotiledon pada embrio somatik sekunder setelah
dikulturkan 21 hari di media induksi 12
4. Eksplan yang digunakan: (D) daun muda, (P) petiol, dan (T) tunas pucuk
dengan ukuran ± 4-5 mm 16
5. Skor pertumbuhan kalus: (a) Skor 1, (b) Skor 2, (c) Skor 3, (d) Skor 4, dan (e) Skor 5 pada eksplan daun muda genotipe Jame-jame 17 6. Kondisi rak kultur: (a) penambahan 2 buah lampu pijar pada perlakuan
suhu 25-27 0C dan (b) inkubasi di rak tertutup tanpa cahaya 18 7. Struktur kalus ubi kayu genotipe Adira 4 dari eksplan (a) daun muda, (b)
tunas pucuk, dan (c) petiol saat 4 MSK 23
8. Kalus embriogenik ubi kayu genotipe Adira 4 saat 4 MSK. 27 9. Waktu muncul kalus ubi kayu genotiope Adira 4 29
10. Waktu muncul kalus ubi kayu genotipe Gajah 29
11. Kalus ubi kayu genotipe Adira 4 (a-d) dan Gajah (e-h): (a dan e) daun muda pada suhu 21-23 ⁰C, (b dan f) tunas pucuk pada suhu 21-23 ⁰C, (c dan g) daun muda pada suhu 25-27 ⁰C, (d dan h) tunas
pucuk pada suhu 25-27 ⁰C 31
12. Skor perubahan warna kalus ubi kayu 35
13. Kalus hasil seleksi in vitro menggunakan AlCl3 pada genotipe
Adira 4 (a-c) dan Jame-jame (d-f) di media: (a dan d) MS + 0 mg L-1 AlCl3, (b dan e) MS + 400 mg L-1 AlCl3, (c dan f) MS + 800 mg L-1
AlCl3 saat 12 MSK 36
14. Kurva respon LC20 dan LC50 terhadap perlakuan konsentrasi AlCl3
pada kalus ubi kayu genotipe: (a) Jame-jame, (b) Adira 4, dan (c) Gajah 39 15. Eksplan buku tunggal (single node) ubi kayu genotipe Jame-jame 43
16. Posisi buku tunggal (single node) ubi kayu genotipe Jame-jame 43
pangkal di media MS0, (b) single node tengah di media MS0, dan (c)
single node ujung di media MS0 50
21. Skema periode kultur planlet ubi kayu sebelum diaklimatisasi 55 22. Persentase tanaman hidup ubi kayu genotipe Jame-jame saat 8 MSA 56 23. Morfologi tanaman ubi kayu genotipe Jame-jame: (a) tanaman hasil
aklimatisasi saat 8 MSA, (b) helai daun umur 10 hari dari tanaman hasil aklimatisasi, (c) helai daun umur 10 hari dari tanaman di lapangan, (d) karakteristik stomata daun hasil aklimatisasi, dan (e) karakteristik
stomata daun di lapangan 56
24. Tinggi tanaman ubi kayu genotipe Jame-jame hasil aklimatisasi 57 25. Jumlah daun total tanaman ubi kayu genotipe Jame-jame hasil
aklimatisasi 57
DAFTAR LAMPIRAN
1. Deskripsi ubi kayu genotipe Jame-jame 70
2. Deskripsi ubi kayu genotipe Gajah 71
3. Penelitian organogenesis ubi kayu di Indonesia dan di mancanegara 72 4. Penelitian embriogenesis somatik ubi kayu di Indonesia dan di
mancanegara 74
5. Komposisi media Murashige-Skoog (MS) 76
6. Komposisi media Gresshoff and Doy (GD) 77
7. Komposisi media MS modifikasi 78
8. Tinggi planlet (cm) ubi kayu genotipe UJ 5 79
9. Jumlah tunas ubi kayu genotipe UJ 5 79
1 PENDAHULUAN
Latar Belakang
Sampai saat ini Indonesia masih mengimpor tepung terigu dan produk gandum untuk memenuhi kebutuhan tepung terigu di dalam negeri dengan nilai impor yang menempati urutan pertama untuk produk pertanian dan pangan. Nilai impor terigu dan produk gandum pada tahun 2006 sampai dengan 2009, berturut-turut mencapai 816.12 juta US$, 1 181.3 juta US$, 1 975.5 juta US$, dan 1 316.1 juta US$. Bahkan devisa negara yang dikeluarkan untuk mengimpor tepung terigu dan produk gandum pada tahun 2010 mencapai 1 424.3 juta US$ (FAO 2011). Nilai impor tepung terigu dan produk gandum yang sangat besar ini diantaranya disebabkan oleh a) perubahan pola konsumsi masyarakat yang lebih menyukai pangan olahan berbahan baku terigu, b) ketersediaan teknologi pangan berbahan baku terigu,c) keterbatasan/kendala budidaya tanaman gandum di wilayah tropika dan belum tersedianya varietas yang adaptif, dan d) sumber pangan lokal pengganti (substitusi) tepung gandum belum digali dengan maksimal, serta e) arah dan kebijakan diversifikasi pangan seyogyanya lebih pada pemanfaatan bahan pangan lokal.
Indonesia terkenal sebagai negara yang memiliki keanekaragaman hayati sangat besar, yang memberikan peluang besar untuk menggali potensi sumber daya pangan lokal dan memanfaatkannya sebagai bahan baku substitusi tepung terigu. Kelompok tanaman umbi-umbian memiliki potensi besar untuk dikembangkan sebagai sumber karbohidrat, seperti ubi kayu, ubi jalar, talas-talasan, iles-iles, gadung, garut, dan ganyong. Melimpahnya ketersedian bahan baku sumber pangan di Indonesia merupakan kekuatan dalam mempertahankan ketahanan pangan dalam negeri. Akan tetapi, menurut Suryana (2009) pola konsumsi pangan penduduk Indonesia telah bergeser menjadi pola beras – terigu. Akibatnya proses penggalian dan pemanfaatan potensi pangan lokal khususnya sumber pangan karbohidrat lain menjadi berkurang.
Ubi kayu (Manihot esculenta Crantz.) memiliki prospek pemanfaatan dan
pengembangan yang besar. Ubi kayu banyak dimanfaatkan sebagai bahan makanan, selain itu ubi kayu juga dimanfaatkan sebagai bahan baku industri terutama industri pellet atau pakan ternak dan industri pengolahan tepung. Ubi
kayu juga dapat dimanfaatkan untuk dijadikan bahan baku pembuatan bioetanol (Purwanti 2008).
Tabel 1. Data luas panen, produktivitas dan produksi ubi kayu nasional Tahun Luas panen (ha) Produktivitas (ton ha-1) Produksi (ton)
2009 1 175 666 18.75 22 039 145
Keterangan: * = data tahun 2014 merupakan angka ramalan I Sumber: BPS (2014)
Teknik perbanyakan bibit ubi kayu secara in vitro perlu dilakukan karena
belum ada lembaga atau perusahaan penghasil stek (bibit) asal in vitro dalam
jumlah besar dan memiliki kejelasan varietas. Selain itu, adanya perluasan areal tanam ubi kayu menuntut adanya penyediaan bibit unggul dan bermutu dalam jumlah besar. Bibit unggul yang dihasilkan dari kultur jaringan umumnya bebas dari patogen dan dapat dijadikan sebagai mother stock.
Penelitian perbanyakan dan perbaikan tanaman ubi kayu melalui teknik kultur jaringan telah banyak dilakukan. Penelitian yang dilakukan mencakup penelitian tentang pembentukan tunas baru (multiplikasi tunas) dan pembentukan kalus embriogenik (Hankoua et al. 2006; Onuoch dan Onwubiku 2007; Feitosa et al. 2007; Rossin dan Rey 2011; Wongtiem et al. 2011; Mapayi et al. 2013).
Penelitian perbaikan tanaman ubi kayu di Afrika dan negara Amerika Latin difokuskan terhadap perbaikan genotipe atau varietas yang tahan terhadap hama dan penyakit (Mushiyimana et al. 2011; Cacai et al. 2013a). Perbaikan sifat ubi
kayu yang telah dilakukan di Indonesia yaitu peningkatan kandungan nutrisi pada umbi seperti jenis protein tertentu, komponen lain seperti fosfor dan rasio antara amilosa dan amilopektin (Sudarmonowati et al. 2002).
Keragaman somaklonal dalam kultur in vitro dapat menghasilkan
individu-individu baru sebagai dampak dari instabilitas somatik selama pengkulturan. Keragaman dapat dipacu bila kultur in vitro diinduksi dengan mutagen fisik atau
kimiawi pada populasi sel yang embriogenik. Regenerasi sel embriogenik membentuk tanaman melalui embriogenesis somatik memberikan peluang yang tinggi untuk mendapatkan varian yang diinginkan karena propagul yang dihasilkan sangat banyak jumlahnya (Ammirato 1987).
Variasi somaklonal yang diperoleh melalui embriogenesis somatik dapat digunakan sebagai materi seleksi in vitro dengan menggunakan media seleksi
yang sesuai sehingga diperoleh somaklon dengan sifat yang diinginkan. Peran seleksi in vitro dalam program pemuliaan tanaman adalah mempercepat waktu
seleksi (Jain 2001). Seleksi in vitro bisa diterapkan pada berbagai kondisi
cekaman abiotik misalnya cekaman terhadap aluminium. Seleksi ini biasanya menggunakan agen seleksi AlCl3. AlCl3 digunakan untuk menyeleksi varian
Tujuan
Tujuan umum penelitian ini adalah mendapatkan protokol perbanyakan tunas beberapa genotipe ubi kayu secara in vitro melalui jalur embriogenesis somatik
dan organogenesis. Secara khusus, penelitian ini bertujuan untuk:
1. Mempelajari pengaruh berbagai jenis media dasar dan zat pengatur tumbuh dengan jenis eksplan daun muda, tunas pucuk, dan petiol terhadap pembentukan kalus embriogenik pada beberapa genotipe ubi kayu.
2. Mendapatkan media induksi kalus embriogenik optimum pada beberapa genotipe ubi kayu.
3. Mendapatkan nilai LC20 dan LC50 AlCl3 pada kalus yang diuji.
4. Mempelajari penggunaan jenis media kultur dan posisi single node
(pangkal, tengah, dan ujung) terhadap pertumbuhan dan multiplikasi planlet ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro.
Hipotesis
Hipotesis dalam penelitian ini adalah:
1. Kalus embriogenik dapat diinduksi dari eksplan daun muda, tunas pucuk, dan petiol beberapa genotipe ubi kayu.
2. Terdapat media induksi kalus embriogenik yang optimal pada masing-masing genotipe ubi kayu.
3. Terdapat jenis media kultur yang optimum untuk pertumbuhan dan multiplikasi planlet ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro.
4. Terdapat posisi single node yang optimum untuk pertumbuhan dan multiplikasi
planlet ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro.
5. Terdapat interaksi antara jenis media kultur dan posisi single node yang
optimum untuk pertumbuhan dan multiplikasi planlet ubi kayu genotipe Jame-jame, UJ 5, dan Gajah secara in vitro.
Ruang Lingkup Penelitian
Ubi kayu merupakan salah satu tanaman penghasil karbohidrat yang dapat dimanfaatkan sebagai sumber substitusi tepung terigu. Pemanfaatan ubi kayu sebagai sumber substitusi tepung terigu dilakukan karena tingginya nilai impor tepung terigu dan produk gandum dari tahun ke tahun. Kondisi seperti ini menuntut dilakukannya program peningkatan produksi ubi kayu. Akan tetapi, peningkatan produksi ubi kayu di lapangan mengalami beberapa kendala, diantaranya adalah membutuhkan bibit (stek batang) unggul dan bermutu dalam jumlah besar dan seragam serta perluasan areal tanam menggunakan lahan marginal seperti lahan bertanah masam karena semakin berkurangnya lahan subur (produktif) di Indonesia. Oleh sebab itu, diperlukan teknologi perbanyakan ubi kayu secara in vitro. Perbanyakan bibit ubi kayu secara in vitro dapat dilakukan
melalui jalur embriogenesis somatik dan organogenesis yang hasil akhirnya adalah tersedianya bibit yang bermutu, seragam, dan true to type dalam jumlah
besar dan dalam waktu cepat. Melalui jalur organogenesis, planlet yang dihasilkan nantinya selain sebagai mother stock juga digunakan sebagai bahan tanam
diikuti oleh seleksi in vitro hasil akhirnya berupa varietas toleran terhadap lahan
bertanah masam. Kerangka berpikir perbanyakan bibit ubi kayu disajikan pada Gambar 1.
Penelitian diawali dengan sterilisasi potongan tunas samping ubi kayu untuk menghasilkan kultur asenik. Daun muda, tunas pucuk, dan petiol in vitro dijadikan
sebagai eksplan pada percobaan 1a yang akan dikulturkan pada delapan jenis media induksi kalus embriogenik (KE). Selanjutnya, jenis eksplan dari genotipe-genotipe yang memiliki respon baik pada media induksi akan dilanjutkan dengan mengkulturkannya pada media proliferasi dan pendewasaan KE. Tahap selanjutnya embrio somatik diregenerasikan menjadi planlet, kemudian dilakukan proses aklimatisasi pada planlet yang terbentuk. Selama penelitian berlangsung, proliferasi KE kurang berhasil karena sebagian besar KE yang dikulturkan mati atau kembali lagi membentuk kalus non-embriogenik sehingga penelitian ini hanya sampai pada tahapan induksi KE. Kegiatan optimasi induksi kalus embriogenik dilakukan pada percobaan 1b. Optimasi dilakukan dengan menggunakan media dan jenis eksplan terbaik yang responsif membentuk KE berdasarkan hasil percobaan 1a. Penanaman eksplan dilakukan pada dua kondisi suhu ruangan kultur yang berbeda (±21-23 0C dan ±25-27 0C).
Kegiatan penentuan lethal concentration 20 (LC20) dan LC50 dalam rangka
seleksi in vitro terhadap toksisitas aluminium dengan menggunakan agen seleksi
AlCl3 dilakukan pada percobaan 2. Bahan tanam yang digunakan adalah kalus
genotipe Jame-jame, Adira 4, UJ 5, dan Gajah. Media seleksi yang digunakan adalah media MS + 3 mg L-1 BAP, dengan penambahan AlCl3 (0, 100, 200, 400,
600, dan 800 mg L-1 ) pada pH rendah (4.0).
Kegiatan multiplikasi tunas ubi kayu secara in vitro dilakukan pada
percobaan 3. Bahan tanam yang digunakan yaitu single node dengan berbagai
posisi (pangkal, tengah, dan ujung) pada genotipe Jame-jame, UJ 5, dan Gajah. Eksplan single node dikulturkan dalam media MS0 dan MS + 3 mg L-1 BAP.
Aklimatisasi bibit ubi kayu hasil perbanyakan secara in vitro dilakukan pada
Gambar 1. Kerangka berpikir perbanyakan bibit ubi kayu Peningkatan jumlah penduduk peningkatan konsumsi karbohidrat
Nilai impor gandum meningkat
Solusi: mencari sumber karbohidrat lain ubi kayu
Kendala dalam perbanyakan ubi kayu di lapangan:
Membutuhkan bibit (stek batang) unggul dan bermutu dalam jumlah besar dan seragam.
Berkurangnya tanah subur (produktif) di Indonesia memanfaatkan lahan marginal misalnya lahan masam perlu varian putatif ubi kayu toleran lahan masam
Teknologi perbanyakan bibit secara in vitro
Embriogenesis somatik Organogenesis
Varian somaklon
Seleksi in vitro dengan AlCl3
Regenerasi menjadi planlet
Regenerasi menjadi planlet
Perbanyakan untuk menghasilkan
mother stock planlet
Aklimatisasi planlet
Varian putatif ubi kayu toleran lahan masam
Produksi stek mikro generasi ke-1 hingga generasi ke-n (G1-Gn) Teknologi perbaikan tanaman
secara in vitro
Peningkatan jumlah penduduk peningkatan konsumsi karbohidrat
Nilai impor gandum meningkat
Solusi: mencari sumber karbohidrat lain ubi kayu
Kendala dalam perbanyakan ubi kayu di lapangan:
Membutuhkan bibit (stek batang) unggul dan bermutu dalam jumlah besar dan seragam.
Berkurangnya tanah subur (produktif) di Indonesia memanfaatkan lahan marginal misalnya lahan masam perlu varian putatif ubi kayu toleran lahan masam
Gambar 2. Diagram alir pelaksanaan penelitian studi embriogenesis dan organogenesis ubi kayu. Tanda artinya tahapan kegiatan yang dikerjakan berkelanjutan; artinya tahapan kegiatan yang tidak berhubungan secara langsung atau kegiatan yang tidak dikerjakan dalam penelitian.
2 TINJAUAN PUSTAKA
Botani dan Deskripsi Tanaman Ubi Kayu (Mannihot esculenta Crantz.)
Ubi kayu merupakan tanaman yang mudah ditanam, dapat tumbuh di berbagai lingkungan agroklimat tropis. Secara umum tanaman ini tidak menuntut iklim yang spesifik untuk pertumbuhannya. Namun demikian ubi kayu akan tumbuh baik pada curah hujan 750−1 000 mm tahun-1, suhu 25−28 ºC, dan pH tanah 4.5−8 (LIPTAN BIP Irian Jaya 1995).
Ubi kayu termasuk dalam famili Euphorbiaceae yang mempunyai 7 200 spesies, beberapa di antaranya mempunyai nilai komersial, seperti karet (Hevea brasiliensis), jarak (Ricinus comunis dan Jatropha curcas), umbi-umbian
(Manihot spp.), dan tanaman hias (Euphorbia spp.). Klasifikasi taksonomi
tanaman ubi kayu sebagai berikut (IPNI 2014): Kelas : Dicotyledoneae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Manihot
Spesies : Manihot esculenta Crantz.
Ubi kayu (Manihot esculenta Crantz.) adalah tanaman daerah tropik yang
dapat tumbuh di berbagai kondisi tanah, bahkan pada tanah yang tidak subur sekalipun (Priadi et al. 2004). Perbanyakan ubi kayu umumnya dilakukan secara
vegetatif sehingga vigor dan produktivitasnya dapat dipertahankan (Roca et al.
2000). Umbi ubi kayu mengandung sumber karbohidrat (termasuk pati) untuk pangan dan pakan serta untuk bahan baku berbagai macam industri.
Tabel 2. Deskripsi ubi kayu varietas Adira 4 dan UJ 5
Keterangan Varietas
Adira 4 UJ 5
Tahun pelepasan 1993 2000
Tetua persilangan bebas, induk betina
BIC 528 (Muara) introduksi Thailand
Rataan hasil 35 ton ha-1 25-38 ton ha-1
Keterangan kualitas rebus bagus tetapi agak pahit
bentuk umbi mencengkeram Sumber: Pusat Penelitian dan Pengembangan Tanaman Pangan (2011)
Kultur Jaringan Tanaman
Salah satu cara perbanyakan tanaman secara vegetatif adalah melalui kultur jaringan. Kultur jaringan merupakan suatu teknik untuk mengisolasi bagian dari tanaman seperti protoplas, sel, sekelompok sel, jaringan, dan organ serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Tujuan pokok dari perbanyakan mikro ini adalah memproduksi tanaman dalam jumlah besar dalam waktu yang singkat (Gunawan 1992; Wattimena et al. 2011). Kultur
jaringan tanaman bisa menghasilkan tanaman dalam jumlah besar dan relatif seragam (Conger 1980). Penerapan teknik kultur jaringan tanaman telah berkembang lebih luas lagi yakni untuk perbanyakan massal tanaman yang unik, perakitan tanaman transgenik, sebagai sistem model dalam fisiologi sel tanaman, penyelamatan tanaman langka, dan rekayasa metabolisme senyawa kimia tertentu (Loyola-Vargas dan Vázquez-Flota 2006).
Prinsip dasar kultur jaringan adalah teori totipotensi. Totipotensi merupakan potensi suatu sel untuk dapat tumbuh menjadi tanaman lengkap dan dewasa bila ditempatkan dalam lingkungan yang sesuai, karena dalam tiap sel terkandung rangkaian gen yang lengkap (Wetherell 1982). Keberhasilan dari teknik kultur jaringan ini antara lain dipengaruhi oleh bagian organ tanaman yang diperlukan, cara sterilisasi, komposisi media tumbuh yang dipakai dan keadaan lingkungan.
Eksplan adalah potongan dari jaringan atau organ suatu tanaman untuk tujuan perbanyakan. Faktor-faktor yang mempengaruhi keberhasilan perbanyakan dengan eksplan adalah genotipe eksplan, ukuran eksplan, jaringan asal eksplan dan umur fisiologi eksplan (Conger 1980). Wetherell (1982) menambahkan bahwa untuk keberhasilan perbanyakan secara in vitro sebaiknya tanaman yang
Media tempat sel, organ, jaringan tersebut tumbuh sangat penting artinya dalam kultur jaringan karena seluruh hara dan zat pengatur tumbuh (ZPT) yang diperlukan untuk pertumbuhan dan perkembangan diperoleh dari media. Menurut Paul (1972) media merupakan faktor penting untuk mengkulturkan sel dan jaringan. Selanjutnya Thomas dan Davey (1975) menambahkan bahwa pertumbuhan dan morfologi suatu jaringan berhubungan dengan komposisi media kultur, taraf konsentrasi hormon pertumbuhan, eksplan yang digunakan serta spesies tanaman tersebut.
Media tanam mengandung komposisi hara esensial makro, mikro, sumber energi, vitamin, asam amino, ZPT, bahan organik dan bahan tambahan lain. Menurut Gunawan (1992), unsur hara makro terdiri atas nitrogen yang berfungsi dalam sintesis asam amino, protein, asam nukleat, berbagai koenzim, dan sebagai konstituen molekul klorofil. Fosfor merupakan komponen dari gula fosfat asam nukleat, nukleotida, koenzim dan fosfolipid. Selain itu fosfor juga berpengaruh pada petumbuhan akar dan pendewasaan tanaman. Kalium berperan sebagai pengatur sistem koenzim yang selanjutnya menentukan sistem fotosintesis, respirasi, metabolisme karbohidrat, dan translokasi. Kalsium berperan sebagai bahan pengisi dinding sel dan juga mempengaruhi tingkat hormon tanaman yang digunakan untuk mendetoksifikasi keracunan oleh unsur lain terutama hara mikro. Magnesium merupakan inti dari klorofil yang memegang peranan penting dalam fotosintesis dan sebagai aktivator enzim.
Media yang digunakan disesuaikan dengan jenis tanaman yang digunakan serta tujuan akhir yang diharapkan dari eksplan yang ditumbuhkan secara in vitro
(Chawla 2002). Salah satu media yang sering digunakan adalah media MS (Murashige and Skoog). Komposisi media MS dibuat untuk kultur kalus
tembakau, tetapi komposisi MS ini pada umumnya mendukung kultur jaringan tanaman lain (Gunawan 1992).
Media lain yang banyak digunakan diantaranya adalah media KC (Knudson C), VW (Vacin dan Went), Gamborg (B5), WPM (Wood Plant Media), dan GD (Gresshoff and Doy). Media KC dan VW sangat baik digunakan untuk perkecambahan biji anggrek (Chawla 2002). Media B5 umumnya digunakan untuk menumbuhkan jaringan kedelai dan menumbuhkan sel bermacam-macam varietas tanaman. Media WPM digunakan terutama untuk tanaman berkayu (Wetter dan Constabel 1991). Media GD digunakan salah satunya untuk menginduksi kalus embriogenik pada tanaman ubi kayu (Taylor et al. 2001).
Teknik perbanyakan secara kultur jaringan biasanya menggunakan zat pengatur tumbuh (ZPT) untuk merangsang percepatan dan pertumbuhan eksplan. Peranan ZPT sangat besar dalam perbanyakan secara kultur jaringan (Wattimena 1988). Menurut Abidin (1994), ZPT merupakan bahan organik (bukan hara) yang dalam jumlah kecil dapat meningkatkan, menghambat, atau memodifikasi proses biologi tanaman. Zat yang dihasilkan secara alami oleh tanaman disebut dengan hormon tanaman atau fitohormon. Menurut Arteca (1996) dan Davies (2004), hormon tanaman adalah sekelompok senyawa organik alami yang mempengaruhi proses-proses fisiologi tanaman dalam konsentrasi rendah.
dalam pertumbuhan tanaman tergantung pada jenis, struktur kimia, konsentrasi, genotipe tanaman serta fase fisiologi tanaman (Satyavathi et al. 2004).
Auksin merupakan salah satu ZPT yang sangat luas digunakan dalam kultur jaringan tanaman. Auksin umumnya berperan dalam merangsang pemanjangan sel, terutama di daerah meristem, pembelahan sel dan pembentukan akar adventif. Auksin berpengaruh pula untuk menghambat pembentukan tunas adventif dan tunas aksilar, namun kehadirannya dibutuhkan dalam meningkatkan embriogenesis somatik pada kultur suspensi sel. Konsentrasi auksin yang rendah meningkatkan pembentukan akar adventif, sedangkan konsentrasi auksin yang tinggi merangsang pembentukan kalus, mencegah morfogenesis, mempercepat dan memperbanyak jumlah embrio somatik yang terbentuk (Pierik 1997). Indole Acetic Acid (IAA) adalah auksin alamiah pada tumbuhan, disintesis dari triptofan
di primordia daun, daun muda, dan biji yang sedang berkembang (Wattimena dan Mattjik 1992). Auksin sintetik yang sering digunakan dalam kultur jaringan tanaman adalah 2.4-D, NAA, IBA, 4-CPA, 2.4.5-T, Dicamba, dan Picloram (Abidin 1994).
Peran auksin pada embriogenesis somatik antara lain untuk inisiasi embriogenesis somatik, induksi kalus embriogenik, proliferasi kalus embriogenik dan induksi embrio somatik (Utami et al. 2007). Berbagai hasil penelitian
menunjukkan bahwa 2.4-D merupakan auksin yang efektif untuk induksi kalus embriogenik. Di samping auksin, sering pula diberikan sitokinin seperti benzyl amino purine (BAP) atau kinetin secara bersamaan (Bhojwani dan Razdan 1996).
Organogenesis dan Embriogenesis Somatik Ubi Kayu
Perbanyakan tanaman melalui kultur jaringan dapat ditempuh melalui dua jalur, yaitu organogenesis dan embriogenesis somatik. Organogenesis adalah suatu proses membentuk dan menumbuhkan tunas dari jaringan meristematik (Gunawan 1992; Pardal 2002). Menurut Wattimena (2006), regenerasi eksplan menjadi organ dan planlet dapat diperoleh melalui jalur organogenesis langsung dan organogenesis tidak langsung. Organogenesis langsung terjadi tanpa melalui pembentukan kalus, sedangkan organogenesis tidak langsung diawali dengan pembentukan kalus, lalu muncul organ pada kalus.
Hartmann et al. (1990) menyatakan bahwa organogenesis merupakan proses
yang menginduksi pembentukan jaringan dari sel atau kalus menjadi tunas, tunas adventif atau akar hingga akhirnya menjadi tanaman lengkap yang sempurna. Menurut Zhang dan Lemaux (2004), pada kultur in vitro organogenesis tunas
Embrio tumbuhan terbentuk melalui proses embriogenesis, baik sebagai kelanjutan dari proses pembuahan (embrio zigotik) maupun melalui proses induksi dari sel-sel somatik (embrio somatik). Terdapat beberapa tahap yang dapat diamati secara visual pada saat perkembangan embrio, yaitu fase globular, triangular, hati, dan torpedo. Tahap perkembangan selanjutnya setelah terbentuk kotiledon adalah tahap maturasi dan germinasi (George et al. 2008).
Embriogenesis somatik adalah proses pembentukan embrio tanpa melalui fusi gamet, tetapi berkembang dari sel somatik (William dan Maheswara 1986). Sementara itu menurut Zulkarnain (2009), embriogenesis somatik adalah proses perkembangan embrio lengkap dari sel-sel vegetatif atau sel-sel somatik yang diperoleh dari berbagai sumber eksplan yang inisiasi dan diferensiasinya tidak melibatkan proses seksual. Embrio somatik dapat dicirikan dari strukturnya yang bipolar, yaitu mempunyai calon meristem akar dan meristem tunas. Sifat perakaran yang dihasilkan akan sama dengan bibit asal biji. Mikropropagasi melalui embriogenesis somatik banyak mendapat perhatian karena jumlah propagula yang dihasilkan tidak terbatas dan dapat diperoleh dalam waktu lebih singkat. Regenerasi tumbuhan melalui embriogenesis somatik lebih menguntungkan dari organogenesis, karena tumbuhan yang diregenerasikan dari embrio somatik dapat berkembang dari sel tunggal, sehingga mengurangi variasi somaklonal (Endress 1997).
Tahapan dalam proses embriogenesis somatik adalah induksi kalus embriogenik, pendewasaan, perkecambahan, dan hardening (tahap aklimatisasi)
(Purnamaningsih 2002). Pada tahap induksi kalus embriogenik, kultur umumnya ditumbuhkan pada media yang mengandung auksin yang mempunyai daya aktivitas kuat atau dengan konsentrasi tinggi dibandingkan keperluan auksin pada pertumbuhan sel normal (Kiyosuke et al. 1993). Tahap pendewasaan adalah
tahap perkembangan dari struktur globular membentuk kotiledon dan primordial akar. Beberapa hasil penelitian menunjukkan bahwa tahap pendewasaan adalah tahap yang paling sulit. Pada tahap ini sering digunakan media tanpa auksin (Pierik 1997), media dengan konsentrasi auksin rendah (Purnamaningsih 2002), atau media dengan konsentrasi auksin dan sitokinin yang sangat rendah (Ammirato 1987) karena dapat menginduksi pembentukan embrio bipolar yang selanjutnya berkembang membentuk planlet. Tahapan pembentukan embrio somatik dari tunas apikal tanaman ubi kayu telah dilaporkan oleh Feitosa et al.
(2007) (Gambar 3).
Gambar 3. Tahapan pembentukan embrio somatik pada tanaman ubi kayu: (a) Tunas apikal pada media induksi; (b) embrio somatik primer pada fase globular setelah dikulturkan 10 hari di media induksi; (c) fase torpedo dan kotiledon setelah dikulturkan 21 hari di media induksi; (d) kotiledon hijau pada embrio somatik primer; (e) induksi embrio somatik sekunder setelah 10 hari inkubasi dari kotiledon somatik pada media induksi; (f) fase torpedo dan kotiledon pada embrio somatik sekunder setelah dikulturkan 21 hari di media induksi (Feitosa et al.
2007).
Seleksi In Vitro terhadap Toksisitas Aluminium
Lahan marginal di Indonesia sebagian besar berupa tanah masam. Tanah masam pada pH dibawah 4.2 memiliki unsur hara yang sedikit serta menyebabkan keracunan aluminium (Al) bagi tanaman sehingga pertumbuhan tanaman menjadi tidak subur (Sanchez 1992). Strategi pengembangan suatu varietas pada tanah masam dilakukan dengan mengembangkan tanaman yang toleran atau mampu menghindari pengaruh toksisitas Al.
Seleksi in vitro adalah teknik yang sangat berguna untuk menghasilkan
somaklon yang mempunyai karakteristik tertentu. Melalui seleksi in vitro,
intensitas seleksi yang lebih besar dan lebih homogen dapat diberikan ke populasi sel dan jaringan tanaman sehingga dapat meningkatkan efisiensi didapatkannya varian tanaman yang diinginkan (Widholm 1996). Menurut Wenzel dan Fouroughi-Wehr (1993) seleksi in vitro mempunyai beberapa keuntungan yaitu
tidak terlalu dipengaruhi lingkungan, memungkinkan untuk melakukan seleksi dalam tingkat sel dengan memberi perlakuan tunggal yaitu perlakuan aluminium.
kemampuan regenerasinya (Biswas et al. 2002). Menurut Mariska et al. (2004),
3 INDUKSI KALUS EMBRIOGENIK BEBERAPA GENOTIPE
UBI KAYU
Abstrak
Embriogenesis somatik merupakan salah satu tahapan penting dalam perbanyakan dan perbaikan tanaman ubi kayu. Percobaan ini bertujuan untuk menginduksi terbentuknya embrio somatik dari eksplan daun muda, tunas pucuk, dan petiol pada delapan jenis media induksi kalus embriogenik. Penelitian terdiri atas empat percobaan yang terpisah, masing-masing menggunakan genotipe UJ 5, Jame-jame, Gajah, and Adira 4 sebagai bahan tanam (eksplan). Hasil percobaan menunjukkan bahwa eksplan daun muda dan tunas pucuk yang dikulturkan dalam media MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D dan MS + 20 g L-1 sukrosa + 10 mg L-1 NAA memberikan jumlah dan persentase eksplan membentuk kalus tertinggi, waktu muncul kalus tercepat, pertumbuhan kalus tertinggi, dan diameter kalus tertinggi. Hasil percobaan ini digunakan sebagai acuan untuk percobaan optimasi pembentukan kalus embriogenik ubi kayu genotipe Adira 4 dan Gajah. Hasil percobaan optimasi menunjukkan bahwa interaksi suhu ruang kultur dan jenis eksplan berpengaruh nyata terhadap waktu muncul kalus, skor pertumbuhan kalus, dan diameter kalus. Suhu 25-27 ⁰C mampu menginduksi pembentukan dan pertumbuhan kalus ubi kayu genotipe Adira 4 dan Gajah lebih baik dibandingkan suhu 21-23 ⁰C. Penggunaan jenis eksplan daun muda dan tunas pucuk tidak menunjukkan perbedaan signifikan terhadap induksi pembentukan dan pertumbuhan kalus.
Kata kunci: 2.4-D, embriogenesis somatik, NAA, optimasi, ubi kayu Abstract
Somatic embryogenesis is one of the important steps in the in vitro propagation
and crop improvement of cassava. The experiment was aimed to induce the percentage of explants forming callus, fastest initiation of callus, highest callus growth, and highest diameter of callus. The results of this experiment were used as a reference for optimization experiments embryogenic callus of cassava Adira 4 and Gajah genotypes. The optimization result showed that the interaction of temperature and type of explant significantly affected the time of callus initiation, callus growth score, and callus diameter. 25-27 ⁰C temperature treatment was able to induce callus formation and growth of cassava Adira 4 and Gajah genotypes better than 21-23 ⁰C temperature. The use of immature leaves and shoot tips explant showed no significant effect in the induction and growth of callus formation.
Pendahuluan
Ubi kayu (Manihot esculenta Crantz.) merupakan salah satu jenis tanaman
pangan tropis penting yang dimanfaatkan untuk konsumsi pangan manusia, pakan ternak dan bahan baku industri. Penelitian mengenai embriogenesis somatik ubi kayu telah banyak dilaporkan baik di dalam negeri (Sudarmonowati dan Henshaw 1996; Priadi dan Sudarmonowati 2006) maupun luar negeri (Ibrahim et al. 2008;
Osorio et al. 2012; Opabode et al. 2014; Vidal et al. 2014). Namun demikian,
penelitian embriogenesis somatik ini belum diaplikasikan untuk perbanyakan skala luas karena frekuensi induksi kalus dan regenerasinya relatif rendah (Wongtiem et al. 2011).
Penelitian in vitro ubi kayu difokuskan diantaranya pada propagasi klonal
dan teknologi transformasi genetik untuk memperoleh sifat-sifat yang diinginkan (Thro et al. 1999). Jaringan embriogenik telah digunakan sebagai target
transformasi genetik maupun regenerasi tanaman ubi kayu transgenik (Taylor
et al. 2001). Kalus embriogenik adalah materi yang efektif untuk transformasi
genetik melalui teknik particle bombardment maupun Agrobacterium.
Joseph et al. (2000) juga menggunakan kalus embriogenik sebagai bahan
penelitian induksi mutasi pada Manihot glaziovii Muell. Arg. melalui iradiasi
sinar gamma. Eksplan yang berasal dari jaringan somatik seperti tunas pucuk dan daun juga dapat digunakan untuk inisiasi sistem regenerasi tanaman yang efisien. Oleh karena itu Szabados et al. (1987) menggunakan tunas pucuk dan daun muda
ubi kayu yang berasal dari kultur in vitro sebagai eksplan untuk induksi
pembentukan embriogenesis somatik. Kalus embriogenik juga telah berhasil diinduksi dari daun pucuk muda kerabat ubi kayu penghasil getah yaitu Manihot glaziovii Muell. Arg. (Joseph et al. 2000).
Embriogenesis somatik merupakan proses yang sangat efisien untuk mikropropagasi dan regenerasi beberapa genotipe ubi kayu karena memungkinkan meningkatkan laju multiplikasi dan produksi embrio yang mampu berkembang menjadi tanaman utuh (Ibaraki dan Murata 2001). Sumber dan jenis eksplan awal serta komposisi media dan zat pengatur tumbuh jenis auksin merupakan faktor penting dalam hal embriogenesis somatik ubi kayu (Rossin dan Rey 2011). Sejumlah penelitian telah menunjukkan bahwa picloram dan 2.4-D merupakan zat pengatur tumbuh yang paling sering digunakan untuk induksi embriogenesis pada tanaman ubi kayu (Hankoua et al. 2006; Atehnkeng et al. 2006; Rossin dan Rey
2011). Hankoua et al. (2006) melaporkan bahwa 12 mg L-1 picloram mampu
menginduksi terbentuknya embrio somatik secara efisien pada sejumlah kultivar ubi kayu Afrika. Atehnkeng et al. (2006) meneliti beberapa varietas ubi kayu
Afrika dan memperoleh hasil embriogenik serupa dengan menggunakan dua konsentrasi picloram (8 dan 12 mg L-1). Rossin dan Rey (2011) melaporkan bahwa embrio somatik kultivar MT116 dihasilkan ketika tunas pucuk dan daun muda dikulturkan di media yang mengandung picloram dan daun muda yang dikulturkan di media yang mengandung 2.4-D. Beberapa penelitian tersebut menunjukkan bahwa kapasitas pembentukan embrio somatik tergantung pada genotipe, jenis eksplan, dan komposisi media.
Proses induksi, maturasi, perkecambahan hingga regenerasi embrio somatik ubi kayu relatif sulit dilakukan. Uzelac et al. (2007) menyatakan bahwa
faktor pembatas dalam aplikasi embriogenesis somatik untuk perbaikan sejumlah spesies tanaman. Embriogenesis somatik pada ubi kayu sangat dipengaruhi oleh genotipe tanaman (genotype specific). Tidak semua kultivar atau genotipe ubi
kayu responsif terhadap pembentukan embriogenesis somatik. Oleh sebab itu, sumber dan jenis eksplan awal serta komposisi media dan konsentrasi zat pengatur tumbuh merupakan faktor penting dalam pembentukan embriogenesis somatik ubi kayu. Hal ini sesuai dengan penelitian Rossin dan Rey (2011) yang melaporkan bahwa penggunaan eksplan tunas aksilar ubi kayu pada media yang mengandung picloram menghasilkan embrio somatik yang lebih tinggi dibandingkan jika menggunakan eksplan daun muda pada media picloram dan eksplan daun muda pada media 2.4-D. Selain itu, suhu ruang kultur juga perlu diperhatikan karena turut berperan dalam proses induksi embriogenesis somatik. Hasil pengamatan pada penelitian ini sebelumnya menunjukkan bahwa fluktuasi suhu ruang kultur diduga mempengaruhi pembentukan embrio somatik ubi kayu. Oleh karena itu, penelitian ini bertujuan untuk menginduksi dan mengoptimasi terbentuknya embrio somatik pada beberapa genotipe ubi kayu.
Bahan dan Metode
3.a Induksi Kalus Embriogenik Empat Genotipe Ubi Kayu
Penelitian ini terdiri atas empat sub percobaan yang terpisah, masing-masing menggunakan genotipe Adira 4, UJ 5, Jame-jame, dan Gajah sebagai bahan tanam (eksplan). Bahan tanam (eksplan) yang digunakan adalah daun muda, tunas pucuk, dan petiol planlet ubi kayu genotipe UJ 5, Jame-jame, Gajah dan Adira 4 (Gambar 4). Bahan lain yang digunakan meliputi sukrosa dan gelrite. Media dasar yang digunakan yaitu media MS (Murashige and Skoog)
(Lampiran 5) dan GD (Gresshoff and Doy) (Lampiran 6) serta zat pengatur
tumbuh 2.4-D, picloram, dan NAA. Peralatan yang digunakan adalah Laminar Air Flow Cabinet (LAFC), autoclave, alat tanam, cawan petri, timbangan, kamera
digital, dan mikroskop cahaya.
Percobaan disusun berdasarkan rancangan acak lengkap (RAL) faktorial dengan dua faktor. Faktor pertama yaitu jenis eksplan yang terdiri atas 3 jenis yaitu daun muda, tunas pucuk, dan petiol. Faktor kedua yaitu komposisi media induksi kalus embriogenik yang terdiri atas 8 jenis media (Tabel 3). Kombinasi dari dua faktor tersebut menghasilkan 24 kombinasi perlakuan yang masing-masing perlakuan diulang sebanyak 10 kali, sehingga terdapat 240 satuan percobaan. Setiap ulangan terdiri atas satu botol kultur (diameter 5 cm) yang berisi dua eksplan. Kultur diinkubasi di tempat gelap, pada suhu 25 ºC selama 4 minggu.
Gambar 4. Eksplan yang digunakan: (D) daun muda, (P) petiol, dan (T) tunas pucuk dengan ukuran ± 4-5 mm
Pengamatan dilakukan untuk melihat pertumbuhan dan perkembangan kalus yang terbentuk selama 1-4 minggu. Peubah yang diamati meliputi:
1. Jumlah dan persentase eksplan membentuk kalus. Pengamatan dilakukan setiap minggu hingga 4 minggu setelah kultur (MSK).
2. Waktu terbentuk kalus, diamati setiap hari selama periode pengamatan berlangsung.
3. Pertumbuhan kalus
Pengamatan dilakukan dengan skoring setiap minggu hingga 4 MSK. Skor pertumbuhan kalus (Gambar 5) adalah sebagai berikut:
Skor 1 : eksplan tidak membentuk kalus
Skor 2 : ≤ 25% kalus menutupi eksplan
Skor 3 : > 25% - 50% kalus menutupi eksplan Skor 4 : > 50% - 75% kalus menutupi eksplan Skor 5 : > 75% - 100% kalus menutupi eksplan
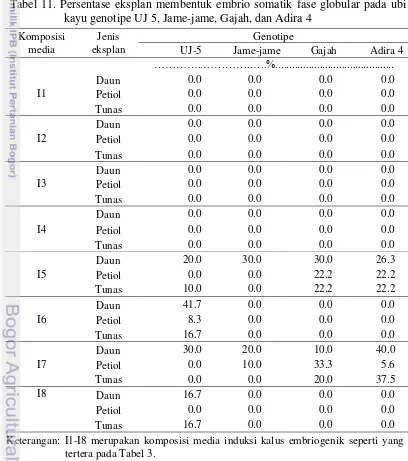
4. Diameter kalus. Pengamatan dilakukan setiap minggu hingga 4 MST. 5. Jumlah eksplan membentuk kalus embriogenik fase globular
Tabel 3. Komposisi media induksi kalus embriogenik ubi kayu Kode Media Komposisi Media
I1 MS + 40 g LµM CuSO -1 sukrosa + 10 mg L-1 picloram + 6 mg L-1 NAA + 4
4
I2 GD + 40 g LµM CuSO -1 sukrosa + 10 mg L-1 picloram + 6 mg L-1 NAA + 4
4
I3 MS + 20 g L-1 sukrosa + 12 mg L-1 picloram + 2 µM CuSO 4
I4 MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D + 2 µM CuSO 4
I5 MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D
I6 GD + 20 g L-1 sukrosa + 8 mg L-1 2.4-D
I7 MS + 20 g L-1 sukrosa + 10 mg L-1 NAA
I8 GD + 20 g L-1 sukrosa + 10 mg L-1 NAA
Keterangan: MS = media dasar Murashige and Skoog; GD= media dasar Gresshoff and Doy.
Media dipadatkan menggunakan 0.25% (w/v) gelrite.
Gambar 5. Skor pertumbuhan kalus: (a) Skor 1, (b) Skor 2, (c) Skor 3, (d) Skor 4, dan (e) Skor 5 pada eksplan daun muda genotipe Jame-jame
a b c
d e
1 cm 1 cm 1 cm
Data kuantitatif dianalisis dengan analisis ragam (ANOVA) untuk mengetahui pengaruh antar pelakuan. Perlakuan yang berpengaruh nyata kemudian diuji lanjut dengan menggunakan Duncan’s multiple range test
(DMRT) dengan tingkat kepercayaan 95%. Analisis data menggunakan program SAS versi 9.1. Data skoring diuji menggunakan uji peringkat Kruskal Wallis
(Walpole 1995).
3.b Optimasi Induksi Kalus Embriogenik Ubi Kayu Genotipe Adira 4 dan Gajah
Penelitian terdiri atas dua sub percobaan yang terpisah, masing-masing menggunakan genotipe Adira 4 dan Gajah sebagai bahan tanam (eksplan). Bahan tanam (eksplan) yang digunakan adalah daun muda dan tunas pucuk planlet ubi kayu genotipe Adira 4 dan Gajah yang dikulturkan pada media MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D (I5) dan MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I7). Genotipe Adira 4 dan Gajah serta media I5 dan I7 merupakan genotipe dan media yang paling responsif terhadap pembentukan kalus embriogenik berdasarkan percobaan 3a. Peralatan yang digunakan adalah Laminar Air Flow Cabinet
(LAFC), autoclave, alat tanam, cawan petri, timbangan, kamera digital, dan
mikroskop cahaya.
Tiap percobaan disusun menggunakan rancangan acak lengkap (RAL) faktorial dengan dua faktor. Faktor pertama yaitu jenis eksplan yang terdiri atas 2 jenis, yaitu daun muda (immature leaves) dan tunas pucuk (shoot tips). Faktor
kedua yaitu suhu ruang kultur, yang terdiri atas 2 taraf yaitu suhu 21-23 0C dan 25-27 0C. Kombinasi dari dua faktor tersebut menghasilkan 4 kombinasi perlakuan yang masing-masing perlakuan diulang sebanyak 10 kali, sehingga terdapat 40 satuan percobaan. Setiap ulangan terdiri atas satu botol kultur (diameter 5 cm) yang berisi dua eksplan. Perlakuan suhu 25-27 0C dilakukan pada rak kultur yang ditutup styrofoam dengan penambahan 2 buah lampu pijar (total
50 watt) selama masa induksi kalus embriogenik. Inkubasi kultur pada perlakuan 21-23 0C dan 25-27 0C dilakukan di rak tertutup tanpa cahaya selama 4 minggu (Gambar 6).
Gambar 6. Kondisi rak kultur: (a) penambahan 2 buah lampu pijar pada perlakuan suhu 25-27 0C dan (b) inkubasi di rak tertutup tanpa cahaya
Pengamatan dilakukan untuk melihat pertumbuhan dan perkembangan kalus yang terbentuk 1-4 minggu dengan peubah yang diamati meliputi:
1. Waktu terbentuk kalus, diamati setiap hari selama periode pengamatan berlangsung.
2. Pertumbuhan kalus
Pengamatan dilakukan dengan sistem skoring setiap minggu hingga 4 MSK. Skoring pertumbuhan kalus:
Skor 1 : eksplan tidak membentuk kalus
Skor 2 : ≤ 25% kalus menutupi eksplan
Skor 3 : > 25% - 50% kalus menutupi eksplan Skor 4 : > 50% - 75% kalus menutupi eksplan Skor 5 : > 75% - 100% kalus menutupi eksplan
3. Diameter kalus. Pengamatan dilakukan setiap minggu hingga 4 MST. 4. Jumlah eksplan membentuk kalus embriogenik fase globular
Data penelitian dianalisis dengan analisis ragam (ANOVA) untuk mengetahui pengaruh antar pelakuan. Perlakuan yang berpengaruh nyata kemudian diuji lanjut dengan menggunakan Duncan’s multiple range test
(DMRT) dengan tingkat kepercayaan 95%. Analisis data menggunakan program SAS versi 9.1. Data skoring diuji menggunakan uji peringkat Kruskal Wallis
(Walpole 1995).
Hasil dan Pembahasan
3.a Induksi Kalus Embriogenik Empat Genotipe Ubi Kayu
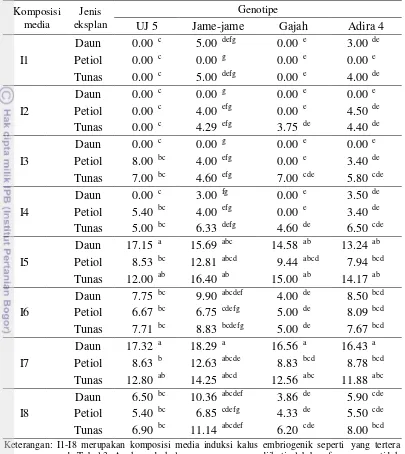
Berdasarkan hasil pengamatan terlihat bahwa persentase eksplan membentuk kalus dari empat genotipe (UJ 5, Jame-jame, Gajah, dan Adira 4) cukup tinggi pada empat jenis media (I5, I6, I7, dan I8) dan jenis eksplan yang digunakan (daun, petiol dan tunas pucuk) yaitu > 50%. Secara umum, persentase eksplan membentuk kalus > 80% pada semua genotipe diperoleh pada media MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D (I5) dan MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I7) untuk semua jenis eksplan yang digunakan (Tabel 4). Tingginya persentase eksplan membentuk kalus pada media I5 dan I7 diduga disebabkan oleh adanya kandungan 2.4-D dan NAA dalam masing-masing media. 2.4-D dan NAA merupakan jenis auksin terbanyak yang digunakan dalam induksi embriogenesis somatik (Jimenez 2005). Fletcher et al. (2011) melaporkan bahwa
penggunaan eksplan daun yang dikulturkan dalam media yang mengandung 8 mg L-1 2.4-D menghasilkan persentase kalus tertinggi pada semua kultivar ubi kayu yang dicobakan.
semua genotipe. Hal yang sama terjadi pada media MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I7) yang dibandingkan dengan media MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I8), dimana persen pembentukan kalus pada media I7 lebih tinggi dibandingkan pada media I8 pada tiga genotipe (UJ 5, Gajah, dan Adira 4). Persen pembentukan kalus tidak berbeda antara media dasar MS dan GD kecuali pada genotipe Jame-jame dimana persen pembentukan kalus pada media dasar GD lebih tinggi dibandingkan pada media dasar MS.
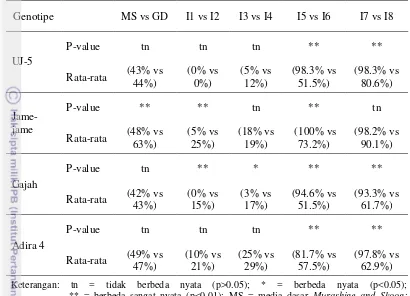
Tabel 4. Persentase eksplan membentuk kalus pada ubi kayu genotipe UJ 5, Jame-jame, Gajah, dan Adira 4 saat 4 MSK
Tabel 5. Uji kontras ortogonal terhadap persentase pembentukan kalus
kalus embriogenik seperti yang tertera pada Tabel 3.
Interaksi jenis media induksi kalus embrio somatik (ES) dan jenis eksplan berpengaruh nyata terhadap waktu muncul kalus pada semua genotipe (Tabel 6). Genotipe UJ 5, Jame-jame, dan Gajah memiliki waktu muncul kalus tercepat yang relatif sama yaitu berturut-turut 6, 5.5, dan 5.8 hari pada media MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I7) dengan menggunakan eksplan daun (UJ 5) dan tunas (Jame-jame dan Gajah). Waktu muncul kalus tercepat (5.3 hari) pada genotipe Adira 4 diperoleh pada media MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D (I5) dengan menggunakan eksplan tunas. Waktu muncul kalus pada penelitian ini relatif lebih cepat dibandingkan penelitian Fletcher et al. (2011) yang melaporkan
bahwa waktu muncul kalus tercepat terjadi saat 7 hari setelah kultur (HSK) ketika eksplan daun dikulturkan dalam media yang mengandung 8 mg L-1 2.4-D.
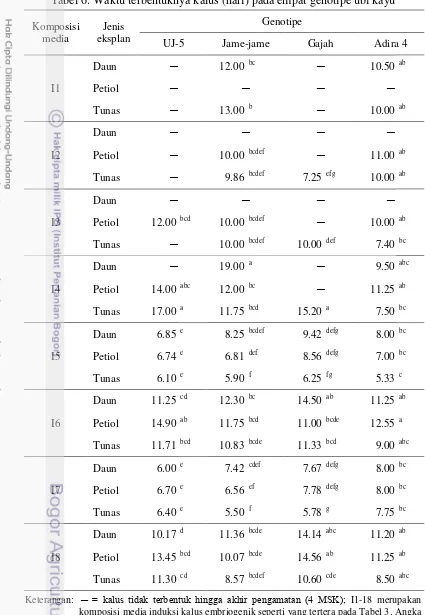
Tabel 6. Waktu terbentuknya kalus (hari) pada empat genotipe ubi kayu
Petiol ─ 10.00 bcdef ─ 11.00 ab
Tunas ─ 9.86 bcdef 7.25 efg 10.00 ab
I3
Daun ─ ─ ─ ─
Petiol 12.00 bcd 10.00 bcdef ─ 10.00 ab
Tunas ─ 10.00 bcdef 10.00 def 7.40 bc
I4
Daun ─ 19.00 a ─ 9.50 abc
Petiol 14.00 abc 12.00 bc ─ 11.25 ab
Tunas 17.00 a 11.75 bcd 15.20 a 7.50 bc
I5
Daun 6.85 e 8.25 bcdef 9.42 defg 8.00 bc
Petiol 6.74 e 6.81 def 8.56 defg 7.00 bc
Tunas 6.10 e 5.90 f 6.25 fg 5.33 c
I6
Daun 11.25 cd 12.30 bc 14.50 ab 11.25 ab
Petiol 14.90 ab 11.75 bcd 11.00 bcde 12.55 a
Tunas 11.71 bcd 10.83 bcde 11.33 bcd 9.00 abc
I7
Daun 6.00 e 7.42 cdef 7.67 defg 8.00 bc
Petiol 6.70 e 6.56 ef 7.78 defg 8.00 bc
Tunas 6.40 e 5.50 f 5.78 g 7.75 bc
I8
Daun 10.17 d 11.36 bcde 14.14 abc 11.20 ab
Petiol 13.45 bcd 10.07 bcde 14.56 ab 11.25 ab
Tunas 11.30 cd 8.57 bcdef 10.60 cde 8.50 abc
Keterangan: ─ = kalus tidak terbentuk hingga akhir pengamatan (4 MSK); I1-18 merupakan
komposisi media induksi kalus embriogenik seperti yang tertera pada Tabel 3. Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata
berdasarkan uji DMRT pada taraf α=5%. Genotipe bukan merupakan faktor
Tabel 7. Uji kontras ortogonal terhadap waktu terbentuknya kalus (HSK) ubi kayu
komposisi media induksi kalus embriogenik seperti yang tertera pada Tabel 3.
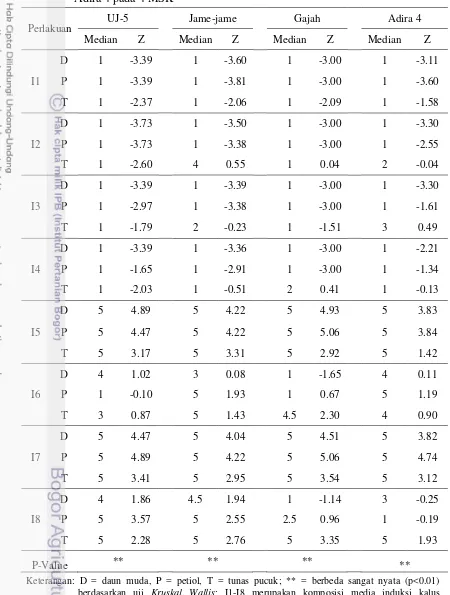
Interaksi jenis media induksi kalus ES dan jenis eksplan berpengaruh nyata terhadap skor pertumbuhan kalus pada semua genotipe (Tabel 8). Skor pertumbuhan kalus tertinggi (skor 5) diperoleh pada media MS + 20 g L-1 sukrosa + 8 mg L-1 2.4-D (I5) dan MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I7) dengan menggunakan semua jenis eksplan pada semua genotipe. Kalus yang terbentuk pada media I5 dan I7 sebagian besar menutupi semua bagian eksplan yang dikulturkan. Hal ini berarti penambahan 2.4-D dan NAA pada media dasar MS memberikan respon yang lebih baik terhadap pertumbuhan kalus.
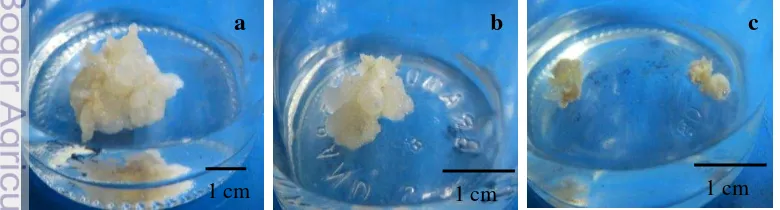
Interaksi jenis media induksi kalus ES dan jenis eksplan berpengaruh nyata terhadap diameter kalus pada semua genotipe (Tabel 9). Diameter kalus tertinggi diperoleh dari jenis eksplan daun yang dikulturkan dalam media MS + 20 g L-1 sukrosa + 10 mg L-1 NAA (I7). Respon diameter kalus tertinggi ini terjadi di semua genotipe. Kalus yang terbentuk dari setiap jenis eksplan menunjukkan struktur yang berbeda. Kalus yang berasal dari eksplan daun muda dan tunas pucuk berstruktur remah, sedangkan kalus yang berasal dari eksplan petiol berstruktur kompak dan keras (Gambar 7).
Gambar 7. Struktur kalus ubi kayu genotipe Adira 4 dari eksplan (a) daun muda, (b) tunas pucuk, dan (c) petiol saat 4 MSK
1 cm
1 cm 1 cm
Tabel 8. Skor pertumbuhan kalus ubi kayu genotipe UJ 5, Jame-jame, Gajah, dan Adira 4 pada 4 MSK
Perlakuan UJ-5 Jame-jame Gajah Adira 4 Median Z Median Z Median Z Median Z
I1
D 1 -3.39 1 -3.60 1 -3.00 1 -3.11
P 1 -3.39 1 -3.81 1 -3.00 1 -3.60
T 1 -2.37 1 -2.06 1 -2.09 1 -1.58
I2
D 1 -3.73 1 -3.50 1 -3.00 1 -3.30
P 1 -3.73 1 -3.38 1 -3.00 1 -2.55
T 1 -2.60 4 0.55 1 0.04 2 -0.04
I3
D 1 -3.39 1 -3.39 1 -3.00 1 -3.30
P 1 -2.97 1 -3.38 1 -3.00 1 -1.61
T 1 -1.79 2 -0.23 1 -1.51 3 0.49
I4
D 1 -3.39 1 -3.36 1 -3.00 1 -2.21
P 1 -1.65 1 -2.91 1 -3.00 1 -1.34
T 1 -2.03 1 -0.51 2 0.41 1 -0.13
I5
D 5 4.89 5 4.22 5 4.93 5 3.83
P 5 4.47 5 4.22 5 5.06 5 3.84
T 5 3.17 5 3.31 5 2.92 5 1.42
I6
D 4 1.02 3 0.08 1 -1.65 4 0.11
P 1 -0.10 5 1.93 1 0.67 5 1.19
T 3 0.87 5 1.43 4.5 2.30 4 0.90
I7
D 5 4.47 5 4.04 5 4.51 5 3.82
P 5 4.89 5 4.22 5 5.06 5 4.74
T 5 3.41 5 2.95 5 3.54 5 3.12
I8
D 4 1.86 4.5 1.94 1 -1.14 3 -0.25
P 5 3.57 5 2.55 2.5 0.96 1 -0.19
T 5 2.28 5 2.76 5 3.35 5 1.93
P-Value ** ** ** **
Keterangan: D = daun muda, P = petiol, T = tunas pucuk; ** = berbeda sangat nyata (p<0.01)
berdasarkan uji Kruskal Wallis; I1-I8 merupakan komposisi media induksi kalus
Tabel 9. Diameter kalus (mm) ubi kayu genotipe UJ 5, Jame-jame, Gajah, dan
Keterangan: I1-I8 merupakan komposisi media induksi kalus embriogenik seperti yang tertera pada Tabel 3. Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak
berbeda nyata berdasarkan uji DMRT pada taraf α=5%. Genotipe bukan merupakan
faktor perlakuan.