UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN
FRAKSI n-HEKSANA SERTA FRAKSI ETILASETAT HERBA
SAWI TANAH (Adenostemma lavenia (L.) Kuntze)
TERHADAP BEBERAPA BAKTERI
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
WINDA REGINA SURBAKTI
NIM 111501102
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN
FRAKSI n-HEKSANA SERTA FRAKSI ETILASETAT HERBA
SAWI TANAH (Adenostemma lavenia (L.) Kuntze)
TERHADAP BEBERAPA BAKTERI
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
WINDA REGINA SURBAKTI
NIM 111501102
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa atas limpahan rahmat, kasih
dan karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini. Penelitian ini
bertujuan untuk melakukan uji aktivitas antibakteri ekstrak etanol dan fraksi n
-heksana serta fraksi etilasetat herba sawi tanah (Adenostemma lavenia (L.) Kuntze)
terhadap bakteri. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh
gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis mengucapkan terima kasih yang tulus dan ikhlas kepada Bapak Prof.
Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Meda n dan
kepada Ibu Prof. Dr. Julia Reveny, M.Si., Apt., selaku Wakil Dekan I Fakultas
Farmasi USU Medan yang telah memberikan fasilitas sehingga penulis dapat
menyelesaikan pendidikan. Bapak Prof. Dr. Matheus Timbul Simanjuntak, M.Sc.,
Apt., selaku penasehat akademis yang telah memberikan bimbingan kepada penulis.
Ibu Dra. Erly Sitompul, M.Si., Apt., dan Ibu Dra. Herawaty Ginting, M.Si., Apt.,
selaku pembimbing yang telah memberikan waktu, bimbingan dan nasehat selama
penelitian sehingga selesainya penyusunan skripsi ini. Ibu Dr. Marline Nainggolan,
M.S., Apt., Bapak Dr. Panal Sitorus, M.Si., Apt., dan Ibu Dra. Suwarti Aris, M.Si.,
Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada
penulis dalam menyelesaikan skripsi ini. Ibu Dr. Marline Nainggolan, M.S., Apt.,
selaku Ketua Departemen Biologi Farmasi serta Ibu Dra. Herawaty Ginting, M.Si.,
Apt., selaku Sekretaris Departemen Biologi Farmasi yang telah memberikan waktu,
kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. Ibu Dra.
Erly Sitompul, M.Si., Apt., selaku kepala Laboratorium Mikrobiologi yang telah
memberikan bantuan dan fasilitas selama penulis melakukan penelitian. Bapak dan
Ibu staf pengajar Fakultas Farmasi USU Medan yang telah mendidik penulis selama
menjalani perkuliahan.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda M. Surbakti dan Ibunda M. Ginting tercinta, yang tiada
hentinya berkorban dengan tulus ikhlas bagi kesuksesan penulis, juga kepada adik
-adik tersayang, Windi Monica Surbakti, Mey Fatrisia Surbakti, Agnes Margaretha
Surbakti dan Samuel Haganta Surbakti yang selalu setia memberi doa, dorongan, dan
motivasi kepada penulis serta semua pihak yang tidak dapat disebutkan satu persatu
yang telah banyak membantu hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh
dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima
kritik dan saran demi kesempurnaan skripsi ini. Akhir kata, penulis berharap semoga
skripsi ini dapat bermanfaat bagi kita semua.
Medan, Juli 2015 Penulis,
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN FRAKSI n-HEKSANA SERTA FRAKSI ETILASETAT HERBA SAWI TANAH (Adenostemma lavenia (L.) Kuntze) TERHADAP BEBERAPA BAKTERI
ABSTRAK
Indonesia merupakan negara yang kaya akan sumber tanaman obat yang secara turun temurun telah digunakan sebagai ramuan obat tradisional. Tanaman sawi tanah (Adenostemma lavenia (L.) Kuntze) merupakan salah satu tanaman obat yang digunakan masyarakat di daerah Namo Rambe, Kabupaten Deli Serdang, Provinsi Sumatera Utara sebagai obat diare, disentri, luka bakar dan mengatasi mata bengkak. Tujuan dari penelitian ini adalah untuk mengetahui karakterisasi simplisia, golongan senyawa dan aktivitas antibakteri ekstrak etanol, fraksi n-heksana dan fraksi etilasetat herba sawi tanah terhadap Staphylococcus aureus, Escherichia coli
dan Shigella dysenteriae.
Serbuk simplisia dikarakterisasi dan diskrining fitokimia kemudian dimaserasi menggunakan pelarut etanol 80% kemudian ekstrak etanol difraksinasi menggunakan pelarut n-heksana dan etilasetat. Selanjutnya ekstrak etanol, fraksi n -heksana dan etilasetat diskrining dan dilakukan uji aktivitas antibakteri terhadap bakteri Staphylococcus aureus, Escherichia coli dan Shigella dysenteriae
menggunakan metode difusi agar dengan cakram kertas.
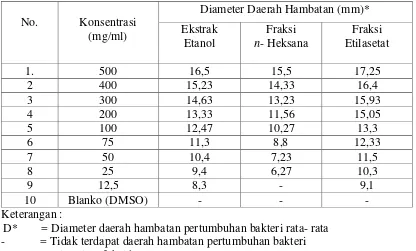
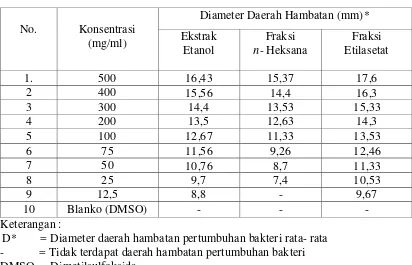
Hasil karakterisasi simplisia diperoleh kadar air 7,89%, kadar sari larut air 11,54%, kadar sari larut etanol 16,57%, kadar abu total 12,26% dan kadar abu tidak larut dalam asam 0,384%. Skrining fitokimia simplisia dan ekstrak etanol menunjukkan adanya golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan steroida/triterpenoida, fraksi n-heksana menunjukkan adanya steroida/triterpenoida dan pada fraksi etilasetat menunjukkan adanya alkaloid, flavonoid, glikosida, saponin dan tanin. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol memberikan aktivitas antibakteri yang efektif pada konsentrasi 200 mg/ml pada bakteri S. aureus dan pada konsentrasi 300 mg/ml pada E. coli dan
S. dysenteriae. Fraksi etilasetat memiliki efektivitas terbesar sebagai antibakteri yaitu konsentrasi 100 mg/ml terhadap S. aureus dan pada konsentrasi 200 mg/ml terhadap
E. coli dan S. dysenteriae. Fraksi n-heksana menunjukkan aktivitas antibakteri yang terlemah yaitu konsentrasi 400 mg/ml efektif terhadap E. coli dan S. dysenteriae dan pada konsentrasi 500 mg/ml terhadap bakteri S. aureus.
ANTIBACTERIAL ACTIVITY TEST OFETHANOL EXTRACT AND n-HEXANE AND ETHYLACETATE FRACTION OF Adenostemma lavenia (L.) Kuntze AGAINST SOME BACTERIA
ABSTRACT
Indonesia is a country which has plentiful source of medicinal plants that historically have been used as a traditional medicine. Adenostemma lavenia (L.) Kuntze is one of the medicine plant which is commonly apply to heal burn, diarrhea, dysentry and to soothe inflamed eyes by people of the disctrict Namo Rambe, Deli Serdang, North Sumatera Province. The purpose of this study is to find out the simplex characterization, phytochemical screening and antibacterial activities of ethanol extract, n-hexane fraction and ethylacetate fraction against Staphylococcus aureus, Escherichia coli and Shigella dysenteriae.
Simplex powder was characterized, phytochemical screening and extracted by maceration using ethanol 80% as solvent and then the ethanol was fractionated using
n-hexane and ethylacetate as solvent. The phytochemical screening of ethanol extract, n-hexane and ethylacetate fraction and the test of antibacterial activity against Staphylococcus aureus, Escherichia coli and Shigella dysenteriae using agar diffusion method have been carried out.
The result of simplex characteristic was showed that the water content 7.89%, the water soluble extract 11.54%, the ethanol soluble extract 16.57%, the total ash 12.26%, and the insoluble ash in acid 0.384%. The pytochemical screening of simplex and ethanol extract were showed the presence of alkaloid, flavonoid, glycocide, saponine, tannin and steroid/triterpenoid. The n-hexane fraction only showed the presence of steroid/triterpenoid and ethylacetate fraction showed the presence of alkaloid, flavonoid, glycocide, saponin and tannin. The result of antibacterial activity test showed that ethanol extract was effective at concentration 200 mg/ml against S.aureus and at concentration 300 mg/ml against E.coli and
S.dysenteriae. The most effective antibacterial agent was ethylacetate fraction that inhibited the growth of S. aureus at concentration 100 mg/ml and at concentration 200 mg/ml against E. coli and S.dysenteriae. The n-hexane fraction showed the less effective antibacterial activity at 400 mg/ml concentration against E. coli and
S.dysenteriae and against S. aureus at concentration 500 mg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Sistematika tumbuhan ... 5
2.1.2 Sinonim tumbuhan ... 5
2.1.3 Nama daerah ... 5
2.1.4 Nama asing ... 5
2.1.5 Morfologi tumbuhan ... 6
2.1.7 Manfaat tumbuhan sawi tanah ... 6
2.2 Ekstraksi ... 7
2.3 Fraksinasi (Ekstraksi Cair-Cair) ... 8
2.4 Bakteri ... 10
2.4.1 Uraian umum ... 10
2.4.2 Staphylococcus aureus ... 12
2.4.3 Escherichia coli ... 13
2.4.4 Shigella dysenteriae ... 13
2.5 Morfologi Bakteri ... 14
2.6 Fase Pertumbuhan Mikroorganisme ... 15
2.7 Pengukuran Aktivitas Antibakteri ... 17
BAB III METODE PENELITIAN ... 19
3.1 Alat-alat ... 19
3.2 Bahan-bahan ... 20
3.3 Pembuatan Larutan pereaksi dan Media ... 20
3.3.1 Pembuatan Larutan Pereaksi ... 20
3.3.2 Pembuatan Media ... 22
3.4 Sterilisasi Alat dan Bahan ... 23
3.5 Pengumpulan dan Pengolahan Bahan Tumbuhan ... 23
3.5.1 Pengumpulan bahan tumbuhan... 23
3.5.2 Identifikasi tumbuhan ... 23
3.5.3 Pembuatan simplisia ... 23
3.6 Karakterisasi Simplisia ... 24
3.6.2 Pemeriksaan mikroskopik ... 24
3.6.3 Penetapan kadar air ... 25
3.6.4 Penetapan kadar sari larut dalam air ... 25
3.6.5 Penetapan kadar sari larut dalam etanol ... 26
3.6.6 Penetapan kadar abu total ... 26
3.6.7 Penetapan kadar abu tidak larut dalam asam ... 26
3.7 Skrining Fitokimia ... 26
3.7.1 Pemeriksaan alkaloida ... 26
3.7.2 Pemeriksaan flavonoida ... 27
3.7.3 Pemeriksaan saponin ... 27
3.7.4 Pemeriksaan tanin ... 27
3.7.5 Pemeriksaan glikosida ... 27
3.7.6 Pemeriksaan glikosida antrakinon ... 28
3.7.7 Pemeriksaan steroida/ triterpenoida ... 28
3.8 Pembuatan Ekstrak ... 29
3.9 Pembuatan Fraksi n-Heksana dan Fraksi Etilasetat ... 29
3.10 Pembuatan Larutan Uji Dengan Berbagai Konsentrasi ... 30
3.11 Pembiakan Bakteri ... 30
3.11.1 Pembuatan stok kultur bakteri ... 30
3.11.2 Penyiapan inokulum bakteri ... 30
3.12 Uji Aktivitas Antibakteri ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Identifikasi Tumbuhan ... 32
4.3 Hasil Ekstraksi dan Fraksinasi ... 35
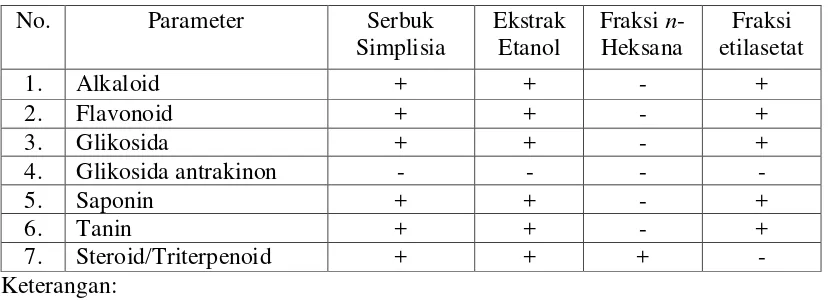
4.4 Hasil Skrining Fitokimia ... 35
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol (EEST), Fraksi n-heksana (FHST), Fraksi Etilasetat (FEST) Herba Sawi Tanah ... 36
BAB V KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi tumbuhan ... 47
2. Tumbuhan, simplisia dan serbuk simplisia tumbuhan Adenostemma lavenia (L.) Kuntze ... 48
3. Hasil pemeriksaan mikroskopik serbuk simplisia herba sawi tanah.. 50
4. Bagan pembuatan simplisia ... 51
5. Bagan pembuatan ekstrak etanol herba sawi tanah (Adenostemma lavenia (L.) Kuntze) ... 52
6. Bagan pembuatan fraksi n-heksana dan fraksi etilasetat herba sawi tanah (Adenostemma lavenia (L.) Kuntze) ... 53
7. Bagan pengujian aktivitas antibakteri ... 54
8. Perhitungan karakterisasi simplisia herba sawi tanah ... 55
9. Data hasil uji aktivitas antibakteri ekstrak etanol, fraksi n-heksana, dan fraksi etilasetat terhadap bakteri Staphylococcus aureus... 58
10. Data hasil uji aktivitas antibakteri ekstrak etanol, fraksi n-heksana, dan fraksi etilasetat terhadap bakteri Escherichia coli ... 60
11. Data hasil uji aktivitas antibakteri ekstrak etanol, fraksi n-heksana, dan fraksi etilasetat terhadap bakteri Shigella dysenteriae ... 62
12. Hasil uji aktivitas antibakteri ekstrak etanol sawi tanah terhadap Staphylococcus aureus, Escherichia coli dan Shigella dysenteriae . 64
13. Hasil uji aktivitas antibakteri fraksi n-heksana sawi tanah terhadap Staphylococus aureus, Escherichia coli dan Shigella dysenteriae . 67
14. Hasil uji aktivitas antibakteri fraksi etilasetat sawi tanah terhadap
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN FRAKSI n-HEKSANA SERTA FRAKSI ETILASETAT HERBA SAWI TANAH (Adenostemma lavenia (L.) Kuntze) TERHADAP BEBERAPA BAKTERI
ABSTRAK
Indonesia merupakan negara yang kaya akan sumber tanaman obat yang secara turun temurun telah digunakan sebagai ramuan obat tradisional. Tanaman sawi tanah (Adenostemma lavenia (L.) Kuntze) merupakan salah satu tanaman obat yang digunakan masyarakat di daerah Namo Rambe, Kabupaten Deli Serdang, Provinsi Sumatera Utara sebagai obat diare, disentri, luka bakar dan mengatasi mata bengkak. Tujuan dari penelitian ini adalah untuk mengetahui karakterisasi simplisia, golongan senyawa dan aktivitas antibakteri ekstrak etanol, fraksi n-heksana dan fraksi etilasetat herba sawi tanah terhadap Staphylococcus aureus, Escherichia coli
dan Shigella dysenteriae.
Serbuk simplisia dikarakterisasi dan diskrining fitokimia kemudian dimaserasi menggunakan pelarut etanol 80% kemudian ekstrak etanol difraksinasi menggunakan pelarut n-heksana dan etilasetat. Selanjutnya ekstrak etanol, fraksi n -heksana dan etilasetat diskrining dan dilakukan uji aktivitas antibakteri terhadap bakteri Staphylococcus aureus, Escherichia coli dan Shigella dysenteriae
menggunakan metode difusi agar dengan cakram kertas.
Hasil karakterisasi simplisia diperoleh kadar air 7,89%, kadar sari larut air 11,54%, kadar sari larut etanol 16,57%, kadar abu total 12,26% dan kadar abu tidak larut dalam asam 0,384%. Skrining fitokimia simplisia dan ekstrak etanol menunjukkan adanya golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan steroida/triterpenoida, fraksi n-heksana menunjukkan adanya steroida/triterpenoida dan pada fraksi etilasetat menunjukkan adanya alkaloid, flavonoid, glikosida, saponin dan tanin. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol memberikan aktivitas antibakteri yang efektif pada konsentrasi 200 mg/ml pada bakteri S. aureus dan pada konsentrasi 300 mg/ml pada E. coli dan
S. dysenteriae. Fraksi etilasetat memiliki efektivitas terbesar sebagai antibakteri yaitu konsentrasi 100 mg/ml terhadap S. aureus dan pada konsentrasi 200 mg/ml terhadap
E. coli dan S. dysenteriae. Fraksi n-heksana menunjukkan aktivitas antibakteri yang terlemah yaitu konsentrasi 400 mg/ml efektif terhadap E. coli dan S. dysenteriae dan pada konsentrasi 500 mg/ml terhadap bakteri S. aureus.
ANTIBACTERIAL ACTIVITY TEST OFETHANOL EXTRACT AND n-HEXANE AND ETHYLACETATE FRACTION OF Adenostemma lavenia (L.) Kuntze AGAINST SOME BACTERIA
ABSTRACT
Indonesia is a country which has plentiful source of medicinal plants that historically have been used as a traditional medicine. Adenostemma lavenia (L.) Kuntze is one of the medicine plant which is commonly apply to heal burn, diarrhea, dysentry and to soothe inflamed eyes by people of the disctrict Namo Rambe, Deli Serdang, North Sumatera Province. The purpose of this study is to find out the simplex characterization, phytochemical screening and antibacterial activities of ethanol extract, n-hexane fraction and ethylacetate fraction against Staphylococcus aureus, Escherichia coli and Shigella dysenteriae.
Simplex powder was characterized, phytochemical screening and extracted by maceration using ethanol 80% as solvent and then the ethanol was fractionated using
n-hexane and ethylacetate as solvent. The phytochemical screening of ethanol extract, n-hexane and ethylacetate fraction and the test of antibacterial activity against Staphylococcus aureus, Escherichia coli and Shigella dysenteriae using agar diffusion method have been carried out.
The result of simplex characteristic was showed that the water content 7.89%, the water soluble extract 11.54%, the ethanol soluble extract 16.57%, the total ash 12.26%, and the insoluble ash in acid 0.384%. The pytochemical screening of simplex and ethanol extract were showed the presence of alkaloid, flavonoid, glycocide, saponine, tannin and steroid/triterpenoid. The n-hexane fraction only showed the presence of steroid/triterpenoid and ethylacetate fraction showed the presence of alkaloid, flavonoid, glycocide, saponin and tannin. The result of antibacterial activity test showed that ethanol extract was effective at concentration 200 mg/ml against S.aureus and at concentration 300 mg/ml against E.coli and
S.dysenteriae. The most effective antibacterial agent was ethylacetate fraction that inhibited the growth of S. aureus at concentration 100 mg/ml and at concentration 200 mg/ml against E. coli and S.dysenteriae. The n-hexane fraction showed the less effective antibacterial activity at 400 mg/ml concentration against E. coli and
S.dysenteriae and against S. aureus at concentration 500 mg/ml.
BAB I PENDAHULUAN
1.1Latar Belakang
Indonesia memiliki iklim tropis dan tanah yang subur sehingga dapat
ditumbuhi oleh berbagai jenis tumbuhan. Beberapa jenis tumbuhan tersebut memiliki
khasiat sebagai obat. Sebagian besar dari tumbuhan tersebut belum diketahui
khasiatnya sehingga tidak pernah terawat dengan baik dan hidup sebagai tanaman
liar (Hariana, 2008).
Tumbuhan sawi tanah (Adenostemma lavenia (L.) Kuntze) adalah salah satu
tumbuhan liar yang dimanfaatkan oleh masyarakat Namo Rambe, Kabupaten Deli
Serdang, Provinsi Sumatera Utara. Masyarakat di daerah ini menggunakan sawi
tanah untuk mengobati penyakit diare, disentri dengan cara menggunakan air rebusan
sawi tanah, juga digunakan untuk menyembuhkan luka dan mata bengkak karena
infeksi.
Daun dan batang sawi tanah yang dihaluskan dapat digunakan sebagai
antidiare, antidisentri, sakit kepala, penyakit kulit, dan ulcer (Quattrocchi, 2012).
Tumbuhan ini berkhasiat juga sebagai obat sakit tenggorokan, sariawan, kulit
terbakar matahari, obat borok dan mencegah kerontokan rambut (Agromedia, 2008).
Tumbuhan sawi tanah mengandung glikosida (Agromedia, 2008), flavonoid,
alkaloid, steroid/triterpenoid (Kusumawati, 2003) dan minyak atsiri (Yongli, et al.,
2007). Senyawa flavonoid, steroid/ triterpenoid dan minyak atsiri dapat digunakan
sebagai antibakteri (Robinson, 1995). Sawi tanah memproduksi senyawa diterpen
aktivitas antitumor yang dilakukan oleh Shimizu, et al., (1989), menunjukkan bahwa
kaurene diterpen pada sawi tanah dapat menstimulasi apoptosis sehingga dapat
digunakan sebagai obat antitumor.
Staphylococcus aureus (gram positif), Escherichia coli (gram negatif),
Shigella dysenteriae (gram negatif) adalah bakteri patogen yang dapat menginfeksi
saluran cerna (Supardi dan Sukamto, 1999). Staphylococcus aureus dapat
menghasilkan enterotoksin yang dapat menyebabkan gangguan perut (Jawetz, et al.,
2001). Bakteri Escherichia coli merupakan flora normal yang terdapat pada usus
besar. Jika bakteri ini masuk ke dalam usus halus akan bersifat patogen dan dapat
menyebabkan diare sedangkan bakteri Shigella dysenteriae bersifat patogen dan
terdapat terbatas pada saluran intestinal manusia dimana mereka dapat menyebabkan
disentri basillus (Tim Mikrobiologi FK Brawijaya, 2003).
Berdasarkan pengalaman yang dimiliki oleh masyarakat tersebut, maka
dilakukan penelitian uji aktivitas antibakteri dari ekstrak etanol, fraksi n-heksana dan
etilasetat herba sawi tanah terhadap pertumbuhan bakteri Staphylococcus aureus,
Escherichia coli dan Shigella dysenteriae. Penelitian ini meliputi karakterisasi
simplisia, skrining fitokimia dan pembuatan ekstrak etanol herba sawi tanah secara
maserasi dan kemudian ekstrak etanol difraksinasi berturut-turut dengan pelarut n
-heksana dan etilasetat. Ekstrak etanol, fraksi n-heksana dan etilasetat herba sawi
tanah yang diperoleh kemudian diuji aktivitas antibakteri.
1.2Perumusan masalah
Rumusan masalah dalam penelitian ini adalah:
2. Apa saja golongan senyawa metabolit sekunder yang terdapat pada serbuk
simplisia, ekstrak etanol dan fraksi herba sawi tanah .
3. Apakah ekstrak etanol, fraksi n-heksana dan fraksi etilasetat herba sawi tanah
mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus,
Escherichia coli dan Shigella dysenteriae.
1.3Hipotesis
Hipotesis dari penelitian ini adalah :
1. Simplisia herba sawi tanah memenuhi persyaratan mutu simplisia.
2. Serbuk simplisia, ekstrak etanol dan fraksi herba sawi tanah mengandung
senyawa alkaloid, flavonoid, glikosida, tanin, saponin dan steroida/triterpenoida.
3. Ekstrak etanol, fraksi n-heksana dan fraksi etilasetat herba sawi tanah
mempunyai aktivitas antibakteri terhadap masing-masing bakteri Staphylococcus
aureus, Escherichia coli dan Shigella dysenteriae .
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk mengetahui simplisia herba sawi tanah yang digunakan memenuhi
persyaratan mutu simplisia.
2. Untuk mengetahui golongan senyawa kimia apa saja yang terdapat pada
simplisia, ekstrak etanol dan fraksi herba sawi tanah.
3. Untuk mengetahui adanya aktivitas antibakteri ekstrak etanol, fraksi n-heksana
dan fraksi etilasetat herba sawi tanah terhadap masing- masing bakteri
1.5 Manfaat Penelitian
Manfaat dari penelitian ini yaitu sebagai bahan informasi tentang
karakterisasi simplisia, golongan senyawa kimia yang terdapat pada simplisia dan
masing-masing ekstrak herba sawi tanah dan aktivitasnya dalam menghambat
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Sistematika tumbuhan
Tumbuhan sawi tanah (Adenostemma lavenia (L.) Kuntze) diklasifikasikan
sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledonae
Ordo : Asterales
Famili : Compositae
Genus : Adenostemma
Spesies : Adenostemmalavenia (L.) Kuntze (Torkelson, 1993).
2.1.2 Sinonim tumbuhan
Adenostemma viscosum Forst., Verbesina lavenia Linn. (Quattrocchi, 2012).
2.1.3 Nama daerah
Legetan warak (Jawa), rumput babi (Jakarta), bababian, jakut jarian, jotang
leuweung (Sunda), jabun-jabun tana (Makasar), langa-langa (Bugis), daun muka
sawit, sayur babi (Maluku), gofo roki (Ternate) (Wijayakusuma, 2008).
2.1.4 Nama asing
Common medicine plant, club wort; rumput tahi babi, sumbong gajah, rumput
pasir (Malaysia); daun tempel daging boton (Filipina); tuyenhung (Vietnamese);
2.1.5 Morfologi tumbuhan
Tumbuhan sawi tanah merupakan herba yang tingginya sekitar 30-100 cm.
Tanaman ini tumbuh di tempat yang terbuka dan lembab, di hutan belukar dan di
semak-semak (Chen, et al., 2011). Batang lurus, keras dan kaku serta memiliki
percabangan di bagian atas batang. Daun berwarna hijau, tipis, permukaannya
gundul, tepi daun bergerigi, berbentuk bulat telur, panjang daun 4 cm - 12 cm dan
lebar daun 2 cm - 5 cm, ujung daun runcing dan pangkal daun meruncing (Wiggins,
1971). Tangkai daun pendek dan memiliki tepi yang melebar (bersayap) dengan
panjang sekitar 0,5 cm - 4 cm, daun tunggal dan berhadapan. Bunga majemuk tak
berbatas (inflorescense), berbentuk cawan, dengan panjang 4 mm - 5 mm dan lebar 6
mm - 8 mm, dan berwarna putih. Buah kurung berkelenjar dan berwarna hitam
kecoklatan pada saat matang dan berukuran 0,4 mm - 1 mm (Wiart, 2006).
2.1.6 Kandungan kimia
Tumbuhan sawi tanah mengandung glikosida (Agromedia, 2008), flavonoid,
alkaloid, steroid/triterpenoid (Kusumawati, et al., 2003) dan minyak atsiri. Minyak
atsiri pada sawi tanah terdiri dari 35 senyawa kimia dimana komponen utamanya
yaitu cubebene (32,62%), caryophyllene (24,97%) and γ-elemen (5,53%). Senyawa
monoterpen dan seskiterpen lainnya yaitu α-caryophyllene, α-chamigrene, bicyclo
[4,3,0]-7-methylene-2,4,4-trimethyl-2-vinyl nonane, γ-terpinen, d-limonene, α
-pinene dan 2-carene (Yongli, et al., 2007).
2.1.7 Manfaat tumbuhan sawi tanah
Daun sawi tanah dapat digunakan sebagai antidiare, antidisentri, stimulan,
antispasmodik, mengobati ulcer, mengobati kongestif paru-paru, pneumonia, edema
mencegah kerontokan rambut (Agromedia, 2008). Akar sawi tanah dapat digunakan
sebagai obat batuk, daunnya yang dihaluskan dapat menyembuhkan kulit yang
terbakar sinar matahari (Heyne, 1987). Sawi tanah juga berkhasiat sebagai
antiradang, peluruh kemih, penurun panas dan antiinflamasi (Wijayakusuma, 2008).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Dengan
diketahui senyawa aktif yang dikandung simplisia akan mempermudah pemilihan
pelarut dengan cara ekstraksi yang tepat (Ditjen POM, 1995). Ekstrak adalah sediaan
kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut
cara dan pelarut yang cocok, di luar pengaruh cahaya matahari langsung (Ditjen
POM, 1979).
Menurut Departemen Kesehatan RI (2000), beberapa metode ekstraksi
dengan menggunakan pelarut yaitu:
a. Cara dingin
1. Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada suhu kamar.
Penambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama
dan seterusnya disebut remaserasi.
2. Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru
sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur
antara, tahap perkolasi sebenarnya (penetesan/ penampungan ekstrak) terus
menerus sampai diperoleh perkolat yang jumlahnya 1 - 5 kali bahan.
b. Cara panas
1. Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas
yang relatif konstan dengan adanya pendingin balik.
2. Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur
lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-50oC.
3. Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu
baru, dilakukan menggunakan alat soklet sehingga terjadi ekstraksi kontinu
dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infudansi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90oC selama 15 menit.
5. Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90oC selama 30 menit.
2.3 Fraksinasi (Ekstraksi Cair-Cair)
Proses pemisahan selanjutnya masih menggunakan prinsip ekstraksi yang
dikenal dengan ekstraksi cair-cair atau yang biasa dikenal dengan nama fraksinasi.
Fraksinasi adalah suatu metode pemisahan senyawa organik berdasarkan kelarutan
senyawa-senyawa tersebut dalam dua pelarut yang tidak saling bercampur, biasanya
antara pelarut air dan pelarut organik seperti metanol, etanol, etilasetat, n-heksana
Teknik pemisahan ekstraksi cair-cair ini biasanya dilakukan dengan
menggunakan corong pisah. Kedua pelarut yang saling tidak bercampur tersebut
dimasukkan ke dalam corong pisah, kemudian digojok dan didiamkan. Solut atau
senyawa organik akan terdistribusi ke dalam fasenya masing-masing bergantung
pada kelarutannya terhadap fase tersebut dan kemudian akan terbentuk dua lapisan,
yaitu lapisan atas dan lapisan bawah yang dapat dipisahkan dengan membuka kunci
pipa corong pisah (Odugbemi, 2008).
Ekstrak dipartisi dengan menggunakan peningkatan polaritas pelarut seperti
petroleum eter, n-heksana, kloroform, dietil eter, etilasetat dan etanol. Pemilihan
pelarut pada ekstraksi umumnya bergantung pada sifat analitnya dimana pelarut dan
analit harus memiliki sifat yang sama, contohnya analit yang sifat lipofilitasnya
tinggi akan terekstraksi pada pelarut yang relatif nonpolar seperti n-heksana
sedangkan analit yang semipolar terlarut pada pelarut yang semipolar seperti
etilasetat atau diklorometana (Venn, 2008).
Kebanyakan aglikon terekstraksi pada fraksi non-polar seperti terpenoid dan
steroid sedangkan flavonoid, glikosida, saponin dan gula ester ditemukan pada fraksi
yang lebih polar dan fraksi air. Petroleum eter dan n-heksana juga dapat digunakan
untuk menghilangkan lipid, wax dan senyawa lemak (Dey, 2012).
Sekilas ada banyak pelarut yang dapat digunakan untuk ekstraksi ini, namun
ternyata ada banyak pelarut yang tidak memenuhi syarat. Pertama, pelarut harus
tidak bercampur dengan air, mempunyai titik didih yang rendah (jika digunakan
untuk evaporasi) dan sebaiknya memiliki densitas yang lebih rendah daripada air
(untuk membentuk lapisan atas sehingga pemisahan lebih mudah dilakukan). Kedua,
yang tidak aman digunakan karena berbagai alasan seperti dietil eter (mudah
terbakar), toluen (memiliki titik didih yang tinggi), benzen (keamanan), dan pelarut
klorida seperti diklorometana (berbahaya bagi lingkungan). Praktisnya, hanya ada
beberapa pelarut saja yang biasa digunakan seperti n-heksana, metil tertier butil eter
(MTBE) dan etilasetat (Venn, 2008).
2.4 Bakteri
2.4.1 Uraian umum
Nama bakteri berasal dari kata “bakterion” dari bahasa Yunani yang berarti
tongkat atau batang, sekarang nama itu dipakai untuk menyebut sekelompok
mikroorganisme yang bersel satu, tidak berklorofil (meskipun ada pengecualian),
bekembangbiak dengan pembelahan diri serta demikian kecilnya sehingga hanya
tampak dengan mikroskop (Dwidjoseputro, 1978).
Bakteri merupakan organisme prokariot yang memiliki kromosom tunggal dan
tidak memiliki nukleus. Struktur sel bakteri yang paling penting adalah dinding sel
yang bersifat kaku dan berfungsi untuk mempertahankan bentuknya serta melindungi
sel dari perubahan tekanan osmotik antara sel dengan lingkungannya (Irianto, 2007).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh :
1. Zat makanan (nutrisi)
Sumber zat makanan bagi bakteri diperoleh dari senyawa karbon, nitrogen,
sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi, tembaga
dan kobalt), vitamin dan air untuk fungsi metabolik dan pertumbuhannya (Pelczar, et
2. Keasaman dan kebasaan (pH)
Kebanyakan bakteri patogen mempunyai pH optimum pertumbuhan antara 7,2
– 7,6 (Staf Pengajar FK Universitas Indonesia, 1993).
3.Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju reaksi
kimia yang dipengaruhi oleh temperatur. Berdasarkan ini maka bakteri dapat
diklasifikasikan sebagai berikut:
a. Bakteri psikofil, yaitu bakteri yang dapat hidup pada temperatur 0 - 30oC, dengan
temperatur optimum adalah 10 - 20 oC.
b. Bakteri mesofil, yaitu bakteri yang dapat hidup pada temperatur 5 - 60 oC,
temperatur optimum adalah 25 - 40 oC.
c. Bakteri termofil, yaitu bakteri yang dapat hidup pada temperatur optimum adalah
55 - 65 oC (Pelczar, et al.,1988).
4. Oksigen
Berdasarkan kebutuhannya akan oksigen, bakteri terbagi atas:
a. Aerobik, yaitu bakteri yang membutuhkan oksigen dalam pertumbuhannya.
b. Anaerobik, yaitu bakteri yang dapat tumbuh tanpa oksigen.
c. Anaerobik fakultatif, yaitu bakteri yang dapat tumbuh dengan oksigen ataupun
tanpa oksigen.
d. Mikroaerofilik, yaitu bakteri yang dapat tumbuh baik dengan adanya sedikit
oksigen (Staf Pengajar FK Universitas Indonesia, 1993).
5.Tekanan osmosa
Medium yang baik bagi pertumbuhan bakteri adalah medium isotonis terhadap
6. Kelembapan
Secara umum bakteri tumbuh dan berkembang biak dengan baik pada
lingkungan yang lembap. Kebutuhan akan air tergantung dari jenis bakterinya
(Pelczar, et al.,1988).
2.4.2 Staphylococcus aureus
Staphylococcus aureus termasuk dalam suku Micrococcaceae, merupakan
bakteri gram positif, berbentuk bulat (kokus) dengan diameter sekitar 1 μm, tidak
membentuk spora, katalase positif, oksidasi negatif dan dan termasuk anaerob
fakultatif. Staphylococcus aureus adalah bakteri mesofil dengan suhu pertumbuhan
optimum 37oC. Staphylococcus aureus hidup sebagai saprofit di dalam
saluran-saluran pengeluaran lendir dari tubuh manusia dan hewan seperti hidung, mulut,
tenggorokan dan dapat pula dikeluarkan pada waktu batuk atau bersin (Supardi dan
Sukamto, 1999).
Keracunan makanan oleh enterotoksin Staphylococcus aureus dapat
menimbulkan berbagai gejala. Gejala-gejala tersebut yaitu meliputi muntah, diare,
mual, kejang dan kram pada abdominal serta sakit kepala. Pemulihannya cepat,
bekisar sampai dua hari (ICMSF, 1996).
Adapun sistematika dari bakteri Staphylococcus aureus yaitu:
Divisi : Schizophyta
Kelas : Schizomycetes
Ordo :Eubacteriales
Suku : Micrococcaceae
Genus : Staphylococcus
2.4.3 Escherichia coli
Bakteri Escherichia coli umumnya merupakan flora normal saluran pencernaan
tubuh manusia dan hewan. Escherichia coli merupakan bakteri gram negatif
berbentuk batang, tidak berkapsul, umumnya mempunyai fimbria dan bersifat motile.
Sel Escherichia coli mempunyai ukuran panjang 2,0-6,0 μm dan lebar 1,1-1,5 μm,
tersusun tunggal, berpasangan, dengan flagella peritikus (Supardi dan Sukamto,
1999).
Escherichia coli dapat memproduksi enterotoksin. Organ sasaran enterotoksin
Escherichia coli adalah usus kecil dan hasilnya berupa diare sebagai akibat dari
pengeluaran cairan dan elektrolit (Tim Mikrobiologi FK Brawijaya, 2003).
Adapun sistematika dari bakteri Escherichia coli adalah sebagai berikut:
Divisi : Schizophyta
Kelas : Schizomycetes
Ordo :Eubacteriales
Suku : Enterobacteriaceae
Genus : Escherichia
Spesies : Escherichia coli (Holt, et al., 1988).
2.4.3 Shigella dysenteriae
Bakteri yang berasal dari suku Enterobacteriaceae bersifat gram negatif dan
berbentuk batang. Bakteri ini mesofil dengan suhu pertumbuhan yaitu diantara suhu
10-45oC dan sensitif terhadap panas seperti spesies lainnya. Tumbuh dengan baik
pada pH 6-8, tetapi tidak tumbuh baik pada pH 4,0 (Adams and Moss, 1995).
Shigella merupakan bakteri patogen yang dapat menyebabkan gejala
gangguan pencernaan yang ditandai dengan peradangan usus terutama kolon disertai
nyeri perut dan buang air besar yang mengandung lendir dan darah (Pelczar, et al.,
1988).
Adapun sistematika dari bakteri Shigella dysenteriae adalah sebagai berikut:
Divisi : Schizophyta
Kelas : Schizomycetes
Ordo : Eubacteriales
Suku : Enterobacteriaceae
Genus : Shigella
Spesies : Shigella dysenteriae (Holt, et al., 1988).
2.5 Morfologi Bakteri
Berdasarkan morfologinya bakteri dapat dibedakan atas tiga bagian yaitu
bentuk basil, kokus dan spiral.
a. Bentuk basil
Basil adalah bakteri yang mempunyai bentuk batang atau silinder, membelah
dalam satu bidang, berpasangan ataupun bentuk rantai pendek atau panjang.
Bakteri dengan bentuk basil dapat dibedakan atas:
1. Monobasil yaitu basil yang terlepas satu sama lain dengan kedua ujung tumpul.
2. Diplobasil yaitu basil yang bergandeng dua dan kedua ujungnya tumpul.
3. Streptobasil yaitu basil yang bergandengan panjang dengan kedua ujung tajam.
Adapun contoh bakteri-bakteri yang mempunyai bentuk basil yaitu Eschericia
coli, Bacillus anthracis, Salmonella typhimurium, Shigella dysentriae (Pelczar, et al.,
b. Bentuk kokus
Kokus adalah bakteri yang bentuknya seperti bola-bola kecil, ada yang hidup
sendiri dan ada yang berpasang-pasangan.
Bentuk kokus ini dapat dibedakan atas:
1. Diplokokus yaitu kokus yang bergandeng dua.
2. Tetrakokus yaitu kokus yang mengelompok empat.
3. Stafilokokus yaitu kokus yang mengelompok dan membentuk anggur.
4. Streptokokus yaitu kokus yang bergandengan panjang menyerupai rantai.
5. Sarsina yaitu kokus yang mengelompok seperti kubus.
Contoh bakteri dengan bentuk kokus yaitu Staphylococcus aureus, Sarcina
luten, Diplococcus pneumoniae, Streptococcus lactis (Volk dan Wheeler, 1989).
c. Bentuk spiral
Bakteri bentuk siral dapat dibedakan atas:
1. Spiral yaitu menyerupai spiral atau lilitan.
2. Vibrio yaitu bentuk batang yang melengkung berupa koma.
3. Spirochaeta yaitu menyerupai bentuk spiral, bedanya dengan spiral dalam
kemampuannya melenturkan dan melengkukkan tubuhnya sambil bergerak.
Adapun contoh bakteri-bakteri dengan bentuk spiral yaitu Vibrio cholerae,
Spirochaeta palida (Volk dan Wheeler, 1989).
2.6 Fase Pertumbuhan Mikroorganisme
Ada empat macam fase pertumbuhan mikroorganisme, yaitu fase lag, fase log
(fase esksponensial), fase stasioner dan fase kematian.
a. Fase lag
Fase lag merupakan fase adaptasi, yaitu fase penyesuaian mikroorganisme pada
suatu lingkungan baru. Waktu penyesuaian ini umumnya berlangsung selama 2 jam.
Kuman belum berkembang biak dalam fase ini, tetapi aktivitas metabolismenya
sangat tinggi. Fase ini merupakan persiapan untuk fase berikutnya (Staf Pengajar FK
Universitas Indonesia, 1993).
b. Fase log (fase esksponensial)
Fase ini merupakan fase dimana mikroorganisme tumbuh dan membelah pada
kecepatan maksimum, tergantung pada genetika mikroorganisme, sifat media, dan
kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang
bertambah secara eksponensial. Hal yang dapat menghambat laju pertumbuhan
adalah bila satu atau lebih nutrisi dalam kultur habis, sehingga hasil metabolisme
yang bersifat racun akan tertimbun dan menghambat pertumbuhan (Pratiwi, 2008).
c. Fase stationer
Fase ini kuman mulai ada yang mati dan pembelahan pun terhambat seiring
dengan meningkatnya jumlah kuman, meningkat juga jumlah hasil metabolisme yang
toksis. Pada suatu saat terjadi jumlah kuman yang hidup tetap sama (Staf Pengajar
FK Universitas Indonesia, 1993).
d. Fase kematian
Fase ini jumlah sel yang mati meningkat. Konsentrasi produk buangan yang
bersifat toksis meningkat dan ketersediaan makanan untuk bakteri menurun. Jumlah
bakteri yang mati meningkat dengan cepat. Sebagian bakteri terlihat berbeda dari
bakteri semakin panjang, terlihat bercabang, filamennya juga berubah sehingga sulit
untuk diidentifikasi (Engelkirk, 2010).
2.7 Pengukuran Aktivitas Antibakteri
Penentuan kepekaan bakteri patogen terhadap agen antibakteri tertentu dapat
dilakukan dengan salah satu dari dua metode pokok yaitu metode dilusi dan metode
difusi.
a. Metode dilusi
Metode ini digunakan untuk mengukur kadar hambat minimum (KHM) dan
kadar bunuh minimum (KBM). Cara yang dilakukan yaitu dengan membuat seri
pengenceran agen antimikroba pada media yang telah ditambahkan dengan mikroba
uji. Larutan uji agen antimkroba pada kadar terkecil yang terlihat jernih tanpa adanya
pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai
KHM tersebut selanjutnya dikultur ulang pada media tanpa penambahan mikroba uji
ataupun agen antimikroba, dan diinkubasi selama 18-24 jam. Media yang tetap
terlihat jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
b. Metode difusi agar
Metode yang paling sering digunakan dalam uji aktivitas antibakteri yaitu
metode difusi agar. Obat dengan jumlah tertentu ditempatkan pada permukaan media
padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya dan
kemudian diinkubasi selama 18-24 jam. Diameter zona hambatan di sekitar
pencadang kemudian diukur dan digunakan untuk mengukur kekuatan hambatan obat
Metode ini dipengaruhi oleh beberapa faktor fisika dan kimia, misalnya sifat
medium, kemampuan difusi, ukuran molekular dan stabilitas obat. Meskipun
demikian, standarisasi faktor-faktor tersebut memungkinkan melakukan uji kepekaan
BAB III
METODE PENELITIAN
Penelitian ini dilakukan dengan menggunakan metode eksperimental
parametrik. Parameter yang digunakan mengacu pada Materia Medika Indonesia. Uji
aktivitas antibakteri dilakukan dengan metode difusi agar menggunakan pencadang
kertas. Parameter yang diukur adalah besarnya zona hambat di sekitar pencadang
kertas. Tahapan-tahapan penelitian meliputi pengumpulan dan pengolahan sampel,
skrining fitokimia, pemeriksaan karakterisasi simplisia, pembuatan ekstrak etanol
sawi tanah dengan cara maserasi kemudian difraksinasi berturut-turut dengan pelarut
n-heksana dan etilasetat. Pengujian aktivitas antibakteri terhadap bakteri
Staphylococcus aureus, Escherichia coli dan Shigella dysenteriae. Penelitian ini
dilakukan di Laboratorium Mikrobiologi Fakultas Farmasi USU Medan dan
Laboratorium Fitokimia Fakultas Farmasi USU Medan pada bulan September 2014 –
Desember 2014.
3.1 Alat- alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, aluminium
foil, alat tanur, autoklaf (Fisons), blender (Philips), cakram kertas, cawan petri,
inkubator (Fiber Scientific), jangka sorong, jarum ose, kaca objek, Laminar Air
Flow Cabinet (Astec HLF I200L), lampu bunsen, lemari pendingin (Toshiba), lemari
pengering, mikro pipet (Eppendorf), neraca analitik (Mettler Toledo), neraca kasar
(Ohanus), oven (Memmert), pinset, rotary evaporator (Haake D) dan
3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah air suling, etanol,
herba sawi tanah (Adenostemma lavenia (L.) Kuntze), nutrient agar, nutrient broth
dan bahan-bahan yang berkualitas proanalisa (E.Merck): α-naftol, amil alkohol, asam
nitrat pekat, asam asetat anhidrat, asam klorida pekat, asam sulfat pekat, benzena,
besi (III) klorida, bismuth nitrat, dimetilsulfoksida (DMSO), etilasetat, iodium,
isopropanol, kalium iodida, kloroform, metanol, natrium hidroksida, natrium klorida,
n-heksana, raksa (II) klorida, serbuk magnesium, timbal (II) asetat dan toluena.
Bakteri yang digunakan adalah bakteri Staphylococcus aureus ATCC 25923,
Escherichia coli ATCC 25922dan Shigella dysenteriae ATCC 12022.
3.3 Pembuatan Larutan Pereaksi dan Media 3.3.1 Pembuatan larutan pereaksi
3.3.1.1 Pereaksi Meyer
Sebanyak 2,266 g raksa (II) klorida dilarutkan dalam air suling hingga 100 ml
dan pada wadah lain dilarutkan 50 g kalium iodida dalam 100 ml air suling. 60 ml
larutan I dicampurkan dengan 10 ml larutan II dan ditambahkan air suling hingga
100 ml (Depkes RI, 1995).
3.3.1.2 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida ditimbang, kemudian dilarutkan dalam
air suling hingga 100 ml (Ditjen POM, 1979).
3.3.1.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dan 2 g iodium dilarutkan dalam air suling
3.3.1.4 Pereaksi Dragendorff
Pereaksi dibuat dua larutan persediaan : (1) 0,6 g bismut nitrat dalam 2 ml HCl
pekat dan 10 ml air; (2) 6 g kalium iodida dalam 10 ml air. Larutan persediaan ini
dicampur dengan 7 ml HCl pekat dan 15 ml air (Harborne, 1987).
3.3.1.5 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
suling hingga 100 ml, lalu disaring (Ditjen POM, 1979).
3.3.1.6 Pereaksi asam klorida 2 N
Asam klorida pekat sebanyak 16,6 ml ditambahkan air suling sampai 100 ml
(Ditjen POM, 1979).
3.3.1.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal asetat ditimbang, kemudian dilarutkan dalam air
suling bebas karbon dioksida hingga 100 ml (Depkes RI , 1995).
3.3.1.8 Pereaksi Liebermann-Burchard
Sebanyak 10 tetes asam asetat anhidrat dicampur dengan 1 tetes asam sulfat
pekat. Ditambahkan dengan hati-hati asetat anhidrida ke dalam campuran tersebut,
didinginkan (Depkes RI, 1995).
3.3.1.9 Pereaksi Molish
Sebanyak 3 g alfa naftol dilarutkan dalam 15 ml etanol 95 % ditambahkan
dengan asam nitrat 0,5 N secukupnya hingga diperoleh larutan 100 ml (Depkes RI,
1995).
3.3.1.10 Pereaksi kloralhidrat
Pereaksi kloralhidrat dibuat dengan cara melarutkan kloralhidrat sebanyak 50 g
3.3.2 Pembuatan Media 3.3.2.1 Media nutrient agar
Komposisi : Bacto beef extract 3,0 g
Bacto peptone 5,0 g
Bacto agar 15,0 g
Cara pembuatan:
Sebanyak 23 g nutrient agar ditimbang, disuspensikan ke dalam air suling
sebanyak 1000 ml, lalu dipanaskan sampai bahan larut sempurna lalu disterilkan di
dalam autoklaf pada suhu 121oC selama 15 menit (Difco, 2009).
3.3.2.2 Media nutrient broth
Komposisi : Peptone 5,0 g
Beef extract 3,0 g
Air suling ad 1 L
Cara pembuatan:
Sebanyak 13 gram serbuk nutrient broth dilarutkan dalam air suling steril
sedikit demi sedikit kemudian volumenya dicukupkan hingga 1 L dengan bantuan
pemanasan sampai semua bahan larut sempurna, kemudian disterilkan di autoklaf
pada suhu 121oC selama 15 menit (Difco, 2009).
3.3.2.3 Pembuatan agar miring
Sebanyak 3 ml media nutrient agar cair, dimasukkan ke dalam tabung reaksi,
diletakkan pada sudut kemiringan 30o-45o dan dibiarkan memadat, kemudian
3.4 Sterilisasi Alat dan Bahan
Alat dan bahan yang digunakan dalam uji aktivitas antibakteri ini disterilkan
lebih dahulu sebelum dipakai. Media pertumbuhan disterilkan di autoklaf pada suhu
121o C selama 15 menit dan alat- alat gelas disterilkan di oven pada suhu 160-170oC
selama 1-2 jam. Jarum ose dan pinset disterilkan dengan cara dibakar dengan nyala
bunsen (Lay, 1994).
3.5 Pengumpulan dan Pengolahan Bahan Tumbuhan 3.5.1 Pengumpulan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan tumbuhan yang sama dengan daerah lain. Bahan tumbuhan yang
digunakan adalah seluruh bagian tumbuhan sawi tanah. Bahan diambil dari Namo
rambe, Kelurahan Tangkahan, Kabupaten Deli Serdang, Provinsi Sumatera Utara.
3.5.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense Bidang Botani Pusat
Penelitian - Biologi LIPI Bogor. Hasil identifikasi dapat dilihat pada Lampiran 1,
halaman 47.
3.5.3 Pembuatan simplisia
Herba sawi tanah dicuci bersih dari pengotoran dengan air sampai bersih dan
ditiriskan. Kemudian dikeringkan di lemari pengering dengan suhu 40o - 50oC. Herba
sawi tanah dianggap kering apabila sudah rapuh (diremas menjadi hancur), kemudian
simplisia herba sawi tanah yang telah kering diserbuk menggunakan blender, dan
disimpan dalam wadah plastik yang tertutup rapat. Gambar simplisia dan serbuk
3.6 Karakterisasi Simplisia 3.6.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk simplisia herba sawi
tanah dengan mengamati bentuk, bau, rasa dan warna.
3.6.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia herba sawi
tanah. Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah
mikroskop (hasil dapat dilihat pada Lampiran 3, halaman 51.
3.6.3 Penetapan kadar air
a. Penjenuhan toluen
Sebanyak 200 ml toluen dimasukkan ke dalam labu alas bulat, lalu
ditambahkan 2 ml air suling, kemudian alat dipasang dan dilakukan destilasi selama
2 jam. Destilasi dihentikan dan dibiarkan dingin selama ± 30 menit, kemudian
volume air dalam tabung penerima dibaca dengan ketelitian 0,1 ml.
b. Penetapan kadar air simplisia
Labu berisi toluen tersebut dimasukkan 5 g serbuk simplisia yang telah
ditimbang seksama, dipanaskan hati-hati selama 15 menit, setelah toluen mendidih,
kecepatan toluen diatur 2 tetes per detik sampai sebagian besar air terdestilasi,
kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik dan setelah semua
air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan
selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air
kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan
yang diperiksa. Kadar air dihitung dalam persen (WHO, 1998).
3.6.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml air-kloroform dalam aquadest sampai 1 L) dengan menggunakan
botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan
selama 18 jam dan disaring. Sebanyak 20 ml filtrat diuapkan hingga kering dalam
cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam
oven pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam air
dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.6.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol
96 % dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam
pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak 20 ml filtrat
diuapkan hingga kering dalam cawan yang berdasar rata yang telah dipanaskan dan
ditara. Residu dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot
tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan
(Depkes RI, 1995).
3.6.6 Penetapan kadar abu total
Sebanyak 2,5 g serbuk simplisia yang telah digerus dan ditimbang seksama,
dimasukkan ke dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Kurs porselin bersama isinya dipijarkan perlahan hingga arang habis,
didinginkan, ditimbang sampai diperoleh bobot yang tetap. Kadar abu dihitung
3.6.7 Penetapan kadar abu yang tidak larut asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut asam dikumpulkan,
disaring dengan kertas saring, lalu cuci dengan air panas. Residu dan kertas saring
dipijarkan sampai diperoleh bobot yang tetap, dinginkan, dan ditimbang beratnya.
Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di
udara (Depkes RI, 1995).
3.7 Skrining Fitokimia
Skrining fitokimia dari serbuk simplisia, ekstrak etanol, n-hesana dan etilasetat
meliputi pemeriksaan golongan senyawa alkaloida, flavonoida, saponin, tanin,
glikosida, glikosida antrakinon dan steroida/triterpenoida (Depkes, 1995;
Farnsworth, 1966). Prosedur pemeriksaan ekstrak etanol dan fraksi herba sawi tanah
sama seperti prosedur skrining fitokimia terhadap simplisia herba sawi tanah.
3.7.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanasakan di atas penangas air selama 2 menit.
Didinginkan dan disaring. Filtrat dipakai untuk percobaan sebagai berikut :
a. Filtrat sebayak 3 tetes ditambah dengan 2 tetes larutan pereaksi Meyer, akan
terbentuk endapan menggumpal bewarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat, akan
terbentuk endapan berwarna coklat sampai hitam.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendorff,
Serbuk mengandung alkaloida jika sekurang-kurangnya terbentuk endapan
dengan menggunakan dua golongan larutan percobaan yang digunakan (Depkes RI,
1995).
3.7.2 Pemeriksaan flavonoida
Sebanyak 0,5 g serbuk simplisia ditambahkan 20 ml air panas, dididihkan
selama 10 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml a mil
alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna
merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.7.3 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
ditambahkan 10 ml air panas, didinginkan kemudian dikocok selama 10 detik, jika
terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan
tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya
saponin (Depkes RI, 1995).
3.7.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring,
filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2
ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1 %. Jika terjadi
warna hijau, biru, atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.7.5 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95 %
dengan air suling (7:3), ditambahkan asam sulfat pekat hingga diperoleh pH 2,
filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok,
didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol
dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan
dengan temperatur tidak lebih dari 50o C. Sisanya dilarutkan dalam 2 ml metanol.
Larutan sisa dipakai untuk percobaan berikut:
a. Larutan sisa dimasukkan ke dalam tabung reaksi selanjutnya diuapkan di atas
penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish.
Tambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung, terbentuk
cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula.
b. Larutan percobaan diuapkan di atas penangas air. Larutkan sisa dalam 5 ml asam
asetat anhidrat. Tambahkan 10 tetes asam sulfat pekat, akan terjadi warna biru
atau hijau, menunjukkan adanya glikosida (Depkes RI, 1995).
3.7.6 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditambah 5 ml asam sulfat 2 N, dipanaskan
sebentar, setelah dingin ditambahkan 10 ml benzena, dikocok dan didiamkan.
Lapisan benzena dipisahkan dan disaring. Kocok lapisan benzena dengan 2 ml
NaOH 2 N, didiamkan. Lapisan air berwarna merah dan lapisan benzena tidak
berwarna menunjukkan adanya glikosida antrakinon (Depkes RI, 1995).
3.7.7 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan n-heksana selama 2 jam, lalu disaring.
Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes asam asetat
anhidrida dan 1 tetes asam sulfat pekat. Timbul warna biru atau hijau menunjukkan
adanya steroid dan timbul warna merah, pink atau ungu menunjukkan adanya
3.8 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut
etanol 80%. Cara kerja :
Sebanyak 250 g serbuk simplisia dimaserasi dengan 75 bagian pelarut (1875
ml) etanol 80%, dimasukkan ke dalam bejana bertutup dan dibiarkan pada suhu
kamar selama 5 hari terlindung dari cahaya sambil sering diaduk, kemudian setelah 5
hari hasil maserasi disaring dan diperas. Ampas ditambah dengan cairan penyari
etanol 80% hingga diperoleh 100 bagian (2,5 L) maserat kemudian dibiarkan di
tempat sejuk dan terlindung dari cahaya selama 2 hari dan dienaptuangkan. Seluruh
maserat digabungkan lalu diuapkan dengan alat rotary evaporator pada temperatur
kurang lebih 40o C dan diperoleh ekstrak etanol kental kemudian dikeringkan dengan
freeze dryer. (Ditjen POM, 1979). Bagan pembuatan ekstrak etanol secara maserasi
dapat dilihat di Lampiran 5, halaman 52.
3.9 Pembuatan Fraksi n-Heksana dan Fraksi Etilasetat
Prosedur fraksinasi dilakukan menurut Harbone (1987):
Pembuatan fraksi-fraksi dilakukan secara ekstraksi cair-cair (ECC)
menggunakan pelarut n-heksana dan etilasetat. Sebanyak 10 g ekstrak etanol
ditambahkan 40 ml etanol dan 100 ml air suling dihomogenkan lalu dimasukkan ke
dalam corong pisah, kemudian diekstraksi dengan 50 ml n-heksana, dikocok,
didiamkan sampai terbentuk 2 lapisan yaitu fraksi n-heksana dan fraksi air. Fraksi n
-heksana dikumpulkan dan fraksinasi dilakukan sampai lapisan n-heksana jernih.
Fraksi air kemudian diekstraksi dengan 50 ml etilasetat, dikocok, didiamkan sampai
dan fraksinasi dilakukan sampai lapisan etilasetat jernih. Fraksi n-heksana dan
etilasetat diuapkan dengan rotary evaporator sampai diperoleh ekstrak kental.
Bagan pembuatan fraksi dapat dilihat pada Lampiran 6, halaman 53.
3.10 Pembuatan Larutan Uji Dengan Berbagai Konsentrasi
Ekstrak etanol herba sawi tanah ditimbang 1 g kemudian dilarutkan dengan
pelarut DMSO hingga 2 ml maka konsentrasi ekstrak adalah 500 mg/ml. Larutan
tersebut diencerkan kembali dengan pelarut DMSO sehingga didapat konsentrasi 400
mg/ml; 300 mg/ml; 200 mg/ml; 100 mg/ml; 75 mg/ ml; 50 mg/ml; 25 mg/ ml; 12,5
mg/ml. Dilakukan prosedur yang sama dengan fraksi n-heksana dan fraksi etilasetat.
3.11 Pembiakan Bakteri
3.11.1 Pembuatan Stok Kultur Bakteri
Satu koloni bakteri diambil dengan menggunakan jarum ose steril. Koloni
bakteri tersebut kemudian ditanamkan pada media nutrient agar miring dengan cara
menggores, setelah itu diinkubasi dalam inkubator pada suhu 36 1o C selama 18 -
24 jam.
3.11.2 Penyiapan inokulum bakteri
Koloni bakteri diambil dari stok kultur bakteri yang telah tumbuh pada media
nutrient agar miring diambil dengan menggunakan jarum ose steril. Koloni bakteri
tersebut kemudian disuspensikan ke dalam tabung yang berisi 10 ml larutan nutrient
broth, kemudian diukur kekeruhan larutan menggunakan alat spektrofotometer
visible pada panjang gelombang 580 nm sampai diperoleh transmitan 25% (Ditjen
3.12 Uji Aktivitas Antibakteri
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu
dituang media nutrient agar sebanyak 15 ml dengan suhu 45o-50o C. Cawan petri
digoyang di atas permukaan meja agar media dan suspensi bakteri tercampur rata dan
dibiarkan memadat. Dilakukan pengujian aktivitas antibakteri dengan metode difusi
cakram kertas yaitu dengan meletakkan cakram kertas yang telah direndam dalam
beberapa konsentrasi larutan uji ekstrak etanol di atas media padat yang telah
diinokulasi bakteri dan dibiarkan 15 menit, kemudian diinkubasi dalam inkubator
pada suhu 36 1o C selama 18-24 jam, setelah itu diukur diameter daerah hambatan
(zona jernih) pertumbuhan di sekitar cakram dengan menggunakan jangka sorong.
Uji aktivitas antibakteri fraksi n-heksana dan fraksi etilasetat dilakukan dengan cara
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian Biologi- LIPI
Bogor, menunjukkan bahwa tumbuhan yang diteliti adalah Adenostemma lavenia
(L.) Kuntze, suku Compositae.
4.2 Hasil Pemeriksaan Karakterisasi
Hasil pemeriksaan makroskopik simplisia herba sawi tanah yaitu hijau
kecoklatan, berbau khas, dan rasa agak kelat. Hasil pemeriksaan mikroskopik serbuk
simplisia memperlihatkan adanya stomata tipe anomositik, rambut kelenjar tipe
labiat, rambut penutup, jaringan gabus, berkas pembuluh, serbuk sari dan tetesan
minyak atsiri. Minyak atsiri memiliki sifat antiseptik sehingga dapat digunakan
sebagai antibakteri dan antifungi (Claus, et al., 1971).
Hasil pemeriksaan karakterisasi serbuk simplisia herba sawi tanah dapat dilihat
pada Tabel 4.1.
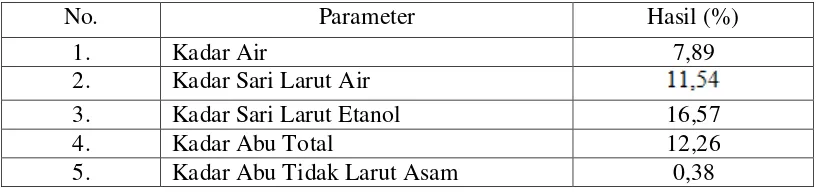
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia sawi tanah No. Parameter Hasil (%)
1. Kadar Air 7,89
2. Kadar Sari Larut Air
3. Kadar Sari Larut Etanol 16,57 4. Kadar Abu Total 12,26 5. Kadar Abu Tidak Larut Asam 0,38
Penetapan kadar air pada simplisia dilakukan untuk mengetahui jumlah air
untuk menjaga kualitas simplisia karena kadar air berkaitan dengan kemungkinan
pertumbuhan jamur/kapang. Hasil penetapan kadar air diperoleh lebih kecil dari
10% yaitu 7,89%. Kadar air yang melebihi 10% dapat menjadi media yang baik
untuk pertumbuhan mikroba, keberadaan jamur atau serangga, serta mendorong
kerusakan mutu simplisia (WHO, 1998).
Penetapan kadar sari dilakukan menggunakan dua pelarut, yaitu air dan etanol.
Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa kimia bersifat
polar yang terkandung di dalam simplisia, sedangkan kadar sari larut dalam etanol
dilakukan untuk mengetahui kadar senyawa larut dalam etanol, baik senyawa polar
maupun non polar. Hasil karakterisasi simplisia herba sawi tanah menunjukkan kadar
sari yang larut dalam air sebesar 11,54%, sedangkan kadar sari yang larut dalam
etanol sebesar 16,57%.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri yang terdapat
di dalam sampel (Ditjen POM, 2000; WHO, 1998). Kadar abu tidak larut asam
untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia dengan
cara melarutkan abu total dalam asam klorida (WHO, 1998). Penetapan kadar abu
pada simplisia herba sawi tanah menunjukkan kadar abu total sebesar 12,26% dan
kadar abu tidak larut dalam asam sebesar 0,38%. Tingginya kandungan mineral
yang terdapat pada simplisia herba sawi tanah mungkin disebabkan karena tempat
tumbuh sawi tanah tersebut berasal dari dataran rendah, dimana kandungan mineral
pada dataran rendah lebih tinggi bila dibandingkan dengan di dataran tinggi. Menurut
Momuat, et al., (2011), terdapat mineral dalam tanah yang ketebalannya adalah 15-35