Lampiran 2.Gambar tumbuhan dan daun sijukkot
Simplisia daun sijukkot
Serbuk simplisia Lampiran 4. Bagan kerja penelitian
Dicuci di air mengalir
Ditiriskan
•Penetapan kadar air
•Penetapan kadar sari yang larut air
•Penetapan kadar sari yang larut etanol
Lampiran 5. Bagan pembuatan ekstrak etanol daun sijukkot (Lactuca indica L.)
Dimasukkan ke dalam bejana
Dimasukkan etanol 80% sampai simplisia terendam sempurna
Dibiarkan selama 5 hari terlindung dari cahaya, sambil sesekali diaduk
Disaring
Diuapkan dengan penguap vakum putar Maserat
Ekstrak kental (78,85 g)
500 g serbuk simplisia
Ampas
daun Sijukkot
Ditambahkan dengan etanol dan akuades
Dimasukkan dalam corong pisah
Diekstraksi dengan n-heksana
Dikocok dan didiamkan sampai terbentuk dua lapisan dan dipisahkan
Ekstrak etanol daun sijukkot
Fraksi n-heksana
Fraksi etilasetat kental (1,60 g) Fraksi air
Lampiran 7. Perhitungan Karakterisasi Simplisia Daun Sijukkot
1. Penetapan kadar air
a. Berat sampel = 5,0064 g
Volume I = 2,0 ml
Volume II = 2,2 ml
Kadar air = 2,2-2,0
5,0064
x 100%= 3,9948%
b. Berat sampel = 5,0025 g
Volume I = 2,2 ml
Volume II = 2,6 ml
Kadar air = 2,6-2,2
5,0025 x 100% = 7,9960%
c. Berat sampel = 5,0045 g
Volume I = 2,6 ml
Volume II = 2,9 ml
Kadar air = 2,9-2,6
5,0045 x 100% = 5,9946%
Kadar air rata-rata = (3,9948+7,9960+5,9946)%
3
=
5,9951%Kadar air
=
volume II-volume I2. Perhitungan penetapan kadar sari larut dalam air
Kadar sari rata-rata = 16,2222+14,8230+16,0091%
3 = 15,6847%
Kadar sari= Berat sari Berat Sampel x
100
Lampiran 7. (lanjutan)
3. Perhitungan penetapan kadar sari larut dalam etanol
a. Berat sampel = 5,0018 g
Kadar sari rata-rata = (16,0242+16,3572+16,2380)%
3 = 16,2064%
Kadar sari= Berat sari Berat Sampel x
100
4. Perhitungan penetapan kadar abu total simplisia
a. Berat sampel = 2,0549 g
Berat abu = 0,2741 g
Kadar abu
=
0,27412,0549
x 100 % = 13,3388 %
b. Berat sampel = 2,0463 g
Berat abu = 0,2695 g
Kadar abu = 0,2695
2,0463 x 100% = 13,1701%
c. Berat sampel = 2,0340 g
Berat abu = 0,2819 g
Kadar abu = 0,2819
2,0340 x 100% = 13,8559%
Kadar abu total rata-rata = (13,3388+13,1701+13,8559)%
3 = 13,4549%
Kadar abu total= Berat Abu
Lampiran 7. (Lanjutan)
5. Perhitungan penetapan kadar abu tidak larut dalam asam
Sampel I Berat sampel = 2,0549 g
Berat abu = 0,0119 g
Kadar abu = 0,0021
2,0549 x 100% = 0,58 %
Sampel II Berat sampel = 2,0463 g
Berat abu = 0,0108 g
Kadar abu = 0,0030
2,0463 x 100% = 0,53%
Sampel III Berat sampel = 2,0340 g
Berat abu = 0,0134 g
Kadar abu = 0,0028
2,0340 x 100% = 0,66%
Kadar abu tidak larut dalam asam rata-rata = 0,58%+0,53%+0,66%
3 = 0,59%
Kadar abu yang tidak larut dalam asam
=
Berat Abu
Diambil dengan jarum ose steril
Ditanam pada media nutrient agar miring
Diinkubasi pada suhu 37oC selama 24 jam
Disuspensikan dalam 10 ml media nutrient broth steril
Dibandingkan kekeruhan suspense bakteri dengan Mc Farland Standard
Dimasukkan 0,1 ml inokulum ke dalam cawan petri
Ditambahkan 15 ml media Nutrient Agar ke dalam cawan petri
Dihomogenkan dan biarkan hingga memadat
Diletakkan pencadang kertas yang telah di tetes larutan uji ekstrak/ fraksi dengan berbagai konsentrasi dan pelarut DMSO sebagai blanko
Diinkubasi pada suhu 37oC selama 18-24 jam
Lampiran 9. Data hasil uji aktivitas antibakteri ekstrak etanol
1. Data hasil uji aktivitas antibakteri ekstrak etanol terhadap Escherichia colidan Lactobacillus acidophillus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Escherichia coli Lactobacillus acidophillus
D1 D2 D3 D* D1 D2 D3 D*
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
- : Tidak terdapat daerah hambatan pertumbuhan bakteri Blanko : DMSO
2. Data hasil uji aktivitas antibakteri ekstrak etanol terhadap Pseudomonas areginosa dan Staphylococcus aureus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Pseudomonas areginosa Staphylococcus aureus
3. Data hasil uji aktivitas antibakteri ekstrak etanol terhadap Streptococcus mutans dan Vibrio cholerae
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Streptococcus mutans Vibrio cholerae
D1 D2 D3 D* D1 D2 D3 D*
1. 500 12,8 12,3 12,4 12,50 14,2 14,1 13,9 14,06 2. 400 10,5 10,1 10,9 10,50 13,5 13,9 13,9 13,76 3. 300 10,1 9,7 10,2 10,00 12,3 12,7 12,8 12,60 4. 200 8,5 8,1 8,3 8,30 11,1 11,6 11,8 11,50
5. 100 - - - - 9,7 9,9 10,1 9,90
6. 75 - - - - 9,7 9,8 9,9 9,80
7. 25 - - - -
8. 20 - - - -
9. 15 - - - -
10. 10 - - - -
11. Blanko - - - -
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
Lampiran 10. Data hasil uji aktivitas antibakteri fraksi n-heksana
1. Data hasil uji aktivitas antibakteri n-heksana terhadap Escherichia colidan Lactobacillus acidophillus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Escherichia coli Lactobacillus acidophillus
D1 D2 D3 D* D1 D2 D3 D*
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
- : Tidak terdapat daerah hambatan pertumbuhan bakteri Blanko : DMSO
2. Data hasil uji aktivitas antibakteri fraksi n-heksana terhadap Pseudomonas areginosa dan Staphylococcus aureus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Pseudomonas areginosa Staphylococcus aureus
3. Data hasil uji aktivitas antibakteri n-heksana terhadap Streptococcus mutans dan Vibrio cholerae
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Streptococcus mutans Vibrio cholerae
D1 D2 D3 D* D1 D2 D3 D*
1. 500 13,2 13,2 12,9 13,10 11,2 11,0 10,4 10,86 2. 400 10,2 10,6 10,1 10,30 10,5 10,3 10,1 10,30 3. 300 10,1 10,2 9,7 10,00 10,2 10,0 9,7 9,96 4. 200 9,1 9,1 9,4 9,20 10,0 9,9 9,6 9,83
5. 100 - - - - 9,9 9,8 9,5 9,73
6. 75 - - - - 9,9 9,6 9,5 9,66
7. 25 - - - - 9,8 9,5 9,4 9,60
8. 20 - - - - 8,2 8,1 8,0 8,10
9. 15 - - - -
10. 10 - - - -
11. Blanko - - - -
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
Lampiran 11. Data hasil uji aktivitas antibakteri fraksi etilasetat
1. Data hasil uji aktivitas antibakteri fraksi etilasetat terhadap Escherichia colidan Lactobacillus acidophillus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Escherichia coli Lactobacillus acidophillus
D1 D2 D3 D* D1 D2 D3 D*
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
- : Tidak terdapat daerah hambatan pertumbuhan bakteri Blanko : DMSO
2. Data hasil uji aktivitas antibakteri fraksi etilasetat terhadap Pseudomonas areginosa dan Staphylococcus aureus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Pseudomonas areginosa Staphylococcus aureus
3. Data hasil uji aktivitas antibakteri fraksi etilasetat terhadap Streptococcus mutans dan Vibrio cholerae
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Streptococcus mutans Vibrio cholerae
D1 D2 D3 D* D1 D2 D3 D*
1. 500 20,1 20,2 20,6 20,30 22,6 22,2 22,7 22,50 2. 400 19,5 19,1 18,7 19,10 21,2 21,2 21,5 21,30 3. 300 17,6 17,2 17,1 17,30 21,1 21,0 21,2 21,10 4. 200 16,3 16,0 16,1 16,13 20,3 20,0 20,0 20,10 5. 100 14,5 14,2 14,2 14,30 19,4 19,2 18,7 19,10 6. 75 13,8 13,9 14,1 13,93 18,2 17,5 15,6 17,10 7. 25 11,3 11,3 10,0 11,20 9,2 8,2 7,8 8,40
8. 20 8,4 8,7 8,6 8,56 - - - -
9. 15 7,9 7,7 7,5 7,70 - - - -
10. 10 - - - -
11. Blanko - - - -
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
Lampiran 12. Data hasil uji aktivitas antibakteri fraksi air
1. Data hasil uji aktivitas antibakteri fraksi air terhadap Escherichia colidan Lactobacillus acidophillus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Escherichia coli Lactobacillus acidophillus
D1 D2 D3 D* D1 D2 D3 D*
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
- : Tidak terdapat daerah hambatan pertumbuhan bakteri Blanko : DMSO
2. Data hasil uji aktivitas antibakteri fraksi air terhadap Pseudomonas areginosa dan Staphylococcus aureus
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Pseudomonas areginosa Staphylococcus aureus
3. Data hasil uji aktivitas antibakteri fraksi air terhadap Streptococcus mutans dan Vibrio cholerae
No. Konsentrasi (mg/mL)
Diameter Daerah Hambatan (mm)
Streptococcus mutans Vibrio cholerae
D1 D2 D3 D* D1 D2 D3 D*
1. 500 10,1 9,7 10,2 10,00 11,2 11,4 10,7 11,10 2. 400 9,0 8,6 9,1 8,90 9,3 10,2 9,9 9,80 3. 300 8,7 7,8 8,4 8,30 7,5 8,3 7,6 7,80 4. 200 6,1 6,1 6,1 6,10 6,3 7,3 7,1 6,90
5. 175 - - - -
6. 150 - - - -
7. 125 - - - -
8. 100 - - - -
9. 75 - - - -
10. 25 - - - -
11. Blanko - - - -
Keterangan: D : Diameter daerah hambatan pertumbuhan bakteri * : Rata-rata
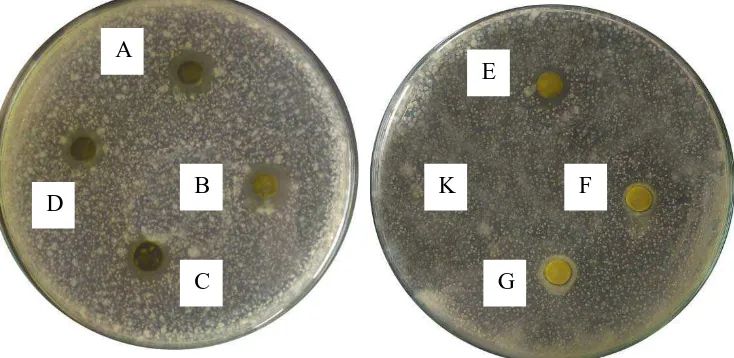
Lampiran 13. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot
1. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot terhadap
Escherichia coli
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, F
E A
B
D
C
E
G
H
I
Lampiran 13. (lanjutan)
1. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot terhadap Lactobacillus acidophillus
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko A
I B
C
K D
F
G
H I H
J
Lampiran 13. (lanjutan)
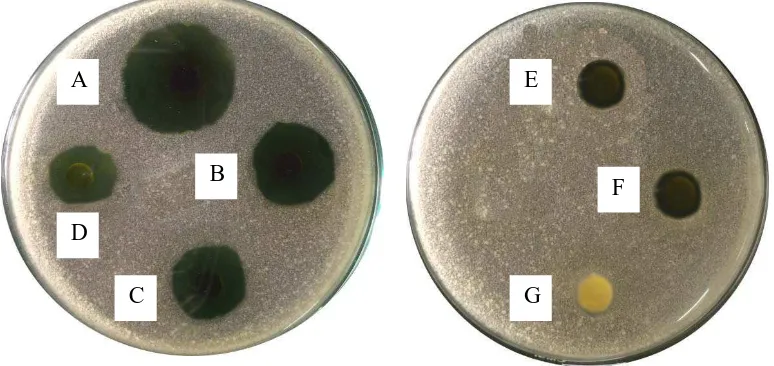
1. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot terhadap Pseudomonas aeroginosa
Keterangan : A, B, C, D, E, F dan G konsentrasi berturut-turut 500, 400, 300, 200, 100, 75 dan 25 mg/ml
K = blanko A
B D
E
F
G C
2. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot terhadap Staphylococcus aureus
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko
B A
C D
E
F G
H
I
Lampiran 13. (lanjutan)
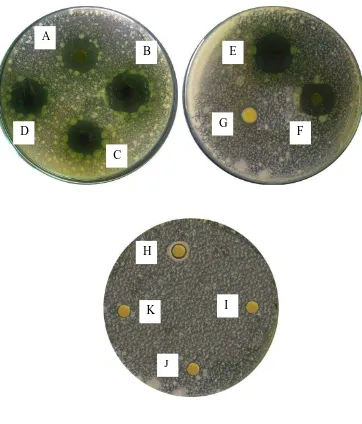
1. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot terhadap
Streptococcus mutans
Keterangan : A, B, C, D, E, F dan G konsentrasi berturut-turut 500, 400, 300, 200, 100, 75 dan 25 mg/ml
K= blanko A
B
C
E
F
G D
1. Gambar pengujian aktivitas antibakteri ekstrak etanol daun sijukkot terhadap
Vibrio cholerae
Keterangan : A, B, C, D, E, F dan G konsentrasi berturut-turut 500, 400, 300, 200, 100, 75 dan 25 mg/ml
K = blanko A
B
C
E
D
F
Lampiran 14. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot
1. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot terhadap Escherichia coli
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko
H
I
J A
B
C D
E
F
G
1. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot terhadap Lactobacillus acidophillus
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko A
B
C D
E
F
G
H
I
Lampiran 14. (lanjutan)
2. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot terhadap Pseudomonas aeroginosa
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko
F E
A
G D
C B
H
I K
3. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot terhadap Staphylococcus aureus
Keterangan : A, B, C, D, E, F dan G konsentrasi berturut-turut 500, 400, 300, 200, 100, 75 dan 25 mg/ml
K = blanko
B
C
E
F
G A
Lampiran 14. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot terhadap Streptococcus mutans
Keterangan : A, B, C, D, E, F dan G konsentrasi berturut-turut 500, 400, 300, 200, 100, 75 dan 25 mg/ml
K = blanko A
B
C D
E
F
1. Gambar pengujian aktivitas antibakteri fraksi n-heksana daun sijukkot terhadap Vibrio cholera
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko A
B
C
E
D
F
G
H
K
I
Lampiran 15. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot
1. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot terhadap Escherichia coli
A
B
E
F
G
H
K
I
J C
1. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot terhadap
Lactobacilus acidophillus
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko C
D
G A
B
E
Lampiran 15. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot terhadap
Pseudomonas aeroginosa
A
B
C D
E
F
G
H
K
I
Lampiran 15. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot terhadap
Staphylococcus aureus
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko A
B
C D
E
F G
H
I K
Lampiran 15. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot terhadap
Streptococcus mutans
A
B
C D
E
F
G
H
K
Lampiran 15. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi etilasetat daun sijukkot terhadap Vibrio cholera
Keterangan : A, B, C, D, E, F, G, H, I, dan J konsentrasi berturut-turut 500, 400, 300, 200, 100, 75, 25, 20, 15, dan 10 mg/ml
K = blanko A
B
C
E
D
F
G
H
I K
Lampiran 16. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi air daun sijukkot terhadap
Lactobacillus acidophilus
A
B
C D
E
F
G
K
H
I
Lampiran 16. (lanjutan)
1. Gambar pengujian aktivitas antibakteri fraksi airdaun sijukkot terhadap
Pseudomonas aeruginosa
Keterangan : A, B, C, D, E, F, G, H, I. J konsentrasi berturut-turut 500, 400, 300, 200, 175, 150, 125, 100, 75 dan 25 mg/ml
K = blanko A
B
C D
E
F
G
I H
Lampiran 16. (lanjutan)
2. Gambar pengujian aktivitas antibakteri fraksi airdaun sijukkot terhadap Staphylococcus aureus
A
B
C D
E
F
G
K H
I
Lampiran 16. (lanjutan)
3. Gambar pengujian aktivitas antibakteri fraksi airdaun sijukkot terhadap Streptococcus mutans
Keterangan : A, B, C, D, E, F, G, H, I. J konsentrasi berturut-turut 500, 400, 300, 200, 175, 150, 125, 100, 75 dan 25 mg/ml
K = blanko A
B
C D
E
F
G
K H
I
Lampiran 16. (lanjutan)
4. Gambar pengujian aktivitas antibakteri fraksi airdaun sijukkot terhadap Vibrio cholera
Keterangan : A, B, C, D, E, F, G, H, I. J konsentrasi berturut-turut 500, 400, 300, A
B
C
E
D
F
G
K H
I
Amelia, S. (2005). Vibrio cholerae. Skripsi. Medan: Universitas Sumatera Utara. Anandh, B.P.V., Sabitha, K.E., dan Shymaladevi, C.S. (2006). Green Tea Extract
Impedes Dyslipidemia and Development of Cardiac Dysfunction in Streptozotocin-diabetic rats. Clin Exp Pharmacol Physiol. 33(12): 1184-9. Ayuningtyas, P. (2009). Uji Antibakteri Fraksi Kloroform Ekstrak Etanol Kayu
Secang (Caesalpinia sappan L.) terhadap Staphylococcus aureus dan Shigella dysentriae serta Bioautobiografinya. Skripsi. Surakarta: Universitas Muhammadiyah Surakarta Fakultas Farmasi.
Depkes RI. (1995). Materia Medika Indonesia. Jilid Keenam. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 333-337.
Depkes. (2000). Parameter StandarUmumEkstrakTumbuhanObat. Jakarta: Depkes RI. Hal. 1, 9-12, 17.
Depkes RI. (2011). Pedoman Umum Penggunaan Antibiotik.Jakarta: Departemen Kesehatan Republik Indonesia. Halaman4.
Difco Laboratories. (2009). Difco & BBL Manual of Microbiological Culture Media. Edisi Kedua. USA: Becton, Dickinson and Company 7 Loveton Circle. Halaman 398, 402.
Ditjen POM RI. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan. Halaman 891-898.
Dwidjoseputro. (1978). Dasar- DasarMikrobiologi. Jakarta:PenerbitDjambatan. Halaman 15-17.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences. 55(3): 259-260, 262, 264-266.
Gaman,P.M. danSherrington,K.B. (1992). IlmuPangan, PengantarIlmuPanganNutrisidanMikrobiologi. Yogyakarta: Gajah Mada University Press. Halaman 248.
Hardiningsih, R., R., Napitupulu, N. R., dan Yulineri, T. (2006). Isolasi dan Uji Resistensi Beberapa Isolat Lactobacillus pada pH Rendah. Biodiversitas.7 (1): 15-17.
Harborne, J.B. (1987). Metode Fitokimia: Penuntun Cara Modern Menganalisa Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Terbitan Kedua. Bandung: ITB. Halaman 71, 130-147.
Hariana, A. (2006). TumbuhanObatdanKhasiatnya. Edisi Ketiga. Jakarta: PenerbitPenebarSwadaya. Halaman 135-136.
Ikhwan, K.( 2007). Si Jukkot, Tumbuhan Langka Makanan Sisingamangaraja XII.
Jawetz, E., Menick, J.L., dan Adelberg, E.A. (2013). Medical Microbiology. Twenty-Sixth Edition. United States: The McGraw-Hill Companies. Halaman 169.
Joung, Y. H., Kim, H. R., Lee, M. K., dan Park, A. J. (2007). Fluconazole Suspectibility Testing of Candida Species by Flow Cytometry. J. Infect. 54: 504-508.
Lay, B.W., dan Sugyo, H. (1992). Mikrobiologi. Cetakan Pertama. Jakarta: Penerbit Rajawali Press. Halaman 32.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoid. Terjemahan Kosasih Padmawinata. Bandung: ITB. Halaman 8-9.
Marliana, E dan Saleh, C. (2001). Uji Fitokimia dan Aktivitas Antibakteri Ekstrak Kasar Etanol, Fraksi n-Heksana dan Metanol dari Buah Labu Air (Lagenari siceraria (Molina) Standl. Jurnal Kimia Mulawarman 8(2): 63. Merck. (2005). Merck Microbiology Manual. Edisi Keduabelas. Berlin: Merck.
Halaman 370-371.
Mayasari, E. (2005). Pseudomonas aeruginosa: Karakteristik, Infeksi dan Penanganan. Skripsi. Universitas Sumatera Utara.
(Drimys becariana. Gibbs). Chem. Prog 6(1): 33-37.
Pratiwi, S.T. (2008). Mikrobiologi Farmasi. Jakarta: Penerbit Erlangga. Halaman 6.
Robinson, T. (1995). KandunganOrganikTumbuhan Tinggi. Edisi Keenam. Bandung: Penerbit ITB. Halaman 191.
Rosyidah, A.N., Lestari., Pujiana, E., Astuti., dan Pudji. (2014). Daya Antibakteri Ekstrak Daun Kendali (Hippobroma longiflora[L] G. Don) terhadap Pertumbuhan Streptococcus mutans. Artikel Ilmiah Hasil Penelitian Mahasiswa 2014.
Rosyidah, K., Nurmuhaimin, S. A., Komari, N., dan Astuti, M. D. (2010). Aktivitas Antibakteri Fraksi Saponin Dari Kulit Batang Tumbuhan Kasturi (Mangifera casturi). Alchemy 1(2): 65-68.
Ryan, K. J., dan Ray, C. G. (2004). Medical Microbiology. Edisi Keempat. New York: McGraw Hill. Halaman 260-271.
Sabir, A. (2005). Aktivitas Antibakteri Flavonoid Propolis Trigona sp. terhadap Bakteri S.mutans (in vitro). Majalah Kedokteran Gigi. 38 (3). 135-141. Sukadana, I. M., Sri, R. S., dan Juliarti, N. K. (2008). Aktivitas Antibakteri
Senyawa Golongan Triterpenoid Dari Biji Pepaya (Carica papaya L.). Jurnal Kimia. 2(1): 15-18.
Sukmono, R.J. (2009). Mengatasi Aneka Penyakit dengan Terapi Herbal. Jakarta: PT. Agromedia Pustaka. Halaman 15-17.
Suriawira, U. (2005). Mikrobiologi Dasar. Jakarta: Papas Sinar Sinanti. Halaman 22-25.
Syamsuni.(2006).Farmasetika Dasar dan HitunganFarmasi.Jakarta: PenerbitBuku Kedokteran EGC. Halaman 29 – 31.
Tim Mikrobiologi FK Universitas Brawijaya. (2003). Bakteriologi Medik. Cetakan Pertama. Malang: Bayu Media Publishing. Hal.134, 141-154, 217.
Trease, G.E., dan Evans, W.C. (1983). Pharmacognosy. Edisi Keduabelas. London: Bailliere Tindall. Halaman 220-221.
Waluyo, L. (2010). TeknikdanMetodeDasar dalamMikrobiologi. Malang: UPT PenerbitanUniversitasMuhammadiyah. Halaman 19-33.
Characteristics of Extract from Lactuca indica. Journal of Agricultural and Food Chemistry. 51: 1506-1512.
WHO. (1998). Quality Control Methods for Herbal Materials. Switzerland: Printed in Malta. Halaman 33-35.
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental meliputi penyiapan alat, bahan dan pereaksi, pengambilan bahan tumbuhan, identifikasi tumbuhan, pembuatan simplisia, karakterisasi simplisia, pembuatan ekstrak etanol daun sijukkot, skrining fitokimia dan uji aktivitas antibakteri secara in vitro terhadap Escherichia coli, Lactobacillus acidophillus, Pseudomonas aeruginosa,
Staphylococcus aureus, Streptococcus mutans dan Vibrio cholerae dengan
metode difusi agar.
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan pada bulan November 2015 sampai dengan Februari 2016 di Laboratorium Fitokimia dan Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara.
3.2 Alat dan Bahan 3.2.1 Alat
(Yenaco), pencadang kertas,pipet mikro (Eppendorf), penguap vakum putar (Haake D), seperangkat alat destilasi penetapan kadar air.
3.2.2 Bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah daun sijukkot (Lactuca indica L.). Bahan kimia yang digunakan jika tidak disebutkan adalah berkualitas pro analisa yaitu: asam klorida pekat, asam nitrat pekat, asamsulfat pekat, asam asetat anhidrida, amil alkohol, α-naftol, besi (III) klorida, bismuth nitrat, serbuk magnesium, timbal (II) asetat dan toluene, etanol 96%, iodium, isopropanol, kalium iodida, klorofom, metanol, merkuri (II) klorida, Nutrient Agar (Merck),Nutrient Broth (Merck), Biakan bakteri Escherichia coli(ATCC 8939), Lactobacillus acidophilus(ATCC 4356), Pseudomonas
aeruginosa(ATCC 9027), Staphylococcus aureus (ATCC 25923), Streptococcus
mutans (ATCC 25175)dan Vibrio cholerae (ATCC 14035).
3.3 Penyiapan Sampel
Penyiapan sampel meliputi pengambilan bahan tumbuhan, identifikasi tumbuhan, pembuatan dan karakterisasi simplisia dan pembuatan ekstrak etanol daun sijukkot (Lactuca indicaL.).
3.3.1 Pengambilan bahan tumbuhan
Identifikasi tumbuhan dilakukan oleh Dr. Marline Nainggolan, M.S., Apt (2015) di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Pembuatan simplisia
Bagian yang digunakan adalah daun sijukkot, dibersihkan dari kotoran yang melekat, dicuci dengan air bersih, ditiriskan, kemudian dikeringkan di lemari pengering hingga kering. Daun telah kering apabila sudah rapuh (bila diremas menjadi hancur) kemudian diserbuk dengan menggunakan blender, serbuk simplisia disimpan dalam wadah plastik tertutup rapat.
3.3.4 Karakterisasi simplisia
Pemeriksaan karakterisasi simplisia meliputi penetapan kadar air yang dilakukan menurut prosedur World Health Organization (1992); pemeriksaan makroskopik, mikroskopik, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam dilakukan menurut prosedur Ditjen POM (1995).
3.3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik terhadap simplisia daun sijukkot meliputi pemeriksaan bentuk, bau, warna dan rasa dan juga dilakukan pemeriksaan makroskopik terhadap daun sijukkotsegar.
3.3.4.2 Penetapan kadar air a. Penjenuhan toluen
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama ± 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,1 ml. b. Penetapan kadar air simplisia
Labu berisi toluen tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kecepatan toluen diatur 2 tetes per detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik dan setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar dan setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,1 ml. Selisih kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen.
3.3.4.3 Penetapan kadar sari yang larut dalam air
yang telah ditara, sisanya dipanaskan pada suhu 105oC sampai bobot tetap. Hitung kadar dalam persen sari yang larut dalam air.
3.3.4.5 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar pada suhu 600oC sampai arang habis dan selanjutnya didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara.
3.3.4.6 Penetapan kadar abu yang tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu dan dicuci dengan air panas. Residu dan kertas saring dipijar pada suhu 600oC sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan.
3.4 Pembuatan Larutan Pereaksi
3.4.1 Pereaksi Mayer
Sebanyak 2,266 g raksa (II) klorida dilarutkan dalam air suling hingga 100 ml dan pada wadah lain dilarutkan 50 g kalium iodida dalam 100 ml air suling. 60 ml larutan I dicampurkan dengan 10 ml larutan II dan ditambahkan air suling hingga 100 ml
3.4.2 Pereaksi Dragendorff
Sebanyak 8 g bismuth nitrat dilarutkan dalam asam nitrat 20 ml kemudian dicampur dengan larutan kalium iodida sebanyak 27,2 g dalam 50 ml air suling.Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air secukupnya hingga 100 ml.
3.4.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling kemudian ditambah 2 g iodium sambil diaduk sampai larut, lalu ditambah air suling hingga 100 ml.
3.4.4 Pereaksi Molisch
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N secukupnya
hingga diperoleh larutan 100 ml.
3.4.5 Pereaksi Liebermann-Burchard
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air hingga 100 ml.
3.4.8 Larutan asam klorida 2 N
Sebanyak 16,67 ml asam klorida pekat diencerkan dalam air suling hingga volume 100 ml.
3.4.9 Larutan asam sulfat 2 N
Sebanyak 5,4 ml asam sulfat pekat diencerkan dalam air suling hinggavolume 100 ml.
3.5 Skrining Fitokimia
Skrining fitokimia dilakukan terhadap daun sijukkot segar, simplisia daun sijukkot dan ekstrak etanol daun sijukkot meliputi pemeriksaan senyawa kimia golongan alkaloid, glikosida, saponin (Ditjen POM, 1995); tanin, flavonoida, triterpenoid dan steroid (Farnsworth, 1966).
3.5.1 Pemeriksaan triterpenoida/steroida
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksana selama 2 jam, disaring, filtrat diuapkan dan sisanya ditambahkan pereaksi Liebermann- Burchard. Jika terbentuk warna ungu atau merah yang berubah menjadi biru ungu atau biru kehijauan menunjukkan adanya triterpenoid/steroid bebas dalam sampel uji.
3.5.2 Pemeriksaan alkaloida
dinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut: a.Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer b.Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat c.Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorf
Alkaloida dianggap positif jika terjadi endapan atau paling sedikit dua atautiga dari percobaan di atas.
3.5.3 Pemeriksaan glikosida
Sampel ditimbang sebanyak 3 g kemudian disari dengan 30 ml campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling. Direfluks selama 30 menit, didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, lalu didiamkan selama 5 menitdan disaring. Filtrat disari dengan 20 ml campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut, yaitu 0,1 ml larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molisch, kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat. Glikosida positif jika terbentuk cincin ungu. 3.5.4 Pemeriksaan flavonoida
Sebanyak 1 g sampel dididihkan selama 3 menit dalam 10 ml air suling lalu didinginkan dan disaring. Filtrat diencerkan sampai hampir tidak berwarna, kemudian ditambahkan 1-2 tetes pereaksi besi (III) klorida 1% (b/v), jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin.
3.5.6 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin.
3.6Pembuatan Ekstrak Etanol Daun Sijukkot (EEDS)
3.6.1 Pembuatan fraksi n-heksana, fraksi etilasetat dan fraksi air
Sebanyak 10 g ekstrak etanol ditambahkan 10 ml aquadest lalu ditambahkan 40 mln-heksana, dikocok dalam corong pisah dan dibiarkan sampai memisah dan dipisahkan, selanjutnya difraksinasi kembali dengan menggunakann-heksana hingga diperoleh fraksi n-heksana yang tidak memberikan reaksi positif dengan penambahan pereaksi Lieberman-Burchard, kemudian fraksi air ditambahkan 50 ml etilasetat, dikocok dan dibiarkan memisah. Lapisan etilasetat dipisahkan dan fraksinasi dilanjutkan sampai diperoleh fraksi etilasetat yang tidak memberikan hasil positif dengan penambahan pereaksi FeCl3. Kumpulan hasil fraksi n-heksana, fraksi etilasetat
dan fraksi sisa (air) masing-masing diuapkan dengan penguap vakum putarpada temperatur ± 40°C sampai diperoleh ekstrak kental, lalu dikeringkan dengan penangas air.
3.7Uji Aktivitas Antibakteri 3.7.1 Sterilisasi alat
Meat extract 3,0 g
Agar-agar 12,0 g
Air suling ad 1 L Cara pembuatan:
Sebanyak 20 g nutrient agar ditimbang, disuspensikan ke dalam air suling sebanyak 1000 ml, lalu dipanaskan sampai bahan larut sempurna lalu disterilkan di dalam otoklaf pada suhu 121oC selama 15 menit (Merck, 2005).
3.7.2.2 Nutrient broth Komposisi : Peptone 5,0 g meat extract 3,0 g Air suling ad 1 L Cara pembuatan:
Sebanyak 8 g serbuk nutrient broth dilarutkan dalam air suling steril sedikit demi sedikit kemudian volumenya dicukupkan hingga 1 L dengan bantuan pemanasan sampai semua bahan larut sempurna, kemudian disterilkan di otoklaf pada suhu 121oC selama 15 menit (Merck, 2005).
3.7.3 Pembuatan media agar miring
Sepuluh ml media agar yang telah dimasak dimasukkan kedalam tabung reaksi, ditutup dan dibungkus lalu disterilkan di dalam otoklaf selama 15 menit pada suhu 121oC pada tekanan 15 psi. Kemudian tabung yang berisi media agar diletakkan pada kemiringan 30-45oC. Diperhatikan bahwa agar tidak menyentuh tutup tabung. Agar dibiarkan menjadi dingin dan keras (Lay, 1992).
3.7.4 Pembiakan bakteri
Masing-masing sebanyak satu ose dari biakan murni bakteriStaphylococcus aureus, Streptococcus mutans, Lactobacillus acidophillus, Pseudomonas aeruginosa, Escherichia coli dan Vibrio choleraedigoreskan
dengan metode sinambung pada permukaan media agar miring, ditutup mulut tabung reaksi dengan kapas. Diinkubasi selama 18-24 jam pada suhu 37oC.
3.7.4.2 Persiapan inokulum bakteri
Stok kultur bakteri Staphylococcus aureus, Streptococcus mutans, Lactobacillus acidophillus, Pseudomonas aeruginosa, Escherichia coli dan Vibrio
cholerae. yang telah tumbuh diambil dengan jarum ose steril lalu disuspensikan
kedalam tabung yang berisi 10 ml media nutrient broth. Diinkubasi 1-2 jam. Kemudian diukur kekeruhan larutan dengan spektrofotometer visibel pada panjang gelombang 580 nm, diperoleh transmitan 25% (konsentrasi 106 CFU/ml) sesuai dengan standar Mc Farland nomor 0,5 (Difco Laboratories, 1977).
3.7.5 Pembuatan larutan uji dengan berbagai konsentrasi
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian Biologi- LIPI Bogor, menunjukkan bahwa tumbuhan yang diteliti adalah tumbuhan Lactuca indica L., suku Compositae.
4.2 Hasil Pemeriksaan Karakterisasi
Hasil pemeriksaan makroskopik simplisia daun sijukkot yaitu daun tunggal, berseling, ujung meruncing pangkal runcing, tepi bergerigi , pertulangan menyirip, menonjol di bawah, permukaan licin dan berwarna hijau pucat dengan ungu.Hasil pemeriksaan karakteristik serbuk simplisia daun sijukkot dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil pemeriksaan karakteristik serbuk simplisia daun sijukkot
No Parameter Kadar (%)
1 Kadar air 5,99%
2 Kadar sari larut air 15,68%
3 Kadar sari larut etanol 16,20%
4 Kadar abu total 13,45%
5 Kadar abu tidak larut asam 0,59%
jamur atau serangga, serta mendorong kerusakan mutu simplisia yang digunakan (WHO, 1992).
Penetapan kadar sari dilakukan menggunakan dua pelarut, yaitu air dan etanol, Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa kimia bersifat polar yang terkandung di dalam simplisia, sedangkan kadar sari larut dalam etanol dilakukan untuk mengetahui kadar senyawa larut dalam etanol, baik senyawa polar maupun non polar. Hasil karakterisasi simplisia daun sijukkot menunjukkan kadar sari yang larut dalam air sebesar 15,68%, sedangkan kadar sari yang larut dalam etanol sebesar 16,20%.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri yang terdapat di dalam sampel (Ditjen POM RI, 2000; WHO., 1992). Kadar abu tidak larut asam untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO., 1992). Penetapan kadar abu pada simplisia daun sijukkot menunjukkan kadar abu total sebesar 13,45% dan kadar abu tidak larut dalam asam sebesar 0,59%.
Monografi simplisia daun sijukkot tidak terdaftar di buku Materia Medika Indonesia (MMI), sehingga perlu dilakukan pembakuan secara nasional mengenai parameter karakterisasi simplisia daun sijukkot. Hasil perhitungan karakterisasi simplisia daun sijukkot dapat dilihat pada Lampiran 7, halaman 36-40.
4.3 Hasil Ekstraksi dan Fraksinasi
78,85 g, danhasil fraksinasi ekstrak etanol sebanyak 40 g dengan cara ekstraksi cair-cair diperoleh fraksi n-heksana 3,46 g, fraksi etilasetat sebesar 1,6 g dan fraksi air 35,5 g.
4.4 Hasil Skrining Fitokimia Serbuk Simplisia
Hasil skrining fitokimia terhadap serbuk simplisia diketahui bahwa serbuk simplisia daun sijukkot mengandung golongan senyawa-senyawa kimia seperti yang terlihat pada Tabel 4.2 berikut ini.
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia
No. Pemeriksaan Hasil
1. Alkaloid -
7. Steroid/ Triterpenoida +
Keterangan: (+) : mengandung golongan senyawa (-) : tidak mengandung golongan senyawa
Menurut Robinson (1995), senyawa metabolit sekunder seperti senyawa flavonoid, saponin, tanin dan triterpenoid/steroida merupakan senyawa kimia yang memiliki potensi sebagai antibakteri dan antivirus.
karena metode ini lebih praktis namun tetap dapat memberikan hasil yang diharapkan.
Hasil uji aktivitas antibakteri EEDS, FHDS, FEDS dan FADS dapat menghambat pertumbuhan semua bakteri uji yang digunakan. Aktivitas suatu zat antimikroba dalam menghambat pertumbuhan atau membunuh mikroorganisme tergantung pada konsentrasi dan jenis bahan antimikroba tersebut (Tim Mikrobiologi FK Brawijaya, 2003).
Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri rata-rata dapat dilihat pada Lampiran 8-11 halaman 50-70 dan hasil rata-ratanya dapat dilihat pada Tabel 4.3 sampai 4.8.
Tabel 4.3 Hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri uji pada ekstrak etanol
Keterangan:
E.c = Escherichia coli S.a =Staphylococcus aureus
L.a = Lactobacillus acidophilus S.m =Streptococcus mutans P.a = Pseudomonas aeruginosa V.c =Vibrio cholerae - = Tidak terdapatdaerah hambatan pertumbuhan bakteri DMSO = dimetilsulfoksida
No. Konsentrasi (mg/mL)
Diameter Rata-rata Daerah Hambatan (mm)
Tabel 4.4 Hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri uji pada fraksi n-heksana
Keterangan:
E.c = Escherichia coli S.a =Staphylococcus aureus L.a = Lactobacillus acidophilus S.m =Streptococcus mutans P.a = Pseudomonas aeruginosa V.c =Vibrio cholerae - = Tidak terdapatdaerah hambatan pertumbuhan bakteri DMSO = dimetilsulfoksida
Tabel 4.5 Hasil pengukuran diameter rata-rata daerah hambatan pertumbuhan bakteri uji pada fraksi etilasetat
No. Konsentrasi (mg/mL)
Diameter Rata-rata Daerah Hambatan (mm)
E. c L. a P. a S. a S. m V.c
bakteri uji pada fraksi air
Keterangan:
E.c = Escherichia coli S.a =Staphylococcus aureus L.a = Lactobacillus acidophilus S.m =Streptococcus mutans P.a = Pseudomonas aeruginosa V.c =Vibrio cholerae - = Tidak terdapatdaerah hambatan pertumbuhan bakteri DMSO = dimetilsulfoksida
Berdasarkan pada hasil pengukuran aktivitas antibakteri yang terlihat pada Tabel 4.3 sampai 4.8 diperoleh konsentrasi hambat minimum (KHM) pada ekstrak etanol berturut-turut 20 mg/ml (Escherichia coli dan Lactobacillus acidophilus), 25 mg/ml (Staphylococcus aureus), 75 mg/ml (Vibrio cholerae), 100 mg/ml (Pseudomonas aeruginosa), 200 mg/ml (Streptococcus mutans); pada fraksi n-heksana KHM berturut-turut 15 mg/ml (Lactobacillus acidophilus), 20 mg/ml (Escherichia coli dan Vibrio cholerae), 25 mg/ml (Pseudomonas aeruginosa), 100 mg/ml (Staphylococcus aureus), 200 mg/ml (Streptococcus mutans); pada fraksi etilasetat KHM berturut-turut 15 mg/ml (Escherichia coli,Pseudomonas aeruginosa, Streptococcus mutans), 20 mg/ml (Staphylococcus aureus), 25
mg/ml (Vibrio cholerae), 75 mg/ml (Lactobacillus acidophilus); pada fraksi air KHM 200 mg/ml (Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Vibrio cholerae), 175 mg/ml (Lactobacillus acidophilus).
No. Konsentrasi (mg/mL)
Hasil pengukuran diameter zona hambat pada bakteri Escherichia coli diperoleh bahwa urutan ekstrak/fraksi dari yang paling aktifyaitu fraksi etilasetat, fraksi n-heksana, ekstrak etanol dan fraksi air; pada bakteri Lactobacillus acidophilusyaitu fraksi n-heksana, ekstrak etanol, fraksi etilasetat, dan fraksi air;
pada bakteri Pseudomonas aeruginosa yaitu fraksi etilasetat, fraksi n-heksana, ekstrak etanol dan fraksi air; pada bakteri Staphylococcus aureusyaitu fraksi etilasetat, ekstrak etanol, fraksi n-heksana dan fraksi air; pada bakteri Streptococcus mutans yaitu fraksi etilasetat, fraksi n-heksana, ekstrak etanol dan
fraksi air; pada bakteri Vibrio cholerae yaitu fraksi n-heksana, fraksi etilasetat, esktrak etanol dan fraksi air. Dari hasil uji yang dilakukan diperoleh bahwa fraksi etilasetat dari daun sijukkot memberikan aktivitas yang terkuat dibanding dengan ekstrak etanol, fraksi n-heksana dan fraksi air dalam menghambat pertumbuhan Escherichia coli, Lactobacillus acidophilus, Pseudomonas aeruginosa,
Staphylococcus aureus, Streptococcus mutans dan Vibrio cholerae. Hal ini
dikarenakan kandungan senyawa metabolit sekunder yang terdapat dalam fraksi etilasetat daun sijukkot memiliki aktivitas antibakteri yaitu adanya senyawa flavonoid dan saponin yang terdapat paling banyak pada fraksi etilasetat.
mekanisme yang berbeda dikemukakan oleh Di Carlo, et al., (1999) dan Estrela, et al., (1995) dalam Sabir (2005) yang menyatakan bahwa gugus hidroksil pada struktur senyawa flavonoid menyebabkan perubahan komponen organik dan transpor nutrisi yang akan mengakibatkan timbulnya efek toksik terhadap bakteri. Mekanisme kerja tanin sebagai antibakteri adalah menghambat enzim reverse transcriptase dan DNA topoisomerase sehingga sel bakteri tidak dapat terbentuk (Nuria et al., 2009). Saponin digunakan sebagai antimikroba pada beberapa tahun terakhir. Mekanisme kerja saponin sebagai antibakteri adalah menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas/kebocoran sel dan mengakibatkan senyawa intraseluler akan keluar (Robinson, 1995).
Aktivitas antibakteri ekstrak etanol lebih rendah dibandingkan dengan dengan fraksi etilasetat. Menurut Marliana (2011), hal ini disebabkan karena adanya kerja yang tidak sinergis antara senyawa metabolit sekunder dalam ekstrak etanol dalam peranannya sebagai antibakteri. Hal tersebut juga dapat disebabkan oleh kuantitas dari senyawa metabolit sekunder yang bersifat antibakteri kuat di dalam ektrak etanol lebih sedikit dibandingkan fraksi etilasetat.
Hasil uji aktivitas antibakteri fraksi air lebih rendah dibandingan fraksi etilasetat. Hal ini disebabkan oleh kandungan senyawa yang terdapat dalam fraksi air sangat sedikit karena senyawa metabolit sekunder yang memiliki aktivitas antibakteri kuat telah ditarik oleh pelarut etilasetat sehingga hanya tersisa beberapa senyawa metabolit sekunder dengan kuantitas yang sedikit.
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Hasil penelitian yang dilakukan terhadap daun sijukkot (Latuca indica L.) diperoleh kesimpulan:
1. Hasil karakterisasi simplisia daun sijukkot diperoleh kadar air 5,99%, kadar sari larut air 15,68%, kadar sari larut etanol 16,24%, kadar abu 13,45% dan kadar abu tidak larut asam 0,59%.
2. Hasil skrining serbuk simplisia menunjukkan hasil positif pada steroida/triterpenoid, flavonoid, glikosida, dan saponin.
3. Aktivitas antibakteri yang terkuat diberikan oleh fraksi etilasetat dibandingkan ekstrak etanol, fraksi n-heksana dan fraksi air dengan KHM 15 mg/ml (Escherichia coli, Pseudomonas aeruginosa, Streptococcus mutans); 20 mg/ml (Staphylococcus aureus);25 mg/ml (Vibrio cholerae);
75 mg/ml (Lactobacillus acidophilus).
5.2 Saran
Disarankan pada peneliti selanjutnya:
1. Untuk melakukan isolasi dan elusidasi senyawa metabolit sekunder dari daun sijukkot.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Sijukkot termasuk jenis tumbuhan dari daerah: sijukkot (Sunda); kuban kayu rana, sawi rana, tempuh wiyang, sawi belanda (Jawa) (Zuhud, 2013).
Tumbuhan ini tumbuh pada ketinggian800 - 2000 m dari permukaan laut,penyebarannya meliputi Jawa dan Sumatera.
2.1.1 Sistematika tumbuhan
Sistematika tumbuhan sijukkot adalah sebagai berikut (LIPI, 2005):
Kingdom
dan lebar 1-10 cm, pertulangan menyirip, menonjol di bawah, permukaan licin dan berwarna hijau pucat dengan ungu. Bunga majemuk terletak secara terminal, bentuk tandu berganda, panjang tangkai 1 cm, tertutup, berbentuk segitiga berwarna hijau, kelopak (berbagi 3, ujung lepas berbagi 8, ujung runcing, panjang 3-13 cm dan perhiasan bunga lengkap) benang sari dan putik banyak serta berwarna kuning tua, mahkota (lepas, bentuk sudip pangkal runcing, ujung rata, bergerigi, panjang 1-1,5 cm dan berwarna kuning muda). Buah lonjong, pipih keras dan berwarna hitam. Biji kecil, halus dan berwarna putih. Akar masif, tidak rata dan bewarna putih kotor (Zuhud, 2013).
2.1.3 Kandungan kimia tumbuhan
Sijukkot kaya akansaponin, kardenolin dan polifenol (Hariana, 2006). 2.1.4 Kegunaan tumbuhan
Sijukkot merupakan lalapan utama raja Sisingamangaraja XII saat perang gerilya melawan Belanda yang diyakini warga sebagai tumbuhan yang memiliki banyak khasiat, di antaranya sebagai penambah nafsu makan, memperlancar pencernaan, menambah stamina, mengobati penyakit gondok (kreatin), mengobati sakit lambung (maag), menurunkan kolesterol, kadar gula darah dan risiko serangan kanker (Ikhwan, 2007).
2.2Uraian Golongan Senyawa Kimia Sijukkot
2.2.1 Flavonoid
Flavonoid mengandung 15 atom karbon dalam inti dasarnya mempunyai struktur C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan oleh tiga atom karbon yang merupakan rantai alifatik. Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah menjadi flavonoid atau senyawa yang berkaitan erat dengannya. Sebagian besar tanin berasal dari flavonoid sehingga merupakan salah satu golongan fenol alam yang terbesar (Markham, 1988).
Flavonoid mencakup banyak pigmen dan terdapat pada seluruh dunia tumbuhan mulai dari fungus sampai angiospermae. Flavonoid mempunyai banyak fungsi dalam tubuh tumbuhan. Beberapa fungsi utamanya adalah untuk tumbuhan yaitu pengaturan tumbuh, pengaturan fotosintesis, kerja antimikroba dan antivirus dan anti serangga (Robinson, 1995).
2.2.2Glikosida
dihubungkan oleh atom N. Contoh: Adenosine.
d. C-glikosida, yaitu senyawa glikosida yang memiliki ikatan antara glikon dan aglikonnya dihubungkan oleh atom C. Contoh: Barbaloin.
2.2.3Tanin
Tanin terdapat luas pada tumbuhan berpembuluh. Tanin dapat bereaksi dengan protein membentuk kopolimer yang tak larut dalam air. Sebagian besar tumbuhan banyak mengandung tanin rasanya sepat. Salah satu fungsi tanin dalam tumbuhan ialah sebagai penolak hewan pemakan tumbuhan (Robinson, 1995).
Berdasarkan identitas inti fenolit dan cara pembentukannya, tanin dibagi menjadi tiga yaitu tanin yang terhidrolisis, tanin yang terkondensasi dan tanin kompleks (Trease dan Evans, 1983).
a. Tanin terhidrolisis (hydrosable tannin)
Tanin jenis ini biasanya berikatan pada karbohidrat dengan membentuk jembatan oksigen dan dapat dihidrolisis menggunakan asam sulfat atau asam klorida ataupun dengan enzim. Prekursor pembentukan tanin ini adalah asam fenolit (asam galat, asam elagit), residu glukosa, serta antara asam fenolit dan glukosa ada ikatan ester.
b. Tanin terkondensasi (condesed tannins)
melalui C8 dengan C4. Prekursor pembentukan tanin ini adalah flavanoida, catechin, flavonol-3-4-diol.
c. Tanin kompleks (complex tannin)
Tanin kompleks merupakan campuran antara tanin terhidrolisis dan tanin terkondensasi. Contoh tumbuhan yang mengandung tanin kompleks adalah teh, kuercus, dan castanea. Ada dua tipe dari tanin kompleks, yaitu true tannin (berat molekul 1000-5000) dan pseudo tannin (berat molekul kurang dari 1000).
2.2.4 Triterpenoid/steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isopren dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualen.Senyawa tersebut mempunyai struktur siklik yang relatif kompleks, kebanyakan merupakan suatu alkohol, aldehid atau asam karboksilat(Harborne, 1987).
Triterpenoid merupakan senyawa tanpa warna, berbentuk kristal, sering kali bertitik leleh tinggi dan optis aktif, yang dibagi atas 4 kelompok senyawa yaitu triterpen sebenarnya, steroid, saponin, dan glikosida jantung. Sebagian senyawa triterpenoid juga merupakan komponen aktif dalam tumbuhan obat, yang berkhasiat sebagai anti diabetes, gangguan menstruasi, gangguan kulit kerusakan hati dan malaria (Robinson, 1995).
Gambar 2.1. Struktur dasar steroida dan sistem penomorannya Menurut asalnya senyawa steroid dibagi atas:
a. Zoosterol, yaitu steroid yang berasal dari hewan, misalnya kolesterol.
b. Fitosterol, yaitu steroid yang berasal dari tumbuhan, misalnya sitosterol dan stigmasterol.
c. Mycosterol, yaitu steroid yang berasal dari fungi, misalnya ergosterol.
d. Marinesterol, yaitu steroid yang berasal dari organisme laut, misalnya spongesterol.
2.2.5Saponin
2.3Simplisia dan Ekstrak 2.3.1Simplisia
Simplisia merupakan bahan alamiah yang digunakan sebagai obat dan belummengalami pengolahan apapun, kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan atas simplisia nabati, simplisia hewani dan simplisia pelikan (Depkes RI., 2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengancara mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian rupa sehingga memenuhi syarat baku yang telah ditetapkan (Depkes RI., 2000).
Ekstraksi adalah kegiatan penarikan zat aktif dengan menggunakan pelarut yang sesuai (Depkes RI., 2000). Metode ekstraksi menurutHanda, dkk (2008) ada beberapa cara, yaitu:
1. Maserasi
Digesti adalah proses penyarian secara maserasi dengan pengadukan pada temperatur yang lebih tinggi dari temperatur kamar.
4. Dekoktasi
Dekoktasi adalah proses penyarian dengan cara merebus simplisia menggunakan pelarut air, kemudian didinginkan dan disaring. Proses ini cocok digunakan untuk senyawa-senyawa yang larut dalam air dan tahan terhadap pemanasan.
5. Perkolasi
Perkolasi adalah suatu cara penyarian simplisia menggunakan perkolator. Simplisia dibasahi dengan cairan penyari lalu didiamkan selama 4 jam, kemudian ditambahkan lagi cairan penyari dan didiamkan selama 24 jam. Outler perkolator dibuka sehingga cairan yang terkandung di dalamnya dapat menetes perlahan secara terus-menerus sampai diperoleh ekstrak (perkolat).
6. Sokletasi
2.4Uraian Bakteri 2.4.1 Pengertian bakteri
Bakteri adalah mikroorganisme yang bersel satu, berkembang biak dengancara membelah diri, serta demikian kecilnya sehingga hanya dapat dilihat dengan menggunakan mikroskop (Dwijoseputro, 1978).
Berdasarkan pengecatan gram, maka bakteri dapat dibedakan menjadi dua bagian (Pratiwi, 2008) yaitu :
1. Bakteri Gram Positif, yaitu bakteri yang memberikan warna ungu saat diwarnai dengan zat warna pertama (kristal violet) dan setelah dicuci dengan alkohol, warna ungu tersebut akan tetap kelihatan. Kemudian ditambahkan zat warna kedua (safranin), warna ungu pada bakteri tidak berubah.
2. Bakteri Gram Negatif, yaitu bakteri yang yang memberikan warna ungu saat diwarnai dengan zat warna pertama (kristal violet) namun setelah dicuci dengan alkohol, warna ungu tersebut akan hilang. Kemudian ditambahkan zat warna kedua (safranin) akan menghasilkan warna merah.
2.4.2 Uraian Staphylococcus aureus
Staphylococcus merupakan sel Gram Positif, berbentuk bulat, biasanya
tersusun dalam rangkaian tak beraturan seperti anggur (Jawetz, et al., 2013), sel berbentuk bola dan tersusun dalam kelompok (Ryan dan Ray, 2004).
Spesies : Staphylococcus aureus 2.4.3 Uraian Escherichia coli
Escherichia coli merupakan bakteri Gram Negatif aerobik atau anaerobik
fakultatif yang habitat alaminya adalah usus besar manusia dan hewan (Jawetz, et al., 2013), berbentuk batang, bergerak dengan flagel yang peritrik atau tidak bergerak dan memiliki kemampuan menguraikan glukosa dan menghasilkan gas (Dwidjoseputro, 1978). Sistematika Escherichia coli(Dwidjoseputro, 1978) Divisi : Protophyta
Kelas : Schizomycetes Ordo : Eubacteriales Famili : Enterobacteriaceae Genus : Escherichia
Spesies :Escherichia coli 2.4.4 UraianStreptococcus mutans
Streptococcus mutans merupakan bakteri Gram Positif, bersifat nonmotil
(tidak bergerak), bakteri anaerob fakultatif. Memiliki bentuk kokus yang sendirian berbentuk bulat atau bulat telur dan tersusun dalam rantai. Bakteri ini tumbuh secara optimal pada suhu sekitar 18-400C. Streptococcus mutans biasanya ditemukan pada rongga gigi manusia yang luka menjadi bakteri yang paling kondusif menyebabkan karies untuk email gigi (Nugraha, 2010).
SistematikaStreptococccus mutans(Nugraha, 2010) Kingdom : Monera
Kelas : Bacilli
Ordo : Lactobacilalles Famili : Streptococcaceae Genus : Streptococcus
Species : Streptococcus mutans 2.4.5UraianPseudomonas aeruginosa
Pseudomonas aeruginosa adalah
berkapsul, mempunyai sekitar 0,6-2,0 µm.Bakteri ini tidak menghasilka menfermentasikan dampak positif pada uji secara luas dapat ditemukan di alam, contohnya di tanah, air, tanaman, dan hewan. Pseudomonas aeruginosaadal
pada paru-paru dan saluran kemih yang merupakan penyebab utama infeksi
Sistematika Pseudomonas aeruginosa .
Kingdom : Bacteria
(Mayasari, 2005)
Filum : Proteobacteria
Lactobacillus acidophilus merupakan bakteri Gram Positif berbentuk
batang yang lurus, tidak berspora, ukurannya 0,5-1µm x 1,5-5. Sel Lactobacillus acidophilus sering berbentuk rantai. (Habibillah, 2009).
Sistematika Lactobacillus acidophillus(Habibillah, 2009) Kingdom : Bacteria
Divisi : Firmicutes Kelas : Bacilli
Ordo : Lactobacillales Famili : Lactobacillaceae Genus : Lactobacillus
Spesies :Lactobacillus acidophilus 2.4.7Uraian Vibrio cholerae
Vibrio cholerae merupaka
bengkok seperti koma dengan ukuran 2-4 um dan bersifat motil (dapat bergerak), bakteri ini tidak membentuk spora. Vibrio cholerae tumbuh baik pada agar Thiosulfate-citrate-bile-sucrose (TCBS) yang menghasilkan koloni berwarna kuning (Amelia, 2005).
SistematikaVibrio cholerae(Amelia, 2005) Kingdom : Bacteria
Divisi : Proteobacteria
Kelas : Gamma Proteobacteria Ordo : Vibrionales
Genus : Vibrio
Spesies : Vibrio cholerae
2.5Faktor - Faktor yang Mempengaruhi Pertumbuhan Bakteri 1. Nutrisi
Nutrisi digunakan untuk keperluan hidupnya, semua mahluk hidup memerlukan bahan makanan untuk sintesis bahan sel dan mendapatkan energi. Demikian juga dengan mikroorganisme, untuk kehidupannya membutuhkan energi dari lingkungannya. Bahan tersebut dinamakan nutrisi atau zat gizi (Waluyo, 2004). Semua mikroorganisme memerlukan nutrisi sebagai sumber energi dan pertumbuhan selnya. Unsur-unsur dasar tersebut adalah karbon, nitrogen, sulfur, zat besi dan sejumlah kecil logam-logam lainnya. Kekurangan sumber nutrisi ini dapat mempengaruhi pertumbuhan mikroba hingga pada akhirnya dapat menyebabkan kematian (Gamman, 1992).
2. Temperatur
Bakteri sangat peka terhadap suhu atau temperatur dan daya tahan tubuh bakteri tidak sama untuk semua spesies. Menurut Gamman (1992), bakteri dapat diklasifikasikan menjadi tiga kelompok berdasarkan suhu pertumbuhan yang diperlukan, seperti diantaranya:
optimumnya antara 50-60°C 3. Oksigen
Oksigen dapat mempengaruhi pertumbuhan mikroorganisme, berdasarkan kebutuhan oksigen, bakteri dapat dibedakan menjadi 4 kelompok antara lain: a. Aerob yaitu bakteri yang membutuhkan oksigen di dalam pertumbuhannya.
b. Anaerob yaitu bakteri yang tidak membutuhkan oksigen di dalampertumbuhannya, bahkan oksigen ini dapat menjadi racun bagi bakteri tersebut.
c. Anaerob fakultatif yaitu bakteri yang dapat hidup tumbuh dengan atau tanpa adanya oksigen.
d. Mikroaerofilik yaitu bakteri yang memerlukan hanya sedikit oksigen dalam pertumbuhannya.
4. pH
Pertumbuhan bakteri juga memerlukan pH tertentu, namun umumnya bakteri memiliki jarak pH yaitu sekitar pH 6,5-7,5 atau pada pH netral (Waluyo, 2004). Untuk tiap mikroorganisme dikenal nilai pH minimum, optimum, dan maksimum. Atas dasar daerah, pH bagi kehidupan mikroba, dibedakan adanya 3 golongan besar (Suriawira, 2005) yaitu:
Semua organisme membutuhkan air dalam reaksi metabolik dalam sel dan merupakan alat pengangkut zat-zat gizi ke dalam dan ke luar sel. Jumlah air yang terdapat dalam bahan pangan atau larutan dikenal sebagai aktivitas air (water activity = a
w), dan air murni mempunyai aw = 1,0. Jenis mikroorganisme yang
berbeda membutuhkan jumlah air yang berbeda pula dalam pertumbuhannya. Bakteri umumnya tumbuh dan berkembang biak hanya dalam media dengan a
w
tinggi (0,91), jamur membutuhkan nilai a
wlebih rendah (0,87-0,91).
Mikroba mempunyai nilai kelembapan optimum. Pada umumnya untuk pertumbuhan ragi dan bakteri diperlukan kelembapan yang tinggi (di atas 85%), sedangkan untuk jamur memerlukan kelembapan yang rendah (di bawah 80%). Bakteri merupakan mahluk yang suka akan keadaan basah, bahkan hidup di dalam air, tetapi dalam air yang tertutup tidak dapat hidup subur, hal ini disebabkan karena kurang udara dan jika udara kering maka bakteri akan mati (Waluyo, 2004).
6. Tekanan Osmosis
2.6Sterilisasi
Steril merupakan keadaan suatu zat yang terbebas dari mikroba hidup, baik yang menimbulkan penyakit maupun tidak menimbulkan penyakit, sedangkan sterilisasi adalah suatu proses untuk membuat ruang atau benda menjadi steril (Syamsuni, 2006).
Peralatan yang dipergunakan dalam uji antibakteri harus dalam keadaan steril, artinya pada peralatan tersebut tidak boleh didapatkan bakteri, baik yang akan merusak media maupun pada proses pengujian yang sedang berlangsung (Suriawira, 2005).
2.6.1 Sterilisasi dengan pemanasan secara kering
2.6.2 Sterilisasi dengan pemanasan secara basah
Sterilisasi dengan pemanasan secara basah menggunakan temperatur di atas 100°C dilakukan dengan uap yaitu menggunakan autoklaf. Prinsip autoklaf adalah terjadinya koagulasi protein yang cepat dalam keadaan basah dibandingkan keadaan kering. Siklus sterilisasi dengan pemanasan secara basah meliputi tahap pemanasan, tahap sterilisasi dan tahap pendinginan (Pratiwi, 2008).
2.7Uji Aktivitas Antibakteri
Menurut Pratiwi (2008), pengujian aktivitas antibakteri dapat dilakukan dengan dua cara yaitu cara difusi dan dilusi.
2.7.1 Cara difusi
Pada cara difusi sebagai pencadang dapat digunakan cakram kertas, silinder gelas, porselen, logam strip plastik dan pencetak lubang (punch hole). a. Cara tuang
menggunakan jangka sorong (Pratiwi, 2008). 2.7.2 Cara dilusi
Metode ini menggunakan antimikroba dengan kadar yang menurun secara bertahap, baik dengan media cair atau padat, kemudian media diinokulasi bakteri uji dan dieramkan. Tahap akhir dilarutkan antimikroba dengan kadar yang menghambat atau mematikan. Uji kepekaan cara dilusi agar memakan waktu dan penggunaannya dibatasi pada keadaan tertentu saja (Jawetz, et al., 2005).
2.8 Mekanisme Kerja Antibakteri
Berbagai faktor yang mempengaruhi penghambatan mikroorganisme mencakup kepadatan populasi mikroorganisme, kepekaan terhadap bahan antimikroba, volume bahan yang disterilkan, lamanya bahan antimikroba diaplikasikan pada mikroorganime, konsentrasi bahan antimikroba, suhu dan kandungan bahan organik (Lay, 1994). Semua substansi yang diketahui memiliki kemampuan untuk menghalangi pertumbuhan organisme lain khususnya mikroorganisme disebut sebagai antibiotik (Pratiwi, 2008).
Antibiotik berdasarkan spektrum diklasifikasikan menjadi antibiotik berspektrum sempit (narrow spectrum) yang hanya mampu menghambat atau membunuh segolongan jenis bakteri saja dan antibiotik berspektrum luas (broad spectrum) yang dapat menghambat atau membunuh bakteri dari semua golongan.
PENDAHULUAN 1.1Latar Belakang
Infeksi adalah masuknya mikroorganisme ke dalam tubuh, yang dapat
menimbulkan penyakit (Pratiwi, 2008),Penyakit infeksi merupakan salah satu
masalah kesehatan masyarakat yang penting, khususnya di negara berkembang seperti
Indonesia. Salah satu obat andalan untuk mengatasi masalah tersebut adalah
antimikroba antara lain antibakteri/antibiotik, antijamur dan antivirus, antiprotozoa.
Antibiotik adalah obat paling banyak digunakan untuk infeksi yang disebabkan oleh
bakteri. Berbagai studi menemukan bahwa 40-62% antibiotik digunakan secara tidak
tepat antara lain untuk penyakit-penyakit yang sebenarnya tidak memerlukan
antibiotik. Pada penelitian tentang kualitas penggunaan antibiotik di rumah sakit
ditemukan 30-80% tidak didasarkan pada indikasi penyakit. Intensitas penggunaan
antibiotik yang relatif tinggi menimbulkan berbagai permasalahan dan merupakan
ancaman global bagi kesehatan, terutama resistensi terhadap antibiotik (Depkes RI.,
2011).
Beberapa jenis penyakit infeksi yang menyerang tubuh manusia dapat disebabkan oleh bakteriGram Positif seperti Lactobacillus acidophilus,Streptococcus mutans,Staphylococcus aureusdan bakteri Gram
Negatif Escherichia coli, Pseudomonas aeruginosa, Vibrio cholerae. Bakteri Lactobacillus acidophilus dapat ditemukan pada saluran cerna dan rongga mulut
sehingga pada rongga mulut dapat menyebabkan karies gigi. Streptococcus mutans dapat dijumpai pada rongga mulut dan dapat menyebabkan karies gigi.
Staphylococcus aureus dapat ditemukan pada kulit, paru-paru, ginjal dan tulang
aeruginosadapat dijumpai pada paru-paru, saluran kemihyang dapat menyebabkan
pneumonia dan otitis eksterna. BakteriEscherichia colidapat dijumpai pada saluran kemih dan saluran cerna yang dapat menyebabkan diare dan infeksi saluran kemih. BakteriVibrio choleraedapat ditemukan pada saluran cerna dan menyebabkan penyakit kolera (Ryan dan Ray, 2004; Jawetz et al., 2013).
Salah satu upaya untuk menanggulangi resistensi terhadap antibiotik adalah mengembangkan antibakteri baru dari bahan tumbuhan (Joung, et al., 2012). Penelitian dilakukan untuk menemukan obat baru yang lebih efektif untuk melawan penyakit yang disebabkan bakteri, jamur dan virus (Sukmono, 2009).
Masyarakat Indonesia sudah mengenal dan menggunakan tanaman untuk mengobati berbagai macam infeksi yang disebabkan oleh bakteri. Hal ini disebabkan efek samping obat sintetik yang lebih besar dibandingkan dengan obat tradisional, harganya relatif lebih murah dan mudah untuk didapatkan (Ayuningtyas, 2009). Jenis tanaman cukup banyak yang dapat dimanfaatkan sebagai tanaman obat, salah satu tanaman yang berkhasiat sebagai obat adalah Lactuca indica yang dikenal dengan daun sijukkot (Wang, et al., 2003).