SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK n-HEKSANA DAN ETILASETAT
SERTA ETANOL ALGA MERAH (Galaxaura oblongata)
SKRIPSI
OLEH:
NOMITA SARI SAGALA NIM 081501061
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK n-HEKSANA DAN ETILASETAT
SERTA ETANOL ALGA MERAH (Galaxaura oblongata)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NOMITA SARI SAGALA NIM 081501061
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK n-HEKSANA DAN ETILASETAT
SERTA ETANOL ALGA MERAH (Galaxaura oblongata)
OLEH:
NOMITA SARI SAGALA NIM 081501061
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 19 Juli 2013
Pembimbing I, Panitia Penguji,
Dra. Suwarti Aris, M.Si., Apt. Dr. Marline Nainggolan, M.S., Apt.
NIP 195107231982032001 NIP 195709091985112001
Pembimbing II, Dra. Suwarti Aris, M.Si., Apt.
NIP 195107231982032001
Dra. Aswita Hafni Lubis, M.Si., Apt. Drs. Panal Sitorus, M.Si., Apt.
NIP 195304031983032001 NIP 195310301980031002
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, Oktober 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan
rahmat, kasih dan karuniaNya, sehingga penulis dapat menyelesaikan skripsi
ini yang berjudul: Skrining Fitokimia dan Uji Aktivitas Antibakteri Ekstrak n
-Heksana dan Etilasetat serta Etanol Alga Merah (Galaxaura oblongata).
Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana
farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih yang tulus dan
ikhlas kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga
penulis dapat menyelesaikan pendidikan. Ibu Dra. Suwarti Aris, M.Si., Apt.,
dan Dra. Aswita Hafni Lubis, M.Si., Apt., selaku pembimbing yang telah
memberi waktu, bimbingan dan nasehat selama penelitian hingga selesainya
penyusunan skripsi ini. Ibu Dr. Marline Nainggolan, M.S., Apt., Ibu Dra.
Suwarti Aris, M.Si., Apt., Bapak Drs. Panal Sitorus, M.Si., Apt., dan Bapak
Drs. Suryadi Achmad, M.Sc., Apt., selaku dosen penguji yang telah
memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan
skripsi ini. Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang
telah mendidik selama perkuliahan dan Ibu Dra. Azizah Nasution, M.Sc., Apt.,
selaku penasehat akademis yang telah memberikan bimbingan kepada penulis.
Ibu kepala Laboratorium Farmakognosi dan Ibu kepala Laboratorium
Mikrobiologi yang telah memberikan bantuan dan fasilitas selama penulis
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda (Alm) K. Sagala dan Ibunda tercinta K. Sinaga,
yang tiada hentinya berkorban dan berdoa dengan tulus ikhlas bagi kesuksesan
penulis, juga kepada abang, kakak dan adikku yang selalu setia memberi doa
dan motivasi selama penulis melakukan penelitian.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna,
sehingga penulis mengharapkan kritik dan saran yang membangun untuk
penyempurnaannya. Harapan saya semoga skripsi ini dapat bermanfaat bagi
ilmu pengetahuan kefarmasian.
Medan, Juli 2013 Penulis
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK n-HEKSANA DAN ETILASETAT SERTA ETANOL ALGA
MERAH (Galaxaura oblongata) ABSTRAK
Rumput laut atau alga yang juga dikenal dengan nama seaweeds
merupakan bagian terbesar dari tanaman laut dan sejak zaman dahulu telah digunakan sebagai makanan dan obat-obatan. Salah satu jenis alga merah yang
terdapat di Desa Halodan, Kabupaten Singkil adalah Galaxaura oblongata
yang merupakan alga penghasil karaginan. Selain itu, Galaxaura oblongata
juga mengandung senyawa flavonoid dan steroid/triterpenoid. Senyawa flavonoid dan beberapa senyawa steroid/triterpenoid memiliki aktivitas antibakteri. Tujuan penelitian ini adalah untuk mengetahui kandungan senyawa
kimia dan uji aktivitas antibakteri dari alga merah (Galaxaura oblongata).
Skrining fitokimia dilakukan terhadap serbuk simplisia selanjutnya
simplisia diekstraksi secara perkolasi bertahap menggunakan pelarut penyari n
-heksana, etilasetat dan etanol kemudian diuji aktivitas antibakterinya terhadap
bakteri Staphylococcus aureus dan Pseudomonas aeruginosa dengan metode
difusi agar menggunakan punch hole.
Hasil skrining fitokimia menunjukkan adanya kandungan senyawa kimia flavonoid, saponin, glikosida, dan steroid/triterpenoid. Hasil uji aktivitas
antibakteri menunjukkan bahwa ekstrak n-heksana tidak memberikan daerah
hambat terhadap pertumbuhan bakteri Staphylococcus aureus dan
Pseudomonas aeruginosa, ekstrak etanol kurang memberikan daerah hambat yang memuaskan terhadap kedua bakteri sedangkan ekstrak etilasetat memberikan daerah hambat yang memuaskan terhadap kedua bakteri. Ekstrak etilasetat memberikan daerah hambat yang memuaskan terhadap bakteri
Staphylococcus aureus dengan konsentrasi 200 mg/ml yaitu 14,18 mm dan
terhadap bakteri Pseudomonas aeruginosa dengan konsentrasi 200 mg/ml yaitu
14 mm.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF n-HEXANE AND ETHYLACETATE AND ETHANOL
EXTRACTS OF RED ALGAE (Galaxaura oblongata) ABSTRACT
Seaweeds or algae is the biggest part of the marine plants and since immemorial time have been used as a food and traditional medicine. One of the
red algae that found in Desa Halodan, Kabupaten Singkil is Galaxaura
oblongata which is a carrageenophyte red algae. In addition Galaxaura oblongata also contain flavonoid and steroid/ triterpenoid compounds. Flavonoid and several steroid/triterpenoid compounds showed antibacterial activity. The object of this study was to know about chemical constituents and
antibacterial activity test of red algae (Galaxaura oblongata).
Phytochemical screening of simplicia powder subsequent gradual
percolation of crude extracted using solvents n-hexane, ethylacetate and
ethanol are then tested antibacterial activity against Staphylococcus aureus and
Pseudomonas aeruginosa by agar diffusion method using punch hole.
Phytochemical screening results showed the present of flavonoid, saponin, glycoside, and steroid/triterpenoid. The result of antibacterial activity
test showed that n-hexane extract do not provide local inhibitory to the growth
of Staphylococcus aureus and Pseudomonas aeruginosa, ethanol extract do not give a satisfactory local inhibitory against both bacteria while ethylacetate extract provide a satisfactory local inhibitory against both bacteria. Ethylacetate extract give a satisfactory inhibitory regions of the bacteria
Staphylococcus aureus with a concentration of 200 mg/ml is 14.18 mm and the
bacteria Pseudomonas aeruginosa witha concentration of 200 mg/ml is14 mm.
2.1.5 Kandungan kimia dan manfaat ... 7
2.4 Pengujian Aktivitas Antimikroba ... 19
BAB III METODE PENELITIAN ... 21
3.1 Alat-alat ... 21
3.2 Bahan-bahan ... 22
3.3 Penyiapan Bahan Tumbuhan ... 22
3.3.1 Pengambilan bahan tumbuhan ... 22
3.3.2 Identifikasi bahan tumbuhan ... 23
3.4.8 Pereaksi asam klorida 2 N ... 24
3.4.9 Pereaksi asam sulfat 2 N ... 24
3.4.10 Pereaksi Lieberman-Bourchard ... 25
3.4.11 Larutan kloralhidrat ... 25
3.5 Pemeriksaan Karakteristik Simplisia ... 25
3.5.1 Pemeriksaan makroskopik ... 25
3.5.2 Pemeriksaan mikroskopik ... 25
3.5.3 Penetapan kadar air ... 26
3.5.4 Penetapan kadar sari larut air ... 26
3.5.5 Penetapan kadar sari larut etanol ... 27
3.5.6 Penetapan kadar abu total ... 27
3.6.4 Pemeriksaan glikosida antrakinon ... 29
3.6.5 Pemeriksaan saponin ... 29
3.6.6 Pemeriksaan tanin ... 30
3.6.7 Pemeriksaan steroid/triterpenoid ... 30
3.7 Pembuatan Ekstrak ... 30
3.8 Sterilisasi Alat ... 31
3.9.1 Media nutrient agar ... 31
3.13Pembuatan Larutan Uji dengan Berbagai Konsentrasi .. 33
3.14Pengujian Aktivitas Antibakteri ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Hasil Identifikasi Tumbuhan ... 35
4.2 Hasil Karakterisasi Simplisia ... 35
4.2.1 Pemeriksaan makroskopik ... 35
4.2.2 Pemeriksaan mikroskopik ... 35
DAFTAR TABEL
Tabel Halaman
4.1 Hasil skrining fitokimia simplisia, ekstrak n-heksana, ekstrak
etilasetat dan ekstrak etanol alga merah(Galaxaura oblongata) .. 37
4.2 Hasil pengukuran diameter daerah hambatan pertumbuhan
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tumbuhan ... 46
2 Gambar simplisia alga Galaxaura oblongata (Ellis et
Solander) Lamouroux ... 47
3 Gambar serbuk simplisia alga Galaxaura oblongata (Ellis et
Solander) Lamouroux ... 48
4 Gambar mikroskopik serbuk simplisia alga Galaxaura
oblongata (Ellis et Solander) Lamouroux pada
pembesaran 10x40 ... 49
5 Bagan pembuatan serbuk simplisia talus alga merah
(Galaxaura oblongata) ... 50
6 Bagan pembuatan ekstrak alga merah dengan cara perkolasi
bertahap ... 51
7 Bagan pengujian aktivitas antibakteri ... 52
8 Tabel hasil pemeriksaan karakteristik serbuk simplisia alga
merah (Galaxaura oblongata) ... 53
9 Perhitungan penetapan kadar air simplisia alga merah
(Galaxaura oblongata) ... 54
10 Perhitungan penetapan kadar sari larut air simplisia alga
merah (Galaxaura oblongata) ... 55
11 Perhitungan penetapan kadar sari larut etanol simplisia alga
merah (Galaxaura oblongata) ... 56
12 Perhitungan penetapan kadar abu total simplisia alga merah
(Galaxaura oblongata) ... 57
13 Perhitungan penetapan kadar abu tidak larut asam simplisia
alga merah (Galaxaura oblongata) ... 58
14 Hasil pengukuran diameter daerah hambatan pertumbuhan
bakteri Staphylococcus aureus dan Pseudomonas
15 Hasil pengukuran diameter daerah hambatan pertumbuhan
bakteri Staphylococcus aureus dan Pseudomonas
aeruginosa oleh ekstrak etilasetat ... 60
16 Hasil pengukuran diameter daerah hambatan pertumbuhan
bakteri Staphylococcus aureus dan Pseudomonas
aeruginosa oleh ekstrak etanol ... 61
17 Gambar uji aktivitas antibakteri ekstrak n-heksana alga
merah (Galaxaura oblongata) terhadap bakteri
Staphylococcus aureus ... 62
18 Gambar uji aktivitas antibakteri ekstrak n-heksana alga
merah (Galaxaura oblongata) terhadap bakteri
Pseudomonas aeruginosa ... 63
19 Gambar uji aktivitas antibakteri ekstrak etilasetat alga
merah (Galaxaura oblongata) terhadap bakteri
Staphylococcus aureus ... 64
20 Gambar uji aktivitas antibakteri ekstrak etilasetat alga
merah (Galaxaura oblongata) terhadap bakteri
Pseudomonas aeruginosa ... 67
21 Gambar uji aktivitas antibakteri ekstrak etanol alga merah
(Galaxaura oblongata) terhadap bakteri
Staphylococcus aureus ... 70
22 Gambar uji aktivitas antibakteri ekstrak etanol alga merah
(Galaxaura oblongata) terhadap bakteri
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK n-HEKSANA DAN ETILASETAT SERTA ETANOL ALGA
MERAH (Galaxaura oblongata) ABSTRAK
Rumput laut atau alga yang juga dikenal dengan nama seaweeds
merupakan bagian terbesar dari tanaman laut dan sejak zaman dahulu telah digunakan sebagai makanan dan obat-obatan. Salah satu jenis alga merah yang
terdapat di Desa Halodan, Kabupaten Singkil adalah Galaxaura oblongata
yang merupakan alga penghasil karaginan. Selain itu, Galaxaura oblongata
juga mengandung senyawa flavonoid dan steroid/triterpenoid. Senyawa flavonoid dan beberapa senyawa steroid/triterpenoid memiliki aktivitas antibakteri. Tujuan penelitian ini adalah untuk mengetahui kandungan senyawa
kimia dan uji aktivitas antibakteri dari alga merah (Galaxaura oblongata).
Skrining fitokimia dilakukan terhadap serbuk simplisia selanjutnya
simplisia diekstraksi secara perkolasi bertahap menggunakan pelarut penyari n
-heksana, etilasetat dan etanol kemudian diuji aktivitas antibakterinya terhadap
bakteri Staphylococcus aureus dan Pseudomonas aeruginosa dengan metode
difusi agar menggunakan punch hole.
Hasil skrining fitokimia menunjukkan adanya kandungan senyawa kimia flavonoid, saponin, glikosida, dan steroid/triterpenoid. Hasil uji aktivitas
antibakteri menunjukkan bahwa ekstrak n-heksana tidak memberikan daerah
hambat terhadap pertumbuhan bakteri Staphylococcus aureus dan
Pseudomonas aeruginosa, ekstrak etanol kurang memberikan daerah hambat yang memuaskan terhadap kedua bakteri sedangkan ekstrak etilasetat memberikan daerah hambat yang memuaskan terhadap kedua bakteri. Ekstrak etilasetat memberikan daerah hambat yang memuaskan terhadap bakteri
Staphylococcus aureus dengan konsentrasi 200 mg/ml yaitu 14,18 mm dan
terhadap bakteri Pseudomonas aeruginosa dengan konsentrasi 200 mg/ml yaitu
14 mm.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF n-HEXANE AND ETHYLACETATE AND ETHANOL
EXTRACTS OF RED ALGAE (Galaxaura oblongata) ABSTRACT
Seaweeds or algae is the biggest part of the marine plants and since immemorial time have been used as a food and traditional medicine. One of the
red algae that found in Desa Halodan, Kabupaten Singkil is Galaxaura
oblongata which is a carrageenophyte red algae. In addition Galaxaura oblongata also contain flavonoid and steroid/ triterpenoid compounds. Flavonoid and several steroid/triterpenoid compounds showed antibacterial activity. The object of this study was to know about chemical constituents and
antibacterial activity test of red algae (Galaxaura oblongata).
Phytochemical screening of simplicia powder subsequent gradual
percolation of crude extracted using solvents n-hexane, ethylacetate and
ethanol are then tested antibacterial activity against Staphylococcus aureus and
Pseudomonas aeruginosa by agar diffusion method using punch hole.
Phytochemical screening results showed the present of flavonoid, saponin, glycoside, and steroid/triterpenoid. The result of antibacterial activity
test showed that n-hexane extract do not provide local inhibitory to the growth
of Staphylococcus aureus and Pseudomonas aeruginosa, ethanol extract do not give a satisfactory local inhibitory against both bacteria while ethylacetate extract provide a satisfactory local inhibitory against both bacteria. Ethylacetate extract give a satisfactory inhibitory regions of the bacteria
Staphylococcus aureus with a concentration of 200 mg/ml is 14.18 mm and the
bacteria Pseudomonas aeruginosa witha concentration of 200 mg/ml is14 mm.
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia sebagai negara kepulauan di perairan tropis diketahui
memiliki keanekaragaman jenis biota yang tinggi, termasuk keanekaragaman
jenis alganya (Atmadja, 1992). Rumput laut atau alga yang juga dikenal
dengan nama seaweed merupakan bagian terbesar dari tanaman laut. Sejak
zaman dulu, alga telah digunakan sebagai makanan dan obat-obatan (Winarno,
1990; Rasyid, 2004).
Alga dapat diperhitungkan sebagai sumber senyawa bioaktif karena
kemampuannya untuk memproduksi metabolit sekunder yang sangat bervariasi
dengan aktivitas biologi yang sangat luas (Subathraa dan Poonguzhali, 2013).
Senyawa dengan aktivitas antioksidan, antivirus, antifungi, amtimikroba
(Antonisamy dan Eahamban, 2012), sitotoksik dan antihelmintik (Varier, dkk.,
2013) terdapat di dalam alga coklat, alga merah, dan alga hijau.
Rhodophyceae (alga merah) merupakan salah satu golongan alga yang
memiliki potensi yang penting, yaitu jenis Euchema sp. sebagai sumber
penghasil karaginan, Gracilaria sp. dan Gelidium sp. sebagai sumber penghasil
agar-agar dan beberapa alga merah dapat juga digunakan sebagai obat.
Beberapa alga merah dapat digunakan sebagai obat antihipertensi yaitu
Gracilaria lichenoides, obat antivirus yaitu Constantinea simplex dan sebagai
antimikroba yaitu Farlowia mollis, Laurencia hybrida, Platysiphonia miniata
Alga memiliki komponen senyawa aktif diantaranya saponin,
flavonoid, triterpenoid/steroid (Lutfiyanti, dkk., 2012), glikosida (Antonisamy
dan Eahamban, 2012) dan florotanin (Varier, dkk., 2013). Kebanyakan
senyawa aktif yang terkandung dalam alga menunjukkan aktivitas antibakteri
(Varier, dkk., 2013). Beberapa jenis alga dengan aktivitas antimikrobanya telah
dilaporkan oleh Chanda, dkk., (2010).
Alga yang terdapat di perairan Indonesia sangat beragam, diantaranya
Euchema cottonii, Euchema spinosum, Gracillaria gigas, Gracillaria
verrucosa, Gelidium rigidum, Sargassum polycystum dan Galaxaura
oblongata. Berbagai jenis alga ini tersebar luas di Indonesia, baik yang tumbuh
secara alami maupun yang dibudidayakan (Anggadiredja, dkk., 2010). Wilayah
sebaran alga yang tumbuh alami terdapat di hampir seluruh perairan dangkal
laut Indonesia seperti jenis alga Galaxaura oblongata yang tumbuh alami di
Desa Halodan, Kecamatan Pulau Banyak Barat, Kabupaten Singkil, Provinsi
Nangroe Aceh Darussalam.
Galaxaura oblongata merupakan alga merah penghasil karaginan
(Trono dan Fortes, 1988) dan mengandung senyawa steroid/triterpenoid
(Lobban dan Wynne, 1981). Menurut Robinson (1991), beberapa senyawa
steroid/triterpenoid menunjukkan aktivitas antibakteri. Selain itu, alga juga
mengandung senyawa flavonoid yang memiliki aktivitas antibakteri (Yunus,
dkk., 2009).
Senyawa triterpenoid/steroid merupakan senyawa aktif yang memiliki
mikroba (Lutfiyanti, dkk., 2012). Beberapa hasil penelitian menunjukkan
senyawa terpenoid memiliki aktivitas antimikroba diantaranya yaitu
triterpenoid saponin dan triterpenoid glikosida (Pranoto, dkk., 2012).
Berdasarkan uraian di atas maka penulis melakukan penelitian untuk
mengetahui kandungan senyawa kimia dan pengujian aktivitas antibakteri dari
ekstrak n-heksana, ekstrak etilasetat, dan ekstrak etanol alga merah Galaxaura
oblongata terhadap bakteri Staphylococcus aureus yang merupakan bakteri
Gram positif dan Pseudomonas aeruginosa merupakan bakteri Gram negatif
dengan metode difusi agar menggunakan punch hole.
1.2 Perumusan Masalah
Perumusan masalah dari penelitian ini adalah:
a. apakah kandungan senyawa kimia yang terdapat di dalam alga merah
Galaxaura oblongata?
b. apakah ekstrak n-heksana, ekstrak etilasetat dan ekstrak etanol alga
merah Galaxaura oblongata mempunyai aktivitas antibakteri?
1.3 Hipotesis
a. Kandungan senyawa kimia yang terdapat di dalam simplisia dan
ekstrak alga merah Galaxaura oblongata adalah flavonoid dan
triterpenoid/steroid.
b. Ekstrak alga Galaxaura oblongata mempunyai aktivitas antibakteri
1.4 Tujuan
a. Untuk mengetahui kandungan senyawa kimia yang terdapat dalam
alga Galaxaura oblongata.
b. Untuk mengetahui aktivitas antibakteri ekstrak n-heksana, ekstrak
etilasetat dan ekstrak etanol alga Galaxaura oblongata terhadap
bakteri Staphylococcus aureus dan Pseudomonas aeruginosa.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah sebagai informasi tentang kandungan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Alga dikelompokkan ke dalam Divisio Thallophyta. Alga tidak
mempunyai akar, batang dan daun tetapi hanya terdiri dari talus saja. Alga
merupakan biota perairan yang tumbuh dengan melekatkan dirinya pada
karang, lumpur, pasir, batu dan benda keras lainnya (Anggadiredja, dkk.,
2010).
2.1.1 Habitat dan sebaran alga
Pertumbuhan dan penyebaran alga seperti halnya biota perairan lainnya
sangat dipengaruhi oleh toleransi fisiologi dari biota tersebut untuk beradaptasi
terhadap faktor-faktor lingkungan, seperti substrat, salinitas (kadar garam),
temperatur, intensitas cahaya, tekanan dan nutrisi. Secara umum, alga dijumpai
tumbuh di daerah perairan yang dangkal atau di daerah pasang surut (intertidal
dan sublitorral) yang masih dapat ditembus oleh sinar matahari dengan kondisi
dasar perairan berpasir, sedikit lumpur, atau campuran keduanya. Alga
memiliki sifat benthic (melekat) dan disebut juga benthic algae. Di samping itu
alga juga hidup sebagai fitobentos dengan cara melekatkan talus pada substrat
pasir, lumpur, karang, fragmen karang mati, kulit kerang, batu atau kayu
(Anggadiredja, dkk., 2010).
Daerah sebaran beberapa jenis alga di Indonesia sangat luas, baik yang
tumbuh alami terdapat di hampir seluruh perairan dangkal laut Indonesia yang
mempunyai rataan terumbu karang (Anggadiredja, dkk., 2010).
2.1.2 Perkembangbiakan alga
Perkembangbiakan alga dapat terjadi melalui dua cara, yaitu secara
vegetatif dengan talus dan secara generatif dengan talus diploid yang
menghasilkan spora. Perbanyakan secara vegetatif dikembangbiakan dengan
cara stek, yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru.
Sementara perbanyakan secara generatif dikembangkan melalui spora, baik
alamiah maupun melalui budidaya. Pertemuan dua gamet membentuk zygot
yang selanjutnya berkembang menjadi sporofit. Individu baru inilah yang
mengeluarkan spora dan berkembang melalui pembelahan dalam sporogenesis
menjadi gametofit (Anggadiredja, dkk., 2010).
Faktor biologi utama yang menjadi pembatas produktivitas alga yaitu
faktor persaingan dan pemangsa dari hewan herbivora. Selain itu, dapat pula
dihambat oleh faktor morbiditas dan mortalitas alga itu sendiri. Morbiditas
disebabkan oleh penyakit dari infeksi mikroorganisme, tekanan lingkungan
perairan (fisika dan kimia perairan) yang buruk, serta tumbuhnya tanaman
penempel (parasit). Sementara, mortalitas dapat disebabkan oleh pemangsaan
hewan-hewan herbivora (Anggadiredja, dkk., 2010).
2.1.3 Morfologi tumbuhan
Ciri-ciri Galaxaura oblongata yaitu talus rimbun, berjumpai padat,
mengandung kapur, tinggi 5-12 cm, pengapuran sederhana dan meningkat
kehijauan hingga merah samar. Percabangan dikotomi berulang. Cabang
berukuran 0,5-0,9 cm dan mudah hancur apabila kering.
2.1.4 Sistematika tumbuhan
Berdasarkan hasil identifikasi di Pusat Penelitian Oseanografi LIPI,
taksonomi alga diklasifikasikan sebagai berikut:
Jenis/Species : Galaxaura oblongata (Ellis et Solander) Lamouroux
2.1.5 Kandungan kimia dan manfaat
Alga jenis rhodophyceae (alga merah) mengandung senyawa
steroid/triterpenoid. Alga ini juga mengandung pigmen fotosintetik berupa
karotin, xantofil, klorofil, fikobilin terutama fikoeretrin penyebab warna merah
dan fikosianin (Atmadja, 1996; Lobban dan Wynne, 1981). Galaxaura
oblongata merupakan alga merah penghasil karaginan (Trono dan Fortes,
1988).
2.2 Ekstraksi
Ekstraksi merupakan penarikan senyawa kimia dari jaringan tumbuhan
ataupun hewan dengan menggunakan penyari tertentu (Ditjen POM, 2000).
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia
langsung, ekstrak kering harus mudah digerus menjadi serbuk. Sebagai cairan
penyari dapat digunakan air, eter atau campuran etanol dan air (Ditjen POM,
1979).
Metode ekstraksi dapat dilakukan dengan berbagai cara yakni:
A. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian dengan merendam simplisia dalam
pelarut yang sesuai pada temperatur ruangan dan terlindungi dari cahaya
yang disertai pengocokan atau pengadukan (Ditjen POM, 2000).
2. Perkolasi
Perkolasi adalah penyarian dengan pelarut baru sampai sempurna yang
dilakukan pada temperatur ruangan. Proses terdiri dari tahap
pengembangan bahan, perendaman dan perkolasi sebenarnya
(penetesan/penampungan ekstrak) (Ditjen POM, 2000).
B. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan pelarut
pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut
terbatas yang relatif konstan dengan adanya pendingin balik (Ditjen POM,
2000).
2. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang dipanaskan hingga
pendingin balik dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan (Ditjen POM, 2000).
3. Digesti
Digesti adalah maserasi dengan menggunakan pemanasan lemah pada
temperatur 40-50oC (Depkes, 1986).
4. Infus
Infus adalah sediaan cair yang dibuat dengan mengekstraksi simplisia
dengan air pada suhu 90oC selama 15 menit (Ditjen POM, 1995).
5. Dekok
Dekok adalah penyarian dengan menggunakan air pada suhu 90oC selama
30 menit (Agoes, 2007).
2.3 Bakteri
Nama bakteri berasal dari kata bakterion (bahasa Yunani) yang berarti
tongkat atau batang. Sekarang nama itu dipakai untuk menyebutkan
sekelompok mikroorganisme yang bersel satu, berbiak dengan pembelahan
diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop
(Dwidjoseputro, 1994).
Berdasarkan bentuk morfologinya, maka bakteri dapat dibagi atas tiga,
yaitu bakteri berbentuk bulat (kokus), bakteri berbentuk batang (basil), dan
bakteri berbentuk melilit (spiral) (Dwidjoseputro, 1994).
Berdasarkan perbedaannya didalam menyerap zat warna Gram bakteri
dibagi atas dua golongan yaitu bakteri Gram positif dan bakteri Gram negatif.
menyebabkan warna ungu, sedangkan bakteri Gram negatif menyerap zat
warna kedua yaitu safranin dan menyebabkannya berwarna merah
(Dwidjoseputro, 1994).
2.3.1 Bakteri Gram positif
Bakteri Gram positif memiliki dinding sel yang tersusun atas beberapa
lapisan peptidoglikan, dan strukturnya tebal dan keras. Selain itu, dinding
selnya juga tersusun atas asam teikoat (teichonic acid) yang mengandung
alkohol (gliserol atau ribitol) dan posfat. Ada 2 macam asam teikoat, yaitu
asam lipoteikoat (lipoteichoic acid) yang merentang di lapisan peptidoglikan
dan terikat pada membran plasma, dan asam teikoat dinding (wall teichoic
acid) yang terikat pada lapisan peptidoglikan (Pratiwi, 2008).
Staphylococcus termasuk bakteri Gram positif dengan familia
Micrococcaceae. Staphylococcus merupakan bakteri yang selnya berbentuk
bulat, biasanya tersusun dalam rangkaian tak beraturan seperti anggur. Bakteri
ini tumbuh pada suhu 37oC dan mempunyai pigmen putih sampai kuning tua.
Salah satu contoh dari bakteri staphylococcus adalah Staphylococcus aureus.
Sistematika Staphylococcus aureus (Dwidjoseputro, 1994).
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococaceae
Marga : Staphylococcus
2.3.2 Bakteri Gram negatif
Bakteri Gram negatif memiliki dinding sel yang tersusun atas satu
lapisan peptidoglikan dan membran luar. Terdapat daerah periplasma, yaitu
daerah yang terdapat di antara membran plasma dan membran luar. Periplasma
berisi enzim degradasi konsentrasi tinggi serta protein-protein transpor.
Dinding sel bakteri Gram negatif tidak mengandung teichoic acid. Membran
luar tersusun atas lipopolisakarida, lipoprotein, dan posfolipid (Pratiwi, 2008).
Kelompok Pseudomonas sp. adalah bakteri Gram negatif yang
berbentuk batang dan terlihat sebagai bakteri tunggal, berpasangan dan
kadang-kadang membentuk rantai yang pendek; berukuran sekitar 0,6 x 2 µ m, aerob,
ditemukan secara luas di tanah, air, tumbuhan dan hewan, tumbuh baik pada
suhu 37-42oC. Sistematika bakteri Pseudomonas aeruginosa (Dwidjoseputro,
1994) adalah sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Pseudomonadales
Suku : Pseudomonadaceae
Marga : Pseudomonas
Jenis : Pseudomonas aeruginosa
2.3.3 Fase pertumbuhan bakteri
Bila koloni mikroorganisme ditanam pada media yang sesuai dalam
waktu tertentu, maka dapat dilihat suatu grafik pertumbuhan yang dapat dibagi
1. Fase penyesuaian diri (lag phase)
Fase pertama ini mikroorganisme mengalami penyesuaian pada lingkungan
baru setelah pemindahan. Fase ini tidak terjadi perkembangbiakan sel, yang
ada hanya peningkatan ukuran sel dan aktivitas metabolisme.
2. Fase pembelahan (log phase)
Fase kedua ini mikroorganisme berkembang dengan cepat yang jumlahnya
meningkat secara eksponensial. Fase ini berlangsung selama 18-24 jam.
3. Fase stasioner (stationary phase)
Fase ketiga terjadi keseimbangan antara jumlah sel yang membelah dengan
jumlah sel yang mati. Hal ini terjadi karena akumulasi hasil metabolisme yang
toksis.
4. Fase kematian
Fase dimana jumlah sel yang mati meningkat dikarenakan keadaan
lingkungan seperti ketidaksediaan nutrisi dan akumulasi hasil metabolisme
yang toksik (Pratiwi, 2008).
Faktor yang mempengaruhi pertumbuhan mikroorganisme dapat
dibedakan menjadi faktor fisika dan faktor kimia. Faktor fisika meliputi
temperatur, pH, dan tekanan osmosis. Faktor kimia meliputi karbon, oksigen,
trace elements dan faktor pertumbuhan organik termasuk nutrisi yang terdapat
dalam media pertumbuhan (Pratiwi, 2008).
1. Temperatur
Pertumbuhan bakteri sangat dipengaruhi oleh temperatur. Setiap
terjadi kecepatan pertumbuhan optimal dan dihasilkan jumlah sel yang
maksimal. Temperatur yang terlalu tinggi dapat menyebabkan denaturasi
protein sedangkan temperatur yang sangat rendah menyebabkan aktivitas
enzim akan terhenti. Berdasarkan kisaran temperatur dibagi atas tiga golongan:
a. Psikrofil, tumbuh pada temperatur maksimal 20oC dengan suhu optimal 0
sampai 15oC.
b. Mesofil, tumbuh pada temperatur 15 sampai 45oC dengan suhu optimal
20 sampai 40oC.
c. Termofil, tumbuh pada temperatur 45 sampai 100oC dengan suhu optimal
55 sampai 65oC.
2. pH
Kebanyakan bakteri memiliki pH optimum terletak antara 6,5 dan 7,5; pH
merupakan indikasi konsentrasi ion hidrogen. Peningkatan dan penurunan
konsentrasi ion hidrogen dapat menyebabkan ionisasi gugus-gugus dalam
protein, amino dan karboksilat. Hal ini dapat menyebabkan denaturasi protein
yang mengganggu pertumbuhan sel.
3. Tekanan osmosis
Tekanan osmosis adalah tekanan yang diberikan untuk mencegah
terjadinya osmosis/mencegah terjadinya perpindahan molekul pelarut ke
larutan. Osmosis merupakan perpindahan air melewati membran
semipermeabel karena ketidakseimbangan material terlarut dalam media. Air
dalam larutan hipertonik air akan keluar dari sel sehingga membran plasma
mengerut dan lepas dari dinding sel.
4. Oksigen
Berdasarkan kebutuhan oksigen dikenal mikroorganisme dibagi menjadi 5
golongan yaitu:
a. Anaerob obligat, hidup tanpa oksigen, oksigen toksik terhadap
golongan ini.
b. Anaerob aerotoleran, tidak mati dengan adanya oksigen.
c. Anaerob fakultatif, mampu tumbuh baik dalam suasana dengan atau
tanpa oksigen.
d. Aerob obligat, tumbuh subur bila ada oksigen dalam jumlah besar.
e. Mikroaerofilik, hanya tumbuh baik dalam tekanan oksigen yang
rendah.
5. Nutrisi
Nutrisi merupakan substansi yang diperlukan untuk biosintesis dan
pembentukan energi. Berdasarkan kebutuhannya, nutrisi dibedakan menjadi
dua yaitu makroelemen, yaitu elemen yang diperlukan dalam jumlah banyak
dan mikroelemen (trace element), yaitu elemen nutrisi yang diperlukan dalam
jumlah sedikit (Pratiwi, 2008).
2.3.4 Media biakan mikroba
Media adalah suatu bahan yang terdiri atas campuran nutrisi atau
zat-zat hara (nutrien) yang digunakan untuk menumbuhkan di atas atau di
perbanyakan, pengujian sifat-sifat fisiologis, dan penghitungan jumlah
mikroorganisme (Waluyo, 2010).
Pertumbuhan mikroorganisme di dalam media dapat tumbuh dengan
baik apabila memenuhi persyaratan (Waluyo, 2010), antara lain:
Media harus mengandung semua nutrien yang mudah digunakan oleh
mikroorganisme.
Media harus mempunyai tekanan osmosis, tegangan permukaan, dan pH
yang sesuai dengan pertumbuhan mikroorganisme.
Media tidak mengandung zat-zat yang menghambat pertumbuhan
mikroorganisme.
Media harus steril sebelum digunakan, supaya mikroorganisme dapat
tumbuh dengan baik.
Media biakan mikroba terbagi menjadi beberapa golongan (Waluyo,
2010; Pratiwi, 2008) yaitu:
a. Penggolongan media berdasarkan konsistensinya
1. Media padat
Media padat diperoleh dengan cara menambahkan agar-agar. Agar
berasal dari ganggang/alga yang berfungsi sebagai bahan pemadat.
Alga digunakan karena bahan ini tidak diuraikan oleh mikroorganisme
dan dapat membeku pada suhu di atas 45oC. Media padat biasanya
digunakan untuk mengamati penampilan atau morfologi koloni dan
2. Media setengah padat (semi solid)
Media setengah padat dibuat dengan bahan yang sama dengan media
padat, akan tetapi yang berbeda adalah komposisi agarnya.
3. Media cair
Media cair dapat digunakan untuk berbagai tujuan seperti pembiakan
mikroba dalam jumlah besar, penelaahan fermentasi, dan berbagai
macam uji. Beberapa contoh media cair adalah kaldu nutrien, kaldu
glukosa, air pepton, dan lain sebagainya.
b. Penggolongan media berdasarkan susunan kimianya
1. Media sintetik
Media sintetik yaitu media yang susunan kimianya dapat diketahui
dengan pasti. Komposisi kimia media sintetik biasanya dibuat dari
bahan-bahan kimia dengan kemurnian tinggi dan ditentukan dengan
tepat. Media ini biasanya digunakan untuk mempelajari kebutuhan
makanan mikroorganisme. Contoh media sintetik: cairan Hanks, Locke,
Thyrode.
2. Media non sintetik
Media non sintetik merupakan media yang susunan kimianya tidak
dapat ditentukan dengan pasti. Media ini banyak digunakan untuk
menumbuhkan dan mempelajari taksonomi mikroorganisme. Misalnya,
bahan-bahan yang teradapat dalam kaldu nutrien; yakni ekstrak daging
dan pepton memiliki komposisi kimia yang tidak pasti. Contoh lain:
3. Media semi sintetik
Media semi sintetik merupakan campuran media sintetik dan media non
sintetik. Misalnya, cairan Hanks yang ditambah serum.
4. Media anorganik
Media ini merupakan media yang tersusun dari bahan-bahan anorganik.
5. Media organik
Media ini merupakan media yang tersusun dari bahan-bahan organik.
c. Penggolongan media berdasarkan fungsinya
1. Media selektif
Media selektif merupakan media yang mendukung pertumbuhan
mikroorganisme tertentu (seleksi) dengan menghambat pertumbuhan
mikroorganisme yang lain. Pada media ini ditambahkan bahan
penghambat pertumbuhan, misalnya bile salt dan dye (fuchsin, crystal
violet, brilliant green) yang akan menghambat pertumbuhan bakteri
Gram positif dan tidak memberi efek pada bakteri Gram negatif.
2. Media diferensial
Media diferensial digunakan untuk membedakan kelompok
mikroorganisme dan bahkan dapat digunakan untuk identifikasi.
Contohnya adalah media agar darah, yang merupakan media diferensial
sekaligus media penyubur, mampu membedakan antara bakteri
hemolitik dan non hemolitik dengan mengetahui sifat lisis eritrosit (ciri:
daerah jernih di sekitar koloni akibat perusakan sel darah merah);
selektif, terdiri dari laktosa dan neutral red dye. Mampu membedakan
antara bakteri yang memfermentasi laktosa dan yang bukan (ciri:
adanya daerah merah muda-merah di sekitar koloni).
3. Media penyubur (enrichment media)
Media penyubur merupakan media yang berguna untuk mempercepat
pertumbuhan mikroorganisme tertentu.
4. Media khusus
Contoh media khusus adalah media untuk bakteri anaerob. Biasanya ke
dalam media tersebut ditambahkan bahan yang dapat mereduksi
kandungan O2 dengan cara pengikatan kimiawi. Contoh bahan-bahan
itu adalah natioglikolat, sistein, asam askorbat. Sebagai indikator
anaerob digunakan rezasurin (bila terjadi oksidasi-yang berarti bakteri
bersifat aerobik-akan terbentuk warna merah).
5. Media penguji
Media penguji adalah media dengan susunan kimia tertentu yang
digunakan untuk pengujian vitamin, asam amino, antibiotik, dan
sebagainya.
6. Media serbaguna
Media ini merupakan media yang paling umum digunakan dalam
mikrobiologi (dapat menunjang pertumbuhan sebagian besar mikroba).
2.4 Pengujian Aktivitas Antimikroba
Pengukuran aktivitas antimikroba secara in vitro dapat dikelompokkan
dalam tiga metode yaitu:
a. Metode Dilusi
Metode ini digunakan untuk menentukan kadar hambat minimum (KHM)
dan kadar bunuh minimum (KBM) dari zat antimikroba. Metode dilusi ini
menggunakan satu seri tabung reaksi yang diisi dengan media cair dan
sejumlah tertentu mikroba yang diuji. Kemudian masing-masing tabung diuji
dengan zat antimikroba yang telah diencerkan secara serial. Seri tabung
diinkubasi pada suhu ± 37oC selama 18-24 jam dan diamati terjadinya
kekeruhan pada tabung. Konsentrasi terendah obat pada tabung yang
ditunjukkan dengan hasil biakan yang mulai tampak jernih (tidak ada
pertumbuhan mikroba) adalah KHM dari obat. Selanjutnya biakan dari semua
tabung yang jernih diinokulasikan pada media agar padat, diinkubasikan dan
keesokan harinya diamati ada tidaknya koloni mikroba yang tumbuh.
Konsentrasi terendah obat pada biakan padat yang ditunjukkan dengan tidak
adanya pertumbuhan koloni mikroba adalah KBM dari obat terhadap bakteri
uji (Tim Mikrobiologi FK Brawijaya, 2003).
b. Metode Difusi
Metode yang paling sering digunakan adalah metode cakram kertas,
silinder gelas/logam tahan karat dan pencetak lubang (punch hole). Cakram
kertas berisi sejumlah tertentu obat ditempatkan pada permukaan medium
kemudian diinkubasi pada suhu 37oC selama 18-24 jam. Selanjutnya diamati
adanya area (zona) jernih di sekitar cakram kertas yang menunjukkan tidak
adanya pertumbuhan mikroba (Pratiwi, 2008).
c. Metode turbidimetri
Metode turbidimetri dilakukan berdasarkan hambatan pertumbuhan
mikroba dalam media cair yang mengandung zat antimikroba. Hambatan
pertumbuhan mikroba ditentukan dengan mengukur serapannya dengan
menggunakan spektrofotometer pada panjang gelombang 530 nm (Ditjen
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental yaitu
suatu penelitian dengan melakukan kegiatan percobaan (experiment) yang
bertujuan untuk mencari pengaruh variabel tertentu terhadap variabel lain dan
penelitian dilakukan di laboratorium. Tahap penelitian meliputi pengumpulan
bahan tumbuhan, identifikasi bahan tumbuhan, pembuatan simplisia,
karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak. Selanjutnya
pengujian aktivitas antibakteri dengan metode difusi agar menggunakan punch
hole. Parameter yang dilihat adalah besarnya diameter hambat pertumbuhan
bakteri. Penelitian ini dilakukan di Laboratorium Farmakognosi dan
Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara
Medan.
3.1 Alat
Alat yang digunakan pada penelitian ini adalah alat-alat gelas, autoklaf
(Fisons), blender (Panasonic), bola karet, desikator, freeze dryer (Modulio),
inkubator (Memmert), jangka sorong, jarum ose, kamera digital (Kodak),
bunsen, krus porselen, Laminar Air Flow Cabinet (Astec HLF 1200L), lemari
pendingin (Glacio), mikroskop (Olympus), neraca kasar, neraca listrik (Mettler
Toledo), oven (Fisher), penangas air, pinset, pipet mikro (Eppendorf), rotary
evaporator (Stuart), seperangkat alat penetapan kadar, silinder logam,
3.2 Bahan
Bahan yang digunakan adalah talus alga merah (Galaxaura oblongata),
Nutrient agar (NA), Nutrient broth (NB), Mueller Hinton agar(MHA), bakteri
Staphylococcus aureus (ATCC 29737) dan Pseudomonas aeruginosa (ATCC
9027) dan air suling. Bahan kimia yang digunakan berkualitas pro analisa,
kecuali dinyatakan lain: dimetilsulfoksida (DMSO), amil alkohol, asam klorida
pekat, asam asetat anhidrida, asam nitrat pekat, asam sulfat pekat, benzen, besi
(III) klorida, bismut (III) nitrat, eter, etanol, etil asetat, n-heksana, isopropanol,
kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida, natrium
sulfat anhidrat, raksa (II) klorida, serbuk magnesium, serbuk zinkum, timbal
(II) asetat dan toluena.
3.3 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan,
identifikasi bahan tumbuhan dan pembuatan simplisia talus alga merah
(Galaxaura oblongata).
3.3.1 Pengambilan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan dari daerah lain. Bahan tumbuhan yang
digunakan adalah talus Galaxaura oblongata (Ellis et Solander) Lamouroux
yang diperoleh dari Desa Halodan, Kecamatan Pulau Banyak Barat, Kabupaten
3.3.2 Identifikasi bahan tumbuhan
Identifikasi bahan tumbuhan dilakukan di Pusat Penelitian Oseanografi
LIPI Jakarta. Identifikasi tumbuhan ini telah dilakukan oleh Violita Milala
(2012) dan bahan tumbuhan yang digunakan dalam penelitian ini adalah alga
Galaxaura oblongata (Ellis et Solander) Lamouroux. Hasil identifikasi
tumbuhan dapat dilihat pada Lampiran 1, halaman 46.
3.3.3 Pembuatan simplisia
Talus Galaxaura oblongata yang telah dikumpulkan, direndam dalam
air dan dibersihkan dari pengotor dan organisme yang melekat serta sisa-sisa
karang yang menempel. Dicuci berkali-kali dengan air sampai bersih dan
ditiriskan. Bahan tumbuhan dikeringkan dengan cara diangin-anginkan terlebih
dahulu kemudian dikeringkan di lemari pengering hingga kering. Selanjutnya
simplisia diblender menjadi serbuk dan disimpan dalam kantung plastik. Bagan
kerja pembuatan simplisia dapat dilihat pada Lampiran 5, halaman 50.
3.4 Pembuatan Pereaksi 3.4.1 Pereaksi Mayer
Larutan raksa (II) klorida P 2,266% b/v sebanyak 60 ml dicampur
dengan 10 ml larutan kalium iodida P 50% b/v, kemudian ditambahkan air
secukupnya hingga 100 ml (Depkes, 1995).
3.4.2 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida P dilarutkan dalam air secukupnya, lalu
ditambahkan 2 g iodium P kemudian ditambahkan air hingga 100 ml (Depkes,
3.4.3 Pereaksi Dragendorff
Larutan bismuth nitrat P 40% b/v dalam asam nitrat P sebanyak 20 ml
dicampur dengan 50 ml kalium iodida P 54,4% b/v, didiamkan sampai
memisah sempurna. Lalu diambil lapisan jernihnya dan diencerkan dengan air
secukupnya hingga 100 ml (Depkes, 1995).
3.4.4 Pereaksi Molish
Sebanyak 3 g α-naftol P, dilarutkan dalam asam nitrat 0,5 N hingga
diperoleh larutan 100 ml (Depkes, 1995).
3.4.5 Pereaksi besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air secukupnya hingga
100 ml (Depkes, 1980).
3.4.6 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air bebas karbon
dioksida hingga 100 ml (Depkes, 1980).
3.4.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g natrium hidroksida, dilarutkan dalam air secukupnya
hingga 100 ml (Depkes, 1980).
3.4.8 Pereaksi asam klorida 2 N
Larutan asam klorida pekat sebanyak 17 ml ditambahkan air suling
sampai 100 ml (Ditjen POM, 1979).
3.4.9 Pereaksi asam sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,808 g ditambahkan air suling
3.4.10 Pereaksi Lieberman-Bourchard
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan
kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak
larut asam. Pemeriksaan karakteristik simplisia ini telah dilakukan oleh Violita
Milala (2012).
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk,
ukuran, warna, bau dan rasa simplisia alga merah.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia alga
merah. Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi
dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian
diamati di bawah mikroskop. Gambar mikroskopik dapat dilihat pada
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi
toluena). Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam
labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit,
kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
Kemudian ke dalam labu yang berisi toluen jenuh tersebut dimasukkan 5 g
serbuk simplisia yang telah ditimbang seksama, dipanaskan hati-hati selama 15
menit. Setelah toluen mendidih, kecepatan tetesan diatur lebih kurang 2 tetes
tiap detik, hingga sebagian air tersuling, kemudian naikkan kecepatan
penyulingan hingga 4 tetes tiap detik. Setelah semua air tersuling, bagian
dalam pendingin dibilas dengan toluen. Penyulingan dilanjutkan selama 5
menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar.
Setelah air dan toluen memisah sempurna, volume dibaca dengan ketelitian
0,05 ml. Selisih kedua volume air dibaca sesuai dengan kandungan air yang
terdapat dalam bahan yang diperiksa (WHO, 1998).
3.5.4 Penetapan kadar sari larut air
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml air-kloroform dalam air suling sampai 1 liter) dengan
menggunakan botol bersumbat warna coklat sambil sesekali dikocok selama 6
jam pertama, kemudian dibiarkan selama 18 jam dan disaring, sejumlah 20 ml
filtrat pertama diuapkan hingga kering dalam cawan yang telah dipanaskan dan
tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah
dikeringkan (Depkes, 1995).
3.5.5 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml etanol
96% dengan menggunakan botol bersumbat berwarna coklat sambil sesekali
dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan
disaring. Sejumlah 20 ml filtrat pertama diuapkan hingga kering dalam cawan
yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu
105oC sampai diperoleh bobot tetap. Kadar sari larut dalam etanol dihitung
terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan
pada suhu 600oC selama 3 jam. Selanjutnya didinginkan dan ditimbang sampai
diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah
dikeringkan (Depkes, 1995).
3.5.7 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan
dalam 25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam
asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air
Kadar abu tidak larut dalam asam dihitung terhadap bahan yang telah
dikeringkan (Depkes, 1995).
3.6 Skrining Fitokimia 3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2
menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji
alkaloida: diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi:
1. ditambahkan 2 tetes pereaksi Mayer
2. ditambahkan 2 tetes pereaksi Bouchardat
3. ditambahkan 2 tetes pereaksi Dragendorff
Alkaloid positif jika terjadi endapan atau kekeruhan pada paling sedikit
dua dari tiga percobaan diatas (Depkes, 1995).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambah air panas, dididihkan selama
5 menit dan disaring dalam keadaan panas. Ke dalam 5 ml filtrat ditambahkan
0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 1 ml amil alkohol,
dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah
kekuningan atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.3 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 ml
ditambahkan 10 ml HCl 2N dan direfluks selama 10 menit, didinginkan, lalu
disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal
(II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari
dengan 20 ml campuran 2 bagian isopropanol dan 3 bagian kloroform,
perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan
Na2SO4 anhidrat, disaring kemudian diuapkan pada temperatur tidak lebih dari
50oC, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk
percobaan berikut: sepersepuluh ml larutan percobaan dimasukkan dalam
tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan
2 ml air dan 5 tetes larutan pereaksi Molish, lalu ditambahkan dengan hati-hati
2 ml asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan,
menunjukkan adanya ikatan gula (glikon) (Depkes, 1995).
3.6.4 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia dicampur dengan 5 ml asam sulfat 2 N,
dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring, kemudian kocok dengan 2
ml NaOH 2 N, didiamkan. Lapisan air berwarna merah menunjukkan adanya
antrakinon (Depkes, 1995).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok kuat-kuat
dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam
klorida 2 N buih tidak hilang (Depkes, 1995).
3.6.6 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1
%. Jika terjadi warna biru atau kehitaman menunjukkan adanya tanin (Depkes,
1989).
3.6.7 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan eter 20 ml selama 2
jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa
ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat
(pereaksi Lieberman-Bourchard), diteteskan pada saat akan mereaksikan
sampel uji. Apabila terbentuk warna biru atau biru hijau menunjukkan adanya
steroida sedangkan warna merah, merah muda atau ungu menunjukkan adanya
triterpenoid (Harborne, 1987).
3.7 Pembuatan Ekstrak n-Heksana, Ekstrak Etilasetat dan Ekstrak Etanol Alga Merah (Galaxaura oblongata (Ellis et Solander) Lamouroux) Secara Perkolasi Bertingkat
Pembuatan ekstrak dilakukan secara perkolasi bertingkat menggunakan
tiga pelarut. Cara kerja: sebanyak 200 g serbuk simplisia dimasukkan ke dalam
bejana tertutup, dituangi cairan penyari n-heksana sampai semua simplisia
terendam sempurna dan dibiarkan sekurang-kurangnya selama 3 jam.
ditekan hati-hati, kemudian dituangi cairan penyari secukupnya sampai cairan
mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, tutup
perkolator dan biarkan selama 24 jam. Biarkan cairan menetes dengan
kecepatan 1 ml per menit, ditambahkan berulang-ulang cairan penyari
secukupnya hingga selalu terdapat selapis cairan penyari di atas simplisia.
Perkolasi dihentikan hingga 500 mg perkolat yang keluar terakhir diuapkan
tidak meninggalkan sisa. Kemudian ampasnya dikeringkan dengan cara
diangin-anginkan dan diperkolasi kembali menggunakan cairan penyari
etilasetat dengan prosedur perkolasi yang sama. Setelah perkolat etilasetat
diperoleh, ampasnya diangin-anginkan kembali dan diperkolasi menggunakan
cairan penyari etanol dengan prosedur perkolasi yang sama. Masing-masing
perkolat yang diperoleh dipekatkan dengan alat penguap rotaryevaporator dan
dikeringbekukan dengan freeze dryer (Ditjen POM, 1979).
3.8 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan
terlebih dahulu sebelum dipakai. Alat gelas disterilkan didalam oven pada suhu
170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C selama 15
menit. Jarum ose dan pinset disterilkan dengan lampu bunsen (Lay, 1994).
3.9 Pembuatan Media
3.9.1 Media nutrient agar (NA) Komposisi : Bacto – Beef extract 3 g
Bacto peptone 5 g
Cara Pembuatan :
Sebanyak 23 g sediaan NA ditimbang, disuspensikan kedalam air suling 1000
ml, lalu dipanaskan sampai larut sempurna. Kemudian media dimasukkan
kedalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama
15 menit (Difco, 1953).
3.9.2 Media nutrient broth (NB)
Komposisi : Bacto beef extract 3,0 g
Bacto peptone 5,0 g
Cara Pembuatan:
Sebanyak 8 g nutrient broth dilarutkan dalam air suling steril sebanyak 1000 ml
kemudian dipanaskan hingga semua larut. Kemudian media dimasukkan
kedalam erlenmeyer dan disterilkan di dalam autoklaf pada suhu 121°C selama
15 menit (Difco, 1953).
3.9.3 Media Mueller Hinton agar (MHA)
Komposisi: Beef infusion form 300 g
Casein hydrolysate 17,5 g
Starch 1,5 g
Agar 17 g
Cara pembuatan:
Sebanyak 38 g sediaan MHA ditimbang kemudian disuspensikan dalam
erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
terbentuk larutan jernih. Disterilkan di dalam autoklaf pada suhu 121oC selama
15 menit (Difco, 1953).
3.10 Pembuatan Agar Miring
Kedalam tabung reaksi dimasukkan 10 ml media Nutrien Agar yang
sudah dicairkan, kemudian diletakkan dengan posisi miring dengan kemiringan
lebih kurang 30-45 derajat, ditutup mulut tabung reaksi dengan kapas dan
dibiarkan memadat (Lay, 1994).
3.11 Pembuatan Stok Kultur Bakteri
Koloni bakteri diambil dengan menggunakan jarum ose steril, lalu
ditanam pada media nutrient agar miring dengan cara menggores. Kemudian
diinkubasi dalam inkubator pada suhu 35-37oC selama 18-24 jam (Ditjen
POM, 1995).
3.12 Penyiapan Inokulum Bakteri
Koloni bakteri diambil dari stok kultur dengan jarum ose steril
kemudian disuspensikan ke dalam 10 ml larutan nutrient broth. Kemudian
diukur kekeruhan larutan pada panjang gelombang 580 nm sampai diperoleh
transmitan 25% (Ditjen POM, 1995).
3.13 Pembuatan Larutan Uji (Ekstrak n-Heksana, Etilasetat dan Etanol) dengan Berbagai Konsentrasi
Sebanyak 2,5 g ekstrak n-heksana ditimbang seksama dengan neraca
analitik, dilarutkan dengan pelarut DMSO yang diencerkan dengan etanol 96%
(1:1) dalam labu tentukur 5 ml hingga garis tanda dan diperoleh konsentrasi
dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml, 90 mg/ml,
80 mg/ml, 70 mg/ml, 60 mg/ml, 50 mg/ml, 40 mg/ml, 30 mg/ml, 20 mg/ml dan
10 mg/ml. Dilakukan prosedur yang sama terhadap ekstrak etilasetat dan
ekstrak etanol.
3.14 Pengujian Aktivitas Antibakteri secara In vitro
Kedalam cawan petri dimasukkan 0,1 ml inokulum (106 CFU/ml)
kemudian ditambahkan 20 ml media MHA steril yang telah dicairkan
(45-50oC) dihomogenkan dan dibiarkan sampai media memadat. Setelah media
padat kemudian dibuat lubang, selanjutnya ke dalam lubang dimasukkan
ekstrak n-heksana sebanyak 0,1 ml dengan berbagai konsentrasi serta pelarut
DMSO-etanol 96% (1:1) sebagai kontrol (blanko). Kemudian diinkubasi pada
suhu ±36oC selama 18-24 jam. Selanjutnya diukur diameter daerah hambat di
sekitar larutan penguji dengan menggunakan jangka sorong. Pengujian
dilakukan sebanyak tiga kali. Hal yang sama dilakukan terhadap ekstrak
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian
Oseanografi LIPI Jakarta, menunjukkan bahwa bahan tumbuhan adalah alga
jenis Galaxaura oblongata (Ellis et Solander) Lamouroux, suku
Galaxauraceae, bangsa Nemalionales, kelas Rhodophyceae, Divisi
Rhodophyta.
4.2 Hasil Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik dari simplisia alga merah Galaxaura
oblongata yaitu Galaxaura oblongata mempunyai talus rimbun, berjumpai
padat, tinggi 5-12 cm, pengapuran sederhana dan meningkat dengan
pertambahan usia, melekat dengan holdfast kecil dan berwarna kehijauan
hingga merah samar. Percabangan secara dikotomi berulang. Cabang
berukuran 0,5-0,9 cm dan mudah hancur apabila kering.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik dari serbuk simplisia alga merah
Galaxaura oblongata memperlihatkan adanya sel propagule serta sel-sel
parenkim yang memiliki pigmen berwarna merah.
4.2.3 Hasil pemeriksaan karakteristik serbuk simplisia
Hasil pemeriksaan karakteristik serbuk simplisia diperoleh kadar air
sebesar 0,49%, kadar abu total sebesar 68,85% dan kadar abu tidak larut asam
sebesar 16,93%.
Kadar air simplisia menunjukkan jumlah air yang terkandung dalam
simplisia yang digunakan. Kadar air simplisia ditetapkan untuk menjaga
kualitas simplisia karena kadar air mempunyai kaitan dengan kemungkinan
pertumbuhan jamur, pertumbuhan mikroba dan kerusakan bahan tumbuhan
terkait hidrolisis. Penetapan kadar sari larut air dan larut etanol dilakukan untuk
mengetahui kadar sari yang dapat larut dalam air maupun dalam etanol dari
suatu simplisia. Senyawa-senyawa yang dapat larut dalam air adalah glikosida,
tanin, gula, pati dan zat warna dan senyawa-senyawa yang dapat larut dalam
etanol seperti glikosida, antrakinon, steroid, flavonoid, klorofil dan saponin
(Depkes, 1986). Kadar sari larut air lebih tinggi daripada kadar sari larut
etanol, hal ini disebabkan alga mengandung karbohidrat yang cukup tinggi.
Penetapan kadar abu dilakukan untuk memberikan gambaran
kandungan mineral internal dan eksternal dari simplisia. Tingginya kadar abu
dari simplisia disebabkan oleh karena kandungan mineral alga yang tinggi.
Alga jenis Galaxaura oblongata memiliki talus dan segmen-segmen yang
keras dan mudah patah yang tergolong dalam kelompok calcareous (kerangka
keras) yaitu jenis alga berzat kapur yang sejati karena dibentuk dari zat kapur
yang cukup tinggi yaitu kalsium karbonat (CaCO3) berupa aragonit berada di
dalam dan permukaan selnya serta zat-zat lain seperti karbonat magnesium dan
karbonat strontium sehingga kadar abu total dan abu tidak larut dalam asam
4.3 Hasil Ekstraksi
Ekstraksi alga merah menggunakan metode perkolasi bertingkat yang
diekstraksi dengan beberapa pelarut untuk mendapatkan ekstrak n-heksana,
ekstrak etilasetat, dan ekstrak etanol. Diharapkan senyawa-senyawa aktif yang
terkandung di dalamnya dapat tersari sempurna. Hasil penyarian dari 200 g
serbuk simplisia alga merah (Galaxaura oblongata) diperoleh ekstrak n
-heksana 3,186 g, ekstrak etilasetat 2,918 g dan ekstrak etanol 5,620 g.
4.4 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia alga merah (Galaxaura
oblongata) dan ekstrak n-heksana, ekstrak etilasetat, serta ekstrak etanol
menunjukkan bahwa alga merah mengandung golongan senyawa-senyawa
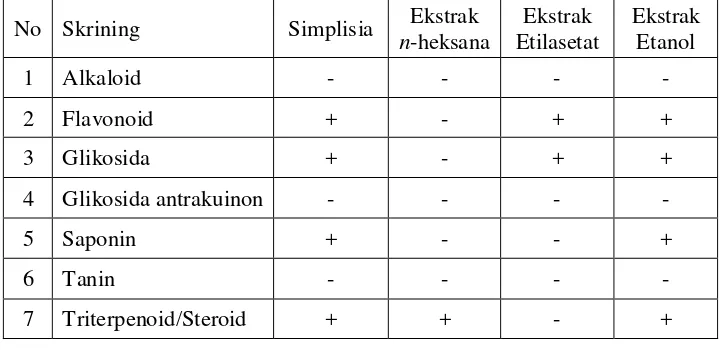
kimia seperti yang terlihat pada Tabel 4.1 berikut ini.
Tabel 4.1 Hasil skrining fitokimia simplisia, ekstrak n-heksana, ekstrak
etilasetat dan ekstrak etanol alga merah (Galaxaura oblongata)
No Skrining Simplisia Ekstrak
n-heksana
(+) positif : mengandung golongan senyawa
Pada serbuk simplisia alga merah (Galaxaura oblongata) yang
ditambahkan pereaksi Molish dan asam sulfat pekat akan terbentuk cincin
berwarna ungu pada batas cairan menunjukkan adanya glikosida. Penambahan
10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik
dengan adanya buih yang mantap selama tidak kurang dari 10 menit, setinggi
1-10 cm dan tidak hilang dengan penambahan asam klorida 2N menunjukkan
adanya saponin. Penambahan serbuk Mg, asam klorida pekat dan amil alkohol
dan dibiarkan memisah memberikan warna kuning menunjukkan adanya
senyawa flavonoid. Penambahan pereaksi Lieberman-Bourchard memberikan
warna merah ungu menunjukkan adanya triterpenoid/steroid.
Alga merah (Galaxaura oblongata) memiliki potensi sebagai
antibakteri, yaitu dengan adanya senyawa-senyawa flavonoida, saponin dan
steroid/triterpenoid yang mempunyai potensi sebagai antibakteri (Robinson,
1991). Senyawa-senyawa ini bekerja pada bakteri dengan cara merusak
membran sitoplasma. Membran sitoplasma bakteri berfungsi mengatur
masuknya bahan-bahan makanan atau nutrisi, apabila membran sitoplasma
rusak maka metabolit penting dalam bakteri akan keluar dan bahan makanan
untuk menghasilkan energi tidak dapat masuk sehingga terjadi
ketidakmampuan sel bakteri untuk tumbuh dan pada akhirnya terjadi kematian
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak n-Heksana, Ekstrak Etilasetat dan Ekstrak Etanol Alga Merah (Galaxaura oblongata) terhadap Bakteri Staphylococcus aureus dan Pseudomonas aeruginosa
Hasil uji aktivitas antibakteri ekstrak n-heksana, ekstrak etilasetat dan
ekstrak etanol alga merah (Galaxaura oblongata) terhadap bakteri
Staphylococcus aureus dan Pseudomonas aeruginosa ditunjukkan pada Tabel
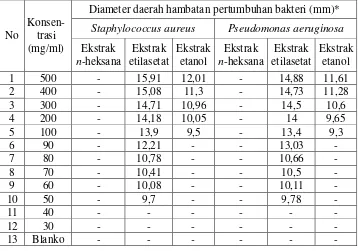
4.2 berikut ini.
Tabel 4.2 Hasil Pengukuran Diameter Daerah Hambatan Pertumbuhan Bakteri
Staphylococcus aureus dan Pseudomonas aeruginosa
No
Konsen-trasi (mg/ml)
Diameter daerah hambatan pertumbuhan bakteri (mm)*
Staphylococcus aureus Pseudomonas aeruginosa
(*) = Hasil rata-rata tiga kali pengukuran
(-) = Tidak ada hambatan
Blanko = DMSO-etanol 96% (1:1)
Hasil uji aktivitas antibakteri dari ekstrak n-heksana tidak memberikan
diameter daerah hambat terhadap bakteri Staphylococcus aureus dan