LAPORAN RESMI PRAKTIKUM KIMIA DASAR
Disusun Oleh: Kelompok VIIA
Bayu Taufani H 23010112120004 Fatimah Al Zahro 23010112120022 Nur Rohmah 23010112120040 Dewi Suryana 23010112120049
FAKULTAS PETERNAKAN DAN PERTANIAN UNIVERSITAS DIPONEGORO
Kelompok : VII (TUJUH A) Tanggal Pengesahan : November 2012
Menyetujui,
Koordinator Umum Asisten Praktikum Kimia Dasar
Landung Dwi Cahyono NIM. H2A 009 028
Asisten Pembimbing
Tri Vidyanto NIM. 23010111120056
Mengetahui,
Koordinator Praktikum Kimia Dasar
RINGKASAN
Kelompok VI1A. 2012. Laporan Resmi Praktikum Kimia Dasar. (Asisten: Tri Vidyanto)
Praktikum Kimia Dasar dilaksanakan pada hari Sabtu tanggal 20 Oktober 2012 pukul 09.45 – 12.45 WIB dengan materi Analisa Kuantitatif dan Karbohidrat serta hari Sabtu tanggal 09 November 2012 pukul 09.45 – 12.45 WIB dengan materi Protein dan Lemak di Laboratorium Fisiologi dan Biokimia Ternak Fakultas Peternakan dan Pertanian Universitas Diponegoro Semarang.
Praktikum Kimia Dasar dengan Analisa Kuantitatif, alat yang digunakan antara lain buret, statif, klem, erlenmeyer 100ml, labu ukur 100 ml, pipet volume 10 ml, pipet tetes. Bahan yang digunakan antara lain NaOH 0,1 N, Asam Oksalat (H2C2O4), Fenolftalein (PP) 1%,. Sedangkan praktikum Analisa Karbohidrat, alat yang digunakan pada praktikum ini adalah pipet tetes,tabung reaksi, rak tabung, penangas air, kaki tiga, penjepit, dan gelas beker 250 ml. Dan bahan yang digunakan adalah glukosa, laktosa, sukrosa, fruktosa, kanji, madu, sirup, Natrium Karbonat, Fehling A, adalah tabung reaksi yang berfungsi untuk tempat bereaksinya larutan atau Fehling B, HNO3 pekat. Pada praktikum mengenai Protein alat yang digunakan antara lain tabung reaksi dan pipet tetes. Bahan yang digunakan yaitu telur, susu, FeCl3, NaOH 10%, CuSO4 0,5% dan HgCl2. Pada praktikum lemak alat yang digunakan yaitu tabung reaksi. Bahan yang digunakan yaitu minyak kelapa, mentega, margarin, lemak (gajih), Na2CO3, air (aquades), alkohol dan eter.
Berdasarkan hasil percobaan dapat disimpulkan bahwa analisa kuantitatif dapat dilakukan dengan mengukur volume larutan yang konsentrasinya diketahui dengan teliti. Pada percobaan standarisasi NaOH setelah dilakukan tiga kali titrasi, didapatkan hasil volume asam oksalat semakin kecil. Hal ini menunjukkan bahwa reaksi tersebut berjalan semakin cepat. Karbohidrat merupakan polihidroksi keton atau polihidroksi aldehid. Karbohidrat sangat diperlukan oleh tubuh kita karena karbohidrat merupakan sumber energi utama. Sedangkan untuk mendeteksi protein dilakukan dengan uji biuret NaOH 10% dan CuSO4 0,5% dimana reaksi positifnya ditandai dengan perubahan warna menjadi ungu. Uji biuret digunakan untuk menentukan ada atau tidaknya ikatan peptida dalam suatu protein. Uji presipitasi dengan larutan garam logam berat diketahui jika presipitasi merupakan bagian dari denaturasi protein. Uji sifat fisik menunjukkan jika lemak ada yang berbentuk cair dan padat. Dan pada percobaan kelarutan lemak diketahui bahwa lemak tidak larut dalam air tetapi larut dalam pelarut non-polar. Uji emulsi lemak menunjukkan jika lemak tidak membentuk emulsi ketika dicampurkan dengan air tidak memebentuk emulsi, tetapi ketika dicampurkan dengan air ditambah Na2CO3 dan air ditambah sabun terbentuk emulsi.
melimpahkan Rahmat, taufik, dan hidayah-Nya. Sehingga kami dapat
menyelesaikan Laporan Kimia Dasar ini dengan sebaik-baiknya.
Penulis ucapkan terima kasih kepada Ir. Tri Agus Sartono, M.Si., selaku
Koordinator Praktikum Kimia Dasar, Landung Dwi Cahyono selaku Koordinator
Umum Asisten Praktikum Kimia Dasar, dan Tri Vidyanto selaku asisten
pembimbing yang telah membimbing dan membantu kami selama praktikum
berlangsung sampai penyusunan laporan praktikum Kimia Dasar ini selesai.
Harapan penulis semoga laporan praktikum ini dapat bermanfaat bagi pembaca.
Kami sangat menyadari bahwa Laporan Resmi Kimia Dasar ini masih jauh
dari kesempurnaan, meskipun demikian kami telah berusaha semaksimal mungkin
yang sesuai dengan kemampuan yang kami miliki untuk menyelesaikan laporan
ini. Kami selaku penulis sangat mengharapkan kritik dan saran yang bertujuan
membangun dari berbagai pihak sehingga laporan ini dapat sempurna. Penulis
berharap Laporan Kimia Dasar ini dapat bermanfaat bagi semua pihak yang
bersangkutan.
Semarang, November 2012
1. Hasil Pengamatan Standarisasi NaOH ... 17
2. Hasil Pengamatan Penetapan Kadar Asam Cuka ... 18
3. Hasil Pengamatan Uji Kelarutan ... 19
4. Hasil Pengamatan Uji Fehling ... 20
5. Hasil Pengamatan Uji Benedict ... 21
6. Hasil Pengamatan Uji Asam Pikrat ... 22
7. Hasil Pengamatan Uji Biuret ... 22
8. Hasil Presipitasi dengan Larutan Garam Logam Berat (Putih Telur) ... 23
9. Hasil Presipitasi dengan Larutan Garam Logam Berat (Protein Susu) ... 24
10. Hasil Pengamatan Sifat Fisik, Kekentalan dan Bau ... 25
11. Hasil Pengamatan Uji Kelarutan Lipid (Minyak) ... 26
12. Hasil Pengamatan Uji Kelarutan Lipid (Margarin) ... 27
13. Hasil Pengamatan Uji Kelarutan Lipid (Mentega) ... 28
14. Hasil Pengamatan Pembentukan Emulsi (Minyak) ... 29
15. Hasil Pengamatan Pembentukan Emulsi (Margarin) ... 30
DAFTAR LAMPIRAN
Nomor Halaman
1. Alat-alat Percobaan Analisa Kuantitatif ... 35
2. Perhitungan normalitas NaOH dan kadar asam cuka ... 38
3. Fotocopy Laporan Sementara Praktikum Analisa Kuantitatif ... 39
4. Menjawab Pertanyaan Karbohidrat ... 40
5. Fotocopy Laporan Sementara Praktikum Karbohidrat ... 44
6. Menjawab Pertanyaan Protein ... 45
7. Fotocopy Laporan Sementara Praktikum Protein ... 46
8. Menjawab Pertanyaan Lemak ... 47
Analisa volumetri merupakan suatu analisa kuantitatif yang dilakukan
dengan cara mengukur volume larutan yang kosentrasinya telah diketahui dengan
teliti. Larutan tersebut harus dapat bereaksi secara kuantitatif dengan larutan zat
yang akan diukur dengan volume tertentu. Karbohidrat merupakan sumber kalori
utama bagi makhluk hidup. Karbohidrat disusun oleh unsur-unsur kimia yaitu
karbon (C), hidrogen (H) dan oksigen (O). Karbohidrat memiliki rumus umum
Cn(H2O)m. Protein adalah senyawa organik yang molekulnya sangat besar dan
susunannya sangat kompleks serta merupakan polimer dari alfa asam-asam amino.
Lemak kehidupan sehari-hari mempunyai peranan yang sangat penting dan
membantu bagi pemenuhan kebutuhan tubuh. Lemak merupakan ester antara
gliserol dan asam lemak, dimana ketiga radikal hidroksal dari gliserol semuanya
diesterkan.
Tujuan praktikum analisa kuantitatif adalah untuk mengenal metode analisa
kuantitatif dan menetapkan kadar asam cuka. Tujuan praktikum karbohidrat
adalah untuk mengetahui sifat umum dan sifat khusus dari karbohidrat. Tujuan
praktikum protein adalah untuk mengetahui sifat umum dan sifat khusus dari
protein. Tujuan praktikum lemak adalah untuk mengetahui sifat umum dan sifat
BAB II
TINJAUAN PUSTAKA
2.1. Analisa Kuantitatif
2.1.1. Pengertian Analisa Kuantitatif
Analisa Kuantitatif adalah penetapan berapa banyak jumlah suatu zat dalam
sampel. Larutan baku adalah larutan pereaksi yang digunakan untuk penentuan
volumetri. Larutan yang konsentrasinya telah diketahui secara pasti disebut
dengan larutan standar yang digunakan sebagai larutan penentu dalam
pelaksanaan titrasi. Konsentrasi larutan standar dapat dinyatakan dengan
bermacam cara, yaitu molaritas (M), molalitas (m), persen berat, part per million
(ppm), dan part per billion (ppb) (Fernando dan Ryan, 1997). Biasanya untuk
mengukur volume larutan standar tersebut, larutan standar harus ditambahkan
melalui alat yang disebut Buret. Proses penambahan larutan standar kedalam
ruang yang ditentukan sampai terjadi reaksi yang sempurna disebut titrasi,
menitrasi atau menitri. Karena reaksi harus sempurna, maka saat reaksi sempurna
sudah tercapai disebut saat ekuivalen atau saat stoikiometri yang biasanya dapat
diketahui karena ada sesuatu yang tampak dalam larutan ini, yaitu perubahan
warna atau terjadinya suatu endapan yang disebabkan oleh larutan standarnya itu
sendiri atau karena adanya penambahan suatu larutan penunjuk atau indikator.
Saat dimana proses titrasi harus dihentikan disebut saat akhir titrasi. Diharapkan
tersebut sulit dicapai secara bersamaan. Selisih waktu tersebut menyebabkan salah
titrasi (Keenan et. al., 1990). Selain reaksi harus kuantitatif juga harus berjalan
cepat, sebab bila reaksinya lambat titik ekuivalen sulit diamati. Reaksi dapat
dipercepat dengan pemanasan, pengadukan atau penambahan katalisator (Day dan
Underwood, 2002). Faktor yang menyebabkan ketidaktepatan adalah kurangnya
ketelitian dalam memperhatikan perubahan warna indikator yang terjadi
(Khopkar, 1998).
2.1.2. Macam-macam Analisa Kuantitatif
Teknik laboratorium dalam analisis kuantitatif digolongkan ke dalam
tirimetri (volumetri), grafimetri dan instrumental. Analisa titrimetri berkaitan
dengan pengukuran volume suatu larutan dengan konsentrasi yang telah diketahui
yang diperlukan untuk bereaksi dengan analit. Analisa gravimetri pengukuran
menyangkut pengukuran berat. Istilah analisa instrumental berhubungan dengan
pemakaian peralatan khusus pada langkah pengukuran (Day dan Underwood,
2002). Analisa kuantitatif ada beberapa macam diantaranya volumetri, grafimetri
dan presipitimetri (Keenan et al., 1990).
Volumetri merupakan suatu metode analisa kuantitatif yang dilakukan
dengan cara mengukur volume larutan yang konsentrasinya telah diketahui
dengan teliti, lalu mereaksikannya telah diketahui dengan larutan yang akan
ditentukan konsentrsainya (Keenan et al. , 1990).
Reaksi dalam volumetri:
HCl+NaOH NaCl+H2O
2. Reaksi pengendapan dan atau pembentukan senyawa kompleks:
AgNO3+NaCl AgCl+NaNO3
3. Reaksi reduksi-oksidasi ( redoks )
2FeCl3+SnCl2 2FeCl+SnCl4
Analisis kuantitatif terdiri dari 5 tahapan, yaitu pengambilan sampel, melarutkan
sampel, mengubah analit menjadi bentuk yang dapat diukur, pengukuran,
perhitungan dan penafsiran pengukuran (Day dan Underwood, 2002).
Gravimetri adalah suatu teknik pengukuran kadar dalam suatu larutan
yang biasa berupa garam-garam klorida. Salah satu cara dalam pengukuran
gravimetri yaitu dengan cara evaluasi, yaitu bahan direaksikan sehingga timbul
suatu gas. Caranya yaitu dengan memasang bahan atau mereaksikan dengan suatu
pereaksi sehingga yang dicari adalah banyaknya gas (Keenan et. al, 1990).
Presipitrimetri yaitu titrasi dimana terbentuk endapan. Semakin kecil kelarutan
endapan, semakin sempurna reaksinya. Titrasi presipitrimetri yang menyangkut
larutan perak disebut argentometri (Day dan Underwood, 2002). Titik akhir titrasi
ditetapkan dengan bantuan perubahan warna indikator asam basa yang sesuai.
(Oxtoby et al., 2008)
2.2. Karbohidrat
2.2.1. Pengertian Karbohidrat
Karbohidrat merupakan senyawa karbon, hidrogen dan oksigen yang
molekul glukosa ialah C6H12O6 (enam kali CH2O). Tahun 1880-an disadari bahwa
gagasan hidrat dari karbon merupakan gagasan yang salah dan karbohidrat
sebenarnya adalah polihidroksi aldehid dan keton atau turunan mereka (Fessenden
dan Fessenden, 1986). Banyak karbohidrat yang merupakan polimer yang
tersusun dari molekul gula yang terangkai menjadi rantai yang panjang serta
bercabang-cabang. Karbohidrat merupakan bahan makanan penting dan sumber
tenaga yang terdapat dalam tumbuhan dan daging hewan. Selain itu, karbohidrat
juga menjadi komponen struktur penting pada makhluk hidup dalam serat (fiber),
seperti selulosa, pektin serta lignin (William et al. , 1994). Karbohidrat berasal
dari kata karbo yang artinya unsur karbon dan hidrat yang artinya air (H2O)
dengan rumus kimia CH2O. Secara eksperimen dapat dibuktikan bahwa rasio C :
H : O adalah 1 : 2 : 1. Jadi rumus kimia karbohidrat lebih diyakini kebenarannya
sekitar tahun 1880-an. Akan tetapi sampai saat ini belum dapat dibuktikan secara
kimiawi bahwa unsur C dapat mengikat molekul H2O. Biomolekul karbohidrat
adalah suatu makromolekul senyawa organic dengan BM beberapa ribu sampai
500.000. Akromolekul senyawa organic tersebut berkerangka rantai hidrokarbon
(Hawab, 2003).
2.2.2. Klasifikasi Karbohidrat
Senyawa-senyawa yang termasuk karbohidrat mempunyai molekul yang
berbeda ukurannya dan digolongkan menjadi 3 golongan. Monosakarida adalah
karbohidrat yang strukturnya paling sederhana, mereka tidak dapat dihidrolisis
senyawa yang dibentuk sebagai kondensasi antara monosakarida dan gugus
hidroksi dari senyawa kedua yang biasa atau bukan monosakarida lain. Ikatan
oligosakarida merupakan hubungan asetat, dihasilkan dari reaksi antar gugus
hemiasetat dan gugus OH lainnya (Lehninger, 1982). Hemiasetat adalah glukosa,
senyawa yang dihasilkan adalah glukosida, bila galaktosa senyawa yang
dihasilkan adalah galaktosida. Disakarida adalah dua monosakarida yang
dihubungkan ikatan glikolisis anumerik karbon pada salah satu unit monosakarida
yaitu maltosa, laktosa, dan sukrosa (Fessenden dan Fessenden, 1986).
Polisakarida adalah karbohidrat yang membentuk banyak molekul
monosakarida dengan hidrolisis. Mempunyai molekul besar dan kompleks.
Berwarna putih dan tidak berbentuk kristal, tidak mempunyai rasa manis dan tidak
mempunyai sifat mereduksi. Tiga polisakarida yang umum adalah starch,
glikogen, dan selulosa (Hart et al., 2003). Pereaksi fehling jika ditambah
karbohidrat pereduksi kemudian di panaskan akan terjadi perubahan warna dari
biru menjadi hijau, dari hijau menjadi kuning, dan dari kuning menjadi
kemerah-merahan (Sumardjo, 1998). Semua monosakarida dan disakarida merupakan gula
pereduksi terhadap Fehling (Hawab, 2003).
2.3. Protein
2.3.1. Pengertian Protein
Protein adalah senyawa organik yang mempunyai molekul yang sangat
besar dan susunannya sangat kompleks serta merupakan polimer dari alfa
membentuk garam dengan asam atau basa. Denaturasi adalah proses perubahan
konfigurasi tiga dimensi dari molekul tanpa menyebabkan adanya pemecahan
ikatan peptida yang terdapat antara asam- asam amino. Penyebab terjadinya
denaturasi protein ialah panas dan radiasi ultraviolet, asam dan basa kuat serta
garam-garam dari logam berat (Martoharsono, 2006). Asam amino dapat
dibedakan menjadi asam amino essensial dan asam amino non essensial. Asam
amino essensial adalah asam amino yang tidak dapat disintesis dalam tubuh.
Sedangkan asam amino non essensial adalah asam amino yang dapat disintesis
dalam tubuh, sehingga tidak harus displai dari makanan (Sumardjo, 1998).
2.3.2. Klasifikasi Protein
Berdasarkan bentuk molekulnya protein dibedakan atas dua golongan,
yaitu protein globular, bentuk bulat, mempunyai bentuk kristal, larut dalam
larutan garam,asam,basa atau alkohol sebagai contoh albumin atau globulin.
Protein fibrosa, bentuk amorphous dan bentuk molekul sukar ditentukan, tidak
larut dalam larutan garam, asam, basa, dan alkohol sebagai contoh keratin dan
rambut. Endapan protein yang tidak dapat diubah lagi disebut denaturasi,
disebabkan oleh panas, asam atau basa kuat, pH yang ekstrim dan logam berat
(Riawan, 1990). Berdasarkan tingkat degradasi, protein dibagi menjadi protein
alam protein yang asli berasal dari alam baik dari hewan maupun
tumbuh-tumbuhan. Protein hewani adalah protein yang sempurna karena mengandung
jenis asam amino essensial. Protein nabati adalah protein yang kurang sempurna
adalah protein sederhana dan majemuk. Protein derivat telah mengalami
perubahan, tetapi belum sampai ke asam amino. Perubahan terjadi karena karena
pengaruh hidrolisa menjadi asam amino tidak berjalan spontan tapi bertingkat
(Sumardjo, 1998). Timbulnya warna biru menunjukkan adanya pati, sedangkan
warna merah adanya Glikogen atau etinodekstrim (Winarno, 1991).
2.4. Lemak
2.4.1. Pengertian lemak
Lemak adalah ester yang terbentuk dari gliserol dengan asam lemak,
dimana ketiga gugus hidroksilnya dieterkan. Lemak dapat didefinisikan sebagai
senyawa organik yang terdapat dalam alam serta tak larut dalam air, tetapi larut
dalam pelarut organik non polar (Fessenden dan Fessenden, 1986). Lemak
merupakan komponen penting di setiap sel, yang terdiri dari unsur C, H, dan O.
Lemak bisa berasal dari oksidasi lemak tak jenuh (Martoharsono, 2006). Emulsi
hanya terjadi pada medium-medium tertentu saja ( Hawab, 2003). Emulsi terjadi
pada medium cair seperti air (Sumardjo. 1998).
2.4.2. Klasifikasi lemak
Lemak dibedakan menjadi asam lemak jenuh dan tidak jenuh. Asam lemak
jenuh adalah asam lemak yang tidak mempunyai ikatan rangkap dua dalam
struktur kimianya yang pada umumnya merupakan unit penyusun dari lemak yang
terdapat pada hewan atau manusia. Daya larutnya dalam air akan semakin
lemak jenuh adalah asam laurat, asam miristat, asam palmitat, asam stearat, asam
arakhidat, dan asam lignoserat (Hawab, 2003). Asam lemak tak jenuh adalah asam
lemak yang memiliki dua ikatan rangkap dalam strukturnya. Berwujud cair dalam
suhu kamar, yaitu minyak. Contohnya adalah asam palmitoleat, asam oleat, dan
asam linoleat, asam linolenat, dan asam arakhidonat. Lemak nabati merupakan zat
cair, karena pada umumnya mengandung satu atau lebih asam lemak tak jenuh
BAB III
MATERI DAN METODE
Praktikum Kimia Dasar dengan materi Analisa Kuantitatif dan Karbohidrat
dilaksanakan pada hari Sabtu, tanggal 20 Oktober 2012 pukul 09.45-11.45 WIB
sedangkan materi Protein dan Lemak dilaksanakan pada hari Sabtu, tanggal 10
November 2012 pukul 09.45-11.45 WIB di Laboratorium Fisiologi dan Biokimia
Ternak Fakultas Peternakan dan Pertanian Universitas Diponegoro, Semarang.
3.1. Materi
Peralatan yang digunakan pada praktikum analisa kuantitatif antara lain
buret yaitu tempat untuk mentitrasi larutan NaOH dan asam cuka, labu ukur 250
ml sebagai tempat pengencer asam cuka dan labu ukur 100 ml sebagai tempat
pengencer larutan asam oksalat, erlenmeyer sebagai tempat pencampuran asam
cuka yang diencerkan dan tiga tetes indikator fenolftalein, sedang erlenmeyer lain
digunakan sebagai tempat NaOH yang telah ditetesi tiga tetes indikator
fenolftalein, penjepit atau statif sebagai tempat memasang tabung buret, pipet
untuk mengambil larutan NaOH dan fenolftalein, dan alat tulis untuk mencatat
hasil pengamatan. Bahan yang digunakan dalam praktikum ini antara lain
indikator fenolftalein, larutan NaOH 0,1 N, larutan asam oksalat 0,1 N, larutan
asam cuka Suka Sari dan aquades.
Alat yang digunakan pada praktikum karbohidrat antara lain tabung reaksi
untuk mengambil larutan, penjepit untuk menjepit tabung reaksi, bunsen untuk
memanaskan tabung reaksi yang berisi bahan, rak tabung sebagai tempat
meletakkan tabung reaksi, gelas beker 250 ml untuk tempat suatu larutan. Bahan
yang digunakan dalam praktikum ini yaitu glukosa, laktosa, maltosa, fruktosa,
madu, sirup, fehling A, fehling B, asam pikrat, sodium karbonat dan pereaksi
benedict.
Materi yang digunakan dalam praktikum protein yaitu meliputi alat dan
bahan. Alat yang dipergunakan dalam praktikum protein adalah tabung reaksi
yang berfungsi untuk meletakkan sampel yang akan diuji dan pipet tetes untuk
mengambil larutan yang akan diuji. Bahan yang digunakan dalam praktikum
protein yaitu telur, susu, NaOH 10%, CuSO4 0,5%, FeCl3 dan HgCl2.
Materi yang digunakan dalam praktikum lemak meliputi alat dan bahan
yang digunakan. Alat yang digunakan dalam praktikun ini yaitu tabung reaksi
yang berfungsi untuk meletakkan sampel yang akan diuji. Bahan yang digunakan
dalam praktikum ini yaitu minyak kelapa, mentega, margarin, lemak (gajih), air
(aquades), alkohol, eter dan Na2CO3.
3.2. Metode
3.2.1. Standarisasi NaOH dengan Larutan Asam Oksalat Standar
Metode yang digunakan dalam praktikum analisa kuantitatif yaitu
menentukan Standarisasi NaOH dengan larutan asam oksalat yaitu menimbang
dengan tepat 0,63 asam oksalat kemudian melarutkan asam oksalat tersebut
Mengisikan larutan asam oksalat ke dalam buret , kemudian memasukkan 10 ml
NaOH dan menambahkan aquades hingga volumenya 100 ml ke dalam
erlenmeyer. Kemudian menambahkan tiga tetes indikator fenolftalein. Setelah itu,
menitrasi larutan tersebut dengan asam oksalat standart sampai warna merah
indikator tepat hilang dan mencatat volume asam oksalat yang diperlukan.
Melakukan titrasi tersebut sebanyak dua kali dan menghitung konsentrasi NaOH.
3.2.2. Penetapan Kadar Asam Cuka
Metode yang dilakukan dalam praktikum analisa kuantitatif uji penetapan
kadar asam cuka yaitu mengisikan larutan NaOH yang telah diketahui
konsentrasinya ke dalam buret, kemudian mengambil 10 ml asam cuka dan
mengencerkan menjadi 250 ml dengan labu takar. Mengambil 10 ml asam cuka
yang telah diencerkan dan memasukkan ke dalam erlenmeyer, dan menambahkan
tiga tetes indikator fenolftalein. Menitrasi larutan tersebut dengan larutan NaOH
sampai timbul warna merah muda yang tetap. Mengulangi langkah tersebut
sebanyak dua kali untuk erlenmeyer yang lain serta mencatat volume NaOH yang
diperlukan dan menghitung kadar asam cuka.
3.2.3. Uji Kelarutan
Metode yang dilakukan dalam uji kelarutan karbohidrat yaitu menyiapkan
lima tabung reaksi, kemudian memasukkan secara berturutan glukosa, fruktosa,
laktosa, maltosa, dan madu ke dalam tabung tersebut. Mengamati dan dicatat
warna dari bentuk fisik karbohidrat itu. Berikutnya menambahkan10 tetes aquades
ke setiap tabung reaksi, tabung ditutup dengan ibu jari lalu digojog dengan baik.
Yang terakhir adalah mengamati larutan tersebut dan mencatatnya dalam lembar
pengamatan.
3.2.4. Uji Fehling
Metode yang dilakukan dalam uji fehling yaitu menyiapkan lima tabung
reaksi, berturut – turut diisi 10 tetes larutan laktosa, glukosa, fruktosa, madu dan
sirup yang mempunyai konsentrasi 2%. Kemudian mengisi masing-masing tabung
dengan 10 tetes fehling A dan fehling B, selanjutmya menggojog dengan baik.
Panaskan di atas lampu bunsen selama 10 menit, kemudian mengamati dan
mencatat perubahan yang terjadi dalam lembar pengamatan. Hasil positif jika
terbentuk endapan merah bata.
3.2.5. Uji Benedict
Metode yang dilakukan dalam uji Benedict yaitu menyiapkan 5 tabung
reaksi lalu memasukkan berturut-turut larutan glukosa, laktosa, fruktosa, maltota
dan madu kedalam masing-masing tabung yang berbeda. Menambahkan 10 tetes
larutan pereaksi benedict lalu menutup tabung dengan ibu jari kemudian
menggojog dengan baik. Memanaskan tabung reaksi dengan bunsen hingga
larutan didalamnya mengalami perubahan warna. Mengati dan mencatat hasil
pengamatan pada lembar pengamatan. Hasil positif jika terbentuk endapan merah
3.2.6. Uji Asam Pikrat
Metode pada uji asam pikrat yaitu memasukkan 10 tetes glukosa 2% ke
dalam tabung reaksi. Kemudian menambahkan larutan Asam Pikrat jenuh dan
sodium karbonat. Memanaskan beberapa saat larutan tersebut dan mengamati
perubahan warna yang terjadi. Reaksi akan positif apabila terbentuk warna merah.
Selanjunya mengulangi pengujian ini terhadap larutan fruktosa, laktosa dan
maltosa.
3.2.7. UjiBiuret
Metode yang dilakukan dalam praktikum protein Uji Biuret yaitu
mencanpurkan 10 tetes albumin telur dengan 10 tetes NaOH 10% dalam tabung
reaksi. Menambahkan dengan tepat 10 tetes larutan CuSO4 0,5% dan mengaduk
dengan sempurna. Mengamati dan mencatat hasil pengamatan dalam lembar
pengamatan. Reaksi positif jika berbentuk warna merah muda atau ungu.
Mengulagi langkah tersebut pada sampel susu murni.
3.2.8. Uji Presipitasi dengan Larutan Garam Logam Berat
Metode yang dikakuan dalam praktikum proteim uji presipitasi dengan
larutan garam logam berat yaitu menyediakan tiga tabung reaksi yang bersih, dan
mengisi masing-masing dengan 10 tetes larutan putih telur encer. Menambahkan
10 tetes larutan FeCL3 pada tabung pertama, 10 tetes CuSO4 pada tabung kedua
endapan yang terbentuk serta mencatat pada lembar pengamatan. Mengulangi
langkah kerja dengan menggunakan larutan protein susu murni.
3.2.9. Uji Sifat Fisik, Kekentalan dan Bau
Metode yang dilakukan dalam praktim lemak Uji Sifat Fisik yaitu
mengamati sifat fisik, kekentalan dan bau lemak dari asam lemak yaitu minyak
kelapa dan lemak (gajih).
3.2.10.Uji Kelarutan
Metode yang dilakukan dalam uji kelarutan lemak yaitu menyediakan lima
tabung reaksi, mengisi tabung pertama dengan 10 tetes air, tabung kedua dengan
10 tetes Na2CO3, tabung ketiga dengan 10 tetes alkohol, tabung keempat dengan
10 tetes eter, dan tabung kelima dengan 10 tetes CHCl3. Menambahkan
masing-masing dengan minyak kelapa sebanyak 10 tetes. Menggojog sampai homogen
dalam beberapa menit. Mengamati perubahan yang terjadi. Lakukan langkah
tersebut dengan menggunakan margarin dan mentega.
3.2.11.Uji Emulsi
Metode yang dilakukan dalam uji emulsi lemak yaitu menyediakan tiga
tabung reaksi, mengisi tabung pertama dengan 10 tetes air dan 1 tetes minyak
kelapa, tabung kedua dengan 10 tetes air tambah 1 tetes minyak kelapa, dan 1
tetes Na2CO3, dan tabung ketiga dengan 10 tetes air tambah 1 tetes minyak kelapa
menit. Mengamati terbentuknya emulsi yang terjadi. Lakukan langkah tersebut
dengan menggunakan margarin dan mentega.
4.1. Analisa Kuantitatif
4.1.1. Standarisasi NaOH dengan Larutan Asam Oksalat Standar
Hasil praktikum Pengenalan Analisa Kuantitatif diperoleh data sebagai
berikut :
Tabel 1. Hasil Pengamatan Standarisasi NaOH
Titrasi Volume asam oksalat (ml)
Titrasi I 1,6
Titrasi II 0,8
Rata-rata 1,2
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan praktikum standarisasi NaOH dengan larutan asam oksalat
yang telah dilakukan, dioeroleh normalitas NaOH sebesar 0,12 N. Standarisasi
dengan larutan standar asam oksalat adalah melakukan titrasi dengan
menggunakan larutan asam oksalat sebagai larutan standarnya yang
konsentrasinya sudah diketahui dengan sangat teliti. Larutan yang akan dititrasi
adalah larutan basa NaOH, sehingga apabila ditambah larutan asam menjadi
netral. Saat ditambahkan larutan indikator fenolftalein (PP) larutan berubah warna
menjadi merah muda. Setelah dititrasi warna merah muda pada laruran NaOH
berangsur-angsur menghilang, saat itulah terjadi titik akhir titrasi. Saat mengamati
perubahan warna pada indikator harus dilakukan dengan teliti, karena dapat
pendapat Day dan Underwood (2002) yang menyatakan bahwa titik akhit titrasi
ditetapkan dengan bantuan warna indikator asam basa yang sesuia. Metode yang
dilakukan dengan cara mengukur voleme larutan yang konsentrasinya sudah
diketahui dengan teliti, lalu mereaksikannya dengan dengan larutan yang akan
dicari berapa besar konsentrasinya. Faktor yang menyebabkan ketidak tepatan
pada hasil pengamatan adalah lambatnya reaksi yang terjadi. Khopkar (2003)
menambahkan bahwa faktor yang menyebabkan ketidaktepatan adalah kurangnya
ketelitian dalam memperhatikan perubahan warna indikator yang terjadi.
4.1.2 Penetapan Kadar Asam Cuka
Hasil praktikum Pengenalan Analisa Kuantitatif diperoleh data sebagai
berikut :
Tabel 2. Hasil Pengamatan Pengukuran Kadar Asam Cuka
Titrasi Volume NaOH (ml)
Titrasi I 20
Titrasi II 18
Rata-rata 19
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan praktikum pengukuran kadar asam cuka yang telah telah
dilakukan dapat diketahui bahwa kadar asam cuka yang didapatkan sebesar
13,68%. Metode yang dilakukan untuk menetapkan kadar asam cuka merupakan
metode volumetri. Titik akhir yang terjadi dalam metode ini ditandai dengan
perubahan warna larutan asam cuka dari bening menjadi merah keunguan ketika
ditambah dengan indikator Phenolphtalein dan dititrasi dengan larutan NaOH
menghasilkan garam yang bersifat basa, sehingga indikator fenolftalein
memberikan warna merah keunguan pada titikakhir titrasi. Hal ini sesuai dengan
pendapat Khopkar (2003) yang mentakan bahwa analisa volumetri atau disebut
juga analisa titrimetri yaitu dimana zat yang akan dianalisis dititrasi dengan zat
lain yang konsentrasi telah diketahui dan dialirkan dari buret dalam bentuk larutan
konsentrasi. Selama proses reaksinya berlangsung, erlenmeyer harus terus
digoyang-goyang agar antara titran dan analit reaksinya berlangsung cepat dan
larutan cepat tercampur. Oxtoby et al. (1999) menambahkan bahwa titik akhir
titrasi ditetapkan dengan bantuan perubahan warna indikator asam basa yang
sesuai.
4.2. Karbohidrat
4.2.1. Uji Kelarutan
Berdasarkan hasil praktikum Uji Kelarutan Karbohidrat diperoleh data
sebagai berikut :
Tabel 3. Hasil Pengamatan Uji Kelarutan
Sampel Warna Bentuk Keterangan
Glukosa Bening Cair Larut
Fruktosa Bening Cair Larut
Laktosa Agak keruh Cair Larut
Maltosa Bening Cair Larut
Sukrosa Bening Cair Larut
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan praktikum di atas di dapatkan hasil bahwa larutan Glukosa
dan tidak mengendap ketika di uji dengan melarutkannya pada aquades. Hal ini
sesuai dengan pendapat Hart et al. (2003) yang menyatakan bahwa monosakarida
dapat larut dalam air. Larutan karbohidrat yang di ujikan seperti glukosa, fruktosa,
laktosa, maltosa, dan sukrosa larut dalam air,karena memiliki gugus -OH yang
bebas sehingga karbohidrat mudah larut dalam air. Hal ini ditambahkan oleh
Fessenden dan Fessenden (1986) yang menyatakan bahwa larutan Karbohidrat
memiliki sifat mudah larut dalam air.
4.2.2. Uji Fehling
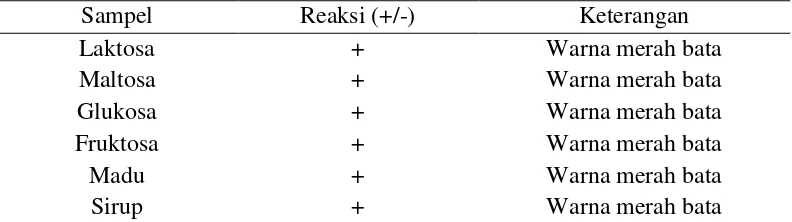
Berdasarkan hasil praktikum Uji Fehling diperoleh data sebagai berikut :
Tabel 4. Hasil Pengamatan Uji Fehling
Sampel Reaksi (+/-) Keterangan
Laktosa + Warna merah bata
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan hasil praktikum sampel apabila ditambah dengan fehling A
dan fehling B akan terjadi perubahan warna saat dipanaskan. Hal ini sesuai
dengan pendapat Hawab (2003) yang menyatakan bahwa semua monosakarida
dan disakarida merupakan gula pereduksi terhadap Fehling. Sedangkan pada
Glukosa, Fruktosa, Madu, dan sirup 2% mengalami pengendapan dan perubahan
warna menjadi merah bata. Hal ini ditambahkan oleh Sumardjo (1998) yang
menyatakan bahwa pereaksi fehling ditambah karbohidrat pereduksi kemudian di
panaskan akan terjadi perubahan warna dari biru menjadi hijau, dari hijau menjadi
kuning, dan dari kuning menjadi kemerah-merahan.
4.2.3. Uji Benedict
Berdasarkan hasil praktikum Uji Kelarutan Karbohidrat diperoleh data
sebagai berikut :
Tabel 5. Hasil Pengamatan Uji Benedict
Sampel Reaksi (+/-) Keterangan
Glukosa 2% + Endapan warna merah bata
Fruktosa + Endapan warna merah bata
Maltosa + Endapan warna merah bata
Laktosa + Endapan warna merah bata
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan hasil praktikum sampel glukosa 2%, fruktosa, maltosa, dan
laktosa bereaksi positif dengan pereaksi benedict dan mengalami perubahan yaitu
terdapat endapan berwarna merah bata. Hal ini sesuai dengan pendapat Sumardjo
(1998) yang menyatakan bahwa modifikasi pereaksi fehling adalah pereaksi
Benedict yang merupakan campuran dari Kupri Sulfat, Natrium Sitrat, dan
Natrium Karbonat dalam air, pemanasan karbohidrat pereduksi dengan pereaksi
benedict akan terjadi perubahan warna dari biru menjadi hijau, hijau menjadi
kuning, dan kuning menjadi kemerah-merahan dan akhirnya terbentuk endapan
merah bata kupro oksida apabila konsentrasi karbohidrat cukup tinggi. Hal ini
ditambahkan oleh Fressenden dan Fessenden (1986) yang menyatakan bahwa
4.2.4. Uji Asam Pikrat
Berdasarkan haasil praktikum Uji Asam Pikrat diperoleh data sebagai
berikut :
Tabel 6. Hasil Pengamatan Uji Asam Pikrat
Sampel Reaksi (+/-) Keterangan
Glukosa 2% + Kuning menjadi merah tua
Fruktosa + Kuning menjadi merah tua
Maltosa + Kuning menjadi merah tua
Laktosa + Kuning menjadi merah tua
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan hasil praktikum sampel glukosa 2%, fruktosa, maltosa, dan
laktosa bereaksi positif terhadap pereaksi asam pikrat sehingga terbentuk warna
merah tua. Hal ini sesuai dengan pendapat Sumardjo (1998) yang menyatakan
bahwa reaksi yang terjadi dalam uji ini adalah oksidasi karbohidrat pereaksi
menjadi asam pikrat dan reduksi asam pikrat yang berwarna kuning menjadi
merah tua. Hal ini ditambahkan oleh Winarno (1997) yang menyatakan bahwa
timbulnya warna biru menunjukkan adanya pati, sedangkan warna merah adanya
Glikogen atau etinodekstrim.
4.2. Protein
4.3.1. Uji Biuret
Berdasarkan hasil praktikum Uji Biuret dapat diperoleh data sebagai
berikut:
Tabel 7. Hasil Pengamatan Uji Biuret
Sampel Reaksi (+/-) Keterangan
Putih telur + Terjadi perubahan warna ungu
Susu + Terjadi perubahan warna ungu
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Hasil praktikum Uji Biuret pada larutan putih telur menunjukkan positif
karena terjadi perubahan warna ungu. Hal ini sesuai dengan pendapat Bintang
(2010) yang menyatakan bahwa warna kompleks ungu menunjukkan adanya
protein. Intensitas warna yang dihasilkan merupakan ukuran jumlah ikatan peptida
yang ada dalam protein. Reaksi ini positif terhadap dua buah ikatan peptida atau
lebih (polipeptida), tetapi negatif untuk asam amino bebas atau satu ikatan
peptida. Martoharsono (2006) menambahkan bahwa asam amino yang satu
dengan yang lainnya ikat mengikat melalui peptida, maka protein juga dinamakan
4.3.2. Presipitasi dengan Larutan Garam Logam Berat (Putih Telur)
Berdasarkan hasil praktikum uji presipitasi dengan larutan garam logam
berat dapat diperoleh data sebagai berikut :
Tabel 8. Hasil Uji Presipitasi dengan Larutan Garam Logam Berat (Putih Telur)
Reagen Reaksi(+/-) Keterangan
FeCl3 + Terbentuk endapan warna orange
CuSO4 + Terbentuk endapan warna biru
HgCl2 + Terbentuk endapan warna putih
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Hasil praktikum uji presipitasi dengan larutan garam logam berat pada
larutan putih telur dengan meneteskan larutan FeCl3 pada tabung pertama, larutan
CuSO4 pada tabung kedua, larutan HgCl2 pada tabung ketiga menunjukkan positif
karena terjadi endapan warna orange pada larutan FeCl3, endapan warna Biru pada
larutan CuSO4 dan endapan warna putih pada larutan HgCl2. Adanya
endapan-endapan yang terbentuk pada larutan tersebut membuktikan bahwa telur positif
mengandung protein. Hal ini sesuai dengan pendapat Sumardjo (1998) bahwa
garam-garam logam berat pada kadar tertentu adalah toksil untuk tubuh apabila
masuk ke dalam tubuh antara lain dapat menggumpalkan atau merusak protein
tubuh yang dikenalnya. Martoharsono (2006) menambahkan bahwa pembentukan
gumpalan putih pada bagian telur yang putih merupakan salah satu contoh proses
denaturasi. Secara umum denaturasi adalah peristiwa penyimpangan dari sifat
alamiah senyawa yang bersangkutan, dalam hal ini adalah protein.
4.3.3. Presipitasi Dengan Larutan Garam Logam Berat (Susu)
Berdasarkan hasil praktikum uji presipitasi dengan larutan garam logam
berat dapat diperoleh data sebagai berikut :
Tabel 9. Hasil Uji Presipitasi dengan Larutan Garam Logam Berat (Susu)
Reagen Reaksi(+/-) Keterangan
FeCl3 + Terbentuk endapan warna kuning
CuSO4 + Terbentuk endapan warna biru
HgCl2 + Terbentukendapan warna putih
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Hasil praktikum uji presipitasi dengan larutan garam logam berat pada
larutan susudengan meneteskan larutan FeCl3 pada tabung pertama, larutan
CuSO4 pada tabung kedua, larutan HgCl2 pada tabung ketiga menunjukkan positif
karena terjadi endapan warna kuning pada larutan FeCl3, endapan warna biru pada
larutan CuSO4 dan endapan warna putih pada larutan HgCl2. Hal ini sesuai dengan
pendapat Sastrohamidjojo (2005) bahwa protein tidak larut di dalam cairan-cairan
organik. Bila dilarutkan dalam air akan memberikan kolodial. Protein diendapkan
atau mengalami “salted out” dari larutannya bila ditambah dengan garam-garam
anorganik (Na2SO4, NaCl) dan juga dengan menggunakan zat-zat organik yang
larut dalam air (alkohol, aseton), pengendapan ini bersifat dapat balik. Sejumlah
zat-zat lainnya, meliputi garam logam berat, asam tannat, asam pikrat dan
pereaksi-pereaksi alkaloid dapat juga mengendapkan protein. Basri (1996)
menambahkan bahwa susu dalam bentuk protein 6% dan dalam bentuk lemak
3-8%. Hasil dari kelenjar putih, berupa emulsi putih, mengandung air, protein,
4.3. Lemak
4.3.1. Sifat Fisik, Kekentalan dan Bau
Berdasarkan praktikum yang telah dilaksanakan didapatkan data sebagai
berikut :
Tabel 10. Hasil Pengamatan Uji Sifat Fisik, Kekentalan dan Bau
Sampel Kekentalan Bau Sifat Fisik
Minyak kelapa Emulsi Biasa Berbentuk larutan
Lemak (gajeh) Agak padat Menyengat Kenyal
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan percobaan ini minyak kelapa kental,mempunyai bau yang
biasa dan cair, pada lemak (gajeh) sangat kental, khas dan padat. Kekentalan yang
ada menyebabkan bentuk pada lemak gajeh yaitu padat. Bentuk padat tersebut
dapat diakibatkan karena adanya hidrolis yang dibiarkan terlalu lama dan akan
menghasilkan asam lemak bebas. Disamping itu dapat juga terjadi oksidasi
terhadap asam lemak tak jenuh yang akan menghasilkan bau dan rasa yang tidak
enak, seperti halnya bau yang dihasilkan dari lemak (gajeh). Hal ini sesuai dengan
pendapat Kimball (1992) yang menyatakan bahwa lemak ada yang bersifat padat
dan ada yang bersifat cair. Lemak berbentuk padat, berbau amis, dan berwarna
putih pucat. Hal ini ditambahkan oleh Soemardjo (1998) yang menyatakan bahwa
lemak adalah senyawa ester antara gliserol dan asam lemak yang bersifat padat
dan cair.
4.3.2. Uji Kelarutan Minyak Kelapa
Berdasarkan praktikum yang telah dilakukan dari percobaan uji kelarutan
minyak kelapa didapatkan data sebagai berikut :
Tabel 11. Hasil Pengamatan Uji Kelarutan Minyak Kelapa
Sampel Kekentalan Bau Sifat Fisik Kelarutan
Air Agak kental Tidak berbau Putih, Cair Tidak larut
Na2CO2 Kental Tidak berbau Putih Tidak larut
Alkohol Kental Khas Putih, Cair Tidak larut
Eter Tidak kental Khas Khas, Cair Larut
Kloroform Tidak kental Khas Khas, Cair Larut
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan hasil praktikum pada uji kelarutan minyak kelapa
memperlihatkan bahwa minyak kelapa larut pada sampel Na2CO2, eter, dan
kloroform ditandai dengan hasilnya yang tidak kental, kecuali Na2CO2. Bau dari
minyak kelapa adalah khas. Lemak dapat mengalami proses hidrolisasi menjadi
komponen-komponen penyusunnya, yaitu gliserol dan asam lemak. Hidrolisis
dapat berlangsung baik dengan katalis enzim lipase, oksidasi ataupun basa.
Katalis-katalis yang akan kita gunakan tergantung pada kebutuhan. Hal ini sesuai
dengan pendapat Winarno (1991) yang menyatakan bahwa H2O dan NaCO3 0,5%
merupakan pelarut yang tidak dapat dalam minyak, margarin, dan mentega yang
berarti bukan termasuk kelarutan lipid. Hal ini ditambahkan oleh Fessenden dan
Fessenden (1986) yang menyatakan bahwa lemak dapat di definisikan sebagai
senyawa organik yang tidak larut dalam air, tetapi larut dalam pelarut organik
4.3.3. Uji Kelarutan Margarin
Berdasarkan praktikum yang telah dilakukan dari percobaan uji kelarutan
margarin didapatkan data sebagai berikut :
Tabel 12. Hasil Pengamatan Uji Kelarutan Margarin
Sampel Kekentalan Bau Sifat Fisik Kelarutan
Air Tidak kental Tidak berbau Terpisah Tidak larut
Na2CO3 Tidak kental Tidak berbau Kuning pucat Tidak larut
Alkohol Tidak kental Khas Kuning Larut
Eter Tidak kental Khas Kuning Larut
Kloroform Agak kental Khas Kuning kental Larut
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan praktikum pada uji kelarutan lipid menggunakan larutan
margarin yang sudah dipanaskan pada sampel air dan Na2CO3 tidak larut margarin
dengan air terpisah. Margarin dapat larut dengan baik hanya pada air dan alkohol
margarin tidak dapat larut. Hail ini sesuai dengan pendapat Kimball (1983) yang
menyatakan bahwa lemak adalah zat organik yang sangat hidrofobik yang berarti
bahwa zat-zat tersebut sangat sukar atau sama sekali tidak larut dalam air. Hal ini
ditambahkan oleh Hardjono (2005) yang menyatakan bahwa lipid adalah senyawa
organik yang terdapat dalam alam serta tidak larut dalam air tapi larut dalam
pelarut organik non-polar seperti hidrokarbon atau dietil eter.
4.3.4. Uji Kelarutan Mentega
Berdasarkan praktikum yang telah dilakukan dari percobaan uji kelarutan
mentega didapatkan data sebagai berikut :
Tabel 13. Hasil Pengamatan Uji Kelarutan Mentega
Sampel Kekentalan Bau Sifat Fisik Kelarutan
Air Tidak kental Tidak berbau Terpisah Tidak larut
Na2CO3 Agak kental Tidak berbau Terpisah Tidak larut
Alkohol Tidak kental Khas Terpisah Tidak larut
Eter Tidak kental Khas Khas Larut
Kloroform Tidak kental Khas Khas Larut
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan praktikum uji kelarutan lipid dengan menggunakan larutan
mentega pada sampel air, Na2CO3, dan alkohol larut dengan sampel tidak
homogen atau menjadi satu tetapi terpisah. Ketiga sampel itu tidak larut dengan
larutan mentega. Sampel eter dan kloroform berwarna kuning dan larut dengan
mentega. Hampir tidak adanya perbedaan elektronegativitas yang kuat ini berarti
pula, bahwa molekul-molekul lemak pada hakekatnya sama sekali tidak polar.
Inilah sebab mengapa lemak itu sangat hidrofobik dan tidak terasosiasi dengan air
yang molekulnya polar itu. Hal ini sesuai dengan pendapat Kimball (1983) yang
menyatakan bahwa campuran air dengan lemak akan segera memisah menjadi
suatu lapisan minyak yang terapung di atas air. Hal ini ditambahkan oleh
Fressenden dan Fessenden (1986) yang menyatakan bahwa emulsi adalah dispersi
4.3.5. Uji Emulsi Minyak Kelapa
Berdasarkan praktikum yang telah dilakukan dari uji pembentukan emulsi
minyak kelapa didapatkan hasil sebagai berikut :
Tabel 14. Hasil Pengamatan Uji Emulsi Minyak Kelapa
Sampel Kekentalan Bau Sifat Fisik
Air+minyak kelapa Encer Khas Tidak terbentuk emulsi
Air+minyak kelapa+Na2CO3 Kental Khas Terbentuk emulsi
Air+minyak kelapa+air sabun Kental Khas Terbentuk emulsi
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan percobaan yang telah dilakukan didapat data bahwa minyak
kelapa apabila direaksikan dengan air akan membentuk emulsi. Karena
molekul-molekul air mampu memecah molekul-molekul minyak kelapa sehingga susunannya
menjadi rusak . Hal ini sesuai dengan pendapat Sastrohamidjojo (2005) yang
menyatakan bahwa lemak dapat teremulsi jika sistem koloid partikel terdispersi
dalam medium pendispersinya sama-sama dalam bentuk cair. Hal ini ditambahkan
juga oleh Kimball (1983) yang menyatakan bahwa rantai hidrokarbon dari
molekul sabun bersifat hidrofobik ujung dengan gugus karboksi bersifat
hidrofobik.
4.3.6. Uji Emulsi Margarin
Berdasar praktikum yang telah dilakukan dari uji pembentukan emulsi
(margarin) didapatkan hasil sebagai berikut :
Tabel 15. Hasil Pengamatan Uji Emulsi Margarin
Sampel Kekentalan Bau Sifat Fisik
Air+margarin Encer Khas Tidak terbentuk emulsi
Air+margarin+Na2CO3 Kental Khas Terbentuk emulsi
Air+margarin+air sabun Kental Wangi Terbentuk emulsi
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan percobaan yang telah dilakukan, didapat data bahwa margarin
apabila direaksikan dengan air sabun akan membentuk emulsi. Karena
molekul-molekul air sabun mampu memecah molekul-molekul margarin sehingga susunannya
menjadi rusak. Hal ini sesuai dengan pendapat Sumardjo (1998) yang menyatakan
bahwa lemak nabati merupakan zat cair, karena pada umumnya mengandung satu
atau lebih asam lemak tak jenuh mempunyai titik lebur yang lebih rendah dan
lebih mudah larut. Hal ini ditambahkan oleh Winarno (1991) yang menyatakan
4.3.7. Uji Emulsi Mentega
Berdasarkan praktikum yang telah dilakukan dari Uji pembentukan emulsi
(mentega) didapatkan hasil sebagai berikut :
Tabel 16. Hasil Pengamatan Uji Emulsi Mentega
Sampel Kekentalan Bau Sifat Fisik
Air+mentega Encer Khas Tidak terbentuk emulsi
Air+mentega+Na2CO3 Kental Khas Terbentuk emulsi
Air+mentega+air sabun Kental Wangi Terbentuk emulsi
Sumber : Data Primer Praktikum Kimia Dasar, 2012.
Berdasarkan percobaan yang dilakukan, didapat bahwa mentega apabila
direaksikan dengan air sabun akan membentuk emulsi. Molekul-molekul air sabun
mampu memecah molekul mentega sehingga susunannya menjadi rusak. Pelarut
H2O pada pembentukan emulsi jika ditambah minyak kelapa, margarin dan
mentega tidak mengalami emulsi,pelarut H2O ditambah Na2CO3 jika ditambah
minyak kelapa maka akan teremulsi, bila ditambah margarin tidak larut dan jika
ditambah dengan mentega tidak larut, pelarut air sabun jika ditambah mentega
juga akan larut. Hal ini sesuai dengan pendapat Hawab (2003) yang menyatakan
bahwa emulsi hanya terjadi pada medium-medium tertentu saja. Hal ini
ditambahkan oleh Sumardjo (1998) yang menyatakan bahwa emulsi terjadi pada
medium cair seperti air.
5.1 Simpulan
Berdasarkan hasil praktikum kimia dasar percobaan analisa kuantitatif
dapat disimpulkan bahwa keberhasilan suatu titrasi tergantung pada tepat tidaknya
pencampuran larutan dengan PP, pengukuran, volume titrasi serta tepat tidaknya
proses titrasi. Praktikum karbohidrat dapat disimpulkan bahwa pada uji kelarutan
semua sampel larut dalam air, pada uji fehling dan uji benedict semua sampel
bereaksi positif dan berwarna merah bata, dan uji asam pikrat semua sampel
bereaksi positi dan berwarna merah. Praktikum protein dapat di simpulkan bahwa
putih telur bereaksi postif yang ditunjukan dengan warna ungu dan hal ini
menandakan pada putih telur terdapat protein, pada uji presipitasi dengan larutan
garam logam berat semua sampel menunjukkan hasil positif. Praktikum lemak
dapat disimpulkan bahwa pada uji kelarutan lipid minyak kelapa, margarin, dan
mentega berbentuk suspense dan berbau khas, pada uji emulsi semua sampel
teremulsi dengan ditunjukan bintik-bintik kecil.
5.2 Saran
Saran yang dapat penulis sampaikan adalah agar praktikan lebih teliti saat
melakukan percobaan dan dalam melakukan percobaan harus sesuai dengan
prosedur yang seharusnya agar hasil percobaan yang dilakukan memperoleh hasil
DAFTAR PUSTAKA
Basri. 1996. Kamus Kimia. PT Gramedia Pustaka Utama, Jakarta.
Bintang, M. 2010. Biokimia Teknik Penelitian. Gadjah Mada University Press,
Fessenden, R. J dan J. S. Fessenden. 1986. Kimia Organik. Erlangga, Jakarta.
Hart, H., L.E. Craine dan D.J. Hart. 2003. Kimia Organik Suatu Kuliah Singkat. Erlangga, Jakarta.
Hawab,M. 2003. Pengantar Biokimia. Bayu Media Publishing, Bogor.
Keenan, C.W., D.C. Klenfelter dan J.H. Wood. 1990. Ilmu Kimia Untuk Universitas Edisi 6. Erlangga, Jakarta.
Khopkar, S.M. 2003. Konsep Dasar Kimia Analitik. UI Press, Jakarta.
Kimball, J. W. 1992. Kimia Edisi kelima. Erlangga, Jakarta.
Lehninger, A.L. 1982. Dasar-Dasar Biokimia. Erlangga, Jakarta.
Martoharsono, S. 2006. Biokimia. Gajah Mada University Press, Yogyakarta.
Oxtoby, D.W, H.P. Gillis dan A.Campion. 1999. Kimia Modern Edisi 4. Erlangga, Jakarta.
Riawan, S. 1990. IlmuPangan. Erlangga, Jakarta.
Sastrohamidjaja, H. 2005. Kimia Organik. Gajah Mada University Press, Yogyakarta.
Sumardjo, D. 1998. Petunjuk Praktikum Kimia Dasar. Undip Press, Semarang.
William L. M., E.J. Slowinski, dan C.L. Stanitski. 1990. Chemical Principle, Sixth Edition Sounder College Publishing. USA.
Gambar 1. Labu Takar
Fungsi = Untuk mengukur volume larutan
Gambar 2. Erlenmeyer
Fungsi = Sebagai wadah larutan dengan jumlah volume tertentu
Gambar 3. Pipet Volume
Fungsi = untuk mengambil larutan dalam jumlah tertentu.
Gambar 4. Pipet Tetes
Fungsi = untuk mengambil larutan dalam jumlah kecil.
Gambar 5. Buret
Gambar 6. Klem dan Statis
Fungsi = Sebagai pengapit dan tepat meletakkan buret.
Gambar 8. Corong
Fungsi = Untuk mempermudah
memasukkan larutan ke dalam mulut Buret.
Gambar 9. Penjepit
Fungsi = untuk menjepit tabung reaksi ketika dipanaskan.
Ganbar 10. Bunsen
Fungsi = untuk memanaskan tabung reaksi pada saat pengujian.
Gambar 12. Tabung Reaksi
Fungsi = untuk meletakkan sampel yang diuji.
Gambar 13. Rak Tabung
Lampiran 4. Menjawab Pertanyaan Karbohidrat
Pertanyaan Uji Fehling
1. Mengapa ada dua karbohidrat yang gagal terhadap uji Fehling?
Jawab : Karena kedua larutan itu (fruktosa dan kanji) bukan merupakan
monosakarida. Padahal larutan Fehling merupakan pereaksi peroksidasi
yang digunakan untuk uji monosakarida.
2. Apakah madu menghasilkan uji Fehling yang positif?
Jawab : Tidak, karena madu warnanya tidak berubah jadi merah bata.
3. Tuliskan nama struktur karbohidrat yang menyebabkan uji ini positif!
Jawab :
4. Apakah sirup yang Saudara uji positif terhadap uji Fehling?
Pertanyaan Uji Benedict
1. Tuliskan reaksi untuk pengujian larutan maltosa dan laktosa!
Jawab :
Maltosa =
Laktosa =
2. Apakah penyusun pereaksi Benedict?
Jawab : Cu2+ dan H2O
3. Kesimpulan apa yang dapat saudara ambil dari percobaan di atas?
Jawab : Larutan Benedict mengandung unsur Cu (tembaga), hal ini dapat
diidentifikasi dengan adanya endapan berwarna merah bata pada larutan
yang diujikan. Endapan itu merupakan zat sisa dari sebuah reaksi.
Endapan akan terbentuk apabila kedua senyawa yang direaksikan memiliki
keterkaitan antar molekul lewat gugus fungsionalnya.
4. Apakah yang terjadi baik glokosa yang banyak dan yang sedikit pereaksi
Benedict dipanaskan?
Jawab : Tetap akan terbentuk endapan berwarna merah bata, hanya saja
tingkat kepekatan pereaksi yang lebih banyak itu lebih tinggi dan laju
Pertanyaan Uji Asam Pikrat
1. Tuliskan masing-masing reaksi untuk pengujian di atas!
Jawab :
a.
(Glukosa) (Asam Pikrat) (Asam Glukorat) (Asam Pikronat)
b.
(Fruktosa) (Asam Pikrat) (Asam Fruktonat) (Asam Pikront)
2. Kesimpulan apa yang dapat saudara ambil dari percobaan ini?
Jawab : Karbohidrat apabila ditambahkan asam pikrat akan berubah warna
Lampiran 6. Menjawab Pertanyaa Protein
Pertanyaan Uji Biuret
1. Tuliskan struktur kimia yang memberi hasil terhadap uji Biuret?
Jawab:
O CuSO4 O
Protein – CH – C – OH + NaO Protein – CH – C – Na + H2O
NH2 NH2
Pertanyaan presipitasi dengan Larutan Logam Berat
1. Bersifat sebagai pakah protein dan logam-logam berat dalam reaksi ini?
Jawab: Sebagai pereaksi
2. Apakah warna masing endapan yang terbentuk, dan tulis
masing-masing reaksi?
Jawab: Larutan putih telur + FeCl3 terbentuk endapan berwarna oranye
Larutan putih telur + CuSO4 terbentuk endapan berwarna biru muda
Larutan putih telur + HgCl terbentuk endapan berwarna putih
Larutan protein susu segar + FeCl3 terbentuk endapan kuning
Larutan protein susu segar + CuSO4 erbentuk endapan biru muda
Larutan protein susu segar + HgCl terbentuk endapan putih
Lampiran 7. Fotocopy Laporan Sementara Praktikum Protein
Lampiran 8. Menjawab Pertanyaan Lemak
1. Senyawa manakah yang merupakan steroid murni?
2. Senyawa manakah yang mempunyai bau paling enak?
Jawab:
1. Lemak(gajeh) dan Minyak kelapa
2. Susu sapi segar, Margarin, dan Mentega.