I. PENDAHULUAN
A. Judul Percobaan
1. Pembuatan Larutan Standar
B. Tujuan
II. METODE
1. Standarisasi Larutan AgNO3 dengan NaCl
Sebanyak 25 ml larutan NaCl diukur dengan gelas ukur, dan dimasukkan ke dalam Erlenmeyer. Lalu larutan K2CrO4 0,003 M
ditambahkan sebanyak 1 ml. Kemudian larutan ditirasi dengan AgNO3
sampai warna berubah menjadi merah bata. Volume larutan AgNO3
N1= Normalitas AgNO3 N2 = Normalitas NaCl
V1 = Volume AgNO3 V2 = Volume NaCl
2. Standarisasi Larutan Na2S2O3 dengan K2Cr2O7
Sebanyak 10 ml larutan K2Cr2O7 0,1 N dimasukkan ke dalam
erlemeyer berkapasitas 250 ml. Lalu larutan CH3COOH ditambahkan
sebanyak 5 ml. Larutan CuSO4 ditambahkan sebanyak 5 ml. larutan Iodin
ditambahkan sebanyak 2 ml. Larutan Amilum ditambahkan sebanyak 2 ml. Kemudian larutan ditritasi dengan larutan Na2S2O3 hingga warna
berubah menjadi biru. Penggunaan larutan Na2S2O3 dicatat dan normalitas
K2Cr2O7 dihitung dengan rumus :
N1 .V1 = N2 . V2
N1= Normalitas Na2S2O3 N2 = Normalitas K2Cr2O7
III. HASIL
A. Hasil
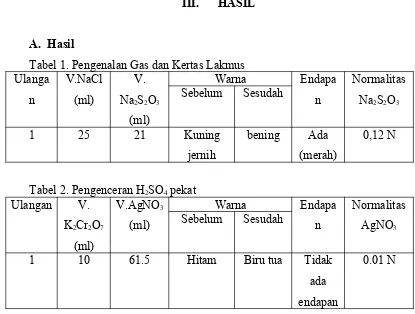
Tabel 1. Pengenalan Gas dan Kertas Lakmus Ulanga
Tabel 2. Pengenceran H2SO4 pekat
Ulangan V.
1 10 61.5 Hitam Biru tua Tidak
ada endapan
0.01 N
B. Pembahasan
Dalam percobaan ini, suatu larutan yang konsentrasinya diketahui secara pasti, disebut larutan standar, dan ditambahkan secara bertahap ke larutan lain yang konsentrasinya belum diketahui, sampai reaksi kimia antara kedua larutan berlangsung sempurna. Jadi dapat didefinisikanlarutan standar adalah larutan yang mengandung suatu zat tertentu dengan berat ekivalen tertentu dalam volume tertentu. Dalam percobaan pembuatan larutan standar, metode yang digunakan adalah metode titrasi. Jadi tujuan dari pembentukan larutan standar ini adalah mencari normalitas larutan yang belum diketahui (Chang, 2003).
Larutan standar ada dua macam, diantaranya adalah larutan standar primer dan larutan standar sekunder.
1. Larutan Standar Primer
titran. Larutan standar primer ini merupakan senyawa yang dapat diperoleh dengan tingkat kemurnian yang tinggi (Cairns, 2009).
Senyawa – senyawa semacam ini, dapat ditimbang secara akurat hingga empat atau bahkan enam decimal, dan volumenya dicukupkan di dalam labu ukur untuk menghasilkan larutan yang diketahui molaritasnya (Cairns, 2009).
Menurut Day dan Underwood (1998), larutan standar primer harus mempunyai karakteristik sebagai berikut :
1. Harus tersedia dalam bentuk murni, atau dalam suatu tingkat kemurnian yang diketahui, pada suatu tingkat biaya yang logis. Secara umum, jumlah total dari pengotor tidak boleh melebihi 0,01 sampai 0,02%, dan harus dilakukan tes untuk mendeteksi kuantitas pengotor – pengotor tersebut melalui tes kuantitatif ddengan sensitivitas yang diketahui.
2. Sebstansi tersebut harus stabil. Harus mudah dikeringkan dan tidak terlalu higroskopis sehingga tidak banyak menyerap air selama penimbangan. Substansi tersebut seharusnya tidak kehilangnan berat bila terpapar udara. Garam hidrat biasanya tidak dipergunakan sebagai standar primer.
3. Yang diinginkan adalah standar primer tersebut mempunyai berat ekivalen yang cukup tinggi agar dapat meminimalisasi konsekuensi galat pada saat penimbangan.
2. Larutan Standar Sekunder
Larutan standar sekunder adalah larutan (titran) biasanya ditempatkan pada buret yang kemudian ditambahkan ke dalam larutan zat yang telah diketahui konsentrasinya secara standar primer).Larutan standar sekunder didapat dari standarisasi terhadap larutan standar primer.
argentometri, garam – garam, seperti natrium klorida (NaCl), dapat ditentukan kadarnya dengan cara berikut:
AgNO3 + NaCl → AgCl (endapan) + NaNO3
AgNO3 + KCN → AgCN (endapan) + KNO3
Garam dilarutkan di dalam air dan di titrasi dengan larutan perak nitrat standar sampai keseluruhan garam perak mengendap. Jenis titrasi ini dapat menunjukan titik akhirnya sendiri (self-indicating), tetapi biasanya suatu indikatir dipilih yang enghasikan endapan berwarna pada titik akhir. Pada penetapan kadar NaCl, kalium kromat ditambahkan ke dalam larutan;
setelah semua NaCl bereaksi, tetesan AgNO3 menghasilkan endapan perak
kromat berwarna merah bata (Cairns, 2009).
Dalam percobaan ini AgNO3 sebagai zat yang dititrasi, NaCl
sebagai larutan standar, dan K2Cr2O4 sebagai indikator. Dalam standarisasi
AgNO3 dengan NaCl didapatkan normalitas AgNO3 sebesar 0,12 N dan
endapan berwarna merah bata serta warna lrutan sesudah titrasi berwarna
bening. Penghitungan normalitas AgNO3 menggunakan rumus V1 . N1 =
V2 . N1
Pada percobaan kedua, titrasi yang digunakan adalah titrasi iodometri. Pada proses titrasi iodometri termasuk dalam titrasi dengan cara tidak langsung, dalam hal ini ion iodide sebagai pereduksi diubah menjadi iodium yang nantinya dititrasi dengan larutan baku Na2S2O3. Metode titrasi
iodometri tak langsung (iodometri) adalah berkenaan dengan titrasi dari iod yang dibebaskan dalam reaksi kimia (Bassett dkk, 1994). Larutan standar yang digunakan dalam kebanyakan proses iodometri adalah natrium thiosulfat. Garam ini biasanya berbentuk sebagai pentahidrat Na2S2O3.5H2O. Larutan tidak boleh distandarisasi dengan penimbangan
Underwood, 1998). Sebagai indikator digunakan larutan amilum. Suatu larutan dari iod dalam larutan air iodide, berwarna kuning pucat sampai coklat tua. Pada percobaan kali ini digunakan amilum sebagai indikator agar jauh lebih peka. Amilum bereaksi dengan iod, dengan adanya iodide, membentuk suatu kompleks yang berwarna biru kuat, yang akan terlihat pada konsentrasi – konsentrasi iod yang sangat rendah. Amilum tidak dapat digunakan dalam medium yang terlalu asam karena akan terjadi hidrolisis dari kanji itu sendiri. Dengan kontrol pada titik akhir titrasi jika kelebihan 1 tetes titran perubahan warna yang terjadi pada larutan akan semakin jelas dengan penambahan indikator amilum/kanji. Metode titrasi iodometri langsung (iodimetri) mengacu kepada titrasi dengan suatu digunakan sebagai pereaksi oksidasi (iodimetri) dan ion iodida digunakan sebagai pereaksi reduksi (iodometri). Relatif beberapa zat merupakan pereaksi reduksi yang cukup kuat untuk dititrasi secara langsung dengan iodium. Maka jumlah penentuan iodometrik adalah sedikit. Akan tetapi banyak pereaksi oksidasi cukup kuat untuk bereaksi sempurna dengan ion iodida, dan ada banyak penggunaan proses iodometrik. Suatu kelebihan ion iodida ditambahkan kepada pereaksi oksidasi yang ditentukan, dengan pembebasan iodium, yang kemudian dititrasi dengan larutan natrium thiosulfat. Dalam industry tapioca, maizena dan terigu, larutan I2 dalam air
dipakai untuk mengindentifikasi amilum, sebab I2 dengan amilum akan
memberikan warna biru (Day dan Underwood, 1998).
Dari percobaan yang telah dilakukan, dari percobaan pertama, yaitu standarisasi larutan AgNO3 dengan NaCl dimana NaCl sebagai
indikator K2Cr2O4 warna yang dihasilkan sebelum titrasi adalah kuning
jernih. Reaksi yang terjadi adalah:
AgNO3(aq) + NaCl(aq) → AgCl (s) + NaNO3(aq)
AgNO3(aq) + Cl-(aq) → AgCl (s) endapan + NO-3(aq)
Larutan AgNO3 dan NaCl pada awalnya tidak berwarna (bening), ketika
NaCl dimasukkan ke dalam Erlenmeyer dan ditambahkan indikator K2CrO4 0,03
M yang kemudian dititrasi sedikit demi sedikit dengan AgNO3 akan terbentuk
endapan putih yang merupakan AgCl. Dan ketika NaCl sudah habis bereaksi
dengan AgNO3 sementara jumlah AgNO3 masih ada maka AgNO3 akan bereaksi
dengan indikator K2CrO4. Dalam titrasi ini, perlu dilakukan secara cepat dan
pengocokannya pun juga kuat agar Ag+ tidak teroksidasi menjadi AgO yang
menyebabakan titik akhir titrasi menjadi sulit dicapai. Pada titik akhir titrasi akan menunjukkkan perubahan warna dari kuning menjadi kuning-coklat. Perubahan ini terjadi karena timbulnya Ag2CrO4 saat hampir mencapai titik ekivalen, hampir
semua ion Cl- berikatan menjadi AgCl. Larutan standar yang digunakan dalam
percobaan ini adalah NaCl yang memiliki normalitas 0,1 N, adanya indikator
K2CrO4 menyebabkan terjadinya reaksi pada titik akhir dengan titran sehingga
terbentuk endapan yang berwarna merah bata, yang menunjukkan titik akhir
adalah perubahan warnanya dari warna endapan analit dengan Ag+. Pada analisa
Cl- terjadi reaksi:
Ag+
(aq) + Cl-(aq) → AgCl(s)
Sedangkan menurut Hidayati (2009), pada titik akhir titran juga bereaksi menurut reaksi :
2Ag+
(aq) + CrO4(aq) → Ag2 CrO4(s)
Setelah di lakukan titrasi lalu dihitung normalitas AgNO3, didapatkan
normalitasnya sebesar 0,12 N.
Pada penetapan kadar NaCl, kalium kromat ditambahkan ke dalam larutan; setelah semua NaCl bereaksi, tetesan AgNO3 menghasilkan
terdapat endapan setelah larutan NaCl dan larutan AgNO3 diteteskan
K2Cr2O4.
Sedangkan pada percobaan kedua, yaitu standarisasi larutan Na2S2O3
dengan K2Cr2O7 dimana larutan Na2S2O3sebagai titran (larutan yang dititrasi) dan
K2Cr2O7 sebagai penitran dengan indikator amilum, pada standarisasi Na2S2O3
terdapat beberapa larutan yang ditambahkan yaitu, CH3COOH yang memberikan
suasana asam, CuSO4 sebagai katalis, dan larutan iod yang membuat amilum
berubah warna menjadi biru. Terdapat zat – zat yang bersifat oksidator seperti besi III, tembaga II, dimana zat ini akan mengoksidasi iodide yang ditambahkan membentuk iodin. Iodin yang terbentuk akan ditentukan dengan larutan baku tiosulfat.
Oksidator + KI → I2 + 2e I2 + Na2S2O3 → NaI + Na2S4O6
Warna biru tua yang dihasilkan merupakan iod-amilum yang menandakan bahwa proses titrasi telah mencapai titik akhir (Karinda dkk, 2013). Pada standarisasi Na2S2O3, warna larutan sebelum yaitu hitam (dapat pula dikatan biru
pekat sehingga terlihat hitam), hal ini karena amilum bereaksi dengan iod, dengan adanya iodide, membentuk suatu kompleks yang berwarna biru kuat, yang akan terlihat pada konsentrasi – konsentrasi iod yang sangat rendah dan sesudah titrasi berubah warna menjadi biruPada titrasi larutan Na2S2O3 dengan K2Cr2O7 terjadi
reaksi sebagai berikut :
K2Cr2O7 + Na2S2O3 → 2K+ + Cr2O72+ + 2Na+ + S2O3
2-Selain itu juga terdapat reaksi lain
S2O32- + 6 I-+ 14H+ → 3I2 + 2Cr3+ + 7H2O
2NaS2O3 + I2 → 2I + NaS4O6
Campuran dari K2Cr2O7, CH3COOH, iodin, dan amilum akan
menghasilkan warna hitam, lalu setelah dititrasi warna larutan berubah menjadi biru biru keunguan. Perubahan warna ini terjadi karena adanya iodin dan amilum.
Indikator yang digunakan pada titrasi ini adalah amilum yang berfungsi merubah warna larutan menjadi biru pada titik akhir titrasi. Standarisasi larutan Na2S2O3 dengan K2Cr2O7 tidak akan menimbulkan
IV.KESIMPULAN
Berdasarkan hasil percobaan yang telah dilakukan, dapat disimpulkan bahwa, dalam pembuatan larutan standar pada percobaan ini menggunakan metode titrasi, yaitu pada percobaan pertama menggunakan metode titrasi iodometri dan pada percobaan kedua menggunakan metode titrasi argentometri. Titrasi argentometri merupakan salah satu metode analit dengan menggunakan larutan baku sekunder yang mengandung unsur perak. Pada standarisasi larutan Na2S2O3 merupakan titrasi iodometri adalah analisa titrimetric yang secara tidak
langsung untuk zat yang bersifat oksidator.Pada standarisasi AgNO3, AgNO3
dititrasi dengan NaCl dan K2Cr2O4 sebagai indikator didapatkan normalitas
AgNO3 sebesar 0,12 N dan endapan berwarna merah bata. Pada standarisasi
Na2S2O3 dengan K2Cr2O7, Na2S2O3 dititrasi dengan K2Cr2O7 dengan amilum
DAFTAR PUSTAKA
Bassett, J., Denney, R.C., Jeffery, G.H, dan Mendham, J. 1994. Buku Ajar Vogel
Kimia Analisis Kuantitatif Anorganik. Penerbit Buku Kedokteran EGC, Jakarta.
Day, R.A., dan Underwood, A.L. 1998. Analisis Kimia Kuantitatif. Erlangga, Jakarta.
Cairns, D. 2009. Intisari Kimia Farmasi. Penerbit Buku Kedokteran EGC, Jakarta.
Chang, R. 2003. Kimia Dasar. Erlangga, Jakarta.
Hidayati, A. 2009. Petunjuk Praktikum Dasar Kimia Analitik. Tadris Kimia Fakultas Tarbiyah IAIN Walisongo, Semarang.
Karinda, M., Fatimawali, dan Citraningtyas, G. 2013. Perbandingan Hasil Penetapan Kadar Vitamin C Mangga Dodol Dengan Menggunakan
Metode Spektrofotometri UV-Vis Dan Iodometri. Jurnal Ilmiah Farmasi
LAMPIRAN
1. Perhitungan dari standarisasi larutan AgNO3 dengan NaCl
VNaCl . NNaCl= VAgNO3 . NAgNO3
25 ml . 0.1= 21 . N2
NAgNO3 = 0.12 N
Jadi normalitas larutan AgNO3 adalah 0.12 N.
2. Perhitungan dari percobaan standarisasi larutan Na2S2O3 dengan K2Cr2O7
VK2Cr2O7. NK2Cr2O7= VNa2S2O3. NNa2S2O3
10 ml . 0.1 = 61.5 ml . N2
1 = 61.5 ml .N2
N2= 0.016 N