commit to user
i
EFEK PENAMBAHAN Cr
3+PADA PERTUMBUHAN
KRISTAL DAN FOTOAKTIVITAS TiO
2Disusun Oleh :
WIDIYA NUR HIDAYATIKA
M0307069
SKRIPSI
Diajukan untuk memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains
April, 2012
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
commit to user
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul ” EFEK
PENAMBAHAN Cr3+ PADA PERTUMBUHAN KRISTAL DAN
FOTOAKTIVITAS TiO2” adalah benar-benar hasil penelitian sendiri dan tidak
terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, April 2012
commit to user
iv
EFEK PENAMBAHAN Cr
3+PADA PERTUMBUHAN
KRISTAL DAN FOTOAKTIVITAS TiO
2WIDIYA NUR HIDAYATIKA
Jurusan Kimia. Fakultas Matematia dan Ilmu Pengetahuan Alam. Universitas Sebelas Maret
ABSTRAK
Telah dilakukan penelitian tentang sintesis TiO2 dan komposit
TiO2-Cr2O3 dengan variasi suhu kalsinasi. Sintesis TiO2 menggunakan metode sol
gel dengan bahan awal Titanium Tetra Isopropoksida (TTIP), sedangkan komposit TiO2-Cr2O3 dengan metode wet impregnation menggunakan bahan awal
menjadi rutile sedangkan dengan penambahan Cr3+ sampai dengan suhu 700 tidak
terdapat fase rutile. Identifikasi dengan spektrofotometer infra merah (FT-IR)
menunjukkan serapan O-Cr pada bilangan gelombang 2283,72 cm-1. Keberadaan Cr2O3 juga didukung dengan spektrofotometer XRF. Fotodegradasi Rhodamin B
menunjukkan hasil terbaik pada degradasi dengan menggunakan TiO2 yang
dipanaskan pada suhu 400oC,yaitu 43,15%
Rhodamin B yang berhasil didegradasi
dan hasil terbaik pada degradasi dengan menggunakan komposit TiO2-Cr2O3 yang
dipanaskan pada suhu 700oC,yaitu 74,71% Rhodamin B yang berhasil didegradasi.
commit to user
v
EFFECT OF ADDITION Cr
3+ON THE GROWTH OF TiO
2CRYSTAL AND PHOTOACTIVITY
WIDIYA NUR HIDAYATIKA
Department of Chemistry. Mathematic and Natural Science Faculty. Sebelas Maret University.
ABSTRACT
The research on synthesis of TiO2 and TiO2-Cr2O3 composite with the
variation of calcination temperature have been investigated. Synthesis of TiO2 has
been carried out by sol gel method with Titanium Tetra Isopropoksida (TTIP) as the starting material, while the composite of TiO2-Cr2O3 has been carried out by
wet impregnation method uses starting material in which Cr(NO3)3.9H2O and
urea. This study aims to determine the effect of the addition Cr3+ on the growth of TiO2 crystal and an increasing of TiO2 fotoactivity after the addition of Cr3+.
The result of research shows the peak of characteristic TiO2 anatase in 2θ
= 25. 35o, (Ti-Cr)
2O3 at 2θ = 33,50o and Cr2O3 at2θ = 36. 35o. Synthesis of TiO2
on the annealling temperature of 500 oC to 700 oC provide there is transformation of anatase to rutile phase, meanwhile this transformation where not occured even the materials were annealed up to 700 oC after the addition of Cr3+ into TiO2.
Identification with Fourier Transform Infra Red (FT-IR) showed absorptions O-Cr in the wave number of 2283. 72 cm-1. The presence of Cr2O3 is also supported by
XRF data. The photodegradation of Rhodamin B shows that the best result is the degradation by using TiO2 which was annealed at 400oC, i.e 43.15% of Rhodamin
B was degraded succesfully, meanwhile the best result is the degradation by using composite which was annealed at 700oC, i.e 74.71% of Rhodamin B was degraded succesfully.
commit to user
vi
MOTTO
Sesungguhnya sesudah kesulitan itu ada kemudahan. Maka apabila kamu telah selesai (dari sesuatu urusan), kerjakanlah dengan sungguh-sungguh (urusan) yang
lain dan hanya kepada Tuhanmulah hendaknya kamu berharap (A Lam Nasyrah:7-8)
Aku melihat air menjadi rusak karena diam tertahan Jika mengalir menjadi jernih, jika tidak, kan keruh menggenang
(Imam Syafi’i)
Seperti besi yang dapat menajamkan besi lain, begitu pula seharusnya manusia dapat menajamkan manusia lain
commit to user
vii
PERSEMBAHAN
Karya ini saya persembahkan untuk,
Orangtuaku tersayang “Bapak & Ibu”,
maaf kalau tidak bisa menyelesaikan ini semua tepat waktu. Terimakasih atas kasih sayang dan do’a yang selalu tercurah untukku.
Kakak dan Adikku tercinta “Widi & Widiva” ,
Yang selalu memberikan dukungan untukku.
Yang tersayang “Ridwan Wibisono”,
Yang selalu memberikan nasehat. Untukku.
commit to user
viii
KATA PENGANTAR
Segala puji dan segenap syukur bagi Allah SWT yang telah menunjukkan jalan yang indah bagi penulis sehingga skripsi ini dapat penulis selesaikan dengan baik sebagai salah satu persyaratan dalam memperoleh gelar sarjana sains Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta. Atas segala karunia-Nya pulalah penulis menyadari bahwa segala sesuatu memiliki proses dan waktunya masing-masing.
Dalam menyusun skripsi ini penulis menemui berbagai hambatan dan permasalahan yang beragam. Namun, atas bimbingan, kritikan, saran, dan dorongan semangat yang bermanfaat dari berbagai pihak, semua hambatan dan permasalahan tersebut dapat penulis atasi dengan baik. Oleh karena itu, penulis ingin menyampaikan terima kasih kepada pihak-pihak yang telah membantu penulis, yaitu sebagai berikut.
1. Ir. Ari Handono Ramelan., M.Sc., Ph.D., selaku dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
2. Dr. Eddy Heraldy., M.Si., selaku ketua jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret, Surakarta
3. Achmad Ainurofiq, Msi., Apt., selaku pembimbing akademik
4. Dr. Sayekti Wahyuningsih, M.Si., selaku pembimbing skripsi, yang dengan penuh kesabaran telah memberikan bimbingan dan arahan kepada penulis dari awal hingga akhir
5. Seluruh staf dan laboran Laboratorium Kimia Dasar FMIPA UNS, Sub Laboratorium Kimia, dan Laboratorium Pusat FMIPA UNS.
6. Bapak Ibu dosen dan seluruh staf jurusan Kimia yang telah memberikan fasilitas dan pelayanan yang baik bagi penulis
7. Bapak, Ibu, Widi dan Widiva dirumah, terimakasih atas dukungan dan motivasi yang diberikan untuk segera menyelesaikan karya ini
commit to user
ix
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun dari semua pihak dalam rangka untuk menyempurnakan skripsi ini. Akhirnya penulis berharap, semoga karya kecil ini dapat memberikan manfaat bagi ilmu pengetahuan dan bagi pembaca.
Surakarta, April 2012
commit to user
1. Identifikasi Masalah ... 3
2. Batasan Masalah ... 4
commit to user
c. Spektrofotometer UV-Visible (UV-Vis) ... 17
d. X-Ray Fluoresence (XRF) ... 19
B. Kerangka Pemikiran ... 19
C.Hipotesis ... 21
BAB III METODOLOGI PENELITIAN... 22
A.Metode Penelitian ... 22
B. Tempat danWaktu Penelitian... 22
C.Alat dan Bahan yang Dibutuhkan ... 22
E. Teknik Pengumpulan dan Analisis Data ... 25
1. Pengumpulan Data ... 25
commit to user
xii
2. Fotodegradasi Rhodamin B dengan Komposit TiO2-Cr2O3 ... 40
BAB V KESIMPULAN DAN SARAN ... 47
DAFTAR PUSTAKA. ... 48
commit to user
xiii
DAFTAR TABEL
Halaman Tabel 1. Rasio A/R pada TiO2 Murni ... 30
Tabel 2. Standar JCPDS dari Cr₂O₃&(Ti0,12Cr0,88)₂O₃ sebagai Pembanding
serta Komposit Hasil Sintesis ... 31 Tabel 3. Hasil Data Analis Fluoresensi Sinar-X Komposit TiO2-Cr2O3 dengan
Variasi Suhu Kalsinasi ... 36 Tabel 4. Hasil Degradasi Rhodamin B pada TiO2 Murni ... 39
commit to user
Gambar 3. Ilustrasi skematis proses fotoeksitasi dan de-eksitasi pada suatu semikonduktor ... 9 Gambar 4. Mekanisme TiO2 di bawah UV dan cahaya tampak ... 11
Gambar 5. Struktur Rhodamin B ... 12
Gambar 6. Spektra difraksi sinar-X dari TiO2 murni dengan variasi suhu
300 oC -700 oC ... 28 Gambar 7. Persentase Relatif fase anatase dan fase rutile pada standar TiO2
murni pada variasi suhu kalsinasi ... 30 Gambar 8. Spektra difraksi sinar-X dari material hasil sintesis dengan
variasi suhu 300 oC -700 oC ... 31 Gambar 9. Presentase relatif TiO2 fase anatase, (Ti0,12Cr0,88)2O3, dan Cr2O3
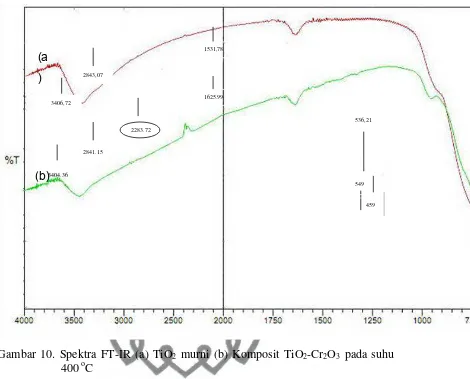
pada material hasil sintesis dengan variasi suhu kalsinasi ... 33 Gambar 10. Spektra FT-IR (a) TiO2 murni (b) Komposit TiO2-Cr2O3 pada
suhu 400 oC ... 34 Gambar 11. Hasil analisa XRF pada komposit TiO2-Cr2O3 ... 36
Gambar 12. Kurva degradasi Rhodamin B oleh TiO2 murni pada suhu
kalsinasi 400 oC dengan Variasi Waktu 0 menit (a), 30 menit (b), 60 menit (c), 120 menit (d), 180 menit (e).. ... 37 Gambar 13. Kurva degradasi Rhodamin B oleh TiO2 murni pada suhu
kalsinasi 500 oC dengan Variasi Waktu 0 menit (a), 30 menit (b),
60 menit (c), 120 menit (d), 180 menit (e). ... 37 Gambar 14. Kurva degradasi Rhodamin B oleh TiO2 murni pada suhu
kalsinasi 600 oC dengan Variasi Waktu 0 menit (a), 30 menit (b),
commit to user
xv
Gambar 15. Kurva degradasi Rhodamin B oleh TiO2 murni pada suhu
kalsinasi 700 oC dengan Variasi Waktu 0 menit (a), 30 menit (b), 60 menit (c), 120 menit (d), 180 menit (e). ... 38 Gambar 16. Hasil fotodegradasi Rhodamin B pada TiO2 murni dengan variasi
suhu... ... 40 Gambar 17. Kurva degradasi Rhodamin B oleh komposit TiO2-Cr2O3 pada
suhu kalsinasi 400 oC dengan Variasi Waktu 0 menit (a), 30
menit (b), 60 menit (c), 120 menit (d), 180 menit (e). ... 41 Gambar 18. Kurva degradasi Rhodamin B oleh komposit TiO2-Cr2O3 pada
suhu kalsinasi 500 oC dengan Variasi Waktu 0 menit (a), 30
menit (b), 60 menit (c), 120 menit (d), 180 menit (e). ... 41 Gambar 19. Kurva degradasi Rhodamin B oleh komposit TiO2-Cr2O3 pada
suhu kalsinasi 600 oC dengan Variasi Waktu 0 menit (a), 30 menit (b), 60 menit (c), 120 menit (d), 180 menit (e). ... 42 Gambar 20. Kurva degradasi Rhodamin B oleh komposit TiO2-Cr2O3 pada
suhu kalsinasi 700 oC dengan Variasi Waktu 0 menit (a), 30 menit (b), 60 menit (c), 120 menit (d), 180 menit (e). ... 42 Gambar 21. Kurva degradasi Rhodamin B pada TiO2 murni pada suhu 400 oC
yang telah dalam bentuk kristal.. ... 44 Gambar 22. Hasil fotodegradasi Rhodamin B pada komposit TiO2-Cr2O3
commit to user
xvi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Bagan Prosedur Kerja Sintesis dan Karakterisasi Komposit
TiO2-Cr2O3 serta Aktivitasnya terhadap Degradasi Zat Warna
Rhodamin B ... 53
Lampiran 2. Perhitungan Persentase Fase TiO2 Anatase dan Fase TiO2 Rutil
dari TiO2 Hasil Sintesis Variasi Suhu ... 57
Lampiran 3. Perhitungan Kelimpahan Fase Anatase, (Ti0.12Cr0.88) dan Cr2O3
dari KompositTiO2-Cr2O3 Variasi Suhu ... 59
Lampiran 4. Hasil Difraksi Sinar X dari Sintesis TiO2 ... 66
Lampiran 5. Hasil Difraksi Sinar X dari Komposit TiO2-Cr2O3 ... 104
Lampiran 6. Difraksi Sinar X dari TiO2 Hasil Sintesis TiO2 Anatase, TiO2
Rutil Standar JCPDS ... 135 Lampiran 7. Difraksi Sinar X dari (Ti0.12Cr0.88)2O3&Cr2O3 Standar JCPDS ... 136
Lampiran 8. Data XRF dari Komposit TiO2-Cr2O3 ... 137
Lampiran 9. Data FT-IR (Fourier Transform Infra Red) dari TiO2 dan
Komposit TiO2-Cr2O3 ... 141
Lampiran10. Perhitungan Persentase Rhodamin B yang Terdegradasi dengan
commit to user
1
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Teknologi fotokatalis merupakan kombinasi dari proses fotokimia dan katalis yang terintegrasi untuk dapat melangsungkan suatu reaksi transformasi kimia. Reaksi transformasi tersebut berlangsung pada permukaan bahan katalis semikonduktor yang terinduksi oleh sinar. Oksida logam titanium (TiO2) banyak
dilaporkan sebagai material semikonduktor yang aktif sebagai fotokatalis. TiO2
memiliki tiga macam bentuk kristal yaitu anatase, rutile, dan brookite, namun
yang paling sering dimanfaatkan yaitu bentuk rutile dan anatase. Dari salah satu
penelitian dinyatakan bahwa nanomaterial TiO2 fasa anatase memiliki aktivitas
fotokatalitik yang lebih tinggi dibandingkan fasa rutile (Subiyanto et al., 2009).
Anatase memiliki aktivitas fotokatalitik yang baik untuk degradasi berbagai
senyawa organik, termasuk zat warna. Anatase dalam suhu yang tinggi dapat
berubah bentuk secara irreversibel menjadi rutile. Transformasi tersebut tidak
memiliki suhu tertentu karena tidak ada kesetimbangan fasa. Oleh karena itu transformasi tersebut dipengaruhi oleh variasi suhu dan beberapa faktor lain seperti adanya pengotor, penyimpangan stokiometri, luas permukaan, ukuran partikel (Riyas et al., 2002). Penelitian yang telah dilakukan oleh Pirault et al.
(2007) pada penambahan 20% Cr2O3 dapat menghambat transformasi bentuk
kristal TiO2 anatase menjadi rutile. Penambahan oksida logam tersebut dapat
menekan pertumbuhan kristal selama proses pemanasan dengan demikian dapat mengurangi transformasi anatase menjadi rutile.
TiO2 merupakan salah satu fotokatalis yang paling menjanjikan karena
memiliki efisiensi fotokatalitik tinggi, murah, inert secara biologis dan kimia (Hoffman et al., 1995). Serbuk TiO2 juga mudah didapat dan diproduksi dalam
jumlah besar. Katalis berupa padatan telah digunakan secara luas karena lebih murah dan mudah dipisahkan. Katalis padatan meliputi katalis oksida logam, katalis logam atau alloy, katalis organologam dan katalis asam atau basa (Green,
commit to user
Banyak studi telah dilakukan untuk memperbaiki mikrostuktural dari TiO2
yaitu dengan memilih metode sintesis yang tepat dan mengatur kondisi selama sintesis berlangsung. Salah satu modifikasi yang dilakukan yaitu menggunakan penambahan jenis unsur lain ke dalam molekul TiO2. Hal ini bertujuan untuk
meningkatkan aktivitas dan efisiensi katalik dengan menghambat proses rekombinasi elektron-hole selama proses katalitik berlangsung. Menurut
Linsebigler et al. (1995) bahwa mikrostruktur, luas permukaan, distribusi ukuran
partikel, porositas, densitas permukaan gugus hidroksil, dan distribusi dopant
dapat mempengaruhi aktivitas fotokatalitik TiO2. Aktifitas fotokatalis dari
titanium berkaitan dengan struktur dan ukuran nanopartikel dari titanium itu sendiri. Modifikasi struktur dan ukuran dapat dilakukan dengan menambahkan ion logam transisi, halida, dan lantanida. Penambahan ion transisi dapat merangsang dalam pembentukan radikal hidroksil (Kim et al., 2007).
Oksida logam transisi memiliki kelimpahan besar di alam dan harga yang relatif murah dibandingkan logam. Oksida logam transisi memiliki karakter yang dapat digunakan sebagai katalis, karena oksida logam transisi memiliki orbital d pada ion logamnya yang masih terisi sebagian. Adanya orbital d yang masih kekurangan elektron tersebut dapat menangkap elektron dari reaktan dan membentuk ikatan yang kuat, sehingga dapat mengaktifkan spesies yang bereaksi (Prakash’s, 1997). Oksida logam yang sering digunakan sebagai katalis
2O3 berbentuk heksagonal berwarna
hijau muda hingga hijau tua (Windholz, 1983).
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
3
penelitian yang memanfaatkan fotokatalis pada pengolahan limbah zat warna.
Rhodamin B termasuk senyawa atau molekul yang memberikan warna akibat
adanya gugus kromofor. Kuantitas warna yang ditimbulkan Rhodamin B sangat
tajam, hal ini disebabkan oleh adanya dua gugus auksokrom. Rhodamin B
merupakan zat warna sintetik yang digunakan untuk industri tekstil, cat, dan kertas. Zat warna ini dapat menyebabkan iritasi dan merupakan zat karsinogenik (Cahyadi, 2006).
Pada penelitian ini dilakukan penambahan Cr3+ pada semikonduktor TiO2
dengan harapan dapat menekan pertumbuhan kristal TiO2 fase rutile dan
meningkatkan aktivitas fotokatalitik pada TiO2 sehingga dapat digunakan untuk
degradasi zat warna Rhodamin B.
B. PERUMUSAN MASALAH
1. Identifikasi Masalah
Titanium dioksida (TiO2) dapat dibuat dari titanium tetraklorida (TiCl4),
suatu cairan ketal tak berwarna yang mudah mengalami oksidasi dengan oksida air. Dimana pada reaksi tersebut terjadi pembentukan yang sangat cepat sehingga untuk menghasilkan TiO2 bentuk anatase sangat sulit. Penelitian
Wahyuningsih et al. (2007) telah melakukan sintesis TiO2 dengan TiCl4
menggunakan proses sol gel dengan hidrolisis lambat. Sintesis TiO2 dengan
proses sol gel dapat juga dilakukan menggunakan prekursor alkoksida seperti TTIP (Titanium Tetra Isopropoksida) (Tjahjanto dan Gunlazuardi, 2001). Pemilihan bahan awal pada sintesis TiO2 sangat diperlukan untuk menghasilkan
kemurnian TiO2 yang tinggi. Menurut Wang et al. (2007) dengan bahan awal
alkoksida sebagai prekursor TiO2 menghasilkan kristalisasi dan karakteristik
powder TiO2 yang lebih baik daripada TiCl4.
Metode untuk pembuatan katalis bermacam-macam, Riyas et al. (2002)
telah melakukan penambahan oksida logam ke dalam TiO2 dengan perbandingan
commit to user
diperoleh menunjukkan bahwa metode wet-impregnation dapat menghasilkan
TiO2 fase anatase lebih banyak.
Pada penelitian yang pernah dilakukan untuk mengetahui ukuran atom dan material katalis, Ryas et al. (2002) menggunakan X-Ray Diffraction (XRD)
sedangkan untuk mengetahui morfologi semikonduktor menggunakan TEM
(Transmission Electron Microscopy) dan SEM (Scanning Electron Microscopy).
Pada kasus yang berbeda untuk mengetahui energi gap suatu semikonduktor menggunakan XPS. Untuk mengetahui perbandingan komposisi pada komposit, Karna dkk. (2006) menggunakan X-Ray Fluoresence (XRF). Fourier Transform
Infra Red (FTIR) untuk menganalisa gugus fungsi suatu material fotokatalis
dilakukan oleh Ryas et al. (2002) .Analisis degradasi zat warna dapat dilakukan
dengan Spektrofotometer UV-Vis serta Spektrofotometer Serapan Atom (AAS).
2. Batasan masalah
Berdasarkan identifikasi masalah yang telah disebutkan di atas maka batasan masalah pada penelitian ini adalah :
a. TiO2 yang digunakan merupakan hasil sintesis dari TTIP (Titanium Tetra
Isopropoksida) dengan metode sol gel.
b. Modifikasi permukaan TiO2 dilakukan dengan penambahan Cr3+dengan
metode wet-impregnation.
c. Karakterisasi TiO2 hasil sintesis dan komposit TiO2-Cr2O3 dilakukan dengan
menggunakan X-Ray Diffraction (XRD), Spekrofotometer Infra Red (IR), dan
X-Ray Fluorescence (XRF).
d. Uji aktivitas komposit TiO2-Cr2O3 dilakukan untuk mendegradasi zat warna
Rhodamin B yang diidentifikasi dengan menggunakan Spektrofotometri
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
5
3. Rumusan Masalah
Berdasarkan batasan masalah yang telah dipaparkan diatas maka rumusan masalah pada penelitian ini adalah :
1. Bagaimana pengaruh penambahan Cr3+ terhadap pertumbuhan kristal TiO2 ?
2. Apakah terjadi peningkatan fotoaktivitas TiO2 setelah penambahan Cr3+?
C. Tujuan Penelitian
1. Mengetahui pengaruh dari penambahan Cr3+ terhadap pertumbuhan kristal
TiO2.
2. Mengetahui peningkatan fotoaktivitas TiO2 setelah penambahan Cr3+.
D. Manfaat Penelitian
Memberikan informasi mengenai efek penambahkan Cr3+ pada pertumbuhan kristal dan sifat fotokatalitik TiO2 sehingga dapat diaplikasikan
commit to user
6
BAB II
LANDASAN TEORI
A.Tinjauan Pustaka
1. Titanium Dioksida (TiO2)
a. Polymorf Titanium Dioksida (TiO2)
Titanium, unsur logam golongan IVB, mempunyai titik leleh 1675 oC dan berat atom 47,90 dengan konfigurasi elektron 3d2 4s2. Energi untuk
mengeluarkan 4 elektron begitu besar sehingga ion Ti4+ tidak ada secara bebas.
Titanium dioksida mempunyai berat molekul 79,90, warnanya bervariasi tergantung sumbernya, tetapi putih saat dimurnikan dan dijual secara komersial, mengalami dekomposisi pada 1640 oC sebelum meleleh, densitas 4,26 g/cm3, tidak larut dalam air tetapi larut dalam H2SO4 (Cotton dan Wilkinson, 1989).
Pada Gambar 1. menunjukkan struktur kristal TiO2 dalam bentuk
anatase, rutile, dan brookite.
Rutile
Anatase
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
7
Gambar 1. Struktur TiO2rutile, anatase, brookite. (Tauste, 2008)
TiO2 mempunyai 3 bentuk struktur kristal yaitu rutile, anatase, dan
brookite. Rutile dan anatase mempunyai struktur tetragonal dengan tetapan kisi
kristal dan sifat fisika yang berbeda, sedang brookite adalah ortorombik. Brookite
dan anatase adalah bentuk-bentuk yang metastabil atau tidak stabil. Sedangkan
rutile adalah bentuk yang lebih stabil dibandingkan anatase dalam semua
temperatur (Kampfer, 1973).
Perubahan bentuk anatase menjadi rutile pada TiO2 terjadi secara
spontan dimana energi bebas pada bentuk rutile lebih rendah daripada anatase
pada semua suhu, tetapi perubahannya kurang baik pada suhu rendah. Anatase
lebih metastabil daripada rutile dalam semua kondisi suhu dan tekanan
(Navrotsky dan Kleppa, 1967). Selain itu perubahan tersebut di pengaruhi oleh metode sintesis, suasana reaksi, kadar pengotor, ukuran partikel, dan kekosongan kisi oksigen dalam konsentrasi TiO2. Pada Gambar 2. menunjukkan bentuk kristal
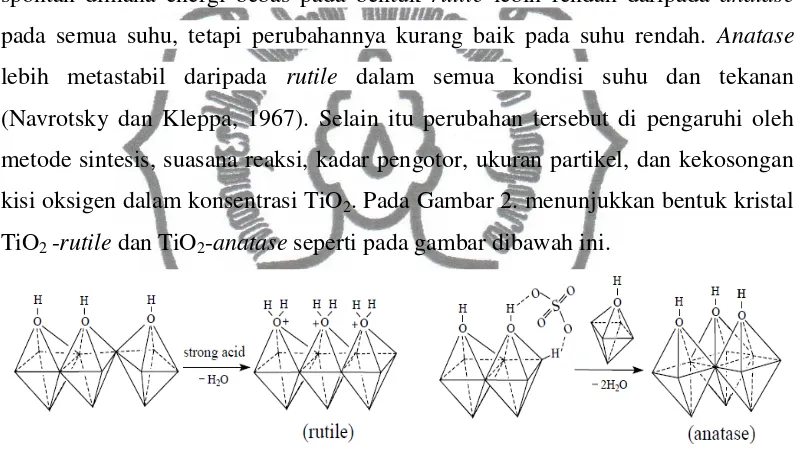
TiO2 -rutile dan TiO2-anatase seperti pada gambar dibawah ini.
Gambar 2. Bentuk TiO2-rutile dan bentuk TiO2-anatase (Tian, 2006).
b.Modifikasi Titanium Dioksida (TiO2)
Kromium oksida memiliki berat molekul 152,02 gr/mol, berbentuk kristal heksagonal berwarna hijau muda hingga hijau tua. Memiliki titik leleh 2435 oC dan titik didih 3000 oC dengan densitas 5,22 (T = 25 oC). Berwarna coklat akibat pemanasan tetapi kembali berwarna hijau pada saat dingin. Tidak larut dalam air, alkohol, aseton, mudah larut dalam asam dan larutan alkali. Kristal Cr2O3 sangat keras, dapat menggores kwarsa, topaz, maupun zircon
commit to user
Oksida ini pada umumnya disebut sebagai oksida kromat atau sesquioksida kromat hijau. Oksida ini digunakan sebagai bahan pewarna hijau untuk cat minyak, oleh karena itu senyawa ini disebut juga sebagai krom hijau.
Cr2O3 merupakan bubuk hijau yang memiliki titik leleh sangat tinggi dan
sangat sukar dicairkan. Senyawa ini digunakan pada pelapisan gelas dan pewarnaan porselen. Penyebabnya yaitu tereduksi oleh logam dengan pemanasan menggunakan karbon pada temperatur tinggi. Senyawa ini merupakan oksida amfoter karena dapat berbentuk garam dengan asam maupun alkali.
Penambahan kromium dapat menghambat transformasi bentuk kristal
TiO2 anatase menjadi rutile seperti pada penelitian yang dilakukan oleh
Pirault et al. (2007) dengan menghambat pertumbuhan ukuran kristal TiO2
~20 nm. Pada suhu yang tinggi akan mempercepat pertumbuhan ukuran kristal TiO2 yang menyebabkan bentuk kristal anatase terkonversi menjadi rutile dengan
ukuran kristal mencapai ~ 30 nm.
2. Fotokatalis Titanium Dioksida (TiO2)
a. Mekanisme Fotokatalitik TiO2
Fotokatalis adalah suatu proses yang dibantu oleh adanya cahaya dan material katalis (TiO2) dengan pencahayaan sinar UV (λ < 405 nm), maka
permukaan TiO2 mempunyai kemampuan mengionisasi reaksi kimia. Dalam
media air, kebanyakan senyawa organik dapat dioksidasi menjadi karbon dioksida dan air. Berarti proses tersebut dapat membersihkan air dari pencemaran organik seperti fenol dan lainya, dan senyawa-senyawa anorganik seperti sianida, tembaga dan nitrit yang beracun dapat diubah menjadi senyawa lain yang relatif tidak beracun.
TiO2 dapat berfungsi sebagai fotokatalis yaitu mempercepat reaksi yang
diinduksi oleh cahaya karena mempunyai struktur semikonduktor yaitu struktur elektronik yang dikarakterisasi oleh adanya pita valensi (valence band; vb) terisi
dan pita konduksi (conduction band; cb) yang kosong. Kedua pita tersebut
dipisahkan oleh celah yang disebut energi celah pita (band gap energi; Eg)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
9
Jika suatu semikonduktor disinari cahaya (foton) sebesar hʋ, maka (e) pada pita valensi akan mengabsorpsi energi foton tersebut dan pindah ke tingkat energi yang lebih tinggi yaitu pita konduksi, akibatnya akan meninggalkan lubang positif (hole atau h+) pada pita valensi. Sebagian besar elektron dan hole berkombinasi kembali di dalam ruah semikonduktor dengan mengemisi kalor, sedangkan sebagian lagi bertahan pada permukaan semikonduktor.
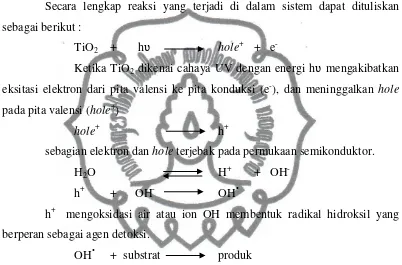
Secara lengkap reaksi yang terjadi di dalam sistem dapat dituliskan sebagai berikut :
TiO2 + hʋ hole+ + e
-Ketika TiO2 dikenai cahaya UV dengan energi hʋ mengakibatkan
eksitasi elektron dari pita valensi ke pita konduksi (e-), dan meninggalkan
hole
pada pita valensi (hole+)
hole+ h+
sebagian elektron dan hole terjebak pada permukaan semikonduktor.
H2O H+ + OH
-h+ + OH- OH•
h+ mengoksidasi air atau ion OH membentuk radikal hidroksil yang berperan sebagai agen detoksi.
OH• + substrat produk
Untuk lebih jelasnya dapat dilihat ilustrasi skematis proses fotoeksitasi pada Gambar 3.
Gambar 3. Ilustrasi skematis proses fotoeksitasi dan de-eksitasi pada suatu semikonduktor (Arutanti et al., 2009)
commit to user
TiO2 dengan proses UV dikenal memiliki banyak keuntungan antara lain:
sejumlah besar senyawa organik terlarut atau terdispersi dalam air bisa sepenuhnya termineralisasi, laju reaksi relatif tinggi jika luas permukaan katalis besar, TiO2 tersedia dengan harga yang relatif murah dan dapat didaur ulang pada
skala teknis, lampu UV memancarkan di daerah spektral yang diperlukan untuk oksidasi fotokatalitik diproduksi dalam berbagai ukuran, serta penyerapan penampang TiO2 dapat ditingkatkan dengan modifikasi permukaan, misalnya oleh
penambahan ion logam transisi. Mekanisme yang menggambarkan proses reaksi fotokatalitik TiO2 adalah sebagai berikut:
TiO2 + hʋ e-cb + h+vb
h+vb + H2O •OH + H+
e-cb + O2 O2•
-2O2•- + 2H2O H2O2 + 2OH- + O2
H2O2 + e-cb OH- + •OH
b. Mekanisme Fotokatalitik TiO2 dengan Penambahan Cr3+
Hanya sekitar 4-6% dari energi matahari yang mencapai permukaan bumi yang di daerah UV. TiO2 dengan eg 3,2 eV hanya mampu menyerap 10% cahaya
matahari. Keterbatasan ini dapat diatasi dengan modifikasi. TiO2 yang telah
dimodifikasi oleh doping ion logam dan fotosensitisasi oleh berbagai senyawa
organik dan anorganik berwarna, penambahan dopant dapat memperpanjang
foto-respon.
Terdapat beberapa variabel bagaimana dopan mempengaruhi fotoaktivitas TiO2, antara lain metode sintesis dari fotokatalis, ukuran partikel,
dan zat warna yang digunakan untuk mempelajari fotokatalis. Efisiensi fotokatalitik biasanya meningkat dengan adanya logam karena elektron-hole
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
11
Ion logam ditambahkan ke dalam polikristalin TiO2 untuk meningkatkan
penyerapan sinar matahari. Oleh karena itu, penelitian tentang peningkatan katalis telah dilakukan dengan modifikasi fisik dan kimia TiO2 untuk meningkatkan
kinerja katalis dan sensitisasi dye untuk meningkatkan jangkauan panjang
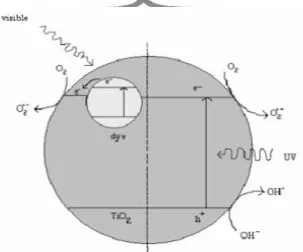
gelombang dengan memanfaatkan radiasi matahari. Prinsip degradasi fotosensitisasi pada semikonduktor diilustrasikan pada Gambar 4.
Gambar. 4 Mekanisme TiO2 di bawah UV dan cahaya tampak ( Kaur, 2007)
Jika potensial oksidasi dari sensitizer lebih tinggi dibanding band konduktansi TiO2, menyusul eksitasi awal pewarna yang terserap di bawah sinar
cahaya, elektron dimasukkan dari dye yang tereksitasi ke dalam pita konduksi
TiO2. Dengan perlahan mampu mengurangi langkah pembentukan yang
memungkinkan untuk memulai degradasi oksidatif dye. Berbagai senyawa
commit to user
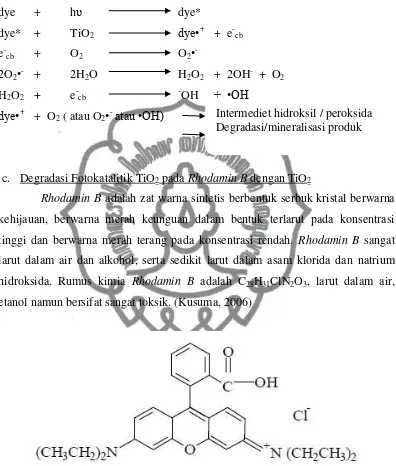
Mekanisme photosensitization untuk degradasi dye pada permukaan TiO2
ditampilkan di bawah ini:
dye + hʋ dye*
dye* + TiO2 dye•+ + e-cb
e-cb + O2 O2•
-2O2•- + 2H2O H2O2 + 2OH- + O2
H2O2 + e-cb -OH + •OH
dye•+ + O
2 ( atau O2•-atau •OH) peroxide or hydroxyl intermediates
degraded or mineralised products
c. Degradasi Fotokatalitik TiO2 pada Rhodamin B dengan TiO2
Rhodamin B adalah zat warna sintetis berbentuk serbuk kristal berwarna
kehijauan, berwarna merah keunguan dalam bentuk terlarut pada konsentrasi tinggi dan berwarna merah terang pada konsentrasi rendah. Rhodamin B sangat
larut dalam air dan alkohol, serta sedikit larut dalam asam klorida dan natrium hidroksida. Rumus kimia Rhodamin B adalah C28H31ClN2O3, larut dalam air,
etanol namun bersifat sangat toksik. (Kusuma, 2006)
Gambar 5. Struktur Rhodamin B (Wirasto, 2008)
Rhodamin B merupakan zat warna golongan xanthenes dyes. Rhodamine
B (C28N31N2O3Cl) adalah bahan kimia sebagai pewarna dasar untuk berbagai
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
13
berkembang untuk berbagai keperluan yang berhubungan dengan sifatnya yang berfluorensi dalam sinar matahari.
Rhodamin B termasuk senyawa atau molekul yang memberikan warna
akibat adanya gugus kromofor, dimana gugus kromofor tersebut yaitu quinoid. Kuantitas warna yang ditimbulkan Rhodamin B sangat tajam, hal ini disebabakan
oleh adanya dua gugus auksokrom, dimana gugus auksokrom tersebut adalah dietil amin.
Proses pembuatan zat warna sintetik biasanya melalui perlakuan pemberian asam sulfat dan asam nitrat yang sering kali terkontaminasi oleh logam berat seperti arsen, atau logam berat lain yang bersifat racun. Pada pembuatan zat pewarna organik sebelum mencapai produk akhir harus melalui suatu senyawa antara dulu, yang kadang-kadang berbahaya. Sering kali dalam proses reaksi tersebut terbentuk senyawa baru yang berbahaya yang lebih tertinggal sebagai residu dalam bahan pewarna tersebut.
Reaksi fotodegradasi merupakan reaksi pemecahan senyawa oleh adanya cahaya atau foton dan katalis secara bersama-sama sehingga katalis ini dapat mempercepat fotoreaksi melalui interaksinya dengan substrat baik dalam keadaan dasar atau dalam keadaan tereksitasi dan foto produk utamanya tergantung pada fotoreaksi tersebut.
Fotodegradasi merupakan sebuah teknik yang relatif baru untuk pengolahan polutan air dan udara. Polutan yang berupa senyawa organik didestruksi secara oksidatif dengan menggunakan cahaya. Pada proses degradasi ini dikenal dua macam senyawa yang ditambahkan untuk mempercepat proses degradasi senyawa organik, yaitu oksidan kimia dan fotokatalis yang biasanya berupa semikonduktor fotoaktif, seperti TiO2, ZnO atau CdS.
Sinar matahari yang keberadaannya melimpah di alam ini menjadikan proses ini membutuhkan biaya yang rendah (low cost). Sinar matahari yang
langsung mempunyai salah satu fraksi energi pada daerah UV dekat yang dapat digunakan dalam induksi fotodegradasi.
Berdasarkan pengukuran laser flash photolysis Hoffman et al., (1995)
commit to user
pembentukan pembawa muatan (hole, h+vb dan elektron, ecb- ), pengikatan
pembawa muatan oleh hidrat primer TiO2, serta transfer muatan pada daerah
antarmuka antara hole yang terjebak pita valensi dengan senyawa yang bersifat donor elektron (pada proses ini terjadi oksidasi senyawa tersebut) atau transfer muatan antar elektron yang terjebak pada pita konduksi dengan senyawa yang bersifat akseptor elektron sehingga senyawa tersebut mengalami reduksi. Proses oksidasi-reduksi tersebut yang memungkinkan terjadinya degradasi gugus-gugus kromofor pada zat warna sehingga terjadi penghilangan warna limbah. Bila sinar dengan panjang gelombang pendek (dibawah ~390 nm) ini mengiluminasi serbuk
anatase (TiO2), elektron pada pita valensi akan tereksitasi ke pita konduksi
menghilangkan hole positif (h+). Hole-hole ini bereaksi dengan ion-ion hidroksida dalam uap air yang teradsobsi pada permukaan TiO2, menghasilkan radikal
hidroksida (OH•). Radikal hidroksil ini merupakan reagen oksidasi yang sangat kuat dan dapat bereaksi dengan senyawa organik menghasilkan produk-produk sederhana, misalnya CO2, H2O, atau HCl jika senyawa tersebut mengandung
klorida.
TiO2 + hv h+vb + eeb
-h +vb + OH- OH•
Senyawa organik + OH• CO2 + H2O
Secara keseluruhan mekanisme reaksi yang terlibat dalam reaksi redoks terkatalisis semikonduktor ini masih belum jelas meskipun dalam banyak kasus, adsorbsi substrat pada artikel diyakini sebagai tahap awal reaksi.
3. Karakterisasi TiO2 dan TiO2– Cr2O3
a. X-Ray Diffactometer (XRD)
Untuk mengetahui kristalinitas suatu zat padat, instrumen yang biasa digunakan adalah X-ray difraction (XRD). Setiap kristal mempunyai harga d yang
khas sehingga dengan mengetahui harga d maka jenis kristalnya dapat diketahui. Referensi harga d dan intensitas suatu senyawa dapat diperoleh dari data Joint
Commite on Powder Diffraction Standars (JCPDS) yang bersumber dari
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
15
elektromagnetik dengan panjang gelombang pendek sekitar 100 pm yang dihasilkan dari penembakan logam dengan elektron energi tinggi. Bila elektron–elektron dari kawat pijar yang dipanasi dipercepat melalui suatu perbedaan potensial yang besar dan diperbolehkan menumbuk suatu sasaran logam di dalam sebuah tabung sinar X maka sinar X dihasilkan dengan suatu distribusi λ yang kontinyu. Jika sinar X itu kemudian menumbuk sebuah kristal, maka sinar X yang akan direfleksikan akan membentuk titik–titik luas yang sangat tinggi intensitasnya pada sebuah layer/film. Titik–titik itu ditimbulkan oleh interferensi konstruktif dari gambar–gambar kecil yang dihasilkan oleh banyak atom (Smart dan Moore, 2005).
Difraksi sinar X atau biasa disebut XRD merupakan alat yang digunakan untuk mengetahui pengaturan atom-atom dalam sebuah tingkat molekul. Pengaturan atom-atom tersebut dapat diinterpretasikan melalui analisa d spasing dari data difraksi sinar X. Selain nilai d spasing, observasi tingkat kristalinitas bahan dan perubahan struktur mesopori dapat pula diketahui melalui data difraksi sinar X. Puncak yang melebar menunjukkan kristalinitas rendah (amorf), sedangkan puncak yang meruncing menunjukkan kristalinitas yang lebih baik (Smart dan Moore, 2005).
Nilai d spasing tidak dapat digunakan untuk menentukan jarak interatom dari suatu molekul, namun dapat digunakan untuk merefleksikan jarak interplanar atau jarak interlayer antar kisi-kisi atom dalam suatu material. Nilai d spasing sangat tergantung pada pengaturan atom dan struktur jaringan polimer dalam material. Jarak interplanar atau interlayer dapat dikalkulasikan melalui persamaan Bragg’s (Park et al., 2002) :
2 d sin θ = n λ Keterangan :
commit to user
Langkah-langkah yang ditempuh dalam analisa kualitatif adalah sebagai berikut :
1. Membuat pola difraksi dari zat tidak diketahui.
2. Menghitung nilai d setiap garis atau dengan menggunakan tabel yang memberikan hubungan antara d dan 2 θ untuk berbagai karakteristik. 3. Memandang data d eksperimental dengan data d dari tabel dengan
kemungkinan kesalahan dalam setiap set nilai adalah 0,02 Å. 4. Membandingkan intensitas relatifnya dengan nilai-nilai yang ada pada
tabel (standar).
Kristal TiO2 fase anatase dan fase rutile teridentifikasi pada 2θ = 25,3˚
untuk fase anatase dan 2θ = 27,3˚ untuk fase rutile (Gonzales, 1996). Pada
penelitian lain yang dilakukan Wei dan Chen. (2009) puncak yang ditunjukkan untuk fase anatase pada 2θ = 25,36˚- 25,48˚. Li et al. (2007) dalam penelitiannya
mendapatkan karakterisasi anatase dengan menggunakan XRD muncul puncak
pada 2θ = 25,5˚.
Data XRD juga dapat digunakan untuk perhitungan semi kuantitatif dimana dapat digunakan untuk mengetahui presentase relatif masing-masing kristal yang ada dalam suatu komposit. Analisa tersebut dapat diperhitungkan dengan mengkalkulasi intensitas puncak masing–masing kristal kemudian dibandingkan dengan intensitas total komposit. Sedangkan khusus dalam perhitungan presentase anatase rutile dalam kristal TiO2 murni dapat digunakan
persamaan berikut : (Riyas et al., 2008)
atau
Keterangan:
IA = Intensitas Anatase
IR = Intensitas Rutile
b. Fourier Transform Infra Red (FTIR)
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
17
molekul-molekulnya dapat menyerap (mengabsorpsi) energi dan terjadilah transisi diantara tingkat vibrasi dasar (ground state) dan tingkat vibrasi tereksitasi (excited
state). Spektrum infra merah memberikan informasi tentang gugus fungsional
suatu molekul (Silverstain et al., 2005).
Radiasi infra merah (IR) merupakan bagian dari spektrum elektromagnetik yang terletak diantara sinar visible dan daerah microwave.
Penggunaan terbesar terdapat pada daerah bilangan gelombang 400-4000 cm-1.
Posisi ikatan pada spektra infra merah ditunjukkan dengan bilangan gelombang ( ʋ ) dengan satuan cm-1. Panjang gelombang ( λ ) digunakan dalam literatur dengan satuan micrometer (μm) (Silverstain et al., 2005).
c. Spektrofotometer UV-Visible (UV-Vis)
Pada spektrofotometer UV, sinar kontinyu dihasilkan oleh lampu awan muatan hidrogen atau deuterium (D2), sedangkan sinar visibel dihasilkan oleh
lampu wolfram. Panjang gelombang cahaya UV-Vis jauh lebih pendek daripada panjang gelombang radiasi IR. Panjang gelombang UV-Vis berada pada kisaran 180 – 800 nm.
Prinsip dasar spektrofotometer UV-Vis adalah terjadinya transisi elektronik yang disebabkan penyinaran sinar UV-Vis yang mampu mengeksitasi elektron dari orbital yang kosong. Umumnya, transisi yang paling mungkin adalah transisi pada tingkat tertinggi (HOMO) ke orbital yang kosong pada tingkat terendah (LUMO). Pada sebagian besar molekul, orbital molekul terisi pada tingkat energi terendah adalah orbital σ, sedangkan orbital π berada pada tingkat energi yang lebih tinggi. Orbital non ikatan (n) yang mengandung elektron – elektron yang belum berpasangan berada pada tingkat energi yang lebih tinggi lagi, sedangkan orbital-orbital anti ikatan yang kosong yaitu π* dan σ* menempati tingkat energi yang tertinggi (Hendayana, 1994).
Absorpsi cahaya UV-Vis mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke
commit to user
promosi elektron. Molekul–molekul yang memerlukan lebih banyak energi untuk promosi elektron akan menyerap pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi yang lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang. Senyawa yang menyerap cahaya pada daerah tampak adalah senyawa yang berwarna karena mempunyai elektron yang lebih mudah dipromosikan daripada senyawa yang menyerap pada panjang gelombang UV yang lebih pendek.
Intensitas penyerapan dijelaskan dengan hukum Lambert – Beer, dimana fraksi cahaya yang diabsorbsi tidak tergantung pada kekuatan sumber cahaya mula-mula dan fraksi yang diabsorpsi tergantung pada banyaknya mol (ketebalan/konsentrasi) yang dapat mengabsorbsi. Oleh karena itu absorpsi cahaya merupakan fungsi dari molekul yang mengabsorbsi, maka cara yang tepat untuk menyatakan absorbansi adalah (Underwood, 1998):
A = ε . b . C Keterangan:
ε = Absorbtivitas molar (mol-1 cm-1 L)
b = Tebal lintasan ( cm )
C= Konsentrasi larutan (mol L-1)
Pada analisa fotodegradasi dilakukan pengaman pada penurunan absorbansi pada larutan yang akan didegradasi. Kemudian akan ditentukan persentase larutan yang terdegradasi. Penentuan persentase larutan yang terdegradasi dapat menggunakan persamaan berikut: (Austero dan De Luna, 2011)
Dimana, Y Absorbance Reduction = Persen penurunan absorbansi ; ABSi =
Absorbansi larutan mula – mula ; ABSt = Absorbansi larutan pada waktu tertentu.
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
19
d. X-Ray Fluoresence (XRF)
Tehnik fluoresensi sinar X (XRF) merupakan suatu tehnik analisis yang dapat menganalisis unsur – unsur yang membangun suatu material. Tehnik ini juga dapat digunakan untuk menentukan konsentrasi unsur berdasarkan pada panjang gelombang dan jumlah sinar X yang dipancarkan kembali setelah suatu material ditembaki sinar X berenergi tinggi.
Dasar analisis Fluoresensi sinar–X adalah pencacahan sinar X yang dipancarkan oleh suatu unsur akibat pengisian kembali kekosongan elektron pada orbital yang lebih dekat dengan inti karena terjadinya eksitasi elektron) oleh elektron yang terletak pada orbital yang lebih luar. Ketika sinar-X yang berasal dari radioisotop sumber eksitasi menabrak elektron dan akan mengeluarkan elektron kulit dalam, maka akan terjadi kekosongan pada kulit itu. Elektron dari kulit yang lebih tinggi akan mengisi kekosongan itu. Perbedaan energi dari dua kulit itu akan tampil sebagai sinar-X yang dipancarkan oleh atom (Sumantry, 2011). Komposisi kimia komposit dapat ditentukan dengan penentuan prosentase logam yang ada dalam komposit dengan metode spektroskopi fluoresensi sinar-X (Kunarti et al., 2009).
B.Kerangka Pemikiran
TiO2 mempunyai tiga macam bentuk kristal yaitu anatase, rutile dan
brookite, namun yang memiliki aktivitas fotokatalis yang terbaik adalah bentuk
anatase tetapi anatase merupakan bentuk tidak stabil dari titanium dioksida yang
mudah berubah ke bentuk rutile yang merupakan bentuk stabil dari titanium
dioksida. Bentuk kristal anatase diamati pada pemanasan TiO2 bubuk mulai dari
suhu 120 oC dan mencapai sempurna pada suhu 500 oC. Pada temperatur yang tinggi terjadi transformasi bentuk kristal anatase menjadi rutile dan terjadi
penurunan luas permukaan serta pelemahan aktivitas fotokatalis secara drastis. Perubahan struktur ini dikarenakan terputusnya dua ikatan Ti-O dalam struktur
anatase, memungkinkan terjadinya penataan ulang dari Ti-O oktahedral, yang
commit to user
dilakukan modifikasi semikonduktor TiO2 dengan menambahkan senyawa logam
oksida, surfaktan, dan non logam. Maka dengan menambahkan jenis unsur lain ke dalam molekul TiO2 dapat menghambat perubahan bentuk kristal titanium
dioksida ke bentuk rutile yang merupakan bentuk TiO2 yang stabil dan dapat
memperbaiki aktivitas dan efisiensi katalitik dengan menghambat proses rekombinasi elektron-hole selama proses katalitik berlangsung. Dengan
penambahan kromium pada TiO2 dapat menghambat perubahan anatase ke
bentuk rutile pada pemanasan di atas 500 oC. Penelitian yang telah dilakukan oleh
Pirault et al., (2007) Pada penambahan 20 % Cr2O3 dapat menghambat
transformasi bentuk kristal TiO2 anatase menjadi rutile. Terhambatnya
transformasi ke bentuk rutile dengan menghambat perkembangan ukuran kristal
TiO2 karena ukuran kristal TiO2 anatase ~ 20 nm, seiring dengan kenaikan suhu
maka ukuran kristal akan naik, ini yang menyebabkan pada suhu tinggi bentuk kristal anatase terkonversi menjadi rutile karena pada suhu ini ukuran kristal
mencapai ~ 30 nm. Hal tersebut dikarenakan ukuran kristal dihambat oleh adanya senyawa lain yang ditambahkan, sehingga ukurannya relatif kecil. Maka dengan penambahan Cr3+diharapkan dapat menekan transformasi anatase menjadi rutile
serta dapat memperbaiki aktivitas dan efisiensi katalitik pada TiO2. Pada
Berbagai senyawa berwarna telah diselidiki dapat bertindak sebagai fotosensitizers. Kristal Cr2O3 berbentuk heksagonal berwarna hijau muda hingga
hijau tua sehingga dapat dipakai untuk alternatif dalam memperbesar keterbatasan sensitivitas spektral dari semikonduktor dengan gap energi yang tinggi, dilakukan modifikasi permukaan dengan menggunakan molekul sensitiser berwarna. Beberapa semikonduktor seperti TiO2 mempunyai gap energi yang tinggi,
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
21
adanya sensitiser berwarna dapat memperbaiki sifat fotokalis pada TiO2.
Perubahan pada fotoreaktivitas partikel TiO2 yang berukuran nano akan
menyebabkan aktif fotokalis.
Preparasi titanium dioksida dilakukan dengan teknik sol-gel menggunakan prekursor TTIP (Titanium Tetra Isopropoksida) dengan pelarut CH3COOH,
selanjutnya ditambahkan dengan Cr(NO3)3.9H2O dan urea menggunakan metode
wet-impregnation dapat menghasilkan komposit TiO2-Cr2O3. Komposit TiO2
-Cr2O3 dapat digunakan untuk fotodegradasi zat warna Rhodamin B. Prinsip umum
fotokatalis TiO2 yaitu suatu semikonduktor mendapatkan energi dari cahaya atau
foton kemudian bertindak sebagai substrat fotokatalitik dengan memproduksi radikal yang sangat reaktif yang dapat mengoksidasi senyawa organik. Degradasi zat warna Rhodamin B dapat dilakukan pada foton atau cahaya dengan panjang
gelombang sinar visibel dengan menggunakan lampu visibel karena keberadaan oksida Cr2O3 yang berperan sebagai sensitiser.
C.Hipotesis
Berdasarkan kerangka pemikiran tersebut dapat diajukan hipotesis sebagai berikut :
1. Penambahan Cr3+ pada TiO2 akan mempengaruhi pertumbuhan kristal TiO2
dengan menekan pertumbuhan TiO2 faserutile dan dapat terjadi substitusi
antara Ti dan Cr.
2. Penambahan Cr3+pada TiO2 akan meningkatkan aktivitas fotokatalis TiO2
commit to user
22
BAB III
METODELOGI PENELITIAN
A.Metodologi Penelitian
Penelitian ini menggunakan metode eksperimental secara laboratoris untuk memperoleh data hasil. Pada penelitian ini dilakukan preparasi semikonduktor TiO2 dan komposit TiO2-Cr2O3 serta uji aktifitasnya untuk fotodegradasi zat
warna Rhodamin B.
Komposit TiO2-Cr2O3 disintesis dengan metode wet impregnation yang
kemudian diikuti dengan proses kalsinasi. Variasi suhu kalsinasi yaitu 300 °C, 400 °C, 500 °C, 600 °C, dan 700 °C.
Terhadap hasil preparasi dilakukan karakterisasi dengan menggunakan XRD (X-Ray Diffraction) untuk mengidentifikasi kristalinitas material dan
struktur kristal, XRF (X-Ray Flouresence) untuk mengetahui komposisi TiO2 dan
Cr2O3 dan FT-IR untuk membuktikan adanya serapan bilangan gelombang dari
TiO2 maupun Cr2O3.
Kemudian dilakukan uji aktifitas komposit TiO2-Cr2O3 untuk
mendegradasi zat warna Rhodamin B menggunakan sinar visibel dengan variasi
waktu penyinaran dan analisis dengan spektrofotometri UV-Vis dengan panjang
gelombang 553 nm.
B.Tempat dan Waktu Penelitian
Penelitian ini akan dilakukan di Sub Laboratorium Kimia UPT Laboratorium Pusat Universitas Sebelas Maret Surakarta pada bulan Juli- November 2011.
C.Alat dan Bahan
1. Alat-alat yang digunakan
a. Peralatan gelas
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
23
c. Spektrofotometer UV-Vis (Perkin Elmer Lambda 25)
d. Spektrofotometer FT-IR (Shimadzu PC 8201)
e. Spektrofotometer XRF (JEOL Element Analyzer JSX-3211)
f. Furnace (Thermolyne 48000)
g. Neraca analisis(Sartorius BP 110, maksimum 110 g; minimum 0,001 g)
h. Oven (Memmert)
i. Penangas air
j. Lampu Halogen (Osram, 35 watt; 12 volt)
k. Stop watch
l. Magnetic stirer
m.Statif dan Klem
n. Termometer 150 oC
o. Pemanas (Hot plate)
p. Spatula
2. Bahan yang digunakan
a. Titanium Tetraisopropoksida (TTIP) p.a (Merck)
b. Cr(NO3)3.9H2O (Merck)
c. Urea (Merck)
d. Asam Asetat glasial (CH3COOH) 98,5 % (Merck)
e. Aquades (Lab. Kimia Pusat FMIPA UNS)
commit to user
g. Batu es
h. Kertas Indikator Universal
D. Prosedur Penelitian
1. Preparasi TiO2
Larutan TTIP dihidrolisis dengan asam asetat berlebih untuk memelihara suspensi dari partikel terhadap aglomerasi. 10 ml TTIP di hidrolisis dengan asam asetat pH 2 sebanyak 100 ml. Setelah itu suhu larutan diturunkan menjadi 10-15 °C hingga terbentuk suspensi sol TiO2 transparan (bening) pada akhir
tahapan hidrolisis. Campuran TiO2 selanjutnya dipanaskan pada suhu maksimum
90 °C diatas pemanas (hot plate) hingga terbentuk suspensi sol TiO2. Kemudian
suspensi sol TiO2 dipanaskan 150 °C selama 24 jam (over night) di dalam oven
hingga terbentuk xerogel TiO2 berwarna putih. Selanjutnya xerogel TiO2 akan di
gunakan sebagai stock untuk preparasi komposit maupun karakterisasi. Dalam pembuatan standar xerogel TiO2 dikalsinasi selama 4 jam dengan variasi suhu
150 °C, 300 °C, 400 °C, 500 °C, 600 °C, dan 700 °C dengan kecepatan furnace 10 ˚C/menit. Kemudian dari hasil kalsinasi dilakukan karakterisasi yang digunakan sebagai standar.
2. Preparasi Komposit TiO2-Cr2O3
0,8 gram TiO2 di tambahkan dengan 4 gram Cr(NO3)3.9H20 dan 3 gram
urea yang telah di larutkan dalam 100 ml aquades. Campuran tersebut diaduk dengan pengaduk magnetik hingga homogen. Campuran tersebut kemudian di panaskan pada suhu 110 °C selama 2 hari. Setelah terbentuk serbuk, kemudian
powder tersebut di kalsinasi dengan variasi suhu 300 °C, 400 °C, 500 °C, 600 °C,
dan 700 °C yang masing – masing selama 4 jam dengan kecepatan furnace 10 ˚C /menit. Kemudian masing – masing komposit TiO2-Cr2O3 yang terbentuk di
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
25
3. Karakterisasi Komposit TiO2- Cr2O3
Karakterisasi dengan difraksi sinar-X dilakukan untuk menentukan fase kristal dan kristalinitas material, karakterisasi dengan spektrofotometer Infra Merah di lakukan untuk membuktikan adanya serapan bilangan gelombang dari TiO2 maupun Cr2O3 dan karakterisasi XRF untuk mengetahui komposisi antara
TiO2 dan Cr2O3.
4. Fotodegradasi Zat Warna Rhodamin B
Sampel standar TiO2 dankomposit TiO2-Cr2O3 dari berbagai hasil variasi
suhu kalsinasi di masukkan ke dalam erlenmeyer masing – masing 0,01 gram TiO2-Cr2O3 ditambah 25 ml Rhodamin B 5 ppm dan di lakukan pengadukan.
Erlenmeyer di tutup dengan plastik transparan, selanjutnya di sinari dengan sinar Visibel dalam reaktor dengan variasi waktu 0, 30, 60, 120, dan 180 menit. Kemudian masing-masing larutan di analisis dengan spektrofotometer UV-Vis pada panjang gelombang antara 400-800 nm.
E.Teknik Pengumpulan Data dan Analisis Data
1.Pengumpulan Data
Data yang diambil untuk karakterisasi standar TiO2 dan komposit TiO2
-Cr2O3 dengan menggunakan X-Ray Diffraction, FT-IR, dan X-Ray Fluoresence.
X-Ray Diffraction akan didapatkan nilai 2θ komposit untuk identifikasi hasil
sintesis sistem kristal dan untuk mengetahui rasio anatase dan rutile.
Karakterisasi gugus fungsional untuk mengetahui struktur digunakan FT-IR. Data komposisi TiO2 dan Cr2O3 dalam komposit diketahui dengan menggunakan X-Ray
Fluoresence. Aplikasi komposit untuk fotodegradasi zat warna Rhodamin B
commit to user
2.Analisa Data
Pola difraksi sinar X dari komposit TiO2-Cr2O3 akan dianalisa secara
kualitatif dan kuantitatif. Analisa kualitatif dilakukan dengan membandingkan harga 2θ dan I/I1 dari spektrum difraksi komposit hasil sintesis dengan spektrum
difraksi standar JCPDS (Joint Commite Powder Difraction Standart). Analisa
kuantitatif dilakukan dengan menghitung rasio anatase dan rutile. Sedangkan
untuk modifikasi TiO2-Cr2O3 dapat dicari difraktogram pada jurnal yang
menganalisis senyawa yang sama.
Analisa degragasi zat warna Rhodamin B sebelum dan sesudah penyinaran
sinar visibel dilakukan dengan mengukur serapan panjang gelombang menggunakan spektroskopi UV-Vis. Pengurangan nilai absorbansi menunjukkan adanya degradasi zat warna Rhodamin B akibat fotodegradasi oleh material
commit to user
27
BAB IV
HASIL DAN PEMBAHASAN
F. Sintesis TiO2 (Titanium Dioksida)
Sintesis material TiO2 yang dilakukan melalui proses sol-gel seperti
penelitian yang dilakukan oleh Wahyuningsih et al. (2007). Jika menginginkan
bentuk kristal anatase lebih banyak dibandingkan dengan rutile atau bentuk
brookite pada hasil sintesis TiO2 maka diperlukan optimasi kondisi sintesis dan
strategi – strategi tertentu.
Bahan awal dalam sintesis TiO2 adalah TTIP (Titanium
Tetraisopropoksida) yang dimasukkan ke dalam asam asetat glasial dalam suasana asam (pH = 2) dan dibawah suhu kamar dimana asam asetat glasial diletakkan pada gelas beker yang berada pada penangas berisi es batu. Penambahan TTIP ke dalam asam asetat glasial dilakukan dalam suhu rendah skitar 10 - 15 oC dengan harapan agar tidak terjadi aglomerasi pada TTIP. Campuran tersebut kemudian dihomogenkan dengan menggunakan pengaduk magnetik hingga campuran bening. Campuran tersebut kemudian dipanaskan secara bertahap sampai suhu 90
oC untuk pembentukan suspensi sol gel hingga asam asetat pada campuran
tersebut menguap. Setelah terbentuk suspensi sol gel untuk menghilangkan pengotor-pengotor organik dan sisa pelarut dilakukan pemanasan dalam oven selama 24 jam dengan suhu 150 oC. Langkah terakhir yang dilakukan adalah perlakuan termal pada variasi suhu kalsinasi yaitu 150 oC, 300 oC, 400 oC, 500
oC, 600 oC, dan 700 oC selama 4 jam sehingga dihasilkan kristal TiO 2.
Reaksi secara keseluruhan dari sintesis TiO2 dari TTIP dapat ditunjukkan
dengan reaksi:
Ti(iPr)4 + CH3COOH H+ Sol TiO2
Sol TiO2 90 oC Sol gel TiO2
Sol gel TiO2 150 oC xerogelTiO2
commit to user
G.Sintesis Komposit TiO2-Cr2O3
Komposit TiO2-Cr2O3 disintesis dengan metode wet impregnation seperti
penelitian yang dilakukan oleh Riyas et al. (2002) yang dilakukan dengan dua
tahapan yaitu penambahan akuades sebagai pelarut dan pemanasan, sedangkan pembuatan Cr2O3 mengacu pada penelitian yang dilakukan Music et al. (1999).
Langkah awal sintesis komposit ini dengan cara 4 gram Cr(NO3)3.9H2O
dilarutkan dalam akuades dengan pengadukkan magnetik hingga homogen kemudian diikuti penambahan urea sebanyak 3 gram yang diaduk dengan
Cr(OH)3. Campuran tersebut dikeringkan dalam oven selama 2 hari pada suhu 110 oC untuk menguapkan pelarut dan menghilangkan pengotor - pengotor organik,
selanjutnya dikalsinasi dengan variasi suhu 300 oC, 400 oC, 500 oC, 600 oC, dan
700 oC selama 4 jam sehingga dihasilkan komposit TiO2-Cr2O3.
Mekanisme pertumbuhan Cr2O3 yang ditambahkan pada TiO2 secara
skematik dapat dijelaskan dengan reaksi sebagai berikut: Cr3+ + 3H2O Cr(OH)3 + 3H+ pengendapan hidroksida. Perlakuan hidrotermal merubah Cr(OH)3 menjadi
CrOOH yang selanjutnya bertransisi menjadi Cr2O3 dikarenakan Cr2O3 lebih tahan
perpustakaan.uns.ac.id digilib.uns.ac.id
TiO2-Cr2O3. Hasil analisa XRDtersebut kemudian dibandingkan dengan JCPDS
(Joint Commite Powder Diffraction Standart) dan jurnal yang bersangkutan.
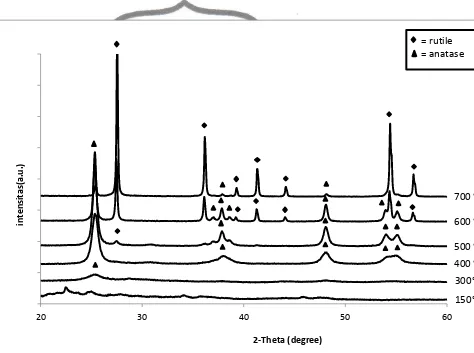
Gambar 6. Spektra difraksi sinar-X dari TiO2 murni dengan variasi suhu 150 oC
-700 oC
Hasil analisa XRD untuk TiO2 murnidapat ditunjukkan pada Gambar 6.
Pada gambar tersebut menunjukkan perbandingan difraktogram TiO2 murni
dengan variasi suhu. Pada spektra difraksi sinar-X TiO2 murni suhu 150 oC dan
300 oC belum banyak informasi yang dapat diperoleh karena pada suhu ini TiO2
commit to user
murni masih dalam bentuk amorf (belum terbentuk kristal). Pada suhu 400 oC kristal mulai terbentuk, dari gambar spektra hasil XRD diketahui muncul puncak yang mengindikasikan TiO2 anatase yang ditunjukkan dengan puncak di daerah
2θ = 25,35o (d101 = 3,5091 Å), 2θ = 37,95o (d004 = 2,3679 Å), dan 2θ = 48,15o (d200
= 1,8874 Å), 2θ = 54,86o (d211 = 1,6716 Å) dan 2θ = 55,01o (d211 = 1,6674 Å)
sesuai dengan standar JCPDS No. 782-486, Pada suhu 500 oC mulai muncul puncak yang mengindikasikan TiO2 rutile yang ditunjukkan dengan puncak
daerah 2θ = 27,50o (d110 =3,2394 Å) sesuai dengan standar JCPDS No. 870-710,
puncak rutile ini pada suhu 600 oC dan 700 oC intensitasnya semakin tinggi
sedangkan pada puncak 2θ = 25,35o (d
101 = 3,5091 Å) intensitasnya semakin
rendah yang berarti semakin tinggi suhu semakin banyak TiO2 anatase yang
terkonversi menjadi rutile dikarenakan rutile merupakan bentuk stabil dari TiO2.
Pada suhu 600 oC kristalinitas kristal yang terbentuk semakin baik sehingga puncak-puncak yang terbentuk semakin terlihat jelas, muncul puncak-puncak baru yang mengindikasikan TiO2 rutile dan TiO2 anatase. TiO2 rutile ditunjukkan
dengan puncak di daerah 2θ = 36,10o (d101 = 2,4849 Å), 2θ = 39,20o (d200 = 2,2952
Å), 2θ = 41,25o (d111 = 2,1857 Å), 2θ = 44,05o (d210 = 2,0531 Å), 2θ = 54,36o (d211
= 1,6858 Å), 2θ = 56,66o (d220 = 1,6227 Å) sesuai dengan standar JCPDS No.
870-710 sedangkan TiO2 anatase ditunjukkan dengan puncak di daerah 2θ = 37,05o
(d004 = 2,48493 Å) dan 2θ = 38,55o (d112 = 2,3324 Å) sesuai dengan standar
JCPDS No. 782-486. Pada suhu 700 oC puncak-puncak yang mengindikasikan
TiO2 anatase intensitasnya menurun drastis dan sebagian puncak TiO2 anatase
menghilang sedangkan puncak yang mengindikasikan TiO2 rutile semakin tinggi
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
31
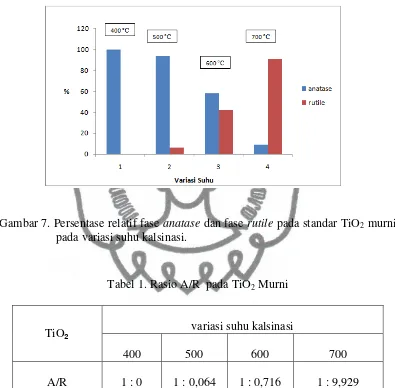
Untuk mengetahui persentase pembentukan masing-masing fase TiO2
murni dapat ditunjukkan pada Gambar 7.
Gambar 7. Persentase relatif fase anatase dan fase rutile pada standar TiO2 murni
pada variasi suhu kalsinasi.
Tabel 1. Rasio A/R pada TiO2 Murni
TiO₂ variasi suhu kalsinasi
400 500 600 700
A/R 1 : 0 1 : 0,064 1 : 0,716 1 : 9,929
Dari diagram batang dan tabel diatas menunjukkan bahwa pada suhu termal 400 oC dihasilkan TiO
2 anatase yang besar yaitu 100 % sedangan dengan
bertambahnya suhu kalsinasi maka dapat meningkatkan perubahan bentuk fase
TiO2 anatase menjadi fase TiO2 rutile. Dapat disimpulkan bahwa TiO2 anatase
tidak tahan terhadap suhu yang tinggi yang ditandai dengan perubahan bentuk dari fase anatase ke fase rutile yang semakin meningkat pada suhu kalsinasi 500 oC -
commit to user
Gambar 8. Spektra difraksi sinar-X dari material hasil sintesis dengan variasi suhu 300 oC -700 oC.
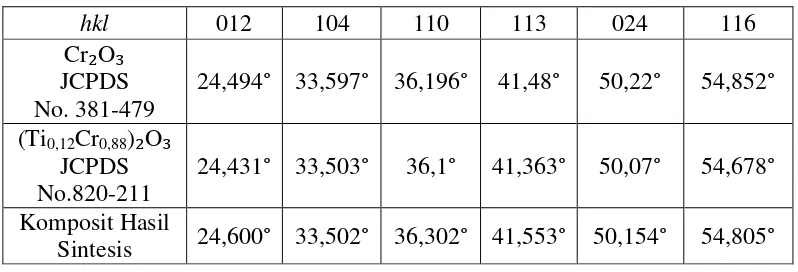
Tabel 2. Standar JCPDS dari Cr₂O₃ dan (Ti0,12Cr0,88)₂O₃ sebagai Pembanding
serta Komposit Hasil Sintesis.
hkl 012 104 110 113 024 116
Cr₂O₃ JCPDS
No. 381-479 24,494° 33,597° 36,196° 41,48° 50,22° 54,852° (Ti0,12Cr0,88)₂O₃
JCPDS
No.820-211 24,431° 33,503° 36,1° 41,363° 50,07° 54,678° Komposit Hasil
Sintesis 24,600° 33,502° 36,302° 41,553° 50,154° 54,805°
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
33
suhu. Pada suhu 400 oC secara keseluruhan spektra hasil XRD belum menunjukkan perbedaan yang signifikan dengan spektra hasil XRD pada suhu 300 oC, tetapi pada suhu 400 oC memiliki puncak yang lebih tinggi dan runcing bila dibandingkan dengan material hasil sintesis pada suhu 300 oC, hal ini dikarenakan semakin tinggi suhu akan mempengaruhi perkembangan kristal yang terbentuk. Pada suhu 400 oC kristal mulai terbentuk sedangkan pada suhu 300 oC masih dalam bentuk amorf sehingga puncak yang terbentuk tidak begitu runcing dan intensitasnya rendah, begitu juga dengan material hasil sintesis suhu 150 oC masih dalam bentuk amorf dan sangat higroskopis sehingga tidak dilakukan karakterisasi dengan XRD. Dari gambar spektra XRD material hasil sintesis suhu 300 oC dan 400 oC diketahui muncul puncak yang mengindikasikan Cr2O3 yang
ditunjukkan dengan puncak 2θ di daerah 2θ = 24,60o (d102 = 3,6144 Å), 2θ =
36,30o (d110 =2,4717 Å), 2θ = 41,55o (d113 = 2,1707 Å), 2θ = 54,80o (d116 = 1,6730
Å) yang sesuai dengan standar JCPDS No. 381-479 (Tabel 2), sedangkan puncak pada 2θ = 33,50o (d104 = 2,6716 Å), 2θ = 50,15o (d024 = 1,8167 Å)
mengindikasikan puncak (Ti0,12Cr0,88)2O3 sesuai dengan standar JCPDS No.
820-211(Tabel 2). Pada penelitian Chen et al, (2009) dan Gallardo et al, (2008)
sebagian dari TiO2 tersubtitusi dalam Cr2O3 sehingga puncak yang terdeteksi
sebagai (Ti0,12Cr0,88)2O3. Dari gambar spektra hasil XRD pada suhu 500 oC
diketahui muncul puncak baru yang mengindikasikan kehadiran TiO2 anatase
yang ditunjukkan dengan puncak di daerah 2θ = 25,30o (d101 = 3,5159Å) sesuai
dengan standar JCPDS No.782-486. Dari gambar spektra hasil XRD pada suhu 600 oC diketahui muncul dua puncak TiO2 anatase yang ditunjukkan dengan
puncak di daerah 2θ = 25,35o (d101 = 3,5091 Å) dan 2θ = 48,05o (d200 = 1,8911Å)
sesuai dengan standar JCPDS No. 782-486, sedangkan pada suhu kalsinasi 700 oC
puncak TiO2anatase mulai menurun intensitasnya.
Bila dibanding dengan TiO2 murni, TiO2 dengan penambahan Cr3+
meningkatkan kristalinitas yang ditunjukkan pada suhu 300 oC telah terbentuk
puncak-puncak yang lebih runcing sedangkan TiO2 murni hanya terlihat satu
puncak yang melebar yang di tunjukkan pada Gambar 6 dan 8. TiO2 dengan
commit to user
tinggi terbukti dengan tidak munculnya puncak rutile pada suhu 500 oC sedangkan
pada TiO2 murni mulai muncul puncak rutile pada suhu 500 oC dan terlihat jelas
pada suhu 600 oC-700 oC dengan puncak TiO2 rutile yang intensitasnya semakin
tinggi dan runcing dengan diikuti menurunnya intensitas pada puncak TiO2
anatase. Dengan kata lain TiO2 dengan penambahan Cr3+ mempunyai ketahanan
termal pada suhu tinggi dibanding dengan TiO2 murni dengan ditunjukkan tidak
terdapat puncak rutile dalam komposit sehingga penambahan Cr3+dapat menahan
kenaikkan ukuran kristal selama proses pemanasan berlangsung. Hal ini sesuai dengan penelitian yang dilakukan oleh Pirault et al. (2007) bahwa dengan
penambahan Cr3+ dapat menahan pertumbuhan ukuran kristal sehingga menahan
perubahan bentuk kristal ke bentuk rutile yang memiliki ukuran kristal ~30 nm.
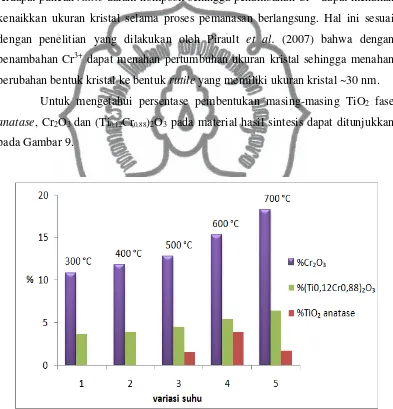
Untuk mengetahui persentase pembentukan masing-masing TiO2 fase
anatase, Cr2O3 dan (Ti0,12Cr0,88)2O3 pada material hasil sintesisdapat ditunjukkan
pada Gambar 9.
Gambar 9. Presentase relatif TiO2 fase anatase, Cr2O3 dan (Ti0,12Cr0,88)2O3 pada
perpustakaan.uns.ac.id digilib.uns.ac.id
commit to user
35
Dari diagram batang pada Gambar 9. menunjukkan bahwa semakin besar suhunya maka pembentukkan Cr2O3 dan (Ti0,12Cr0,88)2O3 semakin meningkat
sedangkan TiO2 fase anatase juga meningkat dari suhu 500 oC ke 600 oC dan
menurun pada suhu 700 oC. Terjadinya pembentukkan (Ti0,12Cr0,88)2O3 dan Cr2O3
akan mempengaruhi fotoaktivitas dalam mendegradasi Rhodamin B, dengan kata
lain pembentukkan (Ti0,12Cr0,88)2O3 dan Cr2O3 juga dapat mempengaruhi
fotoaktifitas seperti TiO2 anatase dan lebih lanjut dijelaskan dalam aktivitas
komposit dalam mendegradasi Rhodamin B.
2. Fourier Transform Infra Red (FT-IR)
Spektrum serapan inframerah suatu material mempunyai pola yang khas sehingga memungkinkan untuk mengidentifikasi material tersebut dan juga menunjukkan keberadaan gugus-gugus fungsional utama dalam struktur senyawa yang diidentifikasi. Selain itu analisa FT-IR digunakan untuk memperkuat identifikasi dari XRD. Analisa dari FT-IR dengan membandingkan hasil karakterisasi dari TiO2 dan komposit TiO2-Cr2O3 sehingga didapatkan