LAPORAN PRAKTIKUM
IDENTIFIKASI ASAM AMINO
DISUSUN OLEH :
HARTAMI TSANIA
(E1M015027)
PROGRAM STUDI PENDIDIKAN KIMIA
JURUSAN PENDIDIKAN MIPA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS MATARAM
IDENTIFIKASI ASAM AMINO A. Abstrak
Tujuan dilakukannya praktikum ini adalah untuk mengidentifikasi jenis asam amino dalam larutan protein secara kualitatif. Dalam praktikum ini, asam amino diidentifikasi dengan beberapa metode yakni uji kelarutan, uji ninhidrin, uji xantoprotein, uji millon, dan uji sulfur. Pada uji kelarutan yang menggunakan pelarut yang berbeda-beda yakni pada pelarut air, yang larut hanyalah glisin, sedangkan pada pelarut alkohol semua asam amino dan sampel tidal larut, kemudian pada pelarut HCl encer semua asam amino larut kecuali sampel, dan pada pelarut NaOH encer semua asam amino larut begitu juga sampel. Pada uji ninhidrin yang bereaksi positif adalah asam aspartat dan glisin yang ditandai dengan terbentuknta larutan berwarna biru atau ungu. Untuk uji xantoprotein, uji positif ditunjukkan oleh tirosin dan triptofan yang ditandai oleh terbentuknya warna kuning pada larutan. Pada uji Millon semua asam amino dan sampel menunjukkan reaksi negatif atau tidak terbentuk warna merah ataupun endapan merah. Dan pada uji sulfur, uji positif ditunjukkan oleh sistein dengan membentuk larutan berwarna cokelat. Oleh karena itu, dapat disimpulkan bahwa sampel yang berupa kasein mengandung asam amino yakni tirosin, triptofan, sistein, prolin, lisin, dan metionin.
Kata kunci : Asam amino, kasein, uji kelarutan, uji ninhidrin, uji xantoprotein, uji Millon, uji sulfur
B. Pendahuluan B.1 Latar Belakang
dalam jumlah yang besar sehingga bila kekurangan protein dapat menyebabkan berbagai macam penyakit yang dapat membahayakan tubuh.
Protein yang sangat berguna bagi kehidupan tersebut tersusun atas asam-asam amino. Asam amino adalah komponen utama yang menyusun protein yang terdapat dalam hampir semua organisme hidup. Asam amino sangat dibutuhkan anak-anak pada masa pertumbuhan dan juga dibutuhkan oleh orang dewasa untuk menjaga kesehatan. Di alam, asam amino jumlahnya mencapai ribuan bahkan ratusan jenis yang berbeda-beda. Namun, yang menyusun protein hanyalah 20 jenis asam amino, dimana asam-asam amino tersebut ada yang dapat disintesis atau dihasilkan oleh tubuh dan ada yang tidak dapat disintesis oleh tubuh. Karena tidak dapat disintesis oleh tubuh, maka asam amino tersebut dapat diperoleh dari makanan tertentu.
Menurut Rita Ramayulis (2014) kasein adalah salah satu protein susu yang jumlahnya tinggi, yaitu hingga mencapai 80 % dari keseluruhan protein yang ada di susu. Sehingga dapat diketahui bahwa kasein merupakan protein terbesar penyusun susu. Dimana di dalamnya tidak hanya terdapat zat-zat organik saja, namun juga mengandung zat-zat anorganik seperti kalsium, phosphor, dan magnesium. Selain itu, kasein juga mengandung sulfur yang terdapat pada metionin dengan jumlah 0,69 % dan sistin 0,09 %. Dalam keadaan yang murni, kasein akan berwarna putih seperti salju, tidak memiliki bau dan rasa. Oleh karena kasein mengandung asam amino yang penting, maka kasein sangat penting untuk dikonsumsi. Kelarutan kasein pada kondisi asam terbilang rendah sehingga pada pH yang rendah (keadaan asam) kasein akan mengendap.
ninhidrin, uji xantoprotein, uji millon, dan uji sulfur. Dimana pada setiap uji tersebut digunakan beberapa asam amino sebagai kontrol sehingga dapat diketahui kandungan asam amino dari kasein. Dengan melakukan percobaan tersebut, kita dapat mengetahui reaksi-reaksi yang terjadi pada asam amino, warna-warna yang terbentuk dari setiap reaksi asam amino tertentu. Bagaimana tingkat kelarutan asam amino tertentu dalam pelarut yang berbeda kepolarannya maupun tingkat keasamannya, ada atau tidaknya gugus aromatik maupun gugus fenol serta kandungan sulfur dalam suatu asam amino. Sehingga berdasarkan percobaan yang dilakukan, akan diketahui kandungan asam amino yang terdapat pada kasein.
B.2 Tinjauan Pustaka
Kata protein berasal dari protos atau proteos yang berarti pertama atau utama. Protein merupakan komponen penting atau komponen utama sel hewan atau manusia. Oleh karena sel itu merupakan pembentuk tubuh kita, maka protein yang terdapat dalam makanan berfungsi sebagai zat utama dalam pembentukan dan pertumbuhan tubuh. Proses kimia dalam tubuh dapat berlangsung dengan baik karena adanya enzim, suatu protein yang berfungsi sebagai biokatalis. Di samping itu hemoglobin dalam buir-butir darah merah atau eritrosit yang berfungsi sebagai pengangkut oksigen dari paru-paru ke seluruh bagian tubuh, adalah salah satu jenis protein. Demikian pula zat-zat yang berperan untuk melawan bakteri penyakit atau yang disebut antigen, juga suatu protein (Poedjiadi, 1994: 81).
sendiri dan disebut tidak esensial apabila spesies tersebut mampu memproduksinya sendiri (Purnomo, dkk, 2012: 1).
Glisin memiliki sebuah atom hidrogen sebagai rantai sisi, sehingga glisin merupakan asam amino yang paling sederhana dan paling kurang interaktif. Karena berukuran kecil, atom hidrogen menimbulkan rintangan sterik minimal. Oleh karena itu, glisin memberikan fleksibilitas struktur yang paling besar apabila glisin terdapat dalam suatu protein. Di lain pihak, asam amino prolin memberikan sedikit fleksibilitas dalam struktur protein. Atom nitrogennya melekat secara kovalen ke rantai sisi, membentuk sebuah cincin yang kaku. Alanin dan asam amino rantai bercabang (valin, leusin, dan isoleusin) memiliki rantai sisi alifatik, nonpolar, dan berukuran besar. Alanin mengandung sebuah gugus metil. Valin, leusin, dan isoleusin memiliki rantai bercabang yang hidrofobik. Asam amino aromatik secara strktural berkaitan dengan alanin. Terdapat sebuah cincin aromatik yang melekat ke karbon 3 (beta karbon), yang merupakan gugus metil alanin. Fenilalanin mengandung sebuah gugus fenil, yang sangat hidrofobik. Walaupun juga hidrofobik, tirosin dan triptofan lebih polar daripada fenilalanin karena tirosin mengandung gugus fenolat sedangkan triptofan memiliki sebuah nitrogen di gugus indolnya (Marks, dkk, 1996: 70).
oleh asam nitrat pekat membentuk nitrobenzena (Girindra, 1986) (Nurlely, dkk, 2014: 79).
Kasein (casein) merupakan senyawa fosfo-gliko protein berbentuk misela (diameter 0,1 μ), berikatan dengan kalsium fosfat dan sitrat yang meliputi 75% protein dalam susu sapi. Kasein alami terdiri atas protein 94%, kalsium (Ca) 35%, fosfor (P) 2,2%, asam sitrat 0,5 %, dan magnesium (Mg) 0,1%. Hasil pemecahan menyisakan suatu masa rantai protein hidrofobik akan membentuk kurd yang bersifat tidak larut, sepeti pada pembuatan keju. Kasein mengandung lisin, kekurangan sistin (0,4%) tetapi kaya akan metionin (kira-kira 3%), dapat dihidrolisis menjadi oligopeptida yang larut dan mudah dicerna. Bahan yang kaya akan kasein, umumnya terdapat pada susu. Jenis susu sapi, domba dan kambing kaya akan kasein (Makfoeld, dkk, 2002: 170).
C. Alat dan Bahan Praktikum
Adapun alat dan bahan yang digunakan dalam praktikum ini adalah sebagai berikut :
1. Alat yang digunakan meliputi : gelas kimia, hot plate, penjepit tabung reaksi, pipet tetes, rak tabung reaksi, spatula, stopwatch, tabung reaksi, waterbath.
2. Bahan yang digunakan meliputi : air panas, alkohol, aquadest, kertas label, larutan asam amino asam aspartat, larutan asam amino fenilalanin, larutan asam amino glisin, larutan asam amino sistein, larutan asam amino sistin, larutan asam amino tirosin, larutan asam amino triptofan, larutan HCl encer, larutan HNO3 pekat, larutan NaOH 0,1 N, larutan NaOH pekat 20
%, larutan NaOH encer, larutan Pb(CH3COO)2 0,2 M, larutan sampel
D. Prosedur Kerja
1. Tes I : Uji Kelarutan
Disiapkan 5 buah tabung reaksi dan diberikan label sesuai dengan nama asam amino ( glysine, asam aspartat, triptofan, fenilalanin) dan sampel. Dimasukkan 0,1 gram serbuk asam amino dan sampel ke dalam masing-masing tabung reaksi dengan nama yang sesuai dengan label, kemudian ditambahkan 1-3 ml aquadest ke dalam masing-masing tabung reaksi tersebut kemudian dikocok hingga larut. Diamati perubahan yang terjadi serta dicatat hasil pengamatan pada tabel hasil pengamatan. Diulangi langkah-langkah tersebut untuk pelarut alkohol, HCl encer, dan NaOH encer.
2. Tes II : Uji Ninhidrin
Disiapkan 4 buah tabung reaksi dan diberi label sesuai dengan nama asam amino (glysine, asam aspartat, tirosin) dan sampel. Dimasukkan masing-masing 1 ml larutan asam amino dan sampel ke dalam tabung reaksi sesuai dengan label, kemudian ditambahkan 5 tetes reagen ninhidrin 0,2 % ke dalam masing-masing tabung reaksi. Dipanaskan masing-masing campuran larutan tersebut pada waterbath selama 2 menit. Dikeluarkan campuran larutan dari waterbath kemudian dibiarkan dingin hingga terbentuk larutan berwarna biru. Dicatat hasil pengamatan pada tabel hasil pengamatan.
3. Tes III : Uji Xanthoprotein
Disiapkan sebanyak 6 buah tabung reaksi dan diberi label sesuai dengan nama asam amino (tirosin, triptofan, fenilalanin, glisin, asam aspartat) dan sampel. Dimasukkan masing-masing 2 ml larutan asam amino dan sampel ke dalam masing-masing tabung reaksi sesuai dengan label kemudian dipanaskan, asam amino yang sudah dipanaskan lalu ditambahkan 2 ml larutan HNO3 pekat ke dalam masing-masing tabung reaksi. Dipanaskan
didinginkan. Ditambahkan larutan NaOH 0,1 N secara perlahan hingga terjadi perubahan warna. Dicatat hasil pengamatan pada tabel hasil pengamatan.
4. Tes IV : Uji Millon
Disiapkan 4 buah tabung reaksi kemudian diberi label sesuai dengan nama asam amino (tirosin, fenilalanin, glisin) dan sampel. Dimasukkan masing-masing 2 ml larutan asam amino dan sampel ke dalam tabung reaksi yang sesuai label, lalu ditambahkan 1 sampai 2 tetes reagen Millon. Dididihkan campuran larutan pada waterbath hingga terbentuk warna merah pada larutan. Dicatat hasil pengamatan pada tabel hasil pengamatan.
5. Tes V : Uji Sulfur
Disiapkan 4 buah tabung reaksi kemudian diberi label sesuai dengan nama asam amino (sistein, sistin, glisin) dan sampel. Dimasukkan masing-masing 1 ml larutan asam amino dan sampel ke dalam tabung reaksi yang sesuai label, lalu ditambahkan 1 ml NaOH pekat 20 %. Dipanaskan campuran larutan dengan hati-hati pada gelas kimia berisi air panas di atas hot plate selama 1 menit. Diangkat larutan kemudian ditambahkan 1 tetes larutan Pb(CH3COO)2
0,2 M. Diamati perubahan yang terjadi dan dicatat pada tabel hasil pengamatan.
E. HASIL dan PEMBAHASAN E.1 Hasil Pengamatan
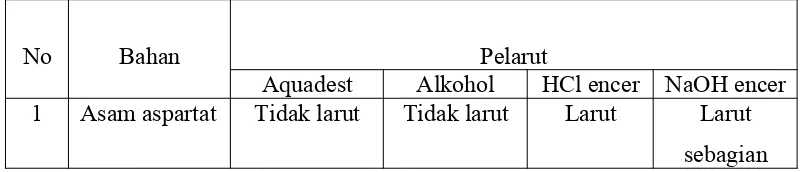
Tabel 1.1 Hasil pengamatan uji kelarutan
No Bahan Pelarut
Aquadest Alkohol HCl encer NaOH encer 1 Asam aspartat Tidak larut Tidak larut Larut Larut
2 Fenilalanin Tidak larut Tidak larut Larut Larut sebagian 3 Glisin Larut Tidak larut Larut Larut 4 Triptofan Tidak larut Tidak larut Larut Larut sebagian 5 Sampel Tidak larut Tidak larut Tidak
larut
Larut sebagian
Tabel 1.2 Hasil pengamatan uji ninhidrin
No Bahan
Warna yang dihasilkan
Sebelum pemanasan Setelah pemanasan 1 Asam aspartat Bening Ungu 2 Glisin Biru Biru kehitaman 3 Tirosin Kuning bening Kuning agak bening 4 Sampel Bening Kuning bening
Tabel 1.3 Hasil pengamatan uji xanthoprotein
No Bahan Warna yang dihasilkan 5 Triptofan Cokelat tua Kuning kecokelatan
6 Sampel Kuning Keruh
Tabel 1.4 Hasil pengamatan uji Millon
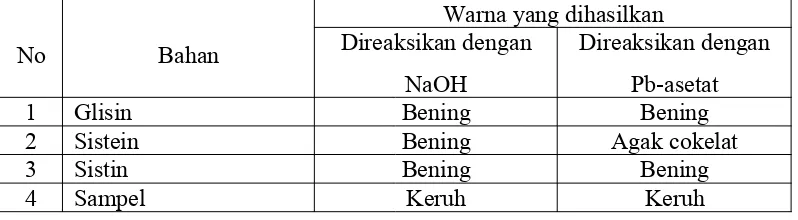
Tabel 1.5 Hasil pengamatan uji sulfur
No Bahan
Warna yang dihasilkan Direaksikan dengan
NaOH
Direaksikan dengan Pb-asetat
1 Glisin Bening Bening
2 Sistein Bening Agak cokelat
3 Sistin Bening Bening
4 Sampel Keruh Keruh
E.2 Pembahasan
adalah asam amino yang paling sederhana sehingga glisin dapat dengan mudah menyesuaikan dengan berbagai keadaan. Glisin memiliki sebuah atom hidrogen sebagai rantai sisi, sehingga glisin merupakan asam amino yang paling sederhana dan paling kurang interaktif. Karena berukuran kecil, atom hidrogen menimbulkan rintangan sterik minimal (Marks, dkk, 1996). Hal tersebut menyebabkan gugus amina dan gugus karboksilat pada glisin akan lebih mudah membentuk zwitter ion yakni dapat membentuk ion yang bermuatan positif ataupun ion yang bermuatan negatif. Oleh sebab itu, glisin pada percobaan ini dapat larut dalam air.
atom karbon yang panjang. Dimana tirosin memiliki sifat yang sama dengan fenilalanin dan triptofan yakni hidrofobik karena termasuk ke dalam asam amino yang aromatik. Karena banyak mengandung tirosin, maka kasein akan banyak mengandung gugus benzena dengan kestabilan yang tinggi sehingga kasein akan sukar larut dalam air.
Selanjutnya, uji kelarutan menggunakan pelarut HCl encer. Pada Tabel 1.1 dapat dilihat hasil pengamatan pada pelarut HCl, semua asam amino dapat larut dalam pelarut HCl. Hal ini dikarenakan asam amino bersifat amfoter yaitu dapat bereaksi dengan asam atau basa (Tim Dosen Biokimia, 2015). Oleh karena pada asam amino mengandung gugus amina dan gugus karboksilat, maka asam amino dalam larutan dapat membentuk ion yang bermatan positif dan juga bermuatan negatif (zwitter ion) (Poedjiadji, 1994). Keadaan inilah yang menyebabkan asam amino bersifat amfoter. Sedangkan sampel (kasein) tidak larut dalam HCl. Hal ini sesuai dengan teori yakni kasein bersifat peka terhadap keasaman (pH). Bila pH susu rendah 4,6, maka kasein menjadi tidak stabil dan akan terkoagulasi (munggumpal) sehingga membentuk padatan (Rukmana, 2001). Karena HCl merupakan suatu asam maka tentunya memiliki pH yang rendah sehingga menyebabkan kasein tidak akan stabil jika dilarutkan pada HCl.
Uji kelarutan yang terakhir adalah menggunakan pelarut NaOH encer. Pada Tabel 1.1 dapat dilihat bahwa hasil dari percobaan ini adalah semua asam amino dapat larut dalam NaOH encer, walaupun hanya sebagian. Hal ini juga disebabkan karena kemampuan asam amino membentuk suatu zwitter ion sehingga bersifat amfoter. Penambahan larutan yang bersifat basa pada suatu asam amino dapat menyebabkan terlepasnya hidrogen pada gugus karboksil sehingga menyebabkan larutan bersifat lebih basa daripada sebelumnya. Dalam larutan basa, gugus karboksil dalam bentuk (COO-) dan gugus amina dalam bentuk
(NH2). Hal ini dapat menunjukkan bahwa asam amino dapat terionisasi pada pH
tinggi (basa). Sampel (kasein) juga pada larutan NaOH encer dapat larut sebagian. Hal ini dikarenakan kasein tidak stabil pada pH rendah sehingga pada pH yang tinggi (basa) kasein akan stabil dan dapat larut pada larutan basa. Pada percobaan ini, asam amino dan sampel tidak larut sempurna dapat dikarenakan waktu yang digunakan untuk mengamati terlalu singkat sehingga reaksi belum sempurna namun pengamatan sudah diberhentikan.
menghasilkan CO2, NH3, dan aldehid dengan kehilangan 1 atom karbon. Senyawa
ini kemudian bereaksi dengan NH3 bebas membentuk senyawa kompleks
berwarna biru. Ninhidrin adalah bahan kimia yang digunakan untuk mendeteksi amina primer dan sekunder (Tim Dosen Biokimia, 2015). Dimana semakin biru atau ungu warna yang dihasilkan maka konsentrasi asam amino didalamnya semkain pekat. Adapun asam amino yang digunakan dalam percobaan ini adalah asam aspartat, glisin, dan tirosin. Pada tabel 1.2 dapat diketahui perubahan warna yang terjadi pada setiap asam amino sebelum maupun sesudah pemanasan. Sebelum dilakukan pemanasan, uji positif dari ninhidrin hanya ditunjukkan oleh glisin. Setelah dipanaskan warna dari glisin menjadi semakin biru kehitaman. Hal tersebut menandakan glisin mengandung gugus α-amino.
Asam amino yang lain yakni asam aspartat dan tirosin sebelum pemanasan masing-masing berwarna bening dan kuning bening. Namun setelah dipanaskan asam aspartat berubah warna menjadi ungu. Hal ini menunjukkan asam aspartat juga mengandung gugus α-amino. Sedangkan tirosin setelah dilakukan pemanasan tetap berwarna kuning bening. Berdasarkan teori, tirosin akan menunjukkan reaksi positif dengan uji ninhidrin. Namun, pada percobaan ini tirosin tidak menunjukkan warna biru maupun ungu. Hal ini dapat terjadi karena proses pemanasan yang tidak tepat sehingga tirosin tidak bereaksi secara sempurna dan tidak menghasilkan warna yang sesuai dengan uji positif pada uji ninhidrin atau konsentrasi bahan yang digunakan tidak sesuai sehingga tidak dapat menghasilkan uji positif. Tirosin bereaksi dengan reagen ninhidrin berdasarkan reaksi :
hasil reaksi yang berbeda yakni warna kuning. Menurut Poedjiadi (1994) pada kasein mengandung prolin sehingga hasil tersebut sesuai dengan teori. Walaupun pada kasein mengandung tirosin, triptofan, dan sistein yang menunjukkan reaksi positif terhadap uji ninhidrin, namun kasein berbentuk dalam senyawa kompleks sehingga banyak yang mempengaruhi reaksi yang terjadi didalamnya dan menyebabkan uji positif dari uji ninhidrin tidak dapat teramati.
Percobaan ketiga yakni uji xantoprotein, dimana asam amino yang digunakan adalah asam aspartat, fenilalanin, glisin, tirosin, dan triptofan. Beberapa asam amino mengandung gugus aromatik yang adalah turunan dari benzena. Kelompok-kelompok aromatik dapat mengalami reaksi yang khas terhadap benzena derivatif. Salah satu reaksi tersebut adalah nitrasi cincin benzena dengan asam nitrat. Reaksi nitrasi ini membentuk produk kuning dengan adanya cincin benzena yang teraktifkan (Tim Dosen Biokimia, 2015). Pada tabel 1.3 dapat dilihat perubahan warna pada setiap asam amino dan sampel pada saat ditambahkan HNO3 pekat dan NaOH 0,1 N. Sebelum direaksikan dengan HNO3
pekat terlebih dahulu asam amino dan sampel dipanaskan terlebih dahulu dengan tujuan agar reaksi lebih cepat terjadi dan untuk mengimbangi penggunaan asam kuat yang akan digunakan. Pada saat penambahan HNO3 pekat yang berubah
warna adalah tirosin menjadi orange, triptofan menjadi cokelat tua, dan sampel berwarna kuning. Sedangkan asam aspartat, fenilalanin, dan glisin tetap berwarna bening. Kemudian setelah penambahan NaOH tirosin berubah warna menjadi kuning kehijauan, sedangkan triptofan menjadi kuning kecokelatan, dan sampel menjadi keruh. Namun, asam aspartat, fenilalanin, dan glisin tetap berwarna bening. Dimana tujuan penambahan NaOH adalah untuk memperjelas warna yang terbentuk. Jika ke dalam larutan asam amino yang direaksikan dengan HNO3
HNO3 pekat. Warnanya memang tidak sesuai dengan teorti yang ada, namun
diperkuat ketika direaksikan dengan NaOH, kedua larutan tersebut berubah warna menjadi kuning. Dimana persamaan reaksi yang terjadi adalah :
Untuk tirosin adalah :
Fenilalanin seharusnya bereaksi positif dengan uji xantoprotein, karena fenilalanin mengandung gugus benzena. Hal tersebut dapat terjadi karena kualitas atau konsentrasi bahan yang digunakan tidak sesuai sehingga tidak menghasilkan reaksi yang positif. Sedangkan pada asam aspartat dan glisin tidak memberikan warna yang positif dengan reagen xantoprotein karena kedua asam amino tersebut merupakan asam amino rantai terbuka atau alifatik dan tidak mengandung gugus benzena sehingga tidak dapat ternitrasi oleh HNO3 pekat. Dan sampel
menunjukkan reaksi yang positif ketika ditambahkan HNO3 pekat yakni berwarna
kuning menunjukkan pada sampel mengandung benzena. Karena pada kasein terdapat tirosin dan triptofan yang merupakan senyawa aromatik dan mengandung gugus benzena.
Uji keempat yakni uji Millon, dimana asam amino yang digunakan adalah fenilalanin, glisin, dan tirosin. Uji Millon adalah uji khusus untuk asam amino yang mengandung fenol. Reagen Millon mengandung HNO3, dimana terdapat
dianggap sebagai hasil positif (Tim Dosen Biokimia, 2015). Berdasarkan Tabel 1.4 dapat diketahui perubahan warna sebelum pemanasan dan sesudah pemanasan. Sebelum pemanasan, ketika ditambahkan reagen Millon tirosin berubah warna menjadi kuning sedangkan pada sampel terbentuk gumpalan putih. Setelah pemanasan, tirosin berubah menjadi bening, yang menandakan tidak berhasilnya percobaan yang dilakukan karena berdasarkan teori, tirosin akan bereaksi positif dengan reagen Millon disebabkan tirosin adalah satu-satunya asam amino yang mengandung gugus fenol. Namun, kesalahan pada percobaan ini dapat disebabkan karena reagen Millon yang ditambahkan terlalu banyak sehingga reaksi tidak berjalan sempurna. Reaksi tirosin dengan reagen Millon dapat dijelaskan sebagai berikut :
Gumpalan putih pada sampel terjadi karena penambahan reagen Millon yang kemudian akan berubah menjadi merah setelah dipanaskan. Namun, pada percobaan ini sampel tidak berubah menjadi merah namun tetap menjadi endapan putih. Hal ini dapat terjadi karena proses pemanasan yang kurang tepat atau penambahan reagen Millon yang terlalu banyak sehingga mengurangi keefisienan reaksi yang terjadi. Sampel (kasein) dapat membentuk endapan putih yang menunjukkan adanya reaksi antara tirosin dengan merkuri yang terkandung pada reagen Millon menunjukkan bahwa pada sampel memang mengandung tirosin, walaupun setelah pemanasan tidak terjadi perubahan warna menjadi merah. Sedangkan pada fenilalanin dan glisin tidak terjadi perubahan warna karena memang kedua asam amino tersebut tidak mengandung gugus fenol sehingga tidak dapat bereaksi positif dengan reagen Millon.
beberapa sulfur dalam struktur asam amino dikonversi menjadi natrium sulfida (Na2S). Na2S dapat dideteksi dengan menggunakan larutan Pb-asetat
menyebabkan pengendapan PbS dari larutan basa (Tim Dosen Biokimia, 2016). Pada Tabel 1.5 dapat dilihat bahwa asam amino setelah penambahan NaOH tidak terjadi perubahan pada larutan asam amino atau larutan tetap berwarna bening sedangkan pada sampel larutan menjadi keruh. Kemudian setelah ditambahkan Pb-asetat sistein berubah warna menjadi agak colekat yang menunjukkan bahwa pada sistein mengandung sulfur. Hal ini sesuai dengan teori yakni sistein mengandung gugus sulfihidril (-SH) yang cukup reaktif terutama pada proses dehidrogenasi (Poedjiadi, 1994). Reaksi yang terjadi pada sistein dalam uji sulfur ini adalah :
H2N CH C
CH2
OH O
SH
(aq) + (aq) Na2S(s)+ CH3 CH COO
-NH3+
NaOH
(aq)
Na2S
(s) + Pb(CH3COO)2(aq) PbS (s) + 2CH3COONa (aq)
E. Simpulan
G. Daftar Pustaka
Anna, P & F. M. T. Supriyanti. (2009). Dasar-Dasar Biokimia, Edisi Revisi. Jakarta:UniversitasIndonesia Press.
Girindra, A. (1986). Biokimia I. Jakarta:Gramedia.
Kuchel, Philip W., dan Gregory B. Ralston. (2002). Schaum’s Easy Outlines Biokimia. Jakarta:Erlangga.
Makfoeld, Djarir, dkk. (2002). Kamus Istilah Pangan dan Nutrisi.
Yogyakarta:Kanisius.
Marks, Dawn B, Allan D. Marks dan Colleen M. Smith. (1996). Biokimia Kedokteran Dasar. Jakarta:EGC.
Nurlely, Muslimah dan Liling Triyasmoro. (2014). Pengujian Daya Cerna Protein Ikan Haruan (Channa striata) Asal Kota Banjarmasin. Jurnal Pharmascience 2 1:76-80.
Poedjiadi, Anna. (1994). Dasar-Dasar Biokimia. Jakarta:Universitas Indonesia.
Purnomo, Hari, Djalal Rosyidi dan Sayoga Kristian Pantoro. (2012). Kadar Protein dan Profil Asam Amino Daging Kambing Peranakan Etawah (PE) Jantan dan Peranakan Boer (PB) Kastari. Jurnal Ilmu dan Teknologi Hasil Ternak 1 7:1-5.
Ramayulis, Rita. (2014). Detox is Easy. Jakarta:Penebar Plus* (Penebar Swadaya Group).
Rukmana, Rahmat H. (2001). Yogurt dan Karamel Susu.
Tim Dosen Biokimia. (2015). Petunjuk Praktikum Biokimia I. Mataram:Universitas Mataram.
Tim Pengajar Kimia Organik. (2016). Petunjuk Praktikum Kimia Organik I. Mataram:Universitas Mataram.