1
IDENTIFIKASI ASAM AMINO PADA ALBUMIN TELUR DAN SAMPEL
UNKNOWN
Kadek Anggra SupraptaFakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Pendidikan Ganesha Email: Dekanggra5@gmail.com
Abstract
This experiment aims to identify the amino acids contained in the protein solution through Test Millon, Hopkins-Cole Test, Test Ninhydrin; Identify the amino acid cysteine to test the Sistine and PbS and nitroprusside test; Identify the types of amino acids contained in the unknown sample through the test reaction of amino acids. Data from the observations obtained with experimental methods in accordance with the working procedures, as well as analyzing the data obtained from the experiments. The results of observations show that the solution of egg albumin test positive to Millon, Hopkins-Cole Test and Test PbS, which means successive egg albumin solution containing amino acids tyrosine, tryptophan, and Cysteine. Sample A solution is then to test positive to Millon, Hopkins-Cole Test and Ninhydrin test which indicates that sample A contains amino acids tyrosine and tryptophan. Samples B and C only positive Ninhydrin test which indicates that the samples B and C is an α amino acid. While the D samples positive for Hopkins-Cole Test and Test Ninhydrin which indicates that the sample D is the amino acid tryptophan.
Keywords: identification, amino acids, egg albumin.
1. PENDAHULUAN
Protein merupakan salah satu kelompok bahan makronutrien. Tidak seperti bahan makronutrien lainnya (karbohidrat, lemak), protein ini berperan lebih penting dalam pembentukan biomolekul daripada sumber energi. Setiap sel hidup mengandung protein yang merupakan senyawa organik essensial bagi mahluk hidup tersusun atas sejumlah asam amino yang membentuk suatu untaian (polimer) dengan ikatan peptida.
Asam amino di dapatkan dari sumber-sumber protein. Protein adalah senyawa organik yang terdiri dari satu atau lebih asam
amino. Protein yang di dapatkan melalui makanan sehari-hari di urai dalam pencernaan dalam bentuk asam amino. Asam amino adalah molekul organik dengan massa molekul rendah (antara 100 – 200 Da) yang mengandung setidak – tidaknya satu gugus karboksil COOH) dan satu gugus amino (-NH2). Gugus karboksil dalam asam amino
memberikan sifat asam dan gugus amina memberikan sifat basa. Dalam bentuk larutan,
asam amino bersifat amfoterik yaitu
cenderung menjadi asam pada larutan basa dan menjadi basa dalam larutan asam (Tika, 2008).
Gambar 1. Struktur umum Asam amino Asam amino termasuk golongan senyawa
yang fungsinya sangat penting dalam
organisme, yaitu sebagai penyusun protein. Kedua puluh jenis asam amino standar
C
C
N
R
H
H
H
O
OH
Gugus
amino
Gugus
-karboksil
2
tersebut yang terdapat dalam protein adalah alanin, valin,leusin, isoleusin, tryptophan, metionin, prolin, fenilalanin, serin, glisin, treonin, sistein, asparagin, glutamin, tirosin, asam aspartat, asam glutamat, arginin, lisin dan histidin. Variasi yang terjadi antara asam– asam amino terletak pada gugus-R atau rantai sampingnya. Berdasarkan gugus-R nya akan dapat diramalkan sifat–ifat suatu asam amino. Sebaliknya, berdasarkan sifat – sifat yang teridentifikasi akan dapat diketahui gugus –R yang terkandung dalam asam amino tersebut atau jenis asam amino tersebut (Tika, 2008).
Identifikasi asam amino dapat dilakukan dengan dua metode yaitu metode kualitatif
dan kuantitatif. Metode kualitatif dilakukan untuk mengetahui keberadaan asam amino dalam suatu protein sedangkan lebih lanjut
dilakukan analisis kuantitatif untuk
mengetahui jumlah suatu asam amino dalam suatu protein. Analisis asam amino dengan metode kuanlitatif dapat dilakukan dengan metode seperti uji Millon, Uji Hopkins–Cole, Uji Ninhidrin, Uji PbS serta Uji Nitroprusida. Pada praktikum ini akan diuji larutan asam amino berupa sampel unknown melalui uji kualitatif. Adapun rancangan metode untuk analisis suatu asam amino tertentu dapat disajikan seperti tabel berikut.
Tabel 1. Rancangan Metode Analisis Asam Amino
Reaksi Uji Reaksi/Reagen Asam amino yang
dideteksi
Warna
Uji Millon HgNO3 dalam asam nitrat
dengan sedikit asam nitrit
Tirosin Merah
Uji Hopkins-Cole Asam glioksilat dalam H2SO4
pekat
Triptophan Ungu
Uji Ninhidrim Triketohidrin Hidrat Asam amino dan
peptida yang memiliki gugus -amino yang bebas
Biru
Uji PbS PbS (timbal sulfida) Asam amino yang
dapat melepaskan
unsur S
Hitam
Uji Nitroprusida Natrium nitroprusida dalam NH3
encer
Sistein Merah
(Redhana, 2010)
2. METODE
Eksperimen identifikasi asam amino ini dilakukan pada tanggal 28 Februari 2014 yang bertempat di Lab Kimia Organik Undiksha. Dalam eksperimen ini digunakan alat-alat dan bahan sebagai berikut: 1 rak tabung reaksi, pipet tetes, corong, gelas kimia 25 mL, gelas kimia 100 mL, gelas ukur ukuran 5 mL, 1 buah labu erlenmeyer ukuran 100 mL, spatula, batang pengaduk, pembakar spritus, korek api, kaca arloji, dan heater. Sedangkan bahan yang digunakan terdiri dari larutan albumin telur, sampel A, B, C dan D, larutan Pb(CH3COO)2,
reagen Millon, reagen Hopkins-Cole, reagen Ninhidrin, larutan natrium nitroprusida,
larutan amonia, NaOH, asam sulfat pekat, larutan NH4OH dan aquades.
Uji Millon
Ditambahkan 5 tetes reagen Millon ke dalam 3 mL larutan protein, campuran dipanaskan sampai mendidih. Jika reagen yang digunakan terlalu banyak, warna akan hilang. Hal yang sama juga dilakukan terhadap larutan asam–asam amino.
Uji Hopkins–Cole
Ke dalam 2 mL larutan protein ditambahkan 2 mL reagen Hopkins-Cole. Ditambahkan sedikit demi sedikit H2SO4
3
tabung. Diamati warna yang terbentuk pada pertemuan kedua cairan. Bila perlu putar
perlahan–lahan tabung tersebut sampai
terbentuk cincin berwarna ungu. Diulangi untuk larutan asam–asam amino yang lain.
Uji Ninhidrin
Ditambahkan 0,5 mL larutan Ninhidrin 0,1% ke dalam 3 mL larutan protein.
Dipanaskan hingga mendidih. Diulangi
percobaan dengan larutan asam amino yang lain.
Uji Pb(CH3COO)2
Ke dalam 5 mL larutan protein ditambahkan 2 mL larutan NaOH dan 2 tetes
Pb-asetat,kemudian dipanaskan di atas
pemanas air. Jika positif, larutan mula–mula berwarna kuning kemudian coklat dan akhirnya hitam
Uji Nitroprusida
Dilarutkan beberapa kristal sistein hidroklorida ke dalam 5 mL air. Ditambahkan 0,5 mL larutan natrium nitroprusida 1%. Kemudian ditambahkan 0,5 mL ammonium hidroksida.
3. HASIL DAN PEMBAHASAN
Pada eksperimen ini dilakukan uji asam amino terhadap larutan albumin telur dan larutan sampel unknown A, B, C, dan D. Pengujian yang dilakukan pada larutan sampel antara lain : uji Millon, uji Hopkins-Cole, uji Ninhidrin, uji PbS dan uji Nitroprusida.
Dengan dilakukan pengujian-pengujian
tersebut maka asam amino yang terkandung pada sampel dapat diidentifikasi.
Uji Millon
Pereaksi Millon pada dasarnya digunakan untuk uji spesifik asam amino Tirosin. Pada uji Millon ini, sebanyak 3 mL larutan larutan albumin telur diteteskan reagen Millon sebanyak 5 mL. Reagen Millon adalah larutan HgNO3 dalam asam nitrat dan sedikit asam
nitrit. Setelah diteteskan, Selanjutnya dilakukan pemanasan hingga mendidih. warna larutan albumin telur berubah menjadi merah. Hal yang sama juga terjadi pada larutan sampel D. Pada sampel A, B dan C tidak terjadi perubahan warna menjadi merah, akan tetapi tetap bening tidak berwarna.
Gambar 2. (a) Larutan albumin telur + Reagen Millon; (b) Sampel A + Reagen Millon; (c) Sampel B + Reagen Millon; (d) Sampel C + Reagen Millon;
(e) Sampel D + Reagen Millon Perubahan warna larutan menjadi merah pada larutan protein albumin telur dan sampel D setelah ditetesi reagen Millon dan dilakukan pemanasan dikarenakan pada larutan protein albumin telur dan sampel D terkandung asam
amino tirosin. Dimana dalam Tirosin
mengandung fenol–fenol yan nantinya
membentuk senyawa merkuri dengan gugus hidroksifenil yang menghasilkan warna merah. Kemudian pada larutansampel A, B,
dan C tidak memberikan perubahan warna menjadi merah ketika ditambahkan reagen Millon dan dilakukan pemanasan dikarenakan tidak terdapat gugus fenol pada struktur asam amino ini sehingga tidak bisa membentuk senyawa merkuri dengan gugus hidroksifenil yang nantinya memberikan warna merah pada larutan. Reaksi yang terjadi adalah sebagai berikut:
4
2 HO CH2CH NH2 C OH O + Hg22+ HO CH 2CH O2N NH2 C O O -Hg22+Gambar 3. Persamaan reaksi pada uji Millon Pereaksi Millon pada dasarnya digunakan
untuk uji spesifik asam amino Tirosin. Jika larutan yang akan dianalisis berada dalam suasana basa, maka harus terlebih dahulu dinetralisasi dengan asam namun bukan HCl. Jika hal ini tidak dilakukan maka ion merkuri dari pereaksi akan mengendap sebagai Hg(OH)2 sedangkan jika digunakan HCl maka
ion Cl- dapat bereaksi dengan asam nitrat membentuk Cl. yang nantinya dapat merusak kompleks berwarna.
Uji Hopkins–Cole
Pada uji Hopkins Cole ini sebanyak 2 mL larutan sampel albumin telur yang berwarna putih keruh ditambahkan 2 mL reagen
Hopkins-Cole. Kemudian setelah
ditambahkan beberapa tetes H2SO4 pekat
melalui dinding tabung, terbentuk cincin ungu pada pertemuan kedua cairan. Hal yang sama juga terjadi pada larutan sampel D. Pada sampel A, B dan C tidak terbentuk cincin ungu, akan tetapi tetap bening tidak berwarna.
Gambar 4.
Terbentuknya cincin ungu pada
pertemuan kedua cairan pada larutan protein albumin telur dan sampel D ini menandakan bahwa dalam larutan protein telur ini positif mengandung asam amino triptophan. Pada asam amino triptophan terdapat cincin indol pada strukturnya. Maka cincin ungu yang terbentuk pada pertemuan kedua cairan
merupakan hasil kondensasi triptophan
dengan gugus aldehida yang berasal dari asam glioksilat (pada reagen Hopkins–Cole) dimana struktur dari asam glioksilat adalah HOOC–
CHO. Sedangkan fungsi penambahan asam sulfat adalah mengkondisikan reaksi agar berjalan pada suasana asam. Uji pada sampel A, B dan C memberikan hasil negatif pada uji Hopkins-Cole yaitu tidak terbentuk cincin ungu, ini disebabkan tidak adanya kandungan cincin indol pada struktur keempat asam amino ini sehingga tidak bisa mengalami kondensasi dengan aldehida yang berasal dari asam glioksilat ini sehingga cincin ungu pun tidak terbentuk. Reaksi yang terjadi adalah sebagai berkut:
(a)
(b)
(c)
d)
(e)
(a) Larutan albumin telur + Reagen Hopkins Cole + H2SO4; (b) Sampel A +
Reagen Hopkins Cole + H2SO4; (c) Sampel B + Reagen Hopkins Cole + H2SO4; (d)
Sampel C + Reagen Hopkins Cole + H2SO4; (e) Sampel D + Reagen Hopkins Cole +
5
Gambar 5. Persamaan reaksi pada Uji Hopkins Cole
Uji Ninhidrin
Uji ini merupakan uji universal untuk asam α amino. Pada uji Ninhidrin ini sebanyak 3 mL larutan sampel albumin telur
ditambahkan dengan 0,5 mL larutan
Ninhidrin. Kemudian dilakukan pemanasan
hingga mendidih. Sebelum dipanaskan
terbentuk larutan bening tak berwarna, dan
setelah dilakukan pemanasan terbentuk
endapan warna merah dan sedilit terdapat warna ungu. Pada sampel A, B, C dan D terjadi perubahan warna secara jelas dari tidak
berwarna menjadi unguji ini merupakan uji universal untuk asam α amino. Pada uji Ninhidrin ini sebanyak 3 mL larutan sampel albumin telur ditambahkan dengan 0,5 mL
larutan Ninhidrin. Kemudian dilakukan
pemanasan hingga mendidih. Sebelum
dipanaskan terbentuk larutan bening tak berwarna, dan setelah dilakukan pemanasan terbentuk endapan warna merah dan sedilit terdapat warna ungu. Pada sampel A, B, C dan D terjadi perubahan warna secara jelas dari tidak berwarna menjadi ungu.
Gambar 6.
Perubahan warna larutan menjadi ungu pada larutan sampel setelah diteteskan dengan larutan Ninhidrin dan dilakukan pemanasan menandakan bahwa seluruh sampel tersebut terdapat kandungan asam α-amino dan peptida yang memiliki gugus α-amino yang bebas. Pembentukan larutan kompleks berwarna ungu ini terjadi karena dekarboksilasi
oksidatif dari asam amino dan produksi ninhidrin tereduksi, NH3 dan CO2. Kemudian
terjadi reaksi antara ninhidrin tereduksi dengan molekul ninhidrin yang lain dan
dengan molekul NH3 yang dibebaskan
sehingga terbentuk kompleks berwarna ungu. Reaksi yang terjadi dalam proses ini adalah sebagai berikut: NH CH2 CH NH2 C OH O + COOH CHO H2SO4 NH H H COOH H NH H H
(a)
(b)
(c)
d)
(e)
(a) Larutan albumin telur + larutan Ninhidrin; (b) Sampel A + larutan Ninhidrin; (c) Sampel B + larutan Ninhidrin; (d) Sampel C + larutan Ninhidrin; (e) Sampel D + larutan Ninhidrin
Asam-2,3,4,5-tetrahidro-β-karbolin-4-karboksilat
(cincin ungu) Triptophan
6
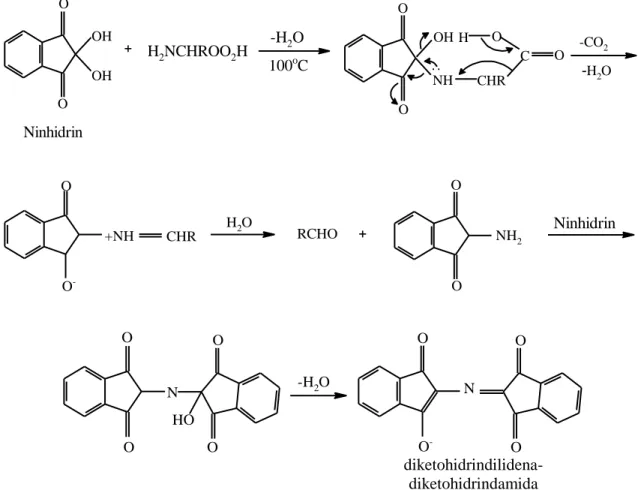
O O OH OH + O O OH NH CHR C O O H -CO 2 -H2O H2NCHROO2H -H2O 100oC Ninhidrin O O -+NH CHR H2O RCHO + O O NH2 Ninhidrin O O N HO O O -H2O O O -N O OGambar 7. Persamaan reaksi pada Uji Ninhidrin
Uji PbS
Untuk uji ini dilakukan dengan cara menambahkan 2 mL NaOH dan 2 tetes Pb-asetat pada 5 mL larutan albumin telur. Kemudian dilakukan pemanasan di atas
pemanas air. Setelah dipanaskan terbentuk endapan berwarna hitam di dasar larutan. Sedangkan pada sampel A, B, C dan D tidak terbentuk endapan hitam.
Gambar 8.
Terbentuknya endapan hitam pada
larutan protein albumin telur menandakan bahwa pada larutan protein albumin telur
terdapat asam amino yang mampu melepas unsur S (metionin atau sistein) dan pada struktur asam amino sistein terdapat unsur S.
diketohidrindilidena-diketohidrindamida (pigmen warna biru-ungu)
(a)
(b)
(c)
d)
(e)
(a) Larutan albumin telur + Pb asetat; (b) Sampel A + Pb asetat; (c) Sampel B + Pb asetat; (d) Sampel C + Pb asetat; (e) Sampel D + Pb asetat
7
Endapan hitam itu merupakan endapan hitam PbS yang terbentuk dari reaksi antara ion sulfida yang dibebaskan oleh asam amino dan ion Pb2+ yang berasal dari larutan Pb-asetat. Reaksi yang terjadi adalah sebagai berikut :
Pb2+ + S2- → PbS↓
Endapan Hitam Penambahan NaOH dalam hal ini adalah untuk mendenaturasikan protein sehingga ikatan yang menghubungkan atom S pada asam amino dapat terputus. Kemudian pada larutan asam amino glisin, tirosin, fenilalanin dan tryptophan tidak terjadi endapan hitam
setelah ditambahkan Pb-asetat dan dilakukan pemanasan hal ini dikarenakan pada struktur keempat asam amino ini tidak terdapat unsur S sehingga tidak bisa melepaskan ion sulfida.
Uji Nitroprusida
Pada uji Nitroprusida larutan sampel ditambahkan larutan natrium nitroprusida dan NH4OH. Uji akan positif terhadap uji
nitroprusida apabila terbentuk larutan
berwarna merah yang merupakan kompleks dari hasil reaksi berikut.
Gambar 9.
4. SIMPULAN
Berdasarkan hasil percobaan yang
diperoleh dapat disimpulan bahwa pada albumin telur mengandung asam amini tirosin, triptopan, asam α-amino bebas, asam amino
yang dalam struktur asam aminonya
mengandung belerang. Untuk sampel
unknown D menghasilkan uji positif pada uji Millon, Hopkins-Cole, dan Ninhidrin yang menandakan adanya tirosin, tiptopan dan asam α-amino bebas. Pada sampel unknown
A,B,C hanya menghasilkan uji positif
Ninhidrin yang mendakan adanya asam α-amino bebas seperti fenilalanin, glisin, triptopan, tirosin dan lain-lain kecuali prolin.
5. UCAPAN TERIMA KASIH
Ucapan terima kasih penulis sampaikan kepada Dr. I Nyoman Tika, M.Si., sebagai dosen pengampu mata kuliah Praktikum Biokimia, Kadek Dewi Wirmandianthy, S.Pd
selaku asisten dosen, dan I Dewa Subamia selaku laboran di Jurusan Pendidikan Kimia
atas masukan dan sarannya sehingga
percobaan ini dapat dilaksanakan dengan baik.
6. REFERENSI
Tika, I Nyoman. 2010. Penuntun praktikum Biokimia. Singaraja: Universitas Pendidikan Ganesha
Chairil Anwar, dkk. 1994. Pengantar
Praktikum Kimia Organik.
Yogyakarta: Departemen Pendidikan dan Kebudayaan
Thenawijaya, Maggy. 1982. Dasar-Dasar Biokimia jilid 1. Jakarta: Erlangga Redhana. 2010. Penuntun Pratikum Biokimia.
Singaraja: Universitas Pendidikan Ganesha
(a) (b) (c) (d)
(a) Larutan sampel A ditambahkan larutan nitroprusida dan NH4OH; (b) Larutan
sampel A ditambahkan larutan nitroprusida dan NH4OH; (c) Larutan sampel A
ditambahkan larutan nitroprusida dan NH4OH; (d) Larutan sampel A ditambahkan