BAB I PENDAHULUAN
A. Latar Belakang Masalah
Senyawa MH2011 atau
[1-(4-hydroxynaphthalen-1-yl)-3-(4-hydroxyphenyl)urea] merupakan suatu analgetik baru hasil modifikasi
parasetamol yang telah didaftarkan ke Dirjen HAKI RI dan mendapatkan Nomor Permohonan Paten P00201200964. Senyawa MH2011 memiliki aktivitas analgetik dimana penentuan aktivitasnya berdasarkan pada molecular docking terhadap enzim COX-2 dan uji in vivo dengan metode geliat. Enzim COX-2 berperan aktif dalam pembentukan prostaglandin, sedangkan prostaglandin sendiri merupakan suatu mediator rasa nyeri (Purnomo, 2012a).
Parasetamol adalah obat yang sudah lama digunakan dalam mengatasi rasa nyeri karena memiliki aktivitas analgetik. Senyawa MH2011 didesain menggunakan molecular docking dalam kaitannya sebagai obat yang memiliki aktivitas analgetik. Hasil molecular docking menunjukkan bahwa senyawa MH2011 lebih stabil berikatan dengan COX-2 (6COX, PDB) dibandingkan dengan parasetamol, hal ini terlihat dari score docking senyawa MH2011 yang memiliki energi lebih rendah (-95,1628) daripada parasetamol (-67,4556), dalam berinteraksi dengan COX-2, sehingga dapat dikatakan bahwa senyawa MH2011 memiliki aktivitas analgetik yang lebih poten dibanding parasetamol (Purnomo, 2012a), hal tersebut juga didukung oleh uji in vivo pada mencit jantan galur
Senyawa MH2011 juga mempunyai keunggulan lain yaitu tidak menyebabkan hepatotoksis pada dosis yang sama dimana parasetamol menyebabkan hepatotoksis. Uji histopatologi menunjukkan bahwa senyawa MH2011 tidak menyebabkan kerusakan pada hepar mencit, hanya terjadi pelebaran pembuluh darah, sedangkan parasetamol menyebabkan kerusakan sel hepar mencit. Sel hepar mencit normal digunakan sebagai kontrol (Purnomo, 2012a).
Sifat fisika kimia partikel-partikel obat memiliki pengaruh yang sangat besar dalam kinetika pelarutan. Secara umum pelarutan obat dalam media berair memiliki peran yang penting sebelum diabsorpsi dalam suatu sistem biologi. Obat harus berada dalam bentuk terlarut pada saluran cerna agar dapat diabsorpsi dengan baik oleh tubuh (Shargel dan Yu, 1989).
Parameter kelarutan merupakan suatu ukuran dari gaya intermolekuler dalam pelarut, sehingga parameter kelarutan dapat memberikan informasi tentang kemampuan suatu larutan untuk bertindak sebagai suatu pelarut. Parameter kelarutan suatu obat memiliki korelasi terhadap kecepatan absorpsi membran dalam sistem biologis (Florence dan Attwood, 2006).
Suatu senyawa obat harus mampu menembus membran biologis dan mencapai jaringan target dalam jumlah yang cukup untuk dapat memberikan aktivitas. Parameter sifat fisika kimia yang paling berperan dalam proses distribusi tersebut adalah parameter lipofilik. Parameter sifat lipofilik yang sering digunakan dalam hubungan kuantitatif struktur aktivitas salah satunya adalah logaritma koefisien partisi (log P) (Siswandono dan Soekardjo, 2000). Reksohadiprodjo (1983) menyatakan bahwa koefisien partisi (log P) merupakan
salah satu sifat fisika kimia yang penting dalam menggambarkan aktivitas biologis suatu senyawa. Koefisien partisi dapat digunakan untuk menunjukkan kemampuan suatu molekul dalam menembus membran biologis yang bersifat seperti halnya lapisan lemak (Hansch, et al, 1972). Koefisien partisi digunakan dalam persamaan matematika yang mencoba menghubungkan aktivitas biologis suatu obat dengan karakteristik fisika dan kimianya (Cairns, 2004).
Sifat fisika kimia senyawa MH2011 belum diketahui. Penelitian ini bertujuan untuk melengkapi data sifat fisika kimia MH2011, yaitu parameter kelarutan dan koefisien partisi semu (Apparent Partition Coefficient/APC). Penelitian ini diharapkan dapat mendukung penelitian-penelitian MH2011 selanjutnya di bidang stabilitas, formulasi, dan aksi farmakologi.
B. Perumusan Masalah
Karakter fisika kimia senyawa MH2011 yang diperlukan untuk pengembangan lebih lanjut senyawa tersebut belum diketahui. Berdasarkan uraian di atas maka dapat dirumuskan masalah yaitu bagaimana karakter fisika kimia senyawa yang terduga MH2011 jika ditinjau dari parameter kelarutan dan koefisien partisi semu (APC)?
C. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk melengkapi data sifat fisika kimia senyawa yang terduga MH2011, yaitu parameter kelarutan dan koefisien partisi semu (APC).
D. Tinjauan Pustaka 1. Parameter Kelarutan
Parameter kelarutan, δT, merupakan suatu sifat fisika kimia intrinsik
dari sebuah senyawa yang membantu penjelasan mengenai interaksi antara molekul obat dan pelarut serta dalam pemilihan pelarut yang tepat untuk mendapatkan kelarutan yang optimal pada preformulasi. Semakin mirip nilai δT dari obat dan pelarut, maka semakin tinggi kelarutannya (Kharwade, et al.,
2013). Parameter kelarutan atau parameter Hildebrand (d) didefinisikan sebagai akar kuadrat dari tekanan dalam (gaya kohesi konstituen) serta interaksi antara solut dan solven (Bustamante dan Bustamante, 1996).
Parameter kelarutan yang menyatakan kohesi antara molekul sejenis, dapat dihitung dari panas penguapan, tekanan dalam, dan sifat-sifat lain seperti diuraikan oleh Hildebrand-Scott dalam persamaan (1).
δ = ∆ / (1)
dengan ∆ adalah panas penguapan, R adalah tetapan gas, T adalah temperatur mutlak, dan Vt adalah volume molar senyawa cair pada temperatur percobaan (Sinko, et al., 2011).
Parameter kelarutan suatu senyawa/solut dapat ditentukan dengan tiga cara yaitu:
1). Berdasarkan persamaan δ = √ ∆
Pada persamaan ini variabel yang sangat sulit ditentukan adalah harga V untuk zat padat karena harus menentukan volume molar zat
tersebut dalam keadaan cair pada temperatur percobaan yang hanya dapat dilakukan secara ekstrapolasi.
2). Berdasarkan persamaan parameter kelarutan parsial :
(δtotal, δD, δP, δH adalah harga molar zat terlarut). Persamaan ini digunakan untuk senyawa yang mempunyai harga andil gugus yang telah ditentukan dalam pustaka.
3). Berdasarkan persamaan parameter kelarutan parsial :
Penentuan parameter kelarutan dilakukan seperti cara 2, tetapi untuk memperkirakan kelarutan parsial bagi senyawa apabila harga-harga andil gugus tidak ditemukan dalam pustaka, untuk kontribusi gugus senyawa baru dan sangat sulit karena tidak ditemukan sumber pembanding.
Usaha lain perlu dicari untuk menentukan parameter kelarutan yang lebih mudah dan praktis, yaitu melalui uji kelarutan maksimum, dimana pada kondisi ini diasumsikan terbentuk larutan ideal. Parameter kelarutan solut sama dengan parameter kelarutan solven pada keadaan ideal tersebut, dengan demikian parameter kelarutan solut dapat diketahui.
Dua komponen yang semakin serupa/mirip harga parameter kelarutannya maka semakin besar kelarutan timbal-balik dari pasangan itu. Suatu perbedaan harus dibuat antara senyawa yang membentuk ikatan
hidrogen dan senyawa yang tidak membentuk ikatan hidrogen dalam penggunaan parameter kelarutan.
Penentuan parameter kelarutan dilakukan menggunakan dua macam pelarut dengan parameter yang berbeda. Kedua pelarut yang digunakan dalam penentuan parameter kelarutan harus bercampur dalam segala perbandingan (Kharwade, et al., 2013). Pelarut yang dapat digunakan misalnya campuran dioxan dan air. Perbandingan campuran dioxan-air yang digunakan dihitung dengan menggunakan persamaan (2).
(Vc δ c) = (Va δ a) + (Vd δ d) (2)
Dengan, Vc = volume campuran, Va = volume air, Vd = volume dioxan,
δc = parameter kelarutan campuran, δa = parameter kelarutan air, dan
δd = parameter kelarutan dioxan.
2. Koefisien Partisi
Koefisien partisi suatu obat didefinisikan sebagai tetapan kesetimbangan kadar obat dalam kedua fase, yaitu di dalam fase lipid dan di dalam fase air (Nogrady, 1992), hal ini dapat digambarkan dengan persamaan (3).
P = (3)
C adalah konsentrasi obat, sedangkan lipid dan air menunjukkan fasenya. Koefisien partisi oktanol/air yang dinyatakan dalam log P merupakan standar kuantitas untuk menentukan sifat hidrofobik suatu molekul. Parameter
hidrofobik/hidrofilik adalah sifat yang sangat penting dalam aplikasi biomedis (Katritzky, et al., 1996).
Koefisien partisi minyak/air dalam sistem-sistem seperti oktanol/air dan kloroform/air adalah suatu hasil pengukuran lipofilisitas obat dari indikasi kemampuannya untuk melewati membran sel. Koefisien partisi didefinisikan sebagai perbandingan obat yang tidak terion antara fase organik dan fase air pada kesetimbangan (Lachman, 1986).
Koefisien partisi merupakan suatu informasi penting karena dapat digunakan untuk memperkirakan proses absorpsi, distribusi, dan eliminasi suatu obat di dalam tubuh. Pengetahuan tentang nilai koefisien partisi dapat digunakan untuk memperkirakan onset kerja obat atau durasi kerja obat, hal ini untuk mengetahui obat akan bekerja secara aktif atau tidak (Cairns, 2004).
Koefisien partisi atau lipofilisitas bertanggung jawab terhadap potensi obat, karena untuk dapat masuk ke organisme dan mencapai reseptor dengan konsentrasi yang cukup serta dapat menimbulkan efek biologis obat harus melewati satu seri daerah hidrofobik dan hidrofilik (Reksohadiprodjo, 1985). Koefisien partisi (P) menggambarkan rasio pendistribusian obat ke dalam pelarut sistem dua fase, yaitu pelarut organik dan air. Molekul yang semakin larut lemak maka koefisien partisinya semakin besar dan difusi trans membran terjadi lebih mudah. Organisme terdiri dari fase lemak dan air, sehingga bila koefisien partisi sangat tinggi ataupun sangat rendah maka hal tersebut merupakan hambatan pada proses difusi zat aktif (Ansel, 1989).
Koefisien partisi dapat ditentukan hanya jika zat terlarutnya tidak terionisasi pada pH pengukuran. Proses ionisasi pada zat terlarut yang bersifat asam lemah atau basa lemah untuk membentuk garam akan sangat mempengaruhi profil kelarutan obat. Garam yang terionisasi penuh akan jauh lebih mudah terlarut di dalam air dibanding dengan asam atau basa yang tidak terionisasi, sehingga perbandingan konsentrasi obat di dalam fase air dan di dalam fase organik akan bervariasi bergantung pada pH pengukuran. Ada dua cara untuk menyelesaikan masalah tersebut, pertama, rincian percobaan diatur untuk memastikan bahwa P terukur merupakan koefisien partisi molekul-molekul yang tidak terionisasi (dengan demikian nilai P untuk asam diukur pada pH rendah ketika asam tidak terionisasi, dan untuk basa diukur pada pH tinggi untuk mencegah terjadinya ionisasi); kedua, perbandingan konsentrasi tersebut didefinisikan sebagai koefisien partisi semu, untuk membedakannya dari koefisien partisi spesies yang tidak terionisasi yang disebut sebagai koefisien partisi sebenarnya (Cairns, 2004).
Koefisien partisi semu (Apparent Partition Coefficient, APC/Papp)
bergantung pada proporsi senyawa yang terdapat di dalam larutan, yang selanjutnya bergantung pada pH larutan.
Papp = P ftidak terionisasi (4)
ftidak terionisasi adalah fraksi jumlah total obat yang tidak terionisasi pada pH
tertentu, dalam hal ini berarti jika ftidak terionisasi = 1, maka Papp = P (senyawanya
tidak terionisasi). Koefisien partisi obat tidak terionisasi (koefisien partisi sebenarnya) ditetapkan dengan persamaan (5).
P =
(5)
Dengan menggunakan konsentrasi total obat di dalam fase air, koefisien partisi semu dapat dihitung dengan persamaan (6).
P =
(6)
Kisaran kemungkinan nilai P yang ditemukan dalam molekul obat adalah luas, mulai dari fraksi yang kecil hingga bernilai beberapa ribu, dengan alasan ini, telah umum digunakan bentuk logaritma koefisien partisi atau log P (Cairns, 2004).
Pelarut nonpolar yang dahulu digunakan pada penentuan koefisien partisi adalah kloroform, karbontetraklorida, benzen, dan lain-lain. Sekarang yang lebih sering digunakan adalah oktanol, hal ini dikarenakan : 1. n-oktanol mengandung rantai hidrokarbon panjang yang bersifat nonpolar dan gugus hidroksi yang bersifat polar, sebagai pendekatan terhadap model membran biologis; 2. n-oktanol bersifat inert dan toksisitasnya rendah; 3. Kadar obat dalam pelarut (Co dan Cw) pada umumnya ditetapkan secara
spektrofotometri-UV, dan 1-oktanol tidak memberikan serapan yang berarti pada panjang gelombang ultraviolet, sehingga kadar senyawa dalam fase n-oktanol dapat ditetapkan dengan metode tersebut. Pelarut polar yang sering digunakan adalah air, air yang didapar pada pH tertentu, atau air yang didapar pada pH 7,4 sebagai pendekatan terhadap model cairan biologis (Siswandono dan Soekardjo, 2000).
Koefisien partisi sistem oktanol-air dapat digunakan untuk menggambarkan distribusi suatu senyawa di antara fase organik dan fase air. Koefisien partisi tidak berdimensi, maka setiap satuan konsentrasi dapat digunakan. Harga koefisien partisi tidak tergantung konsentrasi, sehingga idealnya pengukuran dilakukan pada konsentrasi larutan yang sangat encer. Pada asam dan molekul lain yang cenderung berasosiasi sebaiknya pengukuran dilakukan pada berbagai konsentrasi kemudian diplotkan pada konsentrasi yang sangat kecil (Hansch and Dunn, 1971).
Molekul-molekul yang dapat bereaksi dengan air membentuk ion, koefisien partisinya harus dikoreksi terhadap adanya ionisasi dan dinyatakan sebagai molekul netral atau spesies tak terionkan. Harga P harus dinyatakan sebagai molekul netral atau spesies yang tidak terionkan. Sebagai contoh :
R3N + H2O R3NH+ + OH-
I II
P diukur pada pH dimana hanya terdapat salah satu bentuk molekul saja, molekul netral atau bentuk ionnya. HCl 0,1 N atau NaOH 0,1 N dapat digunakan tergantung derajat disosiasi dari aminanya, pengenceran larutan, dan adanya larutan dapar atau tidak. Dalam larutan dapat terjadi dalam bentuk I atau II dengan perbandingan yang bervariasi (Purcell and George, 1973). Rumus koefisien partisi terkoreksi sebagai berikut :
P =
∝ (7)
Dengan, P = koefisien partisi, C = konsentrasi obat dalam fase, α = derajat ionisasi.
Harga α dapat dihitung sebagai berikut :
untuk asam, α =
(8)
untuk basa, α =
(9)
Untuk pKa lebih besar dari 10-7 tidak perlu koreksi (Purcell and George, 1973).
Koefisien partisi adalah suatu model perhitungan khusus dari kecepatan atau keseimbangan yang mempengaruhi sistem biologis, hal ini kemudian disepakati oleh ahli farmakologi dan kimia medisinal dan selanjutnya menandai kejadian penting dalam penyelidikan hubungan antara struktur dan aktivitas biologis (Sinko, et al., 2011). Aktivitas biologis tidak tergantung pada satu parameter tapi tergantung banyak parameter yang saling berpengaruh, namun demikian koefisien partisi merupakan parameter utama dalam mempelajari SAR. Aktivitas biologis beberapa gugus dari senyawa dapat dikorelasikan dengan koefisien partisinya dalam larutan polar dan nonpolar (Reksohadiprodjo, 1985).
Koefisien partisi susah diukur dalam sistem hidup sehingga biasanya ditentukan secara in vitro dengan menggunakan n-oktanol sebagai fase lipid dan dapar fosfat dengan pH 7,4 sebagai fase air. Koefisien partisi merupakan suatu nisbah, maka tidak mempunyai satuan. Koefisien partisi merupakan sifat aditif bagi molekul, karena setiap gugus fungsi memiliki andil dalam menetapkan kepolaran, dengan demikian juga menetapkan sifat lipofil atau hidrofil dari suatu molekul (Nogrady, 1992). Semakin besar polaritas suatu
obat koefisien partisinya semakin kecil, sebaliknya semakin kecil polaritas suatu obat koefisien partisinya semakin besar (Ritschel, 1976).
Pengukuran koefisien partisi di laboratorium kimia dapat dilakukan dengan tiga cara, yaitu metode labu kocok (shake flask), kromatografi lapis tipis fase terbalik, dan kromatografi cair kinerja tinggi fase terbalik (Cairns, 2004). Secara konvensional koefisien partisi dapat ditetapkan dengan jalan menimbang secara tepat sejumlah senyawa yang akan diselidiki, kemudian dilarutkan ke dalam salah satu pelarut dimana senyawa tersebut lebih mudah larut. Ditambah sejumlah pelarut kedua dan digojog, selanjutnya dipusingkan dengan putaran 2000 rpm selama 1-2 jam. Kedua pelarut lalu dipisahkan dan dianalisis. Pemusingan merupakan suatu hal yang penting karena dapat menyebabkan nilai partisi menjadi tinggi. Pemeriksaan hasil analisis akan lebih mudah dan jumlah total larutan yang terpartisi tidak perlu diketahui jika jumlah total senyawa diketahui (Rekker, 1986).
Harga log P dihitung dengan persamaan (10).
log P = log Co – log Cw (10)
dimana, Co = konsentrasi senyawa dalam pelarut organik, Cw = konsentrasi
senyawa dalam air
Analisis senyawa yang ada dalam masing-masing fase umumnya dilakukan dengan metode spektrofotometri karena relatif mudah dan dapat memberikan hasil yang lebih teliti. Kromatografi gas cair (GLC) juga dapat digunakan bila metode spektrofotometri tidak dapat digunakan. Analisis dapat juga dilakukan dengan menggunakan pereaksi Bessler yaitu untuk
senyawa-senyawa yang dapat memberikan atau melepaskan NH3 (amina atau karbamat)
(Rekker, 1986).
Metode konvensional dikenal juga sebagai metode penggojogan, merupakan metode yang membosankan dan cukup sulit terutama jika senyawa mempunyai kelarutan yang sangat kecil (Boyce dan Milborrow, 1965). Boyce dan Milborrow (1965) mengemukakan suatu metode sederhana, cepat dan banyak digunakan dewasa ini, yaitu metode kromatografi lapis tipis sistem
reverse phase (RPTLC), dengan memanfaatkan hubungan antara koefisien
partisi (π) dan harga Rf yang diperoleh dari kromatografi partisi cair-cair. Silika gel yang dilapisi parafin cair digunakan sebagai fase diam. Fase diam lain yang dapat digunakan adalah poliamida, dalam hal ini parafin diganti dengan minyak silikon (Rekker, 1986).
Fase gerak yang digunakan adalah campuran aseton-air atau pelarut organik lainnya yang dapat campur dengan air seperti metanol dan etanol, kadang-kadang agar lebih baik ditambahkan etilasetat. Fase gerak dijenuhi dulu dengan fase diamnya yaitu parafin cair atau minyak silikon. Perbandingan antara pelarut organik dan airnya tergantung lipofilisitas senyawa yang diselidiki, senyawa yang memiliki lipofilisitas tinggi tidak dapat bergerak jika dielusi dengan fase gerak yang mengandung konsentrasi air yang tinggi. Lempeng dikembangkan setelah sampel ditotolkan, pengembangan dilakukan dengan teknik menaik sampai fase geraknya mencapai jarak 15 cm dari tempat penotolan, setelah kering kemudian dideteksi dan dihitung harga Rf-nya (Rekker, 1986).
Deteksi dapat dilakukan mengunakan metode pembentukan senyawa yang memberikan reaksi warna dengan gugus fungsional dari senyawa yang diselidiki, selain itu dapat juga digunakan lampu ultraviolet untuk mendeteksi senyawa yang mempunyai inti aromatis. Selanjutnya log P dihitung dengan rumus :
log P = log K + RM (11)
Dimana, K = tetapan yang harganya tergantung sistem kromatografi yang digunakan, RM = retention modified
RM = log (12)
Metode ini biasanya digunakan jika hanya tersedia sejumlah bahan yang diselidiki dan apabila senyawa yang diselidiki diduga mengandung bahan pengotor. Bahan pengotor dapat terlihat pada lempeng namun dapat dibedakan dari bercak utama (Rekker, 1986).
Henry, et al., (1976) dan McCall (1975) telah melaporkan penggunaan kromatografi cair bertekanan tinggi dengan sistem reversed phase (RPHPLC) untuk menetapkan koefisien partisi. Selanjutnya retensi ditunjukkan dengan simbol k’ yang dapat dihubungkan dengan t0 dan tR melalui persamaan
berikut:
k’ = (13)
t0 adalah waktu elusi komponen yang tidak ditahan, tR adalah waktu elusi
komponen yang ditahan.
k’ sesuai dengan dari kromatografi lapis tipis, maka persamaan
tersebut dapat ditulis :
log P = log K + log k’ (15)
Persamaan tersebut menunjukkan bahwa waktu retensi (tR) dan faktor
kapasitas (k’) mempunyai hubungan yang linier dengan koefisien partisi yang ditegaskan sebagai log P (Rekker, 1986).
Fase diam yang digunakan adalah Corasil-18, suatu rantai oktadesil yang diikatkan secara kimia pada pelikuler silika gel. Bahan ini mempunyai stabilitas hidrolitik yang baik dan memiliki sifat hidrofilik dan hidrofobik karena adanya terminasi silil eter dan adanya rantai alkil yang berturut-turut. Sistemnya menjadi reversed phase jika digunakan air sebagai fase geraknya (Rekker, 1986). Suatu perbaikan dilakukan oleh McCall (1975) yaitu melapisi Corasil-18 dengan piridin panas untuk memblok sisa aktif pada silanol yang dapat mengganggu dalam percobaan partisi cair-cair (Rekker, 1977).
Harga log P dapat juga ditetapkan dengan perhitungan matematis, untuk ini ada dua macam cara, yaitu dengan menjumlahkan harga tetapan fragmen hidrofobik (f) yang diberikan oleh Rekker (1977) atau dengan menjumlahkan harga tetapan substituen hidrofobik (π) yang diberikan oleh Hansch (Rekker, 1986). Koefisien partisi dapat dihitung dengan tetapan f yang diberikan oleh Rekker menggunakan persamaan (16).
log P = ∑ (16) f adalah tetapan fragmen hidrofobik dan a adalah banyaknya fragmen dalam struktur. Harga f dapat diperoleh dari tabel, baik untuk senyawa aromatis maupun senyawa alifatis (Rekker, 1986).
Perlu dilakukan koreksi terhadap senyawa tertentu untuk mendapatkan hasil yang lebih teliti. Faktor koreksi tersebut dikenal sebagai Magic Constant atau disingkat CM, sehingga menghasilkan persamaan (17) (Rekker, 1986).
log P = ∑
(17)
Adapun senyawa-senyawa yang membutuhkan faktor koreksi tersebut diantaranya adalah :
1). Senyawa yang mempunyai dua gugus elektronegatif yang dipisahkan oleh satu atau dua atom C
Contoh : Dietanolamin HO C H 2 H 2 C N H H 2 C C H 2 OH
2). Senyawa dengan sistem konjugasi aril-aril Contoh : Bifenil
3). Senyawa dengan sistem kondensasi cincin aromatis Contoh : Kinolin
N
4). Senyawa dengan sistem konjugasi silang Contoh : Bensofenon
O
Tetapan substituen hidrofobik (π) yang diberikan oleh Hansch digunakan untuk menentukan harga log P oktanol-air dengan menggunakan persamaan (18).
log
= ρπ
(X) (18)P(SH) adalah koefisien partisi dari senyawa turunan (SH), P(SX) adalah koefisien
partisi dari senyawa dasar, dan ρ adalah tetapan yang menggambarkan sifat karakteristik dari pasangan pelarut yang digunakan untuk penetapan koefisien partisi. Untuk pasangan oktanol-air harga ρ = 1 (Rekker, 1977), maka persamaan (18) menjadi :
log
= π
(X) (19)Seperti pada tetapan fragmen hidrofobik, Hansch juga membedakan antara harga gugus yang terikat pada senyawa aromatis dan senyawa alifatis (Siswandono dan Soekardjo, 2000).
3. Kelarutan
Kelarutan didefinisikan dalam besaran kuantitatif sebagai kadar zat terlarut (solut) dalam larutan jenuh pada suhu tertentu, sedangkan secara kualitatif didefinisikan sebagai interaksi spontan antara dua zat atau lebih untuk membentuk dispersi molekuler homogen (Sinko, et al., 2011). Kelarutan suatu solut di dalam solven tergantung pada sifat kimia solut dan solven, selain itu tergantung juga pada faktor temperatur, tekanan (Sienko dan Plane, 1961), dan pH larutan. Pengetahuan tentang kelarutan penting karena dapat membantu dalam memilih medium yang paling tepat untuk obat atau kombinasi obat, dan dapat membantu jika timbul kesulitan dalam pembuatan larutan farmasetis, serta lebih jauh dapat bertindak sebagai standar atau uji kemurnian (Sinko, et al., 2011).
Tabel I.Tingkat kelarutan bahan dan istilah (Sinko, et al., 2011) Istilah kelarutan Jumlah bagian pelarut yang diperlukan
untuk melarutkan satu bagian zat Sangat mudah larut
Mudah larut Larut
Agak sukar larut Sukar larut
Sangat sukar larut Praktis tidak larut
Kurang dari 1 1 – 10 10 – 30 30 – 100 100 – 1.000 1.000 – 10.000 Lebih dari 10.000
Kelarutan suatu zat dapat dinyatakan dalam molar, molal, persen maupun fraksi mol. Kelarutan dalam Farmakope Indonesia, diartikan dengan kelarutan pada suhu 20 oC (Anonim, 1979) atau 25 oC (Anonim, 1995) dinyatakan dalam satu bagian bobot zat padat atau satu bagian volume zat
cair dalam bagian volume tertentu pelarut, kecuali dinyatakan lain. Kelarutan dapat juga dinyatakan dengan istilah seperti terlihat pada tabel I (Sinko, et al., 2011).
Larutan dapat didefinisikan sebagai suatu campuran dari dua atau lebih komponen yang membentuk suatu dispersi molekuler yang homogen, merupakan satu fase. Jika suatu zat larut dalam zat lain, maka partikel-partikel solut yang berupa molekul atau ion terbagi dalam solven dan partikel-partikel tersebut akan menggantikan tempat-tempat yang dalam keadaan normal ditempati oleh molekul-molekul solven. Zat-zat yang menunjukkan gaya tarik-menarik yang serupa cenderung saling melarutkan, hal ini sering dikenal dengan istilah like dissolves like (Moechtar, 1989).
Larutan yang mengandung zat terlarut dalam jumlah yang diperlukan untuk adanya kesetimbangan antara zat terlarut yang larut dan yang tidak larut disebut larutan jenuh. Jika suatu larutan lebih encer (kalah pekat) daripada suatu larutan jenuh disebut larutan tak jenuh (unsaturated), sedangkan jika suatu larutan lebih pekat dibandingkan suatu larutan jenuh disebut larutan lewat jenuh (supersaturated) (Keenan, et al., 1990).
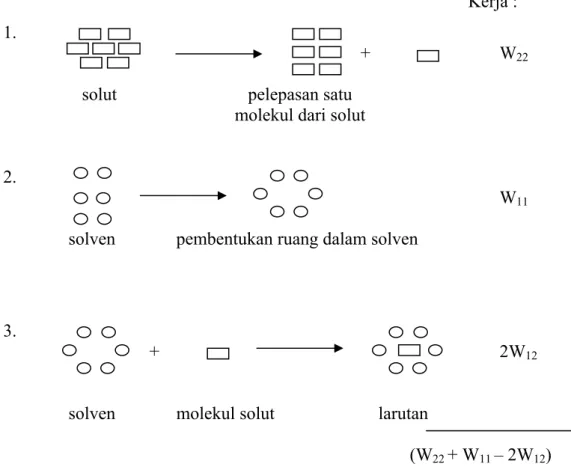
Proses pelarutan dapat dinyatakan dalam tiga tahap yang melibatkan interaksi antara solut-solut, solven-solven, dan solut-solven (Seinko dan Plane, 1961; Suwaldi, 1987). Tiga tahap tersebut adalah : 1. Pelepasan molekul solut dari permukaan kristal padat (memerlukan energi); 2. Pembentukan suatu celah dalam solven (memerlukan energi); 3. Penempatan molekul solut ke
dalam celah yang baru dibentuk di dalam solven (membebaskan energi) (Florence dan Attwood, 2006).
Suatu model sederhana dari proses pelarutan dapat dilihat pada gambar 1.
Kerja : 1.
+ W22
solut pelepasan satu
molekul dari solut
2.
W11
solven pembentukan ruang dalam solven
3.
+ 2W12
solven molekul solut larutan
(W22 + W11 – 2W12)
Gambar 1. Diagram penggambaran tiga tahap dalam proses pelarutan kristal solut (Florence dan Attwood, 2006)
Keterangan:
1. Tahap pertama menyangkut pemindahan suatu molekul dari fase terlarut pada temperatur tertentu. Penerimaan energi potensial atau kerja netto untuk proses ini adalah W22.
2. Tahap kedua menyangkut pembentukan lubang dalam pelarut yang cukup besar untuk dapat menerima molekul zat terlarut. Kerja yang dibutuhkan untuk tahap ini adalah W11, dimana 11 adalah energi
interaksi antara molekul- molekul pelarut.
3. Molekul zat terlarut akhirnya ditempatkan dalam lubang dalam pelarut dan pertambahan kerja atau penurunan energi potensial dalam langkah ini adalah –W12. Angka 12 adalah energi interaksi zat terlarut dengan
pelarut.
Lubang dalam solven sekarang tertutup dan terjadi tambahan penurunan energi, -W12, usaha netto dalam langkah terakhir ini adalah -2W12. Persamaan
untuk kerja (W) yang dibutuhkan adalah : W = (W22 + W11 – 2W12), di mana
W mewakili energi potensial. Interaksi solut-solven dalam tahap terakhir adalah -2W12, sebagai ikatan-ikatan yang dibentuk oleh satu molekul solut dan
dua molekul solven. Semakin besar perbedaan antara (W22 + W11) dan W12
menyebabkan semakin besar kemungkinan obat tidak larut dalam solven (Florence dan Attwood, 2006).
Jika suatu solut dilarutkan dalam zat cair, ada dua kemungkinan yang terjadi, yaitu: larutan ideal dan non-ideal. Larutan ideal adalah larutan yang energi interaksi solut-solut, solut-solven, solven-solven sama besar, sehingga proses pelarutannya tidak mengabsorbsi atau melepaskan energi yang berupa kalor. Larutan non-ideal adalah larutan yang energi interaksi solut, solut-solven, solven-solven tidak sama, sehingga dalam proses pelarutannya
mengabsorbsi atau melepaskan energi dari luar atau keluar sistem (Sinko, et
al., 2011).
Kelarutan zat padat dalam larutan ideal bergantung pada temperatur, titik leleh zat padat, dan panas peleburan molar ∆ , yaitu jumlah panas yang
diabsorbsi untuk melelehkan 1 mol zat padat. Dalam larutan ideal, panas pelarutan sama dengan panas peleburan, yang dianggap konstan dan tidak tergantung pada temperatur. Kelarutan pada larutan ideal dapat dihitung melalui persamaan Hildebrand dan Scott (Sinko, et al., 2011) :
– ,∆ . . (20)
Dengan = Fraksi mol kelarutan ideal solut, = suhu lebur senyawa (dalam
0K), T = suhu percobaan (dalam 0K), dan R = tetapan gas (8,314x107 erg/der
mol).
Tipe larutan ideal jarang dijumpai dalam praktek. Untuk larutan non-ideal harus diperhitungkan pula faktor-faktor aktivitas solut yang koefisiennya sebanding dengan volume (molar) solut dan fraksi volume solven, parameter
kelarutan (δ) yang besarnya sama dengan harga akar tekanan dalam (√ ) solut dan interaksi antara solven-solut. Persamaan yang paling sederhana untuk larutan non-ideal, dinyatakan dalam persamaan (21) yang dikenal sebagai kelarutan regular dan dirumuskan oleh Scatchard-Hildebrand (Sinko,
et al., 2011).
- log X2 = ∆
, . .
.∅
Dengan V2 = volume molar solut, d1 = parameter kelarutan solven,
d2 = parameter kelarutan solut, dan ∅ = fraksi volume solven.
Faktor-faktor yang mempengaruhi kelarutan antara lain adalah sifat solut dan solven (Florence dan Attwood, 2006; Moecthar, 1989), pH medium (Sinko, et al., 2011), temperatur (Moecthar, 1989), tekanan (Osol, 1980), pengaruh solven, komposisi solven, pengaruh surfaktan (Sinko, et al., 2011), dan ukuran partikel (Lachman, et al., 1986).
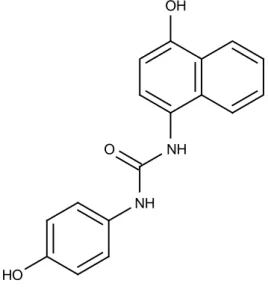
4. Senyawa MH2011 [1-(4-hydroxynaphthalen-1-yl)-3-(4-hydroxyphenyl)urea]
Senyawa MH2011 dengan rumus molekul C17H14N2O3 memiliki bobot
molekul 294, melebur pada suhu 246,2 oC, terdekomposisi pada suhu 208,5 oC dan mempunyai struktur seperti pada gambar 2. Senyawa MH2011 merupakan salah satu modifikasi parasetamol yang memiliki aktivitas analgetik yang lebih poten dibandingkan parasetamol, disintesis dengan menggunakan
starting material p-aminofenol, 4-amino-1-naftol, dan urea. Titik lebur starting material yang digunakan dalam sintesis senyawa MH2011 dapat
dilihat pada tabel II. Aktivitas analgetik senyawa MH2011 dapat diketahui dari kestabilan ikatan senyawa MH2011 dengan reseptor/enzim COX-2 (Purnomo, 2012a) dan uji in vivo pada mencit jantan galur Balb/C dengan metode geliat (Sofiana, 2013). Reseptor COX-2 ini berperan aktif dalam pembentukan prostaglandin sebagai mediator demam dari asam arakidonat. Pada saat mengalami luka, dinding sel akan rusak sehingga menghasilkan fosfolipid oleh enzim fosfolipase-A2 dapat diubah menjadi asam arakidonat
sebagai prekursor terbentuknya prostaglandin. Peran dari reseptor 6COX adalah pada saat pembentukan prostaglandin, native ligand akan berikatan dengan reseptor 6COX sehingga akan mengaktifkan COX-2 dalam pembentukan prostaglandin. Prostaglandin inilah yang akan menjadi mediator demam (Neal, 2006). O NH NH HO OH Gambar 2. Struktur senyawa MH2011
Tabel II. Titik lebur starting material yang digunakan dalam sintesis senyawa MH2011
Senyawa Titik lebur (oC)
p-aminofenol 187,5 (Anonim, 2009a)
4-amino-1-naftol 188,0 (Anonim, 2006)
Urea 132,7 (Anonim, 2009b)
Senyawa MH2011 memiliki ikatan yang lebih stabil berikatan dengan COX-2 dibandingkan dengan parasetamol, hal ini terlihat dari score docking bahwa senyawa MH2011 memiliki energi yang lebih rendah (-95,1628) daripada parasetamol (-67,4556) untuk berikatan dengan COX-2 sehingga dapat dikatakan bahwa senyawa MH2011 membutuhkan energi yang lebih
kecil dibandingkan parasetamol untuk berikatan dengan COX-2, dengan kata lain MH2011 memiliki aktivitas sebagai analgetika yang lebih poten (Purnomo, 2012a). Nilai ED50 MH2011 sebesar 10,98 mg/kgBB (Sofiana,
2013) lebih poten dibanding senyawa invensi sebelumnya HP2009 atau 1,3-bis-p-(hidroksifenil)urea sebesar 58,55 mg/kg BB dan parasetamol 91,00 mg/kgBB (Purnomo, 2012b).
Senyawa MH2011 memiliki 5 bagian hydrogen bonding donor
capability dan hydrogen bonding acceptor capability, hal ini terlihat pada
lampiran I. Ikatan hidrogen terbentuk antara suatu atom yang bersifat elektronegatif (biasanya N dan O) dan atom hidrogen yang berikatan dengan atom elektronegatif lain pada molekul yang sama atau berbeda. Atom yang berikatan dengan hidrogen disebut sebagai donor hidrogen, sedangkan atom elektronegatif yang lain adalah akseptor hidrogen. Ikatan hidrogen dapat bersifat intramolekuler atau intermolekuler (Sumardjo, 2006). Kedua gugus -NH- pada molekul MH2011 terhibridisasi sp3 (tetrahedral) sehingga tidak menutup kemungkinan terjadi ikatan hidrogen intramolekuler yang menyebabkan kemampuan MH2011 untuk berikatan hidrogen dengan air hanya kecil. Molekul senyawa MH2011 juga dapat melakukan ikatan hidrogen intermolekuler dengan molekul MH2011. Struktur MH2011 memiliki 2 cincin aromatik yaitu dari benzena dan naftalena yang miskin substitusi hal ini juga menyebabkan kelarutan MH2011 dalam air kecil. Beberapa hal tersebut kemungkinan yang menyebabkan MH2011 sangat sukar larut dalam air (Muhammad, 2014).
5. Hubungan pKa, pH, dan Koefisien Partisi
Suatu senyawa yang bersifat lipofilik akan didistribusikan dengan mudah ke dalam jaringan, prinsip tenaga penggeraknya adalah gradien konsentrasi dari obat yang tidak terionisasi dan yang tidak terikat di antara jaringan, hal ini dipengaruhi oleh harga pH ekstra dan intra seluler serta pKa (Manfred, 1980). Suatu elektrolit berdifusi ke dalam membran menurut kelarutannya di dalam lemak dari bentuk tak terionkan dan menurut derajat ionisasi pada pH tertentu. Kedua bentuk ionisasi dan tak terionkan ada bersama-sama dalam larutan air, kedua bentuk ini merupakan fungsi pH larutan serta tetapan disosiasi (Ka) yang dihitung sebagai berikut :
Untuk asam pKa – pH = log (Cm – Ci) (24)
Untuk basa pKa – pH = log (Ci – Cm) (25)
Dimana Cm dan Ci adalah konsentrasi molekul yang tak terionkan dan bentuk
yang terionkan (Notari, 1980).
pH memiliki sifat tertentu terhadap derajat ionisasi kebanyakan obat dan hal ini selanjutnya mempengaruhi kelarutan obat dalam lipid, permeabilitas membran, dan absorpsi. Sebagian besar obat diabsorbsi secara difusi pasif melalui dinding lipid, maka koefisien partisi lipid-air dan pKa obat merupakan hal yang memiliki pengaruh penting terhadap derajat absorpsi obat tertentu dalam sistem cerna. Pada umumnya kebanyakan asam lemah tidak terionisasi dalam lambung dan diabsorpsi dengan baik di tempat yang berdinding lipid. Asam kuat umumnya tidak diabsorpsi dengan baik karena derajat ionisasinya yang besar (Howard, 1985). Sebagai contoh: distribusi dari
obat yang bersifat asam lemah (aspirin) menembus membran lipid secara teoritik dari dua media yang berbeda pH-nya yang diperlihatkan pada gambar 3.
Pada pH 1 (media A) derajat ionisasi aspirin sekitar 0,003, pK-nya 3,5 sehingga setiap unit dari jumlah total obat dalam media A hanya 0,003 unit sebagai obat yang terionkan pada kesetimbangan. Pada pH 7,4 (media B) derajat ionisasi sekitar 0,999 unit sebagai bentuk ion. Pada kondisi kesetimbangan rasio kadar antara media B dan A adalah (1+100)/1, dengan demikian aspirin pada pH 1 lebih banyak menembus membran lipid sebagai molekul yang tak terionkan daripada pH 7,4 (Notari, 1980).
Medium A Membran Medium B
pH = 1 pH = 7,4
α = 0,003 α = 0,999
Gambar 3. Distribusi aspirin di antara dua media pH 1 dan pH 7,4 yang dipisahkan oleh membran lipid
Perubahan pH dalam fase air dapat mengubah derajat disosiasi suatu elektrolit. Gugus yang tak terionkan umumnya lebih larut dalam fase
nonpolar, oleh karena itu dengan kenaikan pH untuk obat yang bersifat asam, koefisien partisi akan turun, untuk obat yang bersifat basa akan naik, sehingga pH akan memiliki pengaruh yang nyata terhadap penetrasi dan absorbsi elektrolit lemah serta transpornya dalam sistem fisiologis (Ritschel, 1976).
Hubungan matematik antara koefisien partisi (P), pKa dan pH dapat diungkapkan sebagai berikut :
Sebagai dasar P = (26)
dan Ka = (27)
Koefisien partisi yang diperoleh dari penetapan dengan mengukur pada pH tertentu dapat digambarkan sebagai :
P’ =
(28)
Dari persamaan (26), (27), dan (28), maka diperoleh persamaan (29)
= = = (29)
E. Landasan Teori
Senyawa MH2011 merupakan senyawa baru hasil modifikasi parasetamol yang memiliki aktivitas analgetik lebih poten. Senyawa MH2011 memiliki 5 bagian hydrogen bonding donor capability dan hydrogen bonding acceptor
capability, pada molekulnya, selain ikatan hidrogen intramolekuler, ikatan
pada struktur molekulnya, senyawa MH2011 memiliki dua cincin aromatik. Hal-hal tersebut kemungkinan yang menyebabkan senyawa ini sangat sukar larut di dalam air. Sifat fisika kimia merupakan informasi yang penting untuk mendukung penelitian-penelitian selanjutnya mengenai senyawa MH2011, dua di antaranya adalah parameter kelarutan dan koefisien partisi semu (APC). Parameter kelarutan menyatakan kohesi antara molekul sejenis, hal ini membantu penjelasan mengenai interaksi antara molekul obat dan pelarut serta dalam pemilihan pelarut yang tepat untuk mendapatkan kelarutan yang optimal pada preformulasi. Penentuan parameter kelarutan dapat dilakukan dengan menggunakan pelarut campuran dioxan-air dengan metode shake flask. Koefisien partisi merupakan standar kuantitas untuk menentukan sifat hidrofobik suatu molekul, penentuan parameter kelarutan semu (APC) dapat dilakukan dengan dua pelarut yang saling tidak campur, yaitu oktanol dan air dengan menggunakan metode shake flask. Senyawa MH2011 sukar larut di dalam air, sehingga konsentrasinya di dalam fase air kecil sedangkan konsentrasinya di dalam fase organik tinggi.
F. Hipotesis
1. Senyawa yang terduga MH2011 tergolong senyawa nonpolar dengan nilai parameter kelarutan rendah
2. Senyawa yang terduga MH2011 tergolong senyawa nonpolar dengan nilai koefisien partisi semu (APC) tinggi