TOLERAN TERHADAP CEKAMAN KEKERINGAN
DAN RESISTEN TERHADAP PENYAKIT BUSUK
BATANG Sclerotium rolfsii
Oleh :
A. Farid Hemon
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
ii
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi yang berjudul : “Efektifitas Seleksi In Vitro Berulang untuk Mendapatkan Plasma Nutfah Kacang Tanah yang Toleran terhadap Cekaman Kekeringan dan Resisten terhadap Penyakit Busuk Batang Sclerotium rolfsii” adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum pernah diajukan dalam bentuk apapun untuk memperoleh gelar program sejenis di perguruan tinggi lain. Sumber informasi yang berasal atau dikut ip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Bogor, Desember 2006
A. Farid Hemon
iii
ABSTRACT
A. FARID HEMON, 2006. Effectiveness of Repeat Cycling In Vitro Selection to Produce Drought Tolerant and Stem Rot Sclerotium rolfsii Resistant Peanut Germplasm. SUDARSONO, RUSMILAH SUSENO, HAJRIAL ASWIDINNOOR, dan WIDODO.
The main limiting factors of peanut cultivation in dry land are water insufficient and S. rolfsii infection. The effort of peanut cultivation management in upland is use of drought tolerant and disease resistant cultivar. Application of somaclonal variation induction and in vitro selection using selective agent is reliable method to be developed to create new peanut line. For this reason, the objectives of this research were to evaluate effectiveness of 1) repeat cycling in vitro selection using medium containing polyethylene glycol (PEG) and culture filtrate of S. rolfsii to obtain drought tolerant and stem rot disease resistant peanut cultivar, respectively, and 2) double in vitro selection in both medium containing PEG and culture filtrate.
The experiment was inisiated with induction of somaclonal variation in MS medium containing picloram 16 µM (MS-P16). Medium of MS-P16 that added PEG 15% as selective agent for drought stress and MS-P16 medium with culture filtrate 30% as selective agent for disease resistance. Embriogenic calli were placed on PEG medium during three mont hs per cycle. PEG insensitive somatic embryos (SE) were proliferated, and this SE named SE Pi-I. Somatic embryos Pi-I were secondly selected on PEG medium (repeat cycling, two cycles, ES Pi-II). In vitro double selection was done with challenge SE Pi-I against culture filtrate medium, and insensitive SE named SE PFi-I. Repeat cycling and double in vitro selection against culture filtrate medium as same as PEG in vitro selection. In vitro selection on culture filtrate medium was gotten insensitive SE one cycle (Fi-I), SE two cycles (repeat cycling selection, Fi-II). Somatic embryos
Fi-I was selected on PEG mediun (double selection, SE FPi-I).
All insensitive selected SEs from repeat cycling and double in vitro selection were germinated to generate plantlets (R0 generation). These plants were harvested to obtain R0:1 seeds. The seeds were grown (R1 plant) to produce R1:2 seeds. These plants of R2 generation were used to somaclonal plant evaluation against PEG stress, water stress, and pathogen infection.
Result of this research showed 1) after repeat cycling in vitro selection, PEG and culture filtrate insensitive SE and its R0 shoot of cv. Kelinci and Singa were respectively more tole rance against PEG and culture filtrate stress, 2) while one identified from double selection were more tolerance to both PEG and culture filtrate medium, 3) peanut plant of R0 and R1 resulted from repeat cycling and double in vitro selection consisted of qualitative and quantitative variants, 4) plant performance produced from repeat cycling in vitro selection to PEG was lesser leaf necrosed symptom and more survive under PEG stress, 5) somaclonal plants regenerated from repeat cycling in vitro selection against PEG were more tolerance to water defisit, produced higher vegetative growth and dry pod yield, and lower dry pod yield reduction, 6) regenerant peanut plants resulted from selected SE two cycles against culture filtrate were more resistance to S. rolfsii
iv Finally, this research has showed that repeat cycling and double in vitro selection more effective to produce drought tolerance and S. rolfsii resistance peanut germplasm.
v
ABSTRAK
A. FARID HEMON, 2006. Efektifitas Seleksi In Vitro Berulang untuk Mendapatkan Plasma Nutfah Kacang Tanah yang Toleran terhadap Cekaman Kekeringan dan Resisten terhadap Penyakit Busuk Batang Sclerotium rolfsii. SUDARSONO, RUSMILAH SUSENO, HAJRIAL ASWIDINNOOR, dan WIDODO.
Kendala utama penanaman kacang tanah di lahan kering adalah masalah kekurangan air dan serangan cendawan S. rolfsii. Upaya pengelolaan budidaya kacang tanah di lahan kering adalah menggunakan kultivar toleran kekeringan dan resisten infeksi S. rolfsii. Penggunaan teknik induksi variasi somaklonal dan seleksi in vitro dengan menggunakan agens penyeleksi merupakan metode yang layak untuk dikembangkan. Seleksi in vitro yang dilakukan hanya satu siklus (tiga bulan), masih banyak ditemukan tanaman somaklon yang peka pada kekeringan dan rentan terhadap penyakit. Untuk itu, penelitian disertasi ini dilakukan dengan tujuan menguji efektifitas (1) seleksi in vitro berulang dalam media yang mengandung polietilena glikol (PEG) atau filtrat kultur S. rolfsii untuk mendapatkan tanaman kacang tanah toleran kekeringan dan resisten terhadap penyakit busuk batang, secara berturut-turut, dan (2) seleksi ganda dalam media yang mengandung PEG dan filtrat kultur untuk mendapatkan kacang tanah yang toleran cekaman kekeringan dan resisten terhadap penyakit. busuk batang S. rolfsii.
Percobaan diawali dengan menginduksi variasi somaklonal dengan media MS yang mengandung pikloram (MS-P16). Media MS-P16 yang ditambah PEG 15% digunakan sebagai agens penyeleksi untuk cekaman kekeringan dan media MS-P16 dengan penambahan filtrat kultur S. rolfsii 30% sebagai agens penyeleksi resistensi terhadap S. rolfsii. Kalus embriogen ditempatkan dalam media PEG selama tiga bulan per siklus. Embrio somatik (ES) yang insensitif pada PEG diproliferasi, dan ES ini disebut ES Pi-I. Kalus embriogen Pi-I diseleksi kembali pada media PEG (seleksi berulang/dua siklus, ES Pi-II). Seleksi ganda dilakukan dengan menempatkan ES Pi-I pada media filtrat kultur dan disebut ES PFi-I. Seleksi in vitro berulang pada media filtrat kultur sama seperti seleksi pada media PEG. Akhir dari seleksi in vitro pada filtrat kultur diperoleh ES insensitif satu siklus (ES Fi-I) dan ES insensitif dua siklus (seleksi berulang, ES Fi-II). Embrio somatik Fi-I diseleksi pada media PEG dan yang insensitif disebut ES FPi-I.
Semua ES insensitif hasil seleksi in vitro berulang dan seleksi ganda dikecambahkan sampai tumbuh planlet (generasi R0). Tanaman ini dipane n untuk mendapatkan benih R0:1. Benih ini ditanam kembali (generasi R1) untuk mendapatkan benih R1:2. Benih R1:2 (tanaman R2) inilah yang digunakan untuk menguji toleransi terhadap larutan PEG pada media sekam, terhadap cekaman kekeringan, dan resistensi terhadap infeksi cendawan.
Hasil penelitian adalah (1) ES dan tunas R0 kacang tanah cv. Kelinci dan Singa hasil seleksi in vitro berulang pada media PEG atau filtrat kultur lebih insensitif secara bertur ut-turut terhadap media PEG dan media filtrat kultur, (2) ES dan tunas R0 cv. Kelinci dan Singa hasil seleksi ganda pada media PEG dan filtrat kultur lebih insensitif terhadap media PEG dan filtrat kultur, (3) tanaman kacang tanah generasi R0 dan R1 hasil seleksi in vitro berulang dan seleksi ganda menghasilkan varian kualitatif dan kuantitatif, (4) penampilan tanaman yang
vi dihasilkan dari seleksi in vitro berulang pada PEG menunjukkan gejala nekrosis pada daun lebih sedikit dan mampu bertahan hidup lebih lama pada media sekam dengan larutan PEG. Tanaman ini juga memberikan pertumbuhan vegetatif akar dan tajuk yang lebih baik dengan tingkat toleransi yang lebih baik terhadap cekaman PEG, (5) tanaman dari hasil seleksi in vitro berulang pada PEG menghasilkan pertumbuhan vegetatif dan hasil polong yang lebih tinggi dengan persentase penurunan hasil polong lebih kecil. Tanaman ini juga mempunyai tingkat toleransi yang lebih baik terhadap cekaman kekeringan, dan (6) tanaman dari hasil regenerasi seleksi ES selama dua siklus pada media filtrat kultur menghasilkan polong lebih tinggi dengan penurunan hasil polong akibat infeksi cendawan lebih rendah. Tanaman ini lebih tahan terhadap serangan S. rolfsi.
Penelitian ini telah menunjukkan bahwa seleksi in vitro berulang dan seleksi ganda cukup efektif untuk mendapatkan plasma nutfah tanaman kacang tanah yang toleran terhadap cekaman kekeringan dan resisten terhadap penyakit busuk batang S. rolfsii.
vii
EFEKTIFITAS SELEKSI IN VITRO BERULANG UNTUK
MENDAPATKAN PLASMA NUTFAH KACANG TANAH
TOLERAN TERHADAP CEKAMAN KEKERINGAN
DAN RESISTEN TERHADAP PENYAKIT BUSUK
BATANG Sclerotium rolfsii
Oleh :
A. Farid Hemon
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
viii
© Hak cipta milik Institut Pertanian Bogor, tahun 2006
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi, mikrofilm, dan sebagainya
ix
GLOSARI
ES : embrio somatik, suatu sel tubuh tunggal yang diinduksi untuk ditumbuhkan ke dalam tanaman lengkap.
ES primer : embrio somatik yang pertama terbentuk dari eksplant ES sekunder : embrio somatik yang terbentuk dari embrio somatik
primer setelah disubkultur.
ES Pi-I : embrio somatik insensitif hasil seleksi selama satu siklus (3 bulan) pada media selektif MS-P16 yang mengandung polietilena glikol 15%.
ES Pi-II : embrio somatik insensitif hasil seleksi secara berulang ES Pi-I selama satu siklus lagi pada media selektif MS- P16 yang mengandung polietilena glikol 15% (dua siklus = 6 bulan).
ES PFi-I : embrio somatik insensitif hasil seleksi ES Pi-I diseleksi lagi selama satu siklus pada media selektif MS-P16 yang ditambahkan filtrat kultur 30% S. rolfsii (3 bulan pertama dalam media PEG dan kemudian 3 bulan kedua dalam media filtrat kultur).
ES Fi-I : embrio somatik resisten hasil seleksi selama satu siklus (3 bulan) pada media selektif MS-P16 yang mengandung filtrat kultur 30% Sclerotium rolfsii.
ES Fi-II : embrio somatik resisten hasil seleksi secara berulang ES Fi-I selama satu siklus lagi pada media selektif MS- P16 yang mengandung filtrat kultur 30% Sclerotium rolfsii (dua siklus = 6 bulan).
ES FPi-I : embrio somatik resisten hasil seleksi ES Fi-I diseleksi lagi selama satu siklus pada media selektif MS-P16 yang ditambahkan PEG 15%(3 bulan bulan pertama dalam media filtrat kultur dan kemudian 3 bulan kedua dalam media PEG).
Filtrat kultur : hasil ekstraksi miselia cendawan S. rolfsii
Generasi R0, R1, R2 : tanaman generasi R0 hasil kecambah ES seleksi in vitro : tanaman generasi R1 zuriat dari generasi R0
: tanaman generasi R2 zuriat dari generasi R1
MS : media dasar Murashige dan Skoog untuk kultur jaringan MS-P16 : media MS yang mengandung 16 µM auksin pikloram Planlet atau tanaman
Pi-I
: planlet atau tanaman ya ng berasal dari ES Pi-I Planlet atau tanaman
Pi-II
: planlet atau tanaman yang berasal dari ES Pi-II Planlet atau tanaman
PFi-I
: planlet atau tanaman yang berasal dari ES PFi-I Planlet atau tanaman
Fi-I
: planlet atau tanaman yang berasal dari ES Fi-I Planlet atau tanaman
Fi-II
x Planlet atau tanaman
FPi-I
: planlet atau tanaman yang berasal dari ES FPi-I
PEG : polietilena glikol dengan berat molekul besar yang dapat menurunkan potensial air
Seleksi berulang : seleksi in vitro yang dilakukan secara berulang atau lebih dari satu siklus (satu siklus = 3 bulan) pada media selektif PEG 15% atau pada filtrat kultur 30%.
Seleksi ganda : seleksi in vitro yang dilakukan sekaligus pada dua media selektif, tiga bulan pertama pada media MS-P16 yang ditambahkan PEG 15%, dan tiga bulan kedua pada media yang ditambahkan filtrat kultur 30%. Atau sebaliknya, tiga bulan pertama pada media yang ditambahkan filtrat kultur 30%, an tiga bulan kedua pada media yang ditambahkan PEG 15%
Somaklon/regeneran : tanaman hasil seleksi in vitro yang berasal dari ES Pi-I, Pi-II, PFi-I, Fi-I, Fi-II, dan FPi-I.
xi Judul Disertasi : EFEKTIFITAS SELEKSI IN VITRO BERULANG UNTUK MENDAPATKAN PLASMA NUTFAH KACANG TANAH TOLERAN TERHADAP CEKAMAN KEKERINGAN DAN RESISTEN TERHADAP PENYAKIT BUSUK BATANG Sclerotium rolfsii
Nama Mahasiswa : A. Farid Hemon Nomor Pokok : A361020051 Program Studi : Agronomi
Menyetujui :
1. Komisi Pembimbing
Prof. Dr. Ir. Sudarsono, MSc. Prof. Dr. Ir. Rusmilah Suseno, MSc. Ketua Anggota
Dr. Ir. Hajrial Aswidinnoor, MSc. Dr. Ir. Widodo, MS Anggota Anggota
Mengetahui :
2. Ketua Program Studi Agronomi 3. Dekan Sekolah Pascasarjana
Dr.Ir. Satriyas Ilyas, MS. Prof. Dr. Ir. Khairil Anwar Notodiputro, MS.
xii
RIWAYAT HIDUP
A. FARID HEMON dilahirkan di Kabupaten Dompu Nusa Tenggara Barat pada tanggal 13 April 1963 sebagai anak kedua dari pasangan H. Hemon H. Arsyad dan Hj. St. Hadijah. Pendidikan Sarjana ditempuh di Jurusan Budidaya Pertanian Fakultas Pertanian Universitas Mataram, lulus pada tahun 1987. Pada tahun 1995, dia melanjutkan studi S2 dengan mayor Plant Breeding dan minor
Plant Pathology di Department of Horticulture, College of Agriculture, University of the Philippines Los Banos, dan lulus pada tahun 1997 dengan gelar Master of Science. Pada tahun 2002 dia terdaftar sebagai mahasiswa S3 di Sekolah Pascasarjana Institut Pertanian Bogor pada Program Studi Agronomi dengan menggunakan beasiswa pendidikan pascasarjana (BPPS) dari Departemen Pendidikan Nasional Republik Indonesia
Pada tanggal 29 Mei 1994, dia menikah dengan ULFAH KALSOM, dan dikarunia dua orang anak : Muhammad Dinullah Akbar (lahir 15 Maret 1995) dan Nurul Fidinia Hijah (lahir 20 Maret 1999).
Dari tahun 1989 sampai sekarang A. Farid Hemon bekerja sebagai staf pengajar di program studi Pemuliaan Tanaman Jurusan Budidaya Pertanian Fakultas Pertanian Universitas Mataram.
xiii
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2003 ini ialah seleksi in vitro, dengan judul “Efektifitas Seleksi In Vitro Berulang untuk Mendapatkan Plasma Nutfah Kacang Tanah yang Toleran terhadap Cekaman Kekeringan dan Resisten terhadap Penyakit Busuk Batang Sclerotium rolfsii.
Penulis menyampaikan ucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sudarsono, Dr. Hajrial Aswidinnoor, Dr. Widodo, dan Ibu Prof. Dr. Rusmilah Suseno, selaku Komisi Pembimbing yang telah banyak meluangkan waktunya untuk membimbing selama studi, pelaksanaan penelitian dan penulisan Disertasi ini. Ucapan yang sama penulis sampaikan kepada bapak dan ibu orang tua, mertua, istri dan anak tercinta, kakak dan adik serta seluruh keluarga, atas do’a, dukungan dan kasih saya ngnya selama studi ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2006
xiv
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii DAFTAR GAMBAR... xiii PENDAHULUAN... Latar Belakang... Tujuan Penelitian... Strategi Penelitian... 1 1 3 4 TINJAUAN PUSTAKA...
Penyakit Busuk Batang dan Mekasisme Ketahanan Tanaman
terhadap Sclerotium rolfsii... Pengaruh Cekaman Kekeringan dan Mekanisme Toleransi... Mutasi In Vitro... Seleksi In Vitro untuk Resistensi terhadap Penyakit...
Seleksi In Vitro untuk Toleransi terhadap Cekaman Kekeringan 6 6 8 11 13 15
PERCOBAAN BAGIAN I : SELEKSI IN VITRO, DIAWALI
PADA MEDIA POLIETILENA GLIKOL (PEG) 16
SELEKSI BERULANG DAN IDENTIFIKASI EMBRIO SOMATIK KACANG TANAH YANG INSENSITIF POLIETILENA GLIKOL DAN FILTRAT KULTUR Sclerotium rolfsii...
Abstrak... Abstract... Pendahuluan... Bahan dan Metode... Hasil... Pembahasan... Kesimpulan... 18 18 19 20 21 25 33 36 TIPE VARIAN SOMAKLONAL YANG DIAMATI DIANTARA
POPULASI TANAMAN KACANG TANAH HASIL SELEKSI IN VITRO BERULANG DAN SELEKSI GANDA...
Abstrak... Abstract... Pendahuluan... Bahan dan Metode... Hasil... Pembahasan... Kesimpulan... 37 37 38 39 41 43 50 53
xv PENAMPILAN TANAMAN KACANG TANAH HASIL SELEKSI
IN VITRO BERULANG DAN SELEKSI GANDA PADA
POLIETILENA GLIKOL DAN FILTRAT KULTUR Sclerotium rolfsii TERHADAP CEKAMAN LARUTAN POLIETILENA GLIKOL...
Abstrak... Abstract... Pendahuluan... Bahan dan Metode... Hasil... Pembahasan... Kesimpulan... 54 54 55 56 57 59 68 70 RESPONS TANAMAN KACANG TANAH SOMAKLON DARI
HASIL REGENERASI SELEKSI IN VITRO BERULANG DAN
SELEKSI GANDA TERHADAP KEKERINGAN... Abstrak... Abstract... Pendahuluan... Bahan dan Metode... Hasil ... Pembahasan... Kesimpulan... 71 71 72 73 75 78 94 97
PERCOBAAN BAGIAN II : SELEKSI IN VITRO, DIAWALI
PADA MEDIA FILTRAT KULTUR Sclerotium rolfsii 99
SELEKSI IN VITRO BERULANG DAN SELEKSI GANDA SERTA IDENTIFIKASI PLANLET INSENSITIF CEKAMAN AKIBAT PENAMBAHAN FILTRAT KULTUR Sclerotium rolfsii DAN
POLIETILENA GLIKOL... Abstrak...
Abstract...
Pendahuluan... Bahan dan Metode...
Hasil... Pembahasan... Kesimpulan... 101 101 102 103 104 108 115 118 VARIASI SOMAKLONAL DIANTARA TANAMAN KACANG
TANAH HASIL SELEKSI IN VITRO BERULANG PADA MEDIA FILTRAT KULTUR Sclerotium rolfsii DAN POLIETILENA GLIKOL.
Abstrak... Abstract... Pendahuluan... Bahan dan Metode... Hasil... Pembahasan... Kesimpulan... 119 119 120 121 123 124 132 134
xvi SKRINING TANAMAN KACANG TANAH HASIL REGENERASI
EMBRIO SOMATIK YANG DISELEKSI SECARA BERULANG PADA FILTRAT KULTUR Sclerotium rolfsii DAN POLIETILENA GLIKOL TERHADAP INFEKSI S. rolfsii...
Abstrak... Abstract... Pendahuluan... Bahan dan Metode... Hasil... Pembahasan... Kesimpulan... 135 135 136 137 139 141 156 160 PEMBAHASAN UMUM... 161 SIMPULAN DAN SARAN... 168 DAFTAR PUSTAKA... 171
xvii
DAFTAR TABEL
Halaman
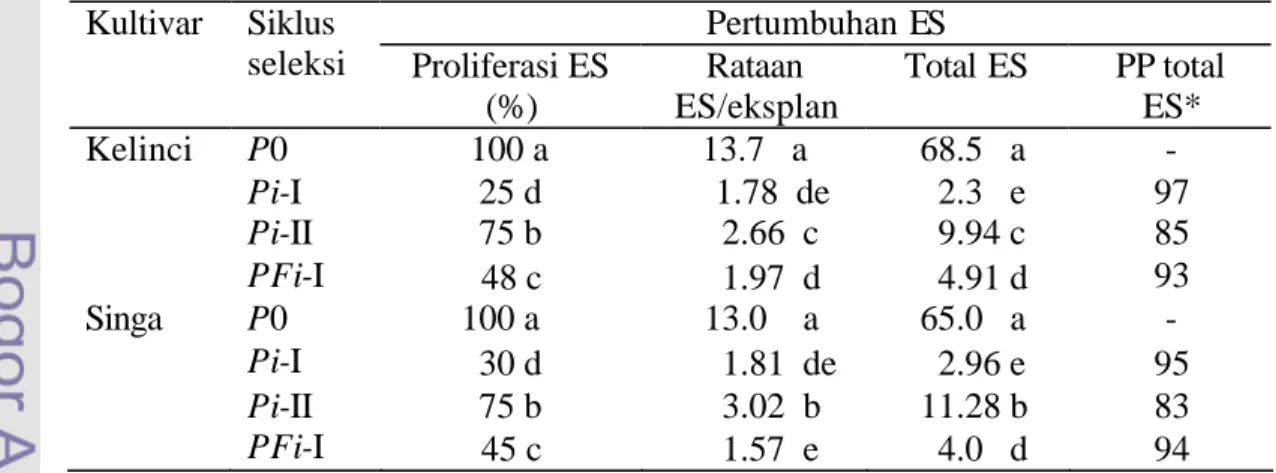
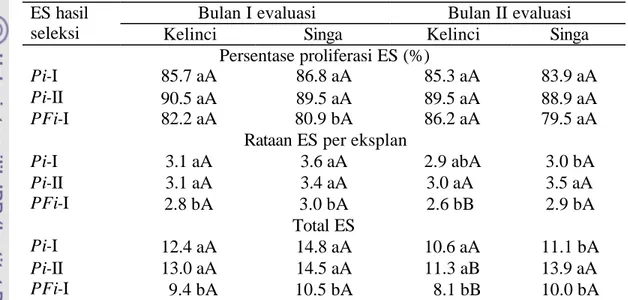
1. Pertumbuhan ES kacang tanah cv. Kelinci atau Singa hasil seleksi satu (Pi-I), dua siklus (Pi-II) dalam media MS-P16 dengan PEG, dan setelah seleksi ganda dalam media dengan PEG dan filtrat kultur S. rolfsii (PFi-I)
26
2. Respons terhadap cekaman PEG dari ES kacang tanah cv. Kelinci dan Singa insensitif PEG yang telah melalui satu (Pi-I), dua siklus (Pi-II) dalam media MS-P16 dengan PEG serta ES insensitif terhadap PEG dan filtrat kultur setelah melalui seleksi ganda dalam media dengan PEG dan filtrat kultur (PFi-I)
28
3. Respons terhadap cekaman filtrat kultur dari ES kacang tanah cv. Kelinci dan Singa insensitif PEG yang telah melalui satu (Pi-I), dua siklus (Pi-II) dalam media MS-P16 dengan PEG serta ES insensitif terhadap PEG dan filtrat kultur setelah melalui seleksi ganda dalam media dengan PEG dan filtrat kultur (PFi-I)
29
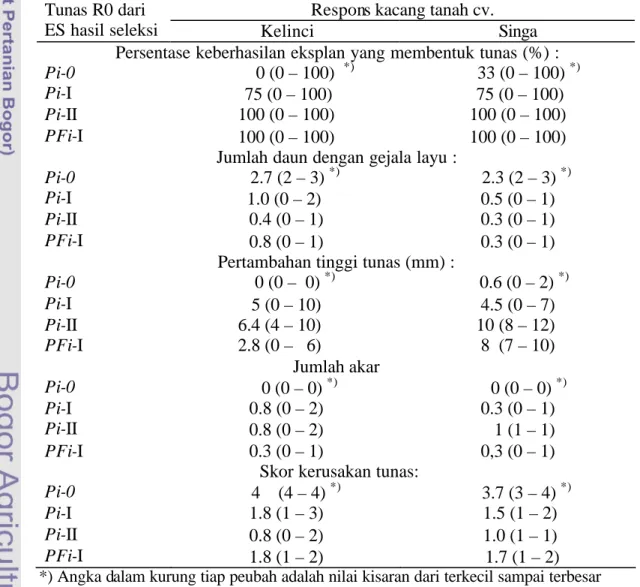
4. Perkecambahan dan regenerasi planlet dari ES kacang tanah cv. Kelinci dan Singa insensitif PEG yang telah melalui satu (Pi-I), dua siklus (Pi-II) dalam media MS-P16 dengan PEG atau insensitif terhadap PEG dan filtrat kultur setelah melalui seleksi ganda dalam media dengan PEG dan filtrat kultur (PFi-I)
30
5. Respons terhadap cekaman PEG dari stek pucuk planlet R0 kacang tanah cv. Kelinci dan Singa hasil regenerasi dari ES insensitif PEG satu (Pi-I) atau dua siklus (Pi-II) dalam media MS-P16 dengan PEG serta ES insensitif PEG dan filtrat kultur setelah melalui seleksi ganda dalam media PEG dan filtrat kultur (PFi-I)
31
6. Respons terhadap cekaman filtrat kultur dari setek pucuk planlet R0 kacang tanah cv. Kelinci dan Singa hasil regenerasi dari ES insensitif PEG satu (Pi-I) atau dua siklus (Pi-II) dalam media MS-P16 dengan PEG serta ES insensitif terhadap PEG dan filtrat kultur setelah melalui seleksi ganda dalam media PEG dan filtrat kultur (PFi-I)
32
7. Macam dan persentase varian kualitatif yang diamati diantara populasi tanaman R0 yang diregenerasikan dari ES kacang tanah cv. Singa dan Kelinci hasil seleksi satu (Pi-I), dua siklus (Pi-II) dalam media PEG serta hasil seleksi ganda dalam media PEG dan diikuti dalam media filtrat kultur (PFi-I) serta populasi tanaman R1
xviii 8. Jumlah cabang (JC), tinggi tanaman (TT), umur berbunga (UB),
jumlah daun (JD), bobot polong kering (BPK) dan jumlah polong kering (JPK) yang diamati pada tanaman cv. Kelinci dan Singa standar (Std), serta tanaman R0 yang diregenerasikan dari ES hasil seleksi in vitro pada media seleksi PEG siklus I (Pi-I), siklus II (Pi -II), dan seleksi ganda pada media PEG dan filtrat kultur (PFi-I)
47
9. Nomer galur tanaman generasi R2 zuriat dari generasi R1 kacang tana h hasil seleksi in vitro berulang dan seleksi ganda yang dievaluasi pada cekaman larutan PEG
57
10. Rata-rata jumlah hari tanaman untuk dapat bertahan hidup dan persentase (%) tanaman yang masih hidup sampai umur 50 hari dalam media yang diberi perlakua n PEG 15% pada populasi tanaman Pi-0 (tanpa seleksi in vitro) dan somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
60
11. Pengaruh cekaman PEG 15% terhadap pertumbuhan tanaman populasi tanaman Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
62
12. Indeks sensitivitas (S) terhadap cekaman PEG berdasarkan sejumlah karakter pertumbuhan pada populasi Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci ha sil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
64
13. Indeks sensitivitas (S) terhadap cekaman PEG berdasarkan sejumlah karakter pertumbuhan pada populasi Pi-0 (tanpa seleksi in vitro) dan galur populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
66
14. Nomer galur tanaman generasi R2 zuriat dari generasi R1 kacang tanah hasil seleksi in vitro berulang dan seleksi ganda yang dievaluasi pada cekaman kekeringan
76
15 Pengaruh cekaman kekeringan terhadap pertumbuhan tanaman pada populasi Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
xix 16. Persentase penurunannya bobot kering dan jumlah polong bernas
pada populasi Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii terhadap kondisi cekaman kekeringan dan optimum
81
17. Indeks sensitivitas kekeringan (S) berdasarkan sejumlah karakter agronomi pada populasi Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
88
18. Indeks sensitivitas kekeringan (S) berdasarkan bobot kering dan jumlah polong bernas pada populasi Pi-0 (tanpa seleksi in vitro) dan galur populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci seleksi dua siklus pada PEG (seleksi in vitro berulang)
89
19. Kandungan prolin dan gula total pada populasi Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii
terhadap kondisi cekaman dan optimum
92
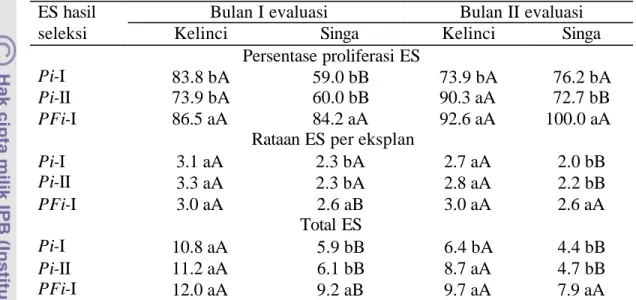
20. Pertumbuhan ES kacang tanah cv. Kelinci dan Singa setelah melalui satu (Fi-I), dua siklus (Fi-II) dalam media MS-P16 dengan filtrat kultur atau seleksi ganda dalam media dengan filtrat kultur dan PEG (FPi-I)
108
21. Respons ES kacang tanah hasil seleksi in vitro siklus I (Fi-I), siklus II (Fi-II), dan seleksi ganda (FPi-I) terhadap cekaman yang diinduksi oleh penambahan filtrat kultur S. rolfsii atau PEG dalam media
110
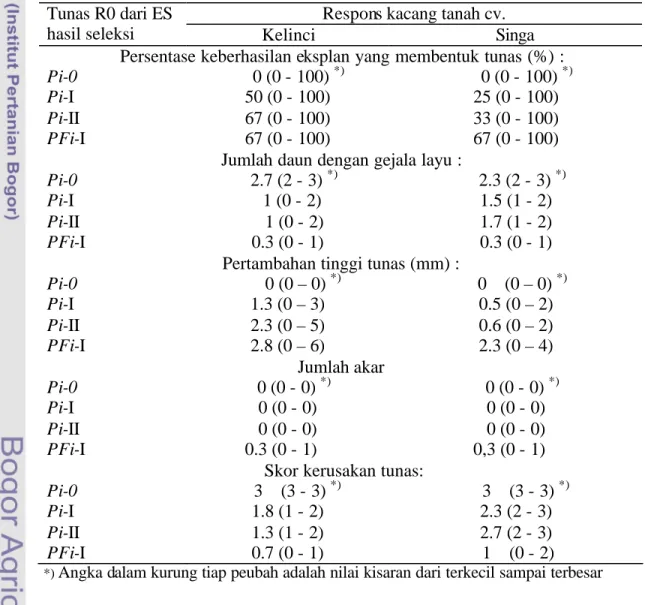
22. Perkecambahan dan regenerasi planlet dari ES kacang tanah cv. Kelinci dan Singa insensitif filtrat kultur yang telah melalui satu (Fi-I) atau dua siklus (Fi-II) dalam media MS-P16 dengan filtrat kultur serta ES insensitif terhadap filtrat kultur dan PEG setelah melalui seleksi ganda dalam media dengan filtrat kultur dan PEG (FPi-I)
111
23. Respons terhadap cekaman PEG dari setek pucuk planlet R0 kacang tanah cv. Kelinci dan Singa hasil regenerasi dari ES insensitif filtrat kultur melalui satu (Fi-I) atau dua siklus (Fi-II) dalam media MS-P16 dengan filtrat kultur serta ES insensitif terhadap filtrat kultur dan PEG setelah melalui seleksi ganda dalam media dengan filtrat kultur dan PEG (FPi-I)
xx 24. Respons terhadap cekaman filtrat kultur dari setek pucuk planlet R0
kacang tanah cv. Kelinci dan Singa hasil regenerasi dari ES insensitif filtrat kultur melalui satu (Fi-I) atau dua siklus (Fi-II) dalam media MS-P16 dengan filtrat kultur serta ES insensitif terhadap filtrat kultur dan PEG setelah melalui seleksi ganda dalam media dengan filtrat kultur dan PEG (FPi-I)
114
25. Macam dan persentase varian karakter kualitatif dibanding tanaman standar yang diamati diantara populasi tanaman generasi R0 dan R1 hasil seleksi ES satu (Fi-I), dua siklus (Fi-II) dalam media filtrat kultur serta hasil seleksi ganda dalam media filtrat kultur dan diikuti dalam media PEG (FPi-I) cv. Kelinci
126
26. Macam dan persentase varian karakter kualitatif diband ing tanaman standar yang diamati diantara populasi tanaman generasi R0 dan R1 hasil seleksi ES satu (Fi-I), dua siklus (Fi-II) dalam media filtrat kultur serta hasil seleksi ganda dalam media filtrat kultur dan diikuti dalam media PEG (FPi-I) cv. Singa
126
27. Jumlah cabang (JC), tinggi tanaman (TT), umur berbunga (UB), jumlah daun (JD), bobot polong kering (BPK) dan jumlah polong kering (JPK) tanaman kacang tanah cv. Kelinci dan Singa standar (Std), serta tanaman R0 hasil seleksi ES satu (Fi-I), dua siklus (Fi -II) pada media filtrat kultur serta hasil seleksi ganda dalam media filtrat kultur dan diikuti dalam media PEG (FPi-I)
127
28. Jumlah cabang (JC), tinggi tanaman (TT), umur berbunga (UB), jumlah daun (JD), bobot polong kering (BPK) dan jumlah polong kering (JPK) tanaman kacang tanah cv. Kelinci dan Singa standar (Std), serta tanaman R1 zuriat dari tanaman R0 hasil seleksi ES satu (Fi-I), dua siklus (Fi-II) pada media filtrat kultur serta seleksi ganda pada media filtrat kultur dan diikuti dalam media PEG (FPi-I)
128
29. Nomer galur tanaman kacang tanah hasil seleksi in vitro berulang dan seleksi ganda ES pada tanaman generasi R2 yang diskrining pada infeksi S. rolfsii
140
30. Persentase (%) tanaman mati dan jumlah hari hidup dari awal inokulasi sampai tanaman mati pada tanaman yang diinokulasi dengan cendawan S. rolfsii pada populasi tanaman Fi-0 (tanpa seleksi in vitro) dan somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media dengan penambahan filtrat kultur 30% dan seleksi ganda pada filtrat kultur S. rolfsii dan PEG
xxi 31. Pengaruh inokulasi cendawan S. rolfsii terhadap pertumbuhan
tanaman pada populasi Fi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media filtrat kultur S. rolfsii dan seleksi ganda pada filtrat kultur S. rolfsii dan PEG
143
32. Persentase penurunannya bobot kering dan jumlah polong bernas pada populasi Pi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media filtrat kultur S. rolfsii dan seleksi ganda pada filtrat kultur S. rolfsii dan PEG terhadap infeksi cendawan S. rolfsii
144
33. Indeks kerentanan terhadap penyakit S. rolfsii (K) berdasarkan bobot kering dan jumlah polong bernas pada populasi Fi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media filtrat kultur S. rolfsii dan seleksi ganda pada filtrat kultur S. rolfsii dan PEG
150
34. Indeks kerentanan terhadap penyakit (K) berdasarkan bobot kering polong dan jumlah polong pada populasi Fi-0 (tanpa seleksi in vitro) dan galur populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci dua siklus (seleksi in vitro berulang)
152
35 Aktivitas enzim peroksidase dan enzim kitinase menggunakan substrat dimer (pNP-NAcGlc) akibat infeksi S. rolfsii pada pangkal batang pada populasi Fi-0 (tanpa seleksi in vitro) dan populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro berulang pada media filtrat kultur S. rolfsii dan seleksi ganda pada filtrat kultur S. rolfsii dan PEG
xxii
DAFTAR GAMBAR
Halaman
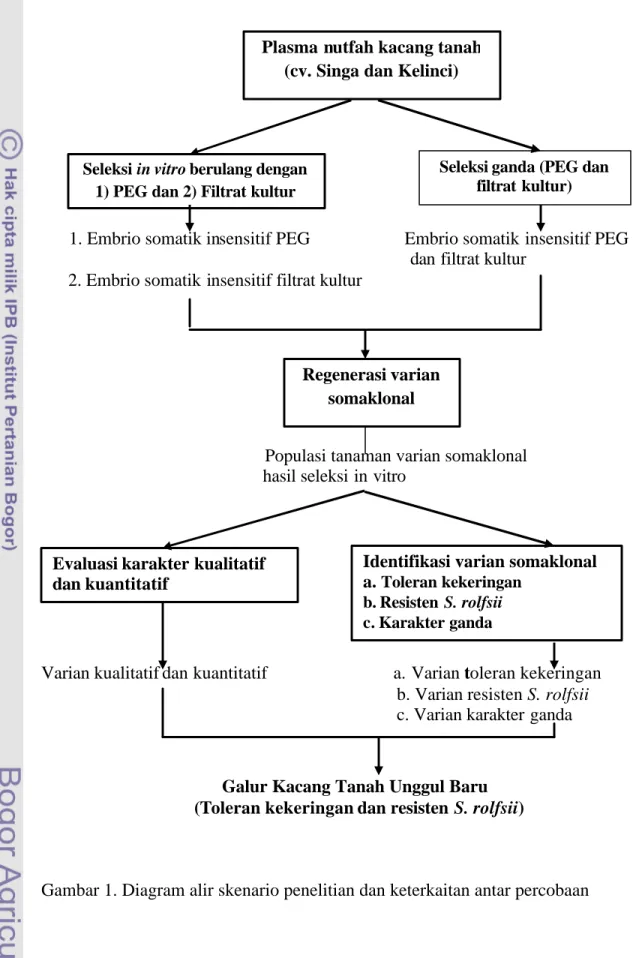
1. Diagram alir skenario penelitian dan keterkaitan antar percobaan 5 2. Respons perkembangan ES yang ditanam dalam media MS-P16 dan
media selektif. PEG
27
3. Regenerasi ES insensitif PEG dan filtrat kultur untuk membentuk planlet.
30
4. Contoh fenotipe varian yang diamati diantara populasi tanaman generasi R0 dan R1 yang diregenerasikan dari ES hasil seleksi in vitro berulang dalam media selektif PEG 15% atau hasil seleksi dalam media dengan PEG, diikuti dengan media filtrat kultur (seleksi ganda)
44
5. Jumlah tanaman R0 yang diregenerasikan dari ES cv. Kelinci hasil seleksi in vitro selama satu atau dua siklus dalam media PEG serta satu siklus dalam media PEG, diikuti media filtrat kultur (seleksi ganda) dan R1 zuriat dari tanaman R0 yang menghasilkan kisaran bobot polong kering tertentu
48
6. Jumlah tanaman R0 yang diregenerasikan dari ES cv. Singa hasil seleksi in vitro selama satu atau dua siklus dalam media PEG serta satu siklus dalam media PEG, diikuti dengan media filtrat kultur (seleksi ganda) dan R1 zuriat dari tanaman R0 yang menghasilkan kisaran bobot polong kering tertentu
49
7. Representasi respons tanaman kacang tanah terhadap cekaman PEG 59 8. Pengaruh cekaman kekeringan terhadap perumbuhan tanaman, akar
dan hasil polong
82
9 Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari ES kacang tanah cv. Singa hasil seleksi in vitro dan menghasilkan bobot polong kering (g) setelah mengalami cekaman kekeringan dan dibandingkan denga n tanaman dalam konsisi optimum
83
10. Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari ES kacang tanah cv. Singa hasil seleksi in vitro dan menghasilkan jumlah polong kering setelah mengalami cekaman kekeringan dan dibandingkan dengan tanaman dalam konsisi optimum
84
11. Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari ES kacang tanah cv. Kelinci hasil seleksi in vitro dan menghasilkan bobot polong kering (g) setelah mengalami cekaman kekeringan dan dibandingkan denga n tanaman dalam konsisi optimum
xxiii 12. Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari
ES kacang tanah cv. Kelinci hasil seleksi in vitro dan menghasilkan jumlah polong kering setelah mengalami cekaman kekeringan dan dibandingkan dengan tanaman dalam konsisi optimum
86
13 Kadar prolin pada populasi somaklon generasi R2 yang diregenerasikan dari ES cv. Singa dan Kelinci hasil seleksi in vitro satu siklus (Pi-I), dua siklus II (Pi-II) pada media PEG dan seleksi ganda pada PEG dan filtrat kultur S. rolfsii(PFi-I atau FPi-I)
93
14 Respons perkembangan ES yang ditanam dalam media selektif filtrat kultur S. rolfsii 30% dan PEG 15 %
109
15 Regenerasi ES insensitif filtrat kultur dan PEG untuk membentuk planlet
111
16 Varian kualitatif yang teramati diantara populasi tanaman generasi R0 dan R1 yang regenerasi ES dari hasil seleksi in vitro berulang dalam media selektif dengan penambahan filtrat kultur dan seleksi ganda dalam media filtrat kultur dan PEG
125
17. Berat polong kering per tanaman (g) dari nomer- nomer galur somaklon generasi R1 cv. Kelinci yang dihasilkan dari seleksi ES satu siklus (Fi-I), dua siklus (Fi-II), dan seleksi ganda (FPi-I) dibandingkan lebih ringan atau lebih berat dari populasi tanaman standar
130
18. Berat polong kering per tanaman (g) dari nomer- nomer galur somaklon generasi R1 cv. Singa yang dihasilkan dari seleksi ES satu siklus (Fi-I), dua siklus (Fi-II), dan seleksi ganda (FPi-I) dibandingkan lebih ringan atau lebih berat dari populasi tanaman standar
131
19. Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari ES kacang tanah cv. Singa hasil seleksi in vitro dan menghasilkan bobot polong kering (g) setelah diinokulasi dengan S. rolfsii dan dibandingkan dengan tanaman sehat
146
20 Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari ES kacang tanah cv. Singa hasil seleksi in vitro dan menghasilkan jumlah polong kering setelah diinokulasi dengan S. rolfsii dan dibandingkan dengan tanaman sehat
147
21 Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari ES kacang tanah cv. Kelinci hasil seleksi in vitro dan menghasilkan bobot polong kering (g) setelah diinokulasi dengan S. rolfsii dan dibandingkan dengan tanaman sehat
xxiv 22. Jumlah tanaman standar dan generasi R2 yang diregenerasikan dari
ES kacang tanah cv. Kelinci hasil seleksi in vitro dan menghasilkan jumlah polong kering (g) setelah diinokulasi dengan S. rolfsii dan dibandingkan dengan tanaman sehat
149
23. Representasi tanaman kacang tanah terserang oleh S. rolfsii 156
Latar Belakang
Kacang tanah (Arachis hypogaea L.) merupakan salah satu sumber protein nabati yang cukup penting dalam pola menu makanan setelah tanaman kedelai. Kebutuhan kacang tanah dalam negeri menunjukkan kenaikan cukup besar yaitu 4,4% per tahun, sedangkan produksi kacang tanah hanya mengalami kenaikan 2,5%. Akibatnya untuk memenuhi kekurangan produksi tersebut harus diimpor (Adisarwanto 2003).
Luas pertanaman kacang tanah menempati urutan keempat setelah padi, jagung, dan kedelai. Di kawasan Asia, Indonesia menempati urutan ketiga dengan luas penanaman mencapai 650.000 Ha dan merupakan negara ketujuh terbesar penghasil kacang tanah di dunia. Namun, produksi kacang tanah Indonesia masih rendah yaitu sekitar 1 ton/Ha polong kering, sedangkan negara lain melebihi 2 ton/Ha (Adisarwanto 2003; Biro Pusat Statistik 1999). Penanaman kacang tanah sebagian besar (70%) ditanam pada lahan kering dan sisanya ditanam pada lahan basah (Saleh & Adisarwanto 1996).
Usaha tani pada lahan kering sulit berkembang karena ketersediaan air tidak selalu terpenuhi sepanjang musim tanam. Hal ini menyebabkan produksi kacang tanah menjadi rendah dan bahkan menyebabkan kegagalan panen. Cekaman kekeringan menyebabkan gangguan pada semua fase pertumbuhan tanaman dan menimbulkan berbagai efek seperti pada perluasan daun dan pemanjangan batang, gangguan aktivitas fotosintesis (Riciardi et al. 2001), menurunkan kemampuan untuk melakukan pembuahan (self-fertility) dan menurunkan ukuran biji (Stoddar 1986). Cekaman air menyebabkan pengurangan biomasa daun dan polong kering kacang tanah (Collino et al. 2000) dan penurunan bobot kering polong diduga disebabkan oleh terhambatnya inisiasi dan pemanjangan ginofor (Chapman et al. 1993).
Selain itu, kondisi sosial ekonomi petani pada lahan kering biasanya tidak cukup mendukung untuk melakukan budidaya secara intensif. Infestasi pada usaha tani lahan kering biasanya rendah, sehingga sangat sulit diharapkan peningkatan
produksi. Kondisi ini sangat bertentangan dengan penerapan pemuliaan moderen yang selalu mensyaratkan menggunakan input teknologi secara intensif (Cercarelli 1996). Salah satu pendekatan yang rasional untuk mengatasi masalah budidaya pada lahan kering adalah dengan mengembangkan kultivar kacang tanah yang berdaya hasil tinggi pada lingkungan tersebut.
Selain masalah cekaman kekeringan, masalah penyakit busuk batang akibat infeksi S. rolfsii juga merupakan faktor pembatas produksi usaha tani kacang tanah di lahan kering. Infeksi patogen dapat menurunkan kuantitas dan kualitas hasil kacang tanah. Menurut Backman dan Brenneman (1997) penurunan hasil akibat serangan patogen ini dapat mencapai 25-80 %. Sclerotium rolfsii
merupakan cendawan tertular tanah (soil borne) dan membentuk sklerotia yang menyebabkan cendawan ini mampu bertahan hidup cukup lama di dalam tanah. Kondisi lahan kering yang sulit diterapkan sistem pengairan, menyebabkan inokulum cendawan sulit dihilangkan pada usaha tani lahan kering (Benhamou & Chert 1996).
Penanaman kultivar resisten yang berdaya hasil tinggi menawarkan harapan dapat mengembangkan budidaya kacang tanah di lahan kering. Pengendalian secara kimiawi dirasakan tidak ekonomis terutama untuk petani lahan kering, tidak efektif karena cendawan soil-born, dan dapat mencemarkan lingkungan. Penggunaan kultivar tahan diharapkan dapat menghambat atau mengurangi perkembangan patogen.
Pemuliaan kultivar toleran kekeringan dan resisten terhadap penyakit dengan metode konvensional membutuhkan waktu yang lama dan prosedurnya tidak efisien. Kultur in vitro dapat digunakan sebagai alternatif untuk mendapatkan tanaman toleran cekaman kekeringan dan resisten terhadap penyakit (Mohamed et al. 2000). Kultur in vitro dapat menginduksi variasi somaklonal dan penggunaan seleksi in vitro pada tingkat sel dan jaringan dengan agens penyeleksi diharapkan dapat diperoleh karakter yang diinginkan (Jain 2001). Seleksi in vitro dapat dilakukan dengan menggunakan filtrat kultur yang dikeluarkan oleh S. rolfsii sebagai agens penyeleksi untuk mengidentifikasi sel atau jaringan tanaman kacang tanah yang tidak mati oleh filtrat kultur (Yusnita et al. 2005). Seleksi in vitro juga dilakukan dengan menggunakan polietilena glikol
(PEG) yang dapat menstimulasi kondisi cekaman kekeringan untuk mengidentifikasi sel atau jaringan tanaman kacang tanah yang tidak mati oleh cekaman PEG (Dami & Hughes 1997; Widoretno et al. 2003a; Rahayu et al. 2005).
Efektifitas seleksi in vitro sangat tergantung dari keberhasilan untuk menghambat perkembangan sel/jaringan normal yang tidak diinginkan dan memproliferasikan sel/jaringan mutan yang diinginkan dengan menggunakan agens penyeleksi. Penggunaan seleksi in vitro berulang diharapkan dapat meningkatkan akumulasi mutagenesis sel-sel atau jaringan tanaman yang hanya toleran terhadap PEG atau resisten terhadap filtrat kultur atau kedua sifat tersebut sekaligus dapat terakumulasi pada satu genotip. Berdasarkan uraian tersebut, maka penelitian ini sangat diperlukan untuk menguji efektifitas seleksi in vitro berulang untuk mendapatkan kultivar kacang tanah unggul baru yang toleran terhadap cekaman kekeringan dan resisten terhadap penyakit busuk batang S. rolfsii.
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk menguji efektifitas seleksi in vitro berulang untuk mendapatkan plasma nutfah tanaman kacang tanah yang toleran terhadap cekaman kekeringan dan resisten terhadap penyakit busuk batang
S. rolfsii.
Secara spesifik penelitian ini bertujuan :
1. Menguji efektifitas seleksi in vitro berulang dalam media yang mengandung PEG untuk me ndapatkan tanaman kacang tanah yang toleran kekeringan. 2. Menguji efektifitas seleksi in vitro berulang dalam media yang mengandung
filtrat kultur S. rolfsii untuk mendapatkan tanaman kacang tanah yang resisten terhadap penyakit busuk batang S. rolfsii.
3. Menguji efektifitas seleksi in vitro ganda dalam media yang mengandung PEG dan filtrat kultur S. rolfsii untuk mendapatkan tanaman kacang tanah yang toleran kekeringan dan resisten terhadap penyakit busuk batang S. rolfsii.
Strategi Penelitian
Untuk me ncapai tujuan penelitian tersebut, strategi penelitian yang ditempuh meliputi beberapa topik penelitian sebagai berikut :
1. Efektifitas seleksi in vitro berulang dalam media selektif yang mengandung PEG untuk mendapatkan varian embrio somatik yang insensitif terhadap PEG.
2. Efektifitas seleksi in vitro berulang dalam media selektif yang mengandung filtrat kultur S. rolfsii untuk mendapatkan varian embrio somatik yang insensitif terhadap filtrat kultur.
3. Efektifitas seleksi in vitro ganda dalam media yang mengandung PEG dan filtrat kultur untuk mendapatkan varian embrio somatik yang insensitif PEG dan filtrat kultur.
4. Evaluasi keragaman karakter kualitatif (morfologis) dan kuantitatif (agronomis) pada populasi kacang tanah hasil seleksi in vitro berulang dan seleksi ganda (pada media yang mengandung PEG dan filtrat kultur S. rolfsii).
5. Identifikasi tanaman varian somaklonal yang toleran kekeringan dan resisten terhadap S. rolfsii pada populasi tanaman somaklon kacang tanah hasil seleksi in vitro berulang dan seleksi ganda.
1. Embrio somatik insensitif PEG Embrio somatik insensitif PEG dan filtrat kultur
2. Embrio somatik insensitif filtrat kultur
Populasi tanaman varian somaklonal hasil seleksi in vitro
Varian kualitatif dan kuantitatif a. Varian toleran kekeringan b. Varian resisten S. rolfsii
c. Varian karakter ganda
Galur Kacang Tanah Unggul Baru (Toleran kekeringan dan resisten S. rolfsii)
Gambar 1. Diagram alir skenario penelitian dan keterkaitan antar percobaan
Plasma nutfah kacang tanah (cv. Singa dan Kelinci)
Seleksi in vitro berulang dengan 1) PEG dan 2) Filtrat kultur
Seleksi ganda (PEG dan filtrat kultur)
Regenerasi varian somaklonal
Evaluasi karakter kualitatif dan kuantitatif
Identifikasi varian somaklonal a. Toleran kekeringan
b. Resisten S. rolfsii c. Karakter ganda
Penyakit Busuk Batang dan Mekasisme Ketahanan Tanaman terhadap
Sclerotium rolfsii
Sclerotium rolfsii Sacc. menyebabkan penyakit busuk batang pada kacang tanah dan berbagai spesies tanaman penting lain. Cendawan ini tertular lewat tanah sehingga pengendalian secara kultur teknik menjadi sangat sulit (Backman & Brenneman 1997). Kacang tanah dapat diserang pada setiap stadium pertumbuhan, mulai dari benih, kecambah sampai tanaman dewasa. Serangan pada fase kecambah menyebabkan tanaman rebah kecambah karena pada pangkal batang terjadi pembusukan. Serangan pada tanaman dewasa menyebabkan lesio berwarna coklat pada batang, daun mulai gugur, terjadi pembusukan pada pangkal batang, satu dua cabang menjadi layu, dan akhirnya tanaman mati. Infeksi juga terjadi pada ginofor dan pembusukan pada polong (Agrios 1988; Melouk & Backman 1995; Benhamou & Chert 1996)
Selama kondisi tidak menguntungkan seperti kekurangan nutrisi, kondisi lingkungan panas atau dingin, adanya mikroba yang antagonis, atau tidak ada inang, menyebabkan cendawan akan membentuk sklerotia. Sklerotia membentuk struktur yang kompak, berukuran seragam, berbentuk agak bulat atau tak beraturan, berwarna putih ketika baru terbentuk dan akan menjadi berwarna coklat tua sampai kehitaman ketika telah masak (Hadar & Gorodecki 1991). Sklerotia tersebut mampu bertahan di dalam tanah selama bertahun-tahun, mampu berkolonisasi, dan mampu hidup secara efektif pada berbagai macam bahan organik dan dapat meningkatkan populasi inokulum (Punja 1985).
Pengamatan pangkal batang yang terkena gejala penyakit ini, nampak terlihat masa miselia yang tumbuh disekitar pangkal batang dan permukaan tanah. Pertumbuhan miselia pada media potato dextrose agar (PDA) berwarna putih, halus dan tampak menyerupai bulu ayam. Miselium ini mampu mematikan batang utama tanaman, membusukkan batang dan merontokkan polong (Melouk & Backman 1995).
Efektifitas patogenisitas cendawan S. rolfsii membutuhkan sekresi toksin asam oksalat yang bersifat racun bagi inang. Asam oksalat bersifat toksin bagi tanaman sehingga dapat mematikan jaringan tanaman inang (Backman & Brenneman 1997; Cessna et al. 2000). Asam oksalat yang dikeluarkan dapat meningkatkan virulensi cendawan S. rolfsii karena enzim seperti poligalakturonase akan aktif ketika adanya asam oksalat. Kerjasama asam oksalat dan enzim ini mengakibatkan kerusakan yang lebih parah pada jaringan tanaman. Senyawa asam oksalat dapat menyebabkan klorosis dan nekrosis daun selama stadia pertama perkembangan tanaman. Oksalat dapat menghambat aktivitas
oxidative burst yang merupakan mekanisme fisiologis tanaman untuk melawan patogen.
Resistansi yang terjadi antara interaksi cendawan dengan tanaman terdiri atas beberapa komponen yaitu reaksi hipersensitif (HR), senjata kimia seperti fitoaleksin antimikrobia dan enzim hidrolitik, dan struktur penghalang untuk pertahanan seperti lignin dan protein dinding sel yang kaya hidroprolin (Dixon et al. 1994). Reaksi hipersensitif mematikan sel-sel tanaman inang dalam beberapa waktu agar tidak kontak dengan patogen. Reaksi hipersensitif menyebabkan patogen tertahan. Reaksi oxidative-burst merupakan reaksi terbentuknya hidrogen peroksida dan reactive oxygen species (ROS) yang menyebabkan kematian sel tanaman sehingga patogen biotropi dapat terperangkap dan kelaparan. Namun untuk patogen nekrotropi, reaksi oxidative burst tidak efektif. Penguatan dinding sel tanaman dapat meningkatkan ketahanan tanaman terhadap patogen. Untuk patogen nekrotropik, penguatan dinding sel dapat menghambat difusi toksin atau enzim patogen pada sel yang lebih dalam. Peroksidase dan kitinase adalah senyawa protein yang berhubungan dengan resitensi tanaman terhadap patogen. Senyawa ini terinduksi ketika tanaman terinfeksi oleh patogen. Peroksidase berperanan untuk mengkatalisa senyawa organik yang berkaitan dalam penguatan dinding sel seperti lignin, fenolik dan suberin (Lagrimini 1991). Sementara kitinase berfungsi untuk mendegradasi senyawa kitin pada dinding sel cendawan (Collinge et al. 1993).
Pengaruh Cekaman Kekeringan dan Mekanisme Toleransi
Ketersediaan air merupakan pembatas utama produksi tanaman. Tanaman akan terganggu pertumbuhannya ketika ketersediaan air dipermukaan akar berkurang. Konsep cekaman kekeringa n pada tanaman adalah berkurangnya suplai air di daerah perakaran dan permintaan air yang berlebihan oleh daun, yang mana laju transpirasi melebihi laju absorpsi air oleh akar (Kaufmann 1981). Perilaku akar selama cekaman kekeringan dan hubungannya dengan daun (pucuk) tanaman belum dimengerti secara jelas. Pada keadaan tanah kering, perubahan signal metabolisme biokimia akar pada daun adalah dengan menekan pertumbuhan, aktivitas stomata, fotosintesis dan potensial osmotik (Kramer & Boyer 1995). Untuk mempertahankan turgor tanaman dapat dijaga keseimbangan antara laju transpirasi dan penyerapan air oleh akar.
Dua komponen utama resistensi tanaman terhadap kekeringan (Franca et al. 2000) yaitu terhindar kekeringan (drought avoidance) dan toleransi terhadap kekeringan (drought tolerance). Pada kacang-kacangan, mekanisme terhindar kekeringan yang utama adalah sistem perakaran yang baik dan efisiensi pembukaan stomata (Barradas et al. 1994). Mekanisme toleransi kekeringan pada status air tanaman rendah adalah proses yang berfungsi pada tingkat sel, dan yang paling penting adalah pengaturan osmotik (osmotic adjustment) dan proteksi sistem membran (Mullet & Whitsitt 1996).
Kondisi cekaman kekeringan dengan potensial air jaringan tanaman rendah mempengaruhi pertumbuhan tanaman terutama pada kenampakan morfologi dan perkembangan tanaman, perkembangan sel, fisiologi dan biokimia (Raper & Kramer 1987; Yoshiba et al. 1997). Pengurangan pemberian air menyebabkan perubahan pola perkembangan daun bunga matahari. Pada keadaan defisit air menyebabkan luas daun berkurang diband ing kondisi optimum. Pengurangan luas daun ini dipengaruhi oleh pengurangan kecepatan pembelahan dan luas areal sel sampai 40 % dibanding tanaman kontrol (Granier & Tardieu 1999). Cekaman air menyebabkan pengurangan biomasa daun dan polong kering kacang tanah (Collino et al. 2000) dan penurunan bobot kering polong diduga disebabkan oleh proses terhambatnya inisia si dan pemanjangan ginofor (Chapman
et al. 1993). Pada tanaman kedelai, defisit air menurunkan luas area dan kandungan klorofil daun (Shimada et al. 1992), menurunkan ukuran polong, biji, dan bobot kering polong (Pookpadi et al. 1990), dan menurunkan kualitas biji (Franca-Neto et al. 1993). Cekaman kekeringan mempengaruhi pula sis tem reproduksi tanaman. Herrero dan Johnson (1981) mempelajari pengaruh cekaman kekeringan pada sistem reproduksi tanaman jagung. Hasil penelitian menunjukkan bahwa pemanjangan rambut jagung (silk) terhenti pertumbuhan pada potensial air daun kira-kira -9 bar. Gejala morfologi yang biasa nampak pada tanaman kekurangan air adalah tanaman layu, daun menggulung, dan kerdil.
Pengaruh cekaman kekeringan pada sel dapat dilihat pada kemampuan melakukan pembelahan dan pemanjangan sel. Pengurangan pemberian air pada tanaman menurunkan jumlah dan ekspansi sel (Granier & Tardieu 1999). Pada penelitian stres osmotik menghasilkan penurunan kadar klorofil dan menurunkan aktivitas mitokondria (Gibon et al. 2000).
Pengaruh lanjut dari osmotic adjusment adalah memelihara pertumbuhan akar dan tunas pada kondisi cekaman, melalui pengaturan kontrol turgor sel (Creelman et al. 1990; Mullet & Whitsitt 1996). Integritas struktur membran sel adalah penting untuk dapat bertahan hidup pada periode cekaman kekeringan. Ketahanan pada fase kecambah dan vegetatif adalah penting agar mendapatkan hasil yang baik.
Cekaman kekeringan mempengaruhi proses fisiologi berupa penurunan transpirasi dan potensial air rendah, dan fotosintesis (Pookpadi et al. 1990; Vieira
et al. 1992). Tanaman yang terkena stres kekringan, potensi air daun menurun, pembentukan klorofil daun terganggu (Alberte et al. 1977) dan struktur kloroplas mengalami disintegrasi (Van Doren & Reicosky 1987). Gangguan fotosintesis terutama berhubungan dengan penutupan stomata, sehingga gas CO2 tidak dapat
terinfiltrasi dalam tanaman karena stomata tertutup. Disamping itu, defisit air menyebabkan bahan baku air untuk fotosintesis berkurang dan kalau terjadi fotosintesis menyebabkan distribusi fotosintat terganggu. Berkurangnya hasil fotosintat menyebabkan gugurnya bunga, polong dan biji yang telah terbentuk (Sloane et al. 1990).
Cekaman kekeringan menyebabkan respons biokimia atau metabolik pada tanaman. Karakter metabolik berupa akumulasi prolin pada jaringan tanaman merupakan karakter untuk toleransi tanaman terhadap cekaman kekeringan. Tanaman yang toleran terhadap stres osmotik mengakumulasikan prolin jauh lebih tinggi dari tanaman peka. Asam amino ini dipercaya berfungsi sebagai protektor atau menstabilisasi enzim atau struktur membran yang sensitif pada kekeringan atau kerusakan yang diinduksi secara ionik (Madan et al. 1995; Girousse et al. 1996; Iyer & Caplan 1998). Kishor et al. (1995) mengamati terjadinya peningkatan reistensi pada defisit air dan cekaman garam pada tanaman transgenik tembakau dengan over ekspresi ?1-pyroline-5-carboxylate synthetase
(P5CS). Penulis lain menjelaskan bahwa prolin dapat berpartisipasi sebagai penyimpan nitrogen, yang sewaktu-waktu dapat digunakan setelah periode cekaman. Tambahan pula bahwa prolin berperanan dalam meregulasi pH sitoplasma (Pesci & Beffagna 1984). Prolin jelas merupakan senyawa osmotikum dan compatible solut yang dapat terakumulasi pada konsentrasi tinggi pada sel sitoplasma tanpa merusak struktur sel. Akumulasi prolin berfungsi sebagai detoksifikasi radikal dan meregulasi status redoks sel.
Sumber metabolik dari akumulasi prolin pada potensial air rendah belum jelas teramati. Salah satu mekanisme yang dapat menjelaskan adalah meningkatkan sintesis prolin dengan menggunakan glutamin dan ornitin sebagai prekursor. Transkripsi mRNA mengkode ?1-pyroline-5-carboxylate reductase
(P5CR) dan P5CS dan selanjutnya mengkatalisis sintesis prolin melalui glutamin (Madan et al. 1995; Yoshiba et al. 1995).
Selain prolin, senyawa osmotic adjusment yang lain adalah gula. Senyawa ini berfungsi untuk pertumbuhan dan perkembangan tanaman. Gula dapat melindungi integritas membran selama dehidrasi dengan mencegah fusi membran, fase transisi, dan fase pemisahan membran (Pelah et al. 1997). Selanjutnya Gebre et al. (1997) melaporkan bahwa akumulasi glukosa dan fruktosa pada Populus deltoides dapat menurunkan pengaruh potensial osmotik pada daun, dan dapat mempertahankan ketegaran tanaman pada cekaman kekeringan. Senyawa gula tersebar pada sitosol yaitu pada daerah intra seluler.
Ketika konsentrasi ion anorganik tinggi pada vakuola, senya wa gula dapat melindungi enzim sitosolik (Rodrigues et al. 1999).
Ketika cekaman kekeringan, tanaman dapat mensintesis hormon tumbuh berupa abscisic acid (ABA). Pembentukan senyawa ini berkaitan dengan respons terhadap kelayuan (Pruvot et al. 1996; Nambara et al. 1998) yaitu untuk meningkatkan laju penyerapan air oleh akar untuk mengimbangi laju transpirasi (Quintero et al. 1998; Roberts 1998). Penyerapan air di akar ditentukan oleh besarnya gradien hidrostatik atau gradien osmotik. Dalam hal ini ABA berperan sebagai pengatur signal transport air secara radial (Quintero et al. 1998).
Mutasi In Vitro
Tanaman yang diregenerasikan secara kultur in vitro melalui sel somatik sering berbeda fenotip denga n tanaman awal. Fenomena ini akhirnya disebut variasi somaklonal (Larkin & Scowcroft 1981; Monacelli et al. 1988; Jain 2001; Larkin 2004). Analisis turunan menunjukkan bahwa variasi somaklonal adalah perubahan genetik walaupun perubahan DNA somaklon sampai sekarang masih terus dipelajari. Perubahan variasi genetik merupakan komponen yang esensial dalam program pemuliaan tanaman. Mutasi spontan yang terjadi secara ekstrim biasanya menghasilkan frekuensi variasi genetik yang sangat rendah. Mutasi in vitro telah memberikan kontribusi yang sangat signifikan untuk meningkatkan variasi genetik tanaman. Penggunaan teknik in vitro seperti kultur anter/mikrospor, organogenesis pucuk, dan embriogenesis somatik dapat mengatasi rendahnya variasi genetik yang disebabkan oleh mutasi spontan. Untuk meningkatkan peranan variasi somaklonal dalam pemuliaan tanaman, diperlukan (Brar dan Jain 1998) yaitu : 1) kultur suspensi sel dan kalus untuk beberapa siklus, 2) regenersi sejumlah tanaman dari long-term culture, 3) skrining karakter yang diinginkan dengan melakukan seleksi in vitro untuk memilih karakter penting seperti toleran terhadap kekeringan dan resisten terhadap patogen, 4) pengujian somaklon terpilih dalam beberapa generasi untuk kestabilan genetik, dan 5) multiplikasi somaklon yang sifat genetiknya stabil untuk mengembangkan kultivar baru.
Munculnya variasi somaklonal selama kultur in vitro berhubungan dengan mutasi titik, chromosomal rearrangement dan rekombinan, transposable element, jumlah kopi sekuens DNA, dan DNA amplifikasi. Sistem kultur jaringan sendiri ikut mengambil bagian dalam sistem mutagenesis karena sel mengalami traumatik setelah diisolasi dari tanaman dan beberapa prosedur atau restruktur isasi dalam proses regenerasi yang berbeda dengan di alam menyebabkan pula munculnya variasi epigenetik pada tanaman ya ng baru diregenerasi (Jain 2000; Larkin 2004). Pengaruh tipe genotipe, tipe eksplan, media kultur, umur tanaman donor, dan jumlah sub kultur berpengaruh pula pada munculnya variasi somaklonal (Veilleux & Johnson 1998; Jain 2001).
Variasi kromosom telah diamati pada beberapa spesies tanaman yang diregenerasikan dari kultur jaringan dan tanaman turunannya (Duncan 1997; Gupta 1998). Eksplan dengan ploidi dan jumlah kromosom tinggi menunjukkan variabilitas lebih tinggi dibanding ploidi dan jumlah kromosom rendah. Pengendalian siklus sel normal dengan mencegah pembelahan sel sebelum mengakhiri replikasi DNA yang terjadi selama kultur in vitro, menyebabkan patahnya kromosom (chromosomal breakage) (Philip et al. 1994). Chromosomal breakage dan konsekuensinya (delesi, duplikasi, inversi, dan translokasi) menyebabkan aberasi kromosom (Duncan 1997). Patahnya kromosom menyebabkan mutasi secara langsung melalui “position effect” atau mengubah ekspresi gen dari chromosomal rearrangement dan menempatkan pada daerah khusus heterokromatin. Metilasi DNA juga menyebabkan patahnya kromosom.
Perubahan genetik tanaman melalui variasi somaklonal dapat diamati pada perubahan morfologi, fisiologi atau molekuler (Jain 2001; Larkin 2004). Variasi genetik yang timbul karena variasi somaklonal dapat teridentifikasi pada generasi R0 (tanaman hasil regenerasi in vitro) dan pewarisan karakter dapat diamati pada generasi R1(turunan dari tanaman generasi R0) dan seterusnya. Karakter tanaman somaklon dapat diwariskan secara genetik melalui pembelaha n meiosis dan teramati pada turunannya, dan terdapat karakter yang tidak diwariskan secara genetik sehingga tidak teramati pada turunannya (epigenetik dan fisiologi) (Skirvin et al. 1993; Jain et al. 1998).
Variasi somaklonal menimbulkan perubahan genetik pada tanaman dan karakter tanaman dapat berubah dari tanaman awal seperti tinggi tanaman, hasil, jumlah bunga per tanaman, kualitas polong, toleran terhadap kekeringan dan resisten terhadap penyakit. Valkonen et al. (1999) mendapatkan tanaman kerdil (pertumbuhannya lambat), ruas-ruas batang pendek, dan daun hijau tua pada tanaman kentang yang diregenerasikan dari kultur antera. Stephens et al. (1991) tidak menemukan perbedaan yang luas antara tanaman turunan homosigot yang diregenerasikan melalui organogenesis pada tanaman kedelai. Ketika dibandingkan dengan tanaman tetua, ternyata kematangan, tinggi tanaman, protein dan minyak biji dan hasil biji berbeda. Variasi somaklonal teramati pada tanaman kedelai yang diregenerasikan melalui proses embriogenesis dan organogenesis. Karakter varian lain yang muncul akibat variasi somaklonal pada tanaman kedelai adalah sterilitas jantan (male sterility), perubahan morfologi daun (Amberger et al. 1992a), dan adanya alel baru dari isozim (Amberger et al. 1992b).
Identifikasi varian somaklonal yang diinginkan biasanya dilakukan dengan menggunakan teknik seleksi in vitro. Kondisi selektif tertentu dapat digabungkan dalam media kultur dan dipakai untuk menumbuhkan varian-varian somaklonal yang telah diperoleh. Tanaman hasil regenerasi dari jaringan yang dapat mengatasi kondisi selektif, besar kemungkinan juga akan menghasilkan fenotipe toleran terhadap kondisi selektif. Hal ini sangat menguntungkan karena proses seleksi in vitro membutuhkan tempat yang relatif sedikit, kondisi selektif dapat dibuat homogen, dan efektifitas seleksi sangat tinggi.
Seleksi In Vitro untuk Resistensi terhadap Penyakit
Langkah awal untuk seleksi in vitro adalah menginduksi embrio somatik. Eksplan yang digunakan adalah poros embrio dari benih yang telah tua atau belum tua (Baker et al. 1995). Pada penelitian Edy (1998) dan Sulichantini (1998) telah menggunakan eksplan poros embrio dan daun embrio biji. Embriogenesis kacang tanah dapat dilakukan dengan diinduksi dalam media MS dengan penambahan zat pengatur tumbuh pikloram (16-20 µM) (Edy 1998; Sulichantini 1998; Susilawati
2003). Pada penelitian Yusnita et al. (2005) juga telah dikembangkan protokol untuk induksi ES, perkecambahan dan regenerasi planlet.
Penggunaan seleksi in vitro dengan menggunakan toksin yang diproduksi oleh patogen telah banyak dilakukan oleh beberapa peneliti. Seleksi in vitro untuk ketahanan terhadap penyakit telah dilakukan seperti Fusarium oxysporum pada tanaman tomat dengan menggunakan agens penyeleksi asam fusarik,
Phytophthora infestans pada kentang dengan menggunakan filtrat kultur,
Xanthomonas oryzae pada padi dengan filtrat kultur (Jayasangkar 2005), dan penyakit busuk batang S. rolfsii pada kacang tanah dengan menggunakan filtrat kultur (Yusnita et al. 2005). Tanaman yang dihasilkan setelah lima atau lebih siklus berulang menghasilkan tanaman resisten terhadap toksin dan patogen. Pada kedelai, tanaman yang diregenerasikan dari kalus terseleksi pada filtrat kultur patotoksik Septoria glycines menyebabkan tertundanya gejala becak coklat dibanding tanaman tanpa seleksi in vitro (Song et al. 1994).
Satu persyaratan untuk keberhasilan sistem seleksi in vitro adalah tersedianya metode regenerasi tanaman. Pada kacang tanah, metode seleksi in vitro telah tersedia (Yusnita et al. 2005). Seleksi in vitro dapat digunakan untuk menapis sel/jaringan varian yang diinginkan. Media selektif akan mematikan dan menghambat petumbuhan sel/jaringan normal yang peka terhadap filtrat kultur dan menumbuhkan sel/jaringan varian yang resisten sehingga dihasilkan tanaman somaklon yang resisten terhadap filtrat kultur cendawan S. rolfsii.
Cendawan S. rolfsii membutuhkan sekresi toksin asam oksalat untuk dapat mematikan jaringan tanaman inang (Backman & Brenneman 1997; Cessna
et al. 2000). Senyawa asam oksalat yang dikeluarkan oleh cendawan digunakan sebagai selective agent dalam proses seleksi in vitro Konsentrasi filtrat kultur S. rolfsii 30% dalam media regenerasi merupakan konsentrasi sub- letal (konsentrasi yang dapat menyebabkan 95% atau lebih jaringan yang ditanam menjadi mati) (Yusnita et al. 2005).
Seleksi In Vitro untuk Toleransi terhadap Cekaman Kekeringan
Potensi osmotik medium adalah penting untuk digunakan dalam seleksi in vitro embrio somatik. Cekaman osmotik yang diterapkan pada kultur in vitro mengurangi kemampuan regenerasi. Namun, setelah diskrining di lapangan, ternyata tanaman regeneran yang dihasilkan dari cekaman osmotik menghasilkan tana man toleran dan hasilnya lebih tinggi dari tetua pada kondisi kekeringan (Mohamed et al. 2000). Beberapa tanaman yang telah diseleksi pada cekaman osmotikum seperti Chrysanthenum morifolium (Shibli et al. 1992), tanaman sorgum (Duncan et al. 1995), padi (Adkins et al. 1995) dan kedelai (Widoretno
et al. 2003a).
Penggunaan senyawa osmotikum yang paling umum adalah senyawa polietilena glikol (PEG). Senyawa ini merupakan non-plasmolysing osmoticum, tidak dapat melakukan penetrasi ke dalam dinding sel tanama n, non-ionic, dan mempunyai pengaruh sama seperti tanaman yang kekurangan air di lapangan dan tidak menimbulkan keracunan pada tanaman (Kong et al. 1998; Dami & Huges 1997). Namun, penggunaan PEG dapat menimbulkan masalah karena meningkatnya viskositas pada media dan menahan difusi oksigen pada akar (Verslues et al. 1998). Senyawa PEG dapat digunakan sebagai senyawa osmotikum yang dapat ditambahkan ke dalam media seleksi in vitro untuk menstimulasi kondisi kekeringan seperti yang ada di lapangan. Penggunaan PEG dengan berat molekul lebih besar dari 4000 dapat menghindari penetrasi ke dalam akar (Newton et al. 1989; Verslue et al. 1998). Senyawa osmotikum lain yang sering digunakan untuk seleksi in vitro adalah manitol dan sorbitol (Gulati & Jaiwal 1993; Rajashekar et al. 1995). Penggunaan PEG untuk seleksi in vitro varian somaklonal yang toleran stres kekeringan telah menghasilkan sejumlah galur kedelai baru yang mempunyai sifat toleran terhadap stres kekeringan (Widoretno et al. 2004).
PERCOBAAN BAGIAN I :
SELEKSI IN VITRO,
DIAWALI PADA MEDIA
POLIETILENA GLIKOL
(PEG)
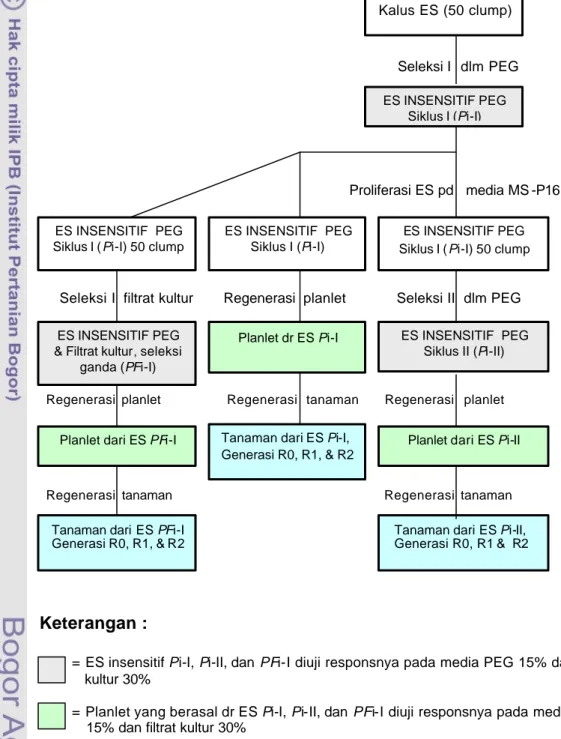
DIAGRAM ALIR PERCOBAAN BAGIAN I :
(Seleksi in vitro, diawali pada media selektif polietilena glikol = PEG)
Seleksi I dlm PEG Proliferasi ES pd media MS -P16
Seleksi I filtrat kultur Regenerasi planlet Seleksi II dlm PEG
Regenerasi planlet Regenerasi tanaman Regenerasi planlet
Regenerasi tanaman Regenerasi tanaman
Keterangan :
= ES insensitif Pi-I, Pi-II, dan PFi-I diuji responsnya pada media PEG 15% dan filtrat
kultur 30%
= Planlet yang berasal dr ES Pi-I, Pi-II, dan PFi-I diuji responsnya pada media PEG
15% dan filtrat kultur 30%
= Tanaman akhir hasil seleksi ES Pi-I, Pi-II, dan PFi-I diamati tipe & macam variasi somaklonal, diuji responsnya pada cekaman larutan PEG 15% dan cekaman kekeringan
ES INSENSITIF PEG Siklus I (Pi-I)
ES INSENSITIF PEG Siklus I (Pi-I) 50 clump ES INSENSITIF PEG
Siklus I (Pi-I) ES INSENSITIF PEG
Siklus I (Pi-I) 50 clump
ES INSENSITIF PEG & Filtrat kultur, seleksi
ganda (PFi-I)
Planlet dari ES PFi-I
ES INSENSITIF PEG Siklus II (Pi-II)
Planlet dari ES Pi-II Planlet dr ES Pi-I
Kalus ES (50 clump)
Tanaman dari ES PFi-I Generasi R0, R1, & R2
Tanaman dari ES Pi-I, Generasi R0, R1, & R2
Tanaman dari ES Pi-II, Generasi R0, R1 & R2
POLIETILENA GLIKOL DAN FILTRAT
KULTUR Sclerotium rolfsii
Abstrak
Percobaan dilakukan untuk mengevaluasi efektivitas seleksi berulang dalam media polieilena glikol (PEG) untuk meningkatkan frekuensi didapatkannya embrio somatik (ES) kacang tanah yang insensitif PEG serta seleksi ganda dalam media PEG dan filtrat kultur S. rolfsii untuk meningkatkan frekuensi didapatkannya ES yang insensitif sekaligus pada media PEG dan filtrat kultur. Regenerasi planlet R0 dan evaluasi respons setek pucuk planlet R0 terhadap PEG atau filtrat kultur juga dilakukan untuk menentukan keberhasilan mendapatkan tanaman varian. Embrio somatik diseleksi selama satu, dua siklus dalam PEG, dan satu siklus dalam PEG dan satu siklus dalam filtrat kultur (3 bulan per siklus seleksi). Selanjutnya, ES yang insensitif terhadap kondisi cekaman diproliferasi dan dikecambahkan menjadi tanaman R0. Hasil percobaan menunjukkan bahwa ES dan tunas R0 cv. Singa dan Kelinci yang diseleksi dua siklus dalam media PEG lebih insensitif terhadap PEG. Sebaliknya, ES dan tunas R0 cv. Singa dan Kelinci hasil seleksi ganda lebih insensitif terhadap filtrat kultur.
REPEAT CYCLING SELECTION AND IDENTIFICATION OF
POLYETHYLENE GLYCOL (PEG) AND Sclerotium rolfsii
CULTURE FILTRATE INSENSITIVE SOMATIC
EMBRYOS OF PEANUT
Abstrak
The objectives of this experiment were to evaluate effectiveness of repeat cycling and double in vitro selection to increase frequency of obtaining PEG and
S. rolfsii culture filtrate insensitive somatic embryos (SE) of peanut. Regeneration of the R0 plants and their evaluation against PEG and culture filtrate were conducted to determine the success of identifying tolerance variants. Peanut SE was subjected to one, two cycles of PEG selection, and one cycle of PEG and culture filtrate selection (3 months per cycle). The identified insensitive SE was proliferated and regenerated into R0 shoots and plantlets. Results of the experiments showed after two cycles of in vitro selection, PEG insensitive SE and its R0 shoots of peanut cv. Kelinci and Singa were more tolerance against stress due to PEG. While ones identified from double selection were more tolerance to culture filtrate.