333333
ANALISIS GAMBARAN DARAH TERHADAP KELANGSUNGAN
HIDUP RELATIF IKAN MAS YANG DIBERI VAKSIN DNA
ANTI-KHV MELALUI PAKAN DENGAN FREKUENSI BERBEDA
NOVI ARIYANTI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Analisis Gambaran Darah terhadap Kelangsungan Hidup Relatif Ikan Mas yang Diberi Vaksin DNA Anti-KHV melalui Pakan dengan Frekuensi Berbeda” adalah benar merupakan hasil karya saya dengan arahan dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2014
Novi Ariyanti
ABSTRAK
NOVI ARIYANTI. Analisis Gambaran Darah terhadap Kelangsungan Hidup Relatif Ikan Mas yang Diberi Vaksin DNA Anti-KHV melalui Pakan dengan Frekuensi Berbeda. Dibimbing oleh SRI NURYATI dan DINAMELLA WAHJUNINGRUM.
Penelitian ini bertujuan untuk menganalisis gambaran darah terhadap kelangsungan hidup relatif ikan mas yang diberi vaksin DNA anti-KHV melalui pakan komersial dengan frekuensi berbeda. Tahapan penelitian yang digunakan adalah kultur bakteri pembawa vaksin (Escherichia coli DH5α) pada media cair LB tripton + ampisilin, vaksinasi dengan dosis 7,6 ng (setara dengan kepadatan bakteri 108 cfu/mL) pada ikan mas dengan bobot 10,22±1,88 gram, dan uji tantang dengan injeksi virus KHV sebanyak 0,1 mL/ekor ikan (pengenceran 10-2) secara intramuskular. Penelitian menggunakan lima kelompok perlakuan vaksinasi berbeda, yaitu pemberian pakan bervaksin dengan frekuensi satu kali pemberian (perlakuan A), dua kali pemberian (perlakuan B), tiga kali pemberian (perlakuan C), kontrol positif, dan kontrol negatif. Hasil penelitian menunjukkan bahwa sekalipun terjadi peningkatan jumlah total leukosit, eritrosit, limfosit, serta penurunan jumlah monosit dan trombosit pada perlakuan A, B, dan C, akan tetapi perlakuan terbaik ditunjukkan oleh perlakuan C yang menghasilkan kelangsungan hidup relatif sebesar 84,6%.
Kata kunci: ikan mas, koi herpesvirus, pakan komersial, uji tantang, vaksinasi
ABSTRACT
NOVI ARIYANTI. Measurement of Haematological Characteristics to Relative Percent Survival in Orally DNA-Vaccinated Common Carp with Different Frequencies. Supervised by SRI NURYATI and DINAMELLA WAHJUNINGRUM.
The aim of this research was to analyze haematological characteristics to relative percent survival in anti-KHV DNA-vaccinated common carp by feed with different frequencies. The stage of study were cultivation of DNA vaccine-containing bacteria (Escherichia coli DH5α) in liquid LB tripton + amphicylin medium, oral vaccination at doses 7.6 ng (equal to bacterial density 108 cfu/mL) in common carp with average body weight 10.22±1.88 gram, and challenge test by intramuscular-injecting KHV amount 0.1 mL/fish (10-2 dilution). There were five different treatments: namely one time vaccination (treatment A), two times vaccination (treatment B), three times vaccination (treatment C), positive control, and negative control. The results showed that although the number of total leukocyte count, total erythrocyte count, and lymphocyte was increased and the number of monocyte and thrombocyte was decreased on treatment A, B, and C, but the best treatment was showed by treatment C with the highest relative percent survival of 84,6%.
./
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
ANALISIS GAMBARAN DARAH TERHADAP KELANGSUNGAN
HIDUPRELATIF IKAN MAS YANG DIBERI VAKSIN DNA
ANTI-KHV MELALUI PAKAN DENGAN FREKUENSI BERBEDA
NOVI ARIYANTI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi: Analisis Gambaran Darah terhadap Kelangsungan Hidup Relatif iiIkan Mas yyang Diberi Vaksin DNA aAnti-KHV melalui Pakan i dengan fFrekuensi Berbeda
Nama : Novi Ariyanti NIM : C14070026
Disetujui oleh
Dr Sri Nuryati, SPi MSi Dr Dinamella Wahjuningrum, SSi MSi
Pembimbing I Pembimbing II
Diketahui oleh
Dr Ir Sukenda, MSc Ketua Departemen
Judul Skrip i: Analisis Gambaran Darah terhadap Kelangsungan Hidup Relatif
lk n . las yang Diberi Vaksin DNA Anti-KHV melalui Pakan dengan Frekuensi Berbeda
Nama ~o';i Ariyanti
NIM Cl-to70026
Disetujui oleh
Dr Sri Nuryati. SPi _ lSi Dr
Dinam
~
~jCm,
SSi MSi Pembimbing I Pembimbing IIDiketahui oleh
)
L I - dl~
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang berjudul “Analisis Gambaran Darah terhadap Kelangsungan Hidup Relatif Ikan Mas yang Diberi Vaksin DNA Anti-KHV melalui Pakan dengan Frekuensi Berbeda” dilaksanakan sejak bulan Oktober sampai Desember 2011 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Sri Nuryati dan Ibu Dr Dinamella Wahjuningrum selaku pembimbing yang telah banyak memberi arahan, serta Ibu Dr Mia Setiawati selaku dosen penguji tamu. Di samping itu, terima kasih penulis sampaikan pula kepada Pak Ranta, Kak Rahman, Pak Maryanta, Mbak Yuli, teman-teman LKI, Vida, Retno, Khodijah, Anitta, serta teman-teman BDP 44-46. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, serta seluruh keluarga, atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat bagi penulis dan pembaca.
Bogor, Maret 2014
DAFTAR ISI
DAFTAR TABEL………. .... vii
DAFTAR GAMBAR………. ... vii
DAFTAR LAMPIRAN………. ... viii
PENDAHULUAN………. ... 1 Latar Belakang……….. ... 1 Tujuan Penelitian………... 2 METODE ……….. ... 2 Materi Uji………. …2 Rancangan Penelitian………..2 Prosedur Penelitian……… ... 3
Kultur Cair Bakteri Pembawa Vaksin……… .... 3
Vaksinasi dan Uji Tantang………. ... 3
Parameter Uji………... 4
Analisis Data………...………….. ... 6
HASIL DAN PEMBAHASAN………. ... 6
Hasil……….. ... 6 Pembahasan………... ... 13 KESIMPULAN………. .... 16 DAFTAR PUSTAKA……… 16 LAMPIRAN……….. 18
DAFTAR TABEL
1 Nilai relative percent survival (RPS) ikan mas yang diberi vaksin DNA anti-KHV……….… . 62 Kisaran parameter kualitas air selama pemeliharaan………... 12
DAFTAR GAMBAR
1 Pola kematian ikan setelah uji tantang dengan KHV………... 72 Jumlah total leukosit ikan uji selama pemeliharaan……… 7
3 Persentase limfosit ikan uji selama pemeliharaan………... 8
4 Persentase monosit ikan uji selama pemeliharaan………... 9
5 Persentase neutrofil ikan uji selama pemeliharaan……….. 9
6 Persentase trombosit ikan uji selama pemeliharaan……… 10
7 Jumlah total eritrosit ikan uji selama pemeliharaan……….………..9 11
8 Kadar hemoglobin ikan uji selama pemeliharaan……… 11
DAFTAR LAMPIRAN
1 Analisis statistik jumlah total leukosit ikan uji selama pemeliharaan………… 18 2 Analisis statistik persentase limfosit ikan uji selama pemeliharaan…………... 19 3 Analisis statistik persentase monosit ikan uji selama pemeliharaan…………... 19 4 Analisis statistik persentase neutrofil ikan uji selama pemeliharaan……….... 20 5 Analisis statistik persentase trombosit ikan uji selama pemeliharaan………… 20 6 Analisis statistik jumlah total eritrosit ikan uji selama pemeliharaan…………. 21 7 Analisis statistik kadar hemoglobin ikan uji selama pemeliharaan……… 21 8 Analisis statistik kadar hematokrit ikan uji selama pemeliharaan………….….. 22
PENDAHULUAN
Latar Belakang
Salah satu penyakit yang cukup serius pada ikan mas dan koi adalah infeksi akibat koi herpesvirus (KHV). Penyakit ini pertama kali muncul di Indonesia pada Maret 2002 di daerah Blitar (Jawa Timur) dan terus menyebar di Pulau Jawa, Bali, Sumatera Selatan, Kalimantan Timur, dan Sulawesi Tengah. Kematian yang diakibatkan oleh penyakit ini bisa mencapai 80-95% sehingga menyebabkan kerugian ekonomi yang besar (Sunarto et al. 2005). Ikan yang terserang KHV memiliki ciri-ciri antara lain produksi lendir (mukus) berlebih sebagai respons fisiologis terhadap kehadiran patogen, insang berwarna pucat atau terdapat bercak putih akibat kerusakan sel-sel insang, pendarahan (hemoragi) di sekitar pangkal dan ujung sirip serta bagian tubuh lain, kulit melepuh, serta hati dan ginjal yang berwarna pucat (Taukhid et al. 2004).
Pengendalian penyakit KHV dapat dilakukan melalui vaksinasi. Beberapa jenis vaksin yang dikenal saat ini antara lain vaksin yang dimatikan (inactivated vaccine), vaksin yang dilemahkan (attenuated vaccine), dan vaksin DNA. Di antara jenis tersebut, vaksin DNA dipercaya menjadi alternatif vaksin masa depan karena keunggulannya dibandingkan vaksin tradisional lain. Lorenzen & LaPatra (2005) menyatakan bahwa vaksin DNA memiliki kelebihan yaitu tingkat keamanan yang tinggi, mampu mengaktifkan respons kekebalan humoral dan selular, memiliki kemampuan proteksi yang tahan lama, serta proses produksi yang relatif mudah dan biaya produksi yang relatif murah.
Metode vaksinasi yang dikenal saat ini antara lain melalui pakan, perendaman, maupun injeksi. Masing-masing metode vaksinasi tersebut memiliki kelebihan dan kekurangan. Berdasarkan penelitian Nuryati et al. (2010), pemberian vaksin DNA melalui injeksi mampu menghasilkan kelangsungan hidup sebesar 96,67%. Akan tetapi metode injeksi kurang efektif untuk vaksinasi secara massal, karena dibutuhkan waktu, tenaga kerja, dan keterampilan yang lebih. Pemberian vaksin DNA melalui pakan dinilai lebih praktis karena dapat diaplikasikan secara massal, tidak menimbulkan stress pada ikan, serta tenaga kerja yang dibutuhkan lebih sedikit (Miyazaki et al. 2008).
Darah ikan tersusun atas cairan plasma dan sel-sel darah yang terdiri dari sel darah merah (eritrosit), sel darah putih (leukosit), dan keping darah (trombosit). Fungsi utama darah adalah untuk transportasi oksigen, karbondioksida, sari-sari makanan, dan hasil metabolisme. Darah mengedarkan substansi tersebut ke seluruh bagian tubuh untuk menjaga agar tubuh dapat menjalankan fungsinya dengan baik (Fujaya 2002). Penyimpangan fisiologis ikan akan menyebabkan terjadinya perubahan parameter hematologi, baik secara kualitatif maupun kuantitatif. Beberapa parameter yang dapat menunjukkan adanya gangguan adalah jumlah eritrosit, jumlah leukosit, nilai hematokrit, dan konsentrasi hemoglobin (Lagler et al.1977). Susunan darah ikan merupakan faktor diagnostik penting, sehingga perubahan gambaran darah banyak digunakan untuk menilai status kesehatan ikan (Amrullah 2004).
2
Pada penelitian ini dilakukan pemeriksaan terhadap gambaran darah ikan mas yang diberi vaksin DNA anti-KHV dengan frekuensi berbeda untuk mengevaluasi respons tanggap kebal ikan mas yang diinfeksi KHV.
Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis gambaran darah terhadap kelangsungan hidup relatif ikan mas yang diberi vaksin DNA anti-KHV melalui pakan dengan frekuensi berbeda.
METODE
Materi Uji
Ikan mas yang digunakan sebanyak 200 ekor dengan bobot rata-rata 10,22±1,88 gram yang telah diuji status kesehatannya dengan menggunakan metode PCR. Bakteri pembawa vaksin DNA anti-KHV adalah hasil temuan Nuryati et al. (2010). Virus KHV berasal dari ikan mas yang terserang KHV yang diperoleh dari Subang. Selain itu juga digunakan reagen-reagen untuk uji gambaran darah dan uji kualitas air.
Rancangan Penelitian
Penelitian ini terdiri atas lima perlakuan dengan frekuensi vaksinasi yang berbeda. Uji tantang menggunakan virus KHV yang diinjeksikan secara intra muskular. Adapun rancangan penelitian yang digunakan dapat dilihat pada skema berikut:
masa vaksinasi 28 hari pengamatan (7 hari) (30 hari) A adaptasi 7 hari J UT B adaptasi 7 hari S J UT C adaptasi 7 hari S R J UT K-
adaptasi 7 hari tanpa vaksin PBS K+
3 Keterangan:
A : vaksinasi satu kali dalam satu minggu dan diuji tantang B : vaksinasi dua kali dalam satu minggu dan diuji tantang C : vaksinasi tiga kali dalam satu minggu dan diuji tantang K- : tanpa vaksinasi dan diinjeksi dengan PBS
K+ : tanpa vaksinasi dan diuji tantang S : Senin R : Rabu J : Jumat UT : uji tantang PBS : injeksi dengan PBS Prosedur Penelitian Kultur Cair Bakteri Pembawa Vaksin
Kultur bakteri Escherichia coli DH5α pembawa vaksin GP25 (Nuryati et al.
2010) dilakukan dengan menginokulasi koloni tunggal bakteri pada media cair LB tripton + ampisilin. Bakteri diinkubasi menggunakan thermoshaker dengan kecepatan 240 rpm pada suhu 37 C selama 16 jam, untuk selanjutnya dilakukan pemanenan. Sebanyak 40 mL bakteri dituangkan secara parsial ke dalam masing-masing microtube bervolume 1,5 mL, lalu disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4 C selama 30 detik. Pellet bakteri yang terbentuk dicuci sebanyak tiga kali dengan 1 mL phosphate buffered saline (PBS). Bakteri diinaktivasi dengan perlakuan panas pada suhu 80 C selama 5 menit, lalu disentrifugasi dan diresuspensi kembali dengan PBS sebanyak 1 mL.
Vaksinasi dan Uji Tantang
Dosis vaksin yang digunakan mengacu pada penelitian Yuliyanti (2011) yaitu 7,6 ng dengan kepadatan bakteri 108 cfu/mL. Bakteri pembawa vaksin dicampurkan terlebih dahulu dengan kuning telur sebelum dicampurkan ke pakan. Campuran ditambahkan ke dalam pakan dan didiamkan pada suhu ruang sampai kering. Pencampuran pakan dengan vaksin DNA dilakukan sesaat sebelum pemberian pakan perlakuan. Ikan diberi pakan sesuai perlakuan sebanyak 5% dari biomassa.
Ikan dipelihara dalam 20 akuarium berukuran 45x40x35 cm3 sebanyak 10 ekor/akuarium. Ikan diadaptasikan terlebih dahulu selama satu minggu dengan diberi pakan komersil dua kali sehari. Vaksinasi dilakukan selama satu minggu sesuai perlakuan dengan pemberian pakan bervaksin. Pemeliharaan ikan setelah divaksinasi selama 28 hari dengan pemberian pakan komersil, lalu ikan diuji tantang untuk melihat respons kekebalannya. Uji tantang dilakukan dengan menginjeksikan virus KHV sebanyak 0,1 mL/ekor dengan dosis pengenceran 10-2 secara intramuskular ke semua ikan uji, kecuali pada kontrol negatif.
4
Parameter Uji
Perhitungan Jumlah Total Leukosit (Svobodova & Vyukusova 1991)
Darah dihisap dengan pipet berskalayang berisi bulir pengaduk warna putih sampai skala 0,5 lalu ditambahkan larutan Turk’s (berfungsi mematikan sel-sel darah merah) sampai skala 11. Pipet digoyangkan agar darah tercampur dan tetesan pertama dibuang. Larutan darah diteteskan pada haemasitometer kemudian ditutup dengan gelas penutup. Pengamatan menggunakan mikroskop perbesaran 400 kali. Perhitungan jumlah leukosit total dilakukan pada 5 kotak besar haemasitometer dan jumlahnya dihitung dengan rumus (Nabib & Pasaribu 1989):
Σleukosit =rataan Σ sel terhitung x x pengenceran besar
kotak volume
1
Penghitungan Jenis dan Jumlah Sel Leukosit (Svobodova&Vyukusova 1991) Preparat ulas darah dibuat untuk mengetahui jenis dan jumlah sel-sel leukosit. Darah diteteskan pada gelas obyek lalu diratakan dan dikering-udarakan. Preparat difiksasi dengan methanol selama 5 menit lalu dibilas dengan akuades dan dikering-udarakan kembali. Preparat diwarnai dengan pewarna Giemsa selama 15 menit lalu dibilas dengan akuades dan dikering-udarakan.
Preparat yang telah keringdiamati di bawah mikroskop untuk dihitung persentase sel-sel leukosit (limfosit, monosit, neutrofil, dan trombosit). Sel-sel leukosit dihitung sampai 100 sel, lalu dikelompokkan dan dipersentasekan sesuai jenisnya dengan rumus:
% limfosit = x 100% 100 L % monosit = x 100% 100 M % neutrofil = x 100% 100 N % trombosit = x 100% 100 T
Keterangan: L : jumlah sel limfosit M : jumlah sel monosit N : jumlah sel neutrofil T : jumlah sel trombosit
Perhitungan Jumlah Total Eritrosit (Svobodova & Vyukusova 1991)
Darah dihisap dengan pipet berskala yang berisi bulir pengaduk warna merah sampai skala 0,5 lalu ditambahkan larutan Hayem’s (berfungsi mematikan sel-sel darah putih) sampai skala 101. Pipet digoyangkan agar darah tercampur dan tetesan pertama dibuang. Larutan darah diteteskan pada haemasitometer kemudian ditutup dengan gelas penutup. Pengamatan menggunakan mikroskop perbesaran 400 kali.
5 Penghitungan jumlah eritrosit total dilakukan pada 5 kotak besar haemasitometer dan jumlahnya dihitung dengan rumus (Nabib & Pasaribu 1989):
Σeritrosit =rataan Σ sel terhitung x x pengenceran besar
kotak volume
1
Pengukuran Kadar Hematokrit (Chinabut et al. 1991)
Kadar hematokrit diukur dengan cara mencelupkan salah satu sisi tabung mikrohematokrit ke dalam ependorf yang berisi darah. Setelah darah merambat sampai sekitar 3/4 bagian tabung, kemudian ujung tabung ditutup dengan crytoseal
sedalam ± 1 mm. Tabung mikrohematokrit disentrifuse dengan kecepatan 5000 rpm selama 5 menit dengan posisi tabung yang terdapat crytoseal menghadap ke luar. Kadar hematokrit diukur berdasarkan perbandingan panjang volume darah yang mengendap terhadap panjang volume total darah.
Kadar hematokrit = x 100% b
a
Keterangan : a= volume darah yang mengendap b= volume total darah
Pengukuran Kadar Hemoglobin (Wedemeyer dan Yasutake 1977)
Kadar hemoglobin diukur dengan metode Sahli. Darah diambil dengan pipet Sahli sampai skala 0.02 ml kemudian dipindahkan ke dalam tabung haemometer yang telah diisi HCl 0.1 N sampai skala 10. Campuran diaduk selama ± 3 menit lalu ditambahkan akuades dengan pipet tetes sedikit demi sedikit sambil diaduk dengan gelas pengaduk sampai warna larutan sama seperti warna larutan standar haemometer. Kadar hemoglobin diukur dengan melihat permukaan larutan darah pada skala Sahli yang berwarna kuning (gr %).
Kelangsungan Hidup Relatif (Relative Percent Survival/RPS)
Penghitungan nilai RPS dilakukan pada akhir penelitian untuk mengetahui efektivitas dari vaksin yang digunakan. RPS dihitung menggunakan rumus:
RPS (%) = [1 ( )] x 100% Keterangan:
RPS : relative percent survival (%) Mn : mortalitas pada perlakuan N (%) Mk : mortalitas pada perlakuan kontrol (%) Kualitas Air
Parameter kualitas air yang paling berpengaruh terhadap infeksi KHV adalah suhu, sehingga pengamatannya dilakukan setiap hari. Selain itu juga diukur nilai pH menggunakan pH-meter, dissolved oxygen (DO) menggunakan DO-meter, dan NH3 menggunakan spektrofotometer.
6
Analisis Data
Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap dengan tiga ulangan. Data yang diperoleh meliputi RPS, jumlah total leukosit, diferensial leukosit, jumlah total eritrosit, kadar hemoglobin, dan kadar hematokrit diolah menggunakan Ms. Excel dan SPSS versi 16.0 serta diuji lanjut dengan uji Duncan untuk mengetahui perbedaan antar perlakuan.
HASIL DAN PEMBAHASAN
Hasil
Relative Percent Survival (RPS)
Pengamatan terhadap RPS dilakukan untuk mengetahui efektifitas vaksin dalam melindungi ikan setelah diuji tantang. Data pada Tabel 1 menunjukkan nilai yang bervariasi pada masing-masing perlakuan. Nilai RPS tertinggi terdapat pada perlakuan C yaitu 84,60±13,32% dan terendah pada perlakuan A yaitu 23,33±13,32%. Hasil analisis statistik ragam (ANOVA) pada selang kepercayaan 95% menunjukkan bahwa nilai RPS pada perlakuan A berbeda nyata dengan perlakuan C (p<0,05).
Tabel 1 Nilai relative percent survival (RPS) ikan mas yang diberi vaksin DNA anti-KHV No Perlakuan Mortalitas (%) RPS (%) 1 A 33,33±5,77 23,07±13,32a 2 B 20,00±10,00 53,84±23,07ab 3 C 6,67±5,77 84,60±13,32b 4 K+ 43,33±5,77 -
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
Huruf superskrip di belakang standar deviasi yang berbeda pada kolom yang sama menunjukkan hasil yang berbeda nyata (p<0,05)
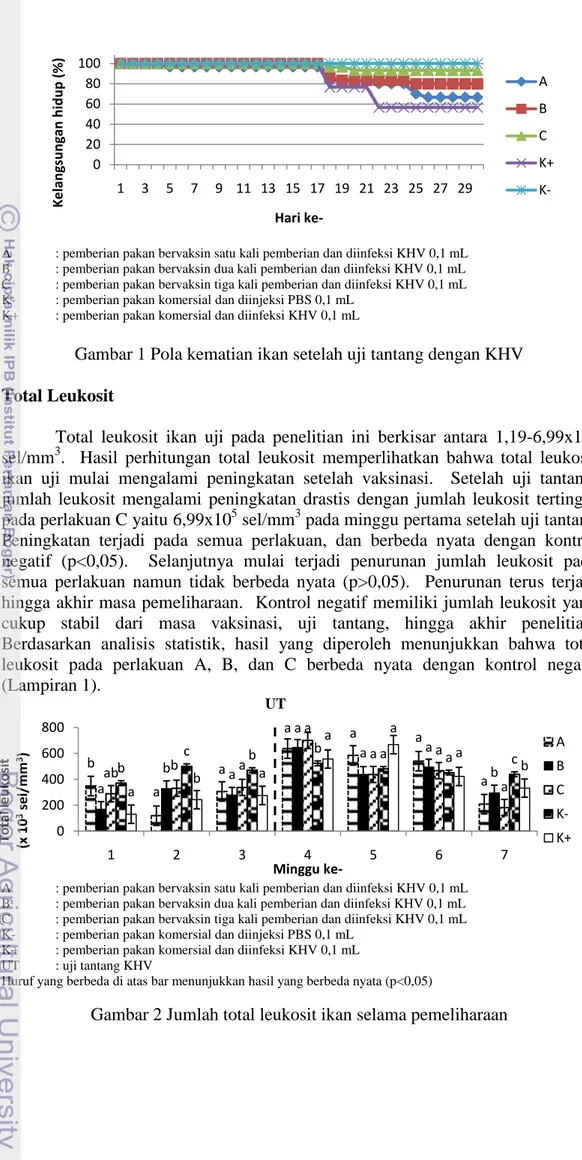
Pola kelangsungan hidup ikan mas setelah uji tantang ditunjukkan oleh Gambar 1. Kematian diawali pada perlakuan A pada hari ke-5 setelah uji tantang KHV, dan diikuti oleh perlakuan B, C, dan kontrol negatif pada hari ke-18 setelah uji tantang KHV. Pada kontrol negatif tidak terjadi kematian hingga akhir penelitian.
7
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
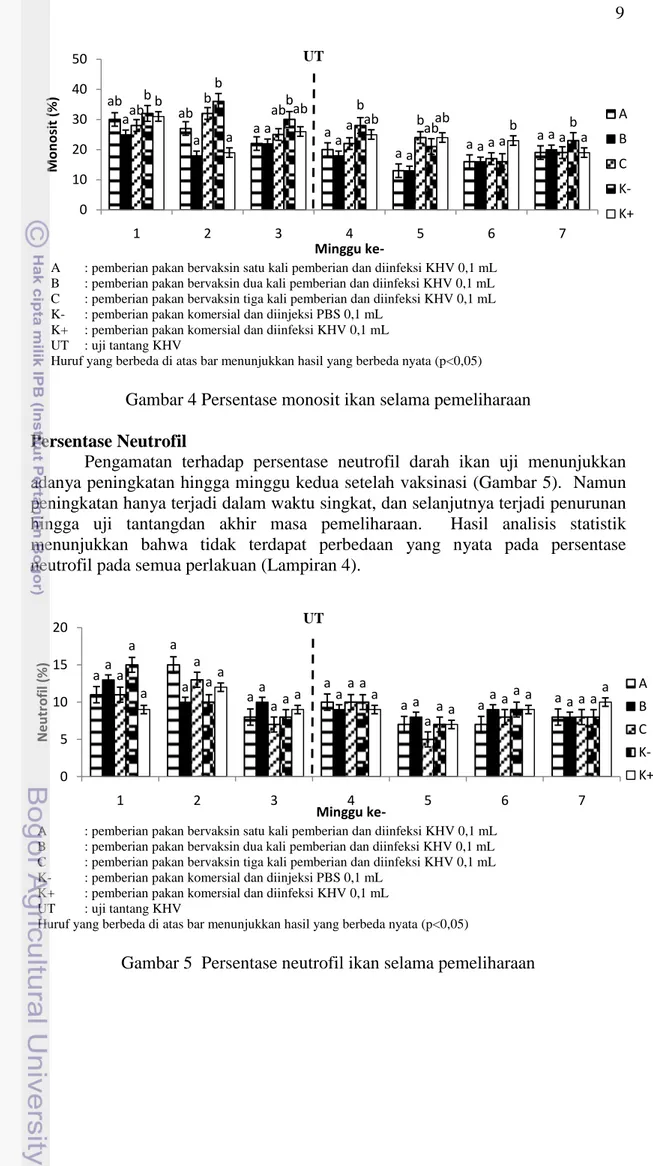
Gambar 1 Pola kematian ikan setelah uji tantang dengan KHV Total Leukosit
Total leukosit ikan uji pada penelitian ini berkisar antara 1,19-6,99x105 sel/mm3. Hasil perhitungan total leukosit memperlihatkan bahwa total leukosit ikan uji mulai mengalami peningkatan setelah vaksinasi. Setelah uji tantang, jumlah leukosit mengalami peningkatan drastis dengan jumlah leukosit tertinggi pada perlakuan C yaitu 6,99x105 sel/mm3 pada minggu pertama setelah uji tantang. Peningkatan terjadi pada semua perlakuan, dan berbeda nyata dengan kontrol negatif (p<0,05). Selanjutnya mulai terjadi penurunan jumlah leukosit pada semua perlakuan namun tidak berbeda nyata (p>0,05). Penurunan terus terjadi hingga akhir masa pemeliharaan. Kontrol negatif memiliki jumlah leukosit yang cukup stabil dari masa vaksinasi, uji tantang, hingga akhir penelitian. Berdasarkan analisis statistik, hasil yang diperoleh menunjukkan bahwa total leukosit pada perlakuan A, B, dan C berbeda nyata dengan kontrol negatif (Lampiran 1).
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 2 Jumlah total leukosit ikan selama pemeliharaan
0 20 40 60 80 100 120 1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 Ke lan gsu n gan h id u p ( % ) Hari ke-A B C K+ K-b a a a a a a a b a a a a b ab b a a a a a b c b b a a c a b a a a a b 0 200 400 600 800 1 2 3 4 5 6 7 To tal le u ko si t (x 10 3sel /m m 3) Minggu ke-A B C K-K+ UT
8
Diferensial Leukosit Persentase Limfosit
Persentase limfosit ikan uji pada penelitian ini berkisar antara 41-74%. Hasil perhitungan terhadap persentase limfosit darah ikan uji menunjukkan bahwa secara umum terjadi peningkatan pada semua perlakuan, baik setelah vaksinasi maupun uji tantang (Gambar 3). Pada minggu kedua pasca vaksinasi, peningkatan pada perlakuan B dan kontrol positif berbeda nyata dengan perlakuan lainnya (p<0,05). Peningkatan tertinggi terdapat pada perlakuan A yaitu 74% pada minggu kedua setelah uji tantang, namun tidak berbeda nyata dengan perlakuan B dan C (p>0,05). Hasil yang diperoleh bervariasi hingga minggu keenam. Di akhir penelitian, persentase limfosit pada perlakuan A dan C berbeda nyata dengan kontrol negatif (p<0,05). Hasil analisis statistik menunjukkan bahwa persentase limfosit perlakuan A dan B berbeda nyata dengan kontrol negatif, tetapi tidak berbeda nyata dengan perlakuan C dan kontrol positif (Lampiran 2).
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 3 Persentase limfosit ikan selama pemeliharaan Persentase Monosit
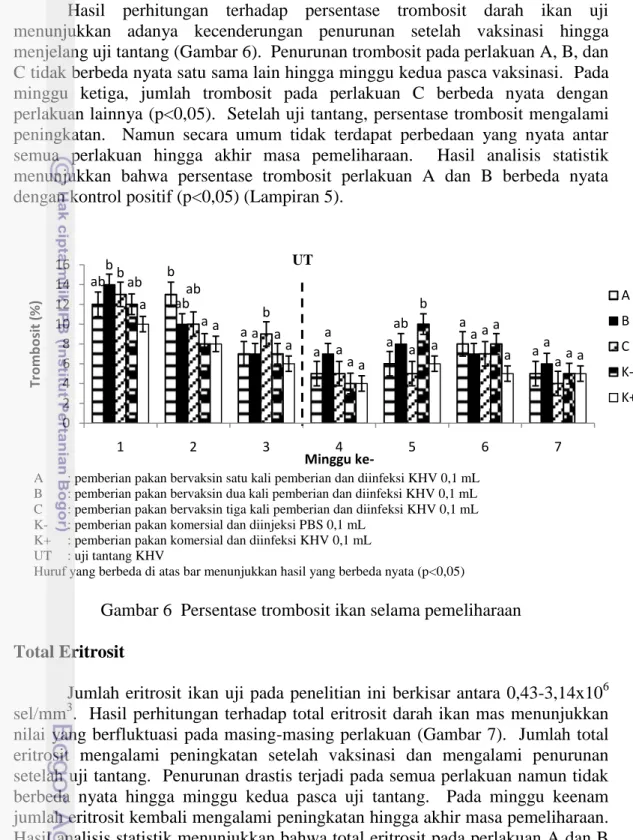
Persentase monosit ikan uji pada penelitian ini berkisar antara 13-36%. Hasil perhitungan menunjukkan terjadinya peningkatan pada semua perlakuan sesaat setelah vaksinasi, lalu menurun hingga masa uji tantang (Gambar 4). Jumlah monosit perlakuan A dan C tidak berbeda nyata dengan kontrol negatif hingga minggu kedua setelah vaksinasi (p>0,05). Penurunan jumlah monosit terus terjadi hingga akhir masa pemeliharaan pada semua perlakuan dan berbeda nyata dengan kontrol negatif (p<0,05). Hasil analisis statistik menunjukkan bahwa persentase monosit perlakuan A dan B berbeda nyata dengan kontrol negatif, tetapi tidak berbeda nyata dengan perlakuan C dan kontrol positif (Lampiran 3). a a b b b b b a b a b b ab ab a a a ab b ab b a a a a a a a a b a ab a a ab 0 20 40 60 80 100 1 2 3 4 5 6 7 Li m fosi t (% ) Minggu ke-A B C K-K+ UT
9
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 4 Persentase monosit ikan selama pemeliharaan Persentase Neutrofil
Pengamatan terhadap persentase neutrofil darah ikan uji menunjukkan adanya peningkatan hingga minggu kedua setelah vaksinasi (Gambar 5). Namun peningkatan hanya terjadi dalam waktu singkat, dan selanjutnya terjadi penurunan hingga uji tantangdan akhir masa pemeliharaan. Hasil analisis statistik menunjukkan bahwa tidak terdapat perbedaan yang nyata pada persentase neutrofil pada semua perlakuan (Lampiran 4).
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 5 Persentase neutrofil ikan selama pemeliharaan
ab ab a a a a a a a a a a a a ab b ab a b a a b b b b ab a b b a ab ab ab b a 0 10 20 30 40 50 1 2 3 4 5 6 7 M o n o si t (% ) Minggu ke-A B C K-K+ a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a 0 5 10 15 20 1 2 3 4 5 6 7 N e u tr o fi l (% ) Minggu ke-A B C K-K+ UT UT
10
Persentase Trombosit
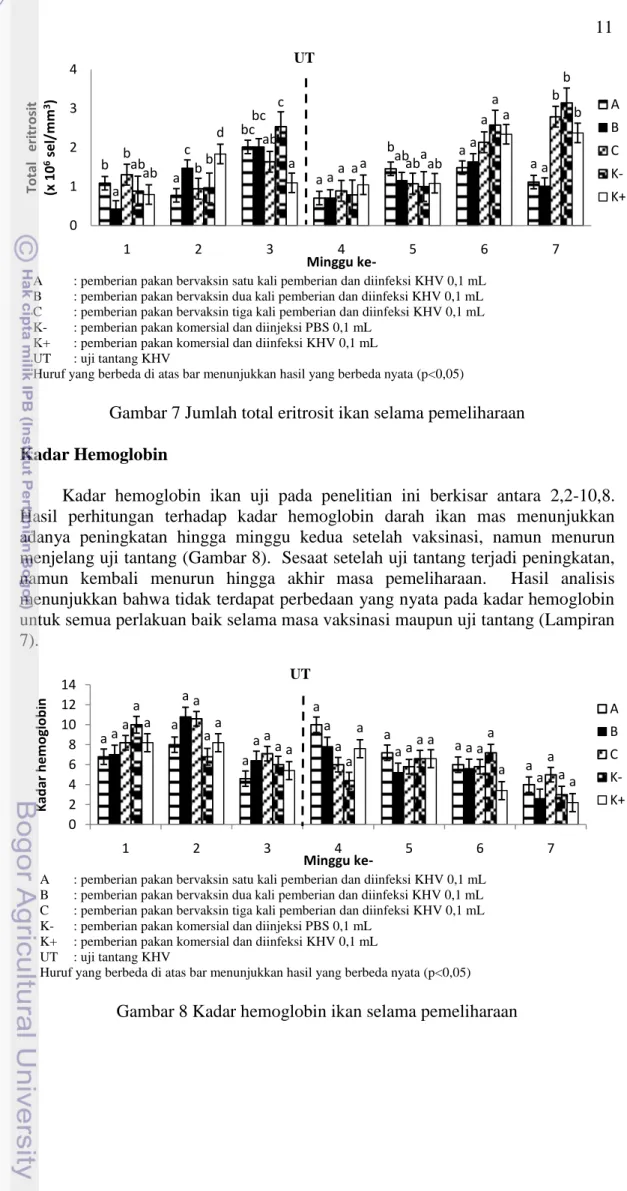
Hasil perhitungan terhadap persentase trombosit darah ikan uji menunjukkan adanya kecenderungan penurunan setelah vaksinasi hingga menjelang uji tantang (Gambar 6). Penurunan trombosit pada perlakuan A, B, dan C tidak berbeda nyata satu sama lain hingga minggu kedua pasca vaksinasi. Pada minggu ketiga, jumlah trombosit pada perlakuan C berbeda nyata dengan perlakuan lainnya (p<0,05). Setelah uji tantang, persentase trombosit mengalami peningkatan. Namun secara umum tidak terdapat perbedaan yang nyata antar semua perlakuan hingga akhir masa pemeliharaan. Hasil analisis statistik menunjukkan bahwa persentase trombosit perlakuan A dan B berbeda nyata dengan kontrol positif (p<0,05) (Lampiran 5).
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 6 Persentase trombosit ikan selama pemeliharaan Total Eritrosit
Jumlah eritrosit ikan uji pada penelitian ini berkisar antara 0,43-3,14x106 sel/mm3. Hasil perhitungan terhadap total eritrosit darah ikan mas menunjukkan nilai yang berfluktuasi pada masing-masing perlakuan (Gambar 7). Jumlah total eritrosit mengalami peningkatan setelah vaksinasi dan mengalami penurunan setelah uji tantang. Penurunan drastis terjadi pada semua perlakuan namun tidak berbeda nyata hingga minggu kedua pasca uji tantang. Pada minggu keenam jumlah eritrosit kembali mengalami peningkatan hingga akhir masa pemeliharaan. Hasil analisis statistik menunjukkan bahwa total eritrosit pada perlakuan A dan B berbeda nyata dengan kontrol negatif (Lampiran 6).
ab b a a a a a b ab a a ab a a b ab b a a a a ab a a a b a a a a a a a a a 0 2 4 6 8 10 12 14 16 1 2 3 4 5 6 7 Tr o m b o si t (% ) Minggu ke-A B C K-K+ UT
11
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 7 Jumlah total eritrosit ikan selama pemeliharaan Kadar Hemoglobin
Kadar hemoglobin ikan uji pada penelitian ini berkisar antara 2,2-10,8. Hasil perhitungan terhadap kadar hemoglobin darah ikan mas menunjukkan adanya peningkatan hingga minggu kedua setelah vaksinasi, namun menurun menjelang uji tantang (Gambar 8). Sesaat setelah uji tantang terjadi peningkatan, namun kembali menurun hingga akhir masa pemeliharaan. Hasil analisis menunjukkan bahwa tidak terdapat perbedaan yang nyata pada kadar hemoglobin untuk semua perlakuan baik selama masa vaksinasi maupun uji tantang (Lampiran 7).
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 8 Kadar hemoglobin ikan selama pemeliharaan
b a bc a b a a a c bc a ab a a b b ab a ab a b ab b c a a a b ab d a a ab a b 0 1 2 3 4 1 2 3 4 5 6 7 To tal e ri tr o si t (x 10 6sel /m m 3) Minggu ke-A B C K-K+ a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a 0 2 4 6 8 10 12 14 1 2 3 4 5 6 7 K ad ar h e m o gl o b in Minggu ke-A B C K-K+ UT UT
12
Kadar Hematokrit
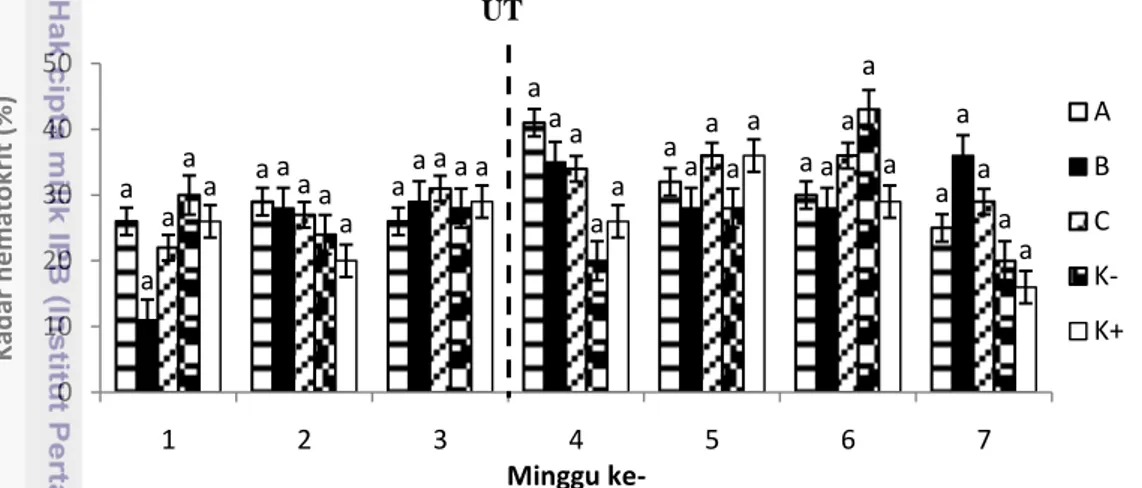
Kadar hematokrit ikan uji pada penelitian ini berkisar antara 11-43%. Hasil perhitungan terhadap kadar hematokrit darah ikan uji menunjukkan nilai yang cenderung stabil setelah vaksinasi (Gambar 9). Sesaat setelah uji tantang, kadarhematokrit pada perlakuan A, B, dan C mengalami peningkatan lalu mulai menurun hingga akhir masa pemeliharaan. Hasil analisis statistik menunjukkan bahwa tidak terdapat perbedaan yang nyata pada kadar hematokrit untuk semua perlakuan baik selama masa vaksinasi maupun uji tantang (Lampiran 8).
A : pemberian pakan bervaksin satu kali pemberian dan diinfeksi KHV 0,1 mL
B : pemberian pakan bervaksin dua kali pemberian dan diinfeksi KHV 0,1 mL
C : pemberian pakan bervaksin tiga kali pemberian dan diinfeksi KHV 0,1 mL
K- : pemberian pakan komersial dan diinjeksi PBS 0,1 mL
K+ : pemberian pakan komersial dan diinfeksi KHV 0,1 mL
UT : uji tantang KHV
Huruf yang berbeda di atas bar menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 9 Kadar hematokrit ikan selama pemeliharaan Kualitas Air
Parameter kualitas air yang paling berpengaruh terhadap serangan KHV adalah suhu, sehingga pengamatan suhu dilakukan setiap hari. Sementara parameter lain diukur pada awal dan akhir penelitian.Data kisaran parameter kualitas air selama penelitian disajikan dalam Tabel 2.
Tabel 2 Kisaran parameter kualitas air selama pemeliharaan
Parameter kualitas air Kisaran Penelitian Kisaran Toleransi
Suhu ( C) 17-23,5 20-28 (Vonti 2008) pH 7,9-8,3 6-9 (Vonti2008) DO (mg/L) 6,6-7,2 > 4 (Vonti 2008) NH3 (mg/L) 0,04-0,06 < 0,2 (Vonti 2008) a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a a 0 10 20 30 40 50 1 2 3 4 5 6 7 K ad ar h e m ato kr it (% ) Minggu ke-A B C K-K+ UT
13 Pembahasan
Vaksin merupakan antigen buatan yang berasal dari jasad patogen yang tidak bersifat patogen lagi (karena sudah dilemahkan atau dimatikan), yang dapat merangsang sistem imun dengan cara meningkatkan kekebalan ikan dari infeksi patogen selanjutnya (Ellis dalam Fitria 2009). Vaksin yang digunakan harus memenuhi beberapa syarat antara lain harus aman, dapat memberikan proteksi, mudah diaplikasikan, dan dapat digunakan untuk spesies lain (Grisez dan Tan 2005). Vaksinasi pada ikan dapat dilakukan dengan beberapa metode antara lain suntikan (injection), perendaman (immersion), dan pakan (oral). Pada penelitian ini, vaksinasi diberikan melalui pakan komersial dengan dosis mengacu pada penelitian Yuliyanti (2011) yaitu 7,6 ng dengan kepadatan bakteri 108 cfu/mL. Kelebihan metode vaksinasi melalui pakan adalah tidak memerlukan tenaga kerja yang banyak serta tidak menyebabkan stress pada ikan (Miyazaki et al. 2008). Vaksinasi dilakukan selama satu minggu dengan frekuensi satu kali (perlakuan A), dua kali (perlakuan B), dan tiga kali (perlakuan C). Ikan mas yang telah divaksinasi dipelihara selama 28 hari agar sistem imunnya terbentuk. Setelah itu dilakukan uji tantang KHV untuk melihat respons tanggap kebal pada ikan yang telah divaksinasi.
Hasil pengamatan kelangsungan hidup ikan mas menunjukkan tidak adanya kematian pada semua perlakuan selama masa vaksinasi hingga hari ke-28 pasca vaksinasi. Hal ini membuktikan bahwa vaksin DNA yang diberikan melalui pakan bersifat aman bagi ikan. Kematian ikan diawali pada perlakuan A yaitu pada hari ke-5 pasca uji tantang dan diikuti perlakuan B, C, dan kontrol positif pada hari ke-18 pasca uji tantang (Gambar 1). Kematian terbanyak terjadi pada hari ke-18 setelah uji tantang. Hal ini diduga karena sebelum hari ke-17 suhu air pada akuarium yang terletak tepat di bawah AC (air conditioner) mencapai 16,5°C sehingga mengurangi virulensi KHV. Menurut Pokorova et al. (2005) KHV bersifat inaktif pada suhu di bawah 18°C dan di atas 24°C.
Kelangsungan hidup relatif (RPS) di akhir penelitian menunjukkan nilai tertinggi pada perlakuan C (84,60%) diikuti oleh perlakuan B (53,84%) dan perlakuan A (23,07%) (Tabel 1). Hal ini menggambarkan bahwa vaksinasi tiga kali seminggu mampu mengaktifkan respons imun ikan dan memberikan proteksi lebih baik terhadap KHV dibandingkan perlakuan vaksinasi satu kali dan dua kali seminggu. Hasil yang diperoleh dalam penelitian ini sesuai dengan hasil penelitian Yuliyanti (2011) bahwa pada pemberian pakan bervaksin dua kali seminggu menunjukkan persistensi yang lebih tinggi dibandingkan pemberian pakan bervaksin satu kali seminggu. Penelitian Miyazaki et al. (2008) tentang pemberian vaksin liposom melalui pakan juga mampu meningkatkan kelangsungan hidup ikan mas yang diinfeksi KHV sebesar 74%. Namun masih perlu dilakukan penelitian lanjutan untuk mengevaluasi seberapa lama kemampuan vaksin dalam memproteksi ikan mas dari serangan KHV.
Analisis gambaran darah dapat menjadi petunjuk status kesehatan ikan. Dalam penelitian ini dilakukan perhitungan terhadap jumlah total leukosit, diferensial leukosit, jumlah total eritrosit, kadar hemoglobin, dan kadar hematokrit. Data gambaran darah tersebut berkaitan erat dengan nilai kelangsungan hidup relatif ikan pada penelitian ini. Jumlah total leukosit mulai mengalami
14
peningkatan setelah vaksinasi (Gambar 2). Peningkatan drastis pada jumlah total leukosit mulai terjadi pada minggu pertama setelah uji tantang. Peningkatan tersebut menunjukkan bahwa mekanisme pertahanan tubuh ikan mulai bekerja melawan infeksi KHV. Martins et al. (2008) menyatakan bahwa jumlah leukosit pada ikan yang terinfeksi patogen akan meningkat sebagai upaya pertahanan tubuh. Peningkatan total leukosit tertinggi terdapat pada perlakuan C yaitu 6,99x105 sel/mm3 pada minggu pertama pasca uji tantang. Diduga pemberian pakan bervaksin tiga kali seminggu lebih mampu membangkitkan kekebalan selular dan humoral sebagai upaya pertahanan tubuh. Hal ini dikuatkan dengan nilai RPS pada akhir penelitian yang menunjukkan nilai tertinggi pada perlakuan C sebesar 84,60%. Penurunan total leukosit pada akhir masa pemeliharaan diduga karena infeksi KHV yang menyerang ikan semakin ganas. Hal ini sejalan dengan kelangsungan hidupnya yang terus mengalami penurunan hingga minggu ketiga pasca uji tantang. Nuryati et al. (2010) yang menyatakan bahwa penurunan jumlah leukosit setelah uji tantang menunjukkan bahwa leukosit tersebut diduga aktif dan keluar dari pembuluh darah menuju jaringan yang terinfeksi.
Diferensial leukosit meliputi limfosit, monosit, neutrofil, dan trombosit. Pengamatan terhadap persentase limfosit menunjukkan adanya kecenderungan peningkatan pada semua perlakuan, baik setelah vaksinasi maupun uji tantang (Gambar 3). Peningkatan jumlah limfosit setelah vaksinasi mengindikasikan bahwa ikan memberikan respons terhadap adanya antigen yang masuk ke dalam tubuh. Setelah uji tantang jumlah limfosit masih terus mengalami peningkatan. Peningkatan ini dikarenakan infeksi KHV yang terjadi pada tubuh ikan mendorong produksi sel limfosit. Hal ini berkaitan dengan peran limfosit sebagai sel pertahanan tubuh. Menurut Kresno (2001), limfosit terdiri dari sel B dan sel T yang berperan sebagai sel pertahanan tubuh. Sel B mampu bertransformasi menjadi sel plasma yang memproduksi antibodi, sedangkan sel T berfungsi dalam kekebalan berperantara sel (sel T sitotoksik) dan mengontrol respon imun (sel T supresor). Persentase limfosit pada penelitian ini ditemukan lebih tinggi daripada persentase monosit, neutrophil, dan trombosit dari awal hingga akhir pengamatan.
Hasil pengamatan menunjukkan terjadinya peningkatan persentase monosit sesaat setelah vaksinasi (Gambar 4). Hal ini mengindikasikan bahwa pemberian vaksin mengaktifkan peran monosit dalam menginduksi sistem imun. Setelah uji tantang terjadi penurunan jumlah monosit pada semua perlakuan kecuali pada kontrol negatif. Penurunan jumlah monosit terus terjadi hingga akhir masa pemeliharaan yang diduga merupakan respon terhadap infeksi KHV. Rendahnya jumlah monosit diduga karena monosit sudah mulai keluar dari pembuluh darah menuju jaringan yang terinfeksi dan berdiferensiasi menjadi makrofag (sel fagosit utama). Hal ini sejalan dengan pendapat Clauss et al. (2008) yang menyatakan bahwa rendahnya jumlah monosit merupakan respon yang menunjukkan terjadinya inflamasi pada ikan teleostei. Sementara pada kontrol negatif jumlah monosit cenderung tetap setelah uji tantang diduga karena monosit tetap berada di pembuluh darah karena tidak terjadi infeksi pada tubuh ikan. Hal ini dikuatkan dengan tidak terjadinya kematian pada ikan kontrol negatif hingga akhir penelitian.
Persentase neutrofil darah ikan uji mengalami peningkatan setelah vaksinasi (Gambar 5). Peningkatan tersebut menunjukkan adanya respons terhadap antigen yang masuk, dalam hal ini vaksin. Namun peningkatan hanya terjadi dalam waktu singkat, dan selanjutnya menurun hingga masa uji tantang dan akhir masa
15 pemeliharaan. Penurunan jumlah neutrofil tersebut diduga karena jumlah limfosit yang berperan dalam pembentukan antibodi mengalami peningkatan. Thakur dan Pandey (1990) menyatakan bahwa penurunan jumlah neutrofil dan peningkatan jumlah limfosit menunjukkan respon kekebalan dalam menghasilkan antibodi. Jumlah neutrofil yang teramati paling sedikit dibandingkan sel leukosit yang lain. Hal ini karena peran utama neutrofil adalah menahan serangan akibat infeksi bakteri, sehingga tidak terlalu berperan dalam merespons serangan akibat infeksi virus (Purwanto 2006).
Trombosit memiliki peran penting dalam penggumpalan darah (Hoole 2001). Pengamatan terhadap persentase trombosit menunjukkan kecenderungan penurunan setelah vaksinasi hingga menjelang uji tantang (Gambar 6). Setelah uji tantang, jumlah trombosit mulai mengalami kenaikan. Hal ini diduga karena setelah uji tantang ikan mengalami luka akibat infeksi KHV, sehingga trombosit memberikan respons dalam proses penggumpalan darah dan penyembuhan luka. Jumlah trombosit yang menurun pada akhir pengamatan diduga karena mulai terjadi penyembuhan luka akibat infeksi KHV.
Pengamatan terhadap jumlah total eritrosit menunjukkan kecenderungan peningkatan setelah vaksinasi hingga menjelang uji tantang pada semua perlakuan (Gambar 7). Namun peningkatan tersebut masih berada pada batas normal. Menurut Ghitino dalam Radu (2009), sel eritrosit normal ikan mas berkisar 1,1-2,2 (x 106 sel/mL). Setelah uji tantang jumlah eritrosit menurun drastis yang diduga karena infeksi KHV menyebabkan pendarahan pada bagian tubuh ikan dan tubuh lebih banyak memproduksi leukosit sebagai bentuk pertahanan tubuh. Pada minggu ketiga setelah uji tantang, jumlah eritrosit kembali mengalami peningkatan yang diduga merupakan upaya pemulihan (recovery) pada tubuh ikan pasca uji tantang. Tanbiyaskur (2011) menyatakan bahwa tubuh ikan akan memproduksi eritrosit lebih banyak untuk menggantikan eritrosit yang menurun akibat infeksi patogen.
Hemoglobin berfungsi mengikat oksigen dalam darah. Tripathi et al.(2004) menyatakan bahwa hemoglobin pada ikan mas berkisar 6,94. Hasil pengamatan memperlihatkan bahwa kadar hemoglobin ikan uji mengalami peningkatan setelah vaksinasi. Namun setelah uji tantang, jumlahnya menurun hingga akhir masa pemeliharaan (Gambar 8). Penurunan kadar hemoglobin ini diduga karena infeksi KHV menyerang organ insang sehingga proses pengikatan oksigen terhambat. Selain itu juga diduga akibat proses pemulihan yang mengakibatkan tubuh ikan memproduksi eritrosit sebagai pengganti eritrosit yang mati akibat infeksi patogen. Eritrosit muda memiliki kemampuan mengikat oksigen yang lebih sedikit dibandingkan eritrosit matang.
Kadar hematokrit merupakan persentase perbandingan antara padatan sel darah merah dalam darah (Affandi dan Tang 2002). Dalam kondisi normal, kadar hematokrit darah ikan mas berkisar 32-43,8% (Ghitino dalam Radu 2009). Secara umum, kadar hematokrit darah ikan uji setelah vaksinasi cenderung stabil setelah vaksinasi (Gambar 9). Sesaat setelah uji tantang, kadar hematokrit mengalami peningkatan lalu mulai menurun hingga akhir masa pemeliharaan. Penurunan kadar hematokrit setelah uji tantang menunjukkan bahwa infeksi KHV yang menyerang ikan sudah cukup serius. Wedemeyer dan Yasutake dalam Khaefah (2011) menyatakan bahwa kadar hematokrit yang rendah merupakan petunjuk kurangnya protein dalam pakan, defisiensi vitamin, atau ikan terkena infeksi.
16
Kualitas air selama penelitian dijaga agar layak sebagai media pemeliharaan ikan, sebab ikan akan mudah terserang penyakit apabila kondisi media hidupnya kurang baik. Pergantian air dan penyifonan dilakukan secara rutin, serta dilakukan pengukuran parameter kualitas air yang meliputi suhu, pH, DO, dan NH3. Hasil pengamatan terhadap parameter kualitas air pada Tabel 2
menunjukkan bahwa parameter tersebut masih berada pada kisaran normal sehingga layak digunakan sebagai media pemeliharaan. Hal ini juga membuktikan bahwa ikan uji yang terserang penyakit dan mengalami kematian bukan disebabkan oleh kualitas air yang buruk, tetapi akibat infeksi KHV.
KESIMPULAN
Hasil penelitian menunjukkan sekalipun terjadi peningkatan jumlah total leukosit, eritrosit, dan limfosit serta penurunan jumlah monosit dan trombosit pada perlakuan A, B, dan C, akan tetapi perlakuan terbaik ditunjukkan oleh perlakuan C (pemberian vaksin tiga kali dalam seminggu) yang menghasilkan kelangsungan hidup relatif sebesar 84,6%.
DAFTAR PUSTAKA
Affandi R, Tang UM. 2002. Fisiologi Hewan Air. Pekanbaru (ID): Unri Pr. Amrullah. 2004. Penggunaan imunostimulan Spirulina plantesis untuk
meningkatkan ketahanan tubuh ikan koi (Cyprinus carpio) terhadap virus herpes [tesis]. Bogor (ID): Institut Pertanian Bogor.
Blaxhall PC. 1972. The haematological assessment of the health of fresh water fish: a review of selected literature. J Fish Biol. 4: 593-608.
Chinabut S, Limsuwan C, Katsuwan. 1991. Histology of Walking Catfish Clarias batrachus. Kanada (CA): IDRC. 96p.
Clauss TM, Dove ADM, Arnold JE. 2008. Hematologic Dissorders of Fish. Vet Clin Exot Anim. 11: 445-462
Ellis AE. 1988. General Principle of Fish Vaccination. In: Ellis AE, editor. Fish Vaccination. San Diego (US): Academic Pr.
Fitria IH. 2009. Efektivitas vaksin DNA dalam meningkatkan kelangsungan hidup ikan mas yang terinveksi koi herpesvirus (KHV) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fujaya Y. 2002. Fisiologi Ikan: Dasar Pengembangan Teknologi Perikanan.
Jakarta (ID): Tineka Cipta.
Grisez L, Tan Z. 2005. Vaccine development for Asian aquaculture. Dis Asian Aquacul. 5: 483-494.
Hoole D, Bucke D, Burgess P, Wellby I. 2001. Disease of Carp and Other Cyprinid Fishes. Cornwal (US): MPG Books Ltd.
17 Khaefah. 2011. Lama pemberian ekstrak bawang putih Allium sativum yang optimum pada pakan untuk mencegah penyakit Koi Herpes Virus pada ikan mas Cyprinus carpio [skripsi]. Bogor (ID): Institut Pertanian Bogor. Khodijah S. 2012. Efektivitas pemberian vaksin DNA melalui pakan terhadap
kelangsungan hidup relatif ikan mas yang diinfeksi koi herpesvirus [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kresno SB. 2001. Imunologi Diagnosis dan Prosedur Laboratorium.Edisi ketiga. Fakultas Kedokteran Universitas Indonesia: Jakarta.
Lagler KF, Bardach JE, Miller RR, Passino DRM. 1977. Ichthyology. New York: John Willey and Sons. Inc.
Lorenzen N, Lapatra SE. 2005. DNA vaccine for aquaculture fish. Ref Sci Tech Off Int Epiz. 24 (1): 201-213.
Martins ML, Mourino JLP, Amara GV, Vieira FN, Dotta G, Jatoba AMB, Pedrotti FS, Jeronimo GT. 2008. Haematological changes in nile tilapia experimentally infected with Enterococcus sp. Braz Journal Biol 68 (3): 657-661.
Miyazaki T, Yasumoto S, Kuzuya Y, Yoshimura T. 2008. A primary study on oral vaccination with liposomes entrapping koi herpesvirus (KHV) antigens against KHV infection in carp. Dis Asian Aquacul. 6: 99-184. Nabib R, Pasaribu FH. 1989. Patologi dan PenyakitIkan.Bogor (ID): PAU IPB. Nuryati S, Maswan NA, Alimuddin, Sukenda, Sumantadinata K, Pasaribu FH,
Soejoeno RD, Santika A. 2010. Gambaran darah ikan mas setelah divaksinasi dengan vaksin DNA dan diuji tantang dengan koi herpesvirus. JAI. 9 (1): 9-15.
Pokorova D, Vesely T, PiackovaV, Reschova S, Hulova J. 2005. Current knowledge on koi herpesvirus (KHV): A Review. Vet Med Czech. 50: 139-147.
Purwanto A. 2006. Gambaran darah ikan mas Cyprinus carpioyang terinfeksi koi herpes virus [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Radu D, Oprea L, Bucur C, Costache M, Oprea D. 2009. Characteristics of haematological parameters for carp culture and koi (Cyprinus carpio) reared in an intensive system. Bull UASVM Animal Sci Biotech. 66 (1-2): 336-342.
Sunarto A, Rukyani A, Itami T. 2005. Indonesian experience on the outbreak of koi herpesvirus in koi and carp (Cyprinus carpio). Bull Fish Res Agen Supp. 2: 15-21.
Svobodova Z, Vyukusova B. 1991. Diagnostik, prevention and therapy of fish disease and intoxication.Research Institute of fish Culture and Hydrobiology Vodnany Czechoslovakia. [http//www.fao.org]
Tanbiyaskur. 2011. Efektivitas pemberian probiotik, prebiotic, dan sinbiotik melalui pakan untuk pengendalian infeksi Streptococcus agalactiae pada ikan nila (Oreochromis niloticus) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Taukhid, Sunarto A, Koesharyani I, Supriyadi H, Gaedenia L. 2004. Strategi pengendalian penyakit koi herpes virus (KHV) pada ikan mas dan koi. Makalah seminar pengendalian penyakit koi herpes virus (KHV) pada budidaya ikan air tawar. Bogor
18
Thakur GK, dan Pandey PK. 1990. BHC (Gammaxene) poisoning effect on leucocytes of an air breathing fish. Clarias batrachus.(Linn). J Env Bio.
11(2):105-110.
Tizard I. 1988. Pengantar Imunologi Veteriner. Edisi ke-2. Partodirejo M, Hardjosworo S, penerjemah. Surabaya (ID): Airlangga Univ Pr. Terjemahan dari: An Introduction to Veterinary Immunology.
Tripathi NK, Latimer KS, Burnley VV. 2004. Haematologic reference interval for koi (Cyprinus carpio), including blood cell morphology, cytochemistry and ultrastructure. Vet Clin Path. 33: 74-83.
Vonti O. 2008. Gambaran darah ikan mas (Cyprinus carpio Lynn) strain sinyonya yang berasal dari daerah Ciampea-Bogor [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wedemeyer GA, Yasutake. 1977. Clinical methods for the assessment of the effect of environmental stress on fish health, Technical Paper of the US Department of the Interior Fish and the Wildlife Service. 89: 1-17.
Yuliyanti. 2011. Persistensi vaksin DNA penyandi Glikoprotein 25 yang diberikan melaui pakan buatan pada ikan mas Cyprinus carpio [skripsi]. Bogor (ID): Institut Pertanian Bogor.
LAMPIRAN
Lampiran 1. Analisis statistik jumlah total leukosit ikan uji selama pemeliharaan
TOTAL LEUKOSIT
Source Type III
Sum of Squares df Mean Square F Sig. PERLAKUAN Hypothesis 2.637E11 4 6.593E10 10.545 .021
Error 2.501E10 4 6.252E9
MINGGU Hypothesis 1.638E12 6 2.730E11 65.968 .000 Error 2.483E10 6 4.138E9
PERLAKUAN * MINGGU Hypothesis 5.081E11 24 2.117E10 3.000 .005 Error 1.694E11 24 7.058E9
Duncan PERLAKUAN N Subset 1 2 K+ 14 3.75E5 B 14 3.78E5 A 14 3.92E5 C 14 3.92E5 K- 14 5.37E5 Sig. .636 1.000
19 Lampiran 2. Analisis statistik persentase limfosit ikan uji selama pemeliharaan
LIMFOSIT
Source Type III
Sum of Squares df Mean Square F Sig. Intercept Hypothesis 126961.829 1 126961.829 386.966 .000 Error 1968.571 6 328.095 PERLAKUAN Hypothesis 191.600 4 47.900 2.963 .040 Error 388.000 24 16.167 MINGGU Hypothesis 1968.571 6 328.095 20.295 .000 Error 388.000 24 16.167 Duncan PERLAKUAN N Subset 1 2 K- 7 56.14 C 7 59.71 59.71 K+ 7 60.57 60.57 A 7 61.57 B 7 63.14 Sig. .062 .157
Lampiran 3. Analisis statistik persentase monosit ikan uji selama pemeliharaan
MONOSIT
Source Type III
Sum of Squares df Mean Square F Sig. Intercept Hypothesis 18240.029 1 18240.029 202.453 .000 Error 540.571 6 90.095a PERLAKUAN Hypothesis 246.686 4 61.671 4.688 .006 Error 315.714 24 13.155b MINGGU Hypothesis 540.571 6 90.095 6.849 .000 Error 315.714 24 13.155b Duncan PERLAKUAN N Subset 1 2 3 B 7 18.86 A 7 21.00 21.00 C 7 23.86 23.86 K+ 7 23.86 23.86 K- 7 26.57 Sig. .280 .176 .198
20
Lampiran 4. Analisis statistik persentase neutrofil ikan uji selama pemeliharaan
NEUTROFIL
Source Type III
Sum of Squares df Mean Square F Sig. Intercept Hypothesis 3055.114 1 3055.114 164.422 .000 Error 111.486 6 18.581 PERLAKUAN Hypothesis 2.457 4 .614 .273 .892 Error 53.943 24 2.248 MINGGU Hypothesis 111.486 6 18.581 8.267 .000 Error 53.943 24 2.248 Duncan PERLAKUAN N Subset 1 C 7 8.86 K+ 7 9.29 A 7 9.43 B 7 9.57 K- 7 9.57 Sig. .434
Lampiran 5. Analisis statistik persentase trombosit ikan uji selama pemeliharaan
TROMBOSIT
Source Type III
Sum of Squares df Mean Square F Sig. Intercept Hypothesis 2021.600 1 2021.600 60.048 .000 Error 202.000 6 33.667 PERLAKUAN Hypothesis 18.114 4 4.529 2.570 .064 Error 42.286 24 1.762 MINGGU Hypothesis 202.000 6 33.667 19.108 .000 Error 42.286 24 1.762 Duncan PERLAKUAN N Subset 1 2 K+ 7 6.29 C 7 7.57 7.57 K- 7 7.71 7.71 A 7 8.00 B 7 8.43 Sig. .068 .281
21 Lampiran 6. Analisis statistik jumlah total eritrosit ikan uji selama pemeliharaan
TOTAL ERITROSIT
Source Type III
Sum of Squares df Mean Square F Sig. PERLAKUAN Hypothesis 2.507E12 4 6.268E11 12.515 .016
Error 2.003E11 4 5.008E10
MINGGU Hypothesis 1.756E13 6 2.927E12 24.691 .001 Error 7.113E11 6 1.186E11
PERLAKUAN * MINGGU Hypothesis 1.190E13 24 4.960E11 5.038 .000 Error 2.363E12 24 9.845E10
Duncan PERLAKUAN N Subset 1 2 B 14 1.21E6 A 14 1.23E6 K+ 14 1.51E6 C 14 1.54E6 K- 14 1.70E6 Sig. .816 .145
Lampiran 7. Analisis statistik kadar hemoglobin ikan uji selama pemeliharaan
HEMOGLOBIN
Source Type III
Sum of Squares df Mean Square F Sig. Intercept Hypothesis 1460.606 1 1460.606 89.707 .000 Error 97.692 6 16.282 PERLAKUAN Hypothesis 3.898 4 .975 .456 .767 Error 51.294 24 2.137 MINGGU Hypothesis 97.692 6 16.282 7.618 .000 Error 51.294 24 2.137 Duncan PERLAKUAN N Subset 1 K+ 7 5.9429 K- 7 6.2857 B 7 6.4857 A 7 6.6571 C 7 6.9286 Sig. .270
22
Lampiran 8. Analisis statistik kadar hematokrit ikan uji selama pemeliharaan
HEMATOKRIT
Source Type III
Sum of Squares df Mean Square F Sig. Intercept Hypothesis 28229.600 1 28229.600 371.768 .000 Error 455.600 6 75.933 PERLAKUAN Hypothesis 99.543 4 24.886 .653 .631 Error 915.257 24 38.136 MINGGU Hypothesis 455.600 6 75.933 1.991 .107 Error 915.257 24 38.136 Duncan PERLAKUAN N Subset 1 K+ 7 26.00 K- 7 27.57 B 7 27.86 A 7 29.86 C 7 30.71 Sig. .213
23
RIWAYAT HIDUP
Penulis dilahirkan di Kota Batu, pada tanggal 29 Desember 1988 dari pasangan Bapak Fatkhul Khoiri dan Ibu Shofiah. Penulis merupakan anak pertama dari dua bersaudara. Pendidikan formal ditempuh penulis di SMA Negeri 1 Batu dan lulus tahun 2007. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB pada program studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah mengikuti praktik lapangan di Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi pada tahun 2011. Penulis juga pernah menjadi asisten mata kuliah Fisiologi Hewan Air dan Pendidikan Agama Islam pada tahun 2009-2011. Selain itu penulis juga aktif sebagai pengurus Himpunan Mahasiswa Akuakultur IPB, Lembaga Dakwah Fakultas Perikanan dan Ilmu Kelautan, serta penyiar di radio komunitas muslim IPB. Penulis memperoleh beasiswa Eka Tjipta Foundation dari tahun 2007 sampai tahun 2011. Tugas akhir dalam pendidikan tinggi diselesaikan dengan menuliskan skripsi yang berjudul “Analisis Gambaran Darah terhadap Kelangsungan Hidup Relatif Ikan Mas yang diberi Vaksin DNA Anti-KHV melalui Pakan dengan Frekuensi Berbeda”.