FORMULASI SEDIAAN KRIM EKSTRAK ETANOLIK DAUN SALAM (Eugenia polyantha Wight.) DENGAN PENGUJIAN AKTIVITASNYA SEBAGAI ANTI INFLAMASI TOPIKAL PADA TIKUS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh :
Tomas Indra Waskitha Utama
NIM: 108114111
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
FORMULASI SEDIAAN KRIM EKSTRAK ETANOLIK DAUN SALAM (Eugenia polyantha Wight.) DENGAN PENGUJIAN AKTIVITASNYA
SEBAGAI ANTI INFLAMASI TOPIKAL PADA TIKUS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
/
Oleh :
Tomas Indra Waskitha Utama
NIM: 108114111
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan Yang Maha Esa karena atas berkat, rahmat serta penyertaan-Nya, penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Formulasi sediaan krim ekstrak etanolik daun salam (Eugenia polyantha Wight.) dengan pengujian aktivitasnya sebagai antiinflamasi topikal pada tikus” sebagai salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmai Universitas Sanata Dharma, Yogyakarta.
Penulis menyadari dalam penyusunan skripsi ini tidak lepas dari bantuan beberapa pihak, oleh karena itu pada kesempatan ini penulis mengucapkan terimakasih kepada :
1. Orangtua penulis, yang telah memberikan doa, semangat serta dukungan moral maupun material kepada penulis sehingga penulis dapat menyelesaikan skripsi ini.
2. Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
3. Ibu C. M. Ratna Rini Nastiti, M. Pharm. Apt., selaku Kaprodi Fakultas Farmasi Universitas Sanata Dharma, sekaligus Dosen Pembimbing Skripsi yang telah memberikan waktu, pengarahan, pendampingan kepada penulis selama proses penelitian, penyusunan, hingga penyelesaian skripsi ini.
5. Bapak Yohanes Dwiatmaka, M.Si. selaku dosen penguji skripsi yang telah memberikan waktu, kritik, saran dan masukan kepada penulis.
6. Semua dosen-dosen farmasi yang tidak dapat disebutkan satu per satu yang telah sabar mendidik serta memberikan ilmu kepada penulis selama menempuh pendidikan di Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
7. Staf – staf laboratorium dan karyawan Fakultas Farmasi Universitas Sanata Dharma: khususnya Pak Musrifin, Pak Wagiran, Pak Heru, Pak Parjiman, Mas Darto yang telah banyak membantu selama penelitian di laboratorium.
8. Odilia Arum Narwastu, Felicia Aniska, Sekar Wulan Kinanthi Herlambang, Samuel Meinardus Dwi Prasetyo, yang menjadi teman seperjuangan dan tempat berbagi keluh kesah selama penelitian dan penyusunan skripsi.
9. Rekan-rekan skripsi lantai 1 (hans dkk, enggar dkk, sisca dkk, via dkk, Stephanie dkk)dan lantai 3 (desti dkk, della dkk, nessya dkk) untuk kebersamaan, bantuan, masukan serta keceriaan selama bekerja di laboratorium.
10.Sahabat-sahabat seperjuangan Stefanus Indra Gamawan, Agriva Devaly Avista, Angga Zakharia, Fransiskus Asisi Dian Kristianto, Hans Gani, Daniel Pradipta, Evan Gunawan, Henny, Verica Septi atas kebersamaan, kekompakan, suka duka, serta motivasi yang selalu diberikan kepada penulis. 11.Lulu Margathe yang selalu menemani penulis dengan doa, semangat, kasih
12.Teman-teman Farmasi 2010, atas persahabatan yang terjalin dari awal kuliah sampai saat ini.
13.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu penulis dalam mewujudkan skripsi ini. Terima Kasih semua.
Penulis menyadari atas ketidaksempurnaan dalam penyusunan karya ini. Oleh karena itu, penulis menerima segala bentuk kritik dan saran yang berguna untuk kesempurnaan skripsi ini. Penulis juga berharap semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Yogyakarta, 24 Mei 2014
DAFTAR ISI
HALAMAN JUDUL ... .i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN KARYA ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
C. Natrium Diklofenak ... 10
I. Oleum Mentha piperita ... 15
J. Krim ... 16
K. Landasan Teori ... 17
L. Hipotesis ... 18
BAB III. METODE PENELITIAN ... 19
A. Jenis dan Rancangan Penelitian ... 19
B. Variabel Penelitian dan Definisi Operasional ... 19
C. Alat Penelitian ... 21
D. Bahan Penelitian ... 21
E. Formula ... 22
F. Tata Cara Penelitian ... 24
1. Determinasi Tanaman ... 24
2. Pengumpulan dan Pembuatan serbuk Simplisia ... 24
3. Standarisasi Ekstrak ... 24
4. Pembuatan Ekstrak Daun Salam ... 24
5. Formulasi Krim ... 25
b. Pembuatan Krim Peppermint 0,5% ... 25
c. Pembuatan Krim Ekstrak Daun Salam ... 26
d. Pembuatan Krim Ekstrak Daun Salam dengan Peppermint 0,5% 26 6. Modifikasi Sediaan Biocream ... 27
a. Pembuatan Biocream® Peppermint 0,5% ... 27
b. Pembuatan Biocream® Esktrak Daun Salam... 27
c. Pembuatan Biocream® Esktrak Daun Salam Peppermint 0,5% .. 27
7. Uji Sifat Fisik Krim ... 27
a. Uji Organoleptis dan pH ... 27
b. Uji Daya Sebar Krim ... 27
c. Uji Viskositas Krim ... 28
8. Uji Aktivitas Antiinflamasi Sediaan Krim Ekstrak Daun Salam ... 28
a. Penyiapan Hewan Uji ... 28
b. Pembuatan Suspensi Karagenin ... 28
c. Uji Aktivitas Antiinflamasi Sediaan Krim Ekstrak Daun Salam .. 29
d. Uji Aktivitas Antiinflamasi Sediaan Biocream® Ekstrak Daun Salam……….29
9. Penentuan Persen (%) Reduksi Inflamasi ... 30
10.Analisis Hasil ... 30
BAB IV. HASIL DAN PEMBAHASAN ... 31
A. Hasil Determinasi Tanaman ... 31
B. Hasil Standarisasi Ekstrak ... 31
1. Uji Organoleptis dan Uji pH ... 32
2. Uji Daya Sebar dan Uji Viskositas ... 33
3. Stabilitas Sediaan ... 35
D. Efek Antiinflamasi Krim Ekstrak Daun Salam ... 36
E. Uji Antiinflamasi Krim Ekstrak Daun Salam ... 38
BAB V. KESIMPULAN DAN SARAN ... 45
A. Kesimpulan ... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN ... 51
DAFTAR TABEL
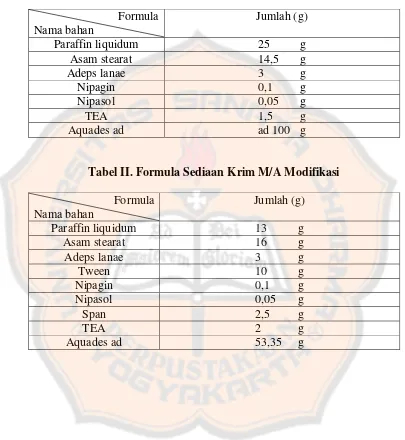
Tabel I. Formula Standar Krim ... 22
Tabel II. Formula Sediaan Krim M/A Modifikasi ... 22
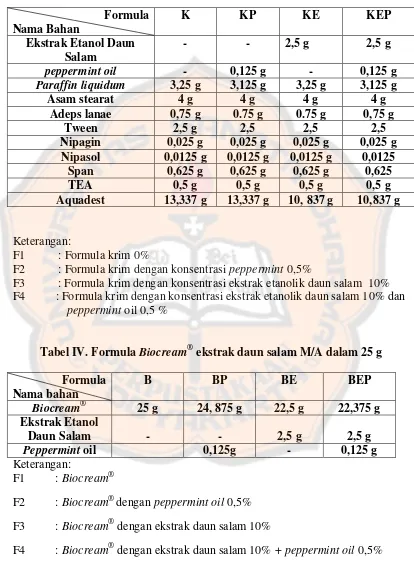
Tabel III. Formula Krim Ekstrak Daun Salam M/A dalam 25 g ... 23
Tabel IV. Formula Biocream® Ekstrak Daun Salam M/a dalam 25 g ... 23
Tabel V. Hasil Uji Organoleptis dan uji pH Krim Ekstrak Daun Salam….. 32
Tabel VI. Hasil Uji Daya Sebar dan Viskositas Krim Ekstrak Daun Salam..33
Tabel VII. Persentase Pergeseran Viskositas Krim Ekstrak Daun Salam ... 36
Tabel VIII. % Reduksi Udema Selama Perlakuan ... 38
Tabel IX. Hasil Uji Statistik % Reduksi Udema Pada Jam Ke-4 ... 41
DAFTAR GAMBAR
Gambar 1. Mekanisme Inflamasi ... 9
Gambar 2. Voltaren® ... 11
DAFTAR LAMPIRAN
Lampiran 1. Lembar Determinasi Daun Salam ... 51
Lampiran 2. Penetapan Kadar Quercetin dengan Metode KLT Densito ... 52
Lampiran 3. Penetapa Kadar Air Menggunakan Metode Gravimetri ... 54
Lampiran 4. Dokumentasi... 56
Lampiran 5. Ethical Clearance ... 59
Lampiran 6. Uji Sifat Fisik ... 60
INTISARI
Ekstrak daun salam (Eugenia polyantha Wight) mengandung flavonoid total tidak kurang dari 0,40% dihitung sebagai kuersetin. Flavonoid dalam tanaman dapat berfungsi sebagai antiinflamasi. Tujuan dari penelitian ini adalah untuk mengetahui efek antiinflamasi dari ekstrak daun salam pada sediaan krim terhadap udema telapak kaki tikus betina yang terinduksi karagenin serta melihat pengaruh penambahan penetration enhancer dalam meningkatkan aktivitas antiinflamasi pada sedian krim.
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan acak pola searah. Penelitian ini dilakukan dengan membagi hewan uji menjadi kelompok kontrol negatif, kelompok basis krim dan biocream, kelompok basis krim dan Biocream® dengan peppermint oil, kelompok ekstrak krim dan Biocream®, kelompok ekstrak krim dan Biocream® dengan peppermint oil dan kelompok kontrol positif voltaren®. Pengukuran udema dilakukan dengan metode jangka sorong pada jam ke-4 dan 24. Analisis data menggunakan program R 3.0.1. dengan taraf kepercayaan 95%.
Hasil penelitian menunjukkan sediaan krim ekstrak daun salam mempunyai stabilitas yang baik pada formula krim ekstrak dan krim ekstrak peppermint sedangkan Biocream® ekstrak dan Biocream® ekstrak peppermint tidak. Formula Biocream® ekstrak mempunyai aktivitas lebih rendah dibandingkan dengan kontrol positif sedangkan pada formula Biocream® ekstrak peppermint, krim ekstrak dan krim ekstrak peppermint mempunyai aktivitas antiinflamasi yang sama kuatnya dengan kontrol positif emulgel pada jam ke-24, sedangkan penambahan peppermint oil sebagai penetration enhancer tidak berpengaruh pada peningkatan aktivitas antiinflamasi.
ABSTRACT
Extract Salam Leaf (Eugenia polyantha Wight) contains polyfenol flavonoid more than 0,40%. Flavonoid in plants can be used as anti-inflammation. This research aimed to observe the anti-inflammation effect from ethanolic extract of Salam Leaf (Eugenia polyantha Wight) cream on carrageenan-induced edema in female rats, and to observe the effect of penetration enhancer (peppermint oil) in cream for increasing the anti-inflammation activity.
The research was conducted with pure experimental using the completely randomized design with direct pattern. The rats were grouped into negative-controlled group, cream and Biocream® base group, cream and Biocream® with peppermint oil group, cream and Biocream® extract Salam Leaf, cream and Biocream® extract Salam Leaf with peppermint oil, and positive controlled Voltaren® emulgel. The edema was measured by Calliper Digital method at 4th and 24th hours.. The data analysis was done using R 3.0.1.
The result of this experiment showed that extract of Salam Leaf cream has good stability on formula extract cream and extract cream with peppermint oil. Biocream extract formula has lower activity compare with positive control, while Biocream with extract and peppermint, cream with extract, and cream with extract and peppermint has an equal activity with control positive at 24th hours. The addition of peppermint oil as penetration enhancer has no effect on the increase of anti-inflammatory activity.
BAB I PENGANTAR
A. Latar Belakang
Inflamasi merupakan mekanisme normal pertahanan tubuh. Setiap orang pasti pernah mengalami inflamasi. Inflamasi bukan merupakan suatu penyakit, melainkan suatu pembentukan keadaan yang membantu netralisasi, penghancuran jaringan nekrosis, yang dibutuhkan pada proses penyembuhan (Price dan Wilson, 1995). Tetapi karena dipandang dapat merugikan maka inflamasi tetap membutuhkan pengatasan dan pengendalian (Tjay dan Rahardja, 2002).
dari obat ini yaitu berupa gangguan gastrointestinal seperti mual, muntah, diare, dispepsia, kembung; sakit kepala, dan ruam kulit (Anonim, 2009).
Pengobatan inflamasi secara topikal lebih dipilih karena dapat meminimalkan terjadinya efek samping seperti halnya yang ditimbulkan pada penggunaan obat inflamasi secara oral. Hal ini dibuktikan dari penelitian Schuelert, Russell dan McDougall, (2011) dimana konsentrasi obat-obat antiinflamasi non steroid topikal yang masuk ke dalam jaringan sistemik, jumlahnya 17 kali lebih rendah dibandingkan dengan penggunaan oral. Keuntungan lain dari penggunaan obat inflamasi secara topikal dibandingkan dengan oral, yaitu tidak melewati hepatic first pass metabolism, mudah penggunaannya, mudah untuk penghentian pengobatan jika dikehendaki, serta meningkatkan kepatuhan penggunaan (Moody,2010).
Daun salam (Syzygium polyanthum Wight.) dikenal masyarakat sebagai bumbu masak (penyedap makanan). Selain itu salam juga bisa digunakan sebagai obat tradisional yaitu antidiare, antidiabetik, pencernaann, serta lemah lambung
Krim adalah bentuk sediaan setengah padat mengandung satu atau lebih bahan obat terlarut atau terdispersi dalam bahan dasar yang sesuai (Depkes RI, 1995). Krim terbentuk dari hasil emulsifikasi antara fase minyak dan fase air dengan bantuan emulsifying agent (Allen, 2002).
Dalam penelitian ini dibuat sediaan krim tipe (M/A) di mana fase pendispersinya air dan fase terdispersinya minyak. Penggunaan krim dipilih karena mempunyai banyak kelebihan, antara lain mudah dioleskan, mudah menyebar, mempunyai daya penetrasi tinggi, member kelembaban kulit, mudah dibersihkan, mudah dicuci dengan air (Mitsui, 1997).
Biocream® mengandung Aerosil®, paraffin liquidum, vaselin album, cetostearol, sorbimacrogol palmit 300, monostearin, Myglycol® 812, asam sorbit, propilenglikol, deionized water. Biocream® adalah sistem emulsi yang stabil dengan distribusi lemak dan air yang merata (ambifilik). Biocream® biasa digunakan sebagai bahan pengencer untuk berbagai zat aktif untuk pengobatan kulit.
meningkatkan penetrasi obat yang bersifat hidrofilik pada konsentrasi terendah 0,1%(v/v). Hal ini menunjukkan bahwa peppermint oil dapat digunakan sebagai penetration enhancer (Fox, Gerber, Plessis, dan Hamman, 2011).
1. Perumusan masalah
Berdasarkan latar belakang di atas maka permasalahan yang diangkat dalam penelitian ini adalah :
a. Apakah ekstrak daun salam dapat dibuat sediaan topikal dan memenuhi kriteria sebagai sediaan krim dan Biocream® ?
b. Apakah sediaan krim ekstrak daun salam dan Biocream® ekstrak daun salam dapat mempunyai efek antiinflamasi ?
c. Apakah penambahan penetration enhancer dalam sediaan krim dan Biocream® berpengaruh pada aktivitas antiinflamasi pada sediaan krim ekstrak daun salam ?
2. Keaslian penelitian
Adapun penelitian terkait tentang daun salam (Eugenia polyantha Wight.) yang pernah dilakukan yaitu :
1. Pengaruh pemberian Ekstrak daun salam (Eugenia polyantha) Terhadap Kadar LDL Kolesterol Serum Tikus Jantan Galur Wistar Hiperlipidemia.
1. Efek Antiinflamasi Infusa Bunga Telang (Clitoria ternatea L.) Pada Udema Telapak Kaki Mencit Betina Terinduksi Karagenin Dengan Pengukuran Jangka Sorong (Manurung, 2013). Dalam penelitian tersebut dilakukan pengukuran persentase reduksi udema kaki tikus dengan menggunakan metode jangka sorong.
Adapun penelitian terkait tentang pembuatan formulasi krim yang pernah dilakukan yaitu :
1. Pengaruh Tween 80 Sebagai Surfaktan dan PEG 6000 Sebagai Basis Terhadap Sifat Fisis dan Stabilitas Krim Ekstrak Etil Asetat Tomat dengan Desain Faktorial (Mantyas, 2014) Dalam penelitian tersebut dilakukan pengukuran stabilitas dengan cara mengukur % pergeseran viskositas.
Sejauh pengetahuan peneliti, penelitian mengenai Formulasi sediaan cream ekstrak etanolik daun salam dengan pengujian aktivitasnya sebagai antiinflamasi belum pernah dilakukan.
3. Manfaat penelitian
Penelitian ini dapat memberikan manfaat teoretis maupun manfaat praktis :
a. Manfaat teoretis : memberikan informasi yang dapat dijadikan acuan untuk penelitian berikutnya berkaitan dengan efektivitas dari daun salam.
B. Tujuan Penelitian Tujuan dari penelitian ini adalah :
1. Tujuan umum :
Tujuan umum penelitian ini adalah untuk menghasilkan sediaan topikal krim ekstrak daun salam sebagai obat anti inflamasi.
2. Tujuan khusus :
Tujuan khusus penelitian ini adalah sebagai berikut :
a. Untuk mengetahui apakah ekstrak daun salam dapat dibentuk menjadi suatu sediaan krim dan Biocream® yang memenuhi kriteria sebagai sediaan yang baik.
b. Untuk mengetahui aktivitas antiinflamasi sediaan krim dan Biocream® ekstrak daun salam sebagai obat anti inflamasi
c. Untuk mengetahui apakah peppermint oil dapat digunakan sebagai penetration enhancer yang dapat membantu meningkatkan aktivitas antiinflamasi pada
BAB II
PENELAAHAN PUSTAKA
A. Inflamasi 1. Definisi
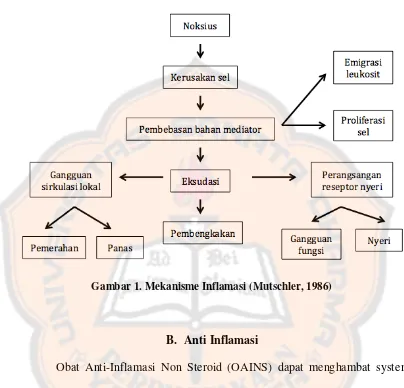
Inflamasi adalah suatu reaksi protektif setempat yang timbul karena adanya cedera atau kerusakan jaringan tubuh karena suatu rangsangan yang berfungsi merusak, mengurangi, baik agen pencedera maupun jaringan yang cedera (Mutscler, 1986). Inflamasi adalah usaha dari tubuh untuk menginaktivasi atau merusak organisme yang menyerang, menghilangkan zat iritan, dan mengatur derajat perbaikan jaringan (Mycek, Harvey, dan Champe, 1997).
2. Gejala
Gejala inflamasi yang dapat diamati adalah kemerahan (rubor), panas meningkat (calor), pembengkakan (tumor), nyeri (dolor), dan gangguan fungsi (fungsio laesa) (Mutschler, 1986).
Rubor merupakan hal pertama yang terlihat di daerah yang mengalami
Calor atau panas, terjadi secara bersamaan dengan rubor pada reaksi peradangan akut. Daerah peradangan pada kulit lebih panas sebab darah yang disalurkan ke permukaan tubuh yang terkena innfeksi lebih banyak daripada yang disalurkan ke daerah normal (Price dan Wilson, 1995).
Tumor atau pembengkakan merupakan tahap kedua dari inflamasi yang disebabkan oleh adanya pengiriman cairan serta sel-sel dari sirkulasi darah ke jaringan radang. Cairan serta sel-sel yang tertimbun di daerah peradangan disebut eksudat. Pada kejadian awal peradangan, cairan eksudat biasanya berisi cairan plasma yang kemudian diikuti oleh hilangnya sel darah putih dari aliran darah dan kemudian terimbun sebagai bagian dari eksudat (Wilmana, 1995, Price dan Wilson, 1995).
Dolor atau rasa sakit dari reaksi peradangan dapat disebabkan oleh beberapa factor. Diantaranya adalah perubahan pH lokal atau konsentrasi lokal ion-ion tertentu dapat merangsang ujung-ujung syaraf. Selain itu, edema yang terjadi mengakibatkan peningkatan tekanan lokal yang dapat menimbulkan rasa sakit (Price dan Wilson, 1995). Mediator-mediator kimiawi seperti baradikinin, prostaglandin, dan serotonin diketahui juga dapat mengakibatkan rasa sakit (Underwood, 1999).
3. Mekanisme
Gambar 1. Mekanisme Inflamasi (Mutschler, 1986)
B. Anti Inflamasi
deaktivasi oleh enzim pencernaan (Babb, 1992). (Fitzgerald et al., 2001). (Gunani, 2009).
Berdasarkan pada selektifitasnya terhadap COX, OAINS dibagi menjadi beberapa golongan :
a. Inhibitor COX non selektif, contoh :indometasin, aspirin, diklofenak, piroksikam, naproxen, ibuprofen dan asam mefenamat.
b. Inhibitor selektif COX-2, contoh : nimesulid, meloksikam, nabumeton dan aseklofenak (Ignatius, Zarangga, dan Ernest, 2007).
c. Inhibitor sangat selektif COX-2, contoh : celecoxib, refocoxib, valdecoxib, etoricoxib dan lumiracoxib (Derle, Gujar, dan Sagar, 2006).
C. Natrium Diklofenak
Natrium diklofenak merupakan suatu anti radang non steroid (Non steroid anti-inflamatory drugs, NSAIDs) yang merupakan suatu turunan asam
D. Voltaren ®
Gambar 2. Voltaren® (Novartis, 2011)
Voltaren Emulgel ® mengandung dietilamin diklofenak di mana tiap 11,6 mg dietilamin diklofenak setara dengan 10 mg natrium diklofenak. Voltaren Emulgel ® juga mengandung dietilamin, polimer asam akrilik, cetomacrogol 1000, isopropyl alcohol, paraffin cair, parfum, propilrn glikol, dan air. Basis dari Voltaren Emulgel® adalah gel emulsi minyak dalam air (MIMS, 2014).
E. Tumbuhan Salam 1. Nama dan habitat
Salam (Eugenia polyantha Wight) mempunyai sinonim Syzygium polyantha (Wight) Walp dan Eugenia Iucidula Miq. Di Aceh salam biasa disebut
2. Klasifikasi
Divisi : Spermatophyta Anak divisi : Angiospermae Kelas : Dycotyledoneae Bangsa : Myrtales
Suku : Myrtaceae Marga : Eugenia
Jenis : Eugenia polyantha Wight
(Backer and Bakhuizen Van den Brink, 1965 ; Van Stennis, 1975; Tjitrosoepomo, 1991)
3. Morfologi
4. Kandungan kimia
Daun salam mengandung saponin, flavonoid, minyak atsiri, alkaloid, dan polifenol. Kulit batangnya mengandung saponin dan tanin (Syamsuhidayat dan Hutapea, 1991). Flavonoid total yang terkandung dari ekstrak kental daun salam tidak kurang dari 0,40% dihitung sebagai kuersetin (Dirjen POM, 2013).
F. Flavonoid
Flavonoid merupakan senyawa metabolit sekunder yang banyak terdapat pada tumbuh-tumbuhan. Kandungan senyawa flavonoid di dalam tumbuhan sangat rendah, yaitu sekitar 0,25% dan secara umum terikat atau terkonjugasi dengan senyawa gula membentuk glikosida (Robinson, 1995). Khusus pada divisi Angiospermae yang lazim dijumpai adalah flavon dan flavonol, C-glikosida dan 0-glikosida, disamping isoflavon dan flavonon (Markham, 1998).
Flavonoid merupakan senyawa polar, maka umumnya flavonoid cukup larut dalam pelarut polar seperti etanol, methanol, butanol dan aseton. Adanya gula yang terikat pada flavonoid cenderung menyebabkan flavonoid lebih mudah larut dalam air dan dengan demikian campuran pelarut di atas merupakan pelarut yang lebih baik untuk glikosida (Markham, 1998).
sebagai antioksidan kuat, melindungi diri dari serangan oksidatif dan radikal bebas. Flavonoid dapat bekerja sebagai inhibitor lipooksigenase yang berperan dalam produksi mediator inflamasi yaitu leukotrien sehingga proses peradangan dapat terhambat (Robinson, 1995).
G. Maserasi
Maserasi merupakan cara penyarian sederhana, dilakukan dengan merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandunng zat aktif. Zat aktif akan larut, dan karena adanya perbedaaan konsentrasi antara larutan zat aktif di dalam sel dan luar sel maka larutan yang terpekat didesak keluar. Peristiwa ini berulang sehingga terjadi keseimbangan konsentrasi antar larutan diluar dan didalam sel. Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif mudah larut dalam cairan penyari. Cairan penyari yang digunakan dapat berupa air, etanol, etanol-air, atau pelarut lainya (Anonim, 1986).
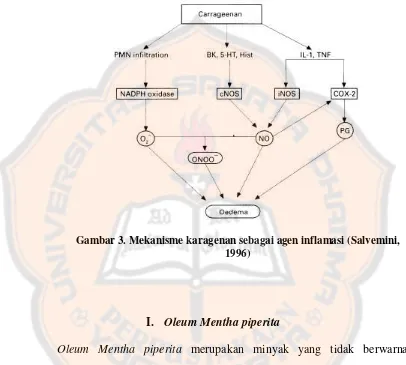
H. Karagenin
antiinflamasi dibandingkan dengan senyawa iritan lainya (Morris,2003), (Siswanto dan Nurlita, 2005).
Gambar 3. Mekanisme karagenan sebagai agen inflamasi (Salvemini, 1996)
I. Oleum Mentha piperita
Oleum Mentha piperita merupakan minyak yang tidak berwarna, kekuningan, atau kehijauan-kuning cair, menjadi lebih gelap dan tebal oleh usia dan paparan udara, memiliki bau khas aromatik pepermint, sangat aromatik, tajam rasa, dan diikuti oleh sensasi dingin saat udara ditarik ke mulut. Kandungan utama dari Oleum mentha piperita adalah menthol (30-55%), atau dapat disebut juga stearopten mint, atau kamper mint (Alankar, 2009).
mempunyai karakteristik yaitu tidak toksik, tidak mengiritasi, tidak berbau, tidak berasa, tidak berwarna (Sinha dan Kaur, 2000). Menurut Fox, Gerber, Plessis dan Hamman (2011), Peppermint oil dapat meningkatkan penetrasi obat yang bersifat hidrofilik pada konsentrasi terendah 0,1%(v/v).
J. Krim
Krim merupakan suatu sediaan berbentuk setengah padat yang mengandung satu atau lebih bahan terdispersi dalam bahan dasar yang sesuai (Dirjen RI, 1995). Terdapat dua tipe krim sederhana, yaitu tipe air dalam minyak (A/M) dan tipe minyak dalam air (M/A). Tipe air dalam minyak (A/M) tidak larut dalam air dan tidak dapat dicuci dengan air, sedangkan tipe minyak dalam air (M/A) dapat bercampur dan dapat dicuci dengan air, serta tidak berminyak (Allen, 1999). Evaluasi krim dapat meliputi uji organoleptis, uji daya lekat, dan uji daya sebar (Banker dan Rhodes, 1990).
Krim digunakan sebagai :
a. Bahan pembawa obat untuk pengobatan kulit b. Bahan pelembut kulit
K. Landasan Teori
Inflamasi terjadi karena adanya reaksi antara jaringan ikat pembuluh dengan pengaruh-pengaruh yang merusak (noksi) baik kimia, fisika, maupun infeksi organisme. Rangsangan tersebut membuat adanya pembebasan mediator-mediator inflamasi yang meliputi : histamine, eicosanoid (prostaglandin, tromboksan, leukotrien), PAF (platelet activating factor), bradikinin, nitrit oksida, neuropeptida, dan cytokine (seperti interleukin, interferon, dll) (Rang, Dale, Ritter, and Moore, 2003)
Daun salam sangat berpotensi sebagai tanaman obat. Penapisan fitokimia yang dilakukan (Kusuma et al, 2011) menyebutkan bahwa ekstrak kasar daun salam tercatat memiliki kandungan senyawa flavonoid. Uji fitokimia menunjukkan bahwa flavonoid yang dikandung oleh daun salam berfungsi sebagai anti bakteri, anti oksidan dan anti inflamasi.
Flavonoid mampu menghambat enzim lipooksigenase sehingga pembentukan leukotrein yang dapat menyebabkan peradangan menjadi terhambat (Robinson, 1995). Flavonoid pada daun salam akan menghambat pelepasan TNF-α dan IL-6 yang merupakan mediator inflamasi sehingga tidak akan terjadi inflamasi (Lafuente, Guillamon, Vilares, 2009).
Oleum Mentha piperita merupakan minyak yang tidak berwarna, kekuningan, atau kehijauan-kuning cair, menjadi lebih gelap dan tebal oleh usia dan paparan udara, memiliki bau khas aromatik pepermint, sangat aromatik, tajam rasa, dan diikuti oleh sensasi dingin saat udara ditarik ke mulut. Kandungan utama dari Oleum mentha piperita adalah menthol (30-55%), atau dapat disebut juga stearopten mint, atau kamper mint (Alankar, 2009). Menurut Fox (2011), Peppermint oil sebagai penetration enhancer dapat memberikan efek pada integritas kulit sehingga zat aktif dapat masuk ke dalam jaringan kulit
L. Hipotesis
1. Sedian krim dan Biocream® ekstrak daun salam menunjukkan kualitas sifat fisik sediaan yang baik
2. Sediaan krim dan Biocream® ekstrak daun salam memiliki aktivitas sebagai antiinflamasi.
BAB III
METODE PENELITIAN A. Jenis dan Rancangan Penelitian
Formulasi sediaan cream ekstrak etanolik daun salam (Syzgium polyantha Wight.) dengan pengujian aktivitasnya sebagai antiinflamasi ini
merupakan penelitian eksperimental murni dengan rancangan acak pola searah.
B. Variabel Penelitian dan Definisi Operasional a. Variabel bebas
Variabel bebas dalam penelitian ini adalah jenis sediaan yaitu basis krim (krim M/A dan Biocream®)dan konsentrasi peppermint oil. b. Variabel tergantung
Dalam hal ini yang menjadi variabel tergantung antara lain: 1) Sifat fisik sediaan krim : daya sebar, viskositas
2) Stabilitas sediaan : pergeseran viskositas 3) % reduksi edema
c. Variabel terkendali dan variabel tak terkendali
Variabel terkendali adalah variabel yang berpengaruh tetapi dapat dikendalikan, dalam hal ini yang menjadi variabel terkendali antara lain : Jenis tikus, Berat badan tikus, umur tikus, jenis kelamin tikus, kecepatan pengadukan, suhu pemanasan.
d. Definisi Operasional Variabel
1. Ekstrak daun salam adalah ekstrak kental yang didapatkan dari serbuk daun salam yang diekstrak dengan etanol 70% sebagai pelarut dengan metode maserasi.
2. Krim ekstrak daun salam adalah sediaan semisolid yang mengandung ekstrak daun salam dengan konsentrasi 10% yang dimaksudkan untuk pemakaian luar atau pada kulit (topikal) yang dibuat sesuai dengan formula dan cara kerja pada penelitian ini.
3. Jenis sediaan pada penelitian ini adalah basis krim dimana terdiri dari basis krim M/A dan basis Biocream®.
4. Biocream® ekstrak daun salam adalah basis krim yang berasal dari Biocream® yang berfungsi sebagai bahan pengencer untuk berbagai zat aktif untuk pengobatan kulit yang mengandung ekstrak daun salam
5. Sifat fisik krim adalah parameter untuk mengetahui kualitas fisik dari sediaan krim M/A ekstrak daun salam dan Biocream® ekstrak daun salam dengan uji daya sebar dan viskositas.
6. Viskositas adalah tahanan dari suatu cairan untuk mengalir. Dalam penelitian ini, besarnya viskositas sampel yang baik berdasarkan viskositas standar yang diambil dari produk pasaran.
7. Daya sebar adalah kemampuan penyebaran krim pada kulit.
dapat dihitung dengan cara mengukur tebal telapak kaki kontrol dikurangi dengan tebal telapak kaki perlakuan lalu dibagi dengan tebal telapak kaki control dan dikalikan 100%.
C. Alat
Alat-alat yang digunakan dalam penelitian ini yaitu : Alat-alat gelas (beaker glass, pengaduk, gelas ukur dan labu ukur merk Pyrek), alat-atal pembuat ekstrak daun salam (Erlenmayer (Pyrek), orbital shaker (Optima), rotary evaporator (Buchi Labortechnik AG CH-9230), waterbath (Memmert), corong Butcher), neraca analitik, jangka sorong Digital Caliper “Wipro”.
D. Bahan
E. Formula
Tabel I. Formula standar krim menurut penelitian Revi, Yenti et al.,(2011) Formula
Tabel III. Formula krim ekstrak daun salam M/A dalam 25 g
F2 : Formula krim dengan konsentrasi peppermint 0,5%
F3 : Formula krim dengan konsentrasi ekstrak etanolik daun salam 10% F4 : Formula krim dengan konsentrasi ekstrak etanolik daun salam 10% dan
peppermint oil 0,5 %
Tabel IV. Formula Biocream®ekstrak daun salam M/A dalam 25 g Formula
F. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman dilakukan oleh Balai Besar Penelitian Dan Pengembangan Tanaman Obat Dan Obat Tradisional Tawangmanggu, Jawa Tengah.
2. Pengumpulan dan pembuatan serbuk simplisia
Daun salam yang digunakan pada penelitian ini berasal dari Balai Besar Penelitian Dan Pengembangan Tanaman Obat Dan Obat Tradisional Tawangmanggu. Digunakan alat penyerbuk mekanik yang berasal dari Laboratorium Farmakognosi Fitokimia Universitas Sanata Dharma, Yogyakarta. Serbuk yang didapat kemudian diayak dengan ayakan no.20 untuk membuat ukuranya menjadi homogen.
3. Standarisasi ekstrak
Standarisasi ekstrak dilakukan oleh Laboratorium Penelitian dan Pengembangan Terpadu Universitas Gadjah Mada Yogyakarta dimana untuk penetapan kadar air digunakan metode gravimetri seadangkan untuk penetapan kadar kuercetin digunakan metode KLT Densitometri.
4. Pembuatan ekstrak daun salam
evaporator untuk menguapkan etanol, dilakukan proses penguapan pelarut dengan waterbath dengan suhu 70o C, dilakukan pengovenan pada suhu 40o C untuk menghitung bobot tetap.
5. Formulasi krim
a. Pembuatan basis krim
Pembuatan basis krim dilakukan dengan cara : fase minyak (paraffin liquidum, asam stearat, adeps lanae,) dan fase air (nipagin, nipasol, TEA, dan
aquadest) masing-masing dipanaskan diatas waterbath pada suhu 60o-70o C sampai lebur. Fase air dan fase minyak dicampurkan sekaligus lalu di mixer dengan kecepatan 300 rpm sampai terbentuk massa basis krim yang homogen. Lalu masing-masing formula disimpan dalam wadah krim.
b. Pembuatan krim peppermint oil 0,5 %
c. Pembuatan krim ekstrak daun salam
Pembuatan krim ekstrak daun salam dilakukan dengan cara : fase minyak (paraffin liquidum, asam stearat, adeps lanae,) dan fase air (nipagin, nipasol, TEA, dan aquadest) masing-masing dipanaskan diatas waterbath pada suhu 60o-70o C sampai lebur. Fase air dan fase minyak dicampurkan sekaligus lalu di mixer dengan kecepatan 300 rpm sampai terbentuk massa basis krim yang homogen. Setelah terbentuk massa basis krim yang homogen, lalu ditambahkan ekstrak etanolik daun salam sebesar 10% ke dalam formula. Diaduk dengan kecepatan 300 rpm sampai homogen.
d. Pembuatan krim ekstrak daun salam dengan peppermint oil 0,5 % Pembuatan krim ekstrak daun salam dengan peppermint 0,5 % dilakukan dengan cara : fase minyak (paraffin liquidum, asam stearat, adeps lanae,) dan fase air (nipagin, nipasol, TEA, dan aquadest) masing-masing dipanaskan diatas waterbath pada suhu 60o-70o C sampai lebur. Fase air dan fase minyak dicampurkan sekaligus lalu di mixer dengan kecepatan 300 rpm sampai terbentuk massa basis krim yang homogen. Setelah terbentuk massa basis krim yang homogen, lalu ditambahkan ekstrak etanolik daun salam 10% dan peppermint oil sebanyak 0,5 %. Dicampur dengan mixer pada kecepatan 300
6. Modifikasi sediaan Biocream®
a. Pembuatan Biocream® peppermint oil 0,5%
Biocream® dikeluarkan dari sediaanya lalu ditambahkan peppermint oil 0,5 %. Dicampur dengan menggunakan mixer dengan kecepatan 300 rpm sampai homogen.
b. Pembuatan Biocream® ekstrak daun salam
Biocream® dikeluarkan dari sediaanya lalu ditambahkan ekstrak daun salam 10 %. Dicampur dengan menggunakan mixer dengan kecepatan 300 rpm sampai homogen.
c. Pembuatan Biocream® ekstrak daun salam dengan peppermint oil 0,5%.
Biocream® dikeluarkan dari sediaanya lalu ditambahkan ekstrak daun salam 10 % dan peppermint oil 0,5 %. Dicampur dengan menggunakan mixer dengan kecepatan 300 rpm sampai homogen.
7. Uji sifat fisik krim
a. Uji organoleptis dan pH. Dicatat bentuk, warna, dan bau dari krim yang terbentuk, kemudian dilakukan pengecekan pH krim menggunakan indikator pH universal.
penyebaranya (Grag, Anggrawal, Garg, dan Singla, 2002). Pengujian dilakukan 48 jam setelah pembuatan sediaan krim.
c. Uji viskositas krim. Sebanyak 25 g krim dimasukkan perlahan-lahan ke dalam wadah dan dipasang pada viscotester Rion VT-O4. Viscotester dinyalakan dan nilai viskositas sediaan diperoleh dengan mengamati gerakan jarum petunjuk pada viscotester setelah jarum stabil. Pengujian dilakukan 48 jam setelah pembuatan sediaan krim dan setelah penyimpanan selama 1 bulan (Hariyadi, Purwanti, dan Soeratri, 2005).
8. Uji aktivitas anti inflamasi sediaan krim ekstrak daun salam a. Penyiapan hewan uji
Hewan uji yang digunakan dalam penelitian ini adalah tikus betina, galur Swiss, usia 2-3 bulan, dengan berat badan 120-150 gram. Kelompok perlakuan terdiri dari kontrol positif Voltaren®, kontrol negatif, basis krim, krim peppermint oil 0,5%, krim ekstrak daun salam, krim ekstrak daun salam dengan pepermint oil 0,5% serta basis Biocream®, Biocream® pepermint oil 0,5%, Biocream® ekstrak daun salam dan Biocream® ekstrak daun salam dengan peppermint oil 0,5%, masing-masing diuji dengan 6 kali replikasi.
b. Pembuatan suspensi karagenin
dalam labu takar 100 ml, sehingga diperoleh konsentrasi karagenin 1% (b/v).
c. Uji aktivitas antiinflamasi sediaan krim ekstrak daun salam
Kaki belakang hewan uji diukur menggunakan jangka sorong sebelum diberi perlakuan karagenin 1%. Kemudian dilihat edema yang terjadi pada waktu setelah diberi karagenin 1%. Penurunan edema dilihat pada waktu ke 120 menit setelah penyuntikan karegenin. Setelah itu diberi perlakuan krim ekstrak daun salam dan diamati penurunan pembengkakanya pada waktu ke 4 jam dan 24 jam. Dibandingkan dengan kelompok kontrol positif yaitu voltaren emulgel, kelompok kontrol negatif yaitu karagenin 1%, kelompok basis sediaan krim dan Biocream® serta kelompok perlakuan ekstrak daun salam .
d. Uji aktivitas antiinflamasi sediaan Biocream® ekstrak daun salam Kaki belakang hewan uji diukur menggunakan jangka sorong sebelum
9. Penentuan persen (%) reduksi inflamasi
Penentuan persen penghambatan inflamasi didapatkan dengan rumus : % reduksi =
10. Analisis hasil
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Bahan yang digunakan pada penelitian ini adalah daun salam yang diperoleh dari Balai Besar Penelitian Dan Pengembangan Tanaman Obat Dan Obat Tradisional Tawangmanggu. Determinasi tanaman dilakukan oleh Balai Besar Penelitian Dan Pengembangan Tanaman Obat Dan Obat Tradisional Tawangmanggu untuk memastikan bahwa bahan yang digunakan dalam penelitian ini adalah benar merupakan daun salam dengan nama ilmiah Eugenia polyantha Wight.
B. Hasil Standarisasi Ekstrak
Standarisasi ekstrak yang dilakukan pada penelitian ini meliputi penetapan kadar quercetin (flavonoid) dan pengujian kadar air ekstrak daun salam. Didapat kadar quercetin sebesar 0,81% dan kadar air sebesar 14,71%.
C. Hasil Uji Sifat Fisis dan Stabilitas Sediaan Krim Ekstrak Daun Salam Krim ekstrak daun salam yang dibuat kemudian diuji sifat fisis dan stabilitasnya. Uji sifat fisis yang dilakukan pada penelitian ini meliputi uji daya sebar dan uji viskositas. Uji daya sebar berhubungan dengan mudah atau tidaknya suatu sediaan untuk dapat menyebar dan merata di kulit, sedangkan uji viskositas berhubungan dengan kemampuan sediaan dalam mempertahankan matriks semisolid. Uji stabilitas sediaan yang dilakukan pada penelitian ini adalah dengan melihat pergeseran viskositas.
1. Uji Organoleptis dan Uji pH
Uji organoleptis meliputi pengamatan warna, bau serta homogenitas sediaan. Uji organoleptis penting terkait “acceptability” sediaan.
Tabel V. Hasil uji organoleptis dan uji pH krim ekstrak daun salam (48 jam) Kriteria Biocream®
Homogenitas Homogen Homogen Homogen Homogen
pH 6±0 6±0 6±0 6±0
Hasil uji pH pada tabel V menunjukkan adanya kesamaan antara setiap formula, di mana semua formula mempunyai pH 6. Kulit mempunyai pH antara 5-6. Pada pH 6, sediaan diharapkan tidak menimbulkan iritasi pada kulit (Heater and Adam, 2012). Dari hasil uji yang diperoleh dapat disimpulkan bahwa krim ekstrak daun salam yang dihasilkan diharapkan dapat diterima oleh konsumen dan tidak menimbulkan iritasi pada kulit.
2. Uji daya sebar dan uji viskositas
Tabel VI. Hasil uji daya sebar dan viskositas (x̅ ± SD) krim ekstrak daun salam setelah 48 jam
Formula Daya sebar (cm) Viskositas (d.Pa.s)
BE 3,90 ± 0,18 280 ± 30,0
BEP : Biocream® ekstrak dengan peppermint oil 0,5% KE : Krim ekstrak
KEP : Krim ekstrak dengan peppermint oil 0,5%
Daya sebar berpengaruh pada penyebaran krim sehingga mempengaruhi kenyamanan saat krim diaplikasikan ke kulit. Daya sebar bertanggung jawab kemudahan penggunaan, penghantaran obat, ekstrudabilitas dari kemasan dan kenyamanan serta penerimaan oleh pasien (Garg et al., 2002).
semakin kecil daya sebarnya. Range daya sebar yang ingin dicapai pada penelitian ini adalah 3-5 cm. Range tersebut didasarkan pada daya sebar dari sediaan Biocream® di mana pada penelitian ini Biocream® juga digunakan sebagai kontrol basis sediaan. Bedasarkan hasil daya sebar diatas maka dapat disimpulkan bahwa semua formula krim ekstrak daun salam memenuhi persyaratan daya sebar yang baik.
Viskositas merupakan parameter yang penting untuk mengetahui sifat fisis dari sediaan krim, di mana semakin besar nilai viskositas maka sediaan tersebut akan semakin kental. Menurut (Heather dan Adam, 2012) viskositas dapat mengindikasikan suatu perubahan fisis dari suatu sediaan. Viskositas suatu sediaan harus diatur sedemikian rupa agar dapat diterima oleh pasien. Untuk itu viskositas tidak boleh terlalu rendah (encer) dan tidak boleh terlalu tinggi (kental). Jika viskositas sediaan rendah (encer) maka sediaan akan mudah tumpah dan ketika diaplikasikan ke kulit maka daya lekat dari sediaan akan rendah sehingga akan menggangu dan menyebabkan ketidaknyamananan bagi pasien. Jika viskositas sediaan terlalu tinggi (kental) maka sediaan akan sulit mengalir pada saat dikeluarkan dari kemasan serta akan harus dibutuhkan energi yang lebih besar untuk pengaplikasianya ke kulit agar dapat merata. Hal tersebut dapat mengurangi penerimaan pasien terhadap suatu sediaan.
diasumsikan sediaan yang kita buat mempunyai stabilitas yang baik dan dapat diterima oleh pasien. Bedasarkan hasil uji viskositas diatas maka dapat disimpulkan bahwa semua formula krim ekstrak daun salam memenuhi persyaratan viskositas yang baik.
Pengukuran dan viskositas dilakukan 48 jam setelah pembuatan krim. Hal ini bertujuan agar krim yang dibuat sudah membentuk system yang stabil dalam artian sudah tidak terpengaruh oleh suhu ataupun proses pembuatan. Pengukuran viskositas dilakukan tiap minggu sampai minggu 4 waktu penyimpanan atau 28 hari waktu penyimpanan.
3. Stabilitas sediaan
Untuk melihat stabilitas fisis dari sediaan krim M/A dan Biocream® dalam penelitian ini dilakukan pengukuran pergeseran viskositas. Pergeseran viskositas dalam penelitian ini menggambarkan perubahan viskositas sediaan krim M/A dan Biocream® pada hari ke-2 setelah pembuatan dan selama masa penyimpanan hari ke 28. Semakin besar nilai pergeseran viskoisitas menunjukkan bahwa perubahan viskositas yang terjadi selama penyimpanan semakin besar.
Persentase pergeseran viskositas dapat dihitung dengan menggunakan rumus :
% pergeseran viskositas = Visk ositas hari ke−2 −Viskositas hari ke−28
Viskositas hari ke−2 x 100%
Tabel VII. Persentase pergeseran viskositas ( x̅ ± SD) krim ekstrak daun
Berdasarkan tabel VII, masing-masing formula mengalami pergeseran viskositas yang cukup besar. Hal ini menunjukkan bahwa modifikasi formula yang dilakukan oleh peneliti kurang reprodusibel. Pergeseran viskositas yang baik yaitu <15%. Dari hasil yang didapat ada 2 formula yang masuk kriteria yaitu formula KE dan KEP. Sedangkan formula BE dan BEP tidak memenuhi standar pergeseran viskositas yang diinginkan oleh peneliti.
D. Efek Antiinflamasi Krim Ekstrak Daun Salam
Penelitian Formulasi sediaan krim ekstrak etanolik daun salam (Syzgium polyantha Wight.) ini bertujuan untuk mengetahui kemampuan efek antiinflamasi
ekstrak daun salam dalam sediaan krim.
setelah diinjeksi karagenin 1% secara sublantar. Dilakukan kalibrasi terhadap jangka sorong yang digunakan untuk memastikan akurasi dan presisi alat tersebut. Pada penelitian kali ini, digunakan karagenin 1% sebagai agen penginduksi inflamasi. Digunakan karagenin karena karagenin dapat menginduksi suatu reaksi inflamasi yang bersifat akut, non-imun, bisa diamati dengan baik dan mempunyai reprodusibilitas yang tinggi. Keuntungan karagenin antara lain : tidak meninggalkan bekas, tidak menimbulkan kerusakan jaringan serta dapat memberikan respon yang lebih peka terhadap obat antiinflamasi dibandingkan dengan senyawa iritan lainya (Morris,2003), (Siswanto dan Nurlita, 2005). Urutan udema akibat karegenin pada telapak kaki tikus yaitu, histamine dan serotonin adalah mediator udem yang pertama, dilanjutkan oleh pelepasan kinin yang menyebabkan gangguan pembuluh darah dalam jaringan terinflamasi (Rainsford,1984). Diikuti pelepasan prostaglandin dan migrasi leukosit ke lokasi radang (Foye, 1981)
digunakan karagenan 1% tanpa perlakuan. Tujuanya adalah untuk melihat penurunan edema kaki tikus tanpa dipengaruhi oleh zat lain.
Dalam penelitian ini edema diukur pada waktu ke 2jam, 4jam, dan 24jam. Pengukuran tersebut didasarkan dari hasil orientasi dimana pengukuran 2 jam dimaksudkan untuk mengukur pembengkakan maksimal yang ditimbulkan oleh karagenin 1%. Pengukuran 2 jam juga digunakan sebagai control untuk menghitung % inhibisi. Pengukuran 4 dan 24 jam dimaksudkan untuk melihat penurunan edema setelah di beri perlakuan.
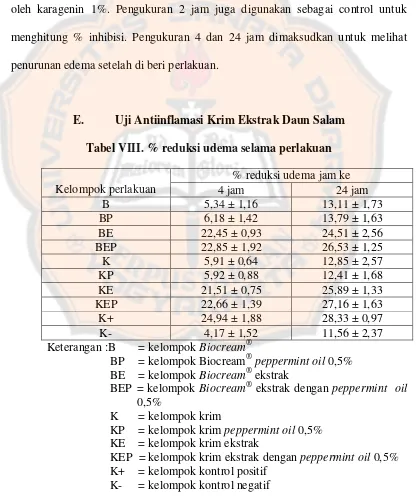
E. Uji Antiinflamasi Krim Ekstrak Daun Salam Tabel VIII. % reduksi udema selama perlakuan
Kelompok perlakuan
Keterangan :B = kelompok Biocream®
BP = kelompok Biocream® peppermint oil 0,5% BE = kelompok Biocream® ekstrak
BEP = kelompok Biocream® ekstrak dengan peppermint oil 0,5%
K = kelompok krim
KP = kelompok krim peppermint oil 0,5% KE = kelompok krim ekstrak
KEP = kelompok krim ekstrak dengan peppermint oil 0,5% K+ = kelompok kontrol positif
Dari tabel VIII di atas terlihat bahwa % inhibisi terbesar ditimbulkan pada kelompok kontrol positif, di mana terlihat % kenaikan inhibisi yang signifikan. Hal ini menunjukkan bahwa voltaren emulgel merupakan OAINS yang memang memiliki daya penghambatan inflamasi. % inhibisi terkecil ditimbulkan pada kelompok kontrol negatif yang hanya disuntik dengan karagenan tanpa perlakuan apa-apa. Penurunan edema yang terjadi kemungkinan disebabkan oleh respon dari tubuh hewan uji yang berupaya untuk memulihkan tubuh dari peradangan. Hal yang sama ditunjukkan oleh kelompok Biocream®, Biocream® peppermint, krim, dan krim peppermint yang hanya menghasilkan % inhibisi yang
kecil. Hal ini disebabkan karena Biocream®dan krim hanya basis yang berfungsi sebagai pembawa dan tidak mempunyai aktifitas sebagai antiinflamasi. Begitu pula dengan penambahan peppermint oil pada kedua sediaan tersebut juga tidak berpengaruh pada kenaikan % inhibisi. Hal ini menunjukkan bahwa peppermint oil tidak mempunyai aktivitas sebagai antiinflamasi. Hal yang berbeda
Tabel IX menunjukkan keberbedaan dari masing-masing kelompok sediaan pada jam ke-4. Dari tabel terlihat bahwa kontrol negatif mempunyai perbedaan yang tidak bermakna terkadap kelompok B, BP, K, dan KP. Hal ini menunjukkan bahwa keempat kelompok basis tersebut tidak mempunyai daya antiinflamasi.
Dari tabel IX tersebut terlihat bahwa kelompok kontrol negatif mempunyai perbedaan yang bermakna dengan kelompok kontrol positif, BE, BEP, KE, dan KEP. Hal ini ditunjukkan dengan nilai p-value < 0,05. Dapat disimpulkan bahwa kelompok kontrol positif, BE, BEP, KE, dan KEP mempunyai kemampuan untuk mereduksi udema pada kaki tikus yang telah diinduksi dengan karagenin 1% secara signifikan pada jam ke-4.
Dari tabel IX, terlihat bahwa kelompok kontrol positif mempunyai perbedaan yang tidak bermakna dengan kelompok BEP. Hal ini ditunjukkan dengan nilai p-value > 0,05. Dapat disimpulkan bahwa kelompok BEP mempunyai daya reduksi yang sama dengan kontrol positif secara statistik.
Tabel IX. Hasil uji statistik % reduksi udema pada jam ke-4
Keterangan : BB = Berbeda bermakna (p-value <0,05) BTB = Berbeda tidak bermakna (p-value >0,05) B = Kelompok Biocream®
KP = Kelompok krim peppermint oil 0,5% KE = Kelompok krim ekstrak
KEP = Klompok krim ekstrak dengan peppermint oil 0,5% K+ = Kelompok kontrol positif
K- = Kelompok kontrol negatif
udema pada kaki tikus yang telah diinduksi dengan karagenin 1% secara signifikan.
Dari tabel X, terlihat bahwa pada jam ke-24 kelompok BE mempunyai perbedaan yang bermakna dengan kontrol positif yang ditunjukkan dengan nilai p-value < 0,05. Dari hasil tersebut dapat disimpulkan bahwa kelompok BE mempunyai daya reduksi yang lebih kecil daripada kontrol positif.
Tabel X. Hasil uji statistic % reduksi udema pada jam ke-24
Keterangan : BB = Berbeda bermakna (p-value <0,05) BTB = Berbeda tidak bermakna (p-value >0,05) B = Kelompok Biocream®
KP = Kelompok krim peppermint oil 0,5% KE = Kelompok krim ekstrak
KEP = Klompok krim ekstrak dengan peppermint oil 0,5% K+ = Kelompok kontrol positif
K- = Kelompok kontrol negatif
Pengukuran kemampuan krim ekstrak daun salam sebagai antiinflamasi sebenarnya bukan hanya dapat dilakukan dalam waktu 4 dan 24 saja, melainkan dapat dilihat dengan pengukuran edema pada rentang waktu 4 sampai 24 dimana dengan melakukan pengukuran yang lebih intensif misalnya dilakukan tiap jam dalam rentang waktu tersebut maka akan dapat diperoleh profil penurunan udema yang terjadi pada setiap jamnya
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Sediaan krim ekstrak daun salam memenuhi syarat viskositas yang baik pada formula krim ekstrak dan krim ekstrak peppermint, sedangkan untuk formula biocream ekstrak dan biocream ekstrak peppermint tidak memenuhi kriteria sebagai sediaan krim yang baik karena tidak memenuhi standar stabilitas yang ditentukan.
2. Sediaan krim dan Biocream® ekstrak daun salam mempunyai aktivitas sebagai antiinflamasi.
3. Penambahan peppermint oil sebagai penetration enhancer tidak berpengaruh terhadap peningkatan aktivitas antiinflamasi sediaan krim dan Biocream® ekstrak daun salam.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut tentang pengujian antiinflamasi ekstrak daun salam menggunakan metode pengukuran lain yang lebih objektif.
2. Perlu dilakukan penelitian lebih lanjut untuk mendapatkan tampilan sediaan krim ekstrak daun salam yang lebih baik.
DAFTAR PUSTAKA
Aiache, 1993, Farmasetika 2: Biofarmasi, terjemahan Widji Soeratri, Airlangga University Press, Surabaya. pp. 156-177
Alankar, S., 2009, A Review on Peppermint Oil, Asian Journal of Pharmaceutical and Clinical Research,Vol.2, pp. 27-33.
Allen, L.V., 1999, Compounding Creams and Lotions, International Journal of Pharmaceutical Compounding, 3, 111-115.
Allen, V.L., 2002, The Art, Science, and Technology of Pharmaceutical Compounding, 2nd ed, American Pharmaceutical Association, Washington D.C., USA, pp. 276, 285.
Anief, M., 1997, Ilmu Meracik Obat, Gadjah Mada University Press, Yogyakarta, pp. 7.
Anonim, 1986, Sediaan Galenik, Departemen Kesehatan RI, Jakarta, pp. 4-11. Anonim, 2009, MIMS Indonesia Petunjuk Konsultasi, Edisi 9, PT Medidata Indonesia, Jakarta Selatan, pp. 136.
Aulton, M.E., 2002, Pharmaceutics : The Science of Dosage Form Design, 2nd Edition, Churchill Livingstone, New York, pp. 530.
Babb, R. R, 1992, Gastrointestinal Complications of Nonsteroidal Anti-Imflammatory Drugs, West J Med, pp. 157, 444-447.
Backer, C.A., & Bakhuizen Van Den Brink, R.C., 1965, Flora of Java, volume II, N.V.P, Noordhoff, Groningen, The Netherlands, pp. 171-172, 178.
Badan Pengawasan Obat dan Makanan, 2004, Monografi Ekstrak Tumbuhan Obat Indonesia Vol 1, Jakarta : BPOM.
Banker, G. S. and C. T. Rhodes, 1990, Modern Pharmaceutics, 2ndEd., Marcell Dekker Inc., New York, pp. 264, 302.
Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995, Farmakope Indonesia, Edisi 4, Departemen Kesehatan RI, Jakarta, pp.6.
Departemen Kesehatan Republik Indonesia, 1986, Sediaan Galenik, Departemen Kesehatan Republik Indonesia, Jakarta, pp. 5-26.
Fitzgerald, G. A., and Patrono, C., 2001, The Coxibs, Selective Inhibitors of Cyclooxygenase-2, N Engl. J. Med., Vol.345, pp. 6.
Fox, L.T., Gerber, M., Du Plessis, J., and Hamman, J.H., 2011, Transdermal Drug Delivery Enhancement by Compounds of Natural Origin, Molecules, Volume 16, pp. 10508, 10515-10516.
Foye, W.O., 1981, Prinsip–Prinsip Kimia Medisinal, diterjemahkan oleh Rasyid, R., Firman, K., Dh., Haryanto, Suwarno, T., Musadad, A., edisi pertama, Gadjah Mada University Press, Yogyakarta, pp.1097.
Grag, A., Anggrawal, D., Garg, S., dan Singla, A.K., 2002, Spreading of Semisolid Formulations: An Update, Pharmaceutical Technology, September 2002, pp. 449-450.
Gunani, S. B., 2009, Uji Daya Antiinflamasi Krim Tipe A/M Ekstrak Etanolik Jahe 10% (Zingiber officinale Roscoe) yang Diberikan Topikal Terhadap Udem Kaki Tikus yang Diinduksi Karagenin, Laporan Penelitian, Surakarta.
Hariyadi, D.M., Purwanti, T., dan Soeratri, W., 2005, Korelasi Kadar Propilenglikol dalam dan Pelepasan Dietilammonium Diklofenak dari Gel Carbopol 940, Majalah Farmasi Airlangga, 5 (1), 1-6.
Heater, A.E., dan Adam C.W., 2012, Transdermal and Topical Drug Delivery: Principles and Practice, A John Wiley & SONS, Inc., New Jersey, pp.281.
Ignatius, G.E., Zarraga, M.D., dan Ernest, R.S., 2007, Coxibs and Heart Disease, J. American Col. Of Cardio., pp. 1-14.
Katzung, B.G, 2002, Basic and Clinical Pharmakology, 8th edition, diterjemahkan oleh bagian Farmakologi, Fakultas Kedokteran, Universitas Airlangga, Farmakologi Dasar dan Klinik, Penerbit Salemba Medika, Jakarta, pp. 449-462.
Lafuente, A. G., Guillamon, E., Villares, A., 2009, Flavonoid as anti-inflammatory agents : implications in cancer and cardiovascular disease, Inflammation Research, pp. 537-542.
Manurung, D.Y., 2013, Efek Antiinflamasi Infusa Bunga Telang (Clitoria ternateae L.) Pada Udema Telapak Kaki Mencit Betina Terinduksi Karagenin Dengan Pengukuran Jangka Sorong, Skripsi, Universitas Sanata Dharma Yogyakarta.
Mantyas. E. 2014, Pengaruh Tween 80 Sebagai Surfaktan dan PEG 6000 Sebagai Basis Terhadap Sifat Fisis dan Stabilitas Krim Ekstrak Etil Asetat Tomat dengan Desain Faktorial, Skripsi, Universitas Sanata Dharma Yogyakarta. Markham, K.R., 1998, The Techniques of Flavonoid Identification, diterjemahkan
oleh Kosasih Padmawinata, Cara Mengidentifakasi Flavonoid, ITB Bandung, pp.1-34.
Martina, L.T., 2008, Pengaruh pemberian Ekstrak daun salam (Eugenia polyantha) Terhadap Kadar LDL Kolesterol Serum Tikus Jantan Galur Wistar Hiperlipidemia, Artikel Ilmiah, Universitas Diponegoro, Semarang. MIMS, 2014, MIMS Indonesia, http://www.mims.com/
Indonesia/drug/info/Voltaren%20Emulgel/?type=full#SpecialPrecautions, diakses tanggal 1 Juni 2014
Mitsui, T., 1997, New Cosmetic Science, Elsevier Science, Amsterdam, pp. 346. Morris, C.J., Carragenin Induced Paw Edema in The Rat an Mouse Inflamation
Protocols, Methods in Molecular Biology, Vol.2, pp.115-122.
Mutschler, E., 1986, Arzneimittelwirkungen, diterjemahkan oleh M. B, Widianto, A, S., Ranti, edisi V, Penerbit ITB, Bandung, pp.17-20.
Mycek, M.J., Harvey, R.A., Champe, P.C., 1997, Pharmacology, 2nd edition, diterjemahkan oleh Azwar Agus, Farmakologi : ulasan bergambar, Penerbit Widya Medika, Jakarta, pp. 404.
Necas, J., Bartosikova, L., 2013, Carragenan : a review, Veterinarni Medicina 58, pp. 187-205.
Novartis, 2011, Voltaren Emulgel The Joy of Movement, http://www.voltaren.ca/voltaren, diakses tanggal 1 Juni 2014.
Rang, H.P., Dale, M.M., Ritter, J.M., and Moore, P.K., 2003, Pharmacology, 5th Edition, Bath Press, London, pp. 217-240, 244-250.
Rainford, 1984, Aspirin and The Salicylates, Butterworths, London, pp.15-17. Robinson, T., 1995, The Organic Constituent of Higher Plants, diterjemahkan
oleh Kosasih Padmawinata, Kandungan Kimia Organik Tumbuhan Tinggi, Edisi IV, ITB Bandung, pp.154-155, 191-216.
Rowe, R. C., Sheskey, P. J., Quinn, M. E, 2009, Handbook of Pharmaceutical Excipients, 6th Edition, Pharmaceutical Press, USA, pp.517-521, 549-553, 592, 697.
Salvemini, D., Wang, Z., Wyatt, P.S., Bourdon, D.M., Marino, M.H., Manning, P.T., et all., 1996, Nitric Oxide: A Key Mediator in The Early and Late Phase of Carrageenan-Induced Rat Paw Inflammation, British Journal Of Pharmacology, pp. 829-838,
Schror, K. and Meyer-Kirchrath, J., 2000, Cyclooxygenase-2 Inhibition and Side-effects to non-steroidal Anti-inflammatory Drugs in the Gastrointestinal Tract, Curr. Med. Chem, pp. 7, 1121-1129.
Schuelert, N., Russell, F.A., McDougall, J.J., 2011, Topical Diclofenac in The Treatment of Osteoarthritis of The Knee, Orthopedic Research and Reviews, Volume 3, pp. 2-4.
Sinha, V.R, Kaur, M.P., 2000, Permeation Enhancer for Transdermal Drug Delivery, Journal of Drug Development and Industrial Pharmacy, India, pp.1131-1140.
Siswanto, A., dan Nurulita N.A., 2005. Daya Antiinflamasi Infus Daun Mahkota Dewa (Phaleria macrocarpa Scheff. Boerl) pada Tikus putih (Rattus norvegicus) Jantan, Prossiding Seminar Nasional TOI XXVII, Batu, pp.177-181.
Syamsuhidayat dan Hutapea, JR, 1991, Inventaris Tanaman Obat Indonesia, Badan Litbangkes, Depkes RI, Jakarta.
Tjay, T.H., dan Rahardja, K., 2002, Obat-Obat Penting : Khasiat Penggunaan dan Efek-Efek Sampingnya, edisi V, Penerbit P.T. Elex Media Komputindo Kelompok Gramedia, Jakarta, pp. 308-315.
Underwood, J.C.E., 1999, General and Systematic Pathology, diterjemahkan oleh Sarjadi, Edisi 2, Vol 1, Penerbit EGC, Jakarta, pp.232-234.
USP, 1995, The United State Pharmacopeia: The National Formulary, USPC Inc., United State of America, pp. 12250.
Van Steenis, 1975, Flora, Pradnya Paramita, Jakarta, pp. 43
Widyastuti, S., 2000, Daya Antibakteri Minyak Atsiri Daun Salam (Eugenia polyanthum Wight) Terhadap Bakteri Shigella dysenteriae, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Williamson, E, M., Okpako, D, T., dan Evans, F, J., 1996, Selection, Preparation, and Pharmacologycaly Evaluation of Plants Material, Vol I, John Willey and Sons, New York, pp. 134-135.
Wilmana, P, F., 1995, Analgesik Antiinflamasi Nonsteroid dan Obat Pirai dalam Ganiswara, S, O., Farmakologi dan Terapi, Edisi IV, Bagian Farmakologi, Fakultas Kedokteran Universitas Indonesia, Jakarta.
LAMPIRAN
Lampiran 4. Dokumentasi
Uji daya sebar Ekstrak daun salam
Formula K rep I Formula K rep II Formula K rep III
Formula KP rep I Formula KP rep II Formula KP rep III
Formula B rep I Formula B rep I Formula B rep I
Formula BP rep I Formula BP rep II Formula BP rep III
Formula BE rep I Formula BE rep II Formula BE rep III
4. Pergeseran Viskositas (%)
Pergeseran viskositas didapatkan dari rumas :
% pergeseran viskositas =Viskositas hari ke−2−Viskositas hari ke−28
Viskositas hari ke−2 x 100%
a. Formula BE
Replikasi Viskositas (d.Pa.s) Pergeseran viskositas 48 jam 28 hari
Replikasi Viskositas (d.Pa.s) Pergeseran viskositas 48 jam 28 hari
Replikasi Viskositas (d.Pa.s) Pergeseran viskositas 48 jam 28 hari
Replikasi Viskositas (d.Pa.s) Pergeseran viskositas 48 jam 28 hari
1 240 220 8.333333333
2 250 200 20
3 230 210 8.695652174
Lampiran 7. Hasil Analisis Aktivitas Antiinflamasi Menggunakan Software R 3.0.1
1. Uji Normalitas Data
a. Inhibisi 4 jam
kontrol.. kontrol...1 krim krim.peppermint krim.ekstrak krim.pepermint.ekstrak
> shapiro.test(indra$negatif)
Shapiro-Wilk normality test
data: indra$negatif
W = 0.9091, p-value = 0.4307
> shapiro.test(indra$positif)
Shapiro-Wilk normality test
data: indra$positif
W = 0.9044, p-value = 0.4007
> shapiro.test(indra$krim)
Shapiro-Wilk normality test
data: indra$krim
W = 0.8738, p-value = 0.2419
> shapiro.test(indra$krim.peppermint)
data: indra$krim.peppermint
W = 0.9488, p-value = 0.7309
> shapiro.test(indra$krim.ekstrak)
Shapiro-Wilk normality test
data: indra$krim.ekstrak
W = 0.9047, p-value = 0.4024
> shapiro.test(indra$krim.pepermint.ekstrak)
Shapiro-Wilk normality test
data: indra$krim.pepermint.ekstrak
W = 0.8511, p-value = 0.1606
> shapiro.test(indra$biocream)
Shapiro-Wilk normality test
data: indra$Biocream®
> shapiro.test(indra$biocream.peppermint)
Shapiro-Wilk normality test
data: indra$biocream.peppermint
W = 0.8963, p-value = 0.3524
> shapiro.test(indra$biocream.ekstrak)
Shapiro-Wilk normality test
data: indra$biocream.ekstrak
W = 0.9112, p-value = 0.4446
> shapiro.test(indra$biocream.peppermint.ekstrak)
Shapiro-Wilk normality test
data: indra$biocream.peppermint.ekstrak
W = 0.9429, p-value = 0.6826
b. Inhibisi 24 jam
negatif positif krim krim.peppermint krim.ekstrak krim.peppermint.ekstrak
2 9.370 28.243 16.919 12.384 24.940 26.937
3 14.661 27.849 11.592 14.893 26.738 27.948
4 14.272 29.345 12.183 10.384 27.927 25.740
5 10.894 26.850 14.773 11.098 25.940 29.472
6 9.223 28.247 9.696 11.938 23.947 24.990
Biocream®biocream.peppermint biocream.ekstrak biocream.peppermint.ekstrak
1 12.839 13.630 25.943 26.940
2 13.516 11.379 22.018 27.940
3 15.836 14.927 21.028 25.816
4 11.526 16.039 24.138 25.839
5 13.892 14.028 27.191 24.819
6 11.081 12.784 26.749 27.847
> shapiro.test(indra$negatif)
Shapiro-Wilk normality test
data: indra$negatif
W = 0.8494, p-value = 0.1556
> shapiro.test(indra$positif)
Shapiro-Wilk normality test
data: indra$positif
> shapiro.test(indra$krim)
Shapiro-Wilk normality test
data: indra$krim
W = 0.9348, p-value = 0.6173
> shapiro.test(indra$krim.peppermint)
Shapiro-Wilk normality test
data: indra$krim.peppermint
W = 0.9666, p-value = 0.869
> shapiro.test(indra$krim.ekstrak)
Shapiro-Wilk normality test
data: indra$krim.ekstrak
W = 0.988, p-value = 0.9837
> shapiro.test(indra$krim.peppermint.ekstrak)
data: indra$krim.peppermint.ekstrak
W = 0.9709, p-value = 0.8985
> shapiro.test(indra$biocream)
Shapiro-Wilk normality test
data: indra$Biocream®
W = 0.9592, p-value = 0.8132
> shapiro.test(indra$biocream.peppermint)
Shapiro-Wilk normality test
data: indra$biocream.peppermint
W = 0.9955, p-value = 0.9983
> shapiro.test(indra$biocream.ekstrak)
Shapiro-Wilk normality test
data: indra$biocream.ekstrak
> shapiro.test(indra$biocream.peppermint.ekstrak)
Shapiro-Wilk normality test
data: indra$biocream.peppermint.ekstrak
W = 0.9161, p-value = 0.4775
2. UjiKesamaan Varian Levene’s Test
a. Inhibisi 4 jam
perlakuan respon
1 kontrol 2.888
2 kontrol 3.768
3 kontrol 6.891
4 kontrol 4.970
5 kontrol 3.033
6 kontrol 3.501
7 positif 24.022
8 positif 21.734
9 positif 26.391
10 positif 24.981
11 positif 26.971
12 positif 25.561
14 krim 6.598
31 krim_peppermint_ekstrak 20.568
32 krim_peppermint_ekstrak 23.553
33 krim_peppermint_ekstrak 21.875
34 krim_peppermint_ekstrak 22.097
35 krim_peppermint_ekstrak 23.864
36 krim_peppermint_ekstrak 21.998
37 Biocream® 5.875
39 Biocream® 4.672
Df F value Pr(>F)
group 9 0.9774 0.4699
50
Keterangan : p-value> 0,05 memiliki kesamaan varian
20 krim_ekstrak 24.940
31 krim_peppermint_ekstrak 27.849
32 krim_peppermint_ekstrak 26.937
33 krim_peppermint_ekstrak 27.948
34 krim_peppermint_ekstrak 25.740
35 krim_peppermint_ekstrak 29.472
36 krim_peppermint_ekstrak 24.990