BAB III
METODE PENELITIAN
3.1 Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan di.Laboratorium Kosmetologi dan Laboratorium Mikrobiologi Fakultas Farmasi, Universitas Sumatera Utara.
3.2 Metode Penelitian
Penelitian ini dilakukan secara eksperimental. Tahap penelitian meliputi penyiapan bahan, menyiapkanekstraketanolkulitbuahkakaopembuatan sediaan krim serta uji aktivitas bakteri terhadap Staphylococcus aureusdan Pseudomonas aeruginosa dengan metode difusi agar. Parameter yang dilihat adalah besarnya diameter daya hambat pertumbuhan bakteri.
3.3 Alat dan Bahan 3.3.1 Alat–alat
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas, autoklaf (Fisons), inkubator (Fiber Scientific), kompor (Miyako), jangka sorong, jarum ose, Laminar Air Flow Cabinet (Astec HLF 1200L), lemari pendingin (Toshiba), neraca listrik (Vibra AJ), oven (Memmert), penangas air (Yenaco), pinset, pipet mikro (Eppendorf), rotary evaporator (Haake D), kertas saring, kertas perkamen, pH meter (Tran Instrumen), cakram kertas dan spektrofotometer visibel sinar tampak (Dynamic), spatula, stamfer, tanur.
3.3.2 Bahan
nutrientagar,nutrientbroth,etanol 96%, Staphylococcus aureus, Pseudomonasaeruginosa(Lab. Mikrobiologi Fakultas Farmasi USU). Bahan kimia yang digunakan berkualitas pro analisa,kecuali dinyatakan lain: etanol 96% (Merck), Dimetilsulfoksida (Fisons).
3.4 Pembuatan Media 3.4.1 Media nutrient agar
Komposisi: Lab-lemco powder 1 g Yeast extract 2g
Peptone 5 g
Sodium chloride 5 g
Agar 15 g
Cara Pembuatan:
Sebanyak 28 g media nutrient agar (NA) dimasukkan kedalam erlenmeyer tambahkan air suling sampai 1000 ml, lalu dipanaskan sampai larutsempurna. Kemudian disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1982)
3.4.2 Media nutrient broth
Komposisi: Lab-lemco powder 1 g Yeast extract 2 g
Peptone 5 g
Sodium chloride 5 g Cara Pembuatan:
ml, dipanaskan sampai semua bahan larutsempurna. Kemudian disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid, 1982).
3.5 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan terlebih dahulu sebelum digunakan. Alat-alat gelas disterilkan di dalam oven pada suhu 170°C selama 1 jam. kemudian Media disterilkan di autoklaf pada suhu 121°Cselama 15 menit. Jarum ose dan pinset dipijar dengan lampu Bunsen (Lay, 1994).
3.6PembuatanAgarMiring
Kedalamtabungreaksisterildimasukkan3mlmedianutrient
agarsteril,didiamkanpadatemperaturkamarsampaisediaanmemadatpadaposisimirin gmembentuksudutkirakira45°Kemudiandisimpandalamlemaripendinginpadasuhu5 °C.
3.7 Pembuatan Stok Kultur Bakteri
Koloni bakteri diambil dengan menggunakan jarum ose steril, laluditanam pada media nutrient agar miring dengan cara menggores. Kemudian diinkubasi dalam inkubator pada suhu 36-37°C selama 24 jam (DitjenPOM, 1995).
3.8 Penyiapan Inokulum Bakteri
Koloni bakteri diambil dari stok kultur dengan jarum ose steril laludisuspensikan dalam tabung reaksi yang berisi 10 ml media nutrient broth. Diukur kekeruhan larutan dengan menggunakan alat spektrofotometer visible sinartampakpada panjang gelombang 580 nm hingga diperoleh transmitan 25% yang setara dengan 106
3.9 Pembuatan Larutan Uji Ekstrak Etanol Kulit Buah Kakao Dengan Berbagai Konsentrasi
Ekstrak etanol kulit buah kakao ditimbang sebanyak2 g kemudian dilarutkan dengan Dimetilsulfoksida dicukupkan sampai 4ml dan diperoleh konsentrasi ekstrak 50(mg/0,1ml). Selanjutnya dibuat pengenceran sampai diperoleh ekstrak dengan konsentrasi 40; 30; 20; 10; 7,50; 5,00; 2,50; 1,25; 0,63dan0,5(mg/0,1ml). 3.10 Metode Pengujian Efek Antibakteri Secara In Vitro
Dimasukkan 0,1 ml inokulum ke dalam cawan petri steril, kemudian dituangkan media nutrient agar sebanyak 15 ml dengan suhu 45-50°C, lalu dihomogenkan dengan cara cawan di goyang di atas permukaan meja agar media dan suspensi bercampur merata dan dibiarkan memadat. Pencadang kertas yang telah direndam pada larutan uji diletakkan pada media yang telah memadat, didiamkan ±15 menit, kemudian diinkubasi dalam inkubator pada suhu 35 °C selama 24 jam. Masing-masing cawan petri diukur diameter daya hambat bakterinya disekitar pencadang kertas menggunakan jangka sorong.
3.11 Pembuatan Sediaan Krim 3.11.1 Formulasi dasar krim
Sediaan krim yang digunakan adalah krim dengan tipe minyak dalam air sebanyak 100 g, dengan menggunakan formula standar sebagai berikut (Depkes, 1966):
R/ Asam stearat 142 g
Gliserin 100 g
Natrium tetraborat 2 g Trietanolamin 10 g
Air suling 750 ml
tetraborat termasuk zat kimia yang dilarang penggunaannya dipasaran dalam sediaan kosmetik dan jumlah gliserin yang digunakan dikurangi dengan tujuan untuk menjaga konsistensi dari sediaan krim tersebut. Untuk itu formula dasar krim yang digunakan adalah sebagai berikut:
R/ Asam stearat 14,2 g Setil alkohol 0,5 g
Gliserin 2 g
Trietanolamin 1 g Air suling ad 100 ml
AdapuncarapembuatanyaituDitimbang semua bahan yang diperlukan. Bahan yang terdapat dalam formula dipisahkan menjadi 2 kelompok, yaitu fase minyak dan fase air. Fase minyak yaitu asam stearat dan cetyl alkohol dilebur di atas penangas air dengan suhu 70–75°C, sedangkan fase air yaitu TEAdan gliserin, dilarutkan dalam air suling panas. Kemudian fase minyak dipindahkan ke dalam lumpangpanas. Fase air ditambahkan secara perlahan-lahan ke dalam fase minyak dengan pengadukan yang konstan sampai diperoleh massa krim.
3.11.2Formulasi sediaan krim
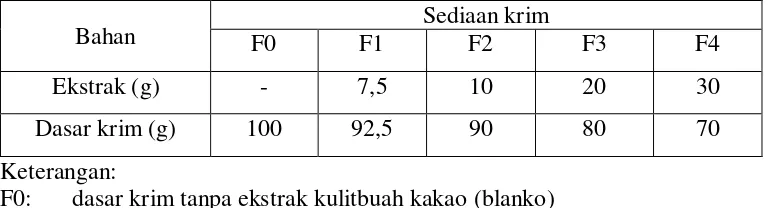
Rancangan formula sediaan krim yang mengandung ekstrak kulitbuah kakao, yang akan digunakan dalam penelitian ini dapat dilihat pada tabel berikut Tabel 3.1 Rancangan formula sediaan krim
Keterangan:
F0: dasar krim tanpa ekstrak kulitbuah kakao (blanko) F1: sediaan krim dengan ekstrak kulitbuah kakao 7,5% F2: sediaan krim dengan ekstrak kulitbuah kakao 10%
Bahan F0 F1 Sediaan krim F2 F3 F4
Ekstrak (g) - 7,5 10 20 30
F3: sediaan krim dengan ekstrak kulitbuah kakao 20% F4: sediaan krim dengan ekstrak kulitbuah kakao 30% Cara pembuatan:
Adapun cara pembuatan yaitu Ekstrak etanol kulitbuah kakao digerus didalam lumpang, lalu ditambahkan sedikit demi sedikit dasar krim dan digerus hingga homogen.
3.12 Evaluasi Terhadap Sediaan 3.12.1 Pemeriksaan homogenitas
Sejumlah tertentu sediaan jika dioleskan pada sekeping kaca atau bahan transparan lain yang cocok, sediaan harus menunjukkan susunan yang homogen dan tidak terlihat adanya butiran kasar (Ditjen POM, 1979).
3.12.2Penentuan tipe emulsi sediaan
Penentuan tipe emulsi sediaan dilakukan dengan dua cara, yaitu pengenceran dengan air dan pengecatan atau pewarnaan. Pengenceran dengan air dilakukan dengan cara mengencerkan 100 mg sediaan krim dengan 10 ml air, bila emulsi mudah diencerkan dengan air, maka emulsi tersebut adalah tipe m/a (Ditjen POM, 1985).
Pengecatan atau pewarnaan dilakukan dengan menambahkan larutan metilen biru sebanyak 1 tetes pada 500 mg sediaan di atas objek gelas. Tutup dengan kaca penutup dan diamati dibawah mikroskop. Bila metil biru tersebar merata berarti sediaan tersebut tipe emulsi m/a, tetapi bila hanya bintik-bintik biru berarti sediaan tersebut tipe emulsi a/m (Syamsuni, 2006).
3.12.3Pemeriksaan stabilitas sediaan
Sediaan dinyatakan stabil apabila warna, bau, dan penampilan tidak berubah secara visual selama penyimpanan, dan juga secara visual tidak ditumbuhi jamur. Pengamatan dilakukan pada suhu kamar pada minggu ke 0, 4, 8 dan minggu ke 12.
3.12.4Pengukuran pH sediaan
Pengukuran pH sediaan dilakukan dengan menggunakan pH meter. Alat terlebih dahulu dikalibrasi dengan menggunakan larutan dapar standar netral (pH 7,0) dan larutan dapar pH asam (pH 4,0) hingga alat menunjukkan harga pH tersebut. Elektroda dicuci dengan air suling, lalu dikeringkan dengan tissue. Sampel dibuat dalam konsentrasi 1% yaitu ditimbang 1 gram sediaan dan dilarutkan dalam 100 ml air suling. Kemudiaan elektroda dicelupkan dalam larutan tersebut. Dibiarkan alat menunjukkan harga pH sampai konstan. Angka yang ditunjukkan pH meter merupakan pH sediaan (Rawlins, 1977).
3.12.5Uji iritasi terhadap sukarelawan
Eritema Edema
Tidak eritema 0 Tidak edema 0
Sangat sedikit eritema 1 Sangat sedikit edema 1 Sedikit eritema 2 Sedikit edema 2
Eritema sedang 3 Edema sedang 3
Eritema sangat parah 4 Edema sangat parah 4
Uji iritasi yang dilakukan terhadap sukarelawan memiliki kriteri-kriteria yang harus dipenuhi adalah sebagai berikut (Ditjen POM, 1985):
1. Wanita
2. Usia antara 20-30 tahun
3. Berbadan sehat jasmani dan rohani 4. Tidak memiliki riwayat penyakit alergi
5. Menyatakan kesediaannya dijadikan panelis uji iritasi
Menurut Manggau, dkk., (2013) penilaian indeks iritasi dihitung dengan cara menjumlahkan nilai dari setiap sukarelawan percobaan setelah 8 jampemberiaan sampel iritan, kemudian dibagi 2. Penilaian iritasinya adalah sebagai berikut:
− 0,00 = tidak mengiritasi
− 0,04 - 0,99 = sedikit mengiritasi
− 1,00 - 2,99 = iritasi ringa n
3.12.6Uji mikrobiologi sediaan
Uji mikrobiologi untuk mengetahui aktivitas antimikoba sediaan krim etanol kulit buah kakao yang dilakukan dengan metode difusi agar, dengan cara
mengukur diameter hambatan antibakteri terhadappertumbuhanbakteriStaphylococcus aureus dan Pseudomonas
aeruginosa.
− 3,00 - 5,99= iritasi sedang
3.12.7Pembuatan larutan uji krim
Ditimbang sebanyak 1 g krim dari setiap formula, dimasukkan ke dalam vial dan diberi label kemudian ditambahkan akuades 1 ml dan diaduk hingga larut.
3.12.8 BakteriStaphylococcus aureus
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu dituang media nutrient agarsteril sebanyak 15 ml dengan suhu 45 – 50oC. Selanjutnya cawan digoyang di atas permukaan meja, agar media dan suspensi bakteri tercampur rata. Pada media yang telah padat diletakkan pencadang kertas, yang telah di rendam pada larutan uji, didiamkan ±15 menit, kemudian diinkubasi dalam inkubator pada suhu 35 o
3.12.9 BakteriPseudomonas aeruginosa.
C selama 24 jam, setelah itu diukur diameter daerah hambatan (zona jernih) pertumbuhan di sekitar pencadang dengan menggunakan jangka sorong.pengujian dilakukan sebanyak 3 kali.
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu dituang media nutrient agar steril sebanyak 15 ml dengan suhu 45 – 50oC. Selanjutnya cawan digoyang di atas permukaan meja, agar media dan suspensi bakteri tercampur rata. Pada media yang telah padat diletakkan pencadang kertas, yang telah di rendam pada larutan uji, didiamkan ±15 menit, kemudian diinkubasi dalam inkubator pada suhu 35 oC selama 24 jam, setelah itu diukur diameter daerah hambatan (zona jernih) pertumbuhan di sekitar pencadang dengan menggunakan jangka sorong.pengujian dilakukan sebanyak 3 kali.
BAB IV
Untukidentitas tumbuhan, pemeriksaan karakteristik simplisia(pemeriksaan simplisia, pemeriksaan karakterisasi serbuk simplisia), ekstrak dan rendemen simplisia serta skrining fitokimiadaribuahkakao(Theobroma cacao L)telah dilakukan oleh Situmorang(2016) dimanahasildapatdilihatpadaLampiran1, 2, 3, halaman 47-50.
MenurutSitumorang(2016), hasil pemeriksaan karakterisasi serbuk kulit buah kakaodanHasil skrining fitokimia ekstrak kulit buah kakaodapatdilihatpadaTabel4.1danTabel4.2dibawahini:
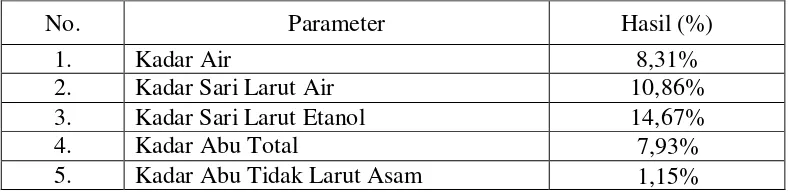
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk kulit buah kakao(Theobroma cacao L.)
No. Parameter Hasil (%)
1. Kadar Air 8,31%
2. Kadar Sari Larut Air 10,86%
3. Kadar Sari Larut Etanol 14,67%
4. Kadar Abu Total 7,93%
5. Kadar Abu Tidak Larut Asam 1,15%
Penetapan kadar air pada simplisia dilakukan untuk mengetahui jumlah air yang terkandung di dalam simplisia. Hasil yang diperoleh dari penetapan kadar air, adalah 8,31%,yaitu kurang dari 10%. Kadar air yang melebihi 10% dapat menjadi media yang baik untuk pertumbuhan jamur.
Penetapan kadar sarilarut air dilakukan untuk mengetahui jumlah senyawa yang bersifat polar yang dapat tersari dalam pelarut air. Kadar sari larut air yang diperoleh adalah 10,86%. Penetapan kadar sari larut etanol dilakukan dan untuk
tersari dalam pelarut etanol. Kadar sari larut etanol yang diperoleh adalah 14,67%. Penetapan kadar abu total dilakukan untuk mengetahui jumlah mineral yang terdapat pada sampel. Kadar abu total yang diperoleh adalah 7,93%.
Penetapan kadar abu tidak larut asam dilakukan untuk mengetahui jumlah mineral yang tidak larut dalam asam, seperti silikat. Kadar abu tidak larut asam yang diperoleh adalah 1,15%.
Monografi simplisia kulit buah kakao tidak terdaftar di buku Materia Medika Indonesia (MMI), sehingga perlu dilakukan pembakuan secara nasional mengenai parameter karakterisasi simplisia kulit buah kakao.
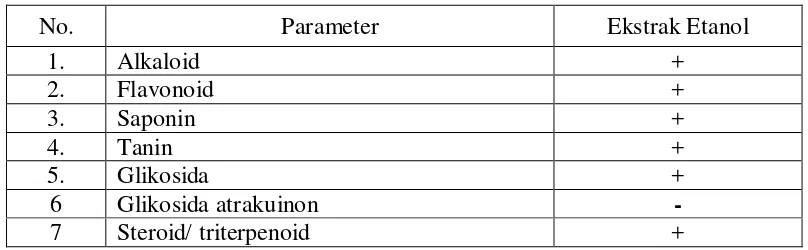
Tabel 4.2 Hasil skrining fitokimia ekstrak kulit buah kakao (Theobroma cacao L.)
No. Parameter Ekstrak Etanol
1. Alkaloid +
2. Flavonoid +
3. Saponin +
4. Tanin +
5. Glikosida +
6 Glikosida atrakuinon -
7 Steroid/ triterpenoid +
Keterangan:
(+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Kulit buah kakao mengandung alkaloid (Mulyatni, dkk., 2012), flavonoid, tannin (Matsumoto, dkk, 2004). Skrining yang dilakukan pada penelitian ini juga menunjukkan hasil yang positif terhadap alkaloid, flavonoid dan tannin.
Menurut Robinson (1995), senyawa metabolit sekunder seperti senyawa flavonoida, saponin dan tanin merupakan senyawa kimia yangmemiliki potensi sebagai antibakteri.
Hasil uji aktivitas antibakteri ekstrak etanol kulit buah kakao dapat dilihat pada Tabel 4.3 dibawah ini. Data selengkapnya dapat dilihat di Lampiran 5, 6halaman 53-54.
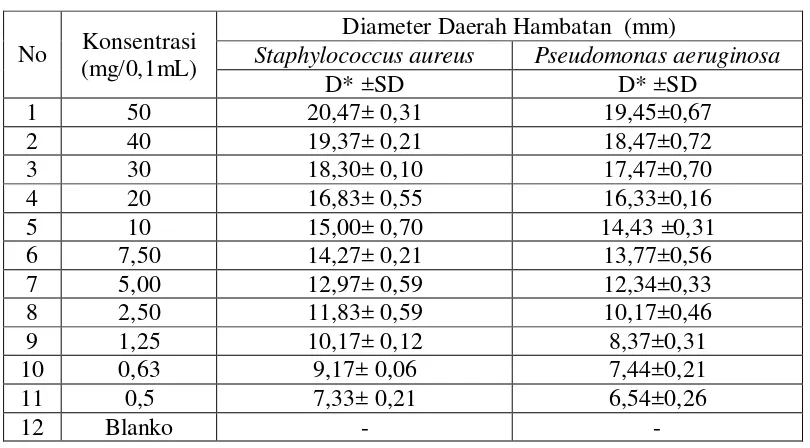
Tabel 4.3Hasil pengukuran diameter hambatanrata-rata pertumbuhan bakteriStaphylococcus aureusdanPseudomonas aeruginosadariekstraketanolkulitbuahkakao.(Theobroma cacao L.)
No Konsentrasi (mg/0,1mL)
Diameter Daerah Hambatan (mm)
Staphylococcus aureus Pseudomonas aeruginosa
D* ±SD D* ±SD
Keterangan : D * = hasil rata-rata tiga kali pengukuran SD = standar deviasi
- = tidak ada hambatan
konsentrasi 0,5 mg/0,1mldengan diameter hambat 7,33± 0,21 mm sedangkan terhadap bakteri Pseudomonas aeruginosa pada konsentrasi 0,5 mg/0,1ml dengan diameter hambat 6,54±0,26 mm.
Berdasarkan perhitungan standar deviasi (SD) menggunakan Microsoft office Excel 2007 dengan insert function STDEV dapat ditentukan bahwa pada setiap konsentrasi ekstrak etanol 50; 40; 30; 20; 10; 7,50; 5; 2,50; 1,25; 0,63; dan 0,50 mg/0,1ml memberikan diameter daerah hambat yang berbedaantara bakteri Staphylococcus aureusdengan bakteri Pseudomonas aeruginosa
Aktivitas antibakteri yang didapatkan dari ektrak etanol merupakan aktivitasantibakteri yang efektif dalam menghambat pertumbuhan bakteri Staphylococcus aureus danPseudomonas aeruginosa. Hal ini dikarenakan kandungan senyawa metabolit sekunder yang terdapat dalam ekstrak etanol kulit buah kakao adalah senyawa yang memiliki aktivitas antibakteri yang kuat yaitu flavonoid,tanin dan saponin.
Tanin adalah senyawa fenol yang tersebar luas pada tumbuhan berpembuluh. Senyawa fenol dan turunannya (flavonoid) merupakan salah satu antibakteri yang bekerja dengan mengganggu fungsi membran sitoplasma. Pada konsentrasi rendah dapat merusak membran sitoplasma yang menyebabkan bocornya metabolit penting yang menginaktifkan sistem enzim bakteri, sedangkan pada konsentrasi tinggi mampu merusak membran sitoplasma dan mengendapkan protein sel (Harborne, 1987; Volk dan Wheller, 1993).
mengakibatkan senyawa intraseluler akan keluar (Robinson, 1995).Mekanisme steroid sebagai antibakteri berhubungan dengan membran lipid dan sensitivitas
terhadap komponen steroid yang menyebabkan kebocoran pada liposom (Manggu, dkk., 2013).
Ekstrak etanol kulit buah kakao memberikan perbedaan aktivitas antibakteri pada berbagai variasi konsentrasi larutan uji terhadap bakteri gram positif Staphylococcus aureusdan bakteri gram negatif Pseudomonas aeruginosa dimana diameter hambatan pertumbuhan bakteri lebih besar terhadap bakteriStaphylococcus aureus. Hal ini disebabkan karena kedua bakteri uji tersebut memilki komposisi dan struktur dinding sel yang berbeda sehingga mengakibatkan bakteri gram positif lebih rentan terhadap senyawa-senyawa kimia dibandingkan gram negatif. Struktur dinding sel bakteri gram positif lebih sederhana, yaitu berlapis tunggal sehingga memudahkan bahan bioaktif masuk ke dalam sel sedangkan struktur dinding sel bakteri gram negatif lebih kompleks, yaitu berlapis tiga terdiri dari lapisan luar lipoprotein, lapisan tengah lipopolisakarida yang berperan sebagai penghalang masuknya bahan bioaktif antibakteri, dan lapisan dalam berupa peptidoglikan (Pelczar dan Chan, 1988; Volk dan Wheeler, 1993
4.2 Hasil Evaluasi Terhadap Sediaan
4.2.1 Hasil pemeriksaan homogenitas sediaan
Sediaan krim yang dihasilkan tidak diperoleh butiran-butiran pada objek gelas dari formula blanko. Hasil yang sama juga diperoleh pada sediaan krim dengan ekstrak Kulitbuah kakao, yaitu tidak ada butiran-butiran pada objek gelas. Gambar hasil pemeriksaan homogenitas dapat dilihat pada, lampiran 10 hal58.
Pengujian tipe emulsi sediaan dilakukan dengan mengamati kelarutan dalam air dan dalam metilen biru dapat dilihat pada Tabel 4.4 berikut ini.
Tabel 4.4 Data Penentuan Tipe Emulsi Sediaan Krim Ekstrak Etanol Kulitbuah kakao.(Theobroma cacao L.)
No Formula Sediaan
Pengenceran dengan air Kelarutan Metil Biru pada Sediaan
Formula 0 :dasar krim tanpa ekstrak etanolKulitbuah kakao (blanko) Formula 1 : sediaan krim dengan ekstrak etanol Kulitbuah kakao7,5% Formula 2 : sediaan krim dengan ekstrak etanol Kulitbuah kakao 10% Formula 3 : sediaan krim dengan ekstrak etanol Kulitbuah kakao 20% Formula 4 : sediaan krim dengan ekstrak etanol Kulitbuah kakao 30%
√ : larut
Menurut Ditjen POM (1985), metode untuk menentukan tipe emulsi yaitu dengan cara krim diencerkan dengan air dengan konsentrasi 1%, bila emulsi mudah diencerkan dengan air, maka emulsi tersebut adalah tipe m/a.
Menurut Syamsuni (2006), untuk membedakan tipe emulsi dapat dilakukan dengan pengecatan atau pewarnaan. Emulsi tipe m/a memberikan warna biru jika ditambah metilen biru karena metilen biru larut dalam air.
Hasil pewarnaan metilen biru pada blanko memberikan warna biru dan pada sediaan krim dengan konsentrasi 7,5% 10%, 20%, 30% memberikan warna hijau tua. Menunjukkan bahwa metilen biru larut dalam sediaan krim dan blanko yang berarti sediaan krim dan blanko tipe m/a.
diencerkan dengan air. Hal ini membuktikan bahwa tipe emulsi sediaan krim yang dibuat adalah m/a. Gambar hasil penentuan tipe emulsi sediaan dapat dilihat pada lampiran 11, halaman 59.
4.2.3 Hasil pemeriksaan stabilitas sediaan
Dari hasil uji stabilitas organoleptis seluruh ekstrak etanol kulitbuah kakao tidak mengalami perubahan bentuk, warna, dan bau. Seluruh sediaan krim ekstrak etanol kulit buah kakao selama penyimpanan 12 minggu dinyatakan stabil.
Tabel 4.5Data Pemeriksaan Stabilitas Sediaan Krim Ekstrak Etanol Kulitbuah kakao(Theobroma cacao L.).
Formula 0 : dasar krim tanpa ekstrak etanol Kulitbuah kakao (blanko) Formula 1 : sediaan krim dengan ekstrak etanol Kulitbuah kakao7,5% Formula 2 : sediaan krim dengan ekstrak etanol Kulitbuah kakao10% Formula 3 : sediaan krim dengan ekstrak etanol Kulitbuah kakao20% Formula4 :sediaan krim dengan ekstrak etanol Kulitbuah kakao30% x : Perubahan warna
y : Perubahan bau z : Pecahnya emulsi - : Tidak terjadi perubahan
√ : Terjadi perubahan
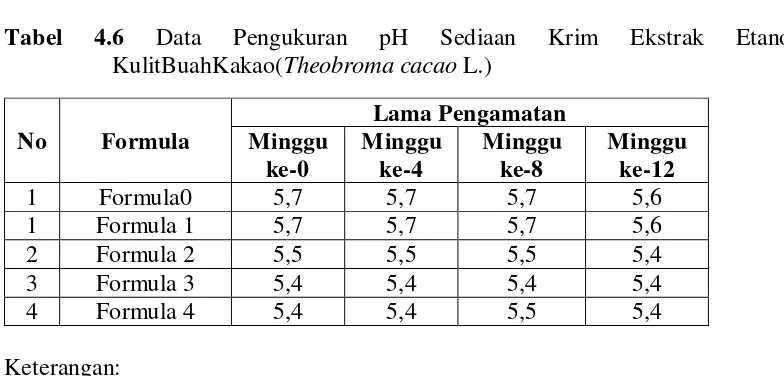
4.2.4 Hasil pengukuran pH sediaan
pH sediaan ditentukan dengan menggunakan pH meter. Hasil pengukuran pH dapat dilihat pada Tabel 4.6. DatapengukuranpH sediaan krim ekstrak etanol kulitbuahkakao(Theobroma cacao L.) secarakeseluruhandapatdilihatpadaLampiran12, halaman 60.
Tabel 4.6 Data Pengukuran pH Sediaan Krim Ekstrak Etanol KulitBuahKakao(Theobroma cacao L.)
Formula0 :dasar krim tanpa ekstrak etanol kulitbuahkakao (blanko) Formula 1 :sediaan krim dengan ekstrak etanol kulitbuahkakao7,5% Formula 2 : sediaan krim dengan ekstrak etanol kulitbuahkakao10% Formula 3 : sediaan krim dengan ekstrak etanol kulitbuahkakao20% Formula 4 : sediaan krim dengan ekstrak etanol kulitbuahkakao30%
karena menurut Balsam dan Sagarin (1972), pH sediaan krimyang sesuai untuk pH kulit adalah antara 5 dan 8.
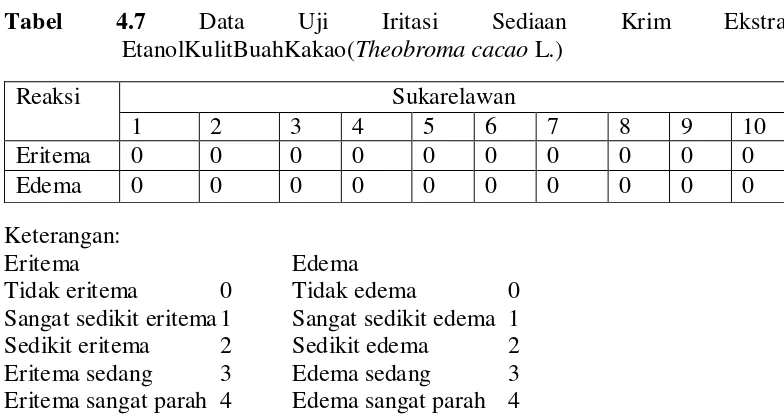
4.2.5 Hasil uji iritasi terhadap sukarelawan
Menurut Wasitaatmadja (1997), uji iritasi kulit dilakukan untuk mengetahui terjadinya efek samping yang ditimbulkan oleh sediaan pada kulit, dengan cara memakai kosmetika dibagian bawah lengan atau di belakang telinga. Hasil uji iritasi yang dilakukan terhadap kulit sukarelawan dapat dilihat pada Tabel 4.7 berikut ini:
Tabel 4.7 Data Uji Iritasi Sediaan Krim Ekstrak
EtanolKulitBuahKakao(Theobroma cacao L.)
Reaksi Sukarelawan
1 2 3 4 5 6 7 8 9 10
Eritema 0 0 0 0 0 0 0 0 0 0
Edema 0 0 0 0 0 0 0 0 0 0
Keterangan:
Eritema Edema
Tidak eritema 0 Tidak edema 0 Sangat sedikit eritema 1 Sangat sedikit edema 1 Sedikit eritema 2 Sedikit edema 2 Eritema sedang 3 Edema sedang 3 Eritema sangat parah 4 Edema sangat parah 4
Dari data diatas bahwa uji iritasi terhadap 10 sukarelawan tidak ada tanda-tanda efek samping dari krim ekstrak etanol kulit buah kakao.
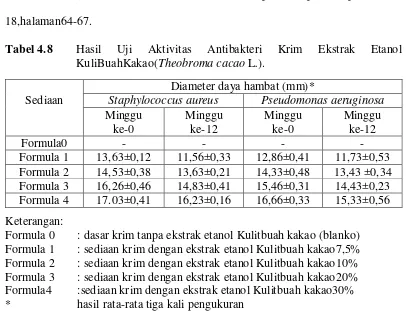
4.2.6 Hasil uji aktivitas antibakteriterhadap krim ekstrak etanol kulitbuahkakao
kulibuahkakao(Theobroma cacao L.) dapatdilihatpadalampiran15dan 18,halaman64-67.
Tabel 4.8 Hasil Uji Aktivitas Antibakteri Krim Ekstrak Etanol KuliBuahKakao(Theobroma cacao L.).
Sediaan
Diameter daya hambat (mm)*
Staphylococcus aureus Pseudomonas aeruginosa Minggu
Formula 1 13,63±0,12 11,56±0,33 12,86±0,41 11,73±0,53 Formula 2 14,53±0,38 13,63±0,21 14,33±0,48 13,43 ±0,34 Formula 3 16,26±0,46 14,83±0,41 15,46±0,31 14,43±0,23 Formula 4 17.03±0,41 16,23±0,16 16,66±0,33 15,33±0,56 Keterangan:
Formula 0 : dasar krim tanpa ekstrak etanol Kulitbuah kakao (blanko) Formula 1 : sediaan krim dengan ekstrak etanol Kulitbuah kakao7,5% Formula 2 : sediaan krim dengan ekstrak etanol Kulitbuah kakao10% Formula 3 : sediaan krim dengan ekstrak etanol Kulitbuah kakao20% Formula4 :sediaan krim dengan ekstrak etanol Kulitbuah kakao30% * hasil rata-rata tiga kali pengukuran
Hasil uji aktivitas antibakteri krim ekstrak etanol kulit buah kakao pada blanko (basis krim) tidak mempunyai daya hambat terhadap bakteriStaphylococcus aureus dan Pseudomonas aeruginosa. Hal ini disebabkan karena pada pembuatan krim tidakmenggunakanbahanpengawet, pada minggu ke-0.
Sediaan krim dengan ekstrak etanol kulit buah kakao 7,5% mempunyai aktivitas antibakteri terhadap bakteriStaphylococcus aureus dan Pseudomonasaeruginosa, hasil rata-rata pada tiga kali pengukuran uji aktivitas antibakteri pada
minggu ke-0 secara berturut-turut 13,63±0,12, mm dan 12,86±0,41 mm.
antibakteri pada minggu ke-12 secara berturut-turut 11,56±0,33 mm dan 11,73±0,53 mm.
Sediaan krim esktrak etanol kulit buah kakao mempunyai aktivitas antibakteri terhadap bakteriStaphylococcus aureus dan Pseudomonas aeruginosa, hasil tiga kali pengukuran uji aktivitas antibakteri pada minggu ke-0 terhadap bakteriStaphylococcus aureus10%, 20% dan 30% secara berturut-turut memberikan zona hambat sebesar 14,86 mm, 16,26 mm, dan 17,03mm dan terhadap bakteriPseudomonas aeruginosa pada konsentrasi 10%, 20%, dan 30% secara berturut-turut memberikan zona hambat sebesar 14,33 mm, 15,46 mm, dan 16,66 mm.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Darihasilpenelitianyangdilakukandapatdisimpulkanbahwa:
1. Ekstrak etanol kulit buah kakao (Theobroma cacao L.) dengan konsentrasi 0,5, 0,63, 1,25, 2,50 5,00, 7,50, 10, 20, 30 40, dan50 mg/0,1ml mempunyaiaktivitasantibakteri,danefektifpadakosentrasi7,50 mg/0,1ml terhadapbakteriStaphylococcus aureusdengandiameterdaerahhambat14,27 ± 0,21,danpadabakteriPseudomonas
aeruginosaefektifpadakosentrasi10mg/0,1mldengandiameterdaerahhambat14, 43 ± 0,31.
2. Ekstrak etanol kulit buah kakao (Theobroma cacao L.) dapat diformulasi ke dalam bentuk sediaan krim.
3. Krim yang mengandung ekstrak etanol kulit buah kakao dengan konsentrasi10%sudahefektifsebagaiantibakteridan stabil pada penyimpanan selama 12 minggu, krim tetap homogen, pH relatif stabil berkisar antara 5,4-5,8, tidak menyebabkan iritasi dan mempunyai aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Pseudomonas aeruginosa..