BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan Dandang Gendis 2.1.1 Sistematika tumbuhan
Tumbuhan dandang gendis memilki sistematika sebagai berikut (Akbar,
2010):
Kingdom : Plantae
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Solanales
Suku : Acanthaceae
Marga : Clinacanthus
Spesies : Clinacanthus nutans (Burm.f.) Lindau)
2.1.2 Nama lain
Tumbuhan dandang gendis memiliki sinonim Beleperone futgina
Hassk., dan Clinacanthus burmani Nees. Nama daerah, yaitu daun thailand, lidah ular, seribu bias (Sumatera), ki tajam (Jawa Barat), gendis (Jawa
2.1.3 Habitat
Tumbuhan dandang gendis (Clinacanthus nutans (Burm.f.) Lindau) tumbuh pada daerah dataran rendah dan dapat digunakan sebagai pagar hidup
(Nainggolan, 2004).
2.1.4 Morfologi
Tumbuhan Clinacanthus nutans (Burm.f) Lindau memiliki batang berkayu, tegak lurus slindris, beruas dan berwarna hijau. Akar tunggang
berwarna putih dan kotor. Daun tunggal berhadapan, bentuk lanset, ujung
runcing, pangkal membulat, tepi beringgit, panjang 8-12 mm, lebar 4-6 cm,
pertulangan menyirip berwarna hijau. Bunga majemuk, bentuk malai, panjang
± 1 cm, mahkota bunga berbentuk tabung, memanjang melebar, panjang ± 3,5
cm, berwarna merah muda. Benang sari coklat, putih berbentuk tabung, bakal
buah pipih, tiap ruas berisi 2 biji berwarna merah. Buah kotak, bulat
memanjang berwrna coklat. Biji kecil berwarna hitam (Anonim, 2005b).
2.1.5 Kandungan kimia
Daun dandang gendis (Clinacanthus nutans (Burm.f.) Lindau) mengandung senyawa alkaloid, triterpenoid/steroid, glikosida, tanin, saponin
dan flavonoid (Linda, 2007; Wirasty, 2004).
2.1.6 Khasiat dan penggunaannya
Pada sistem pengobatan Cina dan pengobatan tradisional lain
disebutkan bahwa tanaman ini memiliki sifat seperti mengefektifkan fungsi
kelenjar tubuh, meningkatkan sirkulasi, peluruh air seni, penurun panas karena
antivirus (herpes dan zoster), antiinflamasi, antioksidan, antitoksin binatang
berbisa, obat luka bakar dan eksim (Nainggolan, 2004).
2.2 Metode Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat dari bahan
asal dengan menggunakan pelarut (Syamsuni, 2006). Zat aktif yang terdapat
dalam simplisia tersebut dapat digolongkan ke dalam golongan minyak atsiri,
alkaloid, flavonoid dan lain-lain (Ditjen POM, 2000). Tujuan utama ekstraksi
ini adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat-zat
yang memiliki khasiat pengobatan (Syamsuni, 2006).
Metode ekstraksi dengan menggunakan pelarut dapat dilakukan dengan
beberapa cara, yaitu :
a. Maserasi
Maserasi adalah proses pengekstraksian simplisia menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan,
sedangkan remaserasi merupakan pengulangan penambahan pelarut setelah
dilakukan penyaringan maserat pertama, dan seterusnya (Ditjen POM, 2000).
Maserasi dilakukan dengan cara masukkan 10 bagian simplisia atau campuran
simplisia dengan derajat halus yang cocok ke dalam sebuah bejana, tuangi
dengan 75 bagian cairan penyari, tutup, biarkan selama 5 hari terlindung dari
cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan cairan penyari
biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari. Enap tuangkan
dan saring (Ditjen POM, 1979).
b. Perkolasi
Perkolasi adalah suatu cara penarikan memakai alat yang disebut
perkolator dimana simplisia terendam dalam cairan penyari, zat-zat akan
terlarut dan larutan tersebut akan menetes secara beraturan. Prosesnya terdiri
dari tahapan pengembangan bahan, tahap perendaman antara, tahap perkolasi
sebenarnya (penetesan/penampungan perkolat) sampai diperoleh ekstrak
(Ditjen POM, 2000).
Prosedur perkolasi yaitu basahi 10 bagian simplisia atau campuran
simplisia dengan derajat halus yang cocok dengan 2,5 bagian sampai 5 bagian
cairan penyari, masukkan ke dalam bejana tertutup sekurang-kurangnya selama
3 jam. Pindahkan massa sedikit demi sedikit ke dalam perkolator sambil tiap
kali di tekan hati-hati, tuangi dengan cairan penyari secukupnya sampai cairan
mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, tutup
perkolator, biarkan selama 24 jam. Biarkan cairan menetes dengan kecepatan
1 ml per menit, tambahkan berulang-ulang cairan penyari secukupnya sehingga
selalu terdapat selapis cairan penyari di atas simplisia, hingga diperoleh 80
bagian perkolat. Peras massa, campurkan cairan perasan ke dalam perkolat,
tambahkan cairan penyari secukupnya hingga diperoleh 100 bagian. Pindahkan
ke dalam bejana, tutup, biarkan selama 2 hari di tempat yang sejuk, terlindung
c. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan pelarut akan terdestilasi menuju pendingin dan akan
kembali ke labu (Ditjen POM, 2000).
d. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana
pelarut akan terdestilasi dari labu menuju pendingin, kemudian jatuh
membasahi dan merendam sampel yang mengisi bagian tengah alat soklet,
setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi,
demikian berulang-ulang (Ditjen POM, 2000).
e. Digesti
Digesti adalah maserasi dengan pengadukan kontiniu pada temperatur
yang tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40º-50ºC (Ditjen POM, 2000). f. Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisia nabati
dengan air pada suhu 90oC selama 15 menit (Ditjen POM, 2000). g. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai
2.3 Toksikologi
Secara sederhana dan ringkas, Lu (1994) mendefinisikan toksikologi
sebagai kajian tentang hakikat dan mekanisme efek toksik berbagai bahan
terhadap makhluk hidup dan sistem biologik lainnya. Menurut Hodgson dan
Levi (2000) toksikologi didefinisikan sebagai cabang ilmu pengetahuan yang
berhubungan erat dengan senyawa racun dimana racun yang dimaksud adalah
senyawa-senyawa yang menimbulkan efek merugikan tubuh bila dikonsumsi
baik secara sengaja maupun tidak sengaja.
2.4 Paparan Umum Toksikologi
Peristiwa timbulnya pengaruh berbahaya atau efek toksik racun
terhadap makhluk hidup terjadi melalui beberapa proses. Pertama kali makhluk
hidup mengalami paparan dengan toksikan. Berikutnya, setelah mengalami
absorpsi dari tempat paparannya maka toksikan atau metabolitnya akan
terdistribusi ke tempat aksi (sel sasaran atau reseptor) tertentu yang ada di
dalam diri makhluk hidup. Di tempat aksi ini kemudian terjadi interaksi antara
toksikan atau metabolitnya dengan komponen penyusun sel sasaran atau
reseptor sehingga timbul pengaruh berbahaya atau efek toksik dengan wujud
serta sifat tertentu. Ada dua kemungkinan toksikan masuk ke dalam tubuh,
yakni secara intravaskuler meliputi intravena, intrakardial, dan intraarteri dimana toksikan langsung masuk ke dalam sirkulasi darah dan ekstravaskuler
meliputi peroral, intramuskular, intraperitonial, subkutan, dan inhalasi dimana
secara ekstravaskuler selanjutnya akan masuk ke dalam sirkulasi darah setelah melalui tahap absorpsi terlebih dahulu. Setelah toksikan berada dalam sirkulasi
darah maka toksikan akan mengalami distribusi ke tempat aksi (sel sasaran
atau reseptor) (Retnomurti, 2008).
2.5 Pengujian Toksisitas
Penelitian toksisitas konvensional pada hewan coba sering
mengungkapkan serangkaian efek akibat pajanan toksikan dalam berbagai
dosis untuk berbagai masa pajanan. Penelitian toksikologi biasanya dibagi
menjadi tiga kategori:
1. Uji toksisitas akut dilakukan dengan memberikan bahan kimia yang
sedang diuji sebanyak satu kali atau beberapa kali dalam jangka waktu 24
jam.
2. Uji toksisitas jangka pendek (dikenal dengan subkronik) dilakukan dengan
memberikan bahan tersebut berulang-ulang, biasanya setiap hari atau lima
kali seminggu, selama jangka waktu kurang lebih 10% dari masa hidup
hewan, yaitu tiga bulan untuk tikus dan satu atau dua tahun untuk anjing.
3. Uji toksisitas jangka panjang dilakukan dengan memberikan bahan kimia
berulang-ulang selama masa hidup hewan coba atau sekurang-kurangnya
sebagian besar dari masa hidupnya, misalnya 18 bulan untuk mencit, 24
bulan untuk tikus, dan 7-10 tahun untuk anjing dan monyet (Lu, 1994).
Uji toksisitas tidak dirancang untuk menunjukkan bahwa bahan kimia
dihasilkan. FDA (Food and Drug Administration), EPA (Environmental Protection Agency), dan Organization for Economic Cooperation and
Development (OECD) telah menuliskan standar cara bekerja yang baik di
laboratorium (GLP) dengan prosedur yang telah ditetapkan. Pedoman ini
diharapkan dapat mendukung pengenalan keamanan bahan kimia ke
masyarakat ketika uji toksisitas dilakukan (Casarett, 2008).
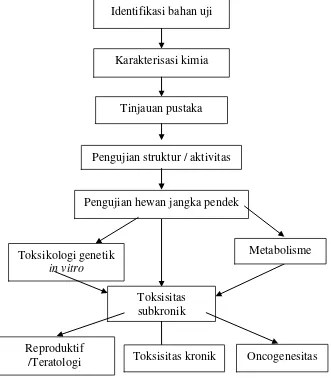
Prinsip pengujian toksikologi dapat dilihat pada Gambar 2.1 berikut.
Gambar 2.1 Prinsip toksikologi (Casarett, 2008) Identifikasi bahan uji
Karakterisasi kimia
Tinjauan pustaka
Pengujian struktur / aktivitas
Pengujian hewan jangka pendek
Toksikologi genetik
in vitro
Toksisitas subkronik
Metabolisme
Oncogenesitas Toksisitas kronik
Suatu kerangka kerja umum bagaimana suatu bahan kimia baru
dievaluasi toksisitasnya ditunjukkan pada Gambar 2.1. Studi awal
membutuhkan evaluasi senyawa kimia untuk mengetahui kemurnian, stabilitas,
kelarutan, dan faktor-faktor fisikokimia lainnya yang dapat mempengaruhi
efektivitas senyawa uji. Kemudian struktur senyawa uji dibandingkan dengan
struktur senyawa yang telah ada untuk mengetahui informasi toksisitasnya.
Hubungan struktur aktivitas dapat ditinjau dari literatur toksikologi yang ada.
Setelah informasi dasar telah dievaluasi, senyawa uji dapat diberikan kepada
hewan untuk studi dosis toksisitas akut dan berulang (Casarett, 2008).
2.5.1 Uji toksisitas akut
Uji toksisitas akut secara umum merupakan uji yang pertama dilakukan.
Uji ini memberikan data pada toksisitas relatif yang meningkat dari dosis
tunggal hingga dosis berganda. Uji standar tersedia dalam pemberian secara
oral, dermal dan inhalasi (Gupta, et al., 2012). Parameter-parameter dasar
dalam pengujian toksisitas akut dapat dilihat pada Tabel 2.1.
Tabel 2.1 Parameter dasar pengujian toksisitas akut
Spesies Tikus lebih disukai pada uji secara oral dan inhalasi, kelinci lebih disukai pada uji secara dermal
Umur Dewasa
Jumlah Hewan 5 setiap jenis kelamin per level dosis
Dosis Tiga level dosis yang direkomendasi, pemberian secara dosis tunggal selama 24 jam untuk uji oral dan dermal dan 4 jam untuk uji inhalasi
Waktu Pengamatan
14 hari
(Gupta, et al., 2012)
Penelitian uji toksisitas akut sebagian besar dirancang untuk
“dosis tunggal suatu bahan yang secara statistik diharapkan akan membunuh
50% hewan coba”. Pengujian ini juga dapat menunjukkan organ sasaran yang
mungkin dirusak dan efek toksik spesifiknya, serta memberikan petunjuk
tentang dosis yang sebaiknya digunakan dalam pengujian yang lebih lama
(Lu, 1994). LD50 adalah dosis perkiraan bahwa ketika racun itu diberikan
langsung kepada hewan uji, menghasilkan kematian 50% dari populasi di
bawah kondisi yang ditentukan dari tes atau LC50 merupakan konsentrasi
perkiraan, dalam lingkungan hewan yang terpapar, yang akan membunuh 50%
dari populasi di bawah kondisi yang ditentukan dari tes (Hodgson dan Levi,
2000).
Nilai LD50 sangat berguna untuk hal-hal sebagai berikut:
1. Klasifikasi lazim zat kimia sesuai dengan toksisitas relatifnya adalah
sebagai berikut:
Kategori LD50
Supertoksik 5 mg/kg atau kurang
Amat sangat toksik 5-50 mg/kg
Sangat toksik 50-500 mg/kg
Toksik sedang 0,5-5 g/kg
Toksik ringan 5-15 g/kg
Praktis tidak toksik >15 g/kg
2. Evaluasi dampak keracunan yang tidak disengaja; perencanaan penelitian
toksisitas subkronik dan kronik pada hewan, memberikan informasi
tentang mekanisme toksisitas, pengaruh umur, seks, faktor penjamu dan
faktor lingkungan lainnya dan variasi respons antarspesies dan antarstrain
Faktor-faktor yang berpengaruh pada LD50 sangat bervariasi antara
jenis yang satu dengan jenis yang lain dan antara individu yang satu dengan
individu yang lain dalam satu jenis. Beberapa faktor tersebut antara lain
(Retnomurti, 2008):
a. Spesies, strain dan keragaman individu
Setiap spesies dan strain yang berbeda memiliki sistem metabolisme
dan detoksikasi yang berbeda. Setiap spesies mempunyai perbedaan
kemampuan bioaktivasi dan toksikasi suatu zat.
b. Perbedaan jenis kelamin
Perbedaan jenis kelamin mempengaruhi toksisitas akut yang
disebabkan oleh pengaruh langsung dari kelenjar endokrin. Hewan betina
mempunyai sistem hormonal yang berbeda dengan hewan jantan sehingga
menyebabkan perbedaan kepekaan terhadap suatu toksikan.
c. Umur
Hewan-hewan yang lebih muda memiliki kepekaan yang lebih tinggi
terhadap obat karena enzim untuk biotransformasi masih kurang dan fungsi
ginjal belum sempurna. Pada hewan yang tua kepekaan individu meningkat
karena fungsi biotransformasi dan ekskresi sudah menurun.
d. Berat badan
Penentuan dosis dalam pengujian toksisitas akut dapat didasarkan pada
berat badan. Pada spesies yang sama, berat badan yang berbeda dapat
memberikan nilai LD50 yang berbeda pula, semakin besar berat badan maka
e. Cara pemberian
Lethal dosis juga dapat dipengaruhi oleh cara pemberian. Pemberian
obat peroral tidak langsung didistribusikan ke seluruh tubuh. Pemberian obat
atau toksikan peroral didistribusikan ke seluruh tubuh setelah terjadi
penyerapan di saluran cerna sehingga mempengaruhi kecepatan metabolisme
suatu zat di dalam tubuh.
f. Faktor lingkungan
Beberapa faktor lingkungan yang mempengaruhi toksisitas akut antara
lain temperatur, kelembaban, iklim, perbedaan siang dan malam. Perbedaan
temperatur suatu tempat akan mempengaruhi keadaan fisiologis suatu hewan.
g. Kesehatan hewan
Status hewan dapat memberikan respon yang berbeda terhadap suatu
toksikan. Kesehatan hewan sangat dipengaruhi oleh kondisi hewan dan
lingkungan. Hewan yang tidak sehat dapat memberikan nilai LD50 yang
berbeda dibandingkan dengan nilai LD50 yang didapatkan dari hewan sehat.
h. Diet
Komposisi makanan hewan percobaan dapat mempengaruhi nilai LD50.
Komposisi makanan akan mempengaruhi status kesehatan hewan percobaan.
2.5.2 Uji toksisitas subkronik
Uji toksisitas subkronik dilakukan dengan memberikan bahan
berulang-ulang, biasanya setiap hari atau lima hari seminggu, selama jangka waktu 10%
dari masa hidup hewan (Retnomurti, 2008). Uji toksisitas subkronis meneliti
(Hodgson dan Levi, 2000). Paparan subkronis dapat bertahan selama periode
waktu yang berbeda, tapi 90 hari adalah durasi uji yang paling umum. Tujuan
utama uji subkronik adalah untuk mencapai NOAEL (no-observed-adverse effect level) dan untuk mengidentifikasi lebih lanjut ciri organ tertentu atau organ yang terpapar senyawa uji setelah pemberian secara berulang. Studi
subkronik dapat dilakukan pada dua spesies (biasanya tikus dan anjing untuk
FDA; dan mencit untuk EPA) dengan rute pemberian yang lazim yaitu oral.
Setidaknya ada tiga dosis yang diberikan (dosis tinggi yang menghasilkan
toksisitas tetapi tidak menyebabkan lebih dari 10% korban jiwa, dosis rendah
yang tidak menghasilkan efek beracun jelas, dan dosis intermediate) dengan 10
sampai 20 tikus dan 4 sampai 6 anjing dari masing-masing jenis kelamin per
dosis (Casarett, 2008). Lama penelitian pada tikus biasanya 90 hari. Pada
anjing masa itu sering diperpanjang sampai enam bulan atau bahkan satu atau
dua tahun (Lu, 1994).
Pengamatan yang dilakukan dalam pengujian toksisitas subkronis
adalah pengamatan pada awal pemberian senyawa meliputi penampakan fisik
(kematian, membran mucus, kulit, dan lain sebagainya), konsumsi makanan,
berat badan, respon neurologi, kelakuan yang tidak normal, pernafasan, ECG,
EEG, hematologi, pemeriksaan darah, urin. Pengamatan pada akhir pengujian
meliputi nekropsi dan histologi (Hogson dan Levi, 2000).
2.5.3 Uji toksisitas kronik
Uji toksisitas kronis menentukan toksisitas dari keberadaan bahan yang
tetapi memerlukan waktu yang lebih lama dan melibatkan kelompok yang
lebih besar dari hewan (Gupta, et al., 2012). Pada tikus, paparan kronik
biasanya 6 bulan sampai 2 tahun. Untuk hewan selain tikus biasanya selama
satu tahun tetapi mungkin lebih lama (Casarett, 2008).
Tujuan uji toksisitas kronik adalah menentukan sifat toksisitas zat kimia
dan menentukan NOAELnya. Protokol yang biasa digunakan pada pengujian
subkronik dan kronik melibatkan kelompok hewan mengandung jumlah yang
sama dari kedua jenis kelamin (jantan dan betina) menerima setidaknya tiga
tingkat dosis obat dan satu kelompok kontrol. Hewan-hewan ini diobservasi
setiap hari terhadap tanda-tanda klinis toksisitas. Berat badan dan konsumsi
makanan diukur secara berkala. Ada tiga parameter, yaitu tanda-tanda klinis,
berat badan, dan konsumsi makanan. Profil kimia hematologi dan serum
lengkap diukur setidaknya pada akhir pengujian (Gupta, et al., 2012).
2.6 Pengujian In Vivo
Pengujian secara in vivo adalah pengujian yang dilakukan dengan menggunakan hewan percobaan untuk mengetahui metabolisme suatu senyawa
di dalam tubuh. Hewan percobaan yang digunakan pada percobaan secara in vivo harus dari jenis mamalia, karena hasilnya dapat diterapkan pada manusia. Ciri-ciri hewan mamalia adalah hewan yang menyusui anaknya, berambut,
berdarah panas, mempunyai empat ruang jantung, dan melahirkan anak
Mencit sebagai hewan percobaan sangat praktis digunakan untuk
penelitian yang bersifat kuantitatif karena sifatnya yang mudah
berkembangbiak. Selain itu, dalam bidang peternakan mencit tidak
membutuhkan biaya yang mahal, efisien dalam waktu, dan kemampuan
reproduksi tinggi dengan waktu yang singkat (Hadriyanah, 2008). Sistem
taksonomi mencit adalah sebagai berikut (Pribadi, 2008).
Kingdom : Animalia
Filum : Chordata
Subfilum : Vertebrata
Kelas : Mamalia
Ordo : Rodentia
Famili : Muridae
Genus : Mus
Spesies : Mus musculus
Mencit memiliki beberapa data biologis, diantaranya (Retnomurti, 2008):
Lama hidup : 1-2 tahun
Lama produksi ekonomis : 9 bulan
Lama hamil : 19-21 hari
Umur dewasa : 35 hari
Umur dikawinkan : 8 minggu
2.7 Hati
Hati adalah organ terbesar yang terdapat di dalam tubuh kita, letaknya
di rongga perut di sebelah kanan bawah diafragma. Hati berwarna merah tua
dan beratnya ± 1,5 kg. hati terbagi dalam dua belahan utama, kanan dan kiri.
Permukaan atas berbentuk cembung dan terletak di bawah diafragma,
permukaan bawah tidak rata dan memperlihatkan lekukan yang disebut fisura
tranversus (Irianto, 2004). Fisura longitudinal memisahkan belahan kanan dan
kiri di bagian atas hati. Selanjutnya hati dibagi empat belahan, yaitu lobus
kanan, lobus kiri, lobus kaudata dan lobus kuadratus. Hati mempunyai dua
jenis peredaran darah, yaitu arteri hepatica dan vena porta (Syaifuddin, 2006).
Fungsi hati adalah sebagai berikut (Syaifuddin, 2006):
1. Mengubah zat makanan yang diabsorpsi dan yang di simpan di suatu
tempat dalam tubuh, dikeluarkan sesuai dengan pemakaiannya dalam
jaringan.
2. Mengubah zat buangan dan bahan racun untuk diekskresi dalam empedu
dan urin.
3. Menghasilkan enzim glikogenik glukosa menjadi glikogen.
4. Sekresi empedu, garam empedu di buat di hati, dibentuk dalam sistem
retikuloendotelium, dialirkan ke empedu.
5. Pembentukan ureum, hati menerima asam amino diubah menjadi ureum,
dikeluarkan dari darah oleh ginjal dalam bentuk urin.
2.8 Ginjal
Ginjal sering disebut buah pinggang. Bentuknya seperti kacang dan
letaknya disebelah belakang rongga perut, kanan dan kiri rongga perut. Ginjal
kiri letaknya lebih tinggi dari ginjal kanan, berwarna merah (Irianto, 2004).
Setiap ginjal terdiri atas 1-4 juta nefron. Setiap nefron terdiri atas bagian yang
melebar, korpuskulus renal, tubulus proksimal, lengkung Henle, dan tubulus
distal. Tubulus dan duktus koligens, menampung urin yang dihasilkan oleh
nefron dan menghantarnya ke pelvis ranalis. Nefron dan duktus koligens
merupakan tubulus uriniferus sebagai satuan fungsional ginjal (Anggraini,
2008).
Fungsi ginjal adalah (Syaifuddin, 2006):
1. Mengatur volume air (cairan) dalam tubuh.
2. Mengatur keseimbangan osmotik dan mempertahankan keseimbangan ion
yang optimal dalam plasma (keseimbangan elektrolit).
3. Ekskresi sisa hasil metabolisme (ureum, asam urat, kreatinin), zat-zat
toksik, obat-obatan, hasil metabolisme hemoglobin dan bahan kimia asing.
4. Mempertahankan keseimbangan kadar asam dan basa dari cairan tubuh.
5. Fungsi hormonal dan metabolisme.
2.9 Jantung
Jantung terletak di dalam rongga mediastinum dari rongga dada (toraks),
di atas paru-paru (Irianto, 2004). Bentuk jantung menyerupai jantung pisang,
agak runcing disebut apeks kordis. Ukuran jantung lebih kurang sebesar
genggaman tangan kanan dan beratnya kira-kira 250-300 gram (Syaifuddin,
2006). Jantung terdiri dari tiga lapisan, yaitu lapisan terluar disebut
epikardium, lapisan tengah disebut miokardium, lapisan terdalam disebut