BAB 2
TINJAUAN PUSTAKA
2.1Enterobacteriaceae 2.1.1Definisi
Enterobacteriaceae adalah kelompok batang gram negatif yang
besar dan heterogen, dengan habitat alaminya di saluran cerna manusia
dan hewan (Brooks et al, 2008). Kebanyakan Enterobacteriaceae
merupakan flora normal pada saluran pencernaan meskipun ada juga
yang beberapa tersebar luas di lingkungan sekitar (Tham, 2012).
Enterobacteriaceae dapat menyebabkan beberapa penyakit infeksi
seperti septikemia, infeksi saluran kemih (ISK), pneumonia, kolesistitis,
kolangitis, peritonitis, meningitis dan gastroenteritis (Brooks et al,
2008).
2.1.2 Klasifikasi
Familinya memilki banyak genus (Escherichia, Shigela,
Salmonella, Enterobacter, Klebsiella, Serratia, Proteus, dan lain-lain).
Enterobacteriaceae terdiri dari 25 genus dan 110 spesies, namun hanya
hanya 20-25 spesies yang memiliki arti klinis, dan spesies lainnya jarang
ditemukan (Brooks et al, 2008). Berikut adalah beberapa genus dari
famili Enterobacteriaceae:
a. Enterobacter
Enterobacter terdiri dari 11 spesies, tetapi hanya 8 spesies yang berhasil
diisolasi dari material klinis. Mereka memfermentasikan glukosa dan
juga menghasilkan asam dan gas. Pada umumnya Enterobacter memliki
flagel peritrik. Beberapa strain Enterobacter yang memilki antigen K
mempunyai kapsul sebagai pelindung dari bakteri (NHS, 2014).
Escherichia terdiri dari enam spesies dimana empat diantaranya dikenal
sebagai penyebab penyakit pada manusia. Spesies yang paling banyak
diisolasi adalah Escherichia coli (NHS, 2014). E. coli merupakan spesies
yang bersifat fakultatif anaerob yang paling banyak terdapat di saluran
cerna manusia (109CFU/g feses) sehingga ditemukannya bakteri tersebut
pada jumlah tertentu dapat dijadikan sebagai indikator dari
kontimanisasi fekal pada makanan maupun minuman. Beberapa strain
dari E. coli menghasilkan enterotoksin atau faktor virulensi lainnya.
Serotipe dan kelompok patogenitas dari E.coli dibuat berdasarkan
lipopolisakaridanya (O) dan antigen flagelanya (H) (Tham, 2012).
c. Klebsiella
Genus Klebsiella terdiri dari lima spesies dan empat subspesies (NHS,
2014). Seperti E.coli, Klebsiella spesies biasanya ditemukan di traktus
gastrointestinal manusia (104CFU/ g feses). Faktor virulensi yang paling
utama dari Klebsiella adalah kapsul polisakaridanya, yang menyebabkan
permukaan koloninya menjadi berlendir (mucoid). Klebsiella
pneumoniae adalah spesies yang paling banyak diisolasi dari infeksi
pada manusia karena dapat menyebabkan infeksi nosokomial seperti
infeksi saluran kemih (ISK), septikemia, kolesistitis, dan lain-lain
(Tham, 2012).
d. Proteus
Proteus terdiri dari empat spesies, dimana tiga diantaranya dapat
menyebabkan penyakit. Semua strain dari Proteus bersifat urease positif
dan motil (NHS, 2014). Proteus sering menjadi penyebab infeksi saluran
kemih (ISK) terutama infeksi pada pasien yang memakai indwelling
catheters atau yang memilki kelainan anatomis atau fungsional pada
saluran kemihnya. Jika dibandingkan dengan E.coli, infeksi yang
disebabkan oleh Proteus cenderung akan lebih parah dan mengarah
e. Shigella
Shigella terdiri atas empat spesies, yaitu Shigella dysenteriae, Shigella
flexnerri, Shigella. boydii, dan Shigella sonnei. Keempat spesies ini
bersifat motil dan cenderung infeksius terutama S. dysenteriae (NHS,
2014).
f. Salmonella
Salmonella teridiri dari dua spesies yaitu Salmonella bongori dan
Salmonella enteritica dan memiliki enam buah sub tipe. Hampir seluruh
serotipe bersifat motil kecuali S. typhi yang menghasilkan gas dari
glukosa. Secara umum, Salmonella menghasilkan hidrogen sulfida,
kecuali S. paratyphi (NHS, 2014).
2.1.3Morfologi
Enterobactericeae adalah bakteri batang gram negatif pendek,
tidak menghasilkan spora, bersifat motil dengan flagel peritrika atau
nonmotil, dan tumbuh secara fakultatif aerob atau anaerob. Morfologi
yang khas terlihat pada pertumbuhan di medium padat in vitro,tetapi
morfologinya sangat bervariasi pada spesimen klinis (Brooks et al, 2008).
2.1.4Biakan
Secara umum, Enterobactericeae tumbuh pada medium pepton
atau ekstrak daging tanpa penambahan natrium klorida atau suplemen lain
dan juga pada agar MacConcey. E. coli dan sebagian besar bakteri enterik
lainnya membentuk koloni yang sirkular, konveks, dan halus dengan tepi
yang datar. Koloni Enterobacteriaceae sama dengan koloni tersebut
tetapi lebih mukoid. Koloni Klebsiella besar akan terlihat sangat mukoid
dan cenderung bersatu pada inkubasi lama. Salmonella dan Shigela akan
membentuk koloni yang menyerupai E. coli tetapi tidak
memfermentasikan laktosa. Beberapa strain E. coli menyebabkan
hemolisis pada darah (Brooks et al, 2008).
2.1.5Sifat Pertumbuhan
Pada umumnya, Enterobacteriaceae melakukan fermentasi glukosa
katalase-positif, oksidasi negatif, dan dapat mereduksi nitrat menjadi
nitrit (Brooks et al, 2008).
a. Eschericia
E.coli secara khas menunjukkan hasil positif pada tes indol, lisin
dekarboksilase, fermentasi manitol, dan menghasilkan gas dari
glukosa. Pada isolat urin dapat segera diidentifikasi sebagai E.coli
dengan melihat hemolisisnya pada agar darah, morfologi koloni yang
khas dengan warna pelangi yang “berkilau” pada medium diferensial
Eosin Methylen Blue (EMB), dan tes bercak indol positif (Brooks et al,
2008).
b. Klebsiella-Enteobacter-Serratia
Pertumbuhan spesies Klebsiella menghasilkan pertumbuhan yang
bersifat mukoid, kapsul polisakarida yang besar, kurang motil, dan
menunjukkan hasil positif untuk lisin dekarboksilase dan sitrat.
Kebanyakan spesies Enterobacter menunjukkan hasil positif terhadap
uji motilitas, sitrat, dan ornitin dekarboksilase serta menghasilkan gas
dari glukosa. Serratia menghasilkan lipase dan gelatinase. Klebsiella,
Enterobacter dan Serratia biasanya memberikan hasil positif terhadap
reaksi Voges-Proskauer (Brooks et al, 2008).
c. Proteus-Morganella-Providencia
Anggota grup ini mendeaminasi fenilalanin, bersifat motil, tumbuh
pada medium kalium sianida (KCN), dan memfermentasikan xilosa.
Spesies Proteus bergerak sangat aktif dengan menggunakan flagel
peritrika, menghasilkan “swarming” pada medium padat kecuali
swarming dihambat oleh zat-zat kimia seperti medium feniletil alkohol
atau CLED (cystine-lactose-electrolyte-deficient). Spesies Proteus dan
Morganella morganii merupakan urease positif, sedangan spesies
Providencia biasanya urease-negatif. Kelompok Proteus-Providencia
sangat lambat memfermentasi laktosa atau tidak
d. Citrobacter
Bakteri ini secara khas bersifat sitrat positif dan tidak
mendekarboksilasi lisin. Organisme ini sangat lambat memfermentasi
laktosa (Brooks et al, 2008).
e. Shigella
Shigella bersifat nonmotil dan biasanya tidak memfermentasikan
laktosa tetapi memfermentasikan karbohidrat lain, serta memproduksi
asam tetapi tidak H2S (Brooks et al, 2008).
f.Salmonella
Salmonella merupakan bakteri berbentuk batang motil yang secara
khas memfermentasikan laktosa dan manosa tanpa memproduksi gas
tetapi tidak memfermentasikan sukrosa. Sebagian besar Salmonella
menghasilkan H2S. Organisme ini umumnya bersifat patogen untuk
manusia bila termakan (Brooks et al, 2008).
2.1.6Struktur Antigenik
Enterobacteriaceae memilki struktur antigenik yang kompleks.
Enterobacteriaceae digolongkan berdasarkan lebih dari 150 antigen
somatik O (lipopolisakarida) yang tahan panas, lebih dari 100 antigen K
(kapsular) yang tidak tahan panas, dan lebih dari 50 antigen H (flagella)
(Brooks, 2008).
Antigen O adalah bagian terluar dari lipopolisakarida dinding sel
dan terdiri dari unit polisakarida yang berulang. Beberapa polisakarida
O-spesifik mengandung pola yang unik. Antigen O resisten terhadap panas
dan alkohol dan biasanya terdeteksi oleh aglutinasi bakteri. Antibodi
terhadap antigen O terutama adalah IgM (Brooks et al, 2008).
Antigen K terletak di luar antigen O pada beberapa
Enterobacteriaceae tetapi tidak semuanya. Beberapa antigen K merupakan
merupakan protein. Antigen K dapat mengganggu aglutinasi dengan
antiserum O, dan dapat berhubungan dengan virulensi (misalnya, strain
E.coli yang menghasilkan antigen K1 sering ditemukan pada meningitis
neonatal) (Brooks et al, 2008).
Klebsiella membentuk kapsul besar yang mengandung
polisakarida (antigen K) yang menutupi antigen somatik (O atau H) dan
dapat diidentifikasi dengan menggunakan uji pembengkakan kapsul
dengan antiserum spesifik. Infeksi saluran napas pada manusia terutama
disebabkan oleh kapsular tipe 1 dan 2, sementara infeksi saluran kemih
disebabkan oleh tipe 8,9,10, dan 24 (Brooks et al, 2008).
Antigen H terdapat di flagela dan didenaturasi atau dirusak oleh
panas atau alkohol. Antigen ini dipertahankan dengan memberikan
formalin pada varian bakteri yang motil. Antigen H seperti ini akan
beraglutinasi dengan antibodi anti-H, terutama IgG. Penentu dalam antigen
H adalah fungsi sekuens asam amino pada protein flagel (flagelin) (Brooks
et al, 2008).
Gambar 2.1. Struktur antigenik pada Enterobacteriaceae (Brooks et al, 2008)
2.2Resistensi bakteri terhadap antibiotik
Timbulnya resistensi terhadap suatu antibiotik terjadi melalui 3
mekanisme (Setiabudy, 2009):
Pada bakteri gram negatif, molekul antibiotik yang kecil dan polar dapat
menembus dinding luar dan masuk ke dalam sel melalui lubang-lubang
kecil yang disebut porin. Bila porin menghilang atau mengalami mutasi
maka masuknya antibiotik ini akan terganggu. Mekanisme lain adalah
bakteri mengurangi mekanisme transport aktif yang memasukkan
antibiotik ke dalam bakteri (misalnya gentamisin). Selain itu ada juga
mekanisme berupa bakteri mengaktifkan pompa keluaran (efflux) untuk
membuang antibiotik yang ada dalam sel (misalnya tetrasiklin).
b. Inaktivasi obat
Mekanisme ini sering mengakibatkan terjadinya resistensi terhadap
golongan aminoglikosida dan beta-laktam karena bakteri mampu
membuat enzim yang dapat merusak kedua golongan antibiotik tersebut.
c. Bakteri mengubah tempat ikatan (binding site) antibiotik
Mekanisme ini terlihat pada S. aureus yang resisten terhadap metisilin
(Methicillin-Resistant Staphylococcus Aureus/MRSA). Bakteri ini
mengubah penicillin binding protein sehingga afinitasnya menurun
terhadap metisilin dan antibiotik beta laktam lainnya.
Penyebaran resistensi pada bakteri dapat terjadi secara vertikal
(diturunkan ke generasi berikutnya) tetapi yang lebih yang sering adalah
secara horizontal atau sel donor. Dilihat dari segi bagaimana resistensi
dipindahkan maka dapat dibedakan dalam 4 cara, yaitu (Setiabudy, 2009):
a. Mutasi
Proses ini terjadi secara spontan,acak dan tidak tergantung dari ada atau
tidaknya paparan antibiotik. Mutasi terjadi akibat perubahan pada gen
mikroba mengubah binding site antibiotik, protein transport, protein
b. Transduksi
Adalah kejadian dimana suatu bakteri menjadi resisten karena mendapat
DNA dari bakteriofag (virus yang menyerang bakteri) yang membawa
DNA dari bakeri lain yang memilki gen resisten terhadap antibiotik
tertentu. Bakteri yang sering mentransfer resistensi dengan cara ini
adalah S. aureus.
c. Transformasi
Transfer resistensi terjadi karena antibiotik mengambil DNA bebas
yang membawa sifat resisten dari sekitarnya. Transformasi sering
menjadi transfer resistensi terhadap penisilin pada Pneumococcus dan
Neisseria.
d. Konjugasi
Resistensi terjadi secara langsung antara 2 bakteri dengan suatu
“jembatan” yang disebut pilus seks. Konjugasi adalah mekanisme
transfer resistensi yang dapat terjadi pada dua bakteri dengan spesies
yang berbeda. Transfer resisteni dengan cara konjugasi lazim terjadi
antara bakteri gram negatif. Sifat resisteni dibawa oleh plasmid.
Faktor yang memudahkan berkembangnya resistensi bakteri
terhadap antibiotik di klinik adalah (Setiabudy, 2009): penggunaan
antibiotik yang sering, penggunaan antibiotik yang irasional, penggunaan
antibiotik baru yang berlebihan, dan penggunaan antibiotik untuk jangka
waktu lama.
2.3 Extended Spectrum Beta-Lactamase (ESBL)
ESBL (Extended Spectrum Beta-Lactamase) merupakan enzim
yang dapat menghidrolisis penicillin, cephalosporin generasi pertama,
kedua, ketiga dan aztreonam (kecuali cephamycin dan carbapenem)
(Pajariu, 2010). ESBL adalah hasil mutasi dari enzim beta-laktamase
TEM-1, TEM-2, dan SHV-1 yang biasa ditemukan pada plasmid
Enterobacteriaceae (Behrooozi, 2010). Isolasi dari ESBL ini pertama kali
et al, 2011).Bakteri yang paling banyak memproduksi ESBL adalah
bakteri dari famili Enterobacteriaceae, terutama Escherichia coli dan
Klebsiella pneumonia (Winarto, 2009).
2.3.1Karakteristik Biologi ESBL
Gen beta-laktamase (bla) biasanya ditemukan pada kromosom
meskipun dapat juga ditemukan di plasmid. Gen pengkode ESBL berada
di plasmid yang mudah dipindahkan ke kuman lain sehingga terjadi
penyebaran resistensi (Winarto, 2009). Hal ini membedakan ESBL dengan
AmpC tipe beta-laktamase yang biasa dikode di dalam kromosom. Selain
itu, berbeda dengan ESBL, Amp C tipe beta-laktamase tidak dapat
diinhibisi oleh asam klavulanat ataupun betalaktamse inhibitor (Tham,
2012).
Kebanyakan ESBL terdiri dari serin pada sisi aktifnya dan
merupakan enzim kelas A menurut klasifikasi molekular oleh Ambler.
Enzim kelas A adalah enzim yang memiliki serin pada sisi aktifnya, berat
molekul 29.000 Dalton dan memiliki kecenderungan dapat menghidrolisis
penicillin (Bradford, 2001). Enzim beta-laktamase yang termasuk kelas A
adalah TEM-1, SHV-1 dan penisilinase yang ditemukan pada
Staphylococcus aureus (Bradford, 2001).
Sampai saat ini klasifikasi molekular tetap dilakukan, meskipun
untuk membedakan setiap enzim yang termasuk klasifikasi grup A belum
terlalu jelas. Oleh karena itu, Richmond dan Skyes menerapkan sistem
klasifikasi yang baru berdasarkan profil substrat dan lokasi gen yang
mengkode beta-laktamase. Sekarang ini, klasifkasi yang lazim dipakai
adalah klasifikasi oleh Bush, Jacoby dan Medeiros dengan menggunakan
karakteristik biokimia dari enzim dan struktur molekular serta nucleotide
sequence dari gen yang mengkode beta-laktamase. Dengan menggunakan
klasifikasi ini, ESBL adalah enzim beta-laktamase yang dapat
klavulanat sehingga secara fungsional dimasukkan kedalam grup 2be
(Paterson dan Bonomo, 2005).
2.3.2Tipe ESBL
Kebanyakan ESBL berasal dari turunan enzim TEM dan SHV.
Sekarang ditemukan lebih dari 90 enzim beta laktamase tipe TEM dan 36
enzim beta-laktamase tipe SHV.
a. ESBL tipe TEM
ESBL tipe TEM terdiri dari TEM-1 dan TEM-2. TEM-1 pertama
kali ditemukan pada tahun 1966 dari E.coli yang diisolasi dari seorang
pasien bernama Temoneira di Yunani (hal ini menyebabkan enzim ini
disebut sebagai TEM) (Bonomo dan Paterson, 2005). TEM-1
beta-laktamase adalah enzim yang bertanggungjawab atas resistensi bakteri
terhadapat ampicillin, penicillin dan cephalosporin generasi pertama dan
dapat diinhibisi oleh asam klavulanat. ESBL menyebabkan sekitar 90%
resistensi E.coli terhadap ampicillin dan juga resistensi H. influenza dan
N. gonorrhoeae terhadap penicillin. Mutasi spesifik yang terjadi pada
blatem-1 yang dimediasi melalui proses seleksi antibiotik menyebabkan
kemampuan enzim untuk menghidrolisis cephalosporin berspektrum luas
dan azteronam meningkat (Rupp dan Fey, 2003). ESBL tipe TEM paling
banyak ditemukan pada E.coli dan K. pneumoniae (Bradford, 2001).
b. ESBL tipe SHV
ESBL tipe SHV lebih banyak ditemukan dibandingkan dengan tipe
ESBL lainnya (Paterson dan Bonomo, 2005). SHV berasal dari kata
sulfhidril variabel. SHV tipe-1 beta-laktamase yang ditemukan pertama
kali pada Klebsiella pneumoniae merupakan enzim yang dikode pada
plasmid yang dapat menyebabkan terjadinya resistensi terhadap penicillin
dan cephalosporin generasi pertama (Rupp dan Fey, 2003). Seperti pada
TEM-1, mutasi yang terjadi blashv-1 menyebabkan kemampuan hidrolisis
SHV-1 meningkat sehingga dapat menghidrolisis cephalosporin
ditemukan pada K. pneumoniae meskipun juga ditemukan pada
Citrobacter diversus, E.coli dan P. aeruginosa. Sekarang ini telah
ditemukan 36 ESBL tipe SHV (Rupp dan Fey, 2003).
c. ESBL tipe lain
Pada beberapa tahun terakhir, ESBL tipe lain ditemukan pada
isolasi E. coli. Enzim baru ini dinamakan CTX-M karena kemampuannya
dalam menghidrolisis cefotaxime. CTX-M banyak ditemukan pada
Salmonella enterica dan juga E.coli, meskipun dapat juga ditemukan pada
spesies lain dari famili Enterobacteriaceae (Bradford, 2001).
2.3.3Epidemiologi ESBL
Secara epidemiologi, ESBL didapatkan di beberapa negara dengan
prevalensi berbeda-beda tergantung dari pola pemakaian antibitiotik.
a. Eropa
ESBL pertama kali ditemukan di benua Eropa tepatnya di Jerman
pada tahun 1983 (Rupp dan Fey, 2013). Survei yang dilakukan di Perancis
menunjukkan terdapat 40% K. pneumoniae yang mengalami resistensi
terhadap ceftazidim. Hal yang berbeda ditemukan di Belanda dengan
prevalensi ESBL positif pada E.coli dan K. pneumoniae <1%. Perbedaan
prevalensi di benua Eropa ini belum diketahui penyebabnya (Rupp dan
Fey, 2003).
b. Amerika
Berdasarkan survei yang dilakukan oleh CDC (Centers for Disease
Control and Prevention) pada tahun 2013, setiap tahunnya terjadi 26.000
infeksi yang disebabkan oleh Enterobacteriaceae penghasil ESBL dan
sekitar 1.700 diantaranya meninggal dunia.
c. Asia
Berdasarkan survei yang telah dilakukan oleh Study for
Monitoring Antimicrobial Resistance Trends (SMART) pada tahun 2007,
infeksi intra-abdominal secara berturut turut adalah 42, 27 % dan 35,8%
(Kang dan Song, 2013).
Di Indonesia sendiri, beberapa penelitian urnuk mengetahui
prevalensi ESBL telah dilakukan meskipun belum dilakukan secara
terpusat. Penelitian yang dilakukan di RS. Ciptomangunkusumo, Jakarta
pada bulan Januari-Desember 2011, menunjukkan prevalensi ESBL
mencapai 58, 42% pada pasien yang menjalani rawat inap di rumah sakit
(Saharman dan Lestari, 2011). Penelitian lain yang dilakukan pada Januari
2010 sampai April 2010 di 3 rumah sakit besar di Indonesia yaitu RS. Dr.
Sutomo, Surabaya;RS. Dr. Kariadi, Semarang; dan RS. Dr. Saiful Anwar,
Malang didapatkan 300 sampel yang dinyatakan positif ESBL (Kuntaman
et al, 2011). Selain itu, pada tahun 2009 penelitian yang sama juga
dilakukan kembali di RS. Kariadi Semarang selama dua tahun, dimana
dari 901 sampel yang ditumbuhi oleh bakteri gram negatif, 50,6% nya
dinyatakan positif ESBL (Winarto, 2009). Tidak hanya di pulau Jawa,
penelitian serupa telah dilakukan di RSUP. H. Adam Malik Medan,
didapatkan dari 91 isolat E.coli, 53 diantaranya dinyatakan positif ESBL.
Beberapa faktor risiko yang dapat menyebabakan terjadinya
kolonisasi ESBL pada manusia adalah (Rupp dan Fey, 2003):
a. Tingkat keparahan penyakit
b. Lamanya tinggal di rumah sakit dan di intensive care unit (ICU)
c. Prosedur invasif
d. Penggunaan akses intravascular seperti kateter arterial dan juga
kateter sentral
e. Pemakaian nasogastric tube, mechanical ventilator, kateter urin
f. Usia
g. Penggunaan antibiotik seperti cephalosporin spektrum luas,
aztreonam, fluoroquinolon, cotrimoxazole (trimethoprim/
2.3.4Mekanisme resistensi bakteri terhadap antibiotik golongan beta-laktam
Mekanisme resistensi bakteri penghasil ESBL terhadap antibiotika
terjadi karena adanya mutasi titik/ point mutation pada gen yang dikode
pada plasmid bakteri (Ejaz et al, 2011). Mutasi ini menyebabkan
peningkatan aktivitas enzimatik beta-laktamase sehingga dapat
menghidrolisis cephalosporin dan aztreonam (Pajariu, 2010). Terdapat
empat mekanisme yang dapat menyebabkan terjadinya resistensi bakteri
terhdapat antibiotik beta-laktam (Fauziyah, 2010):
a. Inaktivasi antibiotik beta laktam melalui enzim beta-laktamase
b. Produksi penicillin binding protein yang baru disertai dengan
penurunan afinitas terhadap antibiotik
c. Menurunkan permeabilitas antibiotik pada dinding sel bakteri dengan
mengubah channel porin.
d. Mengkatifkan pompa efflux sehingga dapat membuang antibiotik dari
sel bakteri
2.3.5Deteksi ESBL
Metode yang digunakan untuk skrining ESBL dikeluarkan oleh
NCCLS (National Committee for Clinical Laboratory Standards) yang
sekarang berganti nama menjadi CLSI (Clinical Laboratory Standard
Institute). Berikut adalah 2 jenis uji yang dapat digunakan untuk skrining
ESBL:
a. Uji Double Disk Synergy
Metode ini pertama kali ditemukan oleh Jarlier et.al pada tahun
1988 dengan menggunakan agar Mueller Hinton (Rupp dan Fey, 2003).
Skrining dengan metode uji Double Disk Synergy memiliki tingkat
kesulitan yang tidak tinggi dan menggunakan alat dan bahan yang cukup
sederhana (Rupp dan Fey, 2003). Uji double disk synergy dilakukan
dengan menggunakan cakram augmentin (20 µg amoxicillin dan 10 µg
asam klavulanat) dan cakram cefotaxim (30 µg), ceftazidime (30 µg) serta
16-20 mm. Seperti yang diketahui, ESBL adalah enzim yang mampu
menghidrolisis antibiotik golongan pencillin, cephalosporin golongan
I,II,III serta aztreonam. Dengan pemberian asam klavulanat sebagai
inhibitor beta laktamase maka enzim beta laktamase dapat dihambat. Oleh
karena itu, interpretasi hasil yang positif ESBL dari metode uji Double
Disk Synergy adalah dengan adanya peningkatan zona hambat dari
cephalosporin ke arah cakram asam klavulanat. Dikarenakan hasil positif
dari uji Double Disk Synergy ini tidak memakai satuan angka yang pasti
sebagai batasan hasil positif dan negatif, tingkat subjektivitas dalam
menginterpretasikan hasil merupakan kelemahan dalam metode in (Rupp
dan Fey, 2003).
Meskipun memiliki kelemahan, metode double disk synergy
memilki tingkat sensitivitas yang cukup baik yaitu berkisar 79%-96%
(Giriyapur et al, 2011). Berdasarkan penelitian yang dilakukan oleh
Giriyapur (2011) dari 313 sampel Enterobacteriaceae, 176 sampel
(56,23%) merupakan bakteri penghasil ESBL yang diskrining dengan
metode double disk synergy, sementara 200 sampel (63,89%) dinyatakan
bakteri penghasil ESBL dengan metode uji phenotypic confirmatory. Hal
ini menunjukkan bahwa metode double disk synergy dapat diandalkan
untuk skrining bakteri penghasil ESBL.
b. Uji Phenotypic Confirmatory
Metode ini menggunakan cefotaxime, ceftazidime, cefotaxim yang
dikombinasikan dengan asam klavulanat dan juga ceftazidime yang
dikombinasikan dengan asam klavulanat. Biakan bakteri yang telah
disesuaikan kekeruhannya 0,5 McFarland diinokulasikan ke dalam agar
Muller Hinton. Cefotaxime dan cefotaxime klavulanat diletakkan dengan
jarak 20 mm diantara keduanya. Hal yang sama juga dilakukan pada
ceftazidime dan ceftazidime klavulanat. Isolat bakteri dinyatakan positif
ESBL jika setelah diinkubasi 1 malam pada suhu 37oC, terdapat
peningkatan diameter > 5 mm pada zona inhibisi dengan cakram antibiotik
(cefotaxim, ceftazidim) yang dikombinasikan dengan asam klavulanat
dibandingkan dengan zona inhibisi dengan cakram antibiotik tanpa
kombinasi (Umadevi et al, 2011).
2.4. Infeksi Saluran Kemih
Istilah infeksi saluran kemih dinyatakan sebagai kondisi klinis
mulai dari adanya bakteri dalam urin pada keadaan asimptomatik sampai
infeksi berat pada ginjal yang disertai dengan sesis (Stamm, 2005).
Bakteriuria bermakna menunjukkan pertumbuhan mikroorganisme murni
lebih dari 100.000 colony forming units (CFU) pada biakan urin.
Bakteriuria bermakna tanpa disertai manifestasi klinis infeksi saluran kemih
(ISK) disebut bakteriuria asimptomatik. Sebaliknya bakteriuria bermakna
disertai manifestasi klinis disebut bakteriuria simptomatik (Yulianto, 2009).
Infeksi saluran kemih merupakan infeksi yang dapat terjadi pada
laki-laki dan perempuan. Angka kejadia penyakit ini lebih sering pada
perempuan daripada laki-laki dengan angka populasi 5%-15%
(Yulianto,2009). Prevalensi infeksi saluran kemih pada anak usia sekolah
mencapai 1-3% dan meningkat pada remaja yang sudah melakukan
pertambahan usia sehingga perbandingan prevalensi antara laki-laki dan
perempuan adalah 1:2 (Yulianto,2009).
Pada umumnya, sekitar 50% infeksi saluran kemih disebabkan oleh
E.coli, penyebab lainnya adalah Klebsiella, Staphylococcus aureus,
Proteus, Pseudomonas sp. dan bakteri gram negatif lainnya. Sebagain besar
dari spesies menjadi etiologi dari ISK yang telah disebutkan di atas adalah
bakteri dari famili Enterobacteriacea.
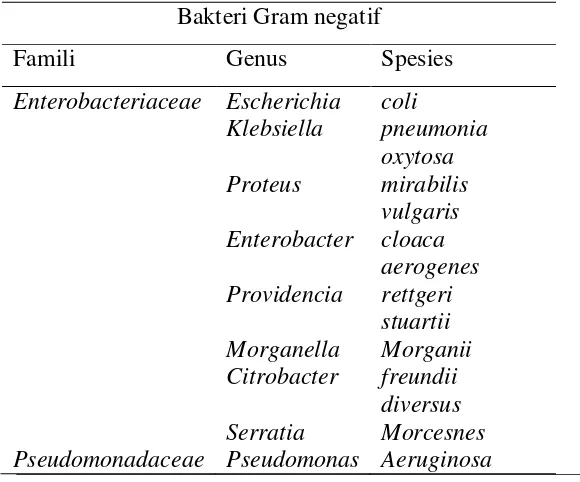
Tabel. 2.1 Famili, Genus dan Spesies Mikroorganisme (MO) yang Paling Sering Sebagai Penyebab Infeksi Saluran Kemih (Sukandar, 2004).
Bakteri Gram positif
Famili Genus Spesies
Micrococcaceae Staphylococcus aureus
Streptococcaceae Streptococcus
Enterococcus fecalis
Pada individu laki-laki maupun perempuan normal, biasanya urin
selalu steril karena dipertahankan jumlah dan frekuensi berkemih. Hampir
semua infeksi saluran kemih disebabkan invasi mikroorganisme asending
dari uretra ke dalam kandung kemih. Pada beberapa pasien tertentu invasi Bakteri Gram negatif
Famili Genus Spesies
Enterobacteriaceae Escherichia coli
Klebsiella pneumonia
mikroorganisme dapat mencapai ginjal. Proses ini dipermudah oleh refluks
vesikouretra. Proses invasi mikroorganisme hematogen sangat jarang
ditemukan. Ginjal diduga merupakan lokasi infeksi sebagai akibat lanjut
septikemia atau endokarditis akibat S. aureus. Beberapa peneliti melaporkan
pielonefritis akut (PNA) sebagai akibat lanjut invasi hematogen dari infeksi
sistemik gram negatif (Sukandar, 2004). Manifestasi dari infeksi saluran
kemih berbeda-beda tergantung dimana letak infeksinya. Infeksi saluran
kemih bagian atas akan menghasilkan gejala klinis berupa demam, kram,
nyeri punggung, muntah, dan penurunan berat badan, sementara gejala klinis
dari infeksi saluran kemih bagian bawah yaitu nyeri suprapubik, disuria,
frekuensi, hematuria, urgensi dan stranguria (Sukandar, 2004).Pemeriksaan
yang dilakukan untuk mendiagnosa infeksi saluran kemih terdiri atas
pemeriksaan fisik dan pemeriksaan penunjang. Pemeriksaan penunjang yang
dibutuhkan yaitu analisa urin, pemeriksaan mikroskop urin segar tanpa
putar, kultur urin, serta jumlah kuman/mL urin. Hal penting yang perlu
diperhatikan untuk konfirmasi sebelum menegakkan diagnosa infeksi
saluran kemih adalah cara pengambilan sampel urin. Sampel untuk
pembiakan urin sebaiknya dilakukan segera (kurang dari setengah jam
sesudah sampel urin diambil). Bila waktu tidak memungkinkan dapat
disimpan alam lemari es pada suhu 4oC dan masih dapat dilakukan
pembiakan sebelum 48 jam. Waktu pengambilan sampel urin untuk
pemeriksaan rutin yang terbaik adalah pagi hari segera sesudah bangun
tidur, sedangkan bila untuk biakan bisa diambil urin sewaktu asalkan sudah
lebih dari 4 jam urin terkumpul dalam kandung kemih. Baku emas untuk
mendiagnosis infeksi saluran kemih adalah pemeriksaan kultur urin dimana
dijumpai bakteriuria >105 CFU/ml urin segar (Sukandar, 2004).Prinsip
tatalaksana infeksi saluran kemih dapat dibagi menjadi 2 yaitu manajemen
infeksi saluran kemih bagian bawah dan infeksi saluran kemih bagian atas.
Tatalaksanaa pada infeksi saluran kemih bagian bawah meliputi asupan
cairan yang banyak, antibiotika yang adekuat dan kalau perlu terapi
akan memberikan respon setelah 48 jam dengan antibiotika tunggal seperti
ampicillin 3 gram atau trimetoprim 200 mg (Sukandar, 2004). Pada infeksi
saluran kemih bagain atas, tatalaksana yang dapat dilakukan adalah
memelihara status hidrasi dan terapi antibiotika parenteral paling sedikit 48
jam (Sukandar, 2004). The Infectious Disease Society of America
menganjurkan dari tiga alternatif terapi antibiotik IV sebagai awal selama
48-72 jam sebelum diketahui mikroorganisme sebagai penyebabnya, yaitu
aminoglykosida dengan atau tanpa ampicillin, cephalosporin berspektrum
luas dengan atau tanpa aminoglikosida serta fluorokuinolon (Sukandar,